一类促胶原分泌超短肽及其应用的制作方法
本发明涉及一类促胶原分泌超短肽及其应用,属于生物医学技术领域。
背景技术:
衰老是任何生物生命过程的必然规律,随着世界范围内人口老龄化问题的日益突出,抗衰老领域已成为全球关注的热点。皮肤是机体衰老过程中最为明显的器官之一,随着年龄的增长,皮肤会发生退行性变化,例如弹性消退、含水量减少、萎缩、出现皱纹等。
皮肤衰老是皮肤组织一系列复杂的生物学过程,是所有内源性生理因素和外源性环境因素共同作用的结果。衰老不仅会影响正常皮肤组织结构和生理功能,而且,也会直接影响皮肤外层的外观和容貌。皮肤是由表皮层、真皮层和皮下脂肪组成。其中,真皮层中的成纤维细胞分泌产生胶原蛋白,以维持皮肤的强度和弹性,与皮肤的老化问题直接相关。胶原蛋白是构成人体结缔组织的蛋白质,占人体总蛋白含量的三分之一还多,而皮肤中的胶原蛋白则高达75%以上,其中主要含有ⅰ型胶原蛋白(collageni)。胶原蛋白的分子量为30万道尔顿,它是由三条肽链构成,其中ⅰ型胶原蛋白是由2条α1和1条α2亚基结合而成的三螺旋结构,并互相盘绕成螺旋结构。胶原蛋白的存在与皮肤健康程度,保水及弹性等有着密切的关系。皮肤衰老的组织学改变主要是胶原蛋白的减少和流失。衰老皮肤中胶原蛋白流失主有两方面原因,一方面是皮肤细胞合成的胶原蛋白量减少,另一方面是被基质金属蛋白酶家族(mmps)中的mmp-1不断降解。由于遗传因素等不可抗内因紫外线、辐射等外界刺激,皮肤会逐渐老化,进而影响到胶原蛋白的合成和降解过程。当胶原蛋白降解的速度大于其生成的速度时,皮肤便会出现松弛、产生皱纹等明显衰老特征
近年来具备抗老化的功能制剂一直受到相关学科领域,特别是医疗保健、美容化妆品科学等领域的高度重视和普遍关注。目前已经研制出种类繁多、剂型多样、琳琅满目的皮肤美容抗衰老化妆品。但是,市面上存在的胶原蛋白相关产品,皆以直接补充胶原蛋白为主要功能,然而,胶原蛋白分子量大,涂抹方式几乎无法使其穿透皮肤角质层作用于真皮层的成纤维细胞;若为注射方式直接补充胶原蛋白,由于其在体内会被降解则需多次注射,过程繁复、成本高,同时注射胶原蛋白造成免疫排斥反应又是一大风险;若以食用,胶原蛋白会在肠道内被消化液分解成小分子多肽或单个氨基酸,因此实际补充胶原蛋白的效果有限。自从人们发现生物活性肽以来,特别是皮肤组织细胞相关的生长因子多肽、胶原多肽、谷胱甘肽、肌肽等天然活性肽、基因重组多肽分子和化学合成多肽等被开发并成功应用于皮肤美容抗衰老化妆品之后,人们发现部分活性肽可以直接激活皮肤细胞自身合成胶原蛋白,从而达到最为有效地促进补充胶原蛋白含量,从根本上提升皮肤自身的活力,激活皮肤细胞合成胶原蛋白,促进皮肤修复、抵抗皮肤衰老。
生物活性肽就是指一类对生物机体的生命活动有益或是具有生理作用的肽类化合物,是一类相对分子质量小于6000da,具有多种生物学功能的多肽。生物活性肽的生物学意义主要体现在其吸收机制优于氨基酸和具有氨基酸不可比拟的生理功能两个方面。尤其是一些小分子的超短肽,由于其具有超短的序列、小分子量,因此更是具备高安全性、易于合成、利于皮肤吸收等优势特征,并且兼具活性肽本身的高生物活性、调节细胞生理功能和代谢活动进而从本质上改变皮肤问题,同时也是大众认为最为安全高效的抗老化原料之一,因此超短肽在皮肤美容修复、医疗保健以及食品、药品添加剂等方面具有十分重要的应用价值和开发前景。
技术实现要素:
本发明涉及一类促胶原分泌超短肽,包括两种促胶原分泌超短肽magin-fl、purin-wh3在制备抗衰老抗皱化妆品、医用改善、调理及/或修补皮肤剂、抗氧化药物、食品添加剂等领域的应用。
本发明的技术方案:
一类促胶原分泌超短肽,包括两种促胶原分泌超短肽magin-fl、purin-wh3;所述的超短肽magin-fl:一种直链小肽,分子量为1205.42da,等电点是9.02,含有10个氨基酸残基,全序列的一级结构为:phe-phe-arg-thr-ser-cys-arg-ser-val-cys;所述的超短肽purin-wh3:一种直链小肽,分子量为672.88da,等电点是9.31,含有6个氨基酸残基,全序列的一级结构:val-val-lys-cys-pro-lys。
本发明的有益效果在于:本发明提供的两种促胶原分泌超短肽magin-fl、purin-wh3,具有促进胶原分泌活性、抗氧化及抗衰老活性,对dpph自由基以及abts·+正离子自由基清除率均十分明显;并且通过双荧光素报告系统检测超短肽magin-fl对于i型胶原蛋白有极强转录活性,浓度为5μg/ml时即可将其转录活性提高1.62倍;同时,通过westernblotting检测超短肽purin-wh3提高i型胶原蛋白的表达水平。此外,两种超短肽具有分子量小、细胞毒性低、无溶血活性、结构简单、易于制备等特点,因此将其应用在促胶原分泌、抗氧化、抗衰老化妆品或医疗、保健品等领域的开发中。
附图说明
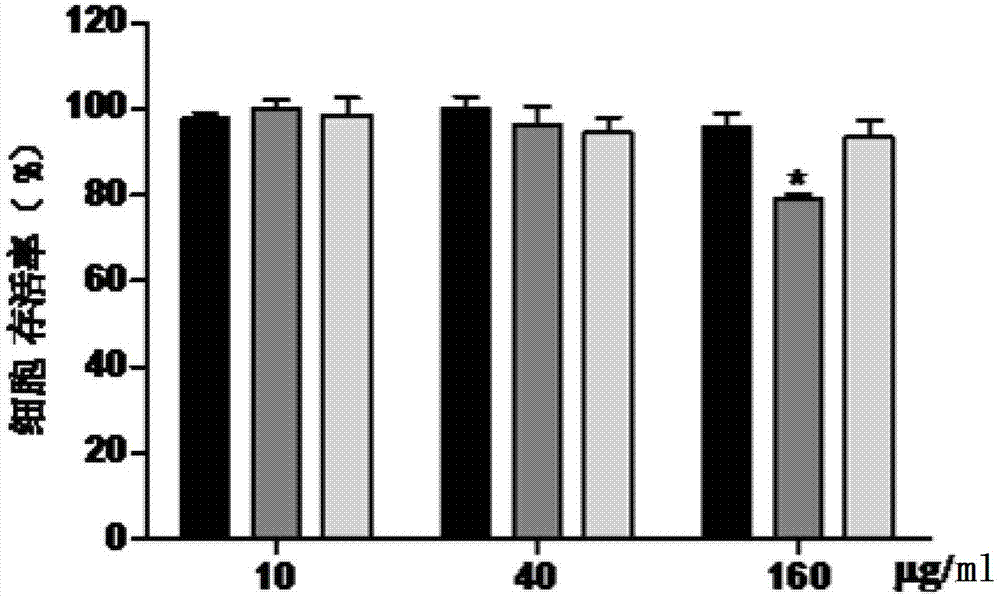
图1是两种超短肽对hff-1细胞的毒性图。
图2(a)是pgl3-coliα2的质粒图谱图。
图2(b)是phrl-tk的质粒图谱图。
图3是hek293细胞中超短肽magin-fl对pgl3-coliα2转录活性的影响图。
图4是超短肽purin-wh3对uva照射成纤维细胞后col1蛋白表达的影响图。
图中:
具体实施方式
以下结合附图和技术方案,进一步说明本发明的具体实施方式。
实施例1
两种促胶原分泌超短肽magin-fl、purin-wh3的化学合成:
(μg1/)ml两种促胶原分泌超短肽magin-fl、purin-wh3的化学合成方法:根据超短肽氨基酸序列,用自动多肽合成仪(433a,appliedbiosystems)合成其全序列,通过hplc反相柱层析脱盐。
(2)分子量测定采用基质辅助激光解析电离飞行时间质谱(maldi-tof)。
(3)纯化的两种促胶原分泌超短肽magin-fl、purin-wh3用高效液相色谱hplc方法鉴定其纯度,分子量测定采用基质辅助激光解析电离飞行时间质谱(maldi-tof),等电聚焦电泳测定等电点,用自动氨基酸测序仪测定氨基酸序列结构。
超短肽magin-fl:一种直链小肽,分子量为1205.42da,等电点是9.02,含有10个氨基酸残基,全序列的一级结构为:phe-phe-arg-thr-ser-cys-arg-ser-val-cys;
超短肽purin-wh3:一种直链小肽,分子量为672.88da,等电点是9.31,含有6个氨基酸残基,全序列的一级结构:val-val-lys-cys-pro-lys。
实施例2
溶血活性测定:
将采集的健康人血与阿氏液混合抗凝,生理盐水洗涤2次并重悬成107-108cell/ml的悬浮液。上述稀释好的红细胞悬液分别与溶解于生理盐水的超短肽样品混合,37℃保温30min,再于1000rpm离心5min,上清液于540nm测吸收值。阴性对照使用生理盐水,阳性对照使用tritonx-100,溶血百分比按以下公式计算:溶血百分比h%=(a样品-a阴性对照)/a阳性对照×100%。
表1.两种超短肽溶血活性
结果表明两种促胶原分泌超短肽magin-fl、purin-wh3浓度为160μg/ml时的溶血百分比为0.41%、1.62%。说明magin-fl、purin-wh3都不具有的溶血活性,不易引起人体红细胞破裂溶解而对人体产生伤害,因此十分利于其在抗氧化及抗皮肤老化的药物、食品或者化妆品添加剂领域进一步的开发应用。
实施例3
细胞毒性测定:
用mtt法检测该组超短肽对人皮肤成纤维细胞hff-1毒性。
人皮肤成纤维细胞hff-1购于上海细胞库。先将成纤维细胞于含有15%胎牛血清以及双抗(青霉素和链霉素各100u/ml)的dmem中培养,待细胞长满后,用0.25%的胰蛋白酶消化下来,用上述培养基洗两次,重新悬浮细胞,细胞计数后将细胞悬浮液100μl加入到96孔细胞培养板中,使每孔细胞数达到105个。加入样品,对照组加入相同体积的灭菌超纯水,置37℃,5%co2培养箱内培养24h。培养结束后,96孔细胞培养板每孔加入20μl5mg/mlmtt溶液(用细胞培养pbs缓冲液配制),继续培养5h,用注射器吸出孔中液体,每孔加入100μldmso,用移液枪吹打几次使紫色结晶完全溶解。酶标仪检测光吸收,测定波长490nm,参考波长630nm。
结果如图1所示,表明两种促胶原分泌超短肽magin-fl、purin-wh3浓度为160μg/ml时的细胞存活率为78.96%、93.55%。说明两种超短肽magin-fl、purin-wh3不具有细胞毒性,对正常细胞存活率无显著性影响,因此十分利于其在抗衰老化妆品添加剂领域进一步的开发应用。
实施例4
抗氧化活性测定:
(1)dpph自由基清除活性(dpphradicalscavengingassay)
称取一定量的dpph(2,2-diphenyl-1-picrylhydrazylhydrate,sigma,美国),用甲醇溶解,配成6×10-5m的溶液,现配现用。将48μldpph溶液和2μl样品(2mg/ml)混合(最终样品与dpph的质量比为3:1),室温下避光静置30min,于517nm处测定吸光值。空白对照组以样品溶解介质代替待测样品。实验做三个平行,紫外分光光度计调零时使用甲醇。
dpph·清除率(%)=(ab-aa)/ab×100(ab:空白对照组吸光值;aa:样品组吸光值)。
(2)abts·+自由基正离子清除活性
abts(3-ethylbezothiazoline-6-sulfonicacid)(3-乙基苯并噻唑啉-6-磺酸)用pbs缓冲液(ph7.4)配成2mm的abts储存液。将abts储存液和70mm过硫酸钾(k2s2o8)水溶液按体积比250:1混合,于室温避光放置15-16h。试验开始前,将abts·+释至734nm波长处的吸光值为0.80±0.03。将4μl不样品和96μl上述校正过的abts·+溶液混合,室温放置10min后,于734nm波长处检测反应液的吸光值。空白对照组为溶解样品所用灭菌去离子水。实验做三个平行。
abts·+清除率i(%)=(ab-aa)/ab×100(ab:空白对照组吸光值;aa:样品组吸光值)。
表2.两种超短肽体外抗氧化活性
结果如表2所示,两种超短肽magin-fl、purin-wh3均具有抗氧化活性。其中,样品magin-fl浓度为2mg/ml时,其dpph自由基清除率i%可达到89.94%、abts·+正离子自由基清除率i%可以达到68.29%;样品purin-wh3浓度为2mg/ml时,其dpph自由基清除率i%可达到85.37%、abts·+正离子自由基清除率i%可以达到79.94%;具备极高的抗氧化活性,显著清除自由基,可直接防止胶原蛋白等生物大分子免受其损伤。
实施例5
应用双荧光素酶报告系统检测超短肽对胶原蛋白转录活性的影响:
选取状态良好的hek293t细胞,用0.25%胰酶消化之后,用含有10%fbs的dmem终止消化。将生长旺盛的293t细胞以5×104~1×105个/ml的密度接种24孔板。每孔500μl用10%fbs的dmem培养基培养,待贴壁之后进行处理。然后,取用两只无菌2mlep管。一只加入1.2ml无血清无双抗dmem培养基并加入20μl脂质体lipofectamine2000,缓慢吹打均匀静置5min。另一只加入1.2ml无血清无双抗dmem培养基,同时加入构建好的pgl3-coliα2(如图2(a)),phrl-tk(如图2(b)),pegfp-n3质粒(质量比为10:2:1)并使加入的总质量不超过1μg。均匀吹打,静置5分钟。将上述两ep管的液体混合室温静置20min,让脂质体充分包裹质粒。随后吸去24孔培养板中的培养基,每孔加入400μl无血清无双抗dmem培养液体并缓慢加入100μl脂质体质粒混合液体。空白组加入100μl无血清无双抗dmem培养基。最后,将24孔板置于37℃中培养6-8h。即可在荧光显微镜下观察到绿色荧光。这是由于宿主细胞表达绿色荧光光蛋白质粒中的基因所致。我们可以计算发光细胞在全细胞中的比例得知转染效率。一般转染效率超过30%就能有效检测荧光素酶的变化。
所有的药物用无血清dmem培养液稀释配制成5μg/ml和50μg/ml高低两种浓度稀释液。由于所有体系均加入等量的内参质粒,如果内参荧光表达过低可推断上述两种浓度下药物毒性过大,因稀释更低浓度进一步筛选。加入转染有质粒的293t细胞,每孔500μl,每个浓度梯度3个重复,对照组则加入等体积的无血清无双抗dmem培养液。加入药物的24孔板置于37℃培养箱培养,12小时后吸去上清液,用pbs缓冲溶液小心清洗细胞2次。之后用pbs稀释的5×被动裂解缓冲液(passivelysisbuffer,plb,promega试剂盒)。每孔加入100μl稀释好的1×plb。室温震荡裂解15min,-20℃冷冻15min,重复冻融步骤2~3次,以使细胞完全充分破裂释放出细胞内的荧光素酶。
荧光素梅活性检测:吸出40μl裂解液,加入到荧光酶检测专用的96孔圆底检测板(greineru-plate)。之后避光每孔加入20ul萤火虫荧光素酶反应底物luciferaseassaybuffer(lab),上仪器读值。此步骤用于检测萤火虫荧光素酶活力。之后再加入20μl海肾荧光素酶反应底物stop&glo(stop),上仪器读值。通过这样处理分别得到了报告质粒和内参质粒的酶含量(酶的数量与荧光发光强度成正比),数据处理时每一个孔都有各自的lab/stop值,即萤火虫荧光素酶与海参荧光素酶的比值(fluc/rluc)。
结果如图3所示,超短肽magin-fl浓度为5μg/ml,50μg/ml时的相对荧光素酶活性分别为1.62、1.80,结果极显著。说明超短肽magin-fl具高效激活i型胶原蛋白转录的能力,因此十分利于其在促胶原分泌、抗衰老、抗氧化药物、食品及化妆品添加剂领域进一步的开发应用。
实施例6
westernblotting电泳法检测col1蛋白表达:
人皮肤成纤维细胞(hff-1)用含有15%胎牛血清的dmem培养基培养至生长对数期,用0.25%胰酶消化后,以105个/ml接种于6孔板中,每孔2ml。在37℃的co2培养箱中过夜培养使细胞贴壁,待细胞密度长至80%左右,将培养基吸去,用磷酸盐缓冲液(pbs:0.8gnacl;0.2gkcl;2.9gna2hpo4.12h2o;0.27gkh2po4溶于800ml去离子水,搅拌溶解,定容至1l,用浓hcl调节ph至7.4,高压灭菌)洗涤细胞2-3次。加入10ug/ml样品,空白加入2%血清dmem处理24h后采用长波紫外线uva(320nm—400nm)紫外进行照射处理,细胞处理完毕后再换为无血清dmem培养基继续培养24h。然后弃去细胞上层培养液,1000g离心5min收集细胞,用预冷的pbs洗涤细胞两次。每孔细胞内加入250ulripa细胞裂解液[50mmtris-hcl(ph7.4),1%nonidetp-40,0.25%脱氧胆酸钠,150mmnacl,1mmedta,1mmpmsf,1mmnaf,1mmna3vo4,各1ug/ml的aprotinin,leupeptin和pepstatin],冰上裂解30min。4℃,12000g离心20min,小心吸取上清,并将上清分装至新的eppendorf管,吸取2ul用bradford法测定蛋白浓度。40ug裂解产物在8%的sds-page电泳后转移至pvdf膜上,5%牛血清白蛋白封闭2h;加特异一抗,一抗col1(1:2000)购自cellsignalingtechnology公司,β-actin(1:3000)购自comwinbiotech公司,按说明书操作,4℃孵育过夜;tbst(39gtris,89gnacl,0.29gkcl,0.5%tween,定容至1000ml,用浓hcl调节ph至7.4)洗涤3次,每次5min;然后加辣根过氧化酶(hrp)标记羊抗兔/鼠抗体常温孵育1h,二抗购自cellsignalingtechnology公司,tbst洗涤3次,每次5min;暗室中加入显色液显色。
结果如图4所示,在外界环境胁迫情况下(uva=10.8j/cm2照射),i型胶原蛋白含量显著低于正常细胞,加药组,即10ug/ml超短肽purin-wh3可以提高损伤组的胶原蛋白含量至正常组。由此说明超短肽purin-wh3能够有效促进胶原蛋白表达,故此超短肽purin-wh3在皮肤修复及再生、刺激皮肤细胞胶原蛋白分泌,防止皮肤老化、粗糙的抗衰老医美等领域具备极佳的开发前景。
- 还没有人留言评论。精彩留言会获得点赞!