一种采用芳香肼合成N‑芳基仲芳酰胺的方法与流程
本发明属于有机合成领域,具体涉及一种采用芳香肼合成n-芳基仲芳酰胺的方法。
背景技术:
酰胺键是有机化学当中最为重要的化学键之一,构成生命的物质蛋白质当中的肽键就属于酰胺键。据统计现如今合成药物分子中的所有反应中,有16%都涉及到了酰胺键的构成,在诸多天然产物、农药、染料、功能高分子材料当中也都可以大量发现酰胺键的存在。传统的酰胺键的构成方法皆使用羧酸及其衍生物(羧酸、酰氯、酯、酸酐)与胺类化合物通过脱去小分子缩合而成[(a)luo,q.-l.;lv,l.;li,y.;tan,j.-p.;nan,w.;hui,q.eur.j.org.chem.2011,2011,6916;(b)duangkamol,c.;jaita,s.;wangngae,s.;phakhodee,w.;pattarawarapan,m.rscadv.2015,5,52624;(c)bao,y.s.;zhaorigetu,b.;agula,b.;baiyin,m.;jia,m.j.org.chem.2014,79,803;(d)li,y.;zhu,f.;wang,z.;rabeah,j.;brückner,a.;wu,x.-f.chemcatchem.2017,9,915.],但是这类方法往往需要苛刻的反应条件,如需要在酸性条件、高温下反应,近年来也有许多研究发明了使用新颖的底物与胺来合成酰胺,如伯醇、醛、n-氯甲酰胺等[(a)wang,y.;zhu,d.;tang,l.;wang,s.;wang,z.angew.chem.int.ed.2011,50,8917;(b)liu,z.;zhang,j.;chen,s.;shi,e.;xu,y.;wan,x.angew.chem.int.ed.2012,51,3231;(c)xu,w.t.;huang,b.;dai,j.j.;xu,j.;xu,h.j.org.lett.2016,18,3114.(d)krishnamoorthy,r.;lam,s.q.;manley,c.m.;herr,r.j.j.org.chem.2010,75,1251.],这些反应足够新颖,但是原子利用率较低、反应过程以及后处理复杂。因此,发明一种在温和的条件下高效合成酰胺且原子利用率较高的方法显得尤为重要。
技术实现要素:
本发明的目的在于提供一种采用芳香肼合成n-芳基仲芳酰胺的方法,以克服上述现有技术存在的缺陷,本发明的合成方法简洁高效,以取代苯肼、在空气中稳定且易得的有机硼酸和co为反应原料,金属钯作为主催化剂,铜或铁作为助催化剂,在较为温和的反应条件下高效合成仲芳酰胺。
为达到上述目的,本发明采用如下技术方案:
一种采用芳香肼合成n-芳基仲芳酰胺的方法,向溶剂中加入如式ⅰ所示的芳基硼酸和如式ⅱ所示的芳香肼,以及主催化剂和助催化剂,然后进行加热搅拌反应后分离提纯即得到如式ⅲ所示的n-芳基仲芳酰胺,反应过程中向反应体系中通入co使反应体系的压力为0.1~5mpa;
其中,r1和r2选自氢、甲基、乙基、氟、氯或溴。
进一步地,所述的芳基硼酸和芳香肼的摩尔比为(10~1):1。
进一步地,所述的芳基硼酸、主催化剂和助催化剂的摩尔比为(100~1):1:1。
进一步地,所述的加热搅拌反应温度为20~150℃,时间为24h。
进一步地,所述的主催化剂为醋酸钯、氯化钯、双三苯基磷二氯化钯、1,2-二苯基磷二茂铁二氯化钯、四三苯基磷钯中的任意一种。
进一步地,所述的助催化剂为铜粉、氯化亚铜、氯化铜、碘化亚铜、氧化铜、纳米氧化铜、氯化铁、氯化亚铁、纳米四氧化三铁中的任意一种。
进一步地,所述的溶剂为二氯甲烷、乙腈、dmf、dmso、二氧六环、正己烷、环己烷、乙腈、苯甲醚、甲苯中的任意一种。
进一步地,向溶剂中加入如式ⅰ所示的芳基硼酸和如式ⅱ所示的芳香肼以及主催化剂和助催化剂后,芳基硼酸在溶剂中的浓度为0.05~2摩尔/升。
与现有技术相比,本发明具有以下有益的技术效果:
本发明采用芳基硼酸,芳香肼、气体co三组分直接合成n-芳基仲芳酰胺,采用有机芳基硼酸与芳香肼通过插入co来构成酰胺键不需要在苛刻的条件下反应,且产物易于分离,产率较高。
附图说明
图1为实施例1所制备的产物的1hnmr谱图;
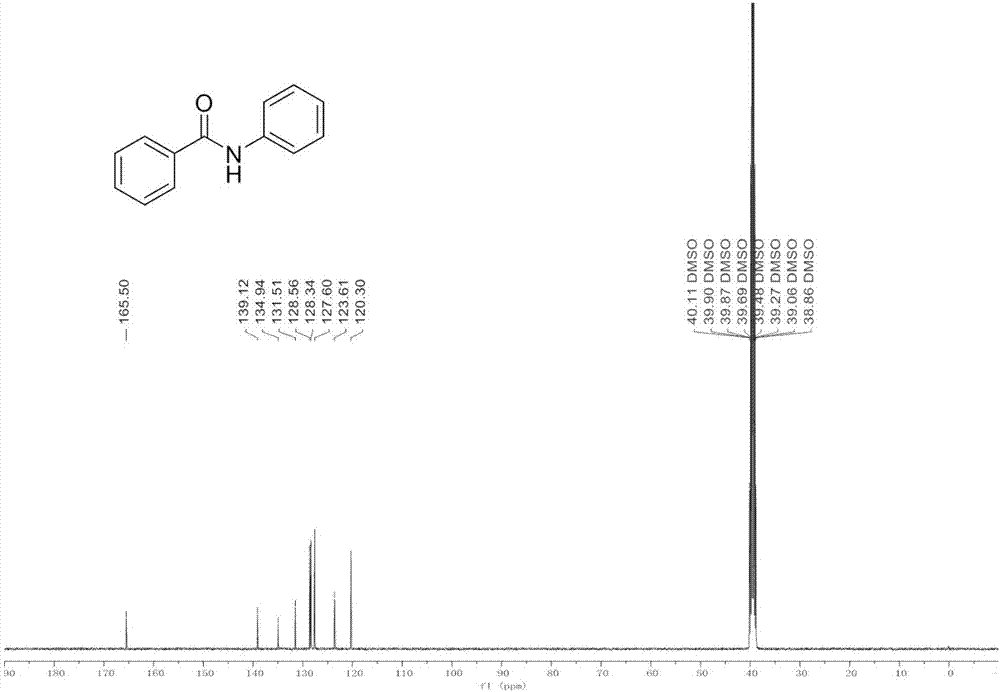
图2为实施例1所制备的产物的13cnmr谱图;
图3为实施例2所制备的产物的1hnmr谱图;
图4为实施例2所制备的产物的13cnmr谱图;
图5为实施例3所制备的产物的1hnmr谱图;
图6为实施例3所制备的产物的13cnmr谱图;
图7为实施例4所制备的产物的1hnmr谱图;
图8为实施例4所制备的产物的13cnmr谱图;
图9为实施例5所制备的产物的1hnmr谱图;
图10为实施例5所制备的产物的13cnmr谱图;
图11为实施例6所制备的产物的1hnmr谱图;
图12为实施例6所制备的产物的13cnmr谱图;
图13为实施例7所制备的产物的1hnmr谱图;
图14为实施例7所制备的产物的13cnmr谱图;
图15为实施例8所制备的产物的1hnmr谱图;
图16为实施例8所制备的产物的13cnmr谱图;
图17为实施例9所制备的产物的1hnmr谱图;
图18为实施例9所制备的产物的13cnmr谱图;
图19为实施例10所制备的产物的1hnmr谱图;
图20为实施例10所制备的产物的13cnmr谱图;
图21为实施例11所制备的产物的1hnmr谱图;
图22为实施例11所制备的产物的13cnmr谱图;
图23为实施例12所制备的产物的1hnmr谱图;
图24为实施例12所制备的产物的13cnmr谱图;
图25为实施例13所制备的产物的1hnmr谱图;
图26为实施例13所制备的产物的13cnmr谱图。
具体实施方式
下面对本发明的实施方式做进一步详细描述:
一种采用芳香肼合成n-芳基仲芳酰胺的方法,向溶剂中加入如式ⅰ所示的芳基硼酸和如式ⅱ所示的芳香肼,以及主催化剂和助催化剂,其中,芳基硼酸和芳香肼的摩尔比为10:1~1:1,芳基硼酸、主催化剂和助催化剂的摩尔比为100:1:1~1:1:1,芳基硼酸在溶剂中的浓度为0.05~2摩尔/升,向反应体系中通入co使反应体系的压力为0.1~5mpa,然后在20~150℃温度下进行加热搅拌反应24h后分离提纯即得到如式ⅲ所示的n-芳基仲芳酰胺;
其中,r1和r2选自氢、甲基、乙基、氟、氯、溴;主催化剂为醋酸钯、氯化钯、双三苯基磷二氯化钯、1,2-二苯基磷二茂铁二氯化钯(pd(dppf)cl2)、四三苯基磷钯中的任意一种;助催化剂为铜粉、氯化亚铜、氯化铜、碘化亚铜、氧化铜、纳米氧化铜、氯化铁、氯化亚铁、纳米四氧化三铁中的任意一种;溶剂为二氯甲烷、乙腈、dmf、dmso、二氧六环、正己烷、环己烷、乙腈、苯甲醚、甲苯中的任意一种。
下面结合实施例对本发明做进一步详细描述:
实施例1
n-苯基苯甲酰胺的制备:
将1.5mmol的苯硼酸溶于盛有5ml苯甲醚的反应器中,在搅拌下加入1mmol苯肼,以0.05mmol醋酸钯为主催化剂,0.05mmolcu为助催化剂,向反应体系中通入co气体使体系中压力达到2mpa,于100℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到99mg白色固体,产率为50%,所得产品结构式如下:
如图1和图2所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.27(s,1h),8.00–7.91(m,3h),7.78(d,j=7.6hz,2h),7.65–7.49(m,3h),7.36(t,j=7.9hz,2h),7.11(t,j=7.4hz,1h).13c-nmr(101mhz,dmso-d6)δ165.50,139.12,134.94,131.51,128.56,128.34,127.60,123.61,120.30.
实施例2
n-(4-甲基苯基)苯甲酰胺的制备:
将1mmol的苯硼酸溶于盛有5ml二氯甲烷的反应器中,在搅拌下加入1mmol对甲基苯肼,以0.1mmol氯化钯为主催化剂,0.1mmol氯化亚铜为助催化剂,向反应体系中通入co气体使体系中压力达到1mpa,于20℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到116mg白色固体,产率为55%,所得产品结构式如下:
如图3和图4所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ
10.17(s,1h),7.99–7.91(m,2h),7.70–7.62(m,2h),7.64–7.54(m,1h),7.53(dd,j=8.2,6.5hz,2h),7.16(d,j=8.3hz,2h),2.29(s,3h).13c-nmr(101mhz,dmso-d6)δ165.28,136.60,135.01,132.54,131.39,128.94,128.31,127.54,120.34,20.46.
实施例3
n-(4-氯苯基)苯甲酰胺的制备:
将5mmol的苯硼酸溶于盛有5ml乙腈的反应器中,在搅拌下加入1mmol对氯苯肼,以0.1mmol双三苯基磷二氯化钯为主催化剂,0.1mmol碘化亚铜为助催化剂,向反应体系中通入co气体使体系中压力达到5mpa,于80℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到111mg白色固体,产率为48%,所得产品结构式如下:
如图5和图6所示,产品核磁表征:1h-nmr(400mhz,chloroform-d)δ7.91–7.86(m,2h),7.67–7.56(m,3h),7.52(dd,j=8.2,6.6hz,2h),7.39–7.33(m,2h).13c-nmr(101mhz,chloroform-d)δ165.16,135.98,134.13,131.59,129.06,128.64,128.40,126.50,120.88
实施例4
4-甲基-n-苯基苯甲酰胺的制备:
将10mmol的4-甲基苯硼酸溶于盛有5mldmf的反应器中,在搅拌下加入1mmol苯肼,以0.1mmolpd(dppf)cl2为催化剂,0.1mmol氯化铜为助催化剂,向反应体系中通入co气体使体系中压力达到0.1mpa(气球中,常压),于150℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到129mg白色固体,产率为61%,所得产品结构式如下:
如图7和图8所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.14(s,1h),7.87(d,j=8.2hz,2h),7.77(d,j=9.5hz,2h),7.34(t,j=7.1hz,4h),7.09(t,j=7.4hz,1h),2.39(s,3h).13c-nmr(101mhz,dmso-d6)δ165.29,141.49,139.20,132.05,128.85,128.52,127.63,123.48,120.31,20.97.
实施例5
4-溴-n-苯基苯甲酰胺的制备:
将2mmol的对溴苯硼酸溶于盛有5mldmso的反应器中,在搅拌下加入1mmol苯肼,以0.02mmol四三苯基膦钯为催化剂,0.02mmol铜粉为助催化剂,向反应体系中通入co气体使体系中压力为0.1mpa(气球中,常压),于150℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到132mg白色固体,产率为48%,所得产品结构式如下:
如图9和图10所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.31(s,1h),7.95–7.88(m,2h),7.81–7.70(m,4h),7.40–7.32(m,2h),7.12(t,j=7.4hz,1h).13c-nmr(101mhz,dmso-d6)δ164.49,138.91,133.97,131.36,129.76,128.59,125.27,123.79,120.37.
实施例6
3-甲基-n-(2-甲基苯基)苯甲酰胺的制备:
将2mmol的间甲基苯硼酸溶于盛有5ml二氧六环的反应器中,在搅拌下加入1mmol邻甲基苯肼,以0.5mmolpd(dppf)cl2为催化剂,0.5mmol纳米氧化铜为助催化剂,向反应体系中通入co气体使体系中压力达到3mpa,于100℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到117mg白色固体,产率为52%,所得产品结构式如下:
如图11和图12所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ9.86(s,1h),7.83–7.74(m,2h),7.46–7.37(m,2h),7.36–7.13(m,4h),2.40(s,3h),2.23(s,3h).13c-nmr(101mhz,dmso-d6)δ165.32,137.67,136.41,134.47,133.69,132.04,130.25,128.26,128.14,126.57,125.95,125.91,124.70,20.95,17.90.
实施例7
3-甲基-n-(4-甲基苯基)苯甲酰胺的制备:
将2mmol的间甲基苯硼酸溶于盛有6ml正己烷的反应器中,在搅拌下加入1mmol对甲基苯肼,以0.05mmol氯化钯为催化剂,0.05mmol氯化铁为助催化剂,向反应体系中通入co气体使体系中压力达到2mpa,于90℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到128mg白色固体,产率为57%,所得产品结构式如下:
如图13和图14所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.12(s,1h),7.83–7.71(m,2h),7.72–7.57(m,2h),7.50–7.33(m,2h),7.15(d,j=8.2hz,2h),2.40(s,3h),2.28(s,3h).13c-nmr(101mhz,dmso-d6)δ165.39,137.59,136.66,135.03,132.47,131.94,128.92,128.19,128.04,124.71,120.31,20.92,20.45.
实施例8
3-甲基-n-(4-氯苯基)苯甲酰胺的制备:
将1mmol的间甲基苯硼酸溶于盛有5ml环己烷的反应器中,在搅拌下加入1mmol对氯苯肼,以1mmol双三苯基磷二氯化钯为催化剂,1mmol氯化亚铁为助催化剂,向反应体系中通入co气体使体系中压力达到5mpa,于80℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到135mg白色固体,产率为55%,所得产品结构式如下:
如图15和图16所示,产品核磁表征:1h-nmr(400mhz,chloroform-d)δ7.73–7.58(m,4h),7.45–7.32(m,4h),2.46(s,3h).13c-nmr(101mhz,chloroform-d)δ165.83,138.83,136.54,134.63,132.80,129.48,129.11,128.73,127.74,123.92,121.35,21.40.
实施例9
4-甲基-n-(4-氟苯基)苯甲酰胺的制备:
将0.5mmol的对甲基苯硼酸溶于盛有10ml乙腈的反应器中,在搅拌下加入1mmol对氟苯肼,以0.1mmol四三苯基膦钯为主催化剂,0.1mmol纳米四氧化三铁为助催化剂,向反应体系中通入co气体使体系中压力达到2mpa,于80℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到69mg白色固体,产率为60%,所得产品结构式如下:
如图17和图18所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.23(s,1h),7.91–7.84(m,2h),7.84–7.75(m,2h),7.34(d,j=7.9hz,2h),7.24–7.15(m,2h),2.39(s,3h).13c-nmr(101mhz,dmso-d6)δ165.21,158.16(d,j=239hz),141.59,135.55,131.83,128.88,127.62,122.08(d,j=7.9hz),115.11(d,j=22.2hz).
实施例10
4-乙基-n-(3-甲基苯基)苯甲酰胺的制备:
将1.5mmol的对乙基苯硼酸溶于盛有5ml甲苯的反应器中,在搅拌下加入1mmol间甲基苯肼,以0.05mmolpd(dppf)cl2为主催化剂,0.05mmol碘化亚铜为助催化剂,向反应体系中通入co气体使体系中压力达到3mpa,于120℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到143mg白色固体,产率为60%,所得产品结构式如下:
如图19和图20所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.10(s,1h),7.95–7.82(m,2h),7.67–7.51(m,2h),7.37(d,j=8.0hz,2h),7.22(t,j=7.8hz,1h),6.92(d,j=7.5hz,1h),2.69(q,j=7.6hz,2h),2.31(s,3h),1.22(t,j=7.6hz,3h).13c-nmr(101mhz,dmso-d6)δ165.29,147.61,139.12,137.65,133.85,132.39,128.37,127.70,124.18,120.79,117.43,28.04,21.20,15.41.
实施例11
4-乙基-n-(4-氯苯基)苯甲酰胺的制备:
将1.5mmol的对乙基苯硼酸溶于盛有5ml苯甲醚的反应器中,在搅拌下加入1mmol对氯苯肼,以0.05mmolpd(dppf)cl2为催化剂,0.05mmolcu为助催化剂,向反应体系中通入co气体使体系中压力达到2mpa,于100℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到145mg白色固体,产率为56%,所得产品结构式如下:
如图21和图22所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.27(s,1h),7.93–7.73(m,4h),7.48–7.27(m,4h),2.69(q,j=7.6hz,2h),1.21(t,j=7.6hz,3h).13c-nmr(101mhz,dmso-d6)δ165.47,147.85,138.21,132.10,128.44,127.75,127.73,127.08,121.76,28.04,15.32.
实施例12
4-氯-n-(3-甲基苯基)苯甲酰胺的制备:
将1.5mmol的对氯苯硼酸溶于盛有5ml苯甲醚的反应器中,在搅拌下加入1mmol间甲基苯肼,以0.05mmolpd(dppf)cl2为主催化剂,0.05mmol碘化亚铜为助催化剂,向反应体系中通入co气体使体系中压力达到2mpa,于100℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到147mg白色固体,产率为60%,所得产品结构式如下:
如图23和图24所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.23(s,1h),8.13–7.81(m,2h),7.70–7.46(m,4h),7.24(t,j=7.8hz,1h),6.94(d,j=7.7hz,1h),2.31(s,3h).13c-nmr(101mhz,dmso-d6)δ164.29,138.83,137.74,136.30,133.65,129.54,128.42,128.40,124.48,120.93,117.58,21.17.
实施例13
4-氯-n-(4-氟苯基)苯甲酰胺的制备:
将2mmol的对氯苯硼酸溶于盛有5ml甲苯的反应器中,在搅拌下加入1mmol对氟苯肼,以0.2mmolpd(dppf)cl2为催化剂,0.2mmol氯化亚铜为助催化剂,向反应体系中通入co气体使体系中压力达到3mpa,于120℃下加热搅拌24小时,用tlc监测反应的进行,反应完全后浓缩,经柱层析分离,得到137mg白色固体,产率为55%,所得产品结构式如下:
如图25和图26所示,产品核磁表征:1h-nmr(400mhz,dmso-d6)δ10.36(s,1h),8.05–7.91(m,2h),7.87–7.74(m,2h),7.62(d,j=8.6hz,2h),7.20(t,j=8.9hz,2h).13c-nmr(101mhz,dmso-d6)δ164.29,158.34(d,j=240.5hz),136.39,135.27(d,j=2.6hz),133.44,129.54,128.44,122.24(d,j=7.9hz),115.17(d,j=22.3hz).
- 还没有人留言评论。精彩留言会获得点赞!