细胞分泌分析的装置和方法与流程
本申请要求于2016年3月17日提交的美国临时专利申请连续号62/309,663的优先权,将其公开内容通过引用整体并入。
发明背景
细胞是生命的基本单位,并且没有两个细胞是相同的。实际上,已经显示看似相同的克隆细胞群在群体内的细胞之间显示出表型差异。从细菌细胞到部分分化的细胞(例如成体干细胞和祖细胞)到高度分化的哺乳动物细胞(例如免疫细胞,如抗体分泌细胞(asc))的所有生命水平均存在细胞差异。细胞状态、功能和应答的差异可以来自多种机制,包括不同的历史、不同的分化状态、表观遗传变化、细胞周期效应、随机变化、基因组序列差异、基因表达、蛋白表达和不同的细胞相互作用效应等。因此,开发用于分析单细胞特性的敏感工具令人非常感兴趣。
许多细胞类型分泌具有生物学功能的蛋白。例如,不同的免疫细胞分泌多种因子,包括通过细胞信号转导起作用的生长因子、促进免疫激活或抑制的细胞因子以及特异性识别病原体(包括病毒、细菌、细胞、蛋白、聚糖或其他外来激发)的抗体。抗体还可以识别作为抗癌应答或自身免疫病症的一部分的非外来抗原(自体抗原或自身抗原)。由此,测量细胞分泌的蛋白的量和/或细胞分泌的蛋白的特性(例如序列、结合伴侣)的能力令人非常感兴趣。理想的是,对个体细胞进行这样的测量,以使测量可以用于鉴定与相同环境或群体内的其他细胞相比任何给定细胞分泌的蛋白的特性的差异。例如,分析单一或少量asc分泌的抗体可以提供在对大量群体进行相同分析时不可获得的关于个体细胞的信息(例如抗体结合特性、功能作用)。
颌类脊椎动物的适应性免疫系统能够产生多种不同的抗体。这种多样性通过多种机制产生,包括可变区基因的组合重组,以在最终表达为独特的抗体的重链和轻链基因中产生遗传编码的多样性。在人中,这种基因重组发生在b细胞发育期间,并且可以在个体中产生数十亿种不同的抗体。激发之后,表达识别激发的抗体的b细胞被激活并扩增以产生无性繁殖的相关的b细胞。在该扩增期间,体细胞超变和选择导致群体中一些抗体的亲和力提高。该过程的结果是表达多种不同抗体的多种多样的b细胞。这些b细胞成熟为继续将抗体分泌到介质中的浆细胞或者成熟为表达膜结合抗体的记忆b细胞。为了鉴定具有改善的特性(例如亲和力、功能活性)的群体中的抗体,应将个体抗体以及因此asc作为个体细胞进行研究。
有效鉴定结合特定靶标的抗体和/或特定功能作用的能力对于产生用于研究、诊断和治疗开发的抗体令人非常感兴趣。具有最佳治疗特性的抗体,特别是靶向表面受体的抗体的发现仍然是药物开发中的严重瓶颈。在针对免疫的应答中,动物可以产生数百万种不同的单克隆抗体(mab)。每种mab由称为抗体分泌细胞(asc)的单一细胞产生,并且每种asc仅产生一种类型的mab。因此,例如用于药物发现目的的抗体分析适用于单细胞分析。然而,当以常规分析形式的体积分析时,即使单独分析asc而不是大量细胞群中,由于单一asc仅产生少量抗体,抗体太稀,使其完全检测不到。
单细胞分析方法提供了增加鉴定新抗体的速度、通量和效率的方法。单细胞抗体表征方法的常用主题是使用小体积限制来增加分析灵敏度。一旦鉴定出目标细胞,就将它们回收以用于后续分析,包括其抗体基因的测序和/或可用于后续实验的更大量抗体的表达。用于筛选和选择来自单一细胞的抗体的小型化形式的实例包括基于板的方法(czerkinsky等人.(1983).journalofimmunologicalmethods65(1-2),pp.109-121;leslie等人.(1996).fasebjournal10(6),pp.346-346)、微流体装置(koster等人.(2008).labonachip8(7),pp.1110-1115;mazutis等人.(2013).natureprotocols8(5),pp.870-891;singhal等人.(2010).analyticalchemistry82(20),pp.8671-8679)、微型印刷(microprinting)(loveet等人.(2006).naturebiotechnology24(6),pp.703-707)和开放微孔阵列(jin等人.(2011).natureprotocols6(5),pp.668-676;wrammert等人.(2008).nature453(7195),pp.667-u10)。
尽管存在用于单一asc分析的技术,但是它们仍然受到低通量、灵敏度和可以进行的表征类型的困扰。本发明解决了本领域对于用于进行单一抗体分泌细胞分析的更稳健的装置、仪器和分析的需求。
发明概述
在一个方面,本发明涉及用于分析可归因于单一效应细胞的细胞外效应的平台。在一实施方案中,效应细胞是分泌生物因子例如抗体(asc)的细胞。在一实施方案中,细胞外效应是细胞增殖、生长减少、细胞凋亡、裂解、分化、感染、结合(例如与细胞表面受体或表位结合)、形态学变化、信号级联的诱导或抑制、酶抑制、病毒抑制、细胞因子抑制或补体激活。在一实施方案中,平台是双组件微流体装置,其包括第一组件和第二组件,所述第一组件具有开放微室。在一个实施方案中,该装置是图4-8之一中描绘的装置。
在一个方面,提供了用于鉴定包含显示细胞外效应的效应细胞的细胞群的方法。在该方面的一个实施方案中,在具有第一组件和第二组件的双组件微流体装置或者包括开放微室的单组件装置中分析一种或多个细胞群。该方法包括在位于微流体装置第一组件内的多个不同室中保留个体细胞群,各细胞群任选地包含一种或多种效应细胞,其中在单个室中保留个体细胞群。各室的纵横比(定义为高度比最小横向尺寸)≥约0.6,例如≥0.7,≥1或者≥1但≤约10。可选地,装置中各室的平均纵横比≥约0.6,例如≥0.7,≥1或者≥1但≤约10。多个开放室的一个或多个中的内容物还包含含有一种或多种读出颗粒的读出颗粒群。使微流体装置的第二组件与第一组件接触,以在两个组件之间产生可逆密封或可逆部分密封。第一组件和第二组件中的一个或两者的接触表面可以包括微尺度结构(如通道结构或室结构),以使当进行这种密封时,装置第一组件的一个或多个开放室可以关闭或基本关闭。此外,当使第二组件与第一组件接触时,例如当通道结构存在于第二组件中时,两个或更多个开放室可以互连。该方法还包括在多个开放室中的一个或多个内孵育多个细胞群或其子集以及一种或多种读出颗粒或其子集;分析多个细胞群或其子集中细胞外效应的存在,其中读出颗粒群或其亚群提供细胞外效应的直接或间接读出;以及基于分析步骤的结果确定多个细胞群中的一种或多个细胞群的一种或多种效应细胞是否表现出细胞外效应。
在一实施方案中,效应细胞是分泌生物因子(例如抗体)的细胞。只要在特定室内检测到细胞外效应的存在,就不必初始鉴定显示细胞外效应的具体效应细胞。也就是说,如果需要进一步表征以识别显示细胞外效应的特定细胞,则可以回收对所述效应进行测量的室中的一些或所有细胞。
附图简述
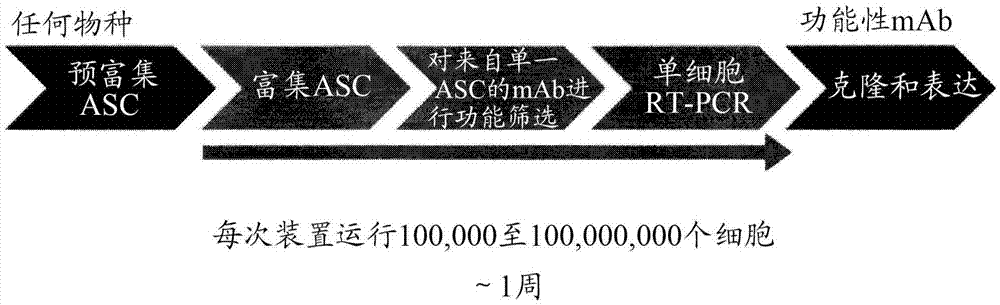
图1是用于单一效应细胞鉴定和选择的一个实施方案的过程流程图。单一细胞获自任何动物或培养细胞群,并任选地富集效应细胞群。将使用双组件微流体装置的高通量微流体分析用于对在一些情况下存在于异质细胞群中的单一效应细胞分泌的抗体进行功能筛选。在一轮或多轮分析后,回收细胞并扩增抗体可变区基因用于测序(vh/vi)和/或克隆到细胞系中。该过程允许在单次装置运行中筛选约100,000个细胞至约100,000,000个细胞,其中一周后回收序列。
图2是微流体效应细胞富集方法的一个实施方案的过程流程图。首先以每室25个细胞的平均浓度装载效应细胞,并孵育以产生抗体的多克隆混合物。筛选利用或不用培养分析细胞的步骤产生的多克隆混合物,用于鉴定显示细胞外效应(例如结合、亲和或功能活性)的室。然后回收40个阳性室以获得富集的群体,其中~4%的效应细胞产生目标抗体。然后在第二阵列中分析有限稀释下富集的效应细胞群,以选择显示细胞外效应的单一asc。富集所需的时间为约4小时,并且总筛选通量为每次运行约100,000个细胞至100,000,000个细胞。如果需要,可以进行两次富集过程,并且对于每次筛选可以使用相同或不同的特性。
图3是pdgfrα的细胞外结构域在人、兔、小鼠和大鼠之间的比对。(上图)显示与pdgfbb二聚体复合的两种pdgfrβ的细胞外结构域(ecd)的结构的带状图(来自shim等人(2010).proc.natl.acad.sci.usa107,pp.11307-11312,通过引用整体并入本文)。注意,显示了pdgfrβ,因为尽管期望pdgfrα的类似结构但是不可获得。(下图)人、小鼠、兔、大鼠之间pdgfrαecd的比对。来自人同种型的变异区域用较浅的阴影和“*”表示。实质性变异指示存在许多可用于抗体识别的表位,其中兔与人差异最大。
图4是本文提供的一个装置实施方案400的横截面的示意图。该装置在本文被称为具有多层顶部的分离装置或多组件装置。顶部组件401包括下推阀结构404和开放通道405。底部组件402包括开放室403。
图5是装置实施方案500和500’的横截面的示意图。
图6是双组件装置实施方案600的横截面的示意图,包括可转移的单层顶部组件601。顶部示意图是装置的横截面,其中向装置底部组件中的室的流动是开放的。底部示意图通过顶部组件的转移显示了密封室。
图7是本文提供的一个装置实施方案700的横截面的示意图。该装置在本文被称为具有单层未图案化的顶部的分离装置或多组件装置。
图8是本文提供的一个装置实施方案的横截面的示意图。该装置包括具有用于成像的容量推出(volumeextrusion)的开放室阵列。
图9是根据本发明的实施方案的微流体室的示意图,其示出了使用磁场来定位室内的颗粒。
图10是使用模板转换的单一细胞hv/lv方法的示意图。将单一细胞沉积到微量离心管中,并由靶向重链和轻链恒定区的多重基因特异性引物产生cdna。将mmlv酶的模板转换活性用于将模板转换寡核苷酸的反向互补附加到所得cdna的3’末端上。将使用与重链和轻链的恒定区退火的多重引物和与复制的模板转换寡核苷酸互补的通用引物的半巢式pcr,用于扩增cdna并引入各单一细胞扩增子特异的索引序列。然后混合扩增子并进行测序。
图11显示了根据实施方案鉴定产生能够特异性结合靶标读出颗粒的生物分子的效应细胞的方法的顶部图(右)和横截面图(左)。
图12显示了鉴定产生特异性结合恶性细胞但不结合正常细胞的生物分子(例如抗体)的至少一种效应细胞的方法的顶部图(右)和横截面图(左)。
图13显示了鉴定产生结合读出细胞的生物分子的效应细胞的方法的实施方案的顶部图(右)和横截面图(左),其中效应细胞的亚群被功能化以也作为读出细胞起作用。
图14是抗体四聚体的示意图。
图15显示了根据实施方案筛选已知生物分子与之结合的靶标表位/分子的方法的顶部图(右)和横截面图(左)。
图16显示了根据实施方案鉴定产生特异性结合靶标表位/抗原的抗体的效应细胞的方法的顶部图(右)和横截面图(左)。
图17显示了定量细胞裂解的方法的顶部图(右)和横截面图(左)。
图18显示了根据实施方案鉴定产生特异性结合靶标表位/抗原的抗体的效应细胞的存在的方法的顶部图(右)和横截面图(左)。
图19显示了定量细胞裂解的方法的顶部图(右)和横截面图(左)。
图20显示了鉴定产生诱导读出细胞生长的生物分子的效应细胞的方法的顶部图(右)和横截面图(左)。
图21显示了鉴定产生刺激读出细胞经历细胞凋亡的生物分子的效应细胞的存在的方法的顶部图(右)和横截面图(左)。
图22显示了鉴定产生刺激读出细胞中的自噬的生物分子的效应细胞的方法的顶部图(右)和横截面图(左)。
图23显示了鉴定产生中和细胞因子的生物分子的效应细胞的方法的顶部图(右)和横截面图(左)。
图24显示了鉴定产生抑制细胞病毒感染的生物分子的效应细胞的方法的顶部图(右)和横截面图(左)。
图25显示了根据本发明的实施方案鉴定产生抑制靶标酶功能的生物分子的效应细胞的存在的方法的顶部图(右)和横截面图(左)。
图26显示了鉴定效应细胞的方法的顶部图(右)和横截面图(左)图,所述效应细胞显示激活第二类型效应细胞的分子,所述第二类型效应细胞转而分泌对读出颗粒有影响的分子。
图27显示了鉴定效应细胞的方法的顶部图(右)和横截面图(左),所述效应细胞分泌激活第二类型效应细胞的分子,所述第二类型效应细胞转而分泌对读出颗粒有影响的分子。
图28显示了检测效应细胞的方法的顶部图(右)和横截面图(左),所述效应细胞分泌具有高亲和力的抗体,其存在于含有分泌针对相同抗原但具有较低亲和力的抗体的细胞的异质细胞群中。
图29显示了根据本发明的实施方案筛选具有增加的抗原特异性的抗体的方法的顶部图(右)和横截面图(左),其中可通过不同的光学特征区分显示不同表位的读出颗粒。
图30显示了同时(i)鉴定同质或异质的效应细胞群中分泌生物分子的细胞和(ii)分析受所述分子影响的一种或多种细胞内化合物的方法的顶部图(右)和横截面图(左)。
图31是根据本发明的一个实施方案的仪器的示意图。该仪器可与本文所述的装置和/或方法之一共同使用,例如用于鉴定包含具有细胞外效应的效应细胞的细胞群。
图32是一组光学显微照片,其显示了在通过经msl制造的单组件多层微流体装置的通道装载之后的tangotmcxcr4-blau2os细胞。比例尺:100μm。
图33是一组光学显微照片,其显示了在装载到双组件微流体装置的底部室中12小时之后的tangotmcxcr4-blau2os细胞。比例尺:34μm。
图34(左)是流经室产生的流线,所述室的尺寸为100μm×100μm×150μm(深度×宽度×长度)并且纵横比为1.0。流线穿透到室的底部并引起颗粒在高流速下移动和/或颗粒损失。图34(右)是流经圆柱形室的流线,所述室的深度为125μm,直径为100μm,以及纵横比为1.25。流线在室的下半部分显示出再循环涡流。室不是按比例绘制的。
图35是在装载来自免疫动物的asc之后微流体室的光学显微照片(左图)。将asc与表达cxcr4的细胞以及亲本细胞系(阴性对照,左起第3幅图)孵育。检测到cxcr4特异性抗体(左起第2幅图)。还检测了结合表达cxcr4的细胞系和亲本细胞系的cxcr4非特异性抗体,并将其从分析中排除(右图)。比例尺:34μm。
图36是显示涂覆3种不同的流感相关抗原的微珠的光学显微照片:h1n1(10μm珠)、h3n2(5μm珠)和b毒株(3μm珠)。在装载人b细胞并孵育以积累分泌的抗体之后,使用荧光标记的第二抗人抗体与不同的二抗的混合物检测抗体与不同珠类型结合的特异性抗体,其中所述不同的二抗用不同颜色标记并且各自对于不同的同种型igg、iga和igm的检测是特异性的。显示了分泌h1n1、h3n2和b毒株抗原特异的抗体的3种不同细胞的人igg。
图37显示了使用多步细胞外效应分析检测和选择抗原特异性抗体的可行性。提供了微流体室的光学显微照片。探测m4-1bb和h4-1bb特异性抗体。也在室中孵育用dylight-650标记的h4-1bb配体,以检测在靶标特异性抗体的存在下配体与其天然受体结合的可能阻断。
图38显示了用荧光标记的二抗检测抗原特异性抗体之后的室的图。显示了包含asc的中心室以及相邻的顶部、底部、右侧和对角线(右上)室的像素强度直方图。标记直方图以指示阳性正珠信号产生的像素,并且显示中心室具有高于背景荧光的像素以及这些像素具有更高的总强度。
图39是显示分离自与活细菌(肺炎克雷伯氏菌(klebsiellapneumoniae))孵育的人样品的asc的光学显微照片。从人扁桃体和人骨髓中显示了igg和iga结合的实例。
图40显示了一系列延时图像,其示出了k562细胞在微流体装置不同微室中的生长。比例尺:100μm。
图41是分离由毛细管回收的含有asc或无asc的连续单个微流体室产生的20个pcr反应的琼脂糖凝胶。用抗体重链特异性引物产生10个上反应(h),以及用抗体轻链特异性引物产生10个下反应(l)。
发明详述
本文使用的单数形式“一个/一种(a)”/“一个/一种(an)”和“所述”包括复数指示物,除非上下文另外明确说明。
本文使用的“读出(readout)”指报告细胞外效应的方法。本文使用的“读出颗粒(readoutparticle)”意为任何颗粒,包括珠或细胞,例如报告功能或特性或者用于确定效应细胞的细胞外效应(例如功能性或特性)的分析的功能化珠或细胞或者效应细胞的产物如抗体。“读出颗粒”可以作为单一读出颗粒存在,或者存在于单个分析室内的同质或异质的读出颗粒群中。“读出颗粒群”包括一种或多种读出颗粒。在一实施方案中,读出颗粒是功能化的珠,其结合由效应细胞分泌的或在裂解时由效应细胞或辅助细胞释放的一种或多种生物分子(例如一种或多种抗体)。单一读出颗粒可以被功能化以捕获一种或多种不同类型的生物分子,例如蛋白和/或核酸。在一实施方案中,一种或多种蛋白是一种或多种不同的单克隆抗体。在一实施方案中,读出颗粒是珠或细胞,其能够结合由产生和/或分泌抗体的效应细胞所产生的抗体。在一些实施方案中,效应细胞也可以是读出颗粒,例如在群体中的一种效应细胞的分泌产物对效应细胞的较大或不同的亚群体具有影响的情况下,或者可选地在一种效应细胞上捕获同种效应细胞的分泌产物以读出捕获的情况下。
本文使用的“读出细胞(readoutcell)”是一种读出颗粒,其在单一效应细胞或包含一种或多种效应细胞(例如分泌抗体的一种或多种效应细胞)的细胞群的存在下表现出应答。在多个实施方案中,读出细胞是显示表面抗原或受体(例如gpcr或rtk或离子通道)的细胞。在一实施方案中,分泌的分子与读出细胞的结合是分析的细胞外效应。读出细胞可以是荧光标记的和/或具有在结合时被激活的荧光报告分子。
本文使用的“效应细胞”指可发挥细胞外效应的细胞。细胞外效应是对读出颗粒的直接或间接效应。细胞外效应可归因于效应细胞或效应细胞分泌的分子,例如信号转导分子、代谢物、抗体、神经递质、激素、酶、细胞因子。在一实施方案中,效应细胞是分泌诸如抗体的蛋白或显示诸如t细胞受体的蛋白的细胞。在本文所述的实施方案中,通过使用读出颗粒或读出颗粒群或亚群来表征细胞外效应。例如,在一实施方案中,细胞外效应是存在于读出细胞或读出珠上的细胞表面受体、离子通道或atp结合盒(abc)转运蛋白的激动作用或拮抗作用。在一实施方案中,效应细胞是抗体分泌细胞(asc)。本发明不受可根据本发明的方法进行分析的效应细胞类型或细胞群的限制。用于本发明的效应细胞类型的实例包括来自任何物种(例如人、小鼠、兔等)的主要抗体分泌细胞、主要记忆细胞(例如igg、igm、igd或细胞表面显示的其他免疫球蛋白或者扩增/分化成浆细胞)、在其表面显示蛋白或肽的树突细胞、选择之后融合或融合之后的直接杂交瘤融合、用一种或多种单克隆抗体(mab)文库转染(稳定或瞬时)的细胞系(例如对于鉴定的mab的亲和力成熟,使用fab区域的突变体文库;或者对于效应细胞功能优化,使用具有fc区域突变的鉴定的mab)或者用来自扩增的获自人/动物/文库的hc/lc可变区的重链(hc)和轻链组合转染的细胞系或者表达mab的细胞的组合(表征或未表征以寻找协同效应)。其他效应细胞包括t细胞(例如cd8+t细胞和cd4+t细胞),造血细胞,源自人和动物的细胞系,重组细胞系,例如工程化以产生抗体的重组细胞系、工程化以表达t细胞受体的重组细胞系。
“抗体分泌细胞”或“asc”是产生和分泌抗体的任何细胞类型。浆细胞(plasmacell)(也称为“血浆b细胞”、“浆细胞(plasmocyte)”和“效应细胞b细胞”)是终末分化的,并且是一种类型的asc。其他asc包括浆母细胞、通过记忆b细胞扩增产生的细胞、表达重组单克隆抗体的细胞系和杂交瘤细胞系。在另一实施方案中,效应细胞是分泌除抗体之外的蛋白的细胞。
本文使用的“细胞外效应”是对效应细胞的细胞外读出颗粒的直接或间接效应,在许多实施方案中,效应细胞是抗体分泌细胞(asc),所述细胞外效应包括但不限于增加细胞增殖、生长减少、细胞凋亡、裂解、分化、感染、结合(例如与细胞表面受体或表位的结合)、形态变化、信号级联的诱导或抑制、酶抑制、病毒抑制、细胞因子抑制、补体激活。在一实施方案中,细胞外效应是由效应细胞分泌的目标生物分子与靶标的结合特性。在另一实施方案中,细胞外效应是诸如第二细胞的凋亡的应答。在一实施方案中,与第二效应细胞或包含第二效应细胞的细胞群显示的效应相比或者与对照(阴性或阳性对照)相比,测量的细胞外效应不同(即变异)。
本文提及的“异质群”,特别是关于颗粒或细胞群,意为包含至少两种具有不同性质的颗粒或细胞的颗粒或细胞群。在一实施方案中,该性质是形态学、大小、荧光报告分子、细胞种类、表型、基因型、细胞分化类型、一种或多种表达的rna种类的序列或者功能特性。
本文使用的“包衣(coating)”可以是向室或通道表面的任何添加,其促进或抑制效应细胞、分泌的分子(如抗体)、读出颗粒或辅助颗粒粘附于表面的能力或者促进生物学过程如细胞生长。在一实施方案中,表面包衣是表面功能化。在一实施方案中,包衣选自:细胞;聚合物刷、聚合物水凝胶、自组装单层(sam)、光接枝分子、具有细胞结合特性的蛋白或蛋白片段(例如来自肌动蛋白、纤连蛋白、整合蛋白、蛋白a、蛋白g等的细胞结合域)、聚-l-赖氨酸。在一实施方案中,使用精氨酸-甘氨酸-天冬氨酸-(丝氨酸)(rgd(s))肽序列基序作为包衣。在另一实施方案中,将聚赖氨酸用作pdms的聚合物包衣,以通过静电相互作用增强细胞粘附;使用具有细胞结合特性的磷脂、具有细胞结合特性的胆固醇、具有细胞结合特性的糖蛋白或具有细胞结合特性的糖脂。在另一实施方案中,使用生物素化的生物分子使pdms表面功能化。牛血清白蛋白(bsa)也可用作包衣。由于bsa的疏水结构域,其容易通过疏水pdms表面上的疏水作用吸附,使得室中基于链霉亲和素的偶联物进一步直接偶联(蛋白、dna、聚合物、荧光团)。基于聚乙二醇的聚合物还因其生物污染特性而闻名,并且可以涂覆在pdms表面上(吸附、共价接枝),防止细胞粘附。也可以使用化学气相沉积(cvd)在pdms表面沉积聚(对二甲苯)例如聚对二甲苯c并防止细胞粘附。
本文使用的“隔离的”指这样的情况:给定室不允许用微流体装置另一室的颗粒或生物分子分析的效应细胞和/或读出颗粒的大量污染。例如,在复合室的情况下可以通过密封室或一组室,通过限制室之间的流体连通或通过限制室之间的流体流动,例如通过诸如纵横比的特定室结构性质来实现这种隔离。
本文所用的“微流体装置”指用于操纵流体的装置,其包括具有最小尺寸小于1mm的特征。
除非另外说明,否则“纵横比”指微流体特征,例如室的高度/深度与最小横向尺寸的比率。
虽然微流体装置可用于解决通量和单一细胞灵敏度的问题,但在许多情况下,通过微尺度通道将细胞装载到装置中可能具有挑战性。较大的细胞类型或天然粘附于通道表面的细胞可能在被递送到装置的分析室之前堵塞通道,从而阻碍分析并导致装置失效。当细胞通过微通道装载到室中时,也可能发生细胞向装置的低效装载或装置中细胞的不均匀装载。此外,在通过微通道装载细胞期间,可能存在大量细胞“沉降”到装置入口处的端口中并随后不进入分析室。当试图在稳健的仪器中使细胞装载和分析标准化和自动化,这些问题尤其严重。在这种情况下,不应要求操作员实时调整装载参数。此外,当使用粘附细胞类型或基于多种不同细胞的抗体发现分析可能需要的其它大细胞类型时,细胞装载可能有问题。
本文提供的装置和仪器通过提供适合与大量细胞类型一起使用的替代分析形式来解决该细胞装载问题。
设计用于容纳多个细胞的本领域已知的方法和装置具有使其不适用于本文所述类型的分析的限制。例如维持细胞活力、选择性地回收目标效应细胞、限制/阻止装置内的蒸发、维持基本相同的压力、消除交叉污染均可能有问题。已知的设备结构还限制了成像能力(例如通过提供颗粒在不同的焦平面中,降低的分辨率)并且缺乏本发明的通量(wo2012/072822和bocchi等人(2012),出于所有目的,将其各自通过引用整体并入)。
在本文所述的方面和实施方案中,本发明的装置和分析包括介质洗涤步骤和/或与不同细胞类型共培养。该形式提供了可以用于进行多种单细胞抗体筛选分析数个有利性质。使用多步筛选策略,可以将此类装置和分析用于每轮装置运行筛选成千上万个细胞。本文描述的方法与支持多种分析形式的高分辨率显微镜检查兼容。此外,本文所述的装置和分析形式提供了这样的手段,其固定抗体分泌细胞(asc)用于分析同时仍然能够控制介质组分的更换,从而支持利用一种或多种介质更换步骤的分析。重要的是,更换介质的能力还能够延长抗体分泌细胞和其他细胞类型的培养。值得注意的是,本发明的装置和分析提供了浓缩分泌的生物分子(如抗体)以及实现高空间密度分析的手段。
除了解决上述细胞装载问题之外,本文提供的装置和方法提供了评估单一细胞的细胞外效应的优点,例如单一asc分泌的抗体的细胞外效应。例如,本文描述的装置是可扩展的,能够减少试剂消耗并增加通量,以提供否则将不切实际或极其昂贵的用于研究的大的单细胞分析平台。
在不希望受理论束缚的情况下,由本文提供的纳升分析体积提供的浓度增加和快速扩散混合以及精确的细胞处理和操作(例如介质条件的时间-空间控制)使得能够进行效应细胞的单细胞分析,所述效应细胞如免疫细胞(例如b细胞、t细胞和巨噬细胞),其主要功能包括分泌不同的效应蛋白,如抗体和细胞因子以及趋化因子。
本文描述的实施方案提供了能够进行多个细胞群的多细胞分析,随后回收多个细胞群中的一种或多种用于后续分析的仪器、装置和方法,每种细胞群包含一种或多种效应细胞。在一实施方案中,多细胞分析是群体中一种或多种细胞的分泌产物(例如抗体)的分析。在一些实施方案中,细胞群是异质细胞群。也就是说,群体中的两种或更多种细胞在基因型、表型、不同的重组抗体基因、不同的重组t细胞受体基因或一些其他特性方面不同。此外,在一实施方案中,当在一个装置上平行分析多个细胞群时,至少两种群体相对于彼此是异质的(例如不同数量的细胞、细胞类型等)。在一些分析实施方案中,以足以检测到读出信号(例如荧光信号)的浓度将包含用作检测试剂的一种或多种读出颗粒(例如表达细胞受体的读出细胞、读出珠、传感因子(sensor)、可溶性酶等)的读出颗粒群暴露于包含一种或多种效应细胞的单个细胞群和来自一种或多种效应细胞的分泌产物。读出信号报告效应细胞的特性,例如由群体中的一种或多种效应细胞诱导的对一种或多种读出颗粒的生物学应答/细胞外效应(例如细胞凋亡)。
值得注意的是,因为效应细胞在许多情况下是稀有细胞,所以通过本文所述方法分析的所有细胞群不一定必须含有效应细胞。例如,在一实施方案中,当在单个装置上分析数千种细胞群时,仅一部分细胞群包含效应细胞。
本文所述的装置和分析提供单细胞分析,其中一种或多种效应细胞存在于装置单个分析室中的一种或多种个体细胞群中。重要的是,可以在较大细胞群(例如异质细胞群)中检测单一效应细胞的效应。通过在单个分析室内采用多细胞分析方法,本文描述的实施方案可以以比先前报道的用于单细胞分析的高得多的通量进行操作。例如,可以以实用的基板尺寸制造1,000,000个室的阵列,并且以高至100个细胞/室的装载密度使用,从而实现每次实验高至100,000,000个细胞的筛选通量(图1)。在一实施方案中,一旦细胞群被鉴定为对读出颗粒表现出细胞外效应(例如与另一群体或对照值相比细胞外效应的变化),则回收细胞群并作为个体细胞亚群进一步分析(例如以有限稀释度分析回收的细胞群),以确定群体中哪种效应细胞负责细胞外效应。
本发明利用小反应体积和大规模平行分析能力来分析个体细胞群(其可以包含单一细胞或少数细胞)的目标特性,即“细胞外效应”。在一实施方案中,细胞外效应是由细胞群中存在的细胞分泌的抗体的特性。细胞外效应不限于特定效应,反而它可以是结合特性(特异性、亲和力、kon、koff等)或功能特性,例如细胞表面受体的激动作用或拮抗作用。在一实施方案中,细胞外效应是效应细胞分泌产物(例如抗体)发挥的效应。然而,细胞外效应可以是细胞自身的效应,例如效应细胞的细胞表面蛋白所发挥的效应。
本文提供的装置和方法部分基于小即灵敏的概念。本文提供的装置包括数千、数万或数十万个纳升体积细胞分析室,每个体积分析室的体积比常规的基于板的分析小约10,000至约100,000倍。在这些纳升或子纳升室中,各单一效应细胞(例如asc)在数分钟内产生高浓度分泌的生物分子,例如抗体。在一实施方案中,利用该浓度效应来实施鉴定由单一原代asc产生的具有特定功能特性的抗体的基于细胞的筛选分析,所述特定功能特性如调节细胞表面受体活性(例如激动或拮抗作用)。浓度效应还允许鉴定在未显示目标特性的其他效应细胞和非效应细胞的存在下显示所述特性的单一效应细胞。本文详细描述了适用于本文提供的方法和装置功能性细胞外效应分析。
重要的是,在本文提供的分析中,只要在包含细胞群的特定室内检测到细胞外效应的存在,就不必初始鉴定具有特定特性的特定效应细胞或效应细胞亚群。可以回收室内对效应进行测量的一些或所有细胞用于进一步表征(例如在有限稀释下),以鉴定负责细胞外效应的特定细胞。在本文所述的实施方案中,可以在同一室中其他细胞的存在下检测来自单一细胞的细胞外效应,例如在同一室中约2至300个其他细胞,例如在同一室中约2至约250个细胞,在同一室中约2至约150个细胞,在同一室中约2至约100个细胞,在同一室中约2至约50个细胞,在同一室中约2至约30个细胞,在同一腔室中约2至约20个细胞或者在同一室中约2至约10个细胞。
本文提供了设计用于进行细胞外效应分析的装置。此类分析允许检测异质细胞群中存在的单一目标效应细胞或本文所述的装置之一的分析室中的单一细胞。具体地,在室包含异质细胞群,群体中的一种或多种细胞分泌抗体(即单个反应室内的异质asc群体),其中仅一种效应细胞或效应细胞亚群细胞分泌产生期望的细胞外效应的抗体的情况下,本文所述的实施方案提供了用于定性和/或定量检测细胞外效应的装置和方法。一旦鉴定出显示效应的室,则回收来自所述室的细胞群用于下游分析,例如通过将细胞群以有限稀释分为亚群。在一实施方案中,回收显示细胞外效应的一种或多种异质细胞群,并在有限稀释下进行进一步筛选,以确定细胞外效应可归因于哪种细胞。
图1中显示了用于单细胞抗体分泌细胞(asc)/抗体选择途径的工作流程的一个实施方案。在该实施方案中,用靶标抗原免疫宿主动物,并在最终免疫加强后一周从脾脏、血液、淋巴结和/或骨髓获得细胞。然后使用建立的表面标志物(如果可以获得)或使用微流体富集,通过流式细胞术(例如facs)或磁珠纯化任选地使这些样品富集asc。然后将得到的富含asc的群体装载到包含纳升体积室的装置阵列中,其中选择达到的装载浓度为约1至约250个细胞/室,例如约2至约100个细胞/室,约10至约100个细胞/室或者约10个细胞至约50个细胞/室。在一实施方案中,装置中大于80%的室含有细胞群。如本文进一步所述,通过直接装载到装置的底部组件中的开放室中实现细胞装载,例如通过液柱产生的静水压力,通过使用诸如移液管的分配仪器产生流动或者通过更换底部组件以上的介质并且上下移动顶部组件或底部组件以引起流体向微室的转移。
根据是否以及如何进行预富集,各个室将包含多种asc、单一asc或零asc。将细胞在室中孵育以允许抗体在室体积中分泌。因为asc通常以每秒1000个抗体分子的速率分泌抗体,并且在一实施方案中本文提供的各个室的体积为约2nl至约5nl,在约3小时内提供约10nm浓度各分泌的单克隆抗体(每种独特的asc分泌独特的单克隆抗体)。在又一实施方案中,使用室中试剂的递送和更换来实施基于图像的细胞外效应分析,其利用自动显微镜检查和实时图像处理而读出。可以通过下述来更换试剂:通过液柱产生的静水压力,通过使用诸如移液管的分配仪器在微阵列阵列上方产生流动或者通过更换底部组件之上的介质并上下移动顶部组件或底部组件以引起流体向室的转移。
然后从单个室回收单一asc或包含分泌具有期望特性(例如结合、特异性、亲和力、功能)的抗体的一种或多种asc的细胞群。然后,例如经台式方法或在本文提供的另一微流体装置中对有限稀释的回收细胞群进行进一步分析(参见例如图2)。可选地,可以在单个测序反应中对来自细胞群的核酸进行测序,以确定抗体序列。在向室提供单一asc并将其回收的情况下,还可以对单一asc进行进一步分析。例如,在一实施方案中,进一步分析包括单细胞rt-pcr以扩增配对的hv和lv用于序列分析并克隆到细胞系中。
在另一实施方案中,在免疫动物并从脾脏、血液、淋巴结和/或骨髓获得细胞之后,细胞组成直接装载到装置单个室中的起始群体,即作为多个细胞群,其中个体细胞群存在于各室中。然后在单个室中进行细胞外效应分析以确定任何个体细胞群是否包含负责细胞外效应的一种或多种效应细胞。
尽管在进行细胞外效应分析之前可以用靶标抗原免疫宿主动物,但是本发明不限于此。例如,在一实施方案中,从来自宿主(包括人)的脾脏、血液、淋巴结或骨髓获得细胞,随后富集asc。可选地,不进行富集步骤,并且将细胞直接装载到本文提供的装置的室中,即作为多个细胞群,其中个体细胞群存在于各室中。
本文提供的方法允许从任何宿主物种中选择抗体。这为发现治疗性抗体提供了两个核心优点。首先,在除小鼠和大鼠以外的物种中起作用的能力允许选择针对与小鼠蛋白具有高度同源性的靶标的mab,以及针对与小鼠交叉反应的人蛋白的mab,因此可用于易于获得临床前小鼠模型。其次,小鼠免疫通常导致以对少数表位具有免疫优势为特征的反应,导致产生低多样性的抗体;因此扩展到其他物种极大地增加了识别不同表位的抗体的多样性。因此,在本文所述的实施方案中,将小鼠大鼠和兔子用于免疫,随后从这些免疫动物中选择asc。在一实施方案中,用抗原免疫兔子,并用本文提供的方法和装置选择来自免疫的兔子的asc。如本领域技术人员将会认识到的,兔子提供了亲和力成熟不同机制的优点,其使用基因转换以产生更大的抗体多样性、更大的物理尺寸(更多的抗体多样性)以及与人类更远的进化距离(更多识别表位)。
在一实施方案中,免疫策略是蛋白、细胞和/或dna免疫。例如,对于pdgfrα,使用从哺乳动物细胞系中的表达获得的细胞外结构域或购自商业来源(calixar)的细胞外结构域。在一实施方案中,对于cxcr4,使用病毒样颗粒(vlp)制剂,其为来自商业来源(integralmolecular)的具有高天然构象gpcr表达的纳米颗粒。通过在细胞系中过表达全长蛋白进行基于细胞的免疫(例如,对于小鼠/大鼠,32d-pdgfrα细胞,以及对于兔子,兔成纤维细胞系(sirc细胞));包括在最终加强时使用新细胞系以富集特异性mab的方案。多种已建立的dna免疫方案适用于本发明。dna免疫已成为复杂膜蛋白的选择方法,因为它(1)消除了对蛋白表达和纯化的需要,(2)确保抗原的天然构象,(3)降低了针对其他细胞膜抗原的非特异性免疫应答的可能性,以及(4)已被证明对激发靶标是有效的(bates等人.(2006).biotechniques40,pp.199-208;chambers和johnston(2003).nat.biotechnol.21,pp.1088-1092;nagata等人.(2003).j.immunol.methods280,pp.59-72;chowdhury等人.(2001).j.immunolmethods249,pp.147-154;surman等人.(1998).j.immunol.methods214,pp.51-62;leinonen等人.(2004).j.immunol.methods289,pp.157-167;takatasuka等人.(2011).j.pharmacol.andtoxicol.methods63,pp.250-257,出于所有目的将其各自通过引用整体并入)。根据动物护理要求和建立的方案进行免疫。
先前已在大鼠、小鼠和兔子中产生抗pdgfrα抗体,并且pdgfrα的细胞外结构域比较显示出几个显著变异的位点(图3)。因此,预期可从该抗原获得良好的免疫应答。先前还使用脂质颗粒和dna免疫这两者产生了抗cxcr4mab,因此该靶标也可能产生良好的免疫应答。在一实施方案中,将使用共表达的groe1或gm-csf(共表达或作为融合体)作为分子佐剂。可选地,使用takatsuka等人.(2011).j.pharmacol.andtoxicol.methods63,pp.250-257;和/或fujimoto等人.(2012)j.immunol.methods375,pp.243-251(出于所有目的将其通过引用整体并入)中公开的佐剂和免疫方案。
本发明部分涉及装置结构,其设计用于高度可再现地和有效的细胞装载过程以对单一效应细胞如asc进行分析。本文提供的装置结构:(i)能够容易且有效地向分析室装载细胞或颗粒,(ii)能够固定细胞和/或颗粒,同时保留更换介质组分的能力,(iii)与高分辨率显微镜检查兼容,(iv)提供来自可溶性荧光试剂的降低的背景荧光信号,(v)提供高密度分析形式,(vi)促进所选细胞或颗粒从任何给定室中的回收,以及(vii)可与筛选仪器集成。
本文提供的装置设计为每次使用容纳数万至数百万个细胞。每次装置运行每个室分离的效应细胞的数目是装载到装置上的细胞悬液中细胞浓度、细胞悬液中特定效应细胞被选择的频率以及装置上室的总数的函数。可以制造并使用具有高至并超过1,000,000个细胞外效应分析室的装置。
本文提供的装置是微流体的,因为其各自包括包含小于1mm的最小尺寸的特征(例如分析室和/或流体通道)。然而,在本文提供的实施方案中,装置之一的特征的最小尺寸<500μm,<100μm或<30μm。
本文提供的微流体装置各自包括多个分析室。分析室可以存在于双组件微流体装置的单个组件中,或存在于单一组件装置中。当装置的多个组件彼此分离时和/或当采用单一组件微流体装置时,分析室对环境开放,即可以例如经移液或倾倒从上方直接接近室,因此在本文被称为“开放室”。应当理解,尽管室最初是开放的,但是一旦在所述室的顶部在其上放置第二“顶部”组件,则室可以被认为是封闭的。
在一实施方案中,本文提供的装置的分析室的平均最小横向尺寸为约50μm至约300μm,约50μm至约250μm,约50μm至约200μm,约50μm至约150μm,约50μm至约100μm。在另一实施方案中,装置的分析室的平均最小横向尺寸为约50μm,约75μm,约100μm,约125μm、150μm或约200μm。
在一实施方案中,本文提供的装置的分析室的平均高度(深度)为约50μm至约300μm,约50μm至约250μm,约50μm至约200μm,约50μm至约150μm,约50μm至约100μm。在另一实施方案中,装置的分析室的平均高度/深度为约50μm,约75μm,约100μm,约125μm、150μm或约200μm。
在一实施方案中,装置的分析室的平均体积为约100pl至约100nl或约100pl至约10nl或约100pl至约1nl。在一实施方案中,装置的分析室的平均体积为约100pl,约200pl,约300pl,约400pl,约500pl,约600pl,约700pl,约800pl,约900pl或约1nl。在另一实施方案中,分析室的体积为约2nl,约1nl至约5nl,约1nl至约4nl或约1nl至约3nl。在另一实施方案中,装置的分析室的平均体积为约10pl至约10nl,约10pl至约1nl,约10pl至约100pl,约500pl至约5nl,约50pl至约5nl,约1nl至约5nl或约1nl至约10nl。在另一实施方案中,装置中的分析室的平均体积为约150pl,约250pl,约350pl,约450pl,约550pl,约650pl,约750pl,约1nl,约5nl或约10nl。
在一实施方案中,本文提供的装置利用基于重力的细胞和/或颗粒固定。基于重力的固定允许非粘附细胞类型的灌注,以及通常在含有效应细胞和/或读出颗粒的室内、通过所述室或在所述室上方缓冲液和试剂的更换,例如在室底板上方。在一个装置实施方案中,每个室具有进入通道通过顶部上方的立体几何形状。如本文所述,可在装置的顶部组件中形成进入室并与包括开放分析室的底部组件对齐。可选地,可以通过装置底部组件中的微制造沟槽形成进入通道,其与开放室结构相连。
在一实施方案中,在装置室装载期间,将颗粒(例如细胞或珠)直接引入位于双组件装置底部组件中的开放室上方,并落到室的底部。在单一组件装置的实施方案中,单一组件是包括开放室的组件,因此是装载有颗粒的组件。在采用多组件装置的实施方案中,可以通过在装置顶部组件和底部组件的界面处形成的进入通道引入细胞。在这种情况下,在装载期间细胞遵循流线并通过室,但是当流动停止时,细胞落到室的底部。由于层流特征,室底部附近的流速可忽略不计。当通过使溶液流过通道来灌注组合装置时,这是事实。当轻轻移液或抽吸液体时,例如当在室上方提供流体贮存器时,在底部组件中的开放室上方更换液体时,这在室内也是事实。这种流体结构允许室阵列的灌注,以及经组合的对流/扩散更换试剂,而不会干扰室中非粘附细胞(或读出颗粒,如读出珠)的位置。
在一实施方案中,包括分析室的组件包括允许介质贮存器直接位于室上方的结构。在一实施方案中,提供介质贮存器,以阻断蒸发,向室提供营养物或其他分子,确保细胞活力和/或为细胞提供生长介质。可以在整个室阵列或其一部分上提供贮存器结构。在另一实施方案中,在室阵列的不同部分提供多个贮存器结构,以允许将不同介质(例如细胞生长介质或分子试剂)递送至阵列的不同部分。在一实施方案中,可将贮存器结构制造为允许在室上方提供约1ml至约20ml,约2ml至约20ml,约3ml至约20ml或约4ml至约20ml介质。在另一实施方案中,可将贮存器结构制造为允许在室上方提供约1ml至约15ml或约2ml至约15ml或约2ml至约15ml或约3ml至约15ml介质。在单一装置上使用多个贮存器结构的情况下,可将此类结构制造为允许每个单个贮存器的贮存器体积为约100μl至约2ml。在一个实施方案中,在提供贮存器结构的情况下,通过从贮存器抽吸然后在阵列上方向贮存器提供新的介质来进行介质更换。
设计本文提供的装置结构,以便当向室添加其它组分(例如辅助颗粒或细胞信号转导配体)或者当引入灌注或洗涤液/介质时,效应细胞的可溶性分泌产物(或分泌产物的一部分)不会从室中洗掉。此外,本文提供的装置允许向室添加组分,而不在装置各室之间引入分泌产物(例如抗体)的显著交叉污染。通过制造纵横比(即高度/深度比最小横向尺寸)≥约0.6或≥约1的室来部分实现此类室的彼此隔离。因此,本文提供的装置各自包括多个室,以便多个室中单个室各自的深度大于或等于室最小横向尺寸的约60%。在又一实施方案中,单个室的纵横比(即高度/深度比最小横向尺寸)≥约1.1,≥约1.5,≥约2,≥约2.1≥约2.5,≥约3,≥约4或≥约5。在另一实施方案中,装置中室的平均纵横比≥约0.6,≥约0.7,≥约0.8,≥约0.9,≥约1,≥约1.1,≥约1.5,≥约2,≥约2.1,≥约2.5,≥约3,≥约4或≥约5。在另一实施方案中,装置中室的平均纵横比≥0.6但≤15,≥0.8但≤10,≥1但≤10,≥1.1但≤10,≥1.2但≤10,≥1但≤5或≥1.5但≤10。
经软光刻制造本文提供的装置或其部分。在一些实施方案中,装置包括分开的顶部和底部组件,并且组件中的至少一件经软光刻制造。装置是透明的或基本透明的以便于分析室的成像。在一些实施方案中,装置的顶部和底部组件是弹性的,例如顶部和底部组件或单一组件由聚二甲基硅氧烷(pdms)制造。
本文提供的装置包括包含分析室阵列的组件。在一实施方案中,由光致抗蚀剂限定室尺寸,然后经软光刻方法由诸如pdms的聚合物材料浇铸室。软光刻方法和光刻中阳性和阴性光致抗蚀剂的使用是本领域普通技术人员已知的,参见例如xia和whitesides(1998).agnew.chem.int.ed.engl.37(5),pp.551-575,出于所有目的将其内容通过引用整体并入。预期室横截面不限于任何具体形状,并且室可以经软光刻制造,其具有圆形、椭圆形、矩形、三角形或其他形状的横截面。
在一些实施方案中,使用压印方法,其中将诸如pdms的液态弹性体倾倒在微制造基底上(如用厚光致抗蚀剂图案化的硅晶片),然后将倾倒的pdms脱气,在微制造基底顶部放置玻璃基底,向下压以挤出过量聚合物材料,加热以使pdms聚合,然后分离以在玻璃基底上留下薄的模塑pdms层。在一实施方案中,模塑室底部与玻璃基底之间的pdms层的厚度小于约5至50μm。在一实施方案中,模塑室下方材料的总厚度主要由玻璃基底的厚度确定,并且其可以小于约100μm、200μm、400μm或1mm。直接在薄透明基底上模塑的具有高纵横比(例如≥约0.6或≥约1或约1至约10)的室的阵列的装置允许穿过玻璃基底底部进行高分辨率成像。也可以通过本领域已知的其他微制造方法生产包括具有本文提供的纵横比的室的阵列的装置,包括热压印(hotembossing)、注射成型、反应离子蚀刻或其他各向异性蚀刻方法。
在一些实施方案中,本文提供的装置包括具有多层的“顶部组件”,例如以限定包括密封通道的阀的微流体通道。在又一实施方案中,装置的“底部组件”包括开放室,如以上所提供的,可以经软光刻制造开放室。当将顶部组件引入底部组件上方时,可以立即密封或基本密封开放室(具有连接相邻室的小通道或开口),其中每个组件的面接触。
可以经多层软光刻(msl)制造包括多层的装置的顶部组件(unger等人(2000).science7,pp.113-116,将其通过引用整体并入)。此外,在“顶部组件”和“底部组件”均由弹性材料制造(例如经软光刻),并且组合在一起以形成不可逆的密封的情况下,装置的多个组件可以表征为由msl制造。
在所有微流控技术中,msl的独特之处在于其具有数千个集成微阀的装置的快速且廉价的原型设计(thorsen等人(2002).science298,pp.58-584)。这些阀可用于构建更高水平的流体组件,包括混合器、蠕动泵(unger等人(2000).science7,pp.113-116)和流体多路复用结构(thorsen等人.(2002).science298,pp.58-584;hansen和quake(2003).curr.opin.struc.biol.13,pp.538-544),因此能够进行高水平的集成和芯片上液体处理(hansen等人.(2004).proc.natl.acad.sci.u.s.a.101,pp.14431-1436;maerkl和quake(2007).science315,pp.233-237)。出于所有目的,将本段中各前述参考文献的公开内容通过引用整体并入本文。
msl制造工艺利用建立的光刻技术的优点和微电子制造技术的进步。msl的第一步是使用计算机绘图软件绘制流动和控制通道的设计,然后将其打印在高分辨率遮板上。将覆盖光致抗蚀剂的硅(si)晶片暴露于紫外光,紫外光通过遮板在某些区域中被滤出。根据光致抗蚀剂是阴性还是阳性,暴露区域(阴性)或非暴露区域(阳性)交联,并且抗蚀剂将聚合。未聚合的抗蚀剂可溶于显影液中,随后被洗掉。通过将不同的光致抗蚀剂组合并以不同的速度旋涂,硅晶片被图案化为具有多种不同的形状和高度,这限定了多个通道和室。然后将晶片用作模具以将图案转移至聚二甲基硅氧烷(pdms)。在一实施方案中,在用pdms模塑之前和在限定光致抗蚀剂层之后,使模具涂覆聚对二甲苯(化学气相沉积的聚(对二甲苯)聚合物屏障)以减少模塑期间pdms的粘附,增强模具耐久性并使得能够复制小的特征。
在msl中,将在彼此顶部堆叠来自不同模具的不同pdms遮板层用于在重叠层中产生通道。通过以互补的化学计量比混合封装预聚物组分与硬化剂组分而将两层(或更多层)结合在一起以实现硫化。
在一实施方案中,使用驱动施加到顶部组件通道中的流体的压力的芯片外计算机可编程螺线管来控制装置中的流体流动,例如以引导试剂流经底部组件中的室。
如本领域技术人员将会理解的,可以通过旋涂速度和选择使用的光致抗蚀剂来部分控制光致抗蚀剂层的厚度。在一实施方案中,大部分分析室由直接位于si晶片上的su-810特征限定。如本领域技术人员已知的,su-8是常用的基于环氧树脂的阴性光致抗蚀剂。可选地,可以使用本领域技术人员已知的其他光致抗蚀剂来限定具有以上所述高度的分析室。在一些实施方案中,如通过su-8特征所限定的,分析室的高度和宽度分别为50-500μm和50-500μm。
软光刻和msl制造技术允许制造宽范围的装置密度和室体积。在一实施方案中,对于本文提供的装置,在单个装置中,即在装置的底部组件中,提供约2000至约1,000,000个分析室,例如约1000至约200,000个分析室。在一实施方案中,效应细胞分析室的平均体积为约0.5nl至约4nl,例如约1nl至约3nl或约2nl至约4nl。
本文提供的装置允许细胞的长期培养和维持(例如约12小时至约2周或约12小时至约10天或约12小时至5天或约12小时至2天或持续约一天),无论是效应种类、辅助种类还是读出种类。在一实施方案中,底部组件中的室阵列可以覆盖有细胞生长介质贮存器。在另一实施方案中,顶部组件包括厚膜(例如约150μm至约500μm厚,约200μm厚,约300μm厚,约400μm厚或约500μm厚)pdms弹性体。将膜置于室上方,并且在一实施方案中,将介质贮存器(例如1ml介质)覆盖在膜上。先前已经描述了类似的形式(lecault等人(2011).naturemethods8,pp.581-586,出于所有目的将其通过引用整体并入本文)。介质贮存器(渗透浴)与室的接近度有效地阻断了蒸发(通过透气性pdms材料)并确保稳健的细胞活力,并且在细胞未完全分化的情况下生长持续数天,以及有利于实现nl体积中的长期培养,其生长速率和细胞应答与μl体积形式相同。
在一些实施方案中,双组件装置的装配在底部组件中产生多排分析室,其通过经过室顶部的流体通道(顶部组件)连接。室设计成具有足够高的纵横比,当在室上方提供流体时,室底部流动特征的速度大大减弱或受到阻碍。在装载细胞群或珠群期间,将细胞或珠的悬液直接装载到特征为具有开放室阵列的装置的底部组件(或单一组件)中。这可以通过例如经移液将一定体积具有已知数目的细胞的细胞悬液递送到底部组件的开放室阵列顶部来实现。一旦将足够数目的细胞/珠引入阵列,则比周围液体更密集的细胞/珠落到室的底部。一旦位于室的底部,则细胞与与流动有效隔离,因为室底部的流速可以忽略不计。在多个实施方案中,本文提供的装置包括主动微阀,其允许顶部组件中连接底部组件中的室的通道闭合,从而隔离各室。此类阀结构还可用于以受控和自动化的方式将试剂递送到阵列的特定区域。当流动再次通过室顶部时,其在室底部充分减弱,以使细胞/珠不移动。然而,室顶部和室底部之间的短长度尺度使得扩散可以快速在阵列的室内更换介质内容物。以这种方式,该装置允许固定悬浮细胞类型和珠,同时保留进行更新或更换介质内容物所需的洗涤步骤的能力。该装置实施方案和装置几何结构的另一性质是将室制造成室的底部紧邻玻璃基底并允许使用倒置显微镜配置或其他仪器进行高质量成像。
在一实施方案中,实现了室与其周围环境的隔离,而没有将室物理密封隔离其周围环境。相反,在一实施方案中,通过限制室之间的流体连通来实现隔离,以防止一个室和相邻室之间的显著污染。例如,代替使用一个或多个阀,将相邻室制造为具有一定的纵横比以限制室之间的扩散和/或使用不混溶的流体相(如油)进行分离以阻塞室入口和/或出口。例如,将室设计为分子进出室的扩散足够慢,使得它不会明显阻碍室内分泌产物(例如抗体)的分析。例如,在不希望受理论束缚的情况下,如果将室设计为分子必须扩散以从一个室的底部移动到另一个室的底部的总最小距离是室最小横向尺寸的2倍以上,然后原始室中与读出颗粒相互作用的分泌分子的比例与相邻室中与读出颗粒相互作用的分泌分子的比例之比大于10,条件是与读出颗粒的相互作用引起分泌分子与读出颗粒结合。如果室的纵横比(定义为高度比最小横向尺寸)≥0.6,例如≥1,≥0.6但≤10,≥1但≤10,≥1.25但≤5,则满足此条件。值得注意的是,该纵横比也足以允许更换室中的试剂,同时保留室中的细胞。
本文提供的装置实施方案通过将试剂和细胞直接装载到开放室内或开放室外而极大地促进了细胞和试剂处理,以及细胞从各阵列中的室的回收。
在一实施方案中,提供“分离”微流体装置用于进行本文所述的一种或多种细胞外效应分析。分离装置包括两个组件:顶部组件和底部组件。底部组件包括细胞外效应分析室。如本文所述,顶部组件也可以是多层的以及通过msl制造的。在另一实施方案中,顶部组件是单层。图4描述了分离装置的一个实施方案。图4显示了包括顶部组件401和底部组件402的双组件装置400。底部组件包括开放室403。顶部组件包括下推阀结构404和开放通道405。
因为在本文所述的细胞外效应分析中实施洗涤和灌注步骤可以在相对低的压力下进行,并且通常不会受到相邻室之间的一些泄漏的不利影响,因此该分离装置结构可以用于进行本文所述的方法。此外,室之间的扩散路径的存在不会导致室之间的显著污染,只要与含有分泌细胞的室中分泌细胞与读出颗粒之间的扩散路径相比,扩散路径的总距离足够长,或者限制扩散路径以限制相邻室之间的扩散式质量传递,或者这两者。因此,相邻室不需要紧密密封。同样地,提供包括两个单独组件的装置用于进行本文所述的一种或多种细胞外效应分析:(i)底部组件,其包括高纵横比室的开放阵列;和(ii)顶部流体组件,其包括设计为与底部组件的室阵列对齐的底层上的开放微通道,以及可用于控制通过这些微通道的流动的集成微阀,但不需要将室密封隔离周围环境(图4)。顶部组件中的此类多层例如经以上所述的msl制造。将顶部组件对齐并压至底部组件,以使微阀定位在室之间,从而当驱动时,将各室彼此密封。还预期可以通过装置的底部组件限定通道结构,并且顶部组件可以用于通过偏转阻碍沿通道向下流动的膜而限定在这些通道上操作的阀。
与非分离装置即经msl制造的装置相比,这种分离微流体装置极大地促进了细胞装载,所述非分离装置包括完全密封的层和需要经微通道寻址的室。首先通过添加细胞悬液和/或颗粒来装载底部组件的开放室阵列。一旦细胞/颗粒沉降到分离装置的室中,则将装置的顶部组件置于阵列上方以执行筛选所需的流体处理和成像步骤。一旦分析完成,可再次移动装置的顶部组件以暴露底部组件中的阵列并从所选室中回收细胞或读出颗粒或两者。除了简化装载过程之外,该策略还简化了装置的制造,因为不需要在薄pdms膜内制造装置。值得注意的是,使用纵横比≥0.6,例如≥0.7,≥1的室对于这种方法是至关重要的,因为它保留了在不将细胞从室中清洗出来的情况下更换溶液的能力,以及因为它允许移除顶部基底但不在室内产生会导致细胞丢失的流动。在一实施方案中,包括开放室的装置的底部组分的纵横比≥0.6,例如≥0.7,≥1但小于约10。
在另一实施方案中,提供“分离”双组件微流体装置用于进行本文所述的一种或多种细胞外效应分析。分离装置包括两个组件:顶部组件和底部组件。顶部组件包括单层并且底部组件包括单层。可以如本文所述经软光刻制造各层。还应注意,尽管“双组件”装置包括两个组件,但这些组件不同于通过msl制造的单组件装置中存在的多“层”。本文所述的双组件装置经可逆结合形成,并且可以在单独的分析步骤后分离,而通过msl制造的装置的层在装置未失败的情况下不能分离。
图5(上图和下图)描绘了分离装置多个实施方案500和500’的横截面示意图。在这些实施方案中,与具有多层顶部的分离装置不同,装置500的顶部组件不包括集成阀,而是由包括通道结构或流动池结构504的单层501组成(图5)。虽然该装置版本不包括主动阀,但它可以与外围控制流控技术联合使用以控制室阵列中试剂的流动和更换。在另一实施方案中,顶部组件具有无特征表面并且用于形成底部组件中限定的通道。
可以在顶部组件501和501’中使用多种流动结构,例如单一宽流动池504(图5,上图)、具有“隔离”间隔物504’的集合的流动池(图5,下图)、通道阵列等。还注意到,因为在装配整个装置之前进行向底部组件502和502’的室503和503’的细胞装载,因此顶部或底部组件中的流动结构可以比传统微流体装置(例如通过msl制造的微流体装置)中的更窄。例如,流动结构可以具有约2μm或5μm、10μm或20μm的最小尺寸。
虽然这种几何结构不包括将分析室彼此密封的微阀,但是使用将一个或多个室与溶液可以流过的入口和出口相连的小通道足以减缓相邻室之间的扩散,从而将交叉污染降低到不妨碍分析性能的水平。还应注意,除了将室之间的扩散运输最小化之外,使用具有小横截面的通道(如本文所述的通道)导致高流体阻抗,其抑制孵育期间室之间任何非期望的对流。此外,可将顶部组件设计成将用于将装置顶部和底部组件组合在一起的压力用于调节连接室的流动路径的横截面,甚至用于密封室。例如,顶部组件可以制造有可以通过增加压力而倒塌的顺应式“隔离”结构504’,从而允许在不需要两个组件之间的可偏转的膜结构的情况下密封阵列(图5,下图)。应当注意,虽然图5描绘了每隔一个室之间的“隔离结构”,但是可以在每个室之间,每隔三个室之间等采用该结构。除了便于装载并保留wo2014/153651(将其公开内容通过引用整体并入本文)中所述的装置的关键功能之外,该实施方案还极大地简化了装置制造,并且通过含有一系列用于控制向阵列的递送的宏观阀和流控技术容易地适用于仪器中的自动化。
在另一实施方案中,分离装置包括(i)底部基底组件,其包括≥0.6,例如≥0.7,≥1但≤约10,≥1但≤约5的高纵横比室的开放阵列;和(ii)顶部组件,其设计成允许通过顶部组件相对于底部组件的平移可逆地密封底部组件阵列中的室。图6提供了诸如包括顶部组件601和包括微室603的底部组件602的装置600的横截面示意图。在该实施方案中,装置600的顶部组件601制造有微通道的导管604(图6),当装置的底部组件和室603对齐时,它提供用于向阵列的室603递送溶液的流体路径。在流体/试剂递送之后,可相对于底部组件平移顶部组件(图6,下图)。在这样做时,通道604与室脱离接触,并且室603被顶部组件的表面密封(图6,下图)。顶层的平移移动提供了完全密封底部组件中的室的方法。其他分离组件装置中存在的细胞和试剂处理以及细胞回收的优点对于该装置同样存在。
又一分离组件装置实施方案包括装置700,其包括顶部组件701和底部组件702,其横截面图在图7中提供。如图7所示,顶部组件701包括未图案化的顶部。具体地,分离组件装置包括(i)底部组件,其包括开放的室阵列703,每个室的纵横比≥0.6,例如≥0.7或≥1但≤约10,≥1但≤约5;和(ii)顶部组件,其基本上是平的且未图案化。底部组件包括室阵列的室之间的一个或多个凸起部分(间隔物)704。在一实施方案中,如本领域普通技术人员所知的,经使用多种光致抗蚀剂的软光刻和光刻制造凸起部分。当将两个组件组合在一起时,一个或多个凸起部分限定顶部组件和底部组件之间的间隔。
在该实施方案中,与本文所述的其他分离装置相比,经过室的流动受到较少控制,但仍可通过通常在阵列上施加压力来实现,例如通过液柱产生的静水压力或通过使用诸如移液管的分配仪器产生流动或者通过更换第二组件上方的介质,然后上下短暂地移动第二组件以引起流体转移到阵列。可使顶部组件与室阵列的表面直接接触,以在孵育期间密封一个或多个室。
在一实施方案中,提供了开放室微流体阵列,其包括多个室用于进行本文所述的一种或多种细胞外效应分析。在该实施方案中,当进行一种或多种细胞外效应分析时,在无顶部组件的情况下使用阵列。然而,任选地使用顶部组件,例如由pdms制造的顶部装置组件,并在成像期间仅覆盖室阵列的一部分(读出细胞外效应分析)。图8提供了此类装置800的横截面示意图。与分离装置一样,阵列室被制造为具有一定的深度以确保细胞/颗粒不受流动干扰(即室803的纵横比≥约0.6,例如≥0.7,≥1但≤约10,≥1但≤约5),而且也使得从一个室的底部到另一个室的扩散路径足够长以便与相邻室相比,对于限定的实验条件(例如孵育时间、珠数目、珠尺寸、室间隔等),各自细胞所位于的室中颗粒捕获细胞分泌产物(例如抗体)的相对效率大于5。
捕获的相对效率=re=含有细胞的室中捕获的来自含有细胞的室的#细胞分泌产物/相邻室中捕获的来自含有细胞的室的#细胞分泌产物。
在该实施方案中,如果使用未图案化的顶部组件801,则消除源自在成像期间存在于室阵列顶部上方的大量可溶性荧光分子804的背景荧光信号。未图案化的顶部801的尺寸限定了其能够置换的介质的体积,例如覆盖室阵列或其一部分的贮存器中的介质。
作为实例,考虑室内抗体被位于同一室中的抗体捕获珠捕获的情况。一旦捕获,则抗体暴露于可溶性荧光抗原,所述抗原可以添加到阵列顶部的溶液中或者通过首先移除覆盖阵列的部分或基本上所有溶液然后应用含有可溶性荧光抗原的溶液来添加。如果抗体与荧光抗原结合,则结合在珠上的抗体将累积荧光信号。然而,珠上也会有大量的荧光抗原,并且这将产生会模糊特定荧光信号的背景荧光。如果在成像之前移除荧光分子,将导致本体溶液中的低抗原浓度,引起珠上结合的抗体的量以取决于抗体-抗原相互作用的解离速率的速度下降。即使对于相当强的相互作用(~1nm),这可能导致在比阵列的成像时间短的时间帧内(例如约10分钟)信号的显著降低。然而,在图像采集步骤期间,通过使用顶部组件801从阵列附近置换荧光溶液,可以在不洗涤阵列的情况下消除该背景荧光。该顶部组件可以例如固定到成像系统并定位在图像采集区域,同时在捕获整个阵列的图像期间将装置平移。
在一些实施方案中,通过涂覆室的一个或多个壁(例如经表面功能化)使效应细胞和读出颗粒在室内分布。在一实施方案中,通过下述进行表面功能化:接枝、共价连接、吸附或以其它方式使一种或多种分子附着于室表面,或者修饰室表面以便改变细胞或颗粒向室表面的粘附。本文使用的此类功能化的非排他性实例是蛋白的非特异性吸附、蛋白的化学偶联、聚合物的非特异性吸附、聚合物的静电吸附、小分子的化学偶联、核酸的化学偶联、表面的氧化等。之前已经描述了pdms表面功能化,并且这些方法可以在本文中用于使本文提供的装置表面功能化(参见,例如zhou等人(2010).electrophoresis31,pp.2-16,出于所有目的将其通过引用并入本文)。在一实施方案中,本文所述的表面功能化选择性结合一种类型的效应细胞(例如,存在于细胞群中的效应细胞)或选择性结合一种类型的读出颗粒。在另一实施方案中,表面功能化用于隔离室中存在的所有读出颗粒。
在另一实施方案中,可以具有表面功能化或多种不同的表面功能化的表面涂层在装置的室内被空间上限定。可选地,表面功能化覆盖整个室表面。两个实施方案都可用于将效应细胞和读出颗粒分配进分析室内的不同位置。例如,在用结合所有类型的引入的读出颗粒的分子将整个室功能化的实施方案中,颗粒固定在功能化的(涂覆的)表面上。在另一实施方案中,整个室被功能化以仅结合一种特定类型的读出颗粒,其中引入多种读出颗粒种类。在该实施方案中,首先使用本文所述的方法之一将所有颗粒引导至一个区域,使得颗粒子集粘附到功能化区域中的室表面,随后向仅置换不与功能化表面结合的颗粒的不同区域施加力。在另一实施方案中,用不同的分子将装置的区域(例如不同室或单个室内的区域)功能化,所述不同的分子选择性结合效应细胞和/或读出颗粒的不同子集,以便诱导效应细胞和/或读出颗粒与基本上整个室表面的相互作用,导致不同区域中不同颗粒或细胞类型的分区。如本文所述,预期表面功能化可以单独用于或与本文所述的其他方法组合用于效应细胞和读出颗粒的操作。颗粒和细胞隔离方法的多种组合以及多种流体几何结构是可能的。
在另一实施方案中,使用磁场将效应细胞和/或读出颗粒定位在室内。应当理解,为了磁性地操纵和定位效应细胞和/或读出细胞,首先将效应细胞和/或读出细胞用与之结合的磁性颗粒功能化或暴露于与之结合的磁性颗粒。在一实施方案中,磁场是外部产生的,即通过使用永磁体、电磁体、螺线管线圈或其他手段在微流体装置外使用磁体来外部产生。在另一实施方案中(参考图9),磁场由集成到装置中或与装置分离的磁结构90局部产生。在一实施方案中,在不同时间施加磁场,并且在一实施方案中,将磁场与粒子装载一起施加,以影响响应磁场的效应细胞和/或读出颗粒的定位。用于分离和/或纯化生物样品的市售珠或纳米颗粒可用于本文提供的装置和方法。例如,“dynabeads”(lifetechnologies)是超顺磁性单一化且球形的聚合物颗粒,并且在一实施方案中,其用作读出颗粒。与特异性结合不同靶标表位或细胞类型的分子缀合的磁性颗粒在本领域众所周知,并且其还适合与本文提供的装置和方法一起使用。当存在具有不均匀特性的磁场时,此类磁性颗粒受到朝向磁场梯度的力。在一实施方案中,该梯度力被应用于定位室内的颗粒。
一旦室装载有细胞群和读出颗粒或读出颗粒群,以及任选地用于对细胞群进行分析的其它试剂,在一实施方案中,室与微流体装置剩余室中的一个或多个流体隔离。
如本文所提供的,在一个方面,本发明涉及鉴定包含显示细胞外效应的效应细胞的细胞群的方法。一旦确定细胞群显示细胞外效应,则回收细胞群或其部分以获得回收细胞群。在一实施方案中,回收包括用微毛细管或微移液管进入本文装置之一的室,并抽吸室内容物或其一部分以获得回收细胞群。因为本文提供的装置采用底部组件中的室,其可与顶部组件可逆地密封,一旦鉴定出含有目标细胞的室,则通过隔离两个组件并直接进入室经抽吸或移液容易地回收其内容。
在一实施方案中,对回收细胞群进行进一步分析,例如从负责细胞外效应的回收细胞群鉴定单一效应细胞或效应细胞亚群。可以在有限稀释下分析回收细胞群,作为针对第二种细胞外效应的亚群,第二种细胞外效应可以与第一种细胞外效应相同或不同。然后可以回收显示第二种细胞外效应的细胞亚群用于进一步分析,例如用于在本发明的装置上的第三细胞外效应或者通过台式方法,例如rt-pcr和/或下一代测序。可选地,将来自细胞群的核酸进行测序,例如以确定群体的抗体序列。然后可以将抗体克隆并表达用于进一步测试。
在一实施方案中,从一个或多个分析室回收一种或多种细胞包括磁性分离/回收。例如,在一实施方案中,将分析室暴露于粘附在室内的一种或多种细胞上的磁性颗粒(或多种磁性颗粒)。粘附可以针对孔内的单一细胞或细胞群的亚群具有选择性,或非选择性的,即磁体可以粘附于所有细胞。在这种情况下,用磁性颗粒标记的细胞被吸引到产生磁场梯度的磁性探针。在一实施方案中,探针被设计成能够打开和关闭磁场,引起细胞粘附于其上以便移除,然后在沉积期间被释放。(easysep选择试剂盒,stemcelltechnologies)。
在一实施方案中,将从室中收获的单一细胞或多种细胞沉积到一个或多个容器中用于进一步分析,例如开放的微孔、微滴、管、培养皿(culturedish)、培养板、皮氏培养皿(petridish)、酶联免疫吸附斑点(elispot)板、第二微流体装置、相同的微流体装置(在不同区域中)等。容器的选择由本领域技术人员确定,并且其基于下游分析和/或储存的性质。
在一些实施方案中,可选地或者除了从鉴定的室回收单一细胞或多种细胞之外,从目标分析室回收细胞衍生产物或胞内物质。例如,在一实施方案中,如果分析室被鉴定为含有显示细胞外效应变化的细胞,则回收来自室的分泌产物用于下游分析(例如序列分析)。在另一实施方案中,在微流体装置上(例如在进行第一分析的室内)裂解细胞或多种细胞,并回收裂解物,例如用于进一步分析,如核酸测序。
在另一实施方案中,使用裂解试剂裂解所有室或室的子集中的细胞,然后回收给定室或室的子集的内容物。在另一实施方案中,在捕获由细胞释放的rna的珠的存在下裂解目标室内的细胞,随后回收珠。在这种情况下,也可以在回收之前或之后使用逆转录酶将rna转化为cdna。
在从目标室回收细胞或细胞衍生物质之后,分析这些物质或细胞以鉴定或表征分离物或单一细胞或多种细胞。可以经本文提供的装置之一(参见例如图2),先前描述的装置之一(例如在wo2014/153651中描述的)或者经常规台式方法进行进一步的分析。因此,本发明允许多轮微流体分析,例如以从显示第二种细胞外效应、第三种细胞外效应和/或第四种细胞外效应的回收细胞群鉴定细胞亚群。通过对回收细胞群重复细胞外效应分析,该方法的使用者获得高度富集的具有目标功能性质或多种目标功能性质的细胞群。可选地,不进行第二细胞外效应分析,以及回收显示细胞外效应的细胞群并进行核酸测序,例如以确定群体中抗体的序列。
在一实施方案中,回收表现出细胞外效应(例如与另一群体或对照值相比,细胞外效应的变化)的一种或多个细胞群,以获得一种或多种回收细胞群。进一步分析一种或多种个体细胞群以确定负责观察到的细胞外效应的细胞,例如在作为细胞亚群的有限稀释下。在一实施方案中,该方法包括在如本文所述的微流体装置的分开的室中保留源自一种或多种回收细胞群的多种细胞亚群。每个分开的室包括包含一种或多种读出颗粒的读出颗粒群。将个体细胞亚群与读出颗粒群孵育。分析个体细胞亚群的第二种细胞外效应,其中读出颗粒群或其亚群提供第二种细胞外效应的读出。第二种细胞外效应可以是与回收细胞群上测量的细胞外效应相同的细胞外效应或不同的细胞外效应。基于第二细胞外效应分析,鉴定表现出第二种细胞外效应(例如与另一群体或对照值相比,第二种细胞外效应的变化)的一种或多种个体细胞亚群。在一实施方案中,然后回收的一种或多种个体细胞亚群用于进一步分析,例如核酸测序。
术语“细胞亚亚群(cellsub-subpopulation)”意为细胞亚群的亚群。在一实施方案中,在多个容器中保留来自回收亚群或多种细胞亚群的细胞作为细胞亚亚群。本领域技术人员将会认识到细胞亚群可以分为进一步的亚群,并且术语“亚亚群”的使用不是进行这种区分所必需的。相反,本文提供的方法允许在有限稀释下进一步分析回收的细胞群。每种细胞亚群存在于单个容器中。裂解个体亚群或亚亚群,并扩增各裂解细胞亚群或裂解细胞亚亚群内的一种或多种核酸。在又一实施方案中,一种或多种核酸包括抗体基因。
可将数种方法(包括用本文提供的装置之一进行分析)用于该下游分析,这取决于细胞的性质、原始筛选中细胞的数目和分析意图。在一实施方案中,在从室回收效应细胞群或从多个室回收多种群体的情况下,将多种细胞中的各细胞分离进单个容器(例如单个分析室),并单独对各效应细胞进行分析。可选地,可以将多个室的内容物合并进单个室或容器中用于下游分析(如核酸测序),例如以确定群体中的抗体序列。如有必要,可将生物信息学用于配对重链和轻链。
在另一实施方案中,在从室回收效应细胞群或从多个室回收多种群体的情况下,将细胞群重新引入同一微流体装置上的单独区域中或重新引入第二装置中,并且细胞在有限稀释下在室中分离(即作为细胞亚群),例如以每室约一个细胞或者每室约2至约10个细胞的密度分离细胞,并进行第二细胞外效应分析。可对任何大小的细胞亚群进行下游分析,例如与初始细胞外效应细胞分析相同的大小,例如当将来自多个室的细胞合并时,或者更小的群体大小,例如单个细胞、两个细胞、约2个细胞至约20个细胞、约2个细胞到约25个细胞。将读出颗粒引入包含细胞亚群的室中,并进行第二细胞外效应分析。回收包含显示细胞外效应(例如与另一细胞群或对照值相比,细胞外效应的变化)的细胞亚群的室内容物用于进一步分析。可使用本文提供的装置之一(例如通过进行第三细胞外效应分析,单细胞pcr)、台式分析(例如pcr、下一代测序)或其组合进行该进一步分析。
在一实施方案中,通过将多种细胞以有限稀释度分配到多个细胞培养容器中而在介质中扩增个体回收效应细胞,以从回收的细胞中获得克隆。例如,在工程化为表达抗体文库的多种效应细胞细胞系存在于目标室中的实施方案中,来自室的细胞经受有限稀释以分离存在于室中的单一效应细胞。然后将单一效应细胞用于获得各相应效应细胞的克隆群体。然后可以分析一种或多种克隆群体以通过测量分泌的抗体的特性来评估哪种效应细胞产生目标抗体(例如通过elisa或功能分析)。
可选地或此外,将细胞从分析室回收,分离(例如通过有限稀释),并扩增以获得足够的材料用于测序或扩增以及纯化一种或多种目的基因,例如编码抗体的基因。在另一实施方案中,将细胞从分析室回收,分离(例如通过有限稀释),并用于单细胞dna或mrna扩增,例如通过聚合酶链式反应(pcr)或逆转录酶(rt)-pcr然后进行测序,以确定一种或多种目的基因的序列。在另一实施方案中,从一种或多种分析室回收表现出细胞外效应的细胞群,分离(例如通过有限稀释),随后用于目的基因的单细胞dna或mrna扩增,然后是将这些基因克隆到另一种细胞类型中,用于随后的表达和分析。在另一实施方案中,来自细胞群的核酸在相同反应中测序。
在一实施方案中,可以分离回收的细胞群或亚群并用于体内分析,例如通过将它们(或来自回收的细胞群的抗体)注射到动物中,或在培养物中扩增。
在一实施方案中,回收显示细胞外效应的细胞群或亚群(例如,在本文提供的装置之一中的第一次或第二次细胞外效应分析之后)并且使回收的细胞的一种或多种核酸扩增。在一实施方案中,扩增通过聚合酶链式反应(pcr),cdna末端的5'-快速扩增(race),体外转录或全转录组扩增(wta)进行。在进一步的实施方案中,通过逆转录(rt)-pcr进行扩增。rt-pcr可以在单个细胞或群体的多个细胞上。从单细胞中回收抗体基因的两种主要方法包括使用简并引物的rt-pcr和cdna末端的5'快速扩增(race)pcr。在一实施方案中,rt-pcr方法基于基因特异性模板转换rt,然后是半巢式pcr和下一代扩增子测序。还可以对合并的细胞群进行核酸分析,然后进行生物信息学方法以鉴定重链和轻链抗体对。
图10显示了与显示细胞外效应变化的鉴定的效应细胞一起使用的rt-pcr方法的一个实施方案。该示意图显示了使用模板转换逆转录和多重引物的单细胞hv/lv方法。在该实施方案中,将单细胞沉积到微量离心管中,并从靶向重链和轻链恒定区的多重基因特异性引物产生cdna。mmlv酶的模板转换活性用于将模板转换寡核苷酸的反向互补物附加到所得cdna的3'末端(huber等人(1989).j.biol.chem.264,pp.4669-4678;luo和taylor(1990).j.virology64,pp.4321-4328;各自为了所有目的通过引用整体并入本文)。半巢式pcr(位于rt引物区域内的常见3'引物和多重嵌套引物)使用重链和轻链恒定区的多重引物,以及与复制的模板转换寡核苷酸互补的通用引物,用于扩增cdna和引入对每个单细胞扩增子特异的索引序列。合并所得的单细胞扩增子并测序。
在一些情况下,在从微流体装置回收后,回收的细胞群不进一步分离成单个细胞,或进行有限稀释以进行进一步分析。例如,如果从室分离的多个细胞含有分泌目标抗体的细胞(例如,存在于分泌其他抗体的一种或多种另外的细胞的群体中),则在一实施方案中,多个细胞在培养物中扩增以产生多个细胞的克隆群,其中一个或一些细胞产生所需产物(即,目标抗体)。在另一实施方案中,将从室中回收的多个细胞裂解(在微流体装置上或在回收后),然后从裂解物中扩增合并的核酸群,并通过测序进行分析。在这种情况下,获得的序列的生物信息学分析可用于推断,可能使用来自其他来源的信息,哪些序列可能编码目的蛋白(例如,抗体)。重要的是,与大量细胞的大量分析相比,由于回收的细胞数量有限,本发明提供的分析方法大大简化。这种有限数量的细胞提供了细胞群内基因组信息的降低的复杂性。
在一实施方案中,根据本领域技术人员已知的方法,使用多个细胞的扩增的dna序列产生在永生化细胞系中重组表达的序列文库。然后可以分析该细胞系(可能通过首先分离克隆),以鉴定目标抗体基因。在一些情况下,这些文库用于筛选导致感兴趣的蛋白复合物的基因组合。例如,在一实施方案中,基因包括抗体基因的重链和轻链,以鉴定全长抗体序列。由于来自回收室的细胞数量很少,这种分析的复杂性大大降低。例如,如果室中有10个细胞显示细胞外效应,则只有100种可能的抗体重链和轻链配对。相比之下,大量样品通常具有数千种不同的抗体序列,对应于数百万种可能的配对。
在一些实施方案中,回收的细胞可含有可使用本领域技术人员已知的方法进一步分离的不同细胞类型。例如,如果分析室包含asc和成纤维细胞,则后者用于维持asc,在一实施方案中,在回收后将asc与成纤维细胞分离,例如通过使用亲和捕获方法。
在一实施方案中,对存在于单个装置的各个室中的多个细胞群进行测定,以确定一个或多个群体内的效应细胞是否分泌抗体或抑制细胞生长或表现出一些其他细胞外效应的其他生物分子。然后可以回收室的内容物用于进一步分析,例如,在效应细胞的有限稀释中确定哪个效应细胞负责该效应。还可以通过本领域技术人员已知的方法回收和测序抗体序列。如本文所述,本发明的装置极大地促进了细胞处理和细胞回收。
在一实施方案中,在鉴定含有显示目标细胞外效应的一种或多种效应细胞的细胞群之后,再次分析细胞群,但是是在有限稀释下,例如作为单个室(或其他反应容器)中的单细胞,或单个室中的较小群体(与第一次筛选相比),以确定负责细胞外效应的个体效应细胞的身份。该两步筛选方法的一个实施方案显示在图2中。一旦鉴定了负责细胞外效应的效应细胞,则可以扩增其遗传信息并测序。
在一个方面,本文提供的装置和方法允许鉴定与一种或多种其他细胞群相比显示细胞外效应的细胞群。也就是说,将细胞外效应信号与对照值或装置中的一些其他室或多个室显示的值进行比较。在这方面,在装置的分开的室中保留个体细胞群,其中至少一种个体细胞群包含一种或多种效应细胞,并且分开的室各自包含读出颗粒群,每种读出颗粒群包含一种或多种读出颗粒。分析细胞群中细胞外效应的存在,由此读出颗粒群或其亚群提供细胞外效应的读出。然后可以从多个细胞群中鉴定表现出细胞外效应(例如与多个细胞群中的一种或多种剩余细胞群或对照值相比不同的效应信号)的细胞群。一旦鉴定出显示细胞外效应的细胞群,则回收该群体并且可以在有限稀释下进一步分析以鉴定群体内负责细胞外效应的细胞。
在本文中可以分析的细胞群不限于特定类型或来源。例如,在一实施方案中,室中分成个体细胞群的细胞群可以是分离自已经用抗原免疫或暴露于抗原的动物的外周血单核细胞(pbmc)。另一实施方案中的细胞群是分离自已经用抗原免疫或暴露于抗原的动物的b细胞。细胞群的来源可以是来自已经用抗原免疫或暴露于抗原的动物的全血。细胞群可以来自已经用抗原免疫或暴露于抗原的动物的淋巴组织或骨髓或脾脏。在期望查看初始库(
分析任选地包含一种或多种效应细胞的个体细胞群以确定相应细胞群是否包含表现出细胞外效应(例如与另一细胞群或对照值相比,细胞外效应的变化)的效应细胞。此外,包含效应细胞的细胞群不需要包含多种效应细胞,或者只是效应细胞群。相反,在本文所述的实施方案中,群体中包含非效应细胞。非效应细胞可以是群体的大多数或少数。包含效应细胞的异质群体不需要包含多种效应细胞。相反,如果两种细胞相对于彼此是异质的,则异质细胞群是异质的。装置室中的细胞群可包含零种效应细胞、一种效应细胞或多种效应细胞。类似地,细胞亚群可包含零种效应细胞、一种效应细胞或多种效应细胞。
在一实施方案中,细胞外效应是结合特性(例如动力学测量、特异性、亲和力等)或者细胞或由细胞分泌的生物分子(例如抗体)的一些其他细胞外效应。例如,在一实施方案中,细胞外效应是细胞表面受体的激动作用或拮抗作用、离子通道的激动作用或拮抗作用或者abc转运蛋白的激动作用或拮抗作用、细胞凋亡的调节、细胞增殖的调节、读出颗粒的外观形态改变、读出颗粒内蛋白定位的变化、读出颗粒的蛋白表达、辅助颗粒的生物活性的中和、效应细胞诱导的读出细胞的细胞裂解、效应细胞诱导的读出细胞的细胞凋亡、读出细胞的细胞坏死、读出细胞对抗体的内化、读出细胞对辅助颗粒的内化、效应细胞的酶中和、可溶性信号转导分子的中和或者他们的组合。
在效应细胞存在于包含多种效应细胞(其分泌对目标靶标(例如抗原)不具备特异性的抗体)的异质细胞群中的实施方案中,容易确定分泌能结合该目标靶标的生物分子(例如抗体)的效应细胞的存在和鉴定。在一实施方案中,这通过以下在各装置室中实现:首先在室中捕获功能化至捕获抗体(例如,用蛋白g或蛋白a功能化)的读出颗粒(例如珠)上的群体的所有或基本上所有分泌的抗体,将荧光标记的抗原加入到室中并对颗粒成像以检测由于抗原与固定化抗体的结合而存在或不存在荧光增加。可以通过进行测量来自单细胞的抗体分泌的实验来获得对可靠检测所需的珠上捕获的最小抗体数量的估计。在一实施方案中,可能检测在约250个细胞的异质群体中从单个asc分泌的抗原特异性抗体。因此,存在于单个反应室中的细胞群可包含约2至约250个细胞,例如每室约10至约100个细胞,或每室约10至约50个细胞。在另一实施方案中,室包含约2至约250个asc,或约2至约100个asc。在一实施方案中,装置的大于80%的室含有细胞群。如上所述,细胞群可以包含效应细胞以外的细胞,并且并非所有细胞群都包含效应细胞。当常规富集方案(例如,facs)不能用于获得相同细胞类型的基本上纯的细胞群时尤其如此。
在需要对单个细胞或读出颗粒进行成像的一个实施方案中,群体中的细胞数量被选择为不足以覆盖被成像的室的底部,使得被成像的细胞被排列在单层中。可选地,细胞群包括许多不足以形成覆盖室表面的双层的细胞。
在一些实施方案中,较大的细胞群可以存在于单个室内的群体中,而不抑制源自单个效应细胞或群体中的少量效应细胞的细胞外效应的检测。例如,在一实施方案中,细胞群中的细胞数为2至约300,或约10至约300,或约100至约300。在另一实施方案中,细胞群中的细胞数为2至约250,或约10至约250,或约100至约250。在另一实施方案中,细胞群中的细胞数为2至约200,或约10至约200,或约100至约200。在另一实施方案中,细胞群中的细胞数为2至约100,或约10至约100,约50至约100。在另一实施方案中,细胞群中的细胞数为2至约90,或约10至约90,或约50至约900。在另一实施方案中,细胞群中的细胞数为2至约80,或10至约80,或2至约70,或约10至约70,或约2至约60,或约10至约60,或约2至约50,或约10至约50,或约2至约40,或约10至约40,或2至约30,或约10至约20,或约2至约10。在一些实施方案中,细胞群中的大多数细胞是效应细胞。
在一实施方案中,将细胞样品分成数千个室中的多个细胞群,并测定单个室内的单个细胞群的细胞外效应。如果一种或多种群体内的效应细胞表现出细胞外效应,则鉴定并回收一种或多种个体细胞群。细胞外效应由使用者确定,并且在一实施方案中,是与抗原,细胞表面受体,abc转运蛋白或离子通道的结合相互作用。
尽管本文提供的方法可用于基于结合相互作用(例如抗原亲和力和特异性)鉴定单个效应细胞(单独或在异质群体内),但本发明不限于此。相反,在一实施方案中,通过实施直接功能测定来进行细胞群的鉴定。因此,本发明包括能够在分泌“功能性抗体”的细胞群中直接发现asc的方法和装置,而无需首先筛选“功能性抗体”的结合特性诸如对抗原靶标的亲和性和选择性。
沿着这些方面,提供了通过本文的方法可发现的功能性抗体和受体。例如,扩增和测序负责细胞外效应的效应细胞的核酸。核酸是编码分泌的生物分子(例如,抗体或其片段)的基因,或编码细胞受体或其片段(例如t细胞受体)的基因。可以通过本领域已知的方法克隆和/或测序抗体或其片段或细胞受体或其片段。例如,在一实施方案中,分泌功能性抗体的asc是通过结合靶细胞表面蛋白调节细胞信号转导的asc,所述靶细胞表面蛋白例如离子通道受体,abc转运蛋白,g蛋白偶联受体(gpcr),酪氨酸激酶受体(rtk)或具有内在酶活性如内在鸟苷酸环化酶活性的受体。
基于在室中进行的细胞外效应测定的结果,在室中鉴定包含一种或多种效应细胞的细胞群。如果细胞外效应可归因于室中的细胞,则回收细胞群并进行分析以确定负责该效应的群体内的效应细胞(参见例如图2)。在效应细胞分泌抗体的实施方案中,然后可以确定编码由asc产生的抗体的dna序列并随后克隆。在一实施方案中,克隆抗体dna序列并在细胞系中表达,以提供单克隆抗体的永生来源,用于进一步验证和临床前测试。
在一实施方案中,细胞群包含经遗传工程改造以表达可结合靶表位的分子文库的细胞群,经遗传工程改造以表达源自目的cdna文库的基因或基因片段的细胞,经基因工程改造为具有用于各种生物功能的报道子的细胞,以及来自永生系或一级来源的细胞。在一实施方案中,源自单个细胞的克隆由于例如,基因沉默,分化,基因表达改变,形态变化等,相对于彼此是异质的。另外,来自永生化系或一级来源的细胞不是单个细胞的相同克隆并且被认为是彼此异质的。来自单个细胞但天然经历体细胞高变或被工程化以进行体细胞高变(例如,通过诱导活化诱导的胞苷脱氨酶的表达等)的细胞不被认为是克隆,因此当这些细胞一起存在时,被认为是异质细胞群。
一旦将细胞群鉴定为显示细胞外效应,在一实施方案中,选择性地回收细胞群以获得回收的细胞群。如果鉴定出多个细胞群显示出细胞外效应,则在一实施方案中,回收并合并多个细胞群,以获得回收的细胞群。与最初装载到装置上的起始细胞群相比,回收的细胞群富集效应细胞,因为与后者相比前者具有更大百分比的效应细胞。可选地,对来自细胞的核酸进行测序以确定抗体核酸序列。
在一实施方案中,测定回收的细胞群的亚群是否存在第二种细胞外效应。第二种细胞外效应可以是与鉴定的细胞群测定的相同效应,或不同的细胞外效应。在进一步的实施方案中,所鉴定的群体的亚群各自包含约1至约10个细胞。在甚至进一步的实施方案中,所鉴定的群体的亚群各自包含平均1个细胞。然后鉴定并回收显示细胞外效应的一种或多种亚群以获得回收的亚群,在一实施方案中,其为效应细胞富集的。如果鉴定出多个细胞亚群,则在一实施方案中,将它们回收并合并,以获得回收的细胞亚群。然后可以分离,扩增和/或测序来自回收的细胞亚群的遗传信息,例如抗体基因序列或其片段。
用于本发明的细胞群不受来源限制,相反,它们可以源自任何动物,包括人或其他哺乳动物,或者来自体外组织培养。可以直接分析细胞,例如,在从来源收获后直接分析,或者在通过使用本领域已知的各种方案(例如,流式细胞术)富集具有所需特性(例如结合特定抗原的抗体的分泌的群体)之后分析细胞。在从动物来源收获之前,在一实施方案中,对动物进行一次或多次免疫。在一实施方案中,流式细胞术用于在装载到本文提供的装置之一上之前富集效应细胞,并且流式细胞术是荧光激活细胞分选(facs)。当使用已经富集效应细胞(例如asc)并且作为单个分析室中的单个细胞群保留的细胞群时,单个细胞群不需要完全由效应细胞组成。相反,其他细胞类型可以作为多数或少数存在。另外,一种或多种个体细胞群可含有零效应细胞。
有几种本领域技术人员已知的富集衍生自动物的asc的方法,其可用于富集和提供细胞群用于通过本文提供的方法和装置进行分析。例如,在一实施方案中,facs用于使用表面标志物cd19+cd20低cd27高cd38高富集人asc(smith等人(2009).natureprotocols4,pp.372-384)。在另一实施方案中,通过基于磁性免疫捕获的显示表面标志物的细胞的阳性或阴性选择来富集细胞群。在另一实施方案中,噬斑测定(jerne等人(1963),science140,p.405),elispot测定(czerkinsky等人(1983).j.immunol.methods65,pp.109-121),液滴测定(powel等人(1990).bio/technology8,pp.333-337),细胞表面荧光连接免疫吸附测定(yoshimoto等人(2013),scientificreports3,1191)或细胞表面亲和基质测定(manz等人(1995).proc.natl.acad.sci.usa92,pp.1921-1925)用于在进行本文提供的方法之一之前或在将起始细胞群装载到本文提供的装置之一上之前富集asc。出于所有目的,本段中引用的每篇参考文献的公开内容均以引用的方式整体并入本文。
关于本文提供的装置,应注意,并非装置上的所有室都必须包括细胞群和/或读出颗粒群,例如,可存在空室或部分填充的室。
在一些实施方案中,期望具有一种或多种辅助颗粒,其可包括存在于分析室中的一种或多种辅助细胞,以支持细胞群中一种或多种细胞的活力和/或功能或实施细胞外效应测定。例如,在一实施方案中,辅助细胞或多个辅助细胞包含成纤维细胞,自然杀伤(nk)细胞,杀伤t细胞,抗原呈递细胞,树突细胞,重组细胞或其组合。
在一实施方案中,辅助颗粒或细胞或包含辅助颗粒或细胞的群体与细胞群和/或读出颗粒群一起递送至室。在一实施方案中,辅助细胞是递送至室的细胞群的一部分。或者/另外,在将待测细胞外效应的细胞群装载到室或多个室之前或之后,将辅助颗粒或辅助细胞递送至室。在装载细胞群后,可以将辅助颗粒(例如,细胞)连续递送至室。可以通过装置顶部组件中的微通道进行递送,或者通过直接装载开放室进行递送。
本文提及的“辅助颗粒”是指任何颗粒,包括但不限于蛋白,蛋白片段或细胞,其(i)支持效应细胞的活力和/或功能,(ii)促进细胞外效应,(iii)促进细胞外效应的测量,或(iv)检测效应细胞的细胞外效应。因此,辅助颗粒可以指可溶性分子。
辅助颗粒包括但不限于蛋白,肽,生长因子,细胞因子,神经递质,脂质,磷脂,碳水化合物,代谢物,信号转导分子,氨基酸,单胺,糖蛋白,激素,病毒颗粒或其组合。在一实施方案中,一种或多种辅助颗粒包含鞘氨醇-1-磷酸,溶血磷脂酸或其组合。在一些实施方案中,辅助颗粒包括蛋白,蛋白片段,肽,生长因子,细胞因子,神经递质(例如,神经调节剂或神经肽),脂质,磷脂,氨基酸,单胺,糖蛋白,激素,病毒颗粒或补体途径激活剂(在将效应细胞分泌产物与读出细胞结合时)或其组合。在一实施方案中,一种或多种辅助颗粒是辅助分子,例如鞘氨醇-1-磷酸,溶血磷脂酸或其组合。
作为辅助细胞的实例,在一实施方案中,成纤维细胞群(不分泌抗体)包含在富集效应细胞(例如asc)的细胞群内以增强效应细胞(例如,群体中的asc)的活力。在另一实施方案中,可以添加nk细胞群作为辅助颗粒以实施抗体依赖性细胞介导的细胞毒性测定,其中nk细胞将在抗体结合靶细胞表面时攻击并裂解靶细胞。在对一种或多个细胞群进行功能性细胞测定的实施方案中,应当理解,一种或多个细胞群内的效应细胞需要保持存活延长的一段时间,同时保持在微流体装置的室内。为此,在一实施方案中,辅助颗粒和/或辅助细胞用于维持细胞群的或,所述细胞群任选地包含一种或多种效应细胞。如本文所述,辅助颗粒(例如辅助细胞)可用于维持或增强读出细胞或其群体的活力。
本文描述的实施方案的一个优点是在单个分析室内分析多于一种效应细胞,和/或在存在其他细胞的情况下分析一种或几种效应细胞,允许更高的测定通量,因此,鉴定和选择所需的效应细胞,否则这些效应细胞太稀少将难以有效检测。当富集所需细胞类型的方法有限或者这种富集具有有害作用(例如降低待测细胞活力)时,这是有利的。
可在无需进行基于表面标志物的富集的情况下鉴定和分离asc。在免疫后从pbmc分离的b细胞中,asc的频率可以为0.01%和1%。在每次装置运行10,000,000至100,000,000个细胞的通量时,这可以通过装载1,000,000个室的阵列以及每个室大约10至100个细胞来实现,可以在没有任何预先纯化的情况下筛选数千个asc。即使在可获得标志物的情况下,这也是重要的,因为asc的facs纯化可降低细胞活力。另外,因为用于富集asc的适当试剂可能不适用于感兴趣的宿主物种,所以在不进一步纯化的情况下筛选asc的能力是asc研究的进步。免疫后,pbmc中抗体分泌细胞的频率可以为0.01和1%,因此通过使用本文提供的装置是可检测的。因此,由于可以在没有特异性捕获试剂的情况下对任何物种进行外周血单核细胞(pbmc)的分离,因此本发明的一些方法提供了从任何物种快速且经济地选择分泌目的抗体的细胞。
在一实施方案中,通过本文提供的方法和装置鉴定来自人的基础水平的asc。虽然可以免疫动物以产生针对大多数抗原的新抗体,但是除了批准的疫苗之外,相同的程序不能在人类中广泛进行。然而,已经天然暴露于抗原或在其寿命的某些时间点接种的人通常具有低基础水平的抗原特异性抗体分泌细胞。本发明可用于从大量细胞中鉴定和分离分泌特异性抗体的极其罕见的效应细胞(例如,每次装置运行大于100,000至100,000,000个)。此类方法在本文中用于发现功能性抗体,例如作为可能存在自身抗体的自身免疫疾病和癌症的治疗剂。
如全文所述,本发明部分涉及在单个装置的室中以大规模平行方式进行的细胞外效应测定。进行测定以测量和检测由细胞群中存在的效应细胞或其多个细胞产生的细胞外效应。读出颗粒群或其亚群提供细胞外效应的读出。例如,本文描述的方法允许,在多达约250个(例如,约2至约100个细胞,或约2至约50个细胞)不发挥细胞外效应的细胞的背景中,鉴定含有发挥细胞外效应(例如,对所需抗原具有特异性的抗体的分泌)的效应细胞的异源细胞群。
在一实施方案中,经受本文所述方法的细胞群包含asc或多个asc,并且读出颗粒群或其亚群显示靶表位或多个靶表位。在一实施方案中,读出颗粒群是功能化以通过表位捕获抗体的珠群。或者/另外,读出颗粒群对抗体的fc区是特异性的,因此不区分具有不同表位的抗体。在一实施方案中,读出颗粒群或其亚群用含有靶表位的荧光缀合的分子标记,例如以进行elisa测定。基于荧光的抗体和细胞因子珠测定是本领域已知的,参见例如singhal等人(2010)。anal.chem.82,pp.8671-8679,
此外,如本文所述,装置的各个室被构造成使得室内的试剂交换成为可能,从而消除或基本上消除室之间的交叉污染。这允许在各个室中进行细胞培养,以及在单个室中检测多种细胞外效应,例如,在单个室中的独特抗原结合事件和/或其他细胞外效应,例如,通过交换抗原和二抗标记各自的结合复合物,然后成像。在这些连续测定步骤中,可以用相同的荧光团进行测定,因为每个反应在洗涤步骤后连续进行。可选地,不同的荧光团可用于在一个分析室中以连续方式或平行地检测不同的细胞外效应。例如,室被制造成具有≥1的纵横比(定义为高度比最小横向尺寸),以实现试剂交换而没有显著的交叉污染。在一实施方案中,装置的多个室的平均纵横比≥约0.6,约≥0.7,约≥0.8,约≥0.9,≥约1,≥约1.5,≥约2,≥约2.5,≥约3,≥约3.5,≥约4,≥约4.5,≥约5,≥约5.5,≥约6。在又一个实施方案中,装置的多个室的平均纵横比≥约1,但是≤10,或≥约1,但≤约9,或≥约1,但≤约8。
在一实施方案中,读出颗粒群是读出细胞群,其中至少一些读出细胞在其表面上显示靶表位。在一实施方案中,读出细胞群或其亚群是存活的和有活力的。在另一实施方案中,读出细胞群或其亚群是固定的。从上面的讨论中可以看出,在测定抗体结合的情况下,“抗体结合”被认为是效应细胞或多种效应细胞的细胞外效应。可以通过例如用一种或多种荧光标记的二抗染色细胞来检测抗体结合。在另一实施方案中,抗体与读出颗粒或读出细胞上的靶表位的结合导致读出细胞的死亡,或如本文所讨论的一些其他读出细胞应答(例如,生物分子的分泌,细胞信号转导途径的激活或抑制)。
可以通过例如形态学,大小,表面粘附性,运动性和荧光反应等特征来区分读出细胞。例如,在一实施方案中,在其表面或细胞内标记读出细胞群,以确定读出细胞是否表现出响应。例如,钙黄绿素,羧基荧光素琥珀酰基酯报道子(cfse)或gfp/yfp/rfp报道子可用于标记一种或多种报道细胞,包括细胞外受体和细胞内蛋白和其他生物分子。
在一些实施方案中,读出颗粒群是异质读出颗粒群,例如异质读出细胞群。例如,在细胞群中存在asc或多个asc的情况下,群体中的个体读出颗粒可以显示不同的靶表位,或显示两种不同的细胞受体(例如,gpcr或rtk或离子通道或其组合,包括多种不同种类,例如两种或更多种gpcr等)。因此,可以评估细胞外效应的特异性,例如抗体对靶表位的特异性,或特定细胞表面受体的抑制。在另一实施方案中,细胞群内的效应细胞是asc,并且读出颗粒群包括非选择性地捕获所有抗体(例如,fc区特异性的)的异质珠群和对独特的靶表位具有特异性的珠群。
在一实施方案中,提供辅助颗粒以促进细胞外效应的读出和/或测量。如全文所述,细胞外效应包括效应细胞分泌产物(例如抗体)表现出的效应。例如,在一实施方案中,提供nk细胞作为辅助颗粒,以便于测量读出细胞的裂解。在该实施方案中,细胞外效应包括当效应细胞分泌的抗体结合上述读出细胞时,nk细胞裂解与特定表位或细胞受体结合的读出细胞。
在一实施方案中,一种或多种细胞因子用作辅助颗粒。可用作辅助颗粒的细胞因子的实例包括趋化因子,干扰素,白细胞介素,淋巴因子,肿瘤坏死因子。在一些实施方案中,辅助分子由读出细胞产生。在一些实施方案中,细胞因子用作辅助颗粒,并且是下表1中提供的一种或多种细胞因子。在另一实施方案中,一种或多种下列细胞因子用作辅助颗粒:白细胞介素(il)-1α,il-1β,il-1ra,il18,il-2,il-3,il-4,il-5,il-6,il-7,il-8,il-9,il-10,il-11,il-12,il-13,il-14,il-15,il-16,il17,il-18,il-19,il-20,粒细胞集落刺激因子(g-csf),粒细胞巨噬细胞集落刺激因子(gm-csf),白血病抑制因子,制瘤素m,干扰素(ifn)-α,ifn-β,ifn-γ,cd154,淋巴毒素β(ltb),肿瘤坏死因子(tnf)-α,tnf-β,转化生长因子(tgf)-β的各种同种型,促红细胞生成素,巨核细胞生长和发育因子(mgdf),fms-相关酪氨酸激酶3配体(flt-3l),干细胞因子,集落刺激因子-1(csf-1),巨噬细胞刺激因子,4-1bb配体,增殖诱导配体(april),分化群70(cd70)),分化群153(cd153),分化群178(cd17)8,糖皮质激素诱导的tnf受体配体(gitrl),light(也称为tnf配体超家族成员14,hvem配体,cd258),ox40l(也称为cd252并且是cd134的配体),tall-1,tnf相关凋亡诱导配体(trail),肿瘤坏死因子细胞凋亡诱导剂(tweak),tnf相关激活诱导细胞因子(trance)或其组合。
在一实施方案中,辅助颗粒是细胞因子或可操作以刺激读出细胞的响应的其他因子。例如,可以将读出细胞与效应细胞或多个效应细胞一起孵育,并用可操作以影响读出细胞的细胞因子脉冲。或者/另外,可操作以影响读出颗粒的细胞因子分泌细胞作为辅助细胞提供给室。在一实施方案中,效应细胞分泌产物对分泌的细胞因子的中和,通过细胞因子对读出细胞的预期作用的缺乏来检测。在另一实施方案中,提供了辅助颗粒,其是可操作以感染一种或多种读出细胞的病毒,并且检测到病毒的中和作为病毒对读出细胞的感染减少。
如本文所述,在一实施方案中,本文提供的方法和装置可辨别的细胞外效应是功能效应。在一实施方案中,功能效应是细胞凋亡,细胞增殖的调节,读出颗粒的形态外观的变化,多个读出颗粒的聚集的变化,读出颗粒内蛋白的定位的变化,读出颗粒对蛋白的表达,读出颗粒对蛋白的分泌,触发细胞信号转导级联,读出细胞内化由效应细胞分泌的分子,或对可操作以影响读出颗粒的辅助颗粒的中和。
一旦在包含细胞群的室中鉴定出细胞外效应,就回收群体并且可以对回收的细胞群的亚群进行下游测定,以确定哪个(些)效应细胞负责测量的细胞外效应。可选地,可以对回收的群体进行测序以确定群体中效应细胞的抗体序列。在一实施方案中,下游测定在与第一细胞外效应测定相同的装置上进行。然而,在另一实施方案中,下游测定在装置中进行,例如,台式单细胞逆转录酶(rt)-pcr反应。在一实施方案中,分离,克隆和表达鉴定和回收的效应细胞的抗体基因序列,以提供新的功能性抗体。
虽然单种asc的功能性细胞外效应可通过本文提供的方法和装置测量,但亲和力,结合和特异性也可测量为效应细胞的“细胞外效应”,例如效应细胞分泌产物的效应。例如,dierks等人(2009).anal.biochem.386,pp.30-35(其全部内容通过引用并入本文)提供的结合测定,可以在本文提供的装置中使用,以确定asc是否分泌能与特定靶标结合的抗体。
在另一实施方案中,细胞外效应是对抗原的亲和力或结合动力学,并且singhal等人(2010).anal.chem.82,pp.8671-8679(出于所有目的通过引用并入本文)描述的方法,用于测定细胞外效应。
在一实施方案中,通过使用多种类型的读出颗粒在一个室中进行多种细胞外效应的平行分析。可替代地或另外地,通过在至少两个不同的室中采用不同的读出颗粒,在单个微流体装置上进行多种功能效应的并行分析。
在一些实施方案中,读出颗粒是分子,例如酶。在一实施方案中,读出颗粒是作为可溶性分子存在的酶,或者被栓系到室表面或室中的另一物理支持物的酶。在这种情况下,在一实施方案中,通过报告酶活性的信号(包括荧光信号或比色信号或沉淀反应)的减少检测抑制读出颗粒的酶活性的抗体的结合。
在一实施方案中,确定细胞群内的效应细胞或多种效应细胞是否显示细胞外效应包括使用含有细胞群的分析室的光和/或荧光显微镜。因此,本发明的一个实施方案涉及将读出颗粒群保持在单个平面中以便于通过显微镜成像颗粒。在一实施方案中,室中的读出颗粒群保持在通过装置材料或其一部分(例如,玻璃或pdms)来成像的单个平面中,以产生室的一个或多个高分辨率图像。在一实施方案中,高分辨率图像是与使用具有可比较的光学仪器(透镜和物镜,照明和对比机构等)的标准显微镜格式所实现的图像相当的图像。
细胞群和读出颗粒群可以同时装载到室中(例如,不同或相同的溶液中,通过直接在室上装载,例如通过液柱产生的静水压力,通过使用诸如移液管的分配仪器产生流动,或者通过更换底部组件之上的介质并上下移动顶部组件或底部组件以引起流体转移到微室)。可选地,将效应细胞和读出颗粒连续装载到室中。本领域普通技术人员将理解,可以在将读出颗粒装载到室之前(或之后)将细胞群提供给室。然而,读出颗粒群和细胞群可以作为混合物一起提供。与辅助颗粒一样,读出颗粒可以直接装载到装置的底部组件中,即直接装载到开放室中,或者通过装置顶部组件中的通道装载。因此,装置架构将决定如何执行装载。
在实施方案中,个体读出颗粒群和细胞群保留在装置的单个室中。在一实施方案中,室基本上与装置的还包括单个细胞群和读出颗粒群的其他室隔离,例如,以最小化室之间的污染。可以在有或没有流体结构的情况下进行隔离。例如,在一实施方案中,装置的顶部组件可包括控制通道以及其下方的薄膜。当与连接室的底层通道合在一起时,能发生设阀。可选地,顶部组件可以设置成“下推”几何形状,其具有底面上有开放通道结构和经过顶部的控制线。
然而,完全隔离对于实施本文提供的方法不是必需的。在需要隔离的一实施方案中,隔离包括流体隔离,并且通过物理密封它们来实现室的流体隔离,例如通过使用可平移装置(参见例如图6)。然而,在另一实施方案中的隔离是在没有物理密封室的情况下,通过限制室之间的流体连通以排除装置的一个室和另一个室之间通过对流或通过扩散的污染来实现的。例如,可以选择室的几何形状(例如,特定纵横比)以便抑制室之间的对流传输并且使得同一室中的效应细胞与读出颗粒之间的距离远小于任何其他室中的效应细胞和读出颗粒之间的距离,从而确保任何给定室中分泌分子扩散至读出颗粒并在其上的积聚主要来自该室中的效应细胞。
为了进行细胞外效应测定,将任选包含一种或多种效应细胞的细胞群和读出颗粒群在室中一起孵育,并且这些孵育在每个装置内以大规模平行的方式进行。应当理解,可以进行额外的孵育步骤,例如,当将诸如辅助颗粒的组分添加到室中时,并且可以在添加读出颗粒之前和/或在将读出颗粒添加到包含细胞群的室中之后进行初始孵育步骤。
例如,孵育步骤可包括介质更换以保持细胞群健康,和/或细胞洗涤步骤。孵育还可以包括添加用于进行细胞外效应测定的辅助颗粒(例如辅助分子)。
在一实施方案中,孵育步骤包括控制室的一种或多种特性,例如湿度,温度和/或ph,以维持细胞活力(效应细胞,辅助细胞或读出细胞)和/或维持室中细胞的一种或多种功能特性,例如分泌,表面标志物表达,基因表达,信号转导机制等。在一实施方案中,孵育步骤包括使灌注流体通过室或在室上方(例如,在室表面上方)流动。根据室中的效应细胞和/或读出细胞的类型选择灌注流体。例如,在一个实施方案中,选择灌注液体以维持细胞活力,例如,补充耗尽的氧气或去除废物产生,或维持细胞状态,例如补充必需的细胞因子,或帮助测定所需效果,例如,添加荧光检测试剂。灌注也可用于交换试剂,例如,以连续方式测定多种细胞外效应。
在另一实施方案中,孵育细胞群包括使灌注流体通过室或在室上方(例如,在室表面上方)流动,以诱导读出颗粒(例如,读出细胞)的细胞响应。例如,在一个实施方案中,孵育步骤包括将包含信号转导细胞因子的流体添加到包含细胞群的室中。孵育步骤可以是周期性的,连续的或其组合。例如,使灌注流体流动到分析室是周期性的或连续的,或其组合。在一实施方案中,孵育液体的流动是压力驱动的,例如通过使用压缩空气,注射泵或重力来调节流动。
一旦为装置内的各个室提供细胞群和读出颗粒群,就进行一种方法以确定群内的细胞是否对读出颗粒群或其亚群表现出细胞外效应。然后适当地检查细胞群和读出颗粒群和/或其亚群以确定群中的细胞是否表现出细胞外效应。只要在室内检测到效应的存在,就不必鉴定室内显示细胞外效应的特定细胞。在一实施方案中,一旦细胞群被鉴定为表现出细胞外效应,则回收细胞群以鉴定负责细胞外效应的特定效应细胞。在另一实施方案中,一旦细胞群被鉴定为表现出细胞外效应(例如,与另一细胞群或对照值相比细胞外效应的变化),则将其回收并且扩增并测序来自细胞群的核酸。
在一实施方案中,细胞外效应是由效应细胞产生的蛋白(例如,抗体或其片段)与读出颗粒(例如珠或细胞)之间的结合相互作用。在一实施方案中,群体中的一种或多种效应细胞是抗体分泌细胞(asc),并且读出颗粒包括具有靶表位的抗原。在一实施方案中,细胞外效应是与对照水平或第二细胞群表现的水平相比与抗原的差异结合。可选地,细胞外效应的变化是存在这样的效应细胞,其分泌对特定抗原具有调节亲和力的抗体。也就是说,结合相互作用是抗原-抗体结合特异性,抗原-抗体结合亲和力和抗原-抗体结合动力学中的一种或多种的量度。或者或另外,细胞外效应是细胞凋亡的调节,细胞增殖的调节,读出颗粒形态外观的变化,读出颗粒内蛋白定位的变化,读出颗粒的蛋白表达,中和附属粒子的生物活性,效应细胞诱导的对读出细胞的细胞裂解,效应细胞诱导的读出细胞的细胞凋亡,读出细胞坏死,抗体内化,辅助颗粒内化,效应细胞的酶中和,可溶性信号转导分子的中和或其组合。
多个读出颗粒可以通过相应的读出颗粒特有的一种或多种特征来区分,例如荧光团类型,不同水平的荧光强度,形态,大小和表面染色。
一旦与包含效应细胞的细胞群一起孵育,检查读出颗粒群或其亚群以确定细胞群内的一种或多种效应细胞是否对一种或多种读出颗粒表现出细胞外效应,无论是直接还是间接的(例如,与另一细胞群或对照值相比细胞外效应的变化)。鉴定出表现出该效应的细胞群,然后回收用于下游分析。如全文所提供的,只要在分析室内检测到细胞外效应的存在,就不必鉴定在一种或多种读出颗粒上显示细胞外效应的特定效应细胞。
在一些实施方案中,一种或多种效应细胞分泌生物分子,例如抗体,并且在读出颗粒或多个读出颗粒(例如,读出细胞)上评估分泌的生物分子的细胞外效应,以便检测显示细胞外效应的细胞群。在另一实施方案中,细胞外效应是t细胞受体的作用,例如,与抗原结合。
在一实施方案中,读出颗粒群是异质的读出细胞群,其包含经工程改造以表达cdna文库的细胞,其中cdna文库编码多种细胞表面蛋白。抗体与这些细胞的结合用于回收分泌能与靶表位结合的抗体的细胞。
在一些实施方案中,一种或多种读出颗粒包括展示或表达靶抗原的读出细胞。在另一实施方案中,将自然杀伤细胞提供给室作为辅助细胞,其促进测量的细胞外效应(裂解)。可以在读出颗粒被装载之前,或者在将读出颗粒装载到室中之后,将辅助细胞与细胞群,读出颗粒一起提供给室。在使用自然杀伤细胞的一个实施方案中,自然杀伤细胞靶向由效应细胞产生的抗体所结合的一种或多种读出细胞。因此,细胞外效应可包括自然杀伤细胞裂解一种或多种读出细胞。裂解可以通过活力染料,膜完整性染料,荧光染料的释放,酶测定等来测量。
在一些实施方案中,细胞外效应是可操作以影响读出颗粒的辅助颗粒(或辅助试剂),例如,可操作以刺激至少一种读出细胞的响应的细胞因子(辅助颗粒)的中和。例如,可以进一步向室提供可操作以影响读出颗粒细胞的细胞因子分泌细胞。可以检测效应细胞对分泌的细胞因子的中和作为细胞因子对读出细胞的预期作用例如,增殖的缺失。在另一实施方案中,辅助颗粒是可操作以感染读出细胞的病毒,并且病毒的中和被检测为病毒对读出细胞的感染减少。
在一些实施方案中,一种效应细胞的细胞外效应诱导第二效应细胞的活化(例如,第二效应细胞分泌抗体或细胞因子),然后其可以在至少一种读出细胞中引发应答。
在一实施方案中,在本文提供的装置之一的室中分离的细胞群包含分泌单克隆抗体的asc。在一实施方案中,基于读出珠的测定法用于检测在一种或多种不分泌抗体的其他细胞的背景中分泌抗体的asc的存在的方法。例如,在一实施方案中,在检测细胞群内的asc的方法中使用基于珠的测定法,所述细胞群的抗体在一种或多种分泌不结合目标靶表位的抗体的另外的asc的存在下结合所述目标靶表位。
在另一实施方案中,评估抗体与靶细胞特异性结合的能力。参照图11,除了至少一种效应细胞182(asc)之外,该测定还包括至少两种读出颗粒,例如读出细胞181和186。读出细胞181在其表面上(天然地或通过基因工程)表达感兴趣的已知靶表位,即靶表位183,而读出细胞186则不表达。两种类型的读出细胞181和186可以通过可区分的荧光标志物,其他染色或形态与它们自身和效应细胞182区分开。效应细胞182在与读出细胞181和186相同的室中分泌抗体184。效应细胞182分泌的抗体184通过靶表位183与读出细胞181结合,但不与读出细胞186结合。使用二抗检测抗体184与读出细胞181的选择性结合。然后对分析室进行成像以确定是否已经发生了抗体184与读出细胞181和/或读出细胞186的结合。
这种测定还可以用于使用高分辨率显微镜评估抗体结合在读出细胞上或内部的位置。在该实施方案中,读出颗粒包括以不同方式(例如,通过透化和固定)制备的不同颗粒类型(例如,细胞类型)或颗粒/细胞,以评估结合特异性和/或定位。例如,该测定可用于鉴定结合活细胞上靶标的天然构象和固定细胞上的变性形式的抗体。可选地,该测定可用于通过首先用针对已知表位的抗体阻断分子的其他部分来确定表位在靶分子上的位置,其中不同的读出颗粒群具有不同的封闭表位。
在另一实施方案中,将个体异质读出颗粒群(例如,包含恶性和正常细胞的读出细胞群)和个体细胞群,其中至少一个个体细胞群包含效应细胞(例如,asc),提供给本文提供的装置之一的多个分析室(例如,大于1000个室)。例如,参考图12,与读出细胞群中的一种或多种恶性读出细胞425结合和不与健康读出细胞426结合,用于鉴定含有一种或多种产生目标抗体的效应细胞(即,产生对群体中的一种或多种恶性细胞特异的抗体428的效应细胞427)的细胞群。室内的两种类型的读出细胞425和426可通过至少一种特性区分,例如荧光,不同水平的荧光强度,形态,大小,表面染色,分析室中的位置。然后将细胞在各个室内孵育并成像以确定一个或多个室是否包括显示细胞外效应(即结合恶性读出细胞但不结合健康读出细胞的抗体)的细胞群。
如果存在,则可以回收含有分泌结合恶性读出细胞425但不结合健康读出细胞426的抗体的一种或多种asc的细胞群,以取得室内抗体的序列,或者对群体内的各个细胞进行其他下游测定,例如,确定群体中哪个asc具有所需结合特性的测定。因此,提供了通过本文描述的一种或多种方法发现的新功能性抗体。恶性读出细胞425上的表位可以是已知的或未知的。
在一实施方案中,单细胞类型可以用作效应细胞和读出细胞。参见图13,用效应细胞430和读出细胞431进行该测定,两者均被功能化以在其表面上捕获感兴趣的分子432,例如使用针对表面标志物和感兴趣的分子432的四聚体抗体433,或细胞上的结合生物素化抗体亲和基质。参考图14,四聚体抗体复合物由结合细胞的抗体(a)435和结合细胞分泌的抗体的抗体(b)436组成,其中抗体a和b通过结合抗体a和b的fc部分的两种抗体437连接。本领域已经描述了这种四聚体抗体复合物(lansdorp等人(1986).europeanjournalofimmunology16,pp.679-683,出于所有目的通过引用整体并入本文)并且是可商购的(stemcelltechnologies,vancouvercanada)。使用这些四聚体,捕获分泌的抗体并将其连接到细胞表面上,从而使效应细胞也起到读出颗粒的作用。一旦结合在细胞表面上,就可以测定这些抗体的结合,例如通过添加荧光标记的抗原。例如,在试图鉴定含有分泌能与特定靶标结合的单克隆抗体的细胞的室的情况下,从效应细胞分泌的抗体可以被捕获在这些效应细胞的表面上,而室中的其他细胞,使用适当的捕获剂。再次参见图13,因此理解效应细胞430还可以作为读出细胞起作用,即,分泌感兴趣的分子432的效应细胞可以比读出细胞431更有效地捕获感兴趣的分子。
在一实施方案中,细胞外效应测定在多个分析室中平行进行,其中室中的读出颗粒群是异质的(例如,异质读出细胞群)和每个室中的细胞群是基本上同质的,其中每个基本上同质的群体内的各个效应细胞各自产生相同的抗体。在另一实施方案中,读出颗粒是经遗传工程改造,以表达蛋白或蛋白片段的文库,以确定效应细胞分泌的抗体的靶表位的读出细胞。参照图15,该测定的一个实施方案包括分泌抗体191的多个效应细胞190。该测定还包括异质读出细胞群,其包含分别显示表位196,197,198和199的读出细胞192,193,194和195。效应细胞190分泌抗体191,其向读出细胞192,193,194和195扩散。抗体191通过靶表位198与读出细胞194结合,但不与读出细胞192,193或195结合。二抗可以用于检测抗体191与读出细胞194的选择性结合。
然后可以从装置中回收分泌结合读出细胞194(或另一表位)的抗体191的细胞群,并进行进一步的测定。
在一实施方案中,在各个装置室中平行进行测定以确定室中细胞群内的asc是否激活靶细胞的细胞裂解,即激活抗体依赖性细胞介导的细胞毒性(adcc)。adcc是细胞介导的免疫防御的机制,其中免疫系统的效应细胞裂解靶细胞,其膜表面抗原已经被特异性抗体,即由本文提供的特定分析室内的asc分泌的抗体结合。经典adcc由自然杀伤(nk)细胞介导。然而,巨噬细胞,嗜中性粒细胞和嗜酸性粒细胞也可以介导adcc,并且可以在本文中提供作为用于adcc细胞外效应测定的辅助细胞。
本文提供的adcc测定的一个实施方案包括含有效应细胞或多种效应细胞的细胞群,读出细胞群(在其表面上具有感兴趣的表位)和作为辅助细胞的nk细胞。进行测定以确定来自细胞群的asc是否诱导nk细胞攻击靶细胞并裂解它们。参考图16,所示实施方案包括细胞群,其包含分别分泌抗体202和203的asc200和201。所示实施方案还包括异质读出细胞群,其包含分别显示表位206和207的读出细胞204和205。asc200和201分泌抗体202和203,其向读出细胞204和205扩散。抗体202通过靶表位207与读出细胞205结合,但不与读出细胞204结合。抗体203不与读出细胞204和205中的任一个结合。nk细胞208检测到读出细胞205已被抗体202结合并继续杀死读出细胞205,同时仅留下未结合的读出细胞204。
本领域技术人员将理解,可以在将效应细胞与读出细胞一起孵育期间或之后将nk细胞添加到室中,条件是它们以便于接近(例如,光学接近)到读出细胞的方式添加到室中。在一实施方案中,将nk细胞(或另一种类型的辅助细胞)直接添加到装置的底部组分中,即直接添加到开放室中。或者/另外,通过在装置的顶部组件中形成的微通道将nk细胞(或另一种类型的辅助细胞)添加到室中。nk细胞可以来自异质的辅助细胞群,例如外周血单核细胞。nk细胞可以来自动物或人源细胞系,并且经过工程改造以增加adcc活性。本领域技术人员将进一步理解,该测定可以用能够介导adcc的其他造血细胞类型进行,例如巨噬细胞,嗜酸性粒细胞或嗜中性粒细胞。在这种情况下,巨噬细胞,嗜酸性粒细胞或嗜中性粒细胞是测定中的辅助细胞。能够介导adcc的细胞类型也可以是动物或人源细胞系,其被改造以增加adcc活性或在靶细胞上结合抗体时报告信号。在后者中,靶细胞是辅助颗粒,而介导adcc的细胞是读出颗粒。
如图16所示,可以对单个细胞(例如,单个效应细胞),同质细胞群或异质细胞群进行adcc细胞外效应测定。类似地,可以用单个读出细胞,均质读出细胞群或异质读出细胞群进行adcc测定,如图16所示。然而,在许多情况下,希望用多个读出细胞进行adcc测定以避免检测到由读出细胞的随机死亡而产生的假阳性。
在一实施方案中,通过克隆形成测定,通过添加膜完整性染料,通过细胞内荧光分子的损失或通过细胞内分子释放在溶液中来定量细胞裂解。释放的生物分子可直接在溶液中测量或捕获到读出颗粒上用于测量。在一些情况下,添加额外的辅助分子,例如用于氧化还原测定的底物或用于酶测定的底物。参考图17,例如,包含分泌第一生物分子502的效应细胞500和不分泌第一生物分子502的第二效应细胞501的细胞群在异质读出颗粒群存在下孵育,所述异质读出颗粒群包含读出细胞503和读出颗粒504和辅助颗粒(例如,自然杀伤细胞505)。第一生物分子502与读出细胞503的结合引发自然杀伤细胞505的募集,其导致读出细胞503裂解。在细胞裂解后,第二生物分子506从读出细胞503释放并捕获在读出颗粒504(一种不同类型的被功能化以捕获第二生物分子506,例如通过分子507的读出颗粒)上。在一实施方案中,分子507是蛋白如抗体或酶,反应基团和/或核酸。捕获的第二生物分子506可以是存在于读出细胞503中的任何分子,例如蛋白,酶,碳水化合物或核酸。在一实施方案中,使用荧光测定,比色测定,生物发光测定或化学发光测定来定量第二生物分子506与读出颗粒504的结合。该测定直接在读出颗粒504上进行或间接在周围溶液中进行,例如,如果捕获的生物分子506是将底物转化为具有不同光学特性的产物的酶。该测定在本文提供的装置之一的多个室中进行,以确定任何室是否包含分泌诱导细胞裂解的生物分子(例如抗体)的效应细胞。
adcc测定是本领域已知的,并且组分可商购获得。例如,可以利用用于流式细胞仪的guava细胞毒性试剂盒(millipore),adccreporter生物测定核心试剂盒(promega),adcc测定(genscript),live/dead细胞介导的细胞毒性试剂盒(lifetechnologies)和delfia细胞毒性测定。
在另一实施方案中,细胞外效应测定是补体依赖性细胞毒性(cdc)测定。在一个cdc实施方案中,提供了用于鉴定在存在通过经典补体途径诱导读出细胞裂解所必需和/或足以通过经典补体途径诱导读出细胞裂解的可溶性因子的情况下,细胞群内能与读出细胞结合的asc(或asc的分泌抗体)的存在的方法。因此,该测定在一实施方案中确定asc分泌的抗体是否通过经典补体途径刺激一种或多种靶细胞的裂解。
cdc测定包括至少一种效应细胞和至少一种读出细胞,并且图18中描绘了一种cdc实施方案。该实施方案包括细胞群,其包括分别分泌抗体212和213的效应细胞210和效应细胞211。所示实施方案还包括异质读出细胞群,其包含分别显示表位216和217的读出细胞214和读出细胞215。效应细胞210和211分泌抗体212和213,其向读出细胞214和215扩散。抗体212通过靶表位217与读出细胞215结合,但不与读出细胞214结合。抗体213不与读出细胞214和215中的任一种结合。酶c1218,辅助颗粒和通过经典补体途径诱导细胞裂解所必需的可溶性因子之一,与抗体212和读出细胞215的复合物结合,同时仅留下未结合的读出细胞214。酶c1208与读出细胞215和抗体212的复合物的结合触发了经典补体途径,其涉及通过类补体途径诱导细胞裂解所必需的其他可溶性因子(未显示),导致读出细胞215的破裂和死亡。
在效应细胞与读出细胞一起孵育期间或之后,添加诱导读出细胞(即,测定所需的辅助颗粒)裂解所必需和/或足以诱导读出细胞裂解的可溶性因子,条件是它们以便于接近读出细胞的方式添加到室中。如上所述,这种辅助颗粒可以通过顶部装置组件或底部装置组件添加到室中。本文提供的cdc测定可以在单个效应细胞,同质效应细胞群或异质细胞群上进行,如图18所示。类似地,cdc测定可以用单个读出细胞,均质读出细胞群或异源读出细胞群进行,如图18所示。然而,在许多情况下,需要用读出细胞群进行cdc测定以避免检测到由读出细胞随机死亡引起的假阳性。
通过补体途径的细胞裂解根据本领域技术人员已知的方法定量。例如,通过克隆形成测定,通过添加膜完整性染料,通过细胞内荧光分子的损失或通过细胞内分子释放到溶液中来定量细胞裂解。释放的生物分子直接在溶液中测量或捕获到读出的颗粒上。在一些情况下,可以添加额外的辅助分子,例如用于氧化还原测定的底物或用于酶测定的底物。参考图19,例如,在异质读出颗粒(例如,读出细胞513和读出颗粒514)的存在下,在辅助颗粒515(例如,补体蛋白)的存在下,孵育细胞群,其包括分泌第一生物分子512的效应细胞510和不分泌第一生物分子512的第二效应细胞511。在辅助颗粒515存在下,生物分子512与读出细胞513的结合导致读出细胞513裂解。在细胞裂解后,第二生物分子516被释放并捕获在读出颗粒514(第二类型的被功能化以捕获生物分子516,例如通过分子517的读出颗粒)上。分子517可以是一种或多种类型的分子,例如蛋白,抗体,酶,反应基团和/或核酸。捕获的生物分子516不限于类型。相反,捕获的生物分子516是存在于读出细胞513中的任何分子,例如蛋白,酶,染料,碳水化合物或核酸。使用荧光测定,比色测定,生物发光测定或化学发光测定来定量第二生物分子516与读出颗粒514的结合。应当理解,该测定可以直接在读出颗粒514上进行或间接在周围溶液中进行,例如,如果捕获的生物分子516是将底物转化为具有不同光学特性的产物的酶。
在另一实施方案中,提供测定以确定单独或在细胞群内的效应细胞是否调节细胞生长。具体地,该测定用于确定效应细胞是否分泌生物分子,例如调节读出细胞生长速率的细胞因子或抗体。参考图20,所示实施方案包括细胞群,其包含分别分泌生物分子222和223的效应细胞220和效应细胞221。所示实施方案还包括包含读出细胞224的同质读出细胞群。效应细胞220和221分泌生物分子222和223,其向读出细胞224扩散。生物分子222结合读出细胞224以诱导读出细胞224的生长(由打孔线表示),而生物分子223不与读出细胞224结合。室的显微成像用于评估读出细胞224相对于未暴露于生物分子的其他室中的细胞的生长。
可以使用任选地包含一种或多种效应细胞的细胞群进行细胞生长调节测定。如上所述,在一些实施方案中,并非所有细胞群都含有效应细胞,因为它们在最初装载到本文提供的装置之一上的起始群体中稀有和/或难以富集。本发明允许通过鉴定包含一种或多种效应细胞的细胞群来鉴定这些稀有细胞。
还可以用单个读出细胞或单个室中的异质读出细胞群进行细胞生长调节测定。然而,在许多情况下,希望用同质读出细胞群进行细胞生长调节测定,以允许更准确地测量生长速率。
在一实施方案中,细胞生长调节测定适于筛选产生抑制细胞生长的生物分子的细胞。在另一实施方案中,该方法适于筛选产生分子的细胞,所述分子调节,即增加或降低读出细胞的增殖速率。在一实施方案中,生长速率通过光学显微镜图像的手动或自动细胞计数,表达荧光的细胞的总荧光强度,用稀释染料(例如cfse)标记的细胞的平均荧光强度,细胞核染色或本领域技术人员已知的一些其他方法来测量。
用于测量增殖的市售测定包括
在另一实施方案中,提供凋亡测定以选择包含一种或多种诱导另一种细胞凋亡(即读出细胞或辅助细胞的细胞凋亡)的效应细胞的细胞群。在另一实施方案中,该方法用于鉴定分泌生物分子(例如诱导读出细胞或辅助细胞凋亡的细胞因子或抗体)的效应细胞的存在。参照图21,该测定在包括细胞群的室中进行,所述细胞群包含分泌生物分子232的效应细胞230和分泌生物分子233的效应细胞231。该室还包括包含读出细胞234的均质读出细胞群。效应细胞230和效应细胞231分泌生物分子232和233,其向读出细胞234扩散。生物分子232与读出细胞234结合并诱导读出细胞234的凋亡,而生物分子233不与读出细胞结合。在一实施方案中,可能使用本领域已知的染色剂和其他凋亡标志物(例如,膜联蛋白5,末端脱氧核苷酸转移酶(tdt)介导的dutp缺口末端标记,线粒体膜电位中断等),使用室的显微成像来评估细胞凋亡。在一实施方案中,使用市售染料或试剂盒测量细胞死亡,例如用碘化丙锭(pi),
在一实施方案中,对包含单一效应细胞的细胞群,任选地包含一种或多种效应细胞的细胞群或包含一种或多种效应细胞的细胞群进行细胞凋亡测定。在一实施方案中,细胞凋亡测定用单个读出细胞或异质读出细胞群进行。然而,在许多情况下,需要用同质读出细胞群进行细胞凋亡测定,以允许更准确地评估细胞凋亡。
在另一实施方案中,本文提供的装置和测定用于鉴定分泌生物分子(例如诱导读出细胞自噬的细胞因子或抗体)的效应细胞。该方法的一个实施方案显示在图22中。在该实施方案中,将包含效应细胞441和效应细胞442的细胞群(其中效应细胞441分泌生物分子443)进行测定。所示实施方案还包括异质读出细胞群,其包括显示靶表位449的第一读出细胞444和缺乏该靶表位的第二读出细胞445。效应细胞441分泌生物分子443,其向第一读出细胞444和第二读出细胞445扩散。生物分子443结合第一读出细胞444并诱导第一读出细胞444的自噬,而生物分子443不结合第二读出细胞445。在一实施方案中,使用本领域已知的自噬报告子工程改造的细胞系(例如,flowcellecttmgfp-lc3reporterautophagyassaykit(u20s)(emdmillipore),premotmautophagytandemsensorrfp-gfp-lc3bkit(lifetechnologies)),利用室的显微成像来评估自噬。
在一实施方案中,对包含单一效应细胞的细胞群,任选地包含一种或多种效应细胞的细胞群或包含一种或多种效应细胞的细胞群进行自噬测定。在一实施方案中,用单个读出细胞或异质读出细胞群或均质读出细胞群进行自噬测定。在一实施方案中,使用均质读出细胞群进行测定。
在另一实施方案中,提供了一种用于鉴定效应细胞的存在或选择分泌生物分子(例如抗体)的效应细胞的方法,所述生物分子干扰已知生物分子(例如细胞因子)在读出细胞中诱导响应的能力。响应不受类型的限制。例如,一个实施方案中的响应选自细胞死亡,细胞增殖,报告子的表达,形态的变化,或由该方法的使用者选择的一些其他响应。图23中提供了该方法的一个实施方案。参见图23,所示实施方案包括包含分别分泌生物分子242和243的效应细胞240和效应细胞241的细胞群。所示实施方案还包括包含读出细胞244的同质读出细胞群。效应细胞240和241分泌抗体242和243,其扩散到室内的介质中。室用细胞因子245脉冲,细胞因子245通常对读出细胞244具有已知作用。抗体242结合细胞因子245,从而阻止它们与读出细胞244结合。因此,未观察到预期的响应,表明效应细胞240和241之一分泌能够中和细胞因子245从而刺激读出细胞244发生响应的能力的抗体。
在一实施方案中,细胞因子中和测定用于鉴定包含效应细胞的细胞群的存在,所述效应细胞产生靶向存在于读出细胞上的细胞因子受体的生物分子。在这种情况下,抗体(例如抗体242)与读出细胞244上的细胞因子245的受体246的结合阻断了细胞因子和受体的相互作用,从而不会刺激响应。在另一实施方案中,细胞因子受体被“溶解”或“稳定化”,例如,是通过heptares
在一实施方案中,通过本领域已知的相关信号转导的显微测量来确定对细胞因子的应答,包括但不限于细胞死亡,细胞生长,荧光报告蛋白的表达,细胞组分的定位,细胞形态的变化,运动性,趋化性,细胞聚集等。在一实施方案中,将具有效应细胞的室的应答与缺乏效应细胞的室进行比较,以确定应答是否被抑制。如果应答被抑制,则收集室内的效应细胞用于进一步分析。
在一实施方案中,细胞因子测定在单个装置室内,在包含单一效应细胞的细胞群,任选地包含一种或多种效应细胞的细胞群或包含一种或多种效应细胞的细胞群上进行。该方法在单个装置的多个室中在多个细胞群上平行进行。在一实施方案中,细胞因子测定用单个读出细胞或异质读出细胞群进行。在一实施方案中,该方法用均质读出细胞群进行,以允许更准确地评估对读出细胞的刺激,或者更确切地说是缺乏刺激。
用于此类测定的市售细胞因子依赖性或细胞因子敏感性细胞系的实例包括但不限于tf-1,nr6r-3t3,ctll-2,l929细胞,a549,huvec(人脐静脉内皮细胞),baf3,bw5147.g.1.4.ouar.1(均可从atcc获得),
在一实施方案中,信号转导测定用于鉴定包含一种或多种效应细胞的细胞群,所述效应细胞分泌对读出细胞的受体具有激动剂活性的分子(例如,抗体或细胞因子)。在与受体结合后,对读出细胞群的效应可包括通过荧光报告子的表达,细胞内荧光报告子的易位,生长速率的变化,细胞死亡,形态变化,分化,在读出细胞表面上表达的蛋白的变化等,而可视化的信号转导途径的激活。几种工程化的报告细胞系是可商购的并且可用于实施这种测定。实例包括pathhunter
在一实施方案中,进行病毒中和测定以鉴定和/或选择包含一种或多种分泌生物分子(例如干扰病毒感染靶标读出细胞或靶标辅助细胞的能力的抗体)的效应细胞的细胞群。该方法的一个实施方案显示于图24中。参见图24,所示实施方案包括细胞群,其包含分别分泌生物分子,例如抗体252和253的效应细胞250和效应细胞251。所示实施方案还包括包含读出细胞254的同质读出细胞群。效应细胞250和251分泌生物分子,例如抗体252和253,其扩散到室内的介质中。然后用病毒255(辅助颗粒)脉冲室,病毒255通常感染读出细胞254。抗体252或253结合病毒255,从而防止病毒与读出细胞254结合。如果未观察到预期的感染,则结论是,效应细胞250或251之一分泌能够中和病毒255的抗体。
病毒中和测定可用于鉴定产生生物分子的效应细胞,所述生物分子结合读出细胞上的病毒受体。在这种情况下,抗体例如抗体252与读出细胞254上的病毒255的受体256的结合阻断了病毒和受体的相互作用,从而不会观察到感染。
可以使用本领域已知的方法进行病毒感染的评估。例如,可以将病毒工程化为包括由感染后的读出细胞表达的荧光蛋白,读出细胞内在病毒感染期间上调的荧光蛋白的表达,读出颗粒上捕获和测量的在病毒感染期间增加的来自读出细胞或辅助细胞的蛋白的分泌,读出细胞或辅助细胞的死亡,读出细胞或辅助细胞的形态变化,和/或读出细胞的凝集。
在一实施方案中,细胞外效应测定是病毒中和测定。在一实施方案中,用单个读出细胞或异质读出细胞群进行病毒中和测定。在一实施方案中,该方法用均质读出细胞群进行,以允许更准确地评估对读出细胞的刺激,或者更确切地说是缺乏刺激,以进行响应。用于病毒中和测定的市售细胞系是mdck细胞(atcc),并且cem-nkr-ccr5细胞(nihaidsreagentprogram)可以与本文描述的方法和装置一起使用。
在另一实施方案中,细胞外效应测定是酶中和测定,并且进行以确定效应细胞是否显示或分泌抑制靶酶的生物分子。图25中提供了该方法的一个实施方案。参见图25,所示实施方案包括含有分别分泌分泌生物分子例如蛋白282和283的效应细胞280和效应细胞281的细胞群。所示实施方案还包括均质读出颗粒群,例如珠284,其中靶酶285与其缀合。然而,在另一实施方案中,靶酶285与装置表面连接,或者是可溶的。蛋白282和283通过介质扩散,并且蛋白282与靶酶285结合,从而抑制其活性,而蛋白283不与靶酶结合。在一实施方案中,通过本领域已知的方法(包括但不限于荧光读出,比色读出,沉淀等)评估对室中存在的底物上的酶活性,或者更确切地说酶活性的缺乏的检测。
在另一实施方案中,对每个个体室的包含单个效应细胞的细胞群,任选地包含一种或多种效应细胞的细胞群或包含一种或多种效应细胞的细胞群进行酶中和测定。在一实施方案中,酶中和测定在单个室中用单个读出颗粒进行。在一实施方案中,在多个细胞群上进行酶中和测定以鉴定表现出测定反应变化的细胞群。
在另一实施方案中,提供了用于鉴定效应细胞的存在的测定,所述效应细胞显示或分泌引发第二类效应颗粒活化的分子,所述效应颗粒又分泌对读出颗粒具有效应的分子。因此,在该实施方案中,将单个细胞群提供给各个分析室。图26中提供了该方法的一个实施方案。参见图26,所示实施方案包括细胞群,其包含在其表面上展示分子461(例如,抗体,表面受体,主要组织相容性复合分子等)的一种效应细胞460,其激活不同类型的相邻效应细胞,在这种情况下是效应细胞462,其诱导由读出颗粒464捕获的另一种类型的分子463(例如,细胞因子,抗体)的分泌。在该实例中,读出颗粒464用抗体465或对分泌分子463具有特异性的受体功能化。
在另一实施方案中,效应细胞在被辅助颗粒活化后可以表现出表型的变化,例如增殖,活力,形态,运动性或分化。在这种情况下,效应细胞也是读出颗粒。这种效应可以由辅助颗粒引起和/或由活化的效应细胞通过蛋白的自分泌引起。
参见图27,所示实施方案包括含有分泌分子471(例如,抗体,细胞因子等)的效应细胞470的细胞群,分子471激活不同类型的第二效应细胞,在这种情况下是效应细胞472。一旦激活,效应细胞472分泌由读出颗粒474捕获的分子473(例如,细胞因子,抗体)。在该实例中,读出颗粒474用抗体475或对分泌分子473具有特异性的受体功能化。
如本文所提供的,具有低解离速率的单克隆抗体在存在大背景(在相同室中)的也对相同抗原特异但具有更快的解离速率的单克隆抗体的情况下是可检测的。然而,利用本文提供的装置和方法也可以测量亲和力,因此也可以测量结合速率。这些测量取决于光学系统的灵敏度以及捕获试剂(例如珠)的结合能力。为了测定特异性,可以设计捕获试剂(读出颗粒)以呈递目标表位,使其仅结合具有所需特异性的抗体。
参见图28,所示实施方案包括分泌对相同抗原具有特异性但具有不同亲和力的抗体的同质细胞群。该测定用于鉴定产生具有高亲和力的抗体的效应细胞。效应细胞450和451分泌对靶表位具有低亲和力的抗体453和454(未显示),而效应细胞452分泌对靶表位具有更高亲和力的抗体455。抗体453,454和455被包含读出珠456的均质读出颗粒群捕获。然后将读出珠与荧光标记的抗原(未显示)一起孵育,所述抗原与所有抗体结合。在用未标记的抗原(未显示)洗涤后,荧光标记的抗原仅在读出珠在其表面上显示高亲和力抗体455时保留。
参考图29,在室中提供分泌生物分子例如抗体261的效应细胞260。室还包括读出颗粒群,其包括光学可区分的读出颗粒,例如分别显示不同靶表位264和265的珠262和263。抗体261在室中扩散,其中它与表位264结合,但不与265结合。在一实施方案中,抗体261与表位264的优先结合在珠262的荧光但不是珠263的方面观察到。
在所示实施方案中,珠262和263可通过形状在光学上区分,以评估交叉反应性。然而,读出颗粒也可以通过其他方式区分,例如,一种或多种特征,例如荧光标记(包括不同的荧光波长),不同水平的荧光强度(例如,使用具有不同荧光强度,形态,大小,表面染色和在分析室中的位置的starfiretm珠)。
在一实施方案中,通过使用不同颜色的荧光团,珠262和263在光学上是可区分的。
在一实施方案中,通过包含与效应细胞分泌的抗体竞争结合靶表位的抗体来测量特异性。例如,在一实施方案中,用荧光标记的二抗鉴定与展示抗原的读出颗粒结合的分泌抗体的存在。随后添加由不同宿主产生并且已知结合抗原上的已知靶表位的未标记的竞争抗体,导致仅在分泌的抗体与竞争抗体结合相同的靶表位时,由于分泌的抗体的置换引起的荧光减少。可选地,如果分泌的抗体具有低特异性,则通过添加各种抗原的混合物来测量特异性,所述抗原与靶表位竞争结合分泌的抗体。可选地,通过在珠上捕获分泌抗体然后使用差异标记的抗原来评估分泌的抗体的结合特性,从而测量特异性。
在一实施方案中,鉴定分泌生物分子的效应细胞的存在的方法与分析效应细胞的一种或多种细胞内化合物的存在或不存在相结合。如全文所述,在一实施方案中,效应细胞的鉴定最初包括鉴定包含效应细胞的细胞群。参考图30,将包含至少一种分泌感兴趣的生物分子522(例如,抗体或细胞因子)的效应细胞类型520和另一种不分泌感兴趣的生物分子的效应细胞类型521的细胞群,在存在包含被功能化以捕获感兴趣的生物分子的读出颗粒523的读出颗粒群的情况下孵育。在孵育期后,裂解包括效应细胞类型520和521的细胞群以释放群体中细胞的细胞内容物。读出颗粒523也被功能化以捕获感兴趣的细胞内生物分子524(例如,核酸,诸如抗体的蛋白)。细胞裂解可以通过本领域技术人员已知的不同方法实现。
在一实施方案中,提供了用于鉴定具有所需结合特性的分泌生物分子的多克隆混合物的方法。可以用效应细胞的异质混合物进行测定,该效应细胞产生对靶表位,靶分子或靶细胞类型具有已知亲和力的抗体。然后可以将在混合物背景下靶标的结合与在单独的单个效应细胞的背景下靶标的结合进行比较,以确定例如混合物是否提供增强的效果。
在本文提供的测定的一实施方案中,在读出颗粒与分析室中的细胞群一起孵育后,进行荧光测量以确定群体内的细胞是否显示细胞外效应。在该实施方案中,读出颗粒群(或其亚群)被荧光标记,并且荧光的变化与细胞外效应的存在和/或大小相关。可以直接或间接标记读出颗粒群。如本领域技术人员所理解的,进行这样的测定,其在一个焦平面中提供读出颗粒和效应细胞,以允许精确成像和荧光测量。
在一实施方案中,使用自动化高分辨率显微镜监测读出颗粒响应。例如,可以通过在axiovert200(zeiss)或dmire2(leica)电动倒置显微镜上使用20x(0.4n.a.)物镜来监测成像。使用本文提供的自动显微镜系统允许在大约30分钟内完成对包括约4000个室的阵列的成像,包括1个明视场和3个荧光通道。该平台可适用于各种装置设计,如lecault等人(2011年).naturemethods8,pp.581-586所述,出于所有目的通过引用整体并入本文。重要的是,本文使用的成像方法在有效的正室中实现了足够的信号,同时使对细胞的光损伤最小化。
在一实施方案中,本文提供的细胞外效应测定受益于长期细胞培养,因此需要保持在装置中的效应细胞是活且健康的细胞。应当理解,在读出细胞或辅助细胞用于细胞外效应测定的实施方案中,它们也保持健康状态并且是活的和健康的。本文提供的流体结构能够控制介质条件以维持效应细胞和读出细胞活力,从而可以进行细胞外效应测定。例如,一些细胞类型需要依赖于分泌产物积累的自分泌或旁分泌因子。例如,cho细胞生长速率高度依赖于接种密度。将单个cho细胞限制在4-nl室中对应于250,000个细胞/ml的接种密度,这与常规宏观培养物相当。因为这些细胞在高接种密度下茁壮成长,cho细胞可能不需要多天灌注。然而,其他细胞类型,特别是那些细胞因子依赖的细胞类型(例如,nd13细胞,baf3细胞,造血干细胞),在宏观培养中通常不会达到高浓度,并且可能需要在微流体装置中频繁供给以防止细胞因子耗尽。细胞因子可以添加到介质中或由饲养细胞产生。例如,骨髓来源的基质细胞和嗜酸性粒细胞已被证明可以支持浆细胞的存活,因为它们产生il-6和其他因子(wols等人(2002).journalofimmunology169,pp.4213-21);chu等人(2011),natureimmunology2,pp.151-159,通过引用整体并入本文)。在这种情况下,可以调节灌注频率以允许旁分泌因子的充分积累,同时防止营养物耗尽。
如全文所提供的,本发明的一个方面提供了用于确定任选地包含一种或多种效应细胞(例如,asc)的细胞群是否对读出颗粒(例如,包含细胞表面受体的细胞)发挥细胞外效应的方法。在一实施方案中,效应细胞是asc。在一实施方案中,细胞外效应是对读出细胞上的细胞表面受体(例如,抗体分泌细胞分泌的抗体的激动剂和/或拮抗剂特性)的抑制(拮抗作用)或激活(激动作用)。在另一实施方案中,细胞外效应是对跨膜蛋白的激动剂或拮抗剂作用,在另一实施方案中,跨膜蛋白是g蛋白偶联受体(gpcr),受体酪氨酸激酶(rtk),离子通道或abc转运蛋白。在进一步的实施方案中,受体是细胞因子受体。除了gpcr和rtk之外,还可以评估对其他代谢型受体的细胞外效应。例如,可以通过将细胞群与表达鸟苷酸环化酶受体的读出细胞群一起孵育来评估对鸟苷酸环化酶受体的细胞外效应。
在使用读出细胞的实施方案中,读出细胞可以是活动的或固定的。在一实施方案中,细胞外效应是对固定读出细胞的细胞内蛋白的效应。还可以在活动的或固定的读出细胞的细胞外蛋白或活的读出细胞的分泌蛋白上测量细胞外效应。
在另一实施方案中,读出细胞表达丝氨酸/苏氨酸激酶受体或组氨酸激酶相关受体,并且细胞外效应测定测量细胞受体的结合,激动作用或拮抗作用。
在特定受体(例如,受体丝氨酸/苏氨酸激酶,组氨酸激酶相关受体或gpcr)是孤儿受体(即,用于激活特定受体的配体是未知的)的实施方案中,本文提供的方法允许通过对表达孤儿受体的读出细胞进行细胞外测定来发现特定孤儿受体的配体,并鉴定包含效应细胞的细胞群或亚群,该效应细胞负责引发表达孤儿受体的读出细胞上的细胞外效应的变化(例如,与对照值相比,对孤儿受体的激动作用或拮抗作用)。
在一实施方案中,读出细胞表面上的细胞表面蛋白是跨膜离子通道。在另一实施方案中,离子通道是配体门控离子通道,并且在测定中测量的细胞外效应是离子通道门控的调节,例如通过激动剂结合打开离子通道或通过拮抗剂结合闭合/阻断离子通道。拮抗剂或激动剂可以是例如由一种或多种效应细胞分泌的生物分子(例如抗体)。本文所述的细胞外效应测定可用于测量效应细胞对表达cys环超家族中的配体门控离子通道,离子移变型谷氨酸受体和/或atp门控离子通道的细胞的细胞外效应。阴离子cys-环离子门控通道的具体实例包括gabaa受体和甘氨酸受体(glyr)。阳离子cys-环离子门控通道的具体实例包括羟色胺(5-ht)受体,烟碱乙酰胆碱(nachr)和锌激活的离子通道。一种或多种上述通道可以由读出细胞表达,以通过激动或拮抗离子通道来确定效应细胞是否对各细胞具有细胞外效应。离子通量测量通常在短时间内(即几秒到几分钟)发生,并且需要精确的流体控制来实现它们。在一实施方案中,在首先鉴定分泌的分子与读出细胞结合后进行离子通量测量。可以使用作为钙通量指示剂的荧光染料进行离子通量测量。市售离子通道测定的实例包括fluo-4-directcalciumassaykit(lifetechnologies),fliprmembranepotentialassaykit(moleculardevices)。表达离子通道的细胞系也是可商购的(例如precisiontm细胞系,emdmillipore)。
在一实施方案中,读出细胞在其表面上表达atp结合盒(abc)转运蛋白,并且细胞外效应测定包括测量底物跨膜的转运。读出颗粒可以是源自表达蛋白的细胞的膜囊泡(例如,genomembraneabctransportervesicles(lifetechnologies)),其可以固定在珠上。例如,abc转运蛋白可以是通透性糖蛋白(多药抗性蛋白),并且可以通过读出细胞中钙黄绿素的荧光强度来测量该效应。vybranttm多药物抗性测定试剂盒(molecularprobes)可商购获得以实施这种测定。
还可以通过使用表达离子移变型谷氨酸受体,例如ampa受体(glua类),红藻氨酸受体(gluk类)或nmda受体(glun类)的读出细胞,进行细胞外效应测定。类似地,还可以通过使用表达atp门控通道或磷脂酰肌醇4-5-二磷酸(pip2)-门控通道的读出细胞进行细胞外效应测定。
本发明提供鉴定细胞群的方法,所述细胞群包含显示细胞外效应变化的效应细胞。在一实施方案中,该方法包括在单独的分析室中保留多个单独的细胞群,其中至少一个单独的细胞群包含一种或多种效应细胞,并且单独的分析室的内容物还包含含有一种或多种读出颗粒的读出颗粒群;在分析室内孵育单独的细胞群和读出颗粒群;测定单独的细胞群中细胞外效应的存在,其中读出颗粒群或其亚群提供细胞外效应的读出。在一实施方案中,细胞外效应是对受体酪氨酸激酶(rtk)的效应,例如,与rtk的结合,rtk的拮抗作用或rtk的激动作用。rtk是许多多肽生长因子,细胞因子和激素的高亲和力细胞表面受体。迄今为止,在人类基因组中已鉴定出约60种受体激酶蛋白(robinson等人(2000).oncogene19,pp.5548-5557,出于所有目的通过引用整体并入)。rtk已被证明可调节细胞过程并在许多类型的癌症的发展和进展中起作用(zwick等人(2001).endocr.relt.cancer8,pp.161-173,为了所有目的通过引用整体并入本文)。
在细胞外效应是对rtk的效应的情况下,本发明不限于特定的rtk类别或成员。已经鉴定了大约20种不同的rtk类别,并且可以用本文提供的方法和装置筛选对这些类别中的任何一类的成员的细胞外效应。表2提供了不同的rtk类别和每个类别的代表性成员,当在读出颗粒(例如读出细胞或囊泡)上表达时,每个类别都适用于本文。在一实施方案中,本文提供了一种用于以平行方式筛选多个细胞群,以鉴定包含对表2中提供的亚类之一的rtk具有细胞外效应的效应细胞的一个或多个群体的方法。在一实施方案中,该方法进一步包括回收包含显示细胞外效应的asc的一种或多个细胞群,以提供回收的细胞群,并进一步使回收的细胞群在有限稀释下进行一种或多种额外的细胞外效应测定,以鉴定负责细胞外效应的asc。在该实施方案中,可以将回收的群体以有限稀释分成亚群。额外的细胞外效应测定可以通过本文提供的装置之一或台式测定进行。可选地,一旦鉴定出具有对rtk表现出细胞外效应的细胞的细胞群,则回收细胞群,裂解并扩增核酸并测序。在进一步的实施方案中,核酸包含一种或多种抗体基因。
在一实施方案中,本发明涉及鉴定包含效应细胞的细胞群,所述效应细胞,例如,通过分泌产物,例如单克隆抗体拮抗或激动rtk(即细胞外效应)。效应细胞存在单独的效应细胞,同质环境或异质环境(例如,具有多种不同的效应细胞)中。
在一实施方案中,rtk是血小板衍生的生长因子受体(pdgfr),例如pdgfrα。pdgf是可溶性生长因子(a,b,c和d)的家族,其组合形成多种同源和异源二聚体。这些二聚体被两种密切相关的具有不同特异性的受体pdgfrα和pdgfrβ识别。特别地,pdgfα选择性结合pdgfrα,并且已显示在纤维化疾病(包括肺纤维化,肝硬化,硬皮病,肾小球硬化和心脏纤维化)中驱动病理性间充质反应(参见andrae等人(2008).genesdev.22,第1276-1312页,其通过引用整体并入本文。还已显示小鼠中pdgfrα的组成型活化导致多个器官中的进行性纤维化(olson等人(2009).dev.cell16,pp.303-313,其通过引用整体并入本文)。因此,抑制pdgfrα的疗法具有治疗纤维化的高潜力,这种病症使高达40%的疾病复杂化并且代表了老龄化人群中巨大的未满足的医学问题。尽管已经探索了抗体(伊马替尼和尼罗替尼)作为pdgfrα的抑制剂,但每种抗体对其他中枢rtk(包括c-kit和flt-3)具有显著的脱靶效应,导致许多副作用。因此,虽然伊马替尼和尼罗替尼可有效抑制pdgfrα和pdgfrβ,但它们的副作用使它们在纤维化疾病的治疗中不可接受,突出了高度特异性抗体抑制剂的潜力。在一实施方案中,与伊马替尼和尼罗替尼相比,本发明通过提供具有更高pdgfrα特异性的抗体克服了该问题。
先前已将pdgfrα确立为治疗纤维化的靶标。进入用于治疗癌症的早期临床试验的两种抗人pdgfrαmab拮抗剂正在开发中(参见,例如,shah等人(2010).cancer116,pp.1018-1026,其通过引用整体并入本文)。本文提供的方法有助于鉴定结合pdgfrα的效应细胞分泌产物。在另一实施方案中,分泌产物在癌症和纤维化模型中都阻断人和鼠pdgfrα的活性。
用于确定效应细胞分泌产物是否结合pdgfrα的细胞外效应测定的一个实施方案基于悬浮细胞系(例如,32d和ba/f3)的使用,该悬浮细胞系严格依赖于细胞因子il-3来存活和生长,但可以通过表达和激活几乎任何酪氨酸激酶来治愈这种“il-3成瘾”。该方法首先由dailey和baltimore用于评估bcr-abl融合癌基因,并且已广泛用于小分子酪氨酸激酶抑制剂的高通量筛选(参见,例如,warmuth等人(2007).curr.opin.oncology19,pp.55-60;daley和baltimore(1988).proc.natl.acad.sci.usa85,pp.9312-9316,各自为了所有目的通过引用整体并入本文)。为了监测信号转导,pdgfrα和pdgfrβ(人和小鼠形式)在32d细胞(读出细胞)中表达,所述32d细胞是不天然表达任一受体的鼠造血细胞系。这允许每个途径的分离,否则这是困难的,因为两种受体通常共表达。先前已证实人pdgfrα/β在32d细胞中的表达产生功能性pdgf诱导的促有丝分裂反应(matsui等(1989).proc.natl.acad.sci.usa86,pp.8314-8318,通过引用整体并入)。在不存在il-3的情况下,32d细胞根本不分裂,但是对表达rtk的细胞的pdgf刺激减轻了对il-3的需求并且提供了可通过显微镜检测到的快速促有丝分裂反应。在一实施方案中,可检测的应答是在拮抗剂存在下的细胞增殖,形态变化,增加的运动性/趋化性或细胞死亡/细胞凋亡。在一实施方案中,光学多重方法用于同时测量本文提供的装置之一中pdgfrα和pdgfrβ应答的抑制/活化。在另一实施方案中,在本文提供的装置之一中抑制/激活pdgfrα和pdgfrβ应答通过在同一分析室中连续进行的两种细胞外测定来测量。
在一实施方案中,使用修饰的pcmv表达载体在32d细胞(atcc;crl-11346)中表达人/小鼠pdgfrα和pdgfrβ(sinobiological)的全长cdna,从而制作两种类型的“读出细胞”,每种“读出细胞”可通过荧光成像区分,所述pcmv表达载体还包括具有gfp或rfp的ires序列。读出细胞被表征以优化介质和供养条件,确定对pdgf配体的剂量反应,并表征响应的形态和动力学。悬浮细胞(例如32d或ba/f3)的使用提供了以下优点:通过图像分析容易地识别单个细胞,并且物理上比贴壁细胞更小(在投影区域中),使得单个室可以容纳到达汇合之前的≥100个读出细胞。在另一实施方案中,代替32d细胞,使用ba/f3细胞(其是另一种与32d具有相似特性的il-3依赖性小鼠细胞系)作为读出细胞。32d和ba/f3细胞均源自骨髓,在针对asc优化的介质中生长良好,并分泌il-6,il-6是维持asc的关键生长因子(参见,例如,cassese等人(2003).j.immunol.171,pp.1684-1690,通过引用整体并入本文)。
已经开发了用于评估pdgfrα在纤维化中的作用的临床前模型,并且可以用于细胞外效应测定中。具体地,可以使用下面讨论的两种心脏纤维化模型。第一种是基于缺血性损伤(异丙肾上腺素诱导的心脏损伤;icd),第二种是基于冠状动脉结扎诱导的心肌梗塞(mi)。在损伤时,纤维化反应由pdgfrα+/sca1+阳性祖细胞(占响应损伤后增殖的细胞的50%以上)的快速扩增引发,随后将这些后代分化成基质,产生pdgfrα低/sca1低肌成纤维细胞。通过rt-qpcr进行的基因表达显示了与纤维化基质沉积相关的多种标志物的表达,包括α-平滑肌肌动蛋白(αsma)和i型胶原(col1),其在(sca1+)祖细胞中可检测到,但在分化的群体中大幅上调。在一实施方案中,鉴定细胞群,其包含分泌单克隆抗体的效应细胞,所述单克隆抗体减弱祖细胞扩增,导致纤维化减少。通过监测两种独立标志物来进行这种细胞外效应测定:sca1+/pdgfrα+祖细胞和coli驱动的gfp的早期增殖。具体地,在mi之后,纤维化反应的特征在于首先在pdgfrα+/sca1+祖细胞中的gfp表达,并且随后在新出现的肌成纤维细胞群中具有增加的强度。
在一实施方案中,细胞外效应测定是gpcr细胞外效应测定,例如gpcr结合,激动或拮抗。如本文所述,细胞外效应不需要归因于群体中的每个细胞,或甚至多个细胞。相反,当效应细胞存在于包含数十至数百个细胞(例如,约10至约250个细胞,或者10至约100个细胞),或包含约2至约50个细胞,例如约2至约10个细胞的异质群体中时,本文提供的方法允许检测单个效应细胞的细胞外效应。。
gpcr是七跨膜受体的超家族,其在人类基因组中包括超过800个成员。每个gpcr的氨基末端位于细胞的细胞外表面,c末端尾部面向细胞质基质。在细胞内部,gpcr与异源三聚体g蛋白结合。在激动剂结合后,gpcr经历构象变化,其导致相关g蛋白的活化。其中大约一半是嗅觉受体,其余的响应于从钙和代谢物到细胞因子和神经递质的不同配体的全范围。在一实施方案中,本发明提供了选择一种或多种对gpcr具有细胞外效应的asc的方法。细胞外效应测定可以使用任何gpcr,只要它可以在读出颗粒例如读出细胞,或辅助颗粒例如辅助细胞上表达。
与特定gpcr天然相关的g蛋白类型决定了转导的细胞信号转导级联。对于gq偶联受体,由受体激活产生的信号是细胞内钙水平的增加。对于gs偶联受体,观察到细胞内camp的增加。对于构成所有gpcr的50%的gi偶联受体,活化导致camp产生的抑制。对于效应细胞特性是激活gi偶联的gpcr的实施方案,有时需要用腺苷酸环化酶的非特异性激活剂刺激读出细胞。在一实施方案中,腺苷酸环化酶活化剂是毛喉素。因此,一种或多种效应细胞激活gi偶联受体将阻止毛喉素诱导的camp增加。因此,毛喉素可用作本文提供的一种或多种gpcr细胞外效应测定中的辅助颗粒。
在一实施方案中,本发明提供了用于确定细胞群内的效应细胞(例如asc)是否对gpcr表现出细胞外效应的手段。gpcr存在于分析室中的一种或多种读出颗粒上,并且在一实施方案中,细胞外效应是与gpcr结合,例如,证明的亲和力或特异性,抑制或活化。gpcr可以是稳定化的gpcr,例如通过heptarestherapeutics的方法制备的gpcr之一(稳定化的受体,
在另一实施方案中,细胞外效应是对内皮分化,g蛋白偶联(edg)受体的效应。edg受体家族包括11种gpcr(s1p1-5和lpa1-6),其负责脂质信号转导并结合溶血磷脂酸(lpa)和1-磷酸鞘氨醇(s1p)。通过lpa和s1p的信号转导调节健康和疾病中的许多功能,包括细胞增殖,免疫细胞活化,迁移,侵袭,炎症和血管生成。在产生针对该家族的有效和特异性的小分子抑制剂中几乎没有成功,使得mab成为非常有吸引力的替代物。在一实施方案中,edg受体是s1p3(edg3),s1pr1(edg1),后者已显示在包括乳腺癌,淋巴瘤,卵巢癌和黑素瘤在内的癌症中激活nf-κb和stat3,并且在免疫细胞运输和癌症转移中起关键作用(milstien和spiegel(2006).cancercell9,pp.148-15,通过引用整体并入本文)。用于治疗晚期实体瘤的中和s1p配体的单克隆抗体(sonepcizumab)最近完成了的ii期试验(nct00661414)。在一实施方案中,本文提供的方法和装置用于鉴定和分离这样的asc,其分泌比sonepcizumab具有更大亲和力的抗体或分泌比sonepcizumab更大程度抑制s1p的抗体。在另一实施方案中,细胞外效应是对lpa2(edg4)受体的效应。lpa2在甲状腺癌,结肠癌,胃癌和乳腺癌以及许多卵巢肿瘤中过表达,其中lpa2是lpa敏感性和有害作用的主要贡献者。
在一实施方案中,测定细胞群中的一种或多种是否对读出颗粒上存在的趋化因子受体表现出细胞外效应。在进一步的实施方案中,趋化因子受体是c-x-c趋化因子受体4型(cxcr-4),其也称为融合蛋白或cd184。cxcr4结合sdf1α(cxcl12),一种强大的免疫细胞募集趋化因子,也称为c-x-c基序趋化因子12(cxcl12)。dna免疫用于产生针对该靶标的92个杂交瘤,其中75个表现出不同的链用量和表位识别(geneticeng和biotechnews,2013年8月),表明杂交瘤选择仅捕获可用抗体多样性的一小部分。通过cxcr4/cxcl12轴的信号转导已被证明在肿瘤细胞生长,血管生成,细胞存活中发挥重要作用,并且参与介导产生cxcl12的器官如肝和骨髓中继发性转移的生长(teicher和fricker(2010).clin.cancerres.16,pp.2297-2931,通过引用整体并入本文)。
在另一实施方案中,筛选细胞群对趋化因子受体cxcr7发挥作用的能力,最近发现趋化因子受体cxcr7与sdf1α结合。与通过经典g蛋白偶联发出信号的cxcr4不同,cxcr7通过β-抑制蛋白途径独特地发出信号。
在另一实施方案中,gpcr是蛋白酶活化受体(par1,par3和par4),其是一类通过凝血酶介导的暴露的n-末端切割而活化的gpcr并参与纤维化。在另一实施方案中,gpcr是下表3a或表3b中的gpcr之一。
经工程改造以提供结合,活化或抑制的读出的表达gpcr的细胞系,可从例如lifetechnologies(geneblazer和tangotm细胞系),discoverx,cisbio,perkinelmer商购获得,并且适用于本文所述的gpcr细胞外效应测定,例如,作为读出细胞。
在一实施方案中,来自以下受体家族之一的gpcr在一种或多种读出细胞上表达,并且针对以下一种或多种gpcr测量细胞外效应:乙酰胆碱受体,腺苷受体,肾上腺素受体,血管紧张素受体,缓激肽受体,降钙素受体,钙敏感受体,大麻素受体,趋化因子受体,胆囊收缩素受体,补体成分(c5ar1),促肾上腺皮质激素释放因子受体,多巴胺受体,内皮分化基因受体,内皮素受体,甲酰肽样受体,甘丙肽受体,胃泌素释放肽受体,受体胃饥饿素受体,胃抑制多肽受体,胰高血糖素受体,促性腺激素释放激素受体,组胺受体,kisspeptin(kiss1)受体,白三烯受体,黑色素浓缩激素受体,黑皮质素受体,褪黑素受体,胃动素受体,神经肽受体,烟碱尼克酸,阿片受体,食欲素受体,孤儿受体,血小板活化因子受体,前动力蛋白受体,催乳素释放肽,前列腺素受体,蛋白酶激活受体,p2y(嘌呤能)受体,松弛素受体,促胰液素受体,血清素受体,生长抑素受体,速激肽受体,加压素受体,催产素受体,血管活性肠肽(vip)受体或垂体腺苷酸环化酶激活多肽(pacap)受体。
在一实施方案中,通过表4中提供的一种或多种测定法测定效应细胞对表达gpcr的读出细胞的细胞外效应。在另一实施方案中,读出颗粒群包含用膜提取物(购自integralmolecular)或稳定化的溶解的gpcr(例如heptares)功能化的囊泡或珠。在将顶部和底部组件组合在一起之前,通过在装置的顶部组件中形成的微通道将读出颗粒添加到室中,或者直接将读出颗粒添加到底部组件的开放室中。
gpcr可被磷酸化并与称为抑制蛋白的蛋白相互作用。测量抑制蛋白激活的三种主要方法是:(i)显微镜检查-使用荧光标记的抑制蛋白(例如gfp或yfp);(ii)酶互补;(iii)使用tangotm报告系统(β-内酰胺酶)(promega)。在一实施方案中,tangotm报告系统用于读出颗粒或多个读出颗粒中。该技术使用通过可切割接头与转录因子连接的gpcr。抑制蛋白与减弱的蛋白酶融合。一旦抑制蛋白结合gpcr,蛋白酶和接头的高局部浓度导致接头切割,将转录因子释放到细胞核中以激活转录。β-内酰胺酶测定可以在活细胞上进行,不需要细胞裂解,并且可以在短至6小时的激动剂孵育中成像。
在一实施方案中,可以普遍用于检测gpcr信号转导的拮抗剂和激动剂的β-抑制蛋白gpcr测定法用于本文提供的方法和装置中以鉴定分泌结合gpcr的生物分子的效应细胞(rossi等人(1997).proc.natl.acad.sci.usa94,pp.8405-8410,出于所有目的通过引用整体并入)。该测定法基于β-半乳糖苷酶(β-gal)酶互补技术,现在由discoverx商业化。gpcr靶标与β-gal酶的小n末端片段框内融合。在gpcr活化后,含有与β-gal的n-末端序列连接的β-抑制蛋白的第二种融合蛋白与gpcr结合,导致功能性β-gal酶的形成。然后β-gal酶迅速将非荧光底物di-β-d-吡喃半乳糖苷(fdg)转化为荧光素,提供大的扩增和优异的灵敏度。在该实施方案中,在引入一个或多种装置个之前,将读出细胞(具有gpcr)预装有细胞可渗透的前底物(乙酰化fdg)。通过酯酶切割乙酸酯基团将前底物转化为细胞不可渗透的fdg。尽管荧光素被主动地从活细胞中转运出来,但是通过在分析室内实施该测定,荧光产物被浓缩,提供了比基于板的测定大大增强的灵敏度。discoverx已经通过大量gpcr验证了这种用于微孔形式中的分析策略。
在一实施方案中,通过检测读出细胞中细胞溶质钙的增加来确定效应细胞对gpcr的活化。在另一实施方案中,用一种或多种钙敏感染料检测细胞溶质钙的增加。钙敏感染料在没有钙的情况下具有低水平的荧光,并且一旦被钙结合就会经历荧光特性的增加。荧光信号在约1分钟时达到峰值,并且可在5到10分钟的窗内检测到。因此,为了使用荧光钙检测活性,激动剂的检测和添加紧密偶联。为了实现这种偶联,将效应细胞同时暴露于读出细胞群和一种或多种钙敏感染料。在一实施方案中,一种或多种钙敏感染料是fliprtm钙测定(moleculardevices)中提供的染料。
在一实施方案中,重组表达的水母光蛋白,水母素,用于功能性gpcr筛选,即其中细胞外效应是gpcr的调节的细胞外效应测定中。水母素是钙敏感的报告蛋白,当加入腔肠素衍生物时,其产生发光信号。gpcr与线粒体靶向形式的脱辅基水母素一起表达的工程化细胞系可商购获得(euroscreen)。在一实施方案中,可从euroscreen获得的一种或多种细胞系用作评估效应细胞的细胞外效应的方法中的读出细胞群(例如,与另一细胞群或对照值相比细胞外效应的变化)。
在一实施方案中,通过使用表达gpcr和环核苷酸门控(cng)通道的actone细胞系之一(codexbiosolutions)作为读出细胞群来测量对gpcr的细胞外效应。在该实施方案中,细胞外效应测定法与含有外源性环核苷酸门控(cng)通道的细胞系一起起作用。通道被camp的升高的细胞内水平激活,这导致离子流(通常可通过钙响应染料检测)和细胞膜去极化,其可用荧光膜电位(mp)染料检测。actonecamp测定允许用荧光酶标仪进行细胞内camp变化的终点和动力学测量。
在一实施方案中,报告基因测定用于确定效应细胞是否调节特定gpcr(例如,包含效应细胞的细胞群是否调节特定gpcr)。在该实施方案中,gpcr的调节是评估的细胞外效应。在一实施方案中,报告基因测定基于gpcr第二信使,例如钙(ap1或nfat反应元件)或camp(cre反应元件),以激活或抑制位于最小启动子上游的响应元件,其反过来调节由用户选择的报告蛋白的表达。在一实施方案中,报告子的表达与通过gpcr信号转导激活的转录因子的响应元件偶联。例如,报告基因表达可以与以下转录因子之一的响应元件偶联:atf2/atf3/aft4,creb,elk1/srf,fos/jun,mef2,gli,foxo,stat3,nfat,nfκb。在进一步的实施方案中,转录因子是nfat。报告基因测定可商购获得,例如来自sabiosciences。
报告蛋白是本领域已知的,并且包括例如β-半乳糖苷酶,荧光素酶(参见,例如,paguio等人(2006)。“usingluciferasereporterassaystoscreenforgpcrmodulators,”cellnotesissue16,pp.22-25;dual-glotmluciferaseassaysystemtechnicalmanual#tm058;pgl4luciferasereportervectorstechnicalmanual#tm259,各自通过引用整体并入本文),绿色荧光蛋白(gfp),黄色荧光蛋白(yfp),青色荧光蛋白(cfp),β-内酰胺酶。用于测量gpcr信号转导的报告基因测定法可商购获得,并可用于本文所述的方法和装置中。例如,lifetechnologies的
在一实施方案中,进行报告细胞中g蛋白的过表达以迫使camp偶联的gpcr通过钙发信号,称为力偶联。
在一实施方案中,gq偶联细胞系用作本文所述方法中的读出细胞系。在一实施方案中,gq偶联细胞系通过β-内酰胺酶报告gpcr信号转导。例如,可以使用基于细胞的gpcr报告细胞系
camp响应元件结合蛋白(creb)是如上所述的转录因子,并且在一实施方案中用于gs和/或gi偶联的gpcr。在进一步的实施方案中,毛喉素用作辅助颗粒。cre报告子以质粒或慢病毒形式获得以驱动从sabiosciences的gfp表达,并且适合与本文所述的方法和装置一起使用。例如,在一实施方案中,可从sabiosciences获得的测定系统用于本文以产生读出细胞(http://www.sabiosciences.com/reporter_assay_product/html/ccs-002g.html)。lifetechnologies还具有表达特定gpcr的cre响应细胞系,并且这些细胞系可用于本文所述的方法以及读出细胞。
在一实施方案中,通过检测一种或多种读出细胞内的camp水平的增加或降低,测定存在于细胞群中的一种或多种效应细胞激活或拮抗一种或多种读出细胞上存在的gpcr的能力。基于elisa的测定,均相时间分辨荧光(htrf)(参见degorce等人(2009).currentchemicalgenomics3,pp.22-32,其公开内容通过引用整体并入)和酶互补均可以与本文提供的装置和测定一起使用以确定读出细胞中的camp水平。这些camp检测方法中的每一种都需要细胞裂解以释放camp用于检测,因为它是实际测量的环amp。
用于测量全细胞中的camp和用于测量膜中的腺苷酸环化酶活性的测定是可商购的(参见,例如,gabriel等人(2003).assaydrugdev.technol.1,pp.291-303;williams(2004).nat.rev.drugdiscov.3,pp.125-135,各自通过引用整体并入本文),并且适用于本文提供的装置和方法。也就是说,可以根据这些方法测定一个或多个分析室中的细胞群。
cisbiointernational(codolet,france)已开发出灵敏的高通量同源camp测定(htrf,参见degorce等人(2009).currentchemicalgenomics3,pp.22-32,其公开内容通过引入整体并入),其基于时间分辨的荧光共振能量转移技术,并且可以在本文中用于筛选对gpcr表现出作用的效应细胞。该方法是由细胞产生的天然camp和camp标记的染料(camp-d2)之间的竞争性免疫测定。通过用cryptate标记的mab抗camp可视化camp-d2结合。特定信号(即能量转移)与样品中camp的浓度(在这种情况下,是效应细胞或效应细胞分泌产物在读出细胞中激活的camp的量)成反比。当测量camp时,首先裂解读出细胞以释放camp用于检测。该测定已经验证了gs-(β2-肾上腺素能,组胺h2,黑皮质素mc4,cgrp和多巴胺d1)和gi/o偶联(组胺h3)受体。与本文所述的其他测定一样,组分可以直接引入底部组件的室中,例如,通过暴露装置的底部组件并在底层的室中移液含有组分的溶液,或通过底部组件的室上方流动的第二组件中的通道。在一实施方案中,通过液柱产生的静水压力,通过使用诸如移液管的分配仪器产生流动,或通过更换底部组件上方的介质并上下移动顶部组件或底部组件以引起流体转移到微室,来实现将试剂/介质递送到室。
基于荧光偏振的camp测定试剂盒也可商购获得,例如来自perkinelmer,moleculardevices和gehealthcare,并且各自适合用作本文提供的方法和装置中的细胞外效应测定。因此,本发明的一个实施方案包括基于camp荧光偏振测定的结果选择效应细胞和/或包含一种或多种效应细胞的细胞群。在一实施方案中,该方法用于确定效应细胞是激活(激动作用)还是抑制(拮抗作用)特定的gpcr。
在一实施方案中,来自perkinelmer的alphascreentmcamp测定,一种需要激光活化的基于敏感珠的化学发光测定法,用于本文提供的装置中以筛选对读出细胞具有作用(具体地,激活或抑制gpcr)的效应细胞。
discoverx(http://www.discoverx.com)提供基于使用荧光或发光底物的专利酶(β-半乳糖苷酶)互补技术,称为hithuntertm的同源高通量camp测定试剂盒(eglen和singh(2003).combchem.highthroughputscreen6,pp.381-387;weberetal.(2004).assaydrugdev.technol.2,pp.39-49;englen(2005).comb.chem.highthroughputscreen8,pp.311-318,各自通过引用整体并入本文)。该测定可用于检测在表达gpcr的读出细胞上展示细胞外效应的效应细胞。
还可以检测由gpcr受体激活或抑制引起的细胞事件,以确定效应细胞在读出细胞上的特性(例如,产生细胞的激活或拮抗的能力的抗体)。例如,在gq偶联受体的情况下,当gpcr被激活时,gq蛋白被激活,这导致磷脂酶c切割膜磷脂。该切割导致肌醇三磷酸3(ip3)的产生。游离ip3与其在内质网表面的靶标结合,导致钙的释放。钙激活特定的钙响应转录载体,例如活化t细胞的核因子(nfat)。因此,通过监测nfat活性或表达,建立了读出细胞中gpcr的间接读出。参见,例如,crabtree和olson(2002).cell109,pp.s67-s79,通过引用整体并入本文。
一旦被激活,所有gpcr的超过60%被内化。利用标记的gpcr(通常用c-末端gfp标签完成),在一实施方案中,受体的分布在配体存在和不存在下成像。在配体刺激时,通常均匀分布的受体通常表现为内吞的斑点。
可以使用仪器评估读出颗粒响应,所述仪器能够在多个荧光通道中进行更快速的成像,同时保持细胞活力所需的条件,然后自动回收所选择的单个细胞,并将回收的细胞沉积到适合于高通量基因组分析的微孔板中(图31)。在一实施方案中,仪器包括计算机控制和软件自动化,配备有自动x-y平移台的倒置荧光显微镜(其具有精密编码器,电动聚焦,高分辨率相机,快速荧光照明系统,用于维持温度,湿度和二氧化碳气体水平的环境罩,以及可以引导微量移液管从任何选定的室中回收细胞的自动的显微操作自动设备),以及其中可以沉积回收的细胞临近的多壁板。在一实施方案中,所述仪器与双组件微流体装置结合使用,所述双组件微流体装置允许在回收细胞之前移除所述装置的顶部。在一实施方案中,使用仪器的自动操纵器自动移除装置的顶部组件。在另一实施方案中,仪器用于分析包含开放阵列的装置内的细胞,并且定位固体片用于在成像期间在阵列顶部挤出介质。在一实施方案中,仪器用于分析以开放式室阵列为特征的装置内的细胞。在一实施方案中,仪器配置有具有开放式室阵列的装置,其中每个室的高度/深度大于其最小横向尺寸。在一实施方案中,使用电磁阀或蠕动泵自动将试剂递送到微流体装置中。在一实施方案中,仪器与图像分析软件一起使用以允许快速确定含有感兴趣的效应细胞的室。在一实施方案中,微流体的、双组件微流体的或开放的室阵列具有至少10,000个室,至少100,000个室,或至少1,000,000个室。在一实施方案中,仪器被配置用于使用宽视场显微镜物镜和高分辨率相机进行快速成像,使得可以在单个图像中成像多于8个室。在一实施方案中,仪器被配置用于使用宽视场显微镜物镜和高分辨率相机进行快速想象,使得可以在单个图像中成像大于约10个,或大于约15个,或大于约16个室。应当理解,可以在一个视场中成像的室的数量将取决于室的总密度,并且较高密度的室将允许更大的总成像速度。在本发明的上下文中,最大室密度由容纳至少一个细胞和至少一个读出颗粒所需的室的所需面积确定,所述读出颗粒可以是细胞或珠。虽然这个最小尺寸为约10μm×10μm=100μm2,但实际上希望具有更大的室面积以促进随机装载策略,其实现每个室多于一个读出颗粒,以提供足够的区域来在室中分散颗粒或细胞,从而促进成像,并且能够进行每个室更多数量的细胞或颗粒的测定。室横向尺寸为约25μm×25μm,或约50μm×50μm或约75μm×75μm或约100μm×100μm或约150μm×150μm或约200μm×200μm,或约300可以使用μm×300μm。如果在室之间提供约25μm的间隔,则这对应于约400/mm2或约178/mm2或约100/mm2或约33/mm2或约20/mm2或约9/mm2的室密度。
实施例
通过参考以下实施例进一步说明本发明。然而,应该注意的是,这些实施例与上述实施方案一样,是说明性的,不应解释为以任何方式限制本发明的范围。
实施例1-对双组件微流体装置的均匀装载
通过将多种类型的微粒装载到装置的底部组件的开放室中来评估装载包括各个微流体室的阵列的双组件微流体装置的效率。微流体室的尺寸为80μm×120μm×160μm(宽度,长度,高度)。
制备甚至浓度为约1,000,000个珠/ml的五个微颗粒群,每个微颗粒群由5μm直径的用不同浓度的荧光团标记的聚苯乙烯珠组成。将五个群体中的每一个以相等的体积比在单个管中混合在一起。将含有约100,000个总微珠的100μl等分试样的混合物引入具有大约10,000个总室的双组件微流体装置的底层部分。这相当于每个室约10个珠。
然后将该装置孵育20分钟以使珠沉降到室中。然后除去室中的介质,通过在阵列上流动新鲜介质洗涤室。将装置的第二层放置在底部室层的顶部上方。然后将微流体室阵列的10,000个室以荧光成像,并使用自动图像分析来确定室内每种珠类型的分布。该分析显示珠在室中的分布基本均匀,每个珠类型检测到每个室的以下平均珠数和标准偏差:
类型1=0.53/室,sd=0.89;
类型2=1.46/室,sd=1.4;
类型3=2.45/室,sd=1.89;
类型4=3.90/室,sd=2.33;
类型5=2.89/室,sd=1.70。
对图像子集的手动检查显示,1型珠的低测量频率主要是由于图像分析软件未能检测到该珠类型。这可归因于具有最低荧光染料浓度的1型珠粒。如通过视觉检查装置的不同区域上的珠接种密度确定的,珠分布的空间均匀性的定性分析表明,与通过输入通道将珠装载到微流体室中时所获得的这些特性相比是优越的。
实施例2-对双组件微流体装置的细胞装载
在本发明的双组件装置中评估贴壁读出细胞的装载,并与将相同细胞装载到通过msl制造的预装配微流体装置中进行比较。
通过引入细胞通过入口端口并通过微流体通道(通道宽度100μm)将它们流入各个室来评估贴壁细胞系(tangotmcxcr4-blau2os)向预装配的微流体装置中的装载。这导致室装载均匀性差,装置中心的细胞浓度增加,装置角落的细胞装载低,相邻室之间的细胞装载密度变化很大。即使在包含胰蛋白酶的介质条件下,也观察到由于细胞粘附导致的通道堵塞(图32)。此外,一旦装载到室中并且在孵育后,细胞不能很好地铺板并且显示出与应力一致的形态。细胞的活力很差,大多数在培养的最初24小时内死亡。
为了解决活力问题并改善室中的细胞铺板,将tangotmcxcr4-blau2os细胞通过入口端装载入第二预装配微流体装置,然后通过微流体通道使它们流入各个室。然而,与第一种装置相反,通道和室首先暴露于含有聚赖氨酸的介质中。试图通过预先涂有聚赖氨酸的通道装载细胞导致细胞快速粘附到通道表面,导致通道阻塞和实验失败。
进行第三个实验,测试双组件装置中贴壁细胞的装载。首先用含有聚赖氨酸的介质涂覆装置的底层约10分钟,然后用不含聚赖氨酸的新鲜介质洗涤。然后将tangotmcxcr4-blau2os细胞装载到装置的底部阵列层的室中,并使其在数小时的时间内铺板。然后用新鲜介质洗涤室(67μm宽×112μm长),并将装置的顶层置于底层上以形成双组件装置。组装的双组件装置的成像显示出良好的细胞装载均匀性,其中室中的细胞数量与基于接种密度和阵列上的随机定位所预期的一致,并且在装载密度方面没有任何明显的空间偏差(图33))。此外,通过选择装载溶液中的细胞浓度和体积来控制细胞接种密度,计算使得细胞总数大约等于每室所需细胞数和室总数的乘积,允许每个室约1个细胞至每个室约20个细胞之间的细胞装载控制。对于贴壁细胞,最佳接种密度由室底面积决定。例如,利用u20s细胞和横向尺寸为67μm×112μm的室,每个室平均约10至15个细胞在均匀性和平板细胞的能力方面提供了良好的结果。当装载到涂有聚赖氨酸的双组件装置中时,发现细胞表现出正常的形态,并且适于过夜培养,具有良好的活力并且没有应激迹象。
实施例3-介质交换期间室纵横比的影响
进行一系列实验以评估室纵横比对室介质更换期间双组件微流体装置性能的影响。在一个实验中,测试具有不同纵横比(深度/高度与最小横向尺寸的比率)的室的微流体装置,以确定通过在含有细胞或珠的室上提供溶液的介质交换是否导致细胞或珠从室丢失,或室内的细胞或珠的移位。
具有尺寸为100μm×100μm×150μm(深度/高度×宽度×长度)的室(对应于纵横比约为1)和通道尺寸为20μm×100μm(高度×宽度))的装置以不同的流速进行测试。将装置入口和出口处的流体端口连接到压力调节器,并调节压力以调节通过通道的流速。发现以1-3磅/平方英寸(psi)的差端口压力流过通道的介质交换不会导致颗粒从室丢失。在这些压力下(通道横截面为15μm×100μm)的每个通道的体积流量估计大约为0.1nl/秒和10nl/秒,这取决于施加压力的装置的截面和通道长度。然而,在这些流动压力下,观察到颗粒(珠或细胞)以流动方向沿着室的底部被推动,使得它们在室的下游侧聚集在一起,结果是可接受的,但对于成像而言并不理想。在5至9psi的较高压力下,流动导致细胞或珠被从室中提起,这导致对细胞进行多步测定的能力产生负面影响。
在室纵横比显著低于1.0时,观察到低流速(例如1至3psi)导致细胞或珠从室丢失。基于该结果,测试了具有更高纵横比的室。发现纵横比大于1.0允许使用高流速而没有颗粒从室中的任何丢失。
这些结果可以通过由不同流速和室纵横比产生的流动分布的数值模拟来解释。例如,使用尺寸为100μm×100μm×150μm(深度×宽度×长度)的室,发现流动主要通过室的上半部分,但是存在向室底部的非零流动(图34,左)。通过较高纵横比室的流动模拟显示在所有情况下改进的性能,并且在一些情况下,表现出定性不同的流动剖面。例如,通过具有1.25的纵横比和圆柱形几何形状(100μm直径和125μm深度)的室计算模拟的流动剖面(图34,右)。这些模拟表明,所产生的流动在室底部产生再循环涡流,即使在低流速和高流速下也能保持颗粒。根据这些计算,发现高达15psi的高操作压力不会导致颗粒从室中丢失,但确实导致颗粒在室底部的运动。基于这些结果,确定在用于双组件装置的室的设计中应使用≥约1的纵横比。
应注意,室中的流体动力学行为主要由室顶部的流速确定,因此这种高纵横比室的使用不限于在顶层中包括阀结构的双组件装置,但也可以有效地与任何双组件装置一起使用,该装置允许通过室顶部的流动交换介质。这些可以包括其中顶部组件具有单个流道层的双组件装置,具有凸起特征以在与底层结合在一起时形成流动结构的双组件装置,或者包括位于底层附近或底层之上的盖板以允许在装置的两个组件之间流动的双组件装置。可选地,具有高纵横比室的底部组件可以单独用于某些实验,即没有顶层。在这种情况下,高纵横比室用于保护颗粒和细胞免受伴随阵列上的液体交换的瞬时流动,从而允许更换介质而不从室移动颗粒。在这些实施方案中,流体贮存器可以放置在室上方以允许流体交换。
实施例4-cxcr4细胞外效应测定
本文描述的装置提供了用于进行多步测定以鉴定分泌特异性结合读出细胞类型的抗体的单细胞的手段。
用包含gpcr靶cxcr4的病毒样颗粒免疫小鼠。将从小鼠脾脏获得的asc装载到双组件微流体装置的室中,每个室具有约68μm的最小横向尺寸和约150μm的深度,随后将两个读出细胞群装载到室(图35)。一个读出细胞群包括稳定表达cxcr4的悬浮细胞系。第二个读出细胞群由不表达cxcr4,并且用被动染料羧基荧光素琥珀酰亚胺酯(cfse)荧光标记的相同细胞系组成。装载后,将组合的细胞群在微流体装置中孵育,以允许每个室中分泌的抗体的浓缩和特异性抗体与靶细胞的结合。孵育后,通过在装置上提供含有荧光标记的二抗的介质来洗涤室,导致表达cxcr4的细胞的选择性染色,其位于具有产生对该靶标特异的抗体的asc的室中(图35)。通过比较单独的通道中被动染料的荧光信号来确定表达靶标的细胞和不表达靶标的细胞的差异染色(图35,右)。
实施例5-流感抗原细胞外效应测定
本文描述的装置提供了同时测定由单个细胞分泌的抗体以确定它们是否与一种或多种抗原结合的手段。在流感的情况下,鉴定可以结合多种毒株的抗体是有用的。
测试人b细胞与来自以下三种不同流感病毒株的抗原的结合:h1n1,h3n2和b毒株。将每种抗原涂覆在具有不同直径的不同珠群体上:h1n1-10μm,h3n2-5μm和b毒株-3μm,从而可以根据珠大小确定抗原身份。将细胞和珠装载到双组件装置的底层中,选择珠密度以在每个室中产生约3至20个每种珠类型,并且选择每个室具有少于单个细胞的细胞密度。
将装置的顶部组件与底部组件对齐,并孵育室以浓缩分泌的抗体并确保这些抗体与每种珠类型的有效相互作用。孵育后,通过在室阵列中提供介质,用含有荧光标记的二抗的新鲜介质洗涤室。荧光标记的二抗含有抗人抗体的混合物,不同的二抗以不同的颜色标记,并且各自对检测不同的同种型igg,iga和igm具有特异性。然后通过在室上方和穿过室提供新鲜介质再次洗涤室以除去背景荧光。对该装置成像以检测具有用二抗选择性染色的珠的室。图36显示来自三个不同室的图像,其被鉴定为含有对三种不同抗原(人igg)中的每一种具有特异性的单个b细胞。
实施例6-h4-1bb跨膜糖蛋白的多重细胞外效应测定
设计基于珠的测定法以允许检测能与靶标人4-1bb(h4-1bb)结合的抗体,所述靶标人4-1bb是属于肿瘤坏死因子(tnf)超家族的2型跨膜糖蛋白。还测试了h4-1bb抗体结合鼠4-1bb的能力。最后,评估h4-1bb抗体阻断4-1bb与其天然配体h4-1bb配体相互作用的能力。
从已用可溶性h4-1bb免疫的小鼠的脾和骨髓中获得小鼠抗体分泌细胞。对该实验中使用的小鼠进行基因工程改造以产生具有人可变区基因的h4-1bb抗体。将缀合以结合分泌的抗体的恒定区的珠装载到双组件装置的室中,每个室的平均浓度为约20至30个珠。然后将asc装载到装置中,并将室孵育约2小时,以使分泌的抗体在室中积累,并使分泌的抗体捕获到珠上。
然后通过在室顶部提供含有h4-1bb(用荧光团标记)和m4-1bb(用具有第二发射谱的荧光团标记)的混合物的溶液来洗涤室。孵育后,以两种颜色对室进行成像,以确定分泌的抗体是否与h4-1bb和/或m4-1bb结合。结果显示在图37中。
接下来,通过使与第三荧光团(其发射第三波长范围)缀合的h4-1bb配体流过室顶部来再次洗涤室。孵育后,将室在第三荧光通道中成像以确定结合的h4-1bb是否仍然能够与h4-1bb配体结合,或者h4-1bb与抗体之间的相互作用是否阻断了这种相互作用(图37,右)。通过移除装置的顶部组件并随后用自动毛细管抽吸室内容物,从室中回收来自确定具有所需特性(结合h4-1bb并保持h4-1bb配体相互作用的抗体)的室的asc。
一旦吸出,将室内容物沉积到管中以扩增编码所选抗体的rna。通过测序确定所得抗体序列。将相应的dna插入物克隆到表达载体中并用于抗体的重组表达。然后测试所得抗体的子集以确认它们显示出从微流体筛选确定的特性。
实施例7-在单组分开放微流体装置对抗体的检测
在此呈现的双组件装置中并入顶部组件在分析从单细胞分泌的抗体中提供了若干优点。例如,双组件装置通过将分泌的抗体限制在单个室的容积中而提供增加的灵敏度;促进实施多步测定所需的流体处理步骤;减少背景荧光,以增加信噪比;并通过抗体的扩散防止室之间的交叉污染。
然而,这里呈现的装置也可以以不并入顶部组件的形式使用。在该实施例中,装置的底部组件(单个组件)装载有与抗原缀合的微珠。接下来,将抗体分泌细胞群以每室大约1个细胞的浓度装载到装置室中,并孵育以允许在含有细胞的室中的珠上捕获抗原特异性抗体并且在较小程度上在与包含细胞的室相邻的室中。然后将低浓度(~10nm)的荧光标记的二抗加入到覆盖室的溶液中并孵育约1小时,然后对室进行成像。结果如图38所示。
图像分析显示存在多组室,其中珠的像素强度显著高于可溶性二抗产生的背景荧光。对这些室中像素强度的直方图的分析表明,与背景相比,中央室显示出具有最高值的像素强度,直接到底部的室和该室的顶部具有次高的值,接着是直接向右和向左的室,最后是来自中央室对角线的室(图38)。强度的这些差异通过每个室中的珠与产生抗体的细胞(在中央室中)的接近度的差异来解释-注意到该实验中的阵列间距在y坐标中要短于x坐标,这有助于与右室和左室(x坐标)相比,顶室和底室(y坐标)中的强度更高。根据该分析,进行从中央室检测和回收具有所需特异性的单一抗体分泌细胞。通过测序,克隆和表达或相应的抗体序列确认抗体身份。
以单层形式检测抗体需要,抗体分泌细胞产生足够的抗体以在存在由于容纳荧光分子的室上方存在大体积(例如,通过使用流体贮存器)而导致的更高背景下(与在双组件装置中使用顶部组件时相比),以及在存在通过扩散进入相邻室的抗体逃逸的情况下进行检测。这通过这样的观察结果证实,使用包含顶部组件的装置形式分析相同样品导致检测到的特异性抗体数量增加,以及由于限制室之间的扩散而引起的相邻荧光的消除和增加的信噪比。
实施例8-5种抗原的多重检测
进行多重免疫和筛选以分离针对5种不同抗原的兔单克隆抗体。在约6周的时间内用5种不同抗原的混合物免疫兔。免疫后,从兔中获得血液样品,其显示所有5种抗原的滴度,并从该样品中分离外周血单核细胞(pbmc)。然后将含有浆细胞的分离的pbmc装载到微流体装置的底层中,所述微流体装置预装载有5种不同珠家族的混合物(starfiretm珠,bangslaboratories)。每个珠家族与用于免疫兔的五种抗原之一缀合,并且每个家族通过珠基质中包含的荧光染料的水平在光学上可区分。在装载细胞和珠后,组装双组件装置并将室孵育约2小时以允许分泌的抗体浓缩并在具有相应抗原的珠上有效捕获特异性抗体。然后用含有二抗的新鲜介质洗涤室,所述二抗用与珠基质中使用的荧光团光学不同的荧光团标记。然后将微流体装置在两个荧光通道中成像,并使用第一通道的自动实时图像分析来自动分割和识别每个室中的珠。使用在第二荧光通道中拍摄的图像的图像分析来确定抗体是否已经结合到每种不同的珠类型。结果显示所有五种抗原都是可检测的。
实施例9-肺炎克雷伯氏菌(klebsiellapneumonia)结合细胞外效应测定
本文描述的装置用于发现针对细菌病原体肺炎克雷伯氏菌的全人抗体。从人骨髓,扁桃体和人血中获得抗体分泌细胞。为了筛选这些细胞,将整个肺炎克雷伯氏菌以每室约100个细菌的浓度装载到微流体装置中。然后将抗体分泌细胞装载到装置的室中,并将顶部组件与底层对齐,然后孵育以允许分泌的抗体的积累。在纳升体积室中的限制允许识别细菌表面上呈递的抗原的抗体随后与细菌结合。
然后通过在室顶部流动的新鲜介质洗涤室,所述新鲜介质含有两种差异标记的二抗的混合物,一种对人igg特异,一种对人iga特异。成像证实在新鲜介质流动期间细菌没有丢失。在不希望受理论束缚的情况下,认为细菌滞留是由于低流速和/或室的约1的纵横比。
在与含有两种差异标记的二抗的混合物的介质进行第二次孵育后,将微流体装置成像为两种颜色,以鉴定含有单一抗体分泌细胞(其产生对细菌上的抗原具有特异性的抗体)的室,并且确定这些抗体的同种型(igg或iga)。结果如图39所示。
检测后,移除微流体装置的顶部组件并回收所选室的内容物。然后将这些内容物用作模板以扩增相应的抗体序列。然后合成,克隆和表达这些序列以产生重组抗体。然后测试一组重组抗体并证实其与肺炎克雷伯氏菌细菌结合。
实施例10-在单室中存在多种不同asc时对单克隆抗体的检测
进行以下实验以证明本文所述的装置和方法适用于这样的测定,其中当在同一室中存在多种其他细胞,例如,其他抗体分泌细胞时,可在单个室中检测和分析由单个细胞产生的单克隆抗体。
筛选人样品中与细菌病原体肺炎克雷伯氏菌结合的稀有抗体。获得人pbmc样品并在促进记忆b细胞扩增和分化成asc的活化条件下培养。激活后,双组件微流体装置的底部组件预装有活细菌,然后装载来自pbmc培养物的细胞,浓度为每室约50个细胞。然后将该装置与其第二组件组装,并孵育以允许室中分泌的抗体积聚,以及这些抗体与细菌的相互作用。孵育后,通过在室的顶部流动的新鲜介质洗涤室,所述介质含有两种差异标记的二抗的混合物,一种对人igg具有特异性,一种对人iga特异性。成像证实在新鲜介质流动期间细菌没有丢失。在不希望受理论束缚的情况下,认为细菌滞留是由于低流速和/或室的约1的纵横比。
在与含有两种差异标记的二抗的混合物的介质进行第二次孵育之后,将微流体装置成像为两种颜色,以鉴定含有单一抗体分泌细胞(其产生对细菌上的抗原具有特异性的抗体)的室,并且确定这些抗体的同种型(igg或iga)。在所有90,000个室中,不到0.1%被发现含有对细菌具有特异性的抗体,从而表明存在于约50个其他细胞的群体中的单个抗原特异性抗体分泌细胞负责在一些室中观察到的阳性信号。在检测到阳性室后,移除微流体装置的顶部组件并回收所选室的内容物并汇集在一起以产生和富集抗体分泌细胞群,其中细菌特异性细胞的近似频率为2%。(每50个细胞中有1个)。然后在有限稀释下(每室少于一个细胞)在第二装置上重新筛选该富集的细胞群,并成功检测并回收分泌对细菌具有特异性的抗体的单个抗体分泌细胞。
实施例11-哺乳动物细胞的延长的微流体培养
进行以下实施例以证明本文提供的双组件装置和方法允许进行需要延长培养具有高活力的哺乳动物细胞的实验。微流体装置装载有k562细胞群。装置的不同部分以每室不同数量的细胞装载,每室1个细胞至约20个细胞(室尺寸:200μm宽度×200μm长度×140μm深度)。装载后,对装置成像以确定每个室中的细胞数量。通过明视场显微镜监测装置室的子集48小时以评估每个室中细胞的扩增和活力。在整个实验过程中,每6小时用新鲜介质冲洗室以确保介质中有足够的营养物质并去除可能抑制细胞生长的代谢产物。观察到室表现出强烈的生长和优异的活力,并且即使在细胞生长至汇合的室中也能维持强大的细胞生长(图40)。
实施例12-从各个微流体室中对细胞的回收
进行以下实施例以证明可以在没有交叉污染并且不损害回收的细胞的完整性的情况下实现从各个装置室的回收。
在该实施例中,将人抗体分泌细胞(asc)群以及经设计以捕获分泌的抗体的微珠装载到存在于双组件微流体装置的底部组件上的室中,然后将顶部组件对齐至底部组件。以每室少于一个细胞的浓度装载细胞。孵育后,用含有荧光标记的对人igg具有特异性的二抗的新鲜介质洗涤室。将该装置孵育并成像以检测具有分泌igg的单细胞的室或不具有细胞的对照室。然后移除装置的顶部组件,并使用自动控制的微毛细管回收10个室的内容物,在含有单个igg分泌细胞的室和不含细胞的对照室之间交替。将每个室的内容物沉积在单独的微量离心管中,并进行rt-pcr反应以扩增人抗体的重链和轻链可变区。
扩增后,运行琼脂糖凝胶以分析所得的扩增产物。结果显示含有来自具有单个细胞(即单个igg抗体分泌细胞)的室的模板的反应,产生清晰的重链和轻链条带,并且所有不含模板的反应(对照室)不产生产物(图41)。这证实了(i)细胞从室中有效回收,(ii)室之间没有明显的交叉污染,和iii)回收的细胞是完整的并含有足够的rna以允许通过rt-pcr回收抗体基因。
实施例13-室内介质更换的时间和空间控制
进行以下实施例以证明本文提供的装置和方法允许对微流体装置的一个或多个室内的介质交换进行空间和时间控制。当进行其中功能性细胞外效应测定在成像中需要高时间分辨率的实验时,该控制可能特别有用。例如,此类测定可以包括监测暴露于因子(例如抗体)的细胞的裂解,监测读出细胞内荧光蛋白的易位,监测响应于刺激的读出细胞中的离子通道通量,监测响应刺激的第二信息钙通量。例如,实施微流体单细胞测定以鉴定响应于添加激动剂而抑制读出细胞中的快速钙通量的抗体,如通过预先装载到读出细胞中的钙敏感性荧光染料所测量的。在这种情况下,信号是瞬时的,使得超过10,000个室的整个装置的成像可能无法提供足够的时间分辨率。通过使用双组件微流体装置可以克服该问题,其中顶部组件被设计成能够在受控定时下将激动剂选择性地添加到装置的子部分,使得室可以在激动剂添加之后在已知且合适的时间成像。这可以使用双组件微流体装置来实现,其中顶层包含阀和通道结构,其允许溶液仅在选定的室子集上流动。子部分的数量和每个子部分的室的数量将取决于测定的要求,并且可以设计到流体网络中。可选地,具有通道但没有阀的顶部组件可以用于,通过使与限定数量的室接口的流体网络的不同部分具有单独的入口来实现相同的结果。可选地,这可以通过使用包括孔的顶层来实现,激动剂可以通过该孔流过室并且该孔不固定在相对于底层的位置,而是可以跨室阵列平移到暴露的不同区域。可选地,可以在没有顶层的情况下使用该装置,并且可以使用自动控制的毛细管使激动剂在阵列的不同区域上流动。可选地,该装置可以在没有顶层的情况下使用,但是可以设计成包括隔离装置的不同子区域的隔板,每个子区域具有用于测定的合适数量的室,并且将激动剂添加到每个不同的子阵列中。可以通过移液到子阵列上来实现。
********
在本申请中引用的所有文献,专利,专利申请,出版物,产品描述和方案出于所有目的通过引用整体并入本文。
本说明书中说明和讨论的实施方案仅旨在向本领域技术人员教导发明人已知的制造和使用本发明的最佳方式。在不脱离本发明的情况下,本发明的上述实施例的修改和变化是可能的,如本领域技术人员根据上述教导所理解的。因此,应理解,在权利要求及其等同物的范围内,本发明可以不同于具体描述的方式实施。
- 还没有人留言评论。精彩留言会获得点赞!