遗传擦除子的制作方法
依据35u.s.c.§119(e),本申请要求2016年7月26日提交的美国临时申请号62/366,755的权益,将其全部按引用并入本文中。
技术实现要素:
在一些实施方式中,本文提供了用于从工程化细胞(例如,细胞疗法中使用的)高效地除去异源核酸(例如,dna)的方法、组合物、系统和试剂盒。这种技术对于建立、工程化、制造和部署下一代人细胞疗法是明显变革性的。
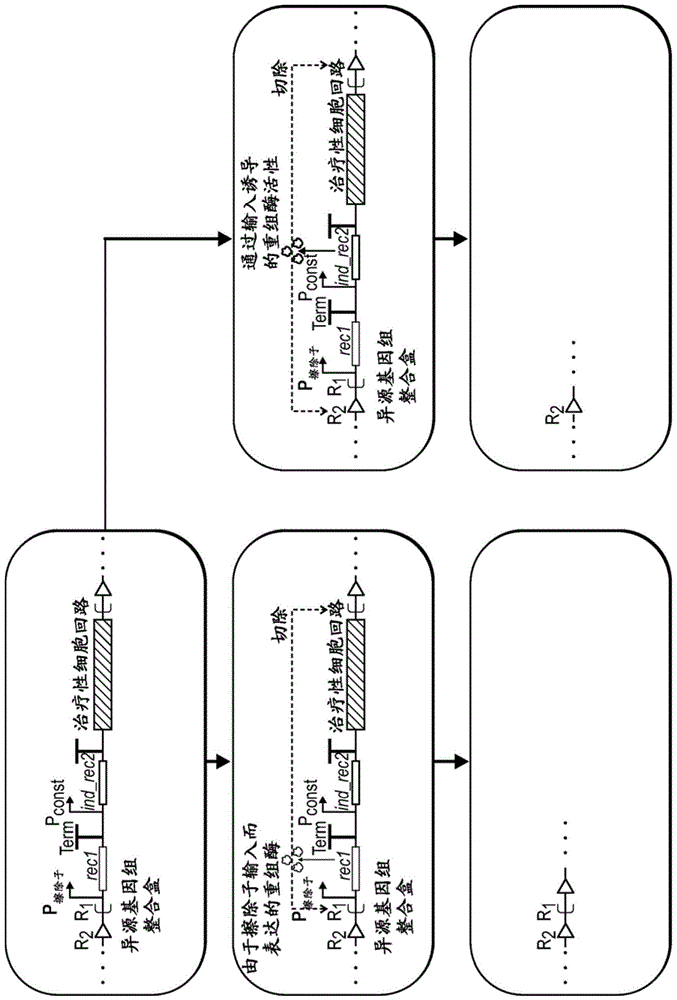
工程化(合成/人造)遗传(基因)回路通常可用于,例如,细胞疗法的离体分化和制造。携带使得能够动态控制细胞功能的工程化遗传回路(异源遗传回路)的细胞可以作为用于治疗/预防许多不同病症的治疗剂用于患者中。然而,一旦形成所需的细胞类型并运用于患者中,该工程化回路可能不是治疗应用必需的,而且甚至可能具有副作用。在这些遗传回路(例如,异源dna盒)运用于患者后有效除去的能力对于患者安全性是有用的。例如,干细胞分化成胰腺β-岛细胞可以通过遗传回路来增强3,但一旦将β-岛细胞引入患者中,遗传回路的去除将减少监管和安全性顾虑。如本文中提供的多层平台(其在一些实施方式中结合了几种遗传切除和/或降解技术)经工程化用于有效去除(“擦除”)异源核酸(例如,dna)。因此,本公开的工程化遗传构建体可以称为“遗传擦除子(geneticeraser)”。
本公开的方面提供了包含表达盒(盒(cassette))的工程化遗传构建体(遗传擦除子),所述表达盒包含(a)编码第一目标产物(例如,重组酶或核酸酶)的核苷酸序列,和(b)编码第二目标产物(例如,治疗性分子)和反选标记(例如,前药)的核苷酸序列,其中第一目标产物的表达或活性是可激活的,并且其中第一目标产物调节盒的切除或降解。在一些实施方式中,组分(a)在组分(b)的上游。
在一些实施方式中,所述工程化遗传构建体(遗传擦除子)包含表达盒(盒),所述表达盒包含(a)编码重组酶的核苷酸序列,(b)编码核酸酶的核苷酸序列,和(b)编码目标产物(例如,治疗性分子)和反选标记(例如,前药)的核苷酸序列,其中所述重组酶和核酸酶是可激活的并且调节盒的切除和/或降解。
在一些实施方式中,所述工程化遗传构建体(遗传擦除子)包含盒,所述盒包含(a)可操作地连接于编码重组酶的核苷酸序列的诱导型启动子,和(b)可操作地连接于编码目标产物和反选标记的核苷酸序列的启动子,其中所述盒侧翼为同源重组酶识别位点。
在一些实施方式中,所述工程化遗传构建体(遗传擦除子)包含盒,所述盒包含(a)可操作地连接于编码核酸酶的核苷酸序列的诱导型启动子,和(b)可操作地连接于编码目标产物和反选标记的核苷酸序列的启动子,其中所述盒侧翼为核酸酶识别位点。
在一些实施方式中,所述工程化遗传构建体(遗传擦除子)包含盒,所述盒包含(a)可操作地连接于编码重组酶的核苷酸序列的诱导型启动子,(b)可操作地连接于编码核酸酶的核苷酸序列的诱导型启动子,和(c)可操作地连接于编码目标产物和反选标记的核苷酸序列的启动子,其中所述盒侧翼为同源重组酶识别位点并且包括同源核酸酶识别位点。
本公开的一些方面提供了包括将本文中所述的任一种工程化遗传构建体引入细胞中的方法,其中所述目标产物有助于细胞的分化、扩增或表型维持。
本公开的其他方面提供了包括将本文中所述的任一种工程化遗传构建体引入细胞中的方法,其中所述目标产物是治疗性分子和/或预防性分子。
本公开还提供了包含本文中所述的任一种工程化遗传构建体的载体、细胞、组合物和试剂盒。
附图说明
图1显示了怎样利用多重冗余和正交重组酶蛋白从靶细胞切除异源dna构建体的实例。这些重组酶通过诱导转录、分裂蛋白(splitprotein)活性的重建或蛋白质至核酸酶的易位来控制。
图2a-2b显示了怎样使用核酸酶来靶向dna用于破坏(图2a)和/或引发重组(图2b)来切除位于核酸酶靶位点(nts)之间的大dna片段的实例。这些核酸酶可以包括大范围核酸酶(meganuclease)、crispr-cas核酸酶、锌指核酸酶和tale核酸酶。核酸酶诱导的双链断裂可以导致灭活所靶向的蛋白质编码序列或催化大的缺失的重组,这可以通过供体dna的存在来进一步增强。
图3显示了异源dna构建体中编码的反选标记(csm)的实例,使得没有经历使用基于重组酶或基于核酸酶的途径的有效dna切除的细胞在添加转化成毒性药物的前药时被杀灭。此外,编码了诱导性杀灭开关(killswitch),其在添加表达毒素或将分裂的毒素二聚化的小分子诱导剂时引发细胞死亡。这些csm将结合遗传擦除子来使用以增强异源dna删除的效率。
图4显示了用于稳定整合的基于重组酶的切除构建体的实例。这个模块构建体使得能够通过用限制酶的不同组合简单消化载体来容易地交换遗传部分。
图5显示了测定重组酶切除效率的系统的实例。报告载体编码侧翼为反选标记(例如,hsv胸苷激酶)的重组序列。dna装配可以使用多步法进行,包括,例如,限制性酶克隆、gibson装配和goldengate装配。重组酶载体编码重组酶(例如,bxb1)。
图6显示了来自测试各种酪氨酸重组酶的重组酶活性的瞬时293ft细胞转染分析的数据。293ft细胞用等比率的报告质粒、重组酶质粒和转染标记质粒(例如,编码bfp的质粒)瞬时转染。分析细胞在转染后24小时的gfp荧光并且针对bfp表达进行门控。上图表示gfp+细胞%,而下图表示gfp+细胞的gfp平均荧光强度的中值。各个条的组从左到右显示对于报告子、重组酶和报告子+重组酶的数据。
图7显示了来自测试各种酪氨酸重组酶的重组酶活性的瞬时293ft细胞转染分析的数据。293ft细胞用等比率的报告质粒、重组酶质粒和转染标记质粒(例如,编码bfp的质粒)瞬时转染。分析细胞在转染后24小时的gfp荧光并且针对bfp表达进行门控。柱状图表示具有和不具有重组酶的转染的细胞群体。
图8显示了用于分析重组酶切除效率的系统的实例。bpii(x2)-hsvtk-sv40pa-egfp-esp3i(x2)盒插入pcdna3.1(+)哺乳动物表达载体(lifetech)中。重组序列通过goldengate消化/连接插入bpii和esp3i位点中。
图9显示了来自测试各种丝氨酸整合酶的重组酶活性的瞬时293ft细胞转染分析的数据。用等比率的报告质粒、重组酶质粒和转染标记质粒(例如,编码bfp的质粒)瞬时转染293ft细胞。分析细胞在转染后24小时的gfp荧光并且针对bfp表达进行门控。上图表示gfp+细胞%,而下图表示gfp+细胞的gfp平均荧光强度的中值。各个条的组从左到右显示了报告子、重组酶和报告子+重组酶的数据。
图10显示了来自测试各种丝氨酸整合酶的表达的瞬时293ft细胞转染分析的数据。用等比率的报告质粒、重组酶质粒和转染标记质粒(例如,编码bfp的质粒)瞬时转染293ft细胞。分析细胞在转染后24小时的gfp荧光并且针对bfp表达进行门控。柱状图表示具有和不具有重组酶的转染的细胞群体。
图11显示了用于位点特异性整合的基于重组酶的切除构建体的实例。将编码基于重组酶的切除构建体的入门载体整合至表达yfp和潮霉素的预先工程化的293ft着陆垫(landingpad)细胞系中。成功的整合驱动嘌呤霉素的表达。
图12显示了gfp报告子成功地整合至293ft着陆垫细胞系中。整合时,细胞表达gfp并且同时失去yfp的表达。使用嘌呤霉素的选择压力除去了未整合的细胞。
图13显示了用于切除基因组整合的构建体的方法的实例。将编码基于重组酶的切除构建体的入门载体整合至预先工程化的293ft着陆垫细胞系中。用表达重组酶的质粒和报告质粒(例如,表达bfp)瞬时转染整合的细胞系,并且分析随着时间的gfp表达。使用反选标记(csm)来杀灭保留整合的构建体的细胞。
图14显示了使用图13中描述的实验方法获得的实例数据。用同源重组酶瞬时转染表达3种不同的基于重组酶的切除构建体的细胞系,并且随着时间分析gfp表达。对于针对bfp表达未进行或进行门控的细胞群体,将gfp+细胞%绘图。各个条的组从左到右显示了第2天、第4天和第7天的数据。
图15显示了使用图13中描述的实验方法获得的实例数据。图14中的b3重组酶瞬时转染后,施用前药来消灭保留pentr_b3rt切除构建体的细胞。反选标记(csm)将前药转化成毒性药物。在这种情况中,csm是hsvtk,并且前药是更昔洛韦(gcv)。用0.5、1、2和5μmgcv处理细胞7天,并随着时间分析gfp表达。柱状图表示gfp-细胞%和gfp+细胞%。
图16显示了使用图13中描述的实验方案获得的实例数据。图14中的flp重组酶瞬时转染后,施用前药来消灭保留pentr_frt切除构建体的细胞。反选标记(csm)将前药转化成毒性药物。在这种情况中,csm是hsvtk,并且前药是更昔洛韦(gcv)。用0.5、1、2和5μmgcv处理细胞7天,并随着时间分析gfp表达。柱状图表示gfp-细胞%和gfp+细胞%。
图17显示了其中指导rna(grna)切割并除去基因组整合回路的系统的实例。在该图中,如果yfp报告子已经稳定地整合至细胞中,grna靶向5’-utr和3’-utr。
图18显示了来自测试使用crispr/cas9除去基因组整合回路的瞬时转染分析的数据。将编码单一grna和cas9的载体与报告质粒(例如,表达bfp)一起转染至表达yfp的细胞系中。在一些情况中,将编码不同grna的两个载体与报告质粒一起转染。将细胞群体针对bfp表达进行门控,并且将yfp+细胞%随着时间绘图。可以使用不同的grna组合来去除yfp。柱状图表示yfp-细胞%和yfp+细胞%。各个条的组从左到右显示了第2天、第5天和第7天的数据。
图19显示了使用图13中描述的实验方法获得的实例数据。根据所示的时间线用b3或flp按序转染表达pentr_b3rt_frt基于重组酶的切除构建体的细胞系。随着时间分析gfp表达,并且柱状图表示第15天的gfp+细胞%。pentr_b3rt_frt基于重组酶的切除构建体编码构建体b3rt_frt_icasp9_sv40pa_frt_b3rt_egfp_bghpa,其中b3rt和frt分别是b3和flp的重组序列;并且icasp9是反选标记(csm)。
图20显示了使用图13中描述的实验方法获得的实例数据。根据所示的时间线用b3或flp按序转染表达pentr_b3rt_frt基于重组酶的切除构建体的细胞系。随着时间分析gfp表达,将第15天的gfp+细胞%绘图。条从左到右显示了无重组酶;b3;b3、flp;flp;和flp、b3的数据。
具体实施方式
本文描述了一种强大的技术,其能够部分地通过从工程化细胞高效地去除异源核酸来实现下一代细胞疗法。可以将本文中的工程化遗传构建体称为“遗传擦除子”。本文中所述的遗传擦除子技术对于至少两种主要的应用是有用的。首先,它们可用于形成有助于细胞离体分化、扩增或表型维持的遗传回路,所述回路随后可以在引入患者之前去除。其次,它们用作可以在体内递送细胞疗法后通过从工程化细胞去除异源dna从而使细胞疗法失去其功能来触发的安全开关。
因此,在一些方面中,这些遗传擦除子能够实现增强特定表型的离体分化、扩增或持续的遗传回路并且随后在引入体内前去除所述遗传回路。用于调节细胞表型的现有策略包括使用小分子、生长因子、rna构建体或dna回路。小分子可用于增强分化,但鉴于内源性细胞调节的复杂性,这样的化学物质的发现可能是费力且困难的。生长因子已经成功用于离体细胞编程,但鉴于许多潜在的组合,其发现、规模化和应用可能是昂贵的。编码转录因子和细胞功能的其他细胞内调节子的rna构建体已经用于细胞编程,但尚未用于将复杂动力学编码到提高效率所必需的细胞程序中,这是由于缺乏可编程的rna调节子(虽然,随着最近的进步,这种情况开始发生变化(25))。dna回路已经用于编程复杂的转录程序,如源自ips细胞的组细胞分化成β-岛样细胞(3),如上所述。这些回路可以用于表达细胞内调节子,如转录因子和微rna,以及分泌旁分泌因子,如生长因子和细胞因子,并且因此有可能提高离体细胞编程的规模和降低其成本。在引入患者中之前去除这样的回路将减少关于安全性和监管负担的顾虑。
在一些实施方式中,本公开的遗传擦除子整合了多种机制以实现显著水平的遗传擦除(删除/降解),这可以将细胞恢复至没有异源活性的基线状态,并且可以将基因组恢复至几乎没有外源dna痕迹的基线状态(重组酶可能留下小的dna疤痕而具有最小的影响)。使用多层冗余的遗传擦除子能够显著提高遗传删除的效率,并且对于能够实现这种技术的临床应用(实现临床级活动)是重要的。
对于本文中所述的各种方法,测量了去除异源dna或杀灭含有异源dna的细胞的效率。在前一种情况中,使用基于荧光或qpcr的分析。在后一种情况中,使用活-死分析监测细胞存活。这在细胞系中是原型的,并扩展到治疗相关的细胞类型(例如,间充质干细胞、t细胞、nk细胞)。这样的技术可用于编程有效的细胞分化,并随后在治疗前去除这些回路。这样的技术还可用作杀灭开关或用于遗传工程化细胞疗法的体内应用的关闭(off)开关。
遗传擦除子的关键技术挑战是最小化从遗传擦除过程中逃逸的细胞数量。试验中的cart细胞的剂量范围从2*105-2*107cd19cart细胞/kg,而用于临床中的间充质干细胞(msc)在1-3*106msc/kg的范围内(27)。因此,临床中使用的细胞疗法的最大剂量上限似乎低于109细胞。为了确保每剂低于1个细胞含有异源遗传物质,在一些实施方式中,这意味着优选的是可以实现高于109的效率的遗传擦除子。为了实现这种严格的效率,可以将多种遗传擦除机制层叠在一起,如本文中提供的。遗传擦除子成分的组合导致增强的效率。例如,如果使用四种不同的重组酶获得高于97%的切除效率以及使用两种反选标记获得高于97%的杀灭效率,那么应用遗传擦除子技术后,~7.310细胞中将只有一个细胞保留。在一些实施方式中,使用条件复制质粒而不是编码遗传回路到基因组中,以提高用新的动态调节子去除异源dna或rna回路的效率(25)。
因此,本文提供了包含盒的工程化遗传构建体,所述盒包含(a)可操作地连接于编码重组酶的核苷酸序列的诱导型启动子,和(b)可操作地连接于编码目标产物和反选标记的核苷酸序列的启动子,其中所述盒侧翼为同源重组酶识别位点。所述重组酶用于自我切割所述盒,而反选标记用于杀灭切除事件后其中保留盒的任何细胞。在一些实施方式中,可操作地连接于编码重组酶的核苷酸序列的诱导型启动子在可操作地连接于编码目标产物的核苷酸序列的启动子的上游(5’侧)。参见,例如,图1和3。
本文还提供了包含盒的工程化遗传构建体,所述盒包含(a)可操作地连接于编码核酸酶的核苷酸序列的诱导型启动子,和(b)可操作地连接于编码目标产物和反选标记的核苷酸序列的启动子,其中所述盒包含同源核酸酶识别位点。所述核酸酶用于切断/降解所述盒,而所述反选标记用于杀灭降解事件后其中保留盒的任何细胞。在一些实施方式中,可操作地连接于编码核酸酶的核苷酸序列的诱导型启动子在可操作地连接于编码目标产物的核苷酸序列的启动子的上游(5’侧)。参见,例如,图2和3。
如以上讨论的,本公开的技术包括多层化平台。因此,编码目标产物的单一遗传构建体可以编码多种(例如,至少2、3、4或5种)不同的重组酶、核酸酶和/或反选标记。同样,同一遗传构建体可以包括多对重组酶识别位点和/或多个核酸酶识别位点,以实现编码不同重组酶和/或核酸酶和目标产物的核酸的高效切除和/或降解。
在一些实施方式中,单一构建体编码重组酶、核酸酶和反选标记。在一些实施方式中,单一构建体编码至少一种(例如,1、2、3、4或5种)重组酶、至少一种(例如,1、2、3、4或5种)核酸酶和至少一种(例如,1、2、3、4或5种)反选标记。在一些实施方式中,单一构建体编码至少一种重组酶和至少一种核酸酶。在一些实施方式中,单一构建体编码至少一种重组酶和至少一种反选标记。在一些实施方式中,单一构建体编码至少一种核酸酶和至少一种反选标记。在一些实施方式中,单一构建体编码至少两种重组酶和至少一种核酸酶。在一些实施方式中,单一构建体编码至少两种重组酶和至少一种反选标记。在一些实施方式中,单一构建体编码至少两种核酸酶和至少一种重组酶。在一些实施方式中,单一构建体编码至少两种核酸酶和至少一种反选标记。在一些实施方式中,单一构建体编码至少两种重组酶、至少两种核酸酶和至少一种反选标记。在一些实施方式中,单一构建体编码至少两种重组酶、至少两种核酸酶和至少两种反选标记。
因此,在一些实施方式中,单一构建体的盒可以侧翼为多对同源重组酶识别位点和/或可以含有多个核酸酶识别位点。
此外,在一些实施方式中,工程化遗传构建体包含含有至少两个诱导型启动子的盒,该诱导型启动子各自连接于编码不同重组酶和/或核酸酶的核苷酸序列,其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点和/或包含对于不同核酸酶同源的核酸酶识别位点。在一些实施方式中,所述诱导型启动子连接于至少两个核苷酸序列,其各自编码不同的重组酶和/或核酸酶,并且其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点和/或包含对于不同核酸酶同源的核酸酶识别位点。在一些实施方式中,所述构建体包含至少三个诱导型启动子,其各自连接于编码不同的重组酶和/或核酸酶的核苷酸序列,其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点和/或包含对于不同核酸酶同源的核酸酶识别位点。在一些实施方式中,所述诱导型启动子连接于至少三个核苷酸序列,其各自编码不同的重组酶和/或核酸酶,其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点和/或包含对于不同核酸酶同源的核酸酶识别位点。
如以上讨论的,遗传擦除子组分的不同组合导致提高的异源核酸去除效率。在一些实施方式中,一系列切除、降解和/或反选反应(其包括将细胞暴露于表达表达盒的每种组分所需的全部诱导剂和/或反选剂)后,低于20%(例如,19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%)的最初接受工程化遗传构建体的细胞保留表达盒。即,高于80%(例如,81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%)的细胞在一系列切除、降解和/或反选反应后不再含有表达盒。在一些实施方式中,1-20%、1-15%、1-10%、1-5%、5-20%、5-15%、5-10%、10-20%或15-20%的最初接受工程化遗传构建体的细胞在一系列切除、降解和/或反选反应后保留表达盒。在一些实施方式中,80-100%、80-95%、80-90%、80-85%、85-100%、85-95%、85-90%、90-100%或95-100%的最初接受工程化遗传构建体的细胞在一系列切除、降解和/或反选反应后不再含有表达盒。
因此,在一些实施方式中,本公开的方法可以包括将本文中提供的工程化遗传构建体引入细胞群体中,培养细胞来产生目标产物,在至少一种(一种或多种)诱导剂的存在下培养细胞来表达重组酶和/或核酸酶以从工程化的遗传构建体切除和/或降解所述盒,在反选剂的存在下培养细胞群体以杀灭仍然保留并表达反选标记的细胞。诱导剂可以是激活同源诱导型启动子(其活性在诱导剂存在下被激活)的任何试剂。反选剂是杀灭表达/含有反选标记(在反选剂的存在下,其对于细胞是毒性的,例如,转化成毒性试剂)的细胞的任何试剂。
基于重组酶的切除
在一些实施方式中,工程化遗传构建体包含表达盒(盒),所述表达盒包含(a)可操作地连接于编码重组酶的核苷酸序列的诱导型启动子,和(b)可操作地连接于编码目标产物和反选标记的核苷酸序列的启动子,其中所述盒侧翼为同源重组酶识别位点。在一些实施方式中,组分(a)在组分(b)的上游。在一些实施方式中,终止子序列位于组分(a)和组分(b)之间。参见,例如,图1。
在一些实施方式中,组分(a)包含至少两个(或至少三个)诱导型启动子,其各自连接于不同的重组酶,并且所述盒侧翼为对于不同重组酶同源的重组酶识别位点。在一些实施方式中,组分(a)的核苷酸序列编码至少两种(或至少三种)不同的重组酶,并且所述盒侧翼为对于不同重组酶同源的重组酶识别位点。在一些实施方式中,组分(b)的核苷酸序列编码至少两种(或至少三种)反选标记。
在一些实施方式中,重组酶选自酪氨酸重组酶和酪氨酸整合酶。例如,重组酶可以选自cre、dre、flp、kd、b2、b3、λ、hk022和hp1重组酶。在一些实施方式中,重组酶选自丝氨酸重组酶或丝氨酸整合酶。例如,重组酶可以选自γδ、para、tn3、gin、φc31、bxb1和r4重组酶。
重组酶是识别介导这些重组酶识别序列之间的重组的短dna序列(通常在约30个碱基对(bp)和40bp之间)的位点特异性酶,这种重组导致重组酶识别序列之间的dna片段的切除、整合、倒置或交换。
基于不同的生化特性,重组酶可以分为两个不同的家族:丝氨酸重组酶(例如,解离酶和转化酶)和酪氨酸重组酶(例如,整合酶)。丝氨酸重组酶和酪氨酸重组酶进一步分成双向重组酶和单向重组酶,双向丝氨酸重组酶的实例包括,但不限于,β-six、cinh、para和γδ;而单向丝氨酸重组酶的实例包括,但不限于,bxb1、φc31、tp901、tg1、
重组的结果部分取决于待重组的两个短的重复dna序列(通常小于30bp长)的位置和方向。重组酶结合这些重复序列(其对于各重组酶是特异性的),并且在本文中称为重组酶识别序列或重组酶识别位点。因此,如本文中使用的,当重组酶可以介导重组dna序列之间的倒置或切除时,重组酶对于重组酶识别位点是特异性的。如本文中使用的,也可以说重组酶识别其同源重组酶识别位点,其位于插入遗传元件(例如,启动子、终止子或输出核酸序列)的侧翼。当元件位于两个重复dna序列之间并且紧邻两个重组dna序列时,核酸或核酸片段被称为在重组酶识别位点侧翼。在一些实施方式中,重组酶识别位点没有彼此重叠。然而,在其他实施方式中,重组酶识别位点彼此重叠,这使得大大地增加组合复杂性。
倒置重组发生在两个短的、倒置的、重复dna序列之间。通过dna弯曲蛋白辅助的dna环形成将两个重复序列汇合在一起,此时发生dna切割和连接。这一反应是非atp依赖性的,而是需要超螺旋dna。这种倒置重组事件的最终结果是重复位点之间的dna片段倒置(即dna片段逆转了方向)使得之前是编码链的现在是非编码链,反之亦然。在这样的反应中,dna是保守的,没有dna的净增加或没有dna的丢失。
相反,整合(切除)重组发生在以相同方向取向的两个短的,重复的dna序列之间。在这种情况下,切除/除去插入的dna。
重组酶还可以分为不可逆的或可逆的。不可逆重组酶是可以催化两个互补重组位点之间的重组,但在没有其他因子的帮助下不能催化通过这种重组形成的杂合位点之间的重组的重组酶。因此,不可逆识别位点是指可以作为不可逆重组酶的两个dna识别序列中的第一个,并且在该位点处重组后修饰为杂合识别位点的重组酶识别位点。互补不可逆识别位点是指可以作为不可逆重组酶的两个dna识别序列的第二个,并且在该位点处的同源重组后修饰为杂合重组位点的重组酶识别位点。例如,attb和attp是bxb1和phic31重组酶的不可逆重组位点—attb是attp的互补不可逆重组位点,反之亦然。attb/attp位点可以突变以形成只彼此相互作用但不与其他突变体相互作用的正交b/p对。这允许单一重组酶控制多个正交b/p对的切除或整合或倒置。
例如,在不存在真核细胞中未发现的其他因子的情况下,phic31
不可逆重组酶和编码不可逆重组酶的核酸在本领域中有描述并且可以使用常规方法获得。不可逆重组酶的实例包括,但不限于,phic31
相反,可逆重组酶是可以催化两个互补重组酶识别位点之间的重组,并且在没有其他因子的帮助下,可以催化由最初重组事件形成的位点之间的重组由此使其逆转的重组酶。通过重组产生的产物位点自身是随后重组的底物。可逆重组酶系统的实例包括,但不限于,cre-lox和flp-frt系统、r、β-six、cinh、para和γδ。
在一些实施方式中,工程化遗传构建体编码选自酪氨酸重组酶或酪氨酸整合酶的重组酶。在一些实施方式中,重组酶选自cre、dre、flp、kd、b2、b3、λ、hk022和hp1重组酶,在一些实施方式中,工程化遗传构建体编码选自丝氨酸重组酶或丝氨酸整合酶的重组酶。在一些实施方式中,重组酶选自γδ、para、tn3、gin、φc31、bxb1和r4重组酶。
本文中提供的重组酶不意味着是可以在本公开的实施方式中使用的重组酶的排他性实例。通过挖掘数据库的新的正交重组酶或设计具有限定的dna特异性的合成重组酶,可以扩展本公开的遗传擦除子的复杂性。有用的重组酶的其他实例是本领域技术人员已知的,并且预期发现或产生的任何新的重组酶能够用于本公开的不同实施方式中。
此外,可以以许多不同方式来实现重组酶表达和/或激活的控制,例如,使用aba系统(liang,f.s.等,sci.signal.,2011,4,rs2lp-rs2)、gib系统(miyamota,t.等,natchembiol,2012,8,465-470)、基于fkbp-frb的二聚化系统(komatsu,t.等,natmeth,2010,7,206-208)、他莫昔芬系统(matsuda,t.等,proc.natl.acad.sci.,2007,104,1027-1032)、dd(fkbp)系统(banaszynski,l.a.等,cell,2006,126,995-1004)、dd(dhfr)系统(iwamoto,m.等,chem.biol.,2010,17,981-988)、smash系统(chung,h.k.等,naturechemicalbiology,11:713-720,2015),或通过蓝光诱导的二聚化(guntas,g.等,proc.natl.acad.sci.,2015,112,112-117,将每篇按引用并入本文中)。
在一些实施方式中,工程化遗传构建体包含盒,所述盒包含(a)编码至少一种配体依赖性嵌合重组酶的核苷酸序列,和(b)编码目标产物和反选分子的核苷酸序列,其中所述盒侧翼为同源重组酶识别位点。
在一些实施方式中,工程化遗传构建体包含盒,所述盒包含(a)编码重组酶的第一片段的核苷酸序列,(b)编码重组酶的第二片段的核苷酸序列,其中第一片段和第二片段组合(二聚化)时形成全长功能性重组酶(参见,例如,miyamoto,t.等,naturechemicalbiology8:465-470,2012,按引用并入本文中),和(c)编码目标产物和反选标记的核苷酸序列,其中所述盒侧翼为同源重组酶识别位点。
基于核酸酶的切除/降解
在一些实施方式中,工程化遗传构建体包含表达盒(盒),所述表达盒包含(a)可操作地连接于编码核酸酶的核苷酸序列的诱导型启动子,和(b)可操作地连接于编码目标产物和反选标记的核苷酸序列的启动子,其中所述盒包含同源核酸酶识别位点。在一些实施方式中,核酸酶识别位点在所述盒侧翼。在一些实施方式中,组分(a)在组分(b)的上游。在一些实施方式中,终止子序列位于组分(a)和组分(b)之间。参见,例如,图2。
在一些实施方式中,组分(a)包含至少两个诱导型启动子,其各自连接于不同的核酸酶,并且所述盒包含对于不同核酸酶同源的核酸酶识别位点。在一些实施方式中,组分(a)的核苷酸序列编码至少两种不同核酸酶,并且所述盒包含对于不同核酸酶同源的核苷酸识别位点。在一些实施方式中,组分(b)的核苷酸序列编码至少两种反选标记。
在一些实施方式中,核酸酶选自大范围核酸酶和rna指导核酸酶。例如,核酸酶可以是选自内含子核酸内切酶和内含肽(intein)核酸内切酶的大范围核酸酶。在一些实施方式中,核酸酶是选自cas9核酸酶和cpf1核酸酶的rna指导核酸酶。因此,所述盒可以进一步包含编码与核酸酶识别位点互补的指导rna(grna)的核苷酸序列。
核酸酶是切割核酸的单体之间的磷酸二酯键的酶。许多核酸酶,如限制性核酸内切酶,在沿着分子的特定位点处切割dna。将核酸酶切割的这些位点称为核酸酶识别位点。存在着根据本公开可以使用的许多不同类型的核酸酶,包括限制性核酸酶,如大范围核酸酶、rna指导核酸酶、锌指核酸酶和转录激活子样效应核酸酶。
大范围核酸酶(例如,i-scei、i-crei、i-dmoi、e-drel和dmocre)是具有长识别位点(例如,12至40个碱基对的双链dna序列)的脱氧核糖核酸内切酶。因此,这种位点通常在任何给定的基因组中只出现一次。存在着上百种本领域已知的大范围核酸酶。大范围核酸酶主要由总称为归巢核酸内切酶的两个主要酶家族来代表:内含子核酸内切酶和内含肽核酸内切酶。在一些实施方式中,大范围核酸酶是laglidadg家族核酸内切酶。这个家族的名称对应于这个家族的所有蛋白质中发现的、总体保守的氨基酸序列(或基序)。
rna指导核酸酶是通过与包括互补于靶位点的序列的指导rna(grna)链结合而被选择性地指引至其靶位点的核酸内切酶。在一些实施方式中,rna指导核酸酶是成簇的、规律地间隔的、短回文重复(crispr)-crispr相关(cas)系统的成员。在一些实施方式中,rna指导核酸酶是ii型crispr-cas系统的成员。crispr-cas系统被各种细菌和古细菌(archaea)利用来介导对抗病毒和其他外源核酸的防御。外源dna的短片段(称为间隔子)在crispr重复序列之间被整合到基因组中并用作过去暴露的“记忆”。crispr间隔子随后用于以类似于真核生物体中的rnai的方式来识别和沉默外源性遗传元件。ii型crispr-cas系统可以工程化以在体外指引靶向的双链dna断裂至特定序列。rna指导核酸酶(rgn)通常包括两个组分:短的~100个核苷酸的单指导rna(grna),在5’端含有20个可变核苷酸,其涉及与靶dna序列的碱基配对;以及cas9核酸酶,其切割靶dna(jinek,m.等,science337,816-821(2012))。
crispr-cas的特异性由间隔序列的特性决定,所述间隔序列的侧翼是在crispr基因座中编码的直接重复序列,其被转录并加工成成熟的指导rna(grna)(jinek,m等(2012))。借助反式激活小rna(tracrrna),grna许可cas9核酸内切酶在靶dna序列(原间隔子(protospacers))中引入双链断裂(jinek,m.等,(2012);bikard,d.等(2012))。因此,通过crispr基因座中间隔子的简单修饰,rna指导的核酸酶可以指导几乎任何dna序列的切割,其中唯一的设计限制是在原间隔子的紧邻3'侧的ngg基序(jinek,m.等(2012))。
本文中可以使用的rna指导核酸酶的非限制性实例包括cas9和cpf1。
本文可以使用其他可编程核酸酶(和系统),包括锌指核酸酶(zfn)和转录激活子样效应核酸酶(talen)。
反选标记
在一些实施方式中,工程化遗传构建体进一步包含编码反选标记的核苷酸序列。反选标记是促进带有其的细胞死亡的分子(参见,例如,reyrat等,infectimmun.66(9):4011-4017,1998)。例如,在反选化合物的存在下,已经整合包含反选标记的工程化遗传构建体的细胞被消除。因此,可以使用如本文提供的反选标记用于正向选择已经经历导致失去反选标记的切除/降解(擦除子)事件的细胞。在一些实施方式中,工程化遗传构建体的盒包括(至少一种)反选标记,因此反选标记可以位于同源重组酶识别位点之间和/或可以包括核酸酶识别位点。在一些实施方式中,反选标记在编码目标产品的核酸下游。在一些实施方式中,可操作地连接于编码目标产物的核苷酸序列的启动子还可以可操作地连接于编码反选标记的核苷酸序列。
在一些实施方式中,反选标记是前药。前药是在施用后代谢成药物学上活性的药物的药剂或化合物。在一些实施方式中,反选标记是胞嘧啶脱氨酶。胞嘧啶脱氨酶将5-氟胞嘧啶(5-fc)转化成5-氟尿嘧啶(5-fu),其可以导致细胞毒性。在一些实施方式中,反选标记是胸苷激酶(例如,hsv胸苷激酶)。hsv胸苷激酶(hsv-tk)将更昔洛韦转化成毒性产物并且可以用于引发细胞杀灭。其他反选标记(例如,杀灭开关)是已知的并且可以按照本文中提供的来使用。
其他反选标记包括在本公开中,包括,例如,以下描述的那些:deans,t.l.等,cell130,363-372,2007;ramos,c.a等,stemcells,28(6):1107-1115,2010;和chung,h.k.等,naturechemicalbiology,11:713-720,各自按引用并入本文中。
工程化核酸
工程化核酸(例如,工程化遗传构建体)是没有在自然界出现的核酸。然而,应当理解,尽管工程化核酸作为整体不是天然产生的,但它可以包括自然界中存在的核苷酸序列。在一些实施方式中,工程化核酸包含来自不同生物体(例如,来自不同物种)的核苷酸序列。例如,在一些实施方式中,工程化核酸包括鼠核苷酸序列、细菌核苷酸序列、人核苷酸序列和/或病毒核苷酸序列。术语“工程化核酸”包括重组核酸和合成核酸。“重组核酸”是指通过连接核酸分子构建,并且在一些实施方式中,可以在活细胞中复制的分子。“合成核酸”是指扩增的或者化学地或通过其他方式合成的分子。合成核酸包括经化学修饰的或另外地修饰,但可以与天然产生的核酸分子碱基配对的那些。重组核酸和合成核酸还可以包括从前述任一复制产生的那些分子。本公开的工程化核酸可以由单个分子(例如,包括在相同质粒或其他载体中)或由多个不同分子(例如,多个不同的独立复制分子)编码。
可以使用标准分子生物学方法来产生本公开的工程化核酸(参见,例如,green和sambrook,molecularcloning,alaboratorymanual,2012,coldspringharborpress)。在一些实施方式中,使用gibson
启动子是指控制核酸序列的其余部分的转录起始和速率的核酸序列的控制区。启动子还可以含有调节蛋白和分子可以与其结合的子区域,如rna聚合酶和其他转录因子。启动子可以是组成型的、诱导型的、可激活的、可抑制的、组织特异性的或其任意组合。启动子驱动其调节的核酸序列的表达或驱动其转录。在本文中,相对于其调节来控制(“驱动”)核酸序列的转录起始和/或表达的核酸序列处于正确的功能位置和方向时,启动子被认为是可操作地连接的。
组成型启动子是持续激活转录的不受调控的启动子。组成型启动子的非限制性实例包括巨细胞病毒(cmv)启动子、延伸因子1-δ(ef1a)启动子、延伸因子(efs)启动子、mnd启动子(含有修饰的momulvltr及骨髓增生性肉瘤病毒增强子的u3区合成启动子)、磷酸甘油酸激酶(pgk)启动子、脾病灶形成病毒(sffv)启动子、猿猴病毒40(sv40)启动子和泛素c(ubc)启动子。
诱导型启动子是特征在于在信号存在、受信号影响或接触信号时调节(例如,抑制或激活)转录活动的启动子。所述信号可以是内源的或通常外源的条件(例如,光)、化合物(例如,化学或非化学化合物)或蛋白质(例如,细胞因子),其以使得有效地调节从诱导型启动子的转录活性的方式接触诱导型启动子。转录的激活可以涉及直接作用于启动子来驱动转录或通过使防止启动子驱动转录的阻遏剂失活来间接作用于启动子。相反,转录失活可能涉及直接作用于启动子以阻止转录或通过激活随后作用于启动子的阻遏剂间接作用于启动子。如果在信号存在下启动子的转录被激活、失活、提高或降低,则认为启动子对该信号有反应。
在一些实施方式中,终止子序列将编码重组酶和/或核酸酶的核苷酸序列与编码目标产物的下游核苷酸序列分隔开。终止子序列是使得转录停止的核酸序列。终止子可以是单向或双向的。它由参与rna聚合酶的rna转录物的特异性终止的dna序列组成。终止子序列防止通过上游启动子转录激活下游核酸序列。最常用的终止子类型是正向终止子。当置于通常转录的核酸序列的下游时,正向转录终止子将导致转录中止。在一些实施方式中,提供双向转录终止子,其通常引起正向和反向链两者上的转录终止。
在真核系统中,终止子区域可以包括允许新转录产物的位点特异性切割的特定dna序列,使得暴露多腺苷酸化位点。这对于专门的内源性聚合酶给出了在转录产物的3'端添加约200个a残基(聚a)的链段的信号。用这种聚a尾修饰的rna分子似乎更稳定并且更有效地翻译。因此,在一些涉及真核生物的实施方式中,终止子可以包含用于rna的切割的信号。在一些实施方式中,终止子信号促进了信使的多腺苷酸化。终止子和/或多腺苷酸化位点元件可以用于提高输出核酸水平和/或最小化核酸之间的通读。
本文还提供了包含本公开的工程化遗传构建体的载体。在一些实施方式中,所述载体是游离型载体,如质粒或病毒载体(例如,腺病毒载体、逆转录病毒载体、单纯疱疹病毒载体和/或嵌合病毒载体)。
目标产物
通过本公开的工程化遗传构建体编码的产物可以是例如治疗性分子和/或预防性分子。在一些实施方式中,目标产物是蛋白质或肽(例如,治疗性蛋白质或肽)。在一些实施方式中,目标产物是核酸(例如,治疗性核酸)。核酸的实例包括rna、dna或rna和dna的组合。在一些实施方式中,目标产物是dna(例如,单链dna或双链dna)。在一些实施方式中,目标产物是rna。例如,目标产物可以选自rna干扰(rnai)分子,如短发夹rna、短干扰rna和微rna。
治疗性和/或预防性分子的实例,如抗体、酶、激素、炎性剂、抗炎剂、免疫调节剂和抗癌剂。
细胞
在一些实施方式中,本公开提供了包含本文中所述的工程化遗传构建体和/或含有本文中所述的工程化遗传构建体的载体的细胞。
在一些实施方式中,所述细胞是干细胞。例如,干细胞可以是间充质干细胞、造血干细胞、胚胎干细胞或多能干细胞(例如,诱导的多能干细胞)。“干细胞”是指具有在培养物中无限期分裂并产生特化细胞的能力的细胞。“多能性干细胞”是指能够分化成生物体的所有组织,但单独不能够支撑完整的生物体发育的干细胞类型。“人诱导多能性干细胞”是指通过迫使细胞表达对于维持胚胎干细胞的定义属性重要的基因和因子而已经重编程至胚胎干细胞样状态的体细胞(例如,成熟或成体细胞)(参见,例如,takahashi和yamanaka,cell126(4):663-76,2006,按引用并入本文中)。人诱导多能性干细胞表达干细胞标志物并且能够产生全部三个胚层(外胚层、内胚层、中胚层)特征性的细胞。
在一些实施方式中,细胞是免疫细胞。可以如本文中所述使用的免疫细胞的非限制性实例包括自然杀伤(nk)细胞、nkt细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、嗜中性粒细胞、树突状细胞、t细胞和b细胞。t细胞的实例包括,但不限于,cd8+t细胞、cd4+t细胞、γ-δt细胞和t调节细胞(例如,cd4+、foxp3+、cd25+细胞)。在一些实施方式中,t细胞是嵌合抗原受体(car)t细胞(例如,源自单克隆抗体的单链可变片段(scfv)的融合体,其与cd3-ξ跨膜-和胞内结构域融合)。
根据本公开可以使用的细胞系的其他非限制性实例包括293-t、293-t、3t3、4t1、721、9l、a-549、a172、a20、a253、a2780、a2780adr、a2780cis、a431、alc、b16、b35、bcp-1、beas-2b、bend.3、bhk-21、br293、bxpc3、c2c12、c3h-10t1/2、c6、c6/36、cal-27、cgr8、cho、cmlt1、cmt、cor-l23、cor-l23/5010、cor-l23/cpr、cor-l23/r23、cos-7、cov-434、ct26、d17、dh82、du145、ducap、e14tg2a、el4、em2、em3、emt6/ar1、emt6/ar10.0、fm3、h1299、h69、hb54、hb55、hca2、hepa1c1c7、高五细胞(highfivecells)、hl-60、hmec、ht-29、huvec、j558l细胞、jurkat、jy细胞、k562细胞、kcl22、kg1、ku812、kyo1、lncap、ma-mel1、2、3....48、mc-38、mcf-10a、mcf-7、mda-mb-231、mda-mb-435、mda-mb-468、mdckii、mg63、mono-mac6、mor/0.2r、mrc5、mtd-1a、myend、nalm-1、nci-h69/cpr、nci-h69/lx10、nci-h69/lx20、nci-h69/lx4、nih-3t3、nw-145、opcn/opctpeer、pnt-1a/pnt2、ptk2、raji、rbl细胞、renca、rin-5f、rma/rmas、s2、saos-2细胞、sf21、sf9、siha、skbr3、skov-3、t-47d、t2、t84、thp1、u373、u87、u937、vcap、wm39、wt-49、x63、yac-1和yar细胞。
组合物和试剂盒
本文还提供了包括本公开的工程化遗传构建体、包含至少一种本公开的工程化遗传构建体的载体或包含至少一种本公开的工程化遗传构建体的细胞中至少一个的组合物。
本文进一步提供了包括至少一种本公开的工程化遗传构建体或至少一个包含至少一种本公开的工程化遗传构建体的载体的试剂盒。在一些实施方式中,所述试剂盒进一步包括至少一种调节表达盒的诱导型启动子的活性的诱导剂。在一些实施方式中,所述试剂盒进一步包括反选剂。
方法
本公开的方面提供了方法,其包括将至少一种工程化遗传构建体(例如,编码(a)至少一种重组酶和/或至少一种核酸酶和(b)目标产物和至少一种反选标记)引入细胞群体中,其中所述目标产物有助于细胞的分化、扩增或表型维持(持久性)(例如,转录因子、生长因子等)。在一些实施方式中,所述方法进一步包括培养所述群体的细胞并产生目标产物。在一些实施方式中,所述方法进一步包括在诱导剂的存在下培养所述群体的细胞,激活可操作地连接于重组酶的诱导型启动子,以及从工程化遗传构建体切除盒(和/或切除细胞中的异源核酸)。在一些实施方式中,所述方法进一步包括在反选剂的存在下培养所述群体的细胞并杀灭表达反选标记的细胞。在一些实施方式中,所述方法进一步包括将所述群体的细胞递送至受试者(例如,人受试者)。
在一些实施方式中,在反选剂的存在下培养所述群体的细胞的步骤之后,所述群体的低于20%的细胞包含所述盒。在一些实施方式中,在反选剂的存在下培养所述群体的细胞的步骤之后,所述群体的低于15%的细胞包含所述盒。在一些实施方式中,在反选剂的存在下培养所述群体的细胞的步骤之后,所述群体的低于10%的细胞包含所述盒。在一些实施方式中,在反选剂的存在下培养所述群体的细胞的步骤之后,所述群体的低于5%的细胞包括所述盒。
细胞(例如,干细胞或免疫细胞)群体可以包括105-1011个细胞。例如,细胞群体可以包括105、106、107、108、109、1010或1011个细胞。在一些实施方式中,细胞群体是同质细胞群体(全部相同的细胞类型),而在其他实施方式中,细胞群体是异质细胞群体(不同细胞类型的混合物)。
本公开的其他方面提供了将至少一种工程化遗传构建体(例如,编码(a)至少一种重组酶和/或至少一种核酸酶和(b)目标产物和至少一种反选标记)引入细胞群体中,其中所述目标产物是治疗性分子和/或预防性分子。在一些实施方式中,所述方法进一步包括将所述群体的细胞递送至受试者。在一些实施方式中,所述方法进一步包括将受试者暴露于诱导剂以激活诱导型启动子并表达重组酶,和从工程化遗传构建体切除盒(和/或切除细胞中的异源核酸)。在一些实施方式中,所述方法进一步包括将受试者暴露于反选剂并杀灭表达反选标记的细胞。
在一些实施方式中,在将受试者暴露于反选剂的步骤后,所述群体的低于20%的细胞包含所述盒。在一些实施方式中,在将受试者暴露于反选剂的步骤后,所述群体的低于15%的细胞包含所述盒。在一些实施方式中,在将受试者暴露于反选剂的步骤后,所述群体的低于10%的细胞包含所述盒。在一些实施方式中,在将受试者暴露于反选剂的步骤后,所述群体的低于5%(例如,4%、3%、2%或1%)的细胞包含所述盒。
根据本公开的各个方面,所述方法可以包括将本公开的任一种工程化构建体递送至细胞。同样,可以将本文提供的任何细胞递送至受试者,如人受试者。
工程化构建体可以使用病毒递送系统(例如,逆转录病毒、腺病毒、腺相关、辅助依赖性腺病毒系统、杂合腺病毒系统、单纯疱疹、痘病毒、慢病毒、epstein-barr病毒)或非病毒递送系统(例如,物理:裸dna、dna轰击、电穿孔、水动力、超声波或磁转染;或化学:阳离子脂质、不同的阳离子聚合物或脂质聚合物)递送(nayerossadatn等,advbiomedres.2012;1:27,按引用并入本文中)。在一些实施方式中,基于非病毒的递送系统是基于水凝胶的递送系统(参见,例如,brandlf等,journalofcontrolledrelease,2010,142(2):221-228,按引用并入本文中)。
可以通过本领域已知的任何体内递送方法将工程化遗传构建体和/或细胞递送至受试者(例如,哺乳动物受试者,如人受试者)。例如,可以静脉内递送工程化遗传构建体和/或细胞。在一些实施方式中,在递送介质(例如,非脂质体纳米颗粒或脂质体)中递送工程化遗传构建体和/或细胞。在一些实施方式中,将工程化遗传构建体和/或细胞全身性递送至患有癌症或其他疾病的受试者,并且在受试者的癌细胞或患病细胞中特异性地激活(激活转录)。
其他实施方式
1.一种包含盒的工程化遗传构建体,所述盒包含:
(a)可操作地连接于编码重组酶的核苷酸序列的诱导型启动子;和
(b)可操作地连接编码目标产物的核苷酸序列的启动子,
其中所述盒侧翼为同源重组酶识别位点。
2.段落1的工程化遗传构建体,其中(a)在(b)的上游。
3.段落2的工程化遗传构建体,其中终止子序列位于(a)和(b)之间。
4.段落1-3任一的工程化遗传构建体,其中所述重组酶选自酪氨酸重组酶或酪氨酸整合酶。
5.段落4的工程化遗传构建体,其中所述重组酶选自cre、dre、flp、kd、b2、b3、λ、hk022和hp1重组酶。
6.段落1-3任一的工程化遗传构建体,其中所述重组酶选自丝氨酸重组酶或丝氨酸整合酶。
7.段落6的工程化遗传构建体,其中所述重组酶选自γδ、para、tn3、gin、φc31、bxb1和r4重组酶。
8.段落1-7任一段的工程化遗传构建体,其中所述目标产物是治疗性分子或预防性分子。
9.段落1-8任一的工程化遗传构建体,其中所述目标产物是蛋白质或肽。
10.段落1-9任一的工程化遗传构建体,其中所述目标产物是核酸。
11.段落10的工程化遗传构建体,其中所述核酸包括rna、dna或rna和dna的组合。
12.段落10的工程化遗传构建体,其中rna选自短发夹rna、短干扰rna和微rna。
13.段落1-12任一的工程化遗传构建体,进一步包含(c)编码反选标记的核苷酸序列。
14.段落13的工程化遗传构建体,其中反选标记位于同源重组酶识别位点之间。
15.段落13或14的工程化遗传构建体,其中(c)的核苷酸序列在(b)的核苷酸序列的下游。
16.段落9或10的工程化遗传构建体,其中所述反选标记是前药。
17.段落13-16任一的工程化遗传构建体,其中所述反选标记选自胞嘧啶脱氨酶和胸苷激酶。
18.段落1-17任一的工程化遗传构建体,其中所述构建体包含至少两个诱导型启动子,其各自连接于编码不同重组酶的核苷酸序列,并且其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点。
19.段落1-17任一的工程化遗传构建体,其中所述诱导型启动子连接于至少两个核苷酸序列,其各自编码不同的重组酶,并且其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点。
20.段落1-17任一的工程化遗传构建体,其中所述构建体包含至少三个诱导型启动子,其各自连接于编码不同重组酶的核苷酸序列,并且其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点。
21.段落1-17任一的工程化遗传构建体,其中所述诱导型启动子连接于至少三个核苷酸序列,其各自编码不同的重组酶,并且其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点。
22.一种包含盒的工程化遗传构建体,所述盒包含:
(a)至少两种诱导型启动子,其各自可操作地连接于编码不同重组酶的核苷酸序列;和
(b)可操作地连接于编码目标产物和反选分子的启动子,
其中所述盒侧翼为对于不同重组酶同源的重组酶识别位点。
23.一种包含段落1-22任一的工程化遗传构建体的载体。
24.段落23的载体,其中所述载体是质粒或病毒载体。
25.一种包含段落1-22任一的工程化遗传构建体的细胞。
26.一种包含段落23或24的载体的细胞。
27.段落25或26的细胞,其中所述细胞是干细胞。
28.段落27的细胞,其中所述干细胞选自间充质干细胞、造血干细胞、胚胎干细胞和多能干细胞。
29.段落25或26的细胞,其中所述细胞是免疫细胞。
30.段落29的细胞,其中所述免疫细胞选自自然杀伤(nk)细胞、nkt细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、嗜中性粒细胞、树突状细胞、t细胞和b细胞。
31.段落30的细胞,其中所述t细胞选自cd8+t细胞、cd4+t细胞、γ-δt细胞和t调节细胞。
32.段落30或31的细胞,其中所述t细胞是嵌合抗原受体(car)t细胞或工程化t细胞受体(tcr)细胞。
33.一种包含段落1-22任一的工程化遗传构建体的组合物。
34.一种包含段落23或24的载体的组合物。
35.一种包含段落25-32任一的细胞的组合物。
36.一种包括段落1-22任一段的工程化遗传构建体和至少一种调节(a)的诱导型启动子活性的诱导剂的试剂盒。
37.一种包括段落23或24的载体和至少一种调节(a)的诱导型启动子的活性的诱导剂的试剂盒。
38.一种方法,包括将段落1-24任一的工程化遗传构建体引入细胞中,其中所述目标产物有助于细胞的分化、扩增或表型维持(持久性)。
39.段落38的方法,其中(b)的启动子是组成型启动子。
40.段落38或39的方法,进一步包括培养细胞和产生目标产物。
41.段落38-40任一的方法,进一步包括激活(a)的启动子、表达重组酶和切除细胞中的异源核酸。
42.段落41的方法,进一步包括将细胞递送至受试者。
43.一种方法,包括将段落1-24任一的工程化遗传构建体引入细胞中,其中所述目标产物是治疗性或预防性分子。
44.段落43的方法,其中(b)的启动子是组成型启动子。
45.段落43或44的方法,进一步将细胞递送至受试者。
46.段落45的方法,进一步包括激活(a)的启动子、表达重组酶并切除细胞中的异源核酸。
47.一种方法,包括将段落25-32任一的细胞递送至受试者。
48.一种包含盒的工程化遗传构建体,其包含:
(a)可操作地连接于编码核酸酶的核苷酸序列的诱导型启动子;和
(b)可操作地连接于编码目标产物的核苷酸序列的启动子,
其中所述工程化遗传构建体包含同源核酸酶识别位点,任选在所述盒的侧翼。
49.段落48的工程化遗传构建体,其中(a)在(b)的上游。
50.段落49的工程化遗传构建体,其中终止子序列位于(a)和(b)之间。
51.段落48-50任一的工程化遗传构建体,其中所述核酸酶选自大范围核酸酶和rna指导核酸酶。
52.段落51的工程化遗传构建体,其中所述大范围核酸酶选自内含子核酸内切酶和内含肽核酸内切酶。
53.段落51的工程化遗传构建体,其中所述rna指导核酸酶选自cas9核酸酶和cpf1核酸酶。
54.段落d6的工程化遗传构建体,进一步包含(c)编码与核酸酶识别位点互补的指导rna(grna),并位于核酸酶识别位点之间的核苷酸序列。
55.段落48-54任一的工程化遗传构建体,其中所述目标产物是治疗性分子或预防性分子。
56.段落48-55任一的工程化遗传构建体,其中所述目标产物是蛋白质或肽。
57.段落48-56任一的工程化遗传构建体,其中所述目标产物是核酸。
58.段落57的工程化遗传构建体,其中所述核酸包括rna、dna或rna和dna的组合。
59.段落57的工程化遗传构建体,其中所述rna选自短发夹rna、短干扰rna和微rna。
60.段落48-59任一的工程化遗传构建体,进一步包含(c)编码反选标记的核苷酸序列。
61.段落60的工程化遗传构建体,其中所述反选标记位于同源核酸酶识别位点之间。
62.段落60或61的工程化遗传构建体,其中(c)的核苷酸序列在(b)的核苷酸序列的下游。
63.段落56或57的工程化遗传构建体,其中所述反选标记是前药。
64.段落60-63任一的工程化遗传构建体,其中所述反选标记选自胞嘧啶脱氨酶和胸苷激酶。
65.段落48-64任一的工程化遗传构建体,其中所述构建体包含至少两个诱导型启动子,其各自连接于编码不同核酸酶的核苷酸序列,并且其中所述工程化遗传构建体包含同源核酸酶识别位点,任选地在所述盒侧翼。
66.段落48-64任一的工程化遗传构建体,其中所述诱导型启动子连接于至少两个核苷酸序列,其各自编码不同的核酸酶,并且其中所述工程化遗传构建体包含同源核酸酶识别位点,任选地在所述盒侧翼。
67.段落48-64任一的工程化遗传构建体,其中所述构建体包含至少三个诱导型启动子,其各自连接于编码不同核酸酶的核苷酸序列,并且其中所述工程化遗传构建体包含同源核酸酶识别位点,任选地在所述盒侧翼。
68.段落48-64任一的工程化遗传构建体,其中所述诱导型启动子连接于至少三个核苷酸序列,其各自编码不同的核酸酶,并且其中所述工程化遗传构建体包含同源核酸酶识别位点,任选地在所述盒侧翼。
69.一种包含盒的工程化遗传构建体,所述盒包含:
(a)至少两个诱导型启动子,其各自可操作地连接于编码不同核酸酶的核苷酸序列;和
(b)可操作地连接于编码目标产物和反选分子的核苷酸序列的启动子,
其中所述盒侧翼为对于不同核酸酶同源的核酸酶识别位点。
70.一种包含段落48-69任一的工程化遗传构建体的载体。
71.段落70的载体,其中所述载体是质粒或病毒载体。
72.一种包含段落48-69任一的工程化遗传构建体的细胞。
73.一种包含段落70或71的载体的细胞。
74.段落72或73的细胞,其中所述细胞是干细胞。
75.段落74的细胞,其中所述干细胞选自间充质干细胞、胚胎干细胞和多能干细胞。
76.段落72或73的细胞,其中所述细胞是免疫细胞。
77.段落76的细胞,其中所述免疫细胞选自自然杀伤(nk)细胞、nkt细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、嗜中性粒细胞、树突状细胞、t细胞和b细胞。
78.段落77的细胞,其中所述t细胞选自cd8+t细胞、cd4+t细胞、γ-δt细胞和t调节细胞。
79.段落77或78的细胞,其中所述t细胞是嵌合抗原受体(car)t细胞或工程化t细胞受体(tcr)细胞。
80.一种包含段落d1-d22任一的工程化遗传构建体的组合物。
81.一种包含段落70或71的载体的组合物。
82.一种包含段落72-79任一的细胞的组合物。
83.一种包括段落48-69任一的工程化遗传构建体和至少一种调节(a)的诱导型启动子的活性的诱导剂的试剂盒。
84.一种包括段落70或71的载体和至少一种调节(a)的诱导型启动子的活性的诱导剂的试剂盒。
85.一种方法,包括将段落48-71任一的工程化遗传构建体引入细胞中,其中所述目标产物有助于细胞的分化、扩增或表型维持(持久性)。
86.段落85的方法,其中(b)的启动子是组成型启动子。
87.段落85或86的方法,进一步包括培养细胞并产生目标产物。
88.段落85-87任一的方法,进一步包括激活(a)的启动子、表达重组酶和切除细胞中的异源核酸。
89.段落88的方法,进一步包括将细胞递送至受试者。
90.一种方法,包括将段落48-71任一的工程化遗传构建体引入细胞中,其中所述目标产物是治疗性或预防性分子。
91.段落90的方法,其中(b)的启动子是组成型启动子。
92.段落90或91的方法,进一步将细胞递送至受试者。
93.段落92的方法,进一步包括激活(a)的启动子、表达重组酶和切除细胞中的异源核酸。
94.一种方法,包括将段落72-29任一的细胞递送至受试者。
95.一种工程化细胞,包含:
(a)包含可操作地连接于编码配体依赖性嵌合重组酶的核苷酸序列的启动子的核酸;和
(b)包含可操作地连接编码目标产物的核苷酸序列的启动子的核酸,其中(b)的核酸侧翼为同源重组酶识别位点。
96.段落95的工程化细胞,其中所述重组酶是配体依赖性嵌合重组酶。
97.段落96的工程化细胞,其中所述配体依赖性嵌合重组酶连接于突变的人雌激素受体(er)配体结合结构域。
98.段落95-97任一的工程化细胞,其中所述目标产物是治疗性分子或预防性分子。
99.段落95-98任一的工程化细胞,其中所述目标产物是蛋白质或肽。
100.段落95-98任一的工程化细胞,其中所述目标产物是核酸。
101.段落100的工程化细胞,其中所述核酸包括rna、dna或rna和dna的组合。
102.段落101的工程化细胞,其中所述rna选自短发夹rna、短干扰rna和微rna。
103.段落95-102任一的工程化细胞,其中(b)的核酸进一步包含编码反选标记的核苷酸序列。
104.段落103的工程化细胞,其中所述反选标记位于同源核酸酶识别位点之间。
105.段落103或104的工程化细胞,其中所述编码反选标记的核苷酸序列在(b)的核苷酸序列的下游。
106.段落103-105任一的工程化细胞,其中所述反选标记是前药。
107.段落103-105任一的工程化细胞,其中所述反选标记选自胞嘧啶脱氨酶和胸苷激酶。
108.段落95-107任一的工程化细胞,其中所述细胞是干细胞。
109.段落108的工程化细胞,其中所述干细胞选自间充质干细胞、胚胎干细胞和多能干细胞。
110.段落95-107任一的工程化细胞,其中所述细胞是免疫细胞。
111.段落110的工程化细胞,其中所述免疫细胞选自自然杀伤(nk)细胞、nkt细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、嗜中性粒细胞、树突状细胞、t细胞和b细胞。
112.段落111的工程化细胞,其中所述t细胞选自cd8+t细胞、cd4+t细胞、γ-δt细胞和t调节细胞。
113.段落111或112的工程化细胞,其中所述t细胞是嵌合抗原受体(car)t细胞或工程化t细胞受体(tcr)细胞。
114.一种包含段落95-113任一的工程化细胞的组合物。
115.一种试剂盒,包括:
(a)包含可操作地连接于编码配体依赖性嵌合重组酶的核苷酸序列的启动子的核酸;和
(b)包含可操作地连接于编码目标产物的核苷酸序列的启动子的核酸,其中(b)的核酸侧翼为同源重组酶识别位点。
117.段落116的方法,其中所述配体依赖性嵌合重组酶连接于突变的人雌激素受体(er)配体结合结构域。
118.段落116或117的方法,进一步包括将工程化细胞接触诱导剂并切除细胞中的异源核酸。
119.段落118的方法,其中所述诱导剂是4-羟基他莫昔芬(oht)和/或ici182,780(ici)。
120.段落119的方法,进一步包括将工程化细胞递送至受试者。
121.一种工程化细胞,包含:
(a)包含可操作地连接于编码重组酶的第一片段的核苷酸序列的启动子的核酸;
(b)包含可操作地连接于编码重组酶的第二片段的核苷酸序列的启动子的核酸,其中第一片段和第二片段组合时形成全长功能性重组酶;和
(c)包含可操作地连接于编码目标产物的核苷酸序列的启动子的核酸,其中(c)的核酸侧翼为同源重组酶识别位点。
122.段落121的工程化细胞,其中所述第一片段连接于fkbp结构域,而第二片段连接于frb结构域。
123.段落121或122的工程化细胞,其中所述目标产物是治疗性分子或预防性分子。
124.段落121-123任一的工程化细胞,其中所述目标产物是蛋白质或肽。
125.段落121-123任一的工程化细胞,其中所述目标产物是核酸。
126.段落125的工程化细胞,其中所述核酸包括rna、dna或rna和dna的组合。
127.段落126的工程化细胞,其中所述rna选自短发夹rna、短干扰rna和微rna。
128.段落121-127任一的工程化细胞,其中(c)的核酸进一步包含编码反选标记的核苷酸序列。
129.段落128的工程化细胞,其中所述反选标记位于同源核酸酶识别位点之间。
130.段落128或128的工程化细胞,其中所述编码反选标记的核苷酸序列在(c)的核苷酸序列的下游。
131.段落128-130任一的工程化细胞,其中所述反选标记是前药。
132.段落128-130任一的工程化细胞,其中所述反选标记选自胞嘧啶脱氨酶和胸苷激酶。
133.段落121-132任一的工程化细胞,其中所述细胞是干细胞。
134.段落133的工程化细胞,其中所述干细胞选自间充质干细胞、胚胎干细胞和多能干细胞。
135.段落121-132任一的工程化细胞,其中所述细胞是免疫细胞。
136.段落135的工程化细胞,其中所述免疫细胞选自自然杀伤(nk)细胞、nkt细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、嗜中性粒细胞、树突状细胞、t细胞和b细胞。
137.段落136的工程化细胞,其中所述t细胞选自cd8+t细胞、cd4+t细胞、γ-δt细胞和t调节细胞。
138.段落136或137的工程化细胞,其中所述t细胞是嵌合抗原受体(car)t细胞或工程化t细胞受体(tcr)细胞。
139.一种包含段落121-138任一的工程化细胞的组合物。
140.一种试剂盒,包括:
(a)包含可操作地连接于编码重组酶的第一片段的核苷酸序列的启动子的核酸;
(b)包含可操作地连接于编码重组酶的第二片段的核苷酸序列的启动子的核酸,其中所述第一片段和第二片段组合时形成全长功能性重组酶;和
(c)包含可操作地连接于编码目标产物的核苷酸序列的启动子的核酸,其中(c)的核酸侧翼为同源重组酶识别位点。
141.一种方法,包括培养段落121-138任一的工程化细胞并产生目标产物。
142.段落141的方法,其中所述第一片段连接于fkbp结构域,而第二片段连接于frb结构域。
143.段落141或142的方法,进一步包括将工程化细胞接触诱导剂并切除细胞中的异源核酸。
144.段落143的方法,其中所述诱导剂是4-羟基他莫昔芬(oht)和/或ici182,780(ici)。
145.段落144的方法,进一步包括将工程化细胞递送至受试者。
146.一种工程化遗传构建体,包含
盒,其包含(a)可操作地连接于编码第一目标产物的核苷酸序列的启动子,其在(b)可操作地连接于编码第二目标产物和任选地反选标记的核苷酸序列的启动子的上游,其中所述第一目标产物的表达或活性是可激活的(可诱导的)和其中所述第一目标产物调节所述盒的切除或降解。
147.段落146的工程化遗传构建体,其中(a)的启动子是诱导型启动子。
148.段落146或147的工程化遗传构建体,其中所述盒侧翼为重组酶识别位点。
149.段落148的工程化遗传构建体,其中所述第一目标产物是同源重组酶。
150.段落146或147的工程化遗传构建体,其中所述盒侧翼为核酸酶识别位点。
151.段落150的工程化遗传构建体,其中所述第一目标产物是同源核酸酶。
152.段落146-151任一的工程化遗传构建体,其中所述第二目标产物是治疗性分子或预防性分子。
153.一种包含段落146-152任一的工程化遗传构建体的细胞。
154.一种包含段落146-152任一的工程化遗传构建体或段落k8的细胞的组合物或试剂盒。
155.一种将段落153的细胞递送至受试者的方法。
156.一种工程化遗传回路,其包括:
(a)一种或多种通过重组酶基因的可诱导转录、重组酶可诱导的转位至核中和/或分裂重组酶的可诱导的二聚化来调节的重组酶;
(b)一种或多种大范围核酸酶或crispr-cas核酸酶;和/或
(c)一种或多种反选标记。
实施例
实施例1
在这个实施例中,使用重组酶蛋白来切除异源遗传盒(图1)。通过重组酶基因的可诱导转录、重组酶可诱导的转位至核中和/或分裂重组酶的可诱导的二聚化来实现重组酶活性的控制。例如,通过使用强力霉素、根皮素(9)、香草酸(13)、大环内酯类(12)或其他诱导剂来控制重组酶表达。作为另一个实例,重组酶可以与核受体融合,因此在诱导剂不存在的情况下重组酶不催化重组。添加诱导剂如4oht时,重组酶转位至核中并催化重组(14,15)。这种方法已经针对cre、flp和phic31得到了验证,并且可扩展至其他整合酶(15-17)。作为再另一个实例,重组酶蛋白可以分裂成两个本身无活性,但可以通过添加小分子(例如,雷帕霉素类似物)二聚化的片段,这种二聚化是由于与各自与片段中的一个融合的两个蛋白质结构域(例如,fkbp和frb)的相互作用(18)。这种方法已经针对cre得到了证明并且可扩展至其他重组酶。重组酶的文库(19)可以以这种方式来使用。
实施例2
在这个实施例中,通过靶向的双链断裂,使用核酸酶蛋白(如大范围核酸酶或crisp-cas核酸酶)来切除或降解异源遗传盒(图2)。将这些核酸酶编程为在围绕我们的异源dna构建体的特定位点处切割,其已经显示出明显增强遗传删除的效率(20)。添加与待删除区域的侧翼末端同源的供体dna可用于增强删除效率。在一些实施方式中,将这些效应子置于诱导型启动子的控制下。
实施例3
在这个实施例中,使用反选标记,如胞嘧啶脱氨酶或胸苷激酶,来杀灭在切除或降解反应后仍然含有异源dna的细胞(参见图3)。例如,酵母或细菌胞嘧啶脱氨酶将5-氟胞嘧啶(5-fc)转化成5-氟尿嘧啶(5-fu),这可以产生细胞毒性(21,22)。hsv胸苷激酶(hsv-tk)将更昔洛韦转化成毒性产物并且可以用于引发细胞杀灭,尽管根据细胞背景,毒性可能是可变的(23)。可以使用可诱导杀灭开关,其在iptg控制下表达白喉毒素的α链以引发细胞死亡(24)。在一些实施方式中,通过经由小分子的二聚化的可诱导毒素激活可以用于增强细胞杀灭。
实施例4
在这个实施例中,进行瞬时293ft细胞转染分析以测试各种酪氨酸重组酶的重组酶活性。用等比率的报告质粒、重组酶质粒和转染标记质粒(例如,编码bfp的质粒)瞬时转染293ft细胞。分析细胞在转染后24小时的gfp荧光并针对bfp表达进行门控。图6和7显示了来自瞬时293ft细胞转染分析的数据。上图表示gfp+细胞%,而下图表示gfp+细胞的gfp平均荧光强度的中值。
实施例5
在这个实施例中,使用系统来分析重组酶切除效率。将bpii(x2)-hsvtk-sv40pa-egfp-esp3i(x2)盒插入pcdna3.1(+)哺乳动物表达载体(lifetech)中。将重组序列通过goldengate消化/连接插入bpii和esp3i位点中。
实施例6
在这个实施例中,进行瞬时293ft细胞转染分析以测试各种丝氨酸整合酶的重组酶活性。用等比率的报告质粒、重组酶质粒和转染标记质粒(例如,编码bfp的质粒)瞬时转染293ft细胞。分析细胞在转染后24小时的gfp荧光并针对bfp表达进行门控。图9和10显示了来自瞬时293ft细胞转染分析的数据。上图表示gfp+细胞%,而下图表示gfp+细胞的gfp平均荧光强度的中值。
实施例7
在这个实施例中,将编码基于重组酶的切除构建体的进入载体整合至预先工程化的表达yfp和潮霉素的293ft着陆垫细胞系中。参见图11。图12显示gfp报告子成功整合至293ft着陆垫细胞系中。整合时,细胞表达gfp并同时失去yfp的表达。使用嘌呤霉素的选择压力除去了未整合的细胞。
实施例8
这个实施例概述了用于切除基因组整合的构建体的方法。将编码基于重组酶的切除构建体的进入载体整合至预先工程化的293ft着陆垫细胞系中。用重组酶表达质粒和报告质粒(例如,表达bfp)瞬时转染整合的细胞系,并分析随着时间的gfp表达。使用反选标记(csm)来杀灭保留整合的构建体的细胞。参见图13。
用同源重组酶瞬时转染表达3种不同的基于重组酶的切除构建体的细胞系,并且分析随着时间的gfp表达。参见图14。
b3重组酶的瞬时转染后,施用前药以杀灭保留pentr_b3rt切除构建体的细胞。反选标记(csm)将前药转化成毒性药物。在这种情况中,csm是hsvtk,并且前药是更昔洛韦(gcv)。用0.5、1、2和5μmgcv处理细胞7天,并且分析随着时间的gfp表达。柱状图表示gfp-细胞%和gfp+细胞%。参见图15。flp重组酶的瞬时转染后,施加gcv(如上)以杀灭保留pentr_frt切除构建体的细胞。参见图16。
根据所示的时间线,用b3或flp按序转染表达pentr_b3rt_frt基于重组酶的切除构建体的细胞系。随着时间分析gfp表达,并且柱状图表示第15天的gfp+细胞%。pentr_b3rt_frt基于重组酶的切除构建体编码构建体b3rt_frt_icasp9_sv40pa_frt_b3rt_egfp_bghpa,其中b3rt和frt分别是用于b3和flp的重组序列,并且icasp9是反选标记(csm)。参见图19。
根据所示的时间线,用b3或flp按序转染表达pentr_b3rt_frt基于重组酶的切除构建体的细胞系。分析随着时间的gfp表达,并且将第15天的gfp+细胞%作图。参见图20。
实施例9
图17显示了一个系统的实例,其中指导rna(grna)切割并除去基因组整合的回路。在图17中,如果yfp报告子已经稳定地整合至细胞中,grna靶向5’-utr和3’-utr。
使用crispr/cas9进行瞬时转染分析来测试基因组整合的回路的去除。将编码单一grna和cas9的载体与报告质粒(例如,表达bfp)一起转染至表达yfp的细胞系中。在一些情况中,编码不同grna的两个载体与报告质粒一起转染。将细胞群体针对bfp表达进行门控,并且将随着时间的yfp+细胞%绘图。可以使用不同的grna组合来除去yfp。参见图18。
参考文献
1.frakesae,ferraiuolol,haidet-phillipsam,schmelzerl,braunl,mirandacj,ladnerkj,bevanak,foustkd,godboutjp,popovichpg,guttridgedc,kasparbk.microgliainducemotorneurondeathviatheclassicalnf-kappabpathwayinamyotrophiclateralsclerosis.neuron.2014;81(5):1009-23.doi:10.1016/j.neuron.2014.01.013.pubmedpmid:24607225;pmcid:pmc3978641.
2.xiez,wroblewskal,prochazkal,weissr,benensony.multi-inputrnai-basedlogiccircuitforidentificationofspecificcancercells.science.2011;333(6047):1307-11.epub2011/09/03.doi:10.1126/science.1205527.pubmedpmid:21885784.
3.saxenap,hengbc,baip,folcherm,zulewskih,fusseneggerm.aprogrammablesyntheticlineage-controlnetworkthatdifferentiateshumanipscsintoglucose-sensitiveinsulin-secretingbeta-likecells.naturecommunications.2016;7:11247.doi:10.1038/ncomms11247.pubmedpmid:27063289;pmcid:pmc4831023.
4.rogakouep,pilchdr,orrah,ivanovavs,bonnerwm.dnadouble-strandedbreaksinducehistoneh2axphosphorylationonserine139.jbiolchem.1998;273(10):5858-68.pubmedpmid:9488723.
5.barretinaj,caponigrog,stranskyn,venkatesank,margolinaa,kims,wilsoncj,leharj,kryukovgv,sonkind,reddya,lium,murrayl,bergermf,monahanje,moraisp,meltzerj,korejwaa,jane-valbuenaj,mapafa,thibaultj,bric-furlonge,ramanp,shipwaya,engelsih,chengj,yugk,yuj,aspesip,jr.,desilvam,jagtapk,jonesmd,wangl,hattonc,palescandoloe,guptas,mahans,sougnezc,onofriorc,liefeldt,macconailll,wincklerw,reichm,lin,mesirovjp,gabrielsb,getzg,ardliek,chanv,myerve,weberbl,porterj,warmuthm,finanp,harrisjl,meyersonm,golubtr,morrisseymp,sellerswr,schlegelr,garrawayla.thecancercelllineencyclopediaenablespredictivemodellingofanticancerdrugsensitivity.nature.2012;483(7391):603-7.doi:10.1038/nature11003.pubmedpmid:22460905;pmcid:pmc3320027.
6.huangwy,hsusd,huanghy,sunym,chouch,wengsl,huanghd.methhc:adatabaseofdnamethylationandgeneexpressioninhumancancer.nucleicacidsres.2015;43(databaseissue):d856-61.doi:10.1093/nar/gku1151.pubmedpmid:25398901;pmcid:pmc4383953.
7.gureao,turecio,sahinu,tsangs,scanlanmj,jagere,knutha,pfreundschuhm,oldlj,chenyt.ssx:amultigenefamilywithseveralmemberstranscribedinnormaltestisandhumancancer.intjcancer.1997;72(6):965-71.pubmedpmid:9378559.
8.landgrafp,rusum,sheridanr,sewera,iovinon,aravina,pfeffers,ricea,kamphorstao,landthalerm,linc,soccind,hermidal,fulciv,chiarettis,foar,schliwkaj,fuchsu,novosela,mullerru,schermerb,bisselsu,inmanj,phanq,chienm,weirdb,choksir,devitag,frezzettid,trompeterhi,hornungv,tengg,hartmanng,palkovitsm,dilauror,wernetp,macinog,roglerce,naglejw,juj,papavasilioufn,benzingt,lichterp,tamw,brownsteinmj,bosioa,borkhardta,russojj,sanderc,zavolanm,tuschlt.amammalianmicrornaexpressionatlasbasedonsmallrnalibrarysequencing.cell.2007;129(7):1401-14.doi:10.1016/j.cell.2007.04.040.pubmedpmid:17604727;pmcid:pmc2681231.
9.gitzingerm,kemmerc,el-babamd,weberw,fusseneggerm.controllingtransgeneexpressioninsubcutaneousimplantsusingaskinlotioncontainingtheapplemetabolitephloretin.procnatlacadscius
a.2009;106(26):10638-43.doi:10.1073/pnas.0901501106.pubmedpmid:19549857;pmcid:pmc2700147.
10.fuxc,mosers,schlatters,rimannm,baileyje,fusseneggerm.streptogramin-andtetracycline-responsivedualregulatedexpressionofp27kip1senseandantisenseenablespositiveandnegativegrowthcontrolofchinesehamsterovarycells.nucleicacidsresearch.2001;29(4):e19.doi:10.1093/nar/29.4.e19.
11.fusseneggerm,morrisrp,fuxc,rimannm,vonstockarb,thompsoncj,baileyje.streptogramin-basedgeneregulationsystemsformammaliancells.natbiotech.2000;18(11):1203-8.
12.weberw,fuxc,daoud-elbabam,kellerb,webercc,kramerbp,heinzenc,aubeld,baileyje,fusseneggerm.macrolide-basedtransgenecontrolinmammaliancellsandmice.natbiotech.2002;20(9):901-7.doi:http://www.nature.com/nbt/journal/v20/n9/suppinfo/nbt731_s1.html.
13.gitzingerm,kemmerc,flurida,el-babamd,weberw,fusseneggerm.thefoodadditivevanillicacidcontrolstransgeneexpressioninmammaliancellsandmice.nucleicacidsres.2012;40(5):e37.doi:10.1093/nar/gkr1251.pubmedpmid:22187155;pmcid:pmc3300003.
14.hirrlingerj,requardtrp,winkleru,wilhelmf,schulzec,hirrlingerpg.split-creert2:temporalcontrolofdnarecombinationmediatedbysplit-creproteinfragmentcomplementation.plosone.2009;4(12):e8354.doi:10.1371/journal.pone.0008354.pubmedpmid:20016782;pmcid:pmc2791205.
15.feilr,wagnerj,metzgerd,chambonp.regulationofcrerecombinaseactivitybymutatedestrogenreceptorligand-bindingdomains.biochembiophysrescommun.1997;237(3):752-7.doi:10.1006/bbrc.1997.7124.pubmedpmid:9299439.
16.sharman,moldtb,dalsgaardt,jensentg,mikkelsenjg.regulatedgeneinsertionbysteroid-inducedphic31integrase.nucleicacidsres.2008;36(11):e67.doi:10.1093/nar/gkn298.pubmedpmid:18499713;pmcid:pmc2441784.
17.hunternl,awatramanirb,farleyfw,dymeckism.ligand-activatedflpefortemporallyregulatedgenemodifications.genesis.2005;41(3):99-109.doi:10.1002/gene.20101.pubmedpmid:15729687.
18.jullienn,sampierif,enjalberta,hermanjp.regulationofcrerecombinasebyligand-inducedcomplementationofinactivefragments.nucleicacidsres.2003;31(21):e131.pubmedpmid:14576331;pmcid:pmc275488.
19.yangl,nielsenaa,fernandez-rodriguezj,mcclunecj,laubmt,lutk,voigtca.permanentgeneticmemorywith>1-bytecapacity.natmethods.2014.doi:10.1038/nmeth.3147.pubmedpmid:25344638.
20.canvermc,bauerde,dassa,yienyy,chungj,masudat,maedat,pawbh,orkinsh.characterizationofgenomicdeletionefficiencymediatedbyclusteredregularlyinterspacedpalindromicrepeats(crispr)/cas9nucleasesysteminmammaliancells.jbiolchem.2014;289(31):21312-24.doi:10.1074/jbc.m114.564625.pubmedpmid:24907273;pmcid:pmc4118095.
21.negronil,samsonm,guigonisj-m,rossib,pierrefite-carlev,baudoinc.treatmentofcoloncancercellsusingthecytosinedeaminase/5-fluorocytosinesuicidesysteminducesapoptosis,modulationoftheproteome,andhsp90βphosphorylation.molecularcancertherapeutics.2007;6(10):2747-56.doi:10.1158/1535-7163.mct-07-0040.
22.kievite,bershade,nge,sethnap,devi,lawrencets,rehemtullaa.superiorityofyeastoverbacterialcytosinedeaminaseforenzyme/prodruggenetherapyincoloncancerxenografts.cancerres.1999;59(7):1417-21.pubmedpmid:10197605.
23.beckc,cayeuxs,luptonsd,dorkenb,blankensteint.thethymidinekinase/ganciclovir-mediated"suicide"effectisvariableindifferenttumorcells.humangenetherapy.1995;6(12):1525-30.doi:10.1089/hum.1995.6.12-1525.pubmedpmid:8664377.
24.deanstl,cantorcr,collinsjj.atunablegeneticswitchbasedonrnaiandrepressorproteinsforregulatinggeneexpressioninmammaliancells.cell.2007;130(2):363-72.epub2007/07/31.doi:s0092-8674(07)00684-8[pii]10.1016/j.cell.2007.05.045.pubmedpmid:17662949.
25.wroblewskal,kitadat,endok,sicilianov,stillob,saitoh,weissr.mammaliansyntheticcircuitswithrnabindingproteinsforrna-onlydelivery.natbiotechnol.2015;33(8):839-41.doi:10.1038/nbt.3301.pubmedpmid:26237515;pmcid:pmc4532950.
26.mullerpy,miltonmn.thedeterminationandinterpretationofthetherapeuticindexindrugdevelopment.natrevdrugdiscov.2012;11(10):751-61.doi:10.1038/nrd3801.pubmedpmid:22935759.
27.capellic,pedrinio,valgardsdottirr,daroitf,golayj,intronam.clinicalgradeexpansionofmscs.immunollett.2015;168(2):222-7.doi:10.1016/j.imlet.2015.06.006.pubmedpmid:26092523.
本文公开的所有参考文献、专利和专利申请关于其各自所述的主题按引用并入,在一些情况中可以包括所述文件的全部。
如本文在说明书和权利要求书中使用的不定冠词“一(a)”和“一个(an)”,除非明确表示相反,否则应当理解为表示“至少一个”。
还应当理解,除非明确表示相反,在本文要求的任一个包括超过一个步骤或动作的方法中,所述方法的步骤或动作的顺序不必定限于其中所陈述的方法的步骤或动作的顺序。
在权利要求中,以及在以上的说明书中,所有过渡性短语,如“包含(comprising)”、“包括(including)”、“携有(carrying)”、“具有(having)”、“含有(containing)”、“涉及(involving)”、“持有(holding)”、“组成(composedof)”等理解为开放式的,即,表示包括但不限于。只有过渡性短语“由……组成(consistingof)”和“基本上由……组成(consistingessentiallyof)”应当分别是封闭式的或半封闭式的过渡性短语,如美国专利局审查指南第2111.03章节所述的。
- 还没有人留言评论。精彩留言会获得点赞!