促进T细胞应答的方法与流程
本发明涉及促进t细胞应答的方法。
背景技术:
癌症是主要关注的问题,因为它是全球死亡的主要原因,于2012年造成了820万人死亡(全球癌症报告,2014,世界卫生组织)。例如,癌症在美国是仅次于心脏病的第二大常见死亡原因,并且每4例死亡中就有近1例死于癌症(癌症事实和数据2015,美国癌症协会)。尽管存在许多现有的治疗方法,但仍需改进的癌症治疗方法。
t细胞应答代表了抗肿瘤免疫应答的关键要素。对抗肿瘤t细胞应答仍然了解甚少,但一些研究表明,细胞毒性cd8型和辅助cd4型应答起关键作用(motz,gt和coukos,g.解密和逆转肿瘤免疫抑制(decipheringandreversingtumorimmunesuppression).immunity,2013,39:61-73)(bos,r和sherman,la.肿瘤环境中cd4+t细胞辅助是cd8+t淋巴细胞募集和溶细胞功能所必需的(cd4+t-cellhelpinthetumormilieuisrequiredforrecruitmentandcytolyticfunctionofcd8+tlymphocytes).cancerres.,2010,70:8368-8377)(tosolini,m等(2011),不同类型浸润性t细胞毒性和辅助细胞(th1、th2、treg、th17)对结直肠癌患者的临床影响(clinicalimpactofdifferentclassesofinfiltratingtcytotoxicandhelpercells(th1,th2,treg,th17)inpatientswithcolorectalcancer).cancerres.,71:1263-1271)。此外,th17细胞通过将免疫细胞募集到肿瘤、激活效应cd8+t细胞,或甚至直接通过向th1表型转化并产生ifn-γ来驱动抗肿瘤免疫应答(th17细胞可塑性和癌症免疫功能(th17cellplasticityandfunctionsincancerimmunity),leslieguéry和stéphaniehugues,biomedresearchinternational,2015卷(2015))。
最有前景的激活治疗性抗肿瘤免疫的方法之一是阻断免疫检查点。免疫检查点是指硬连接(hardwired)到免疫系统中的大量的抑制通路,其对于保持自身耐受性和最小化附属组织损伤至关重要。现在清楚,肿瘤利用特定的免疫检查点通路,尤其通过骨髓细胞,作为免疫抵抗的主要机制(couzin-frankel,2013;dehenau,rausch等,2016)。
在过去的几年中,越来越多的证据表明肿瘤利用抑制性的c型凝集素受体(clr)的生理过程,特别是那些与伤口愈合有关的过程,来抑制骨髓细胞活化以及促进免疫逃逸。clr具有识别肿瘤细胞引起的异常糖基化的特性,还能识别更多种配体,如垂死细胞释放的脂质、蛋白质或damp(geijtenbeek和gringhuis,2009;yan,kamiya等,2015)。几项实验研究证明,clr通过其在细胞粘附或t细胞应答形成中的功能,来促进癌症发展和转移性扩散(yan,kamiya等,2015;ding,yao等,2017)。例如,已显示,免疫调节受体dc-sign、mincle、dcir和bdca-2抑制骨髓细胞活化、炎症并对驱动foxp3+cd4+cd25+treg扩增至关重要(yan,kamiya等,2015;ding,yao等,2017)。dc-sign识别几乎所有人类癌症上过表达的癌胚抗原(nonaka,ma等,2008),并促进骨髓细胞分泌免疫抑制细胞因子il-10和il-6。此外,dc-sign基因启动子的多态性被发现与结直肠癌患者的风险增加有关(lu,bevier等,2013)。已显示,mincle在胰腺导管腺癌中的肿瘤浸润性白细胞中增强,特别是通过髓样抑制细胞(msc)增强。mincle与垂死细胞释放的sap130(一种组蛋白脱乙酰酶复合物的亚基)的连接会诱导强烈的肿瘤周围抑制(seifert,werba等,2016)。类似地,已显示,clrlox-1在癌症患者的血液或肿瘤浸润性中性粒细胞的细胞表面被特异性增强(15%至50%),而在健康捐献者的血液中几乎检测不到(condamine,dominguez等,2016)。在这项研究中,他们表明内质网应激会诱导lox-1表达并将中性粒细胞转化为具有强抑制功能的msc。
相反,已显示,激活clr(例如dectin-1)的触发信号会增强抗肿瘤免疫力并减少treg和msc(tian,ma等,2013)。给药β-葡聚糖(一种dectin-1的配体)会抑制小鼠癌模型中(li,cai等,2010;masuda,inoue等,2013;tian,ma等,2013)、人黑素瘤、神经母细胞瘤、淋巴瘤异种移植模型中(modak,koehne等,2005)以及人卵巢癌和胃癌中(inoue,tanaka等,1993;oba,kobayashi等,2009)的肿瘤生长。
因此,特别是在该微环境中被诱导的靶向抑制性clr代表了促进骨髓细胞活化和抗肿瘤免疫的具有前景的治疗策略。
在过去,本发明人鉴定出了c型凝集素样受体-1(clec-1)在啮齿动物的同种异体移植耐受性模型中被上调(thebault,lhermite等,2009)。clec-1属于c型凝集素样受体的dectin-1簇(plato,willment等,2013),虽然很久以前就已被鉴定出来,但配体和信号传导仍未被表征。clec-1属于ctlr(包括clec-2、dectin-1、clec-9a、micl、mah和lox-1)的dectin-1簇,虽然很久以前就已被鉴定出来(colonnam,samaridisj,angmanl.两种新型c型凝集素样受体的分子表征,其中一种在人树突细胞中选择性表达(molecularcharacterizationoftwonovelc-typelectin-likereceptors,oneofwhichisselectivelyexpressedinhumandendriticcells).eur.j.immunol.,2000,30(2):697-704),但配体、下游信号和生物效应仍未被表征。clec-1在胞质尾区中不含有免疫受体酪氨酸激活基序(itam)或免疫受体酪氨酸抑制基序(itim),而是含有未表征信号序列中的酪氨酸残基(florneslm,nylennao,saetherpc,dawsmr,dissene,fossums.由大鼠自然杀伤细胞基因复合物编码的受体的完整清单(thecompleteinventoryofreceptorsencodedbytheratnaturalkillercellgenecomplex).immunogenetics,2010,62(8):521-530)。然而,尚不清楚该基序是否经历磷酸化,或者clec-1是否与其他ctlr一样需要衔接子链以稳定表达和信号传导。clec-1同dectin-1、dc-sign或clec-2一样也含有三酸性基序(tri-acidicmotif)[ddd]。有趣的是,这种三酸性基序已被证明可用于dectin-1调节raf-1活性,以及抑制由大多数ctlr诱导的胱天蛋白酶募集域蛋白9(caspaserecruitmentdomain-containingprotein9,card9)依赖性的nf-κb信号通路,以重新编程一组分泌的细胞因子和随后的th1和th17细胞分化的平衡(gringhuissi,dendunnenj,litjensm等.dectin-1通过控制由raf-1和syk的非经典nf-κb活化来指导t辅助细胞分化(dectin-1directsthelpercelldifferentiationbycontrollingnoncanonicalnf-kappabactivationthroughraf-1andsyk).nat.immunol.,2009,10(2):203-213)。到目前为止,关于人clec-1蛋白表达、调节和功能的描述很少。仅有一篇关于clec-1表达的出版物,其公开了:人clec-1只能在内皮细胞的细胞内被检测到,具有类似于内质网蛋白染色模式;tgf-β和炎症刺激都不能促进至细胞表面的显著易位(人c型凝集素样受体clec-1被tgf-β上调且主要位于内质膜区(thehumanc-typelectin-likereceptorclec-1isupregulatedbytgf-βandprimarilylocalizedintheendoplasmicmembranecompartment).sattler等,scand.j.immunol.,2012,75(3):282-92)。因此,现有技术中可获得的关于hclec-1的唯一信息(即,位于内皮细胞的细胞内)与大鼠中已知的信息相反(即,rclec-1位于内皮细胞和骨髓细胞的表面)。
本申请的发明人首次表明,clec-1由常规树突状细胞(cdc)和人血液中单核细胞及树突状细胞(dc)的小亚群在细胞表面表达,并且被免疫接种抑制细胞因子tgfβ增强。他们在啮齿动物和人类中证实,clec-1在骨髓细胞中起抑制性受体的作用,并阻止il12p40表达和下游th1和th17体内应答。
他们还表明,使用抗hclec-1抗体作为clec-1的拮抗剂,会促进人t细胞增殖和人ifn-γ。他们还证明,缺乏clec-1的小鼠对肿瘤生长具有更好的抗性,并且在肝癌小鼠模型中呈现出增加的存活率。本发明人表明,人clec-1由m2型促肿瘤巨噬细胞、来自胸腔积液间皮瘤和卵巢肿瘤腹水的骨髓细胞表达。因此,clec-1作为细胞表面受体可以代表一种有用治疗工具在临床环境中增强抗肿瘤免疫。
技术实现要素:
本发明涉及促进t细胞应答的方法。特别地,本发明由权利要求限定。
附图说明
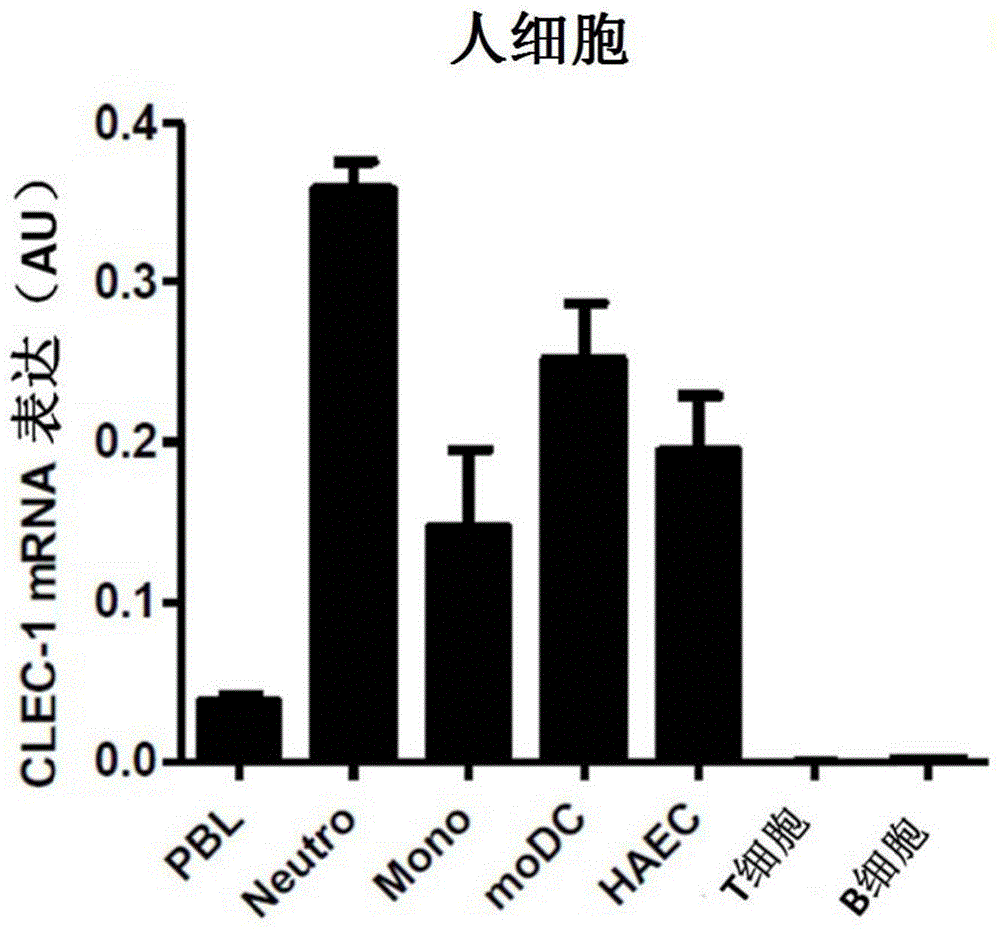
图1:clec-1mrna和蛋白在人体器官和细胞中的表达和调控。
a)通过定量rt-pcr评估在外周血白细胞(pbl)、中性粒细胞(neutro)、单核细胞(mono)、单核细胞衍生的树突细胞(modc)、人主动脉内皮细胞(haec)、t细胞和b细胞中的clec-1mrna表达。
b)通过流式细胞术用mab抗hclec-1对人血液进行评估的igg1同种型或clec-1染色的代表性点和直方图。i)cd45+cd14-cd11c+hla-dr高dc;ii)cd45+cd14+单核细胞;iii)ssc高cd16+嗜中性粒细胞;和iiii)在haec上和在haec内(细胞外和细胞内)。直方图具有clec-1的覆盖图像,其与用对照同种型igg1染色的细胞的直方图相匹配。
c)clec-1在人modc上的表达。i)表达细胞表面clec-1(apc)和hla-dr(fitc)的modc的%的代表性点的图,如材料和方法中所述,通过流式细胞仪用mab抗hclec-1检测未刺激的(us)细胞、lps(tlr4-l)刺激的细胞、polyi:c(tlr3-l)刺激的细胞、r848(tlr7-l)刺激的细胞和tgf-β刺激的细胞。igg1同种型作为对照。ii)直方图表示6次独立实验中clec-1染色的平均荧光强度(mfi)±sem。在us和刺激的细胞之间进行clec-1mfi染色的统计分析。
图2:clec-1触发对人modc成熟和下游t细胞活化的影响。
a)未加试剂进行孵育的人modc、用结合到孔板的抗clec-1mab孵育的人modc、用igg1同种型对照孵育的人modc,使用lps(1μg/ml)对它们同时刺激24小时,收获细胞,并通过流式细胞术评估cd80、cd86、cd83和hla-dr;以及b)通过elisa评估上清液中的tnf-α、il-12p70、il-6、il-23和il-10。
c)然后,洗涤细胞并用同种异体t细胞进行mlr5天。通过流式细胞术用cfse稀释液在同种异体t细胞中评估增殖情况,并且通过elisa评估上清液中的il-17和ifn-γ。
图3:clec-1缺陷(clec-1ko大鼠)对大鼠bmdc成熟、细胞因子分泌和t细胞活化特性的影响。
如材料和方法中所述,从wt或ko大鼠产生bmdc8天,并用来自初生大鼠(
图4:用clec-1fc融合蛋白阻断clec-1信号传导对大鼠bmdc介导的t细胞激活的影响。
在mlr中,用来自初生大鼠的同种异体纯化的cd4+t细胞并和clec-1-fc或者不相关的hseap-fc融合蛋白(在相同条件下产生和纯化)(10μg/ml)将来自wt大鼠的bmdc孵育4天。i)通过流式细胞术用cfse稀释液在cd4+t细胞中评估foxp3+和foxp3-细胞的增殖;和ii)通过elisa在mlr的上清液中评估il-17和ifn-γ细胞因子的产生。直方图所呈现的数据为4次独立实验的平均值±sem。
图5:clec-1缺陷(clec-1ko大鼠)对体内dc介导的cd4+t细胞致敏和th极化命运(thpolarizationfate)的影响。
a)通过定量rt-pcr在来自次级淋巴器官(slo)的大鼠cd103+cd4-(交叉呈递)和cd4+(非交叉呈递)常规dc的不同细胞亚型中评估clec-1mrna的表达(n=5,*p<0.05)。
b)用cfa和klh蛋白(100μg/ml)在足垫中对wt和clec-1ko大鼠进行皮下免疫接种。在免疫接种后第10天,收获膝后窝淋巴结,并在klh或对照ova(25μg/ml)存在的条件下培养3天。i)用cfse稀释液评估cd4+t中的增殖和ii)通过流式细胞术评估门控cd4+t细胞中l-17+、il-17+ifn-γ+和ifn-γ+细胞的比例的直方图和代表性图。直方图所呈现的数据为4次独立实验的平均值±sem。
图6:clec-1的潜在拮抗剂对mlr活化(modc+allot)的影响。
mlr由从外周血中分离的纯化t细胞(5×104)、高水平表达clec-1的同种异体单核细胞衍生的树突状细胞(12.5×103)混合组成。以0.5~10μg/ml的剂量加入同种型对照(igg1)或抗人clec-1抗体5天。然后用羧基荧光素琥珀酰亚胺酯稀释液来评估t细胞的增殖,并通过流式细胞术评估t细胞中的ifn-γ表达,并通过elisa评估上清液中的ifn-γ表达(图6a、b和c,直方图和代表性图)。
图7:癌症中的抑制性检查点clec-1(在啮齿动物中的概念性证明)。
a)在啮齿动物的实体瘤中快速和持久地表达clec-1(hepa1.6肝癌肿瘤细胞被肝内注射到b6小鼠的肝脏中,通过q-pcr评估clec1a表达)。
b)clec-1缺陷型啮齿动物比野生型动物小鼠更能对抗肿瘤:hepa1.6肝癌肿瘤细胞经门静脉被注射到b6wt或clec1a缺陷小鼠的肝脏中,数据以wilcoxson检验小鼠存活率%表示,***p<0.001。
c)大鼠:将c6神经胶质瘤细胞(1百万个)皮下注射到spraguedawley(spd)wt或clec1a缺陷大鼠的胁腹中,并监测肿瘤体积直至第35天。
d)将c6神经胶质瘤细胞(1百万个)皮下注射到spraguedawley(spd)wt或clec1a缺陷大鼠的胁腹中,并在第18天收获肿瘤和淋巴结,并对进行q-pcr以检测inos、ifng和tnfa。数据代表inos、ifng和tnfa相对于hprt表达量的直方图,并以肿瘤(n=3)的任意单位(与同窝wt大鼠中的表达相比,倍数变化的值为1)或淋巴结的交叉比率(n=6,*p<0.05)来表示。
图8:clec-1由m2型促肿瘤巨噬细胞表达,并且由来自胸腔积液间皮瘤和卵巢肿瘤腹水的骨髓细胞表达。
将人单核细胞与m-csf一起培养以产生m0巨噬细胞,然后用ifnγ、lps或il-4培养以产生m1或m2巨噬细胞,如zajac,blood,2013所述。通过q-pcr(a)和流式细胞术(b)评估clec-1表达,n=4,*p<0.05。收集来自间皮瘤的胸腔积液并进行流式细胞术以评估用fcblock和人ab阳性血清(同种型对照)阻断fc受体后cd45+hladr+cd16+骨髓细胞上的clec-1表达(c)。在卵巢癌患者的常规护理期间收集腹水,并在ficoll密度梯度离心后分离单核细胞。使用cd14微珠分离人cd14+细胞,并用automacs进行阳性选择。在用fcblock和人ab阳性血清阻断fc受体后,用同种型对照单克隆抗体或抗人clec-1对cd14+细胞进行染色(d)。
具体实施方式
令人惊讶的是,本发明人研究了clec-1在人dc中的表达和功能,并首次证明了细胞表面表达。本发明人还表明了在人体中,h-clec-1由m2型促肿瘤巨噬细胞、来自胸腔积液间皮瘤和卵巢肿瘤腹水的骨髓细胞表达。他们研究了它在触发t细胞应答机制(orchestration)后的功能作用。
此外,他们用clec-1缺陷型大鼠和大鼠clec-1fc融合蛋白在体外和体内研究了,破坏clec-1信号传导对dc功能和下游t细胞免疫的后果。破坏clec-1信号传导会促进体外th17激活,并在体内促进t细胞致敏(priming)以及th17和th1激活。他们的结果清楚地表明,dc中的clec-1抑制下游th17和th1细胞激活的程度和质量,并且作为细胞表面受体可以提供一种操纵t细胞应答的治疗工具。本发明人还表明,使用抗hclec-1抗体作为clec-1的拮抗剂增加了人t细胞增殖和人ifn-γ。他们还证明,缺乏clec-1的小鼠对肿瘤生长具有更好的抗性,并且在肝癌小鼠模型中表现出增加的存活率。结果表明,clec-1通过提高激活阈值在骨髓细胞中起到抑制性受体的作用。clec-1失活促进t细胞增殖,以及th1和th17极化。
因此,本发明的第一个方面涉及在有需要的受试者中促进t细胞应答的方法,包括向所述受试者施用治疗有效量的clec-1拮抗剂。
根据本发明的方法,其中所述受试者患有癌症。
本发明的另一方面涉及组合物,特别是药物组合物,其包含本发明的clec-1拮抗剂。
如本文所用,术语“t细胞”具有其在本领域中的一般含义,并且是指t淋巴细胞,它是一种在细胞表面上具有t细胞受体并在细胞介导的免疫中起重要作用的淋巴细胞。
如本文所用,术语“t细胞应答”是指任何涉及t细胞增殖和/或细胞因子合成的生物学过程。
t细胞应答可以用本领域技术人员熟知的各种方法通过评估t细胞增殖和/或细胞因子合成来测定。在一个实施方式中,通过进行混合白血球反应(mlr)来测定t细胞应答,所述混合白血球反应由从外周血中分离的纯化t细胞组成,所述外周血混合有表达clec-1的同种异体单核细胞衍生的树突细胞。t细胞增殖可以通过羧基荧光素琥珀酰亚胺酯稀释液来进行评估,ifnγ表达可以通过在t细胞中用流式细胞术和在上清液中用elisa进行评估。
如本文所用,术语“受试者”表示哺乳动物,例如啮齿动物、猫科动物、犬科动物和灵长类动物。优选地,根据本发明的受试者是人。
术语“癌症”在本领域中具有其一般含义,并且是指涉及异常细胞生长的一组疾病,其可能侵入或扩散至身体的其他部分。术语“癌症”还包括原发性癌症和转移性癌症。可通过本发明的方法和组合物进行治疗的癌症实例包括但不限于:来自膀胱、血液、骨、骨髓、脑、乳腺、结肠、食道、胃肠、牙龈、头部、肾脏、肝、肺、鼻咽、颈、卵巢、前列腺、皮肤、胃、睾丸、舌头或子宫的癌细胞。此外,癌症可具体地具有以下组织学类型,但不限于这些:瘤(neoplasm),恶性;上皮癌(carcinoma);上皮癌(carcinoma),未分化的;巨细胞癌和梭形细胞癌;小细胞癌;乳头状癌;鳞状细胞癌;淋巴上皮癌;基底细胞癌;毛母质癌;移行细胞癌;乳头状移行细胞癌;腺癌;胃泌素瘤,恶性;胆管癌;肝细胞癌;合并的肝细胞癌和胆管癌;小梁状腺癌;腺样囊性癌;腺瘤性息肉中的腺癌;腺癌,家族性结肠息肉病;实体癌;类癌瘤,恶性;支气管肺泡腺癌;乳头状腺癌;嫌色细胞癌;嗜酸性粒细胞癌;嗜酸性腺癌;嗜碱性粒细胞癌;透明细胞腺癌;颗粒细胞腺癌;滤泡性腺癌;乳头状和滤泡性腺癌;非包膜性硬化癌;肾上腺皮质癌;子宫内膜样癌;皮肤附属器癌;大汗腺癌;皮脂腺癌;耵聍腺癌;腺癌;粘液表皮样癌;囊腺癌;乳头状囊腺癌;乳头状浆液性囊腺癌;粘液性囊腺癌;粘液腺癌;印戒细胞癌;浸润性导管癌;髓样癌;小叶癌;炎性癌;佩吉特病(paget'sdisease),乳腺的;腺泡细胞癌;腺鳞癌;腺癌伴鳞状化生(adenocarcinomaw/squamousmetaplasia);胸腺瘤,恶性;卵巢间质瘤,恶性;卵泡膜细胞瘤,恶性;颗粒细胞瘤,恶性;母细胞瘤(roblastoma),恶性;支持细胞癌;莱迪希细胞瘤,恶性;脂质细胞瘤,恶性;副神经节瘤,恶性;乳腺外副神经节瘤,恶性;嗜铬细胞瘤;血管球肉瘤;恶性黑色素瘤;无黑色素性黑色素瘤;浅表扩散性黑色素瘤;巨大色素痣中的恶性黑色素瘤;上皮样细胞黑素瘤;蓝痣,恶性;肉瘤;纤维肉瘤;纤维组织细胞瘤,恶性;粘液肉瘤;脂肪肉瘤;平滑肌肉瘤;横纹肌肉瘤;胚胎性横纹肌肉瘤;肺泡横纹肌肉瘤;间质肉瘤;混合瘤,恶性;米勒管混合瘤;肾母细胞瘤;肝母细胞瘤;癌肉瘤;间质瘤,恶性;brenner瘤,恶性;叶状肿瘤,恶性;滑膜肉瘤;间皮瘤,恶性;无性细胞瘤;胚胎癌;畸胎瘤,恶性;甲状腺肿样卵巢瘤,恶性;绒毛膜癌;中肾瘤,恶性;血管肉瘤;血管内皮瘤,恶性;卡波西氏肉瘤;血管外皮细胞瘤,恶性;淋巴管肉瘤;骨肉瘤;近皮质骨肉瘤(juxtacorticalosteosarcoma);软骨肉瘤;软骨母细胞瘤,恶性;间充质软骨肉瘤(mesenchymalchondrosarcoma);骨巨细胞瘤;尤因氏肉瘤;牙源性肿瘤,恶性;成釉细胞牙肉瘤;成釉细胞瘤,恶性;成釉细胞纤维肉瘤;松果体瘤,恶性;脊索瘤;胶质瘤,恶性;室管膜瘤;星形细胞瘤;原浆型星形细胞瘤;纤维性星形细胞瘤;星形母细胞瘤;胶质母细胞瘤;少突神经胶质瘤;成少突神经胶质细胞瘤;原始神经外胚瘤;小脑肉瘤;成神经节细胞瘤;神经母细胞瘤;视网膜母细胞瘤;嗅神经源性肿瘤;脑膜瘤,恶性;神经纤维肉瘤;神经鞘瘤,恶性;颗粒细胞瘤,恶性;恶性淋巴瘤;霍奇金病;霍奇金淋巴瘤;副肉芽肿;恶性淋巴瘤,小淋巴细胞;恶性淋巴瘤,大细胞,弥漫性;恶性淋巴瘤,滤泡;蕈样真菌病;其他特异性的非霍奇金淋巴瘤;恶性组织细胞病;多发性骨髓瘤;肥大细胞肉瘤;免疫增殖性小肠疾病;白血病;淋巴白血病;浆细胞白血病;红白血病;淋巴肉瘤细胞白血病;髓样白血病;嗜碱性白血病;嗜酸粒细胞白血病;单核细胞性白血病;肥大细胞白血病;巨核细胞白血病;骨髓肉瘤;和多毛细胞白血病。
在一些实施方式中,所述受试者患有选自下组的癌症:胆管癌、膀胱癌、骨癌、脑和中枢神经系统癌症、乳腺癌、castleman病、宫颈癌、结直肠癌、子宫内膜癌、食道癌、胆囊癌、胃肠道类癌、霍奇金病、非霍奇金淋巴瘤、卡波西氏肉瘤、肾癌、喉和下咽癌、肝癌、肺癌、间皮瘤、浆细胞瘤、鼻腔和鼻窦癌、鼻咽癌、神经母细胞瘤、口腔和口咽癌、卵巢癌、胰腺癌、阴茎癌(penilecancer)、垂体癌、前列腺癌、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、皮肤癌、胃癌、睾丸癌、胸腺癌、甲状腺癌、阴道癌、外阴癌和子宫癌。
在一个实施方式中,癌症是肝癌(livercancer)。
在一个实施方式中,癌症是肝脏上皮细胞恶性肿瘤(hepatocarcinoma)。
在一个实施方式中,癌症是卵巢癌。
在一个实施方式中,癌症是神经胶质瘤。
如本文所用,“治疗”(treatment)或“治疗”(treating)是用于获得包括临床结果的有益或期望结果的方法。对于本发明的目的,有益的或期望的临床结果包括但不限于以下一种以上:缓解由疾病引起的一种以上症状,减轻疾病的程度,稳定疾病(例如,预防或延迟疾病的恶化),预防或延迟疾病的扩散,预防或延迟疾病的复发,延缓或减缓疾病的进展,改善疾病状态,提供疾病的(部分或全部)缓解,减少治疗疾病所需的一种以上其他药物的剂量,延迟疾病的进展,提高生活质量和/或延长生存期。术语“治疗”包括预防性治疗。如本文所用,术语“预防”是指降低获得或发展给定病症的风险。
如本文所用,术语“clec-1”具有其在本领域中的一般含义,并且是指c型凝集素样受体-1,特别是来自哺乳动物物种,更特别是人clec-1。clec-1属于c-型凝集素样受体(ctlr,包括clec-2、dectin-1、clec-9a、micl、mah和lox-1)的dectin-1簇。
优选地,术语“人clec-1”是指蛋白质,所述蛋白质具有由q8nc01uniprot登录号引用的氨基酸,并且被51267ncbi登录号引用的clec1a基因编码。
特别地,clec-1拮抗剂是人clec-1的拮抗剂。
如本文所用,术语“clec-1拮抗剂”具有其在本领域中的一般含义,并且是指阻断、抑制或降低clec-1生物活性的任何天然或合成的化合物。具体地,clec-1拮抗剂抑制受体clec-1与其至少一种配体之间的相互作用,特别是抑制受体clec-1与其所有配体之间的相互作用。更具体地,clec-1拮抗剂可以与受体clec-1或其任何一种配体结合。clec-1拮抗剂增强t细胞应答,特别是增加t细胞增殖和/或细胞因子(例如ifnγ)合成。
例如,clec-1拮抗剂可通过以下方法识别,所述方法包括以下步骤:
a)提供在细胞表面表达clec-1的多个细胞;
b)用候选化合物孵育所述细胞;
c)测定所述候选化合物是否结合并阻断、抑制或降低clec-1的生物学活性,特别是所述候选物是否促进t细胞应答;
以及d)选择结合并阻断、抑制或降低clec-1的生物活性的候选化合物,特别是促进t细胞应答的候选化合物。
在一些实施方式中,clec-1拮抗剂是有机小分子。术语“有机小分子”是指与通常用于药物的那些有机分子尺寸相当的分子。该术语不包括生物大分子(例如,蛋白质、核酸等)。优选的有机小分子的尺寸范围为至多约5000da,更特别为至多2000da,最特别为至多约1000da。
在一些实施方式中,clec-1拮抗剂是抗体或其抗原结合片段。在一些实施方式中,clec-1拮抗剂是特异性结合clec-1的抗体或其抗原结合片段。
如本文所用,术语“与……特异性结合”(specificallybindsto)或“特异性结合”(bindsspecifically)是指抗原受体与抗原结合的能力,其具有的亲和力至少为1x10-6m、1x10-7m、1x10-8m、1x10-9m、1x10-10m、1x10-11m、1x10-12m或更多,和/或其与靶标结合的亲和力比其与非特异性抗原结合的亲和力大至少2倍。
亲和力可以通过本领域技术人员熟知的各种方法测定。这些方法包括但不限于biacore分析、blitz分析和scatchard图。
在一个实施方式中,根据本发明所述的抗体或其抗原结合片段与clec-1(特别是人clec-1)的kd值为10-8m以下,优选为10-9m以下,更优选为1.10-10m以下,可以通过生物传感器分析(特别是biacore分析)测定。
在一些实施方式中,clec-1的拮抗剂,特别是根据本发明所述的抗体或其抗原结合片段与clec-1(特别是人clec-1)的细胞外结构域特异性结合。
在一个实施方式中,人clec-1的细胞外结构域的氨基酸序列是:yyqlsntgqdtisqmeerlgntsqelqslqvqniklagslqhvaeklcrelynkagahrcspcteqwkwhgdncyqfykdskswedckyfclsenstmlkinkqedlefaasqsyseffysywtgllrpdsgkawlwmdgtpftselfhiiidvtsprsrdcvailngmifskdckelkrcvcerragmvkpeslhvppetlgegd(seqidno:1)。
在一个实施方式中,被clec-1拮抗剂识别,特别是被本发明所述抗体或其抗原结合片段识别的氨基酸序列是:cerragmvkpeslhvppetlgegd(seqidno:2)。
如本文所用,“抗体”包括天然存在的和非天然存在的抗体。具体地,“抗体”包括多克隆、单克隆、重组(包括嵌合和人源化)、双特异性、多特异性和经修饰的抗体,以及其单价和二价抗原结合片段。此外,“抗体”包括嵌合抗体、完全合成的抗体、单链抗体,以及它们的片段。抗体可以是人或非人抗体。非人抗体可以通过重组方法人源化以降低其在人体内的免疫原性。
如本文所用,“经修饰的抗体”对应于包含抗体或其抗原结合片段的分子,其中所述抗体或其片段与功能不同的分子(functionallydifferentmolecule)相关联。
在本文所述抗体或其部分的一个实施方式中,所述抗体是单克隆抗体。在本文所述抗体或其部分的一个实施方式中,所述抗体是完整的人单克隆抗体。在本文所述抗体或其部分的一个实施方式中,所述抗体是多克隆抗体。在本文所述抗体或其部分的一个实施方式中,所述抗体是人源化抗体。在本文所述抗体或其部分的一个实施方式中,所述抗体是嵌合抗体。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的轻链。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的重链。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的fab部分。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的f(ab')2部分。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的fc部分。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的fv部分。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的可变结构域。在本文所述抗体或其部分的一个实施方式中,所述抗体的一部分包含抗体的一个以上cdr结构域。
根据常规方法制备抗体。可以使用kohler和milstein的方法(nature,256:495,1975)生产单克隆抗体。为了制备可用于本发明的单克隆抗体,用clec-1的抗原形式以合适的间隔(例如,每周两次、每周一次、每月两次或每月一次)对小鼠或其它合适的宿主动物进行免疫接种。可以在处死的一周内给动物施用最终的“加量(boost)”抗原。通常理想的是在免疫期间使用免疫佐剂。合适的免疫佐剂包括弗氏完全佐剂、弗氏不完全佐剂、明矾、ribi佐剂、hunter'stitermax、皂苷佐剂如qs21或quila,或含cpg的免疫刺激性寡核苷酸。其他合适的佐剂在本领域中是众所周知的。动物可以通过皮下、腹膜内、肌肉内、静脉内、鼻内或其他途径进行免疫接种。给定的动物可以通过多种途径用多种形式的抗原进行免疫接种。简而言之,重组clec-1可以通过用重组细胞系表达来提供。特别地,clec-1可以以在其表面表达clec-1的人细胞的形式提供。在免疫方案后,从动物的脾、淋巴结或其他器官中分离淋巴细胞,并使用诸如聚乙二醇的试剂,使淋巴细胞与合适的骨髓瘤细胞系融合,以形成杂交瘤。融合后,使用如(编码、单克隆抗体:原理与实践:细胞生物学、生物化学与免疫学中单克隆抗体的制备和应用(coding,monoclonalantibodies:principlesandpractice:productionandapplicationofmonoclonalantibodiesincellbiology,biochemistryandimmunology),第3版,academicpress,纽约,1996)所述的标准方法,将细胞置于允许杂交瘤生长、但不允许融合配偶体生长的培养基中。杂交瘤培养后,分析细胞上清液中所需特异性抗体(即选择性结合抗原)的存在。合适的分析技术包括elisa、流式细胞术、免疫沉淀和蛋白质印迹。其他筛选技术在本领域中是众所周知的。优选技术是那些确认抗体结合构象完整、天然折叠的抗原的技术,例如非变性elisa、流式细胞术和免疫沉淀。
在一个实施方式中,clec-1的拮抗剂选自嵌合抗体、人源化抗体和完全人单克隆抗体。
在一个实施方式中,本发明的抗体是嵌合抗体,特别是嵌合小鼠/人抗体。根据本发明,术语“嵌合抗体”是指包含非人抗体的vh结构域和vl结构域,以及人抗体的ch结构域和cl结构域的抗体。
在一些实施方式中,所述抗体是人源化抗体,特别是人源化单克隆抗体。如本文所用,“人源化”描述了从非人物种产生的抗体,其蛋白质序列已被修饰以增加其与人体天然产生的抗体变体的同一性。因此,在动物中(特别是在啮齿动物中,特别是在大鼠中)最初获得,然后在动物中免疫接种并产生抗体(特别是来自杂交瘤的单克隆抗体)之后,接着所述抗体通过在框架中(并且可选地还在cdr序列中)取代氨基酸残基而在其vh和/或vl序列中被修饰,获得人源化抗体。特别地,相对于原cdr区,所述人源化抗体在单个考虑的cdr区中具有少于10%的突变氨基酸残基,优选具有一个或不具有突变的氨基酸残基。人源化方法包括但不限于在美国专利号4,816,567、5,225,539、5,585,089、5,693,761、5,693,762和5,859,205中描述的那些,在此引入作为参考。
在一些实施方式中,所述抗体是完全人抗体,特别是完全人单克隆抗体。完全人单克隆抗体也可以通过免疫转基因小鼠的大部分人免疫球蛋白重链和轻链基因座来制备。参见,例如,美国专利号5,591,669、5,598,369、5,545,806、5,545,807、6,150,584和其中引用的参考文献,其内容通过引用并入本文。对这些动物进行遗传修饰,使得产生的内源性(例如鼠)抗体存在功能性缺失。所述动物被进一步修饰以含有全部或部分人种系免疫球蛋白基因座,如此这些动物的免疫接种将导致产生针对目标抗原的完全人抗体。在这些小鼠(例如,xenomouse(abgenix)、humab小鼠(medarex/genpharm))的免疫接种之后,可以根据标准杂交瘤技术制备单克隆抗体。这些单克隆抗体将具有人免疫球蛋白氨基酸序列,并因此当施用于人时将不会引起人抗小鼠抗体(kama)反应。还存在产生人抗体的体外方法。这些方法包括噬菌体展示技术(美国专利号5,565,332和5,573,905)和人b细胞的体外刺激(美国专利号5,229,275和5,567,610)。这些专利的内容在此引入作为参考。
各种抗体分子和片段可以衍生自任何公知的免疫球蛋白类别,包括但不限于iga、分泌型iga、ige、igg和igm。igg亚类也是本领域技术人员熟知的,包括但不限于人igg1、igg2、igg3和igg4。
在另一个实施方式中,根据本发明的抗体是单结构域抗体。术语“单结构域抗体”(sdab)或“vhh”指可以在天然缺乏轻链的骆驼科动物哺乳动物中发现的抗体类型的单个重链可变结构域。这种vhh也称为
在一些实施方式中,本发明的抗体不介导抗体依赖性细胞介导的细胞毒性,并因此不包含诱导抗体依赖性细胞毒性(adcc)的fc部分。在一些实施方式中,本发明的抗体不直接或间接导致表达clec-1的细胞的消耗(例如,不导致10%、20%、50%、60%或更多表达clec-1的细胞数量的消除或减少)。在一些实施方式中,本发明的抗体缺乏fc结构域(例如缺少ch2和/或ch3结构域)或包含igg2或igg4同种型的fc结构域。
如本文所用,术语“抗体依赖性细胞介导的细胞毒性”或“adcc”是指细胞介导的反应,其中非特异性细胞毒性细胞(例如,自然杀伤(nk)细胞、中性粒细胞和巨噬细胞)识别靶细胞上结合的抗体,并随后引起靶细胞的裂解。不希望受限于任何特定的作用机制,这些介导adcc的细胞毒性细胞通常表达fc受体(fcr)。
如本文所用,关于表达clec-1的细胞,术语“消耗”指可以杀灭、消除、裂解或诱导这种杀灭、消除或裂解从而对样品或受试者中存在的表达clec-1的细胞数量产生负面影响的过程、方法或化合物。
在一个实施方式中,clec-1拮抗剂是结合抗原的抗体模拟物。
如本文所用,术语“结合抗原的抗体模拟物”指能够结合抗原、模拟抗体的人工蛋白质、肽和任何化合物。
此类模拟物包含亲和素(affitins)和anticalins以及适配体(肽适配体和寡核苷酸核酸适配体)。
在一个实施方式中,clec-1拮抗剂是适配体。适配体是一类分子,其在分子识别方面代表抗体的替代物。适配体是具有以高亲和力和特异性识别几乎任何类别靶分子的能力的寡核苷酸或寡肽序列。这些配体可以通过随机序列文库的指数富集的配体系统进化技术(systematicevolutionofligandsbyexponentialenrichment)(selex)来分离。所述随机序列文库通过组合化学合成dna而获得。在该文库中,每个成员是最终经化学修饰具有独特的序列的线性寡聚体。肽适配体由平台蛋白(例如通过两种杂交方法从组合文库中筛选出来的大肠杆菌硫氧还蛋白a)呈现的构象限制的抗体可变区域组成。
在一些实施方式中,clec-1拮抗剂是多肽。
术语“多肽”在本文中指没有特定长度的氨基酸聚合物。因此,肽、寡肽和蛋白质均包括在“多肽”的定义中,并且这些术语在整个说明书以及权利要求中可互换使用。术语“多肽”不排除翻译后修饰,包括但不限于磷酸化、乙酰化、糖基化等。
在一个实施方式中,本发明的多肽具有2至200个氨基酸的长度。在一个实施方式中,本发明的多肽的长度为2至190个氨基酸,特别是10至180、10至170、10至160、10至150、10至140、10至130、10至120、10至110个氨基酸。在一个实施方式中,本发明的多肽具有10至100个氨基酸的长度。在一个实施方式中,本发明的多肽具有50至100个氨基酸的长度。在一个实施方式中,本发明的多肽的长度为50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个氨基酸。
在一个具体实施方式中,多肽是clec-1的功能等同物。如本文所用,clec-1的“功能等同物(functionallyequivalent)”是能够结合至少一种clec-1配体从而防止其与clec-1的相互作用的化合物。术语“功能等同物”包括clec-1的片段、突变体和突变蛋白。因此,术语“功能等同物”包括通过改变氨基酸序列(例如通过一个以上氨基酸缺失、取代或添加,使得蛋白质类似物保留与其配体结合的能力)而获得的clec-1的任何等同物。氨基酸取代可以通过例如对编码氨基酸序列的dna的点突变来进行。
功能等同物包括但不限于这些分子,所述分子与clec-1的配体结合并且包含clec-1的全部或部分细胞外结构域,以形成能够捕获clec-1的配体的可溶性受体。因此,功能等同物包括clec-1的可溶形式。这些蛋白质或其功能等同物的合适可溶形式可包括,例如,已通过化学、蛋白水解或重组方法从其中除去跨膜结构域的截短形式的蛋白质。特别地,功能等同物由在相应蛋白质的整体长度上与相应蛋白质具有至少80%同一性的序列组成,更特别是由具有至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%同一性的序列组成,甚至更特别是由具有至少99%同一性的序列组成。如本文所用,术语“相应蛋白质”是指与本发明的功能等同物具有类似功能的蛋白质。本发明的描述中参考的同一性百分比是基于待比较序列的全局比对(globalalignment)确定的,也就是说,在其整个长度上进行序列比对,使用例如needleman和wunsch于1970年提出的算法。该序列比对例如可以使用needle软件,通过使用参数“gapopen”等于10.0、参数“gapextend”等于0.5和矩阵“blosum62”来完成。诸如needle的软件可在全球网站ebi.ac.uk上获得,名称为“needle”。本文使用的术语“功能等同片段”还可以指与clec-1的配体结合的任何clec-1的片段或组装片段。因此,本发明提供了一种多肽,特别是一种功能等同物,其能够抑制clec-1与clec-1的至少一种配体结合,所述多肽包含连续氨基酸,所述连续氨基酸的序列对应于clec-1细胞外结构域的至少部分序列,该部分与clec-1的配体结合。在一些实施方式中,所述多肽(特别是所述功能等同物)对应于clec-1的细胞外结构域。
在一些实施方式中,clec-1的功能等同物与异源多肽融合以形成融合蛋白。如本文所用,“融合蛋白”包含与异源多肽(即,除相同多肽之外的多肽)可操作地连接的本发明的功能等同物的全部或(通常是有生物活性的)部分。在融合蛋白内,术语“可操作地连接”旨在表示本发明的功能等同物和异源多肽在框架内彼此融合。异源多肽可以被融合到本发明的功能等同物的n-末端或c-末端。
在一些实施方式中,clec-1的功能等同物与免疫球蛋白恒定区结构域(fc区)融合以形成免疫粘附素。免疫粘附素可具有人抗体的许多有价值的化学和生物学特性。由于免疫粘附素可以由人蛋白质序列构建,其中所述人蛋白序列具有连接到适当的人免疫球蛋白铰链和恒定区结构域(fc)序列的所需特异性,因而可以完全使用人组分来实现目标的结合特异性。这种免疫粘附素对患者具有最低的免疫原性,并且对于慢性或重复使用是安全的。在一些实施方式中,fc区是天然序列fc区。在一些实施方式中,fc区是变体fc区。在又一个实施方式中,fc区是功能性fc区。如本文所用,术语“fc区”用于限定免疫球蛋白重链的c末端区域,包括天然序列fc区和变体fc区。尽管免疫球蛋白重链fc区的边界可能变化,但人igg重链fc区通常被限定为从cys226位点的氨基酸残基或从pro230的氨基酸残基延伸至其羧基末端。免疫粘附素的粘附部分和免疫球蛋白序列部分可以通过最小接头(minimallinker)连接。免疫球蛋白序列通常(但不必须)为免疫球蛋白恒定区结构域。本发明的嵌合体中的免疫球蛋白部分可以由igg1、igg2、igg3或igg4亚型、iga、ige、igd或igm(通常由igg1或igg4)获得。在一些实施方式中,clec-1的功能等同物与免疫粘附素的免疫球蛋白序列部分通过最小接头连接。如本文所用,术语“接头”指连接本发明的多肽和免疫球蛋白序列部分的至少一个氨基酸的序列。这种接头可用于防止空间位阻。在一些实施方式中,接头具有4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30个氨基酸残基。然而,上限并不重要,但是为了例如这种多肽的生物制药生产方便起见而选择上限。接头序列可以是天然存在的序列或非天然存在的序列。如果用于治疗目的,接头在施用免疫粘附素的受试者中通常是非免疫原性的。一组有用的接头序列是如wo96/34103和wo94/04678中描述的衍生自重链抗体铰链区的接头。其他实例是聚丙氨酸接头序列。
对本领域技术人员是显而易见的,本发明的多肽可以通过任何合适的方法产生。为了产生足够量的多肽用于本发明,通过在适当条件下培养含有本发明的多肽的重组宿主细胞,可以方便地实现表达。特别地,通过重组方法通过从编码核酸分子表达产生多肽。用于在多种不同宿主细胞中克隆和表达多肽的系统是众所周知的。当以重组形式表达时,多肽尤其通过从宿主细胞中的编码核酸表达而产生。可以使用任何宿主细胞,这取决于特定系统的个体需求。合适的宿主细胞包括细菌、哺乳动物细胞、植物细胞、酵母和杆状病毒系统。本领域可用于表达异源多肽的哺乳动物细胞系包括中国仓鼠卵巢细胞、hela细胞、幼仓鼠肾细胞和许多其他细胞。细菌也是生产重组蛋白的优选宿主,因为细菌可以容易地被操作和生长。常见的优选细菌宿主是大肠杆菌。
根据本发明的本发明多肽,其片段和融合蛋白可以呈现翻译后修饰,包括但不限于糖基化(例如,n-连接或o-连接的糖基化)、肉豆蔻酰化、棕榈酰化、乙酰化和磷酸化(例如,丝氨酸/苏氨酸或酪氨酸)。
在一些实施方式中,可以预期的是,可以修饰本发明治疗方法中使用的多肽以改善其治疗功效。治疗性化合物的这种修饰可用于降低毒性、增加循环时间或改变生物分布。例如,通过与改变生物分布的各种药物载体赋形剂(vehicle)的结合,可以显着降低潜在重要治疗性化合物的毒性。
本发明的另一方面涉及在有需要的受试者中(特别是通过促进t细胞应答)治疗癌症的方法,包括向受试者施用治疗有效量的clec-1拮抗剂。
因此,本发明涉及clec-1的拮抗剂,其用于治疗癌症,特别是通过促进t细胞应答治疗癌症。
因此,本发明涉及clec-1拮抗剂在制备用于(特别是通过促进t细胞应答)治疗癌症的药物中的用途。
在一些实施方式中,本发明的clec-1拮抗剂以治疗有效量施用于受试者。
术语“施用”或“给药”指将存在于体外的物质(例如,本发明的clec-1拮抗剂)注射或以其他方式物理递送至受试者中的行为,例如通过粘膜、皮内、静脉内、皮下、肌内、关节内递送和/或本文所述或本领域已知的任何其他物理递送方法。当治疗疾病或其症状时,通常在疾病或其症状发作之后施用该物质。当预防疾病或其症状时,通常在疾病或其症状发作之前施用该物质。
“治疗有效量”是指足够量的clec-1拮抗剂,其用于以合理利益/风险比治疗癌症的适用于任何医学治疗的方法中。应当理解,本发明化合物和组合物的每日总用量将由主治医师在合理的医学判断范围内决定。任何特定受试者的特定治疗有效剂量水平将取决于多种因素,包括受试者的癌症的严重程度、年龄、体重、一般健康状况、性别和饮食;给药时间、给药途径和所用特定化合物的排出率;治疗的持续时间;以及医学领域众所周知的因素。例如,本领域技术人员众所周知的是,以低于实现所需治疗效果所需的水平开始化合物的剂量,并逐渐增加剂量直至实现所需效果。然而,产品的每日剂量可在每个成人每天0.01~1,000mg的宽范围内变化。通常,组合物含有0.01、0.05、0.1、0.5、1.0、2.5、5.0、10.0、15.0、25.0、50.0、100、250和500mg活性成分,用于对待治疗的受试者的剂量的症状调整。药物通常含有约0.01mg至约500mg活性成分,通常含有1mg至约100mg活性成分。通常以每天0.0002mg/kg至约20mg/kg体重的剂量水平提供有效量的药物,特别是每天约0.001mg/kg至7mg/kg体重。
根据本发明的组合物配制用于肠胃外、透皮、口服、直肠、皮下、舌下、局部或鼻内给药。
合适的单位给药形式包括口服途径形式,例如片剂、凝胶胶囊、粉末、颗粒和口服悬浮液,或溶液、舌下和口腔给药形式,气溶胶、植入物、皮下(subcutaneous)、透皮、局部、腹膜内、肌内、静脉内、皮下(subdermal)、透皮、鞘内和鼻腔给药形式和直肠给药形式。
在一个实施方式中,根据本发明的组合物,特别是药物组合物被配制用于非肠胃给药。药物组合物含有赋形剂,所述赋形剂对于能被注射的制剂是药学上可接受的。这些可以具体是等渗的、无菌的、含盐的溶液(磷酸一钠或磷酸二钠、氯化钠、氯化钾、氯化钙或氯化镁等或这些盐的混合物),或干燥的,特别是冷冻干燥的组合物,根据情况,这些组合物加入无菌水或生理盐水,可以制成可注射溶液。
在一个优选的实施方式中,根据本发明的组合物被配制成用于静脉内给药。在另一个实施方式中,根据本发明的组合物被配制成用于口服给药。
通常,将本发明的活性成分(即clec-1拮抗剂)与药学上可接受的赋形剂(excipient)以及可选的缓释基质(例如可生物降解的聚合物)组合,形成药物组合物。
术语“药学的”或“药学上可接受的”指当被适当地施用于哺乳动物,特别是人时,不产生不利、过敏或其他不良反应的分子实体和组合物。
药学上可接受的载体或赋形剂是指无毒的固体、半固体或液体填充剂、稀释剂、包封材料或任何类型的制剂助剂。载体也可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、它们的合适混合物以及植物油。例如,通过使用诸如卵磷脂的涂层,通过在分散的情况下保持所需的粒度以及通过使用表面活性剂,可以保持适当的流动性。可以通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等来防止微生物的作用。在许多情况下,优选包括等渗剂,例如糖或氯化钠。通过在组合物中使用延迟吸收的试剂,例如单硬脂酸铝和明胶,可以实现可注射组合物的延长吸收。
在一些实施方式中,本发明的clec-1拮抗剂与第二活性成分组合施用于受试者。
所述第二活性成分包括但不限于如下所述的益生菌和治疗剂。
因此,本发明涉及clec-1拮抗剂与第二活性成分的组合,用于治疗癌症。
在一些实施方式中,本发明的clec-1拮抗剂与标准(常规)治疗组合施用于受试者。因此,本发明涉及clec-1拮抗剂与常规治疗的组合,用于治疗癌症。
如本文所用,术语“标准或常规治疗”是指通常施用于患有癌症的受试者的任何癌症治疗(药物、放射疗法等)。
在一些实施方式中,本发明的clec-1拮抗剂与至少一种其他治疗剂组合施用于受试者,例如用于治疗癌症。这种施用可以是同时地、分别地或按顺序地。对于同时施用,药剂可以视情况作为一种组合物或作为分别的组合物施用。其他治疗剂通常与待治疗的病症有关。示例性治疗剂包括其他抗癌抗体、细胞毒性剂、化学治疗剂、抗血管生成剂、抗癌免疫原、细胞周期控制/凋亡调节剂、激素调节剂和下述其他药剂。
在一些实施方式中,本发明的clec-1拮抗剂与化学治疗剂、靶向癌症疗法、免疫治疗剂或放射疗法组合使用。
在一些实施方式中,本发明的clec-1拮抗剂与化学治疗剂组合使用。因此,本发明涉及clec-1拮抗剂与化学治疗剂的组合,用于治疗癌症。
术语“化学治疗剂”是指有效抑制肿瘤生长的化合物。化学治疗剂的实例包括烷化剂,例如三胺硫磷和环磷酰胺;烷基磺酸盐,例如白消安(busulfan)、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮杂环丙烷,例如苯佐替派(benzodopa)、卡波醌(carboquone)、美妥替哌(meturedopa)和乌瑞替哌(uredopa);乙烯亚胺和甲基氨基吖啶(methylamelamine),包括六甲蜜胺(altreremine)、三乙蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三甲蜜胺;聚乙酸类(acetogenins),特别是布拉它辛(bullatacin)和布拉他辛酮(bullatacinone);喜树碱(carnptothecin),包括合成的类似物托泊替康(topotecan);苔藓抑素(bryostatin);卡利斯塔叮(callystatin);cc-1065,包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物;隐藻素类(cryptophycins)(特别是隐藻素1和隐藻素8);多拉司他汀(dolastatin);倍癌霉素(duocarmycin)(包括合成类似物、kw-2189和cbi-tmi);五加素(eleutherobin);全能花碱(pancratistatin);匍枝珊瑚酉享(sarcodictyin);软海绵素(spongistatin);氮芥类(nitrogenmustards),如苯丁酸氮芥(chlorambucil)、萘氮芥(chlornaphazine)、胆磷酰胺(cholophosphamide)、雌莫司汀(estrarnustine)、异环磷酰胺(ifosfamide)、氮芥(mechlorethamine)、盐酸甲氧氮芥(mechlorethamineoxidehydrochloride)、美法仑(melphalan)、新氮芥(novembichin)、苯芥胆甾醇(phenesterine)、松龙苯芥(prednimustine)、氯乙环磷酰胺(trofosfamide)、脲嘧啶氮芥(uracilmustard);亚硝基脲类(nitrosureas),如卡莫司汀(carmustine)、吡葡亚硝脲(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)、雷尼司汀(ranimustine);抗生素如烯二炔类抗生素,例如加利车霉素(calicheamicin),特别是加利车霉素11和加利车霉素211,参见,例如agnewchemintl.ed.engl.33:183-186(1994);迪呢霉素(dynemicin),包括迪呢霉素a;埃斯佩拉霉素(esperamicin);以及新制癌菌素发色团(neocarzinostatinchromophore)和相关的色素蛋白烯二炔抗生素发色团(chromoproteinenediyneantiobioticchromomophore);阿克拉霉素(aclacinomysins);放线菌素(actinomycin);安曲霉素(authramycin);重氮丝氨酸(azaserine);博来霉素类(bleomycins);放线菌素c(cactinomycin);卡柔比星(carabicin);洋红霉素(canninomycin);嗜癌素(carzinophilin);色霉素(chromomycins);放线菌素d(dactinomycin);道诺霉素(daunorubicin);地托比星(detorubicin);重氮氧代正亮氨酸(6-diazo-5-oxo-l-norleucine);多柔比星(doxorubicin),包括吗啉代-多柔比星(morpholino-doxorubicin)、氰基吗啉代-多柔比星(cyanomorpholino-doxorubicin)、2-吡咯啉基-多柔比星(2-pyrrolino-doxorubicin)和脱氧比星(deoxydoxororicicin);表柔比星(epirubicin);依索比星(esorubicin);伊达比星(idanrbicin);麻西罗霉素(marcellomycin);丝裂霉素(mitomycins);霉酚酸(mycophenolicacid);诺加霉素(nogalarnycin);橄榄霉素(olivomycins);培洛霉素(peplomycin);泊非霉素(potfiromycin);嘌呤霉素(puromycin);三铁阿霉素(quelamycin);罗多比星(rodorubicin);链黑菌素(streptomgrin);链脲霉素(streptozocin);杀结核菌素(tubercidin);乌苯美司(ubenimex);净司他丁(zinostatin);佐柔比星(zorubicin);抗代谢物,如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,如二甲叶酸(denopterin)、甲氨蝶呤(methotrexate)、蝶罗呤(pteropterin)、曲美沙特(trimetrexate);嘌呤类似物,如氟达拉滨(fludarabine)、6-巯基嘌呤(6-mercaptopurine)、硫咪嘌呤(thiamiprine)、硫鸟嘌呤(thioguanine);嘧啶类似物,如安西他滨(ancitabine)、阿扎胞苷(azacitidine)、6-氮尿苷(6-azauridine)、卡莫氟(carmofur)、阿糖胞苷(cytarabine)、双脱氧尿苷(dideoxyuridine)、多西氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿苷(floxuridine)、5-fu;雄激素如卡鲁睾酮(calusterone)、丙酸甲雄烷酮(dromostanolonepropionate)、环硫雄醇(epitiostanol)、美雄烷(mepitiostane)、睾内脂(testolactone);抗肾上腺素,如氨鲁米特(aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂如弗罗林酸(frolinicacid);醋葡醛内酯(aceglatone);醛磷酰胺糖苷(aldophospharnideglycoside);氨基酮戊酸(aminolevulinicacid);安吖啶(amsacrine);阿莫司汀(bestrabucil);比生群(bisantrene);依达曲沙(edatraxate);地佛法明(defofamine);地美可辛(demecolcine);地吖醌(diaziquone);依洛尼塞(elfomithine);依利醋铵(elliptiniumacetate);埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓(galliumnitrate);羟基脲(hydroxyurea);香菇多糖(lentinan);洛尼代宁(lonidainine);美登木素类,如美登素(maytansine)和安丝菌素(ansamitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫匹丹莫(mopidanmol);二胺硝吖啶(nitraerine);喷司他汀(pentostatin);苯来美特(phenamet);吡柔比星(pirarubicin);鬼臼酸(podophyllinicacid);2-乙基酰肼(2-ethylhydrazide);甲苄肼(procarbazine);
该定义还包括用于调节或抑制对肿瘤的激素作用的抗激素剂,例如抗雌激素,包括例如他莫昔芬(tamoxifen)、雷洛昔芬(raloxifene)、芳香酶抑制4(5)-咪唑(aromataseinhibiting4(5)-imidazoles)、4-羟基三苯氧胺(4-hydroxytamoxifen)、三恶唑(trioxifene)、雷洛昔芬(keoxifene)、ly117018、奥那司酮(onapristone)和托瑞米芬(fareston);和抗雄激素,如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮丙瑞林(leuprolide)和戈舍瑞林(goserelin);以及任何上述的药学上可接受的盐、酸或衍生物。
在一些实施方式中,本发明的clec-1拮抗剂与靶向癌症疗法组合使用。因此,本发明涉及clec-1拮抗剂与靶向疗法的组合,用于治疗癌症。
靶向癌症疗法是通过干扰参与癌症生长、发展和扩散的特定分子(“分子靶标”)来阻断癌症生长和扩散的药物或其他物质。靶向癌症疗法有时被称为“分子靶向药物”、“分子靶向疗法”、“精准药物”或类似名称。在一些实施方式中,靶向疗法包括向受试者施用酪氨酸激酶抑制剂。术语“酪氨酸激酶抑制剂”是指作为受体和/或非受体酪氨酸激酶的选择性或非选择性抑制剂的多种治疗剂或药物中的任何一种。酪氨酸激酶抑制剂和相关化合物是本领域熟知的,并描述于美国专利公开2007/0254295中,其通过引用整体并入本文。本领域技术人员将理解,与酪氨酸激酶抑制剂相关的化合物将概括酪氨酸激酶抑制剂的作用,例如,相关化合物将作用于酪氨酸激酶信号通路的不同成员,以产生与酪氨酸激酶的酪氨酸激酶抑制剂相同的作用。适用于本发明实施方式的方法的酪氨酸激酶抑制剂和相关化合物的实例包括但不限于:达沙替尼(bms-354825)、pp2、bez235、塞卡替尼(saracatinib)、吉非替尼(iressa)、舒尼替尼(sutent;su11248)、厄洛替尼(tarceva;osi-1774)、拉帕替尼(gw572016;gw2016)、卡奈替尼(ci1033)、semaxinib(su5416)、瓦他拉尼(ptk787/zk222584)、索拉非尼(bay43-9006)、伊马替尼(gleevec;sti571)、来氟米特(su101)、凡德他尼(zactima;zd6474)、mk-2206(8-[4-(1-氨基环丁基)苯基]-9-苯基-1,2,4-三唑并[3,4-f][1,6]萘啶-3(2h)-酮盐酸盐),它们的衍生物,它们的类似物,以及它们的组合。适用于本发明的其他酪氨酸激酶抑制剂和相关化合物被描述于,例如,美国专利公开2007/0254295,美国专利号5,618,829、5,639,757、5,728,868、5,804,396、6,100,254、6,127,374、6,245,759、6,306,874、6,313,138、6,316,444、6,329,380、6,344,459、6,420,382、6,479,512、6,498,165、6,544,988、6,562,818、6,586,423、6,586,424、6,740,665、6,794,393、6,875,767、6,927,293和6,958,340,所有这些都通过引用整体并入本文。在一些实施方式中,酪氨酸激酶抑制剂是已被口服给药的小分子激酶抑制剂,并且已成为至少一个i期临床试验,更优选至少一个ii期临床试验,甚至更优选至少一个iii期临床试验的主题,并且最优选被fda批准用于至少一种血液学或肿瘤学指征。此类抑制剂的实例包括但不限于:吉非替尼(gefitinib)、厄洛替尼(erlotinib)、拉帕替尼(lapatinib)、卡奈替尼(canertinib)、bms-599626(ac-480)、来那替尼(neratinib)、krn-633、cep-11981、伊马替尼(imatinib)、尼罗替尼(nilotinib)、达沙替尼(dasatinib)、azm-475271、cp-724714、tak-165、舒尼替尼(sunitinib)、瓦他拉尼碱(vatalanib)、cp-547632、凡德他尼(vandetanib)、博舒替尼(bosutinib)、来他替尼(lestaurtinib)、坦度替尼(tandutinib)、米哚妥林(midostaurin)、enzastaurin、aee-788、帕唑帕尼(pazopanib)、阿西替尼(axitinib)、莫特沙芬(motasenib)、osi-930、西地尼布(cediranib)、krn-951、多韦替尼(dovitinib)、seliciclib、sns-032、pd-0332991、mkc-i(ro-317453;r-440)、索拉非尼(sorafenib)、abt-869、布立尼布(bms-582664)、su-14813、替拉替尼(telatinib)、su-6668、(tsu-68)、l-21649、mln-8054、aew-541和pd-0325901。
在一些实施方式中,本发明的clec-1拮抗剂与免疫治疗剂组合使用。因此,本发明涉及clec-1拮抗剂与免疫治疗剂的组合,用于治疗癌症。
如本文所用,术语“免疫治疗剂”是指间接或直接增强、刺激或增加身体对癌细胞的免疫应答和/或降低其他抗癌疗法的副作用的化合物、组合物或治疗。因此,免疫疗法是直接或间接刺激或增强免疫系统对癌细胞的反应和/或减轻可能由其他抗癌剂引起的副作用的疗法。免疫疗法(immunotherapy)在本领域中也称为免疫疗法(immunologictherapy)、生物疗法(biologicaltherapy)、生物反应调节剂疗法和生物疗法(biotherapy)。本领域已知的常见免疫治疗剂的实例包括但不限于:细胞因子、癌症疫苗、单克隆抗体和非细胞因子佐剂。或者,免疫治疗可以由向受试者施用一定量的免疫细胞(t细胞、nk细胞、树突细胞、b细胞......)组成。免疫治疗剂可以是非特异性的,即广泛地增强免疫系统以使人体更有效地对抗癌细胞的生长和/或扩散,或者它们可以是特异性的,即靶向癌细胞本身,免疫治疗方案可以结合使用非特异性免疫治疗剂和特异性免疫治疗剂。非特异性免疫治疗剂是刺激或间接改善免疫系统的物质。非特异性免疫治疗剂已被单独用作治疗癌症的主要疗法;以及在除了主要疗法之外的情况下,非特异性免疫治疗剂作为佐剂起作用以增强其他疗法(例如,癌症疫苗)的有效性。非特异性免疫治疗剂也可以在后一种情况下起作用以减少其他疗法的副作用,例如由某些化学治疗剂引起的骨髓抑制。非特异性免疫治疗剂可作用于关键的免疫系统细胞并引起二次应答,例如细胞因子和免疫球蛋白的产生量增加。或者,药剂本身可包含细胞因子。非特异性免疫治疗剂通常分类为细胞因子或非细胞因子佐剂。已发现许多细胞因子作为旨在增强免疫系统的一般非特异性免疫疗法或作为与其他疗法一起提供的佐剂应用于癌症治疗。合适的细胞因子包括但不限于干扰素、白细胞介素和集落刺激因子。本发明考虑的干扰素(ifn)包括ifn的常见类型,ifn-α、ifn-β和ifn-γ。ifn可以直接作用于癌细胞,例如,通过减缓它们的生长、促进它们发育成具有更正常行为的细胞和/或增加它们的抗原产生从而使癌细胞更容易被免疫系统识别和破坏。ifn还可以间接作用于癌细胞,例如,通过减慢血管生成、增强免疫系统和/或刺激自然杀伤(nk)细胞、t细胞和巨噬细胞。重组ifn-α可作为roferon(rochepharmaceuticals)和introna(scheringcorporation)商购获得。本发明考虑的白细胞介素包括il-2、il-4、il-11和il-12。市售的重组白介素的实例包括
在一些实施方式中,本发明的clec-1拮抗剂与放射疗法组合使用。因此,本发明涉及clec-1拮抗剂与放射疗法的组合,用于治疗癌症。
放射疗法可以包括对患者进行辐射或放射性药物的相关给药。辐射源可以在待治疗患者的外部或内部(放射治疗可以是例如外部束放射治疗(ebrt)或近距离放射治疗(bt)的形式)。可用于实施这些方法的放射性元素包括例如镭、铯-137、铱-192、镅-241、金-198、钴-57、铜-67、锝-99、碘(iodide)-123、碘-131和铟-111。
在一个实施方式中,本发明涉及clec-1拮抗剂的筛选方法,包括以下步骤:
a)提供在细胞表面表达clec-1的多个细胞;
b)用候选化合物孵育所述细胞;
c)测定所述候选化合物是否结合并阻断、抑制或降低clec-1的生物学活性,以及所述候选物是否促进t细胞应答;
以及d)选择结合并阻断、抑制或降低clec-1的生物活性并促进t细胞应答的候选化合物。
在一个具体实施方式中,本发明的筛选方法可以进一步包括步骤:将步骤d)中选择的候选化合物施用于动物模型以验证所述候选化合物物的保护和/或治疗效果。
通常,这种筛选方法涉及提供在其表面上表达clec-1的合适细胞。特别地,编码clec-1的核酸可用于转染细胞,从而表达本发明的受体。这种转染可以通过本领域熟知的方法完成。
本发明还涉及制备用于治疗癌症的化合物的方法,所述方法包括步骤:识别能够促进t细胞应答的clec-1拮抗剂。
通过以下附图和实施例进一步对本发明进行说明。然而,这些实施例和附图不应以任何方式被解释为限制本发明的保护范围。
实施例1
方法&材料
动物
大鼠购自“centred’elevagejanvier”(genest,saint-isle,法国),实验程序严格按照卢瓦尔河地区动物实验伦理委员会(committeeontheethicsofanimalexperimentsofpaysdelaloire)批准的协议进行,并得到法国政府高等教育和研究部的授权。clec-1敲除(knockout,ko)由转基因大鼠和免疫表型平台(immunophenomicsplatform)设施(sfr-santé-nantes)在近亲交配rt1alewis背景中用锌指核酸酶(zfn)技术产生。通过蛋白质印迹法证实了预期大小为32kda的clec-1蛋白的缺乏。
抗体
通过淋巴细胞体细胞杂交(biotem,apprieu,法国),用编码hclec-1细胞外结构域的肽免疫balb/c小鼠,来产生抗人clec-1单克隆抗体(mab),并通过elisa筛选重组人clec-1蛋白(rd系统)对其进行选择,然后通过蛋白a层析对其进行纯化。抗人clec1mab(igg-d6)来自santacruzbiotechnologies(dallas,ca)。纯化的抗大鼠-β-肌动蛋白、cd3(g4.18);抗大鼠tcrαβ-a647或-a488(r73)、cd4-pecy7(ox35)、cd8-a488(ox8)、il-17-apc(ebio17b7)、foxp3-apc、ifnγ-fitc、cd11b-percp-cy5.5(wt.5)、cd103(αe整联蛋白)-fitc和抗人磷酸酪氨酸(p-tyr)(4g10)、cd4-pe、cd3-apc、cd45-percp、cd3-fitc、cd19-pe、cd16-pe、cd14-fitchla-dr-apc/cy7、hla-dr-fitc、cd11c-pecy7、cd11b-fitccd80-fitc、cd86-fitc、cd83-fitc和igg1同种型对照来自bdbiosciences(富兰克林湖)。
通过锌指核酸酶(zfn)技术产生clec-1-/-敲除(ko)大鼠。
如前所述,将对大鼠clec-1具有特异性的、体外转录的mrna编码的zfn靶向序列(sigma-aldrich,stlouis,mo)显微注射到受精的单细胞期胚胎中。通过pcr检测新生个体的突变。其中一位首建者(founder)表现出7bp的缺失,导致在缺乏大部分细胞外结构域的clec-1的114号氨基酸提前出现了终止密码子。对杂合子进行育种以产生ko和野生型(wt)同窝仔畜。
产生大鼠clec-1fc融合蛋白。
通过pcr扩增编码clec-1细胞外结构域(adk94891氨基酸74-261)的cdna,分别用ecoribglii限制性位点对5'和3'末端进行标记。消化后,克隆cdna产物,并在框架内被插入到含有igg2afc片段的3号氨基酸被突变以防止fcγri结合的pfuse-migg2ae1-fc2v10[fab](invivogen,sandiego,ca)载体中。根据制造商(thermofisher)的说明书,用脂质体在真核细胞中转染质粒。用hitrapg亲和柱(gehealthcarebio-sciences,pittsburgh,pa)从上清液中纯化clec-1fc,使用slide-a-lyzer透析盒(thermofisher)透析,并使用bcaproteinassayreagentkit(pierce)定量。通过sds-page确认纯度和蛋白质结构,然后用抗小鼠igg或抗大鼠clec-1抗体进行考马斯染色和蛋白质印迹分析(如补充材料和方法的蛋白质印迹部分所述)。人胚胎碱性磷酸酶(hseapfc)的对照重组分泌的截短形式被产生(pfuse-seap-hfc,invivogen)并在与clec-1fc相同的条件下被纯化。
klh免疫
使用被乳化(v:v)在100μl完全弗氏佐剂(cfa)(difco)的钥孔血蓝蛋白(klh)蛋白(sigma)(100μg),在足垫对大鼠进行皮下免疫接种,并在免疫接种后10天收获膝后窝淋巴结。用klh或不相关的蛋白质ova(25μg/ml),对来自初生wt大鼠的羧基荧光素琥珀酰亚胺酯(cfse)(molecularprobes/invitrogen)-标记的(5μm)总细胞(1×105)或纯化的cd4+t细胞(1×105)和t细胞耗竭的脾细胞(1×105)进行3天的体外二次攻击。
流式细胞术和细胞分选
在染色之前,如制造商说明书所述,对细胞进行fc阻断(bdbiosciences)。对于细胞内细胞因子染色,在蛋白质转运抑制剂golgistop(2μl/孔)的存在下,细胞被pma和离子霉素(分别为50ng/ml和1μg/ml)刺激4小时,并被固定和透化(facs透化溶液)(所有试剂均来自bdbiosciences)。使用facslsrii(bdbiosciences)测量染色细胞(2.5μg/ml)的荧光标记,并用
对于细胞分选,通过使用facsaria流式细胞仪(bdbiosciences)进行阳性筛选,分别用tcr+和cd4+染色和cd11b、cd103和cd4染色,从初生大鼠脾脏中纯化大鼠cd4+t细胞和cd11b+cd103+cd4-和cd11b+cd103+cd4+dc;对于人细胞,t细胞和b细胞分别用ssc低cd45+cd3+或cd19+,对于中性粒细胞,用ssc高cd45+cd16+,对于单核细胞,用ssc低cd45+cd14+,对于cdc,用ssc低cd45+hla-dr+cd11c+。纯度>99%。
通过对4',6-二脒基-2-苯基吲哚(dapi)-阴性细胞进行门控排除死细胞。
细胞生成、体外刺激和混合白血球反应(mlr)
从培养了7天的经淘洗的单核细胞中产生人单核细胞衍生树突状细胞(modc),所述单核细胞被培养于rpmi1640完全培养基(10%无内毒素fcs)(perbiosciences)、2mml-谷氨酰胺(sigma)、1mm丙酮酸钠(sigma)、1mmhepes(sigma)和5x10-5m2-巯基乙醇(sigma)中,补充有il-4(40ng/ml;abcys,巴黎,法国)和gm-csf(1000iu/ml;abcys)。然后,用lps(0.5μg/ml)(sigma)、polyi:c(2μg/ml)(invivogen,圣地亚哥,加利福尼亚州)、r848(2.5μg)(invivogen)、重组人tgfβ1(20ng/ml)(r&dsystems),或者在10μg/ml抗-clec-1mab或igg1同种型对照(预先涂在板上)的存在下,刺激细胞(1×106/ml)24小时,并进行流式细胞术或用5×104同种异体人t细胞(pantcellisolationkit(mylteni))培养(12.5×103)5天(mlr)。重组clec-1-his标签(r&dsystem)或无关的重组猪α-1,3gt-6-his蛋白以10μg/ml被添加在mlr中。通过流式细胞术用cd3+cd4+细胞中的cfse谱测量增殖,通过elisa评估上清液中il-17和ifn-γ细胞因子。
分离并培养来自主动脉(haec)或来自脐静脉(huvec)的人内皮细胞(ec),或者用1000单位/ml的重组人tnfα(ebiosciences)刺激12小时。
将人单核细胞与m-csf一起培养以产生m0巨噬细胞,然后用ifnγ、lps或il-4培养以产生m1或m2巨噬细胞,如zajac,blood,2013所述。
收集来自间皮瘤患者的胸腔积液并进行流式细胞术。
在卵巢癌患者的常规护理期间收集腹水,并在ficoll密度梯度离心后分离单核细胞。使用cd14微珠分离人cd14+细胞,并用automacs进行阳性选择。
用结合到孔板的抗cd3(cloneg4.18)(5μg/ml)刺激大鼠cd4+t细胞。通过在补充有大鼠il-4(4ng/ml)和鼠gm-csf(1.5ng/ml)的完全rpmi培养基中培养细胞8天,获得来自初生clec-1wt和kolew.1a(rt1a)同窝大鼠的骨髓来源树突状细胞(bonemarrow-deriveddc,bmdc)。然后,用lps(1μg/ml)(sigma)或zymozan(20μg/ml)(invivogen)刺激bmdc6小时以进行转录物分析,刺激bmdc24小时用于成熟标记物的表达以及mlr(用5μmcfse标记的lew.1w(rt1u)初生大鼠的肠系膜淋巴结中纯化的同种异体cd4+t细胞共培养5天)。或者,在内毒素抑制剂多粘菌素b(10μg/ml)(invivogen)的存在下,在mlr中加入大鼠clec-1fc融合蛋白和对照hseap-fc(10μg/ml)。
rna提取和实时定量rt-pcr
根据制造商的说明书,使用trizol(invitrogen)制备来自组织、肿瘤或细胞的总rna。合并的人体器官的cdna是来自于男性或女性高加索人的人免疫系统和mtcpaneli(clontechmountainview)。
使用viia7实时pcr系统和
免疫沉淀和蛋白质印迹法
将人modc与酵母聚糖(20μg/ml)一起或不与酵母聚糖(20μg/ml)一起,置于培养基中抗clec-1或对照igg1同种型(invitrogen)mab涂布的孔板(10μg/ml)上5或20分钟。在有蛋白酶抑制剂混合物(sigmaaldrich)的nonidetp-401%裂解缓冲液中,裂解人modc、haec、huvec和hek。用4μg抗人clec1mab(d6)进行clec-1免疫沉淀,然后用蛋白g-sepharose珠孵育。然后用pngasef(sigmaaldrich)过夜处理蛋白质,洗脱并通过在laemmli加样缓冲液中煮沸5分钟溶解。使用bc测定试剂盒以bsa作为标准物(interchim,圣佩德罗),测定蛋白质浓度。用tween-20-tris缓冲盐水和5%牛奶封闭硝酸纤维素膜,并用0.5μg/ml抗磷酸酪氨酸(4g10)或2μg/ml抗clec1mab孵育,然后用辣根过氧化物酶偶联的二级抗体(jacksonimmunoresearch,西格罗夫,宾夕法尼亚州)孵育。根据制造商(r&dsystem)的说明书,使用proteomeprofilerhumannf-κbpathwayarraykit试剂盒。使用westpico化学发光底物(thermofisherscientific,沃尔瑟姆,马萨诸塞州)进行化学发光检测,并通过las4000(fuji)评估蛋白质表达。
免疫组织化学
将嗜中性粒细胞、modc、贴壁转染的hek293t细胞和huvec细胞(在盖玻片上培养过夜)在4%多聚甲醛(electronmicroscopyscience,哈特菲尔德,宾夕法尼亚州,美国)中固定,并用tritonx100(0.1%)对其进行透化(modc除外)。对于modc,细胞在室温下用抗clec1mab(d6)或igg1同种型对照(invitrogen)(4μg/ml)在pbs1%fcs、1%bsa和fcblock中染色1小时,然后用二级alexafluor488或alexafluor568抗小鼠igg1抗体染色1小时。在含有1%dapi的pbs中孵育10分钟后,使用prolongantifadereagent(invitrogen)固定载玻片,并通过荧光显微镜(nikona1rsiconfocal显微镜)观察。使用连续模式获得图像(x60planapon.a:1.4,zoom2),并使用imagej程序进行分析。
体内肿瘤模型
将hepa1.6肝癌肿瘤细胞通过门静脉内注射到b6wt或clec1a缺陷小鼠的肝脏中。将c6神经胶质瘤细胞(1百万个)皮下注射到spraguedawley(spd)wt或clec1a缺陷大鼠的胁腹中。
统计分析
所有统计分析均使用graphpadprism软件(lajolla)进行,采用双尾非配对非参数student’st检验(mann-whitney)。如果p值<0.05,则认为结果显着。
结果
人髓样dc在细胞表面表达clec-1。
到目前为止,关于clec-1在人类中的表达的已发表信息是有限的。到目前为止,关于人clec-1蛋白表达、调节和功能的描述很少。仅有一篇关于clec-1表达的出版物,其公开了人clec-1只能在内皮细胞的细胞内被检测到,其染色模式类似于内质网蛋白,并且tgf-β和炎症刺激都不能促进显着易位至细胞表面(人c型凝集素样受体clec-1被tgf-β上调且主要位于内质膜区(thehumanc-typelectin-likereceptorclec-1isupregulatedbytgf-βandprimarilylocalizedintheendoplasmicmembranecompartment).sattler等,scand.j.immunol.,2012,75(3):282-92)。因此,现有技术中可获得的关于hclec-1的唯一信息(即,位于内皮细胞的细胞内)与大鼠中已知的信息相反(即,rclec-1位于内皮细胞和骨髓细胞的表面)。
本发明人通过定量rt-pcr观察到clec-1转录物在肺和胎盘中强烈表达,以及在淋巴器官如胸腺、淋巴结、脾和扁桃体中更适中地表达(数据未显示)。在人细胞亚型中,在中性粒细胞、单核细胞、modc和haec中发现了丰富的clec-1转录物(图1a),并且在t细胞和b细胞中未检测到转录物。通过clec-1免疫沉淀,然后进行蛋白质印迹(数据未显示),证实了clec-1蛋白存在于modc和ec中,与在上皮hek细胞中观察到的低量形成对比。本发明人产生了针对细胞外结构域的小鼠抗人clec-1mab,并在转染的hek细胞的细胞表面观察到clec-1的低异位表达,证实了先前在文献中描述的内容(数据未显示)。对于其他clr,clec-1可能需要其他衔接子链、其他prr或足够的糖基化以有效表达、转运和维持细胞表面稳定性。通过转染的细胞中的免疫组织化学证实了clec-1蛋白的细胞表面表达(数据未显示)。
使用产生的mab,他们通过流式细胞仪首次证明了clec-1在人血液循环骨髓cd16-dc(cd45+cd14-hla-dr高cd11c+)亚群和cd14+cd16+单核细胞(cd45+cd14+cd16+)的细胞表面上表达。在bdca3+骨髓dc亚群(bdca3+cd45+hla-dr高cd11c低)和cd123+浆细胞样dc(cd123+cd11c-hla-dr高)均未观察到细胞表面表达(数据未显示)。在中性粒细胞或haec的细胞表面观察到clec-1的低表达,如先前的报道,其表达大部分是在细胞内的(图1b)。通过免疫组织化学观察到了clec-1蛋白的相同定位,其中观察到了人嗜中性粒细胞和ec的细胞内clec-1染色,及dc的细胞表面表达(数据未显示)。重要的是,类似于我们先前在大鼠中描述的,本发明人观察到人中clec-1的表达经炎性刺激(如tlr配体)在dc上被下调,并且被tgfβ上调(分别见图1c的代表性点图和mfi直方图)。
人modc上clec-1触发会抑制体外下游同种异体th17的激活。
由于尚未识别clec-1天然配体,本发明人使用抗人clec-1mab来模拟配体并在modc的细胞表面交联clec-1。在低严格条件下进行clec-1免疫沉淀后,他们通过蛋白质印迹法观察到,clec-1触发后,预期大小的clec-1(32kda)没有被酪氨酸磷酸化,这表明细胞质尾部的酪氨酸基序不会直接被磷酸化(数据未显示)。尽管如此,我们观察到酪氨酸磷酸化模式的几个变化,大小在40-50kda左右的几个条带的磷酸化被增强或减少了,这强烈表明clec-1是通过待识别的结合配偶体发出信号的功能性受体。
然后,本发明人研究了clec-1触发是否如其他活化或抑制性clr那样调节tlr诱导的modc的成熟。根据激活标记物cd80、cd86、cd83和hla-dr的表达(图2a)及tnfα、il-12、il-6、il-23或il-10的产生(图2b),他们观察到clec-1触发本身既不诱导也不加强或抑制lps诱导的modc的成熟。用其他tlr配体观察到了类似的结果(数据未显示)。
然后,本发明人评估了clec-1触发对modc极化下游同种异体t细胞应答的能力的影响。在clec-1单独触发(图2c)或与tlr一起触发(数据未显示)后,未观察到随后的同种异体t细胞增殖的差异。然而,他们发现同种异体t细胞分泌的il-17显著减少及ifnγ显著增多,这表明modc上clec-1触发减少了随后的同种异体th17活化,并使反应向th1倾斜(图2c)。
鉴于clr信号传导导致nf-κb活化,在clec-1单独或与酵母聚糖(一种ectin-1和tlr信号通路的激动剂)联合触发后,他们通过proteomeprofiler研究了nf-κbt通路相关蛋白的含量水平和活化情况。本发明人观察到,与酵母聚糖相反,clec-1触发本身不会诱导nf-κb通路的激活,这通过nf-κb抑制剂、iκbα的降解和relap65(ser529)亚基的磷酸化来进行评估(数据未显示)。然而,他们表示,clec-1触发的结合减少了由酵母聚糖诱导的iκbα的降解。然而,未观察到p65亚基磷酸化的显著降低。由于在ser529的磷酸化不依赖于ikkβ,因此这些数据表明clec-1可能特别抑制ikkβ活化通路。总的来说,这些数据表明,人modc上的clec-1触发具有功能活性,并且,虽然我们观察到对细胞因子产生没有显着影响,但可以调节prr诱导的nf-κb信号通路,以精细调节其活化状态并抑制下游th17应答。
破坏大鼠bmdc中clec-1信号传导会增强体外t细胞应答。
为了深入了解clec-1的作用,本发明人产生了clec-1缺陷大鼠。clec-1缺陷大鼠是有活力的、健康的,并且来自于具有预期孟德尔频率的杂合子育种。在稳态下,clec-1缺陷大鼠在血液和外周淋巴器官中显示出规则的髓样和淋巴免疫细胞区室(数据未显示)。
本发明人从clec-1缺陷大鼠产生bmdc,并观察到这些细胞响应lps刺激(cd80、cd86、i类和ii类mhc)而正常分化和成熟(数据未显示)。有趣的是,他们观察到在通过lps或酵母聚糖活化后,clec-1缺陷bmdc的il-12p40转录物的表达水平高于来自野生型大鼠的bmdc(数据未显示)。对于il-6、il-23、tgfβ和il-10表达,没有观察到显着差异。然而,令人印象深刻的是,clec-1缺陷bmdc诱导同种异体cd4+t细胞增殖增强,这与th17t细胞活化增加有关(图3)。
为了进一步证实这些数据,本发明人产生了大鼠clec-1fc融合蛋白(数据未显示)。该融合蛋白由融合至iggfc片段的大鼠clec-1的细胞外结构域组成,该iggfc片段在3号氨基酸突变以防止fcγri结合;该融合蛋白应以其推定配体阻断bmdc上clec-1相互作用,从而模拟clec-1缺陷。类似地,他们观察到,在体外mlr中存在clec-1fc融合蛋白的情况下,非foxp3同种异体效应t细胞增殖更加显著和th17活化更多(图4)。重要的是,在抗cd3多克隆活化后,在纯化的t细胞上用clec-1fc未观察到th-17的诱导(数据未显示),证明这种作用对bmdc中clec-1信号传导的破坏具有特异性,而不是由于t细胞上clec-1fc连接和对推定配体的激动剂作用。
总的来说,这些数据表明,在骨髓细胞中(特别是在dc中)clec-1信号传导的缺乏,增强了它们体外高效t细胞增殖和活化所需的活化状态。
clec-1缺陷增强体内dc介导的t细胞应答。
接着,本发明人研究了用外来抗原钥孔血蓝蛋白(klh)和完全弗氏佐剂皮下注射免疫后,clec-1在体内dc介导的th分化中的潜在作用。首先,他们评估了clec-1转录物在淋巴结中cdccd103+cd11b+的不同亚型中的表达。有趣的是,他们观察到clec-1表达限于cd4-dc,所述cd4-dc对应于小鼠中专门用于死细胞的吞噬作用并表现出细胞毒活性的cd8α+dc(图5a)。
免疫接种后,他们观察到,体外二次攻击引流淋巴结后,免疫的clec-1缺陷大鼠的klh特异性cd4+t细胞的增殖增加,这与il-17+、il-17+ifnγ+和ifnγ+cd4+t细胞数量增加有关(直方图和代表性点图,图5b)。重要的是,在野生型大鼠dc存在的情况下,用来自免疫的clec-1缺陷大鼠的纯化cd4+t细胞,也观察到了对klh的回忆应答被增强,证明在缺乏clec-1情况下,体内t细胞致敏的特异性增加(数据未显示)。
这些数据在体内证明了,cdc中clec-1信号传导的缺陷加剧了下游t细胞介导的免疫应答。
讨论
在本研究中,本发明人首次证明,人clec-1是功能性dc细胞表面调节受体,其抑制随后的效应子th17应答。此外,clec-1缺陷大鼠揭示了,在预防dc介导的cd4+t细胞致敏过度中clec-1的体内作用。与在大鼠中一样,他们观察到人modc中的clec-1表达通过炎性刺激而降低并且通过tgfβ而上调。在dc中随炎症刺激而减少表达的这种特征,代表了在其他抑制性受体(例如micl或dcir)中观察到的经典应答,这些其他抑制性受体(例如micl或dcir)也被显示会抑制体内t细胞应答和炎症(utot等,clec4a4是树突细胞的调节受体,其损害炎症和t细胞免疫(clec4a4isaregulatoryreceptorfordendriticcellsthatimpairsinflammationandt-cellimmunity),natcommun,2016,7:11273)(redelinghuysp等,micl控制类风湿性关节炎中的炎症(miclcontrolsinflammationinrheumatoidarthritis),annrheumdis,2015)。有趣的是,本发明人发现,clec-1在大鼠中通过淋巴器官中cdc的cd4+亚群表达。该dc亚群对应于参与细胞毒活性和死细胞吞噬作用的小鼠对应物cd8α+dc,并且其被描述为il-12的主要产生者并参与肿瘤抗原的交叉呈递。这种表达模式与抑制性受体dcir-2形成对比,dcir-2已被显示其受限于cd8α-cdc。然而,在人血液中,观察到clec-1在cd16-cd14-骨髓dc的亚群中的细胞表面上表达,而不在bdca3+dc(cd8α+dc的人类对应物)上表达。人与啮齿动物之间的这种差异需要被进一步调查。本发明人观察到,clec-1信号传导的破坏在体外特别增强了dc介导的th17活化,但是在体内免疫接种后,th1和th17应答都增加。这表明,clec-1可以根据prr的共同参与来有区别地抑制th1和th17应答。相反,dectin-1作为dc中的活化受体,通过精细调节极化细胞因子il-12和il-23的分泌,根据配体和prr共同参与,有区别地促进th17/th1平衡(gringhuissi等,dectin-1通过控制raf-1和syk的非经典nf-κb活化来指导t辅助细胞分化(dectin-1directsthelpercelldifferentiationbycontrollingnoncanonicalnf-kappabactivationthroughraf-1andsyk),natimmunol,2009,10(2):203-213)(leibundgut-landmanns等,先天免疫的syk-和card9依赖性偶联诱导产生白细胞介素17的t辅助细胞(syk-andcard9-dependentcouplingofinnateimmunitytotheinductionofthelpercellsthatproduceinterleukin17),natimmunol,2007,8(6):630-638)(leeej等,mincle激活和syk/card9信号轴是眼睛自身免疫性疾病发展的核心(mincleactivationandthesyk/card9signalingaxisarecentraltothedevelopmentofautoimmunediseaseoftheeye),j.immunol.,2016,196(7):3148-3158)。例如,响应烟曲霉(aspergillusfumigatus)的攻击,显示小鼠中dectin-1通过降低ifn-γ和il12p40表达从而降低th1极化来显着增强th17分化。有趣的是,本发明人没有观察到dc中的clec-1信号传导抑制prr诱导的th17极化细胞因子的表达,并且仅注意到对大鼠kobmdc的il-12p40产生的影响。这些结果表明,dc中的clec-1可能通过除极化细胞因子表达之外的其他机制来形成th17/th1平衡。例如,已显示dectin-1信号还通过调节dc上共刺激分子ox40配体的表达来影响t细胞极化命运(jooh等,在th2极化中人浆细胞样树突状细胞和髓样树突状细胞表达的dectin-1的相反作用(opposingrolesofdectin-1expressedonhumanplasmacytoiddendriticcellsandmyeloiddendriticcellsinth2polarization),j.immunol.,2015,195(4):1723-1731)。有趣的是,本发明人观察到,在人dc上的clec-1触发阻止了dectin-1信号传导诱导的iκbα降解。因此,clec-1还可以阻止card9信号通路,该card9信号通路通过激活clr介导并且已知特异性地维持th17应答。
他们用clec-1fc融合蛋白未能检测到表达内源配体的细胞。然而,他们的数据表明clec-1配体可以由造血细胞表达,或被“天然地”释放,或特别是在组织或细胞损伤的背景下被释放。配体可以由表达clec-1的细胞本身表达,正如dcir-2或t细胞的情况一样。据报道,内源性dectin-1配体由t细胞表达,不同于作为增强t细胞增殖的共刺激分子的clec-1(ariizumik等,通过消减cdna克隆鉴定新的树突细胞相关分子dectin-1(identificationofanovel,dendriticcell-associatedmolecule,dectin-1,bysubtractivecdnacloning),j.biol.chem.,2000,275(26):20157-20167)。
这些发现证实了dc中clec-1在严格控制下游t细胞活化的程度和质量方面的相关性,并且作为细胞表面受体可以提供操纵t细胞应答的治疗工具。
因此,作为骨髓细胞中的细胞表面抑制受体,clec-1突出了癌症治疗干预和新治疗范式的潜在目标。
几项实验研究表明,clr通过其在细胞粘附或t细胞应答形成中的作用而促进癌症进展和转移性扩散(yan,kamiya等,2015;ding,yao等,2017)。例如,免疫调节受体dc-sign、mincle、dcir和bdca-2已被证明可抑制骨髓细胞活化、炎症并对推动foxp3+cd4+cd25+treg扩增至关重要(yan,kamiya等,2015;ding,yao等,2017)。dc-sign识别在几乎所有人类癌症中过度表达的癌胚抗原(nonaka,ma等,2008),并促进骨髓细胞分泌免疫抑制细胞因子il-10和il-6。此外,发现dc-sign基因启动子的多态性与结直肠癌患者的风险增加有关(lu,bevier等,2013)。显示mincle在胰腺导管腺癌中的肿瘤浸润性白细胞中被增强,特别是通过髓样抑制细胞(msc)增强。mincle与死亡细胞释放的sap130(组蛋白脱乙酰酶复合物的亚基)的连接会诱导强烈的肿瘤周围抑制(seifert,werba等,2016)。类似地,已显示,clrlox-1在癌症患者的血液或肿瘤浸润性中性粒细胞的细胞表面被特异性增强(15%至50%),而在健康捐献者的血液中几乎检测不到(condamine,dominguez等,2016)。在这项研究中,他们表明内质网应激会诱导lox-1表达并将中性粒细胞转化为具有强抑制功能的msc。
相反,已显示,激活clr(例如dectin-1)的触发信号会增强抗肿瘤免疫力并减少treg和msc(tian,ma等,2013)。给药β-葡聚糖(一种dectin-1的配体)会抑制小鼠癌模型中(li,cai等,2010;masuda,inoue等,2013;tian,ma等,2013)、人黑素瘤、神经母细胞瘤、淋巴瘤异种移植模型中(modak,koehne等,2005)以及人卵巢癌和胃癌中(inoue,tanaka等,1993;oba,kobayashi等,2009)的肿瘤生长。
因此,通过clec-1拮抗剂来增强dc或更广泛的骨髓细胞的活化,这可以代表调节下游效应t细胞免疫的免疫检查点目标,其可能在癌症中具有重要的临床意义。
实施例2
本发明人之前已表明,在大鼠中用clec-1fc融合蛋白阻断clec-1会增强混合白血球反应(mlr)中t细胞增殖(参见实施例1)。他们已经生产了几种针对人clec-1细胞外部分的mab,并且他们表明一种mab似乎是clec-1信号传导的拮抗剂,因此其能促进混合白血球反应(mlr)中t细胞增殖和ifn-γ产生。mlr由从外周血中分离的纯化t细胞(5×104)、高水平表达clec-1的同种异体单核细胞衍生的树突状细胞(12.5×103)混合组成。以0.5~10μg/ml的剂量加入同种型对照(igg1)或抗人clec-1抗体5天。然后用羧基荧光素琥珀酰亚胺酯稀释液来评估t细胞的增殖,并通过流式细胞术评估t细胞中的ifn-γ表达,并通过elisa评估上清液中的ifn-γ表达(图6a、b和c,直方图和代表性图)。
实施例3
clec-1在肿瘤中高度表达并在肿瘤免疫中起功能性作用
在小鼠肝癌模型(门静脉内注射hepa1.6肿瘤细胞)中,本发明人观察到clec-1在肿瘤中增加的且持久的表达(图7a)。重要的是,在该模型中,缺乏clec-1的小鼠(由derrickj.rossi,harvardstemcellinstitute,cambridge提供)对肿瘤生长具有更好的抵抗力并且表现出更高的存活率(中位生存期在ko中为28天,在wt中为21天)(图7b)。类似地,在皮下(sc.)大鼠神经胶质瘤模型(c6)中,本发明人观察到5只clec-1缺陷大鼠(在我们的实验室通过zfn技术产生)中有3只的肿瘤完全消退(图7c)。重要的是,通过在肿瘤细胞接种后第18天收获的肿瘤中进行q-pcr,据评估来自clec-1缺陷大鼠肿瘤中的inos、tnfa和ifng的mrna表达水平更高(图7d)。此外,在淋巴结中检测到了ifng更高水平的mrna表达(图7d)。这些数据表明,在clec-1缺陷型大鼠中具有更好的抗肿瘤反应,并且表明clec1的缺失诱导了更多的抗肿瘤m1巨噬细胞和更多的细胞毒性t细胞及th1t细胞。
clec-1的表达限于专门用于交叉呈递的cdc
有趣的是,本发明人在大鼠和小鼠中都观察到来自次级淋巴器官的cdc的clec-1表达仅限于专门用于抗原交叉呈递的dc的特定亚群(大鼠中为cd4+,小鼠中为cd8α+)(图5a)。显示这些细胞分泌高水平的il-12并负责激活抗肿瘤细胞毒性cd8+t淋巴细胞(ctl)应答。因此,通过在这些特定dc亚群中作为抑制性受体,clec-1触发可以阻止il-12的产生、对肿瘤抗原的有效交叉呈递和ctl应答。
clec-1由m2型促肿瘤巨噬细胞表达,并由来自胸腔积液间皮瘤和卵巢肿瘤腹水的骨髓细胞表达。
本发明人观察到,与m1型抗肿瘤巨噬细胞或与m0巨噬细胞相比,人m2型原始巨噬细胞上clec-1表达的转录物水平(a)和蛋白质水平(b)均更高(图8)。此外,他们观察到了,与对照同种型相比的来自胸腔积液间皮瘤的人骨髓cd45+hladr+cd16+细胞(c)和来自卵巢癌腹水的cd14+骨髓细胞(d)上的clec-1细胞表面蛋白表达(图8)。这些数据表明肿瘤微环境中髓样细胞上的clec-1表达被增强,并且可以在肿瘤免疫逃逸中起关键作用。
总之,鉴于上述结果(特别是显示“clec-1fc融合蛋白和针对人clec-1细胞外部分的抗体会增强t细胞增殖”的结果),clec-1拮抗剂可用于治疗癌症看起来是可信的。
参考:
在整个申请中,各种参考文献描述了本发明所属领域的现有技术。这些参考文献所公开内容通过引用被并入到本公开中。
序列表
<110>国立卫生和医学研究所(inserm)
南特大学(universitedenantes)
ose免疫疗法(oseimmunotherapeutics)
<120>促进t细胞应答的方法
<130>bio16204
<160>2
<170>siposequencelisting1.0
<210>1
<211>206
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>seqidno:1
<400>1
tyrtyrglnleuserasnthrglyglnaspthrileserglnmetglu
151015
gluargleuglyasnthrserglngluleuglnserleuglnvalgln
202530
asnilelysleualaglyserleuglnhisvalalaglulysleucys
354045
arggluleutyrasnlysalaglyalahisargcysserprocysthr
505560
gluglntrplystrphisglyaspasncystyrglnphetyrlysasp
65707580
serlyssertrpgluaspcyslystyrphecysleusergluasnser
859095
thrmetleulysileasnlysglngluaspleugluphealaalaser
100105110
glnsertyrsergluphephetyrsertyrtrpthrglyleuleuarg
115120125
proaspserglylysalatrpleutrpmetaspglythrprophethr
130135140
sergluleuphehisileileileaspvalthrserproargserarg
145150155160
aspcysvalalaileleuasnglymetilepheserlysaspcyslys
165170175
gluleulysargcysvalcysgluargargalaglymetvallyspro
180185190
gluserleuhisvalproprogluthrleuglygluglyasp
195200205
<210>2
<211>24
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>seqidno:2
<400>2
cysgluargargalaglymetvallysprogluserleuhisvalpro
151015
progluthrleuglygluglyasp
20
- 还没有人留言评论。精彩留言会获得点赞!