一种微生物生长图像检测微室微流控系统的制作方法
本发明属于微生物检测技术领域,更具体地,涉及微生物生长图像检测微室微流控系统。
背景技术
微生物的培养是生命科学和医学研究,以及工业发酵和食品检测领域的基础技术,而目前的细菌培养检测领域,往往只能获得细菌的生长曲线这一个检测指标,即利用浊度检测装置,如分光光度计、酶标仪等获得细菌菌体密度和个数的变化曲线。但是随着科学技术和经济的发展,这一检测技术已经不能满足当今的科学研究以及食品发酵工业检测领域的要求。因此急需一种高通量,样品消耗少,快速化,微型化,自动化,可视化,集成化与便携化的检测装置。
微流控技术是指利用微尺度管道控制微小流体(体积一般为皮升至纳升)进行流动、传热、传质的技术,其涉及到化学、生物学、生物医学工程、材料、微电子等多口学科。微流控技术始于20世纪90年代,最早于1992年由瑞士的andreasmanz教授提出,经过二十多年的发展,微流控技术已从当初的毛细管电泳技术,一维连续流动式芯片发展成具有三维,高通量和多功能集成的芯片。如今的微流控芯片(microfluidicchips),己被广泛应用在生化样品(核酸和蛋白等)的分析、合成、分离及检测中。相较于其他的分析技术,微流控芯片的技术优势明显,其特征在于可将各种不同功能的单元技术在微小平台上进行组合与集成,使得科学研究过程更高效、便捷。
微流控芯片作为微流控技术的核心平台,其加工技术起源于半导体集成电路芯片的微加工技术,之后经过长时间的发展,到目前为止,常用的微流控芯片加工方法有刻蚀法、热压法、模塑法、注塑法、激光烧蚀法、软光刻以及liga技术等。
然而随着微流控技术的发展,其应用领域目前也拓展到细胞和细菌的研究中,torisawa等(2007)设计并制备了pdms材料的微管道与硅制作的微孔板连接到一起的三维芯片,并将多细胞的球状体培养在芯片上,经过14天的连续观察,研究了球状体的形成,该研究为进行活细胞与癌细胞的药物筛选建立了一种芯片模型。2008年lanning等设计了一种t型的微流控芯片,利用两条液流在主管道里混合,形成层流,并产生浓度梯度,观察细菌在这样的环境下的迁移情况。观察到尽管在有液流的条件下,细菌仍可以在层流中迁移,使其朝着有利于自身生存的方向移动。2010年kim等设计了一种基于微流控芯片技术的细胞共培养模型,模拟了肠出血性大肠杆菌对hala细胞的感染过程,观察到细菌在细胞上的定植与繁殖,并且形成了细菌被膜。
虽然微流控芯片已经在细菌和细胞领域有了一定的发展,但是对微生物的培养仍然有很多技术缺陷,如多采用通道培养模式,单一通道的培养会使得微生物的生长和运动收到限制;另外多采用双层限制培养模式,即底层接种微生物,然后在上层覆盖一层高分子薄膜,通过在上层流通培养基的方法进行渗透培养,该方法严重限制了微生物的运动和微生物与培养基的接触,不利于微生物的生长,更不能进行微生物的运动性研究。
技术实现要素:
本发明为了解决上述现有技术的缺陷和不足,提供一种用于微生物实时培养观察的微室微流控芯片。所述微流控芯片具有透光、透氧、高通量、样品消耗少、微型化、自动化、可视化、便携式等特点,利用所述芯片可对细菌的形态和生长进行实时在线检测。
本发明的再一目的是提供一种微生物生长图像检测微室微流控系统。
本发明的上述目的是通过以下技术方案给予实现的:
一种用于微生物实时培养观察的微室微流控芯片,包括芯片主体,所述芯片主体包含至少一条微流通道,所述微流通道由依次连通的进液口1、主通道2和出液口3组成;所述主通道1的中间段为折线型,所述折线型主通道在拐角处沿液流方向向外延伸形成环形通道并形成围堰结构的微室4,微室4靠近主通道的一端设置有t型角5;所述微室4与主通道1间的通道上设置有微柱6;所述微室4的围堰为半封闭、不完全封闭或全封闭,所述芯片主体上设置有至少三个上述不同类型的微室(4)。
本发明的微流控芯片设置有独立培养的微室,微室根据不同的功能采用不同的三种设计;其中半封闭的微室作为观察微室,用于细菌生长的培养观察,由于采用半封闭的设计,当培养基在通过环形通道时可与微室内的细菌充分混合,从而适用于细菌生长的培养观察;不完全封闭的微室作为趋化性追踪微室,适用于细菌的生长观察及趋化性追踪,当不同的培养基通过环形通道时,由于微室与环形通道为不完全封闭,因此微室内的细菌可感知环形通道流过的培养基,从而产生趋化运动;完全封闭的微室则作为生物膜测量微室,由于环形通道与微室之间没有任何开口,因此细菌均在微室外围通道生长,整个微室起到微柱黏附作用。另外,微柱为多柱形传动结构,其与t型角起到阀门的作用,通过利用微柱黏附作用,起到传送菌液及培养基到环形通道和微室的作用,t型角同时起到分流作用,使液流具有方向性,可以从环形通道的一端流入从另一端流出;同时,每个微室的围堰也具有阀门的作用,保证细菌和培养基可以流经环形通道和微室。
优选地,所述主通道深度为35µm,微室深度为8µm;如果深度太深容易造成细菌培养室叠层,从而不利于观察,如果太浅又会造成细菌培养时通量不够,影响观察结果。
优选地,所述微室直径为150~160µm或250~260µm,150~160µm适于40倍物镜下观察,250~260µm适于20倍物镜观察。
优选地,所述半封闭微室的开口大小为微室圆周长的三分之一左右。
优选地,所述不完全封闭微室的开口大小略大于细菌的直径,为5~10µm。
优选地,所述微流控芯片由pdms材料制成。pdms材料可谓微生物的培养提供微生物的恒化培养提供一个稳定空间结构和透气环境,微室高度适配细胞细菌等各种微生物的生长和运动,同时为后期的观察提供一个良好透光介质。
本发明还请求保护上述微室微流控芯片在制备微生物生长图像检测系统中的应用。
一种微生物生长图像检测微室微流控系统,包括显微镜、恒流注射泵、注射器、恒温载物台、上述任一所述微室微流控芯片、收集器和cmos视频检测组件;所述恒温载物台置于显微镜载物上;所述微室微流控芯片置于恒温载物台上,为芯片提供恒定的培养温度,大小适配于显微镜和芯片;所述cmos视频检测部件通过连接固定于显微镜上方,所述cmos视频检测组件用于配套测量所述微室微流控芯片中每个微室内细菌的形态学变化;所述微室微流控芯片的进液口连接有恒流注射泵,恒流注射泵上设置有注射器;所述微室微流控芯片的出液口连接有收集器。
优选地,所述cmos视频检测组件包括运算单元,运算单元是基于中值滤波原理和对应的分割公式和系数,用于获得微生物清晰的灰度图像信息。
优选地,所述运算单元是基于mat2gray函数和imfilter函数进行图像滤波,图像分割采用bwareaopen函数和bwareaclose函数以及环形分割公式s=(r2-r2)。
具体为采用imfilter函数(实现线性空间滤波函数),参数设置为‘corr’即相关和‘replicate’即图像大小通过复制外边界的值来扩展,平均滤波窗口大小为30,最小滤波像素阈值0.035,使用imfilter函数前先采用mat2gray函数将图像矩阵归一化,即,所有数据除以最大值,矩阵最大值为1,从而将矩阵数据归一化在0到1之间,便于后期参数的设定。
bwareaopen函数(matlab)和bwareaclose函数,参数阈值p分别为0.3和5000,邻域为8。
优选地,所述cmos视频检测组件为数码相机;优选为尼康d7100相机,可实现传输像素为1080p,频率10帧/秒的高速记录单元,能够清晰准确的记录高速运动的微生物,获得更为可靠的图像信息,而且价格相对与同等性能的工业相机,价格低廉。配套的图像滤波和分割算法,mat2gray函数和imfilter函数可对图像进行滤波,去除图像噪点,平滑背景的不均一,而bwareaopen函数和bwareaclose函数可分割去除图像中过小和过大面积非微生物的图形结构,从而获得准确真实的图形数据,环形分割公式s=(r2-r2)可实现对生物膜区域的分割。
优选地,所述显微镜为荧光显微镜,荧光模块为ccd荧光灯,可发射蓝光、红光、绿光。
优选地,所述系统还包括视频记录仪、移动硬盘和显示器,视频记录仪连接显分别和coms视频检测组件、移动硬盘和显示器相连接。
与现有技术相比,本发明具有如下有益效果:
(1)本发明提供了一种用于微生物实时培养观察的微室微流控芯片,所述微流控芯片具有透光、透氧、高通量、样品消耗少、微型化、自动化、可视化、便携式等特点,利用所述芯片可视化在线实时检测培养可获得细菌的形态信息、运动信息、群体响应信息、分裂模型信息、与其他物种细胞的相互作用信息等一系列直观数据,这些数据可用来判断细菌的种类、活性、耐药性、毒力、定植和感染能力等一系列重要功能指标对细菌的形态和生长进行实时在线检测。
(2)本发明提供了一种微生物生长图像检测微室微流控系统,通过微流控芯片的实时恒定培养,以及cmos的记录功能可实时获得微生物的生长、分裂、运动、死亡、生物膜的形成等图像信息,配套的运算单元可去除噪点和杂点,清晰分割出微生物的形态学特征,为后期微生物的生长、运动、分裂、死亡、生物膜的形成等模型的建立提供可靠的图像信息和数据信息,所提供的检测方法和检测系统具有廉价,省时省力、测量精准、高频实时记录、获得数据真实可靠的特点。
附图说明
图1为实施例1微室微流控芯片的俯视图。
图2为实施例1微室微流控芯片的正视图。
图3为实施例1微室微流控芯片的俯视图。
图4为实施例1微室微流控芯片的微室区。
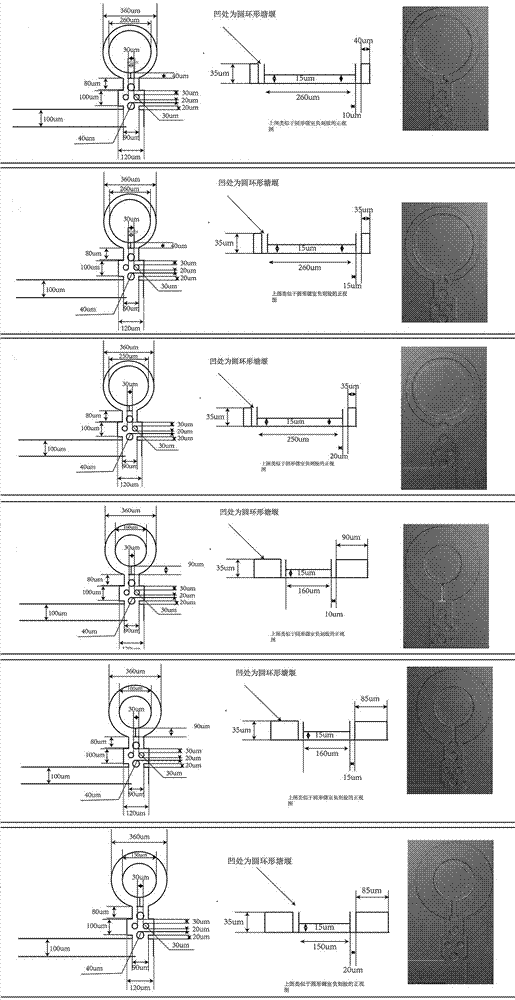
图5为实施例1微室微流控芯片的具体制备参数。
图6为实施例2微生物生长图像检测微室微流控系统的示意图。
图7为应用例1的图像记录结果。
图8为应用例1的分隔结果。
图9为应用例1的灰度值统计结果。
图10为应用例2的图像记录结果。
图11为应用例2的分隔结果。
图12为应用例2部分菌的其运动轨迹图。
图13为应用例3图像记录及分割结果。
图14为应用例3生物膜测定结果。
图注:1-进液口;2-主通道;3-出液口;4-微室;5-t型角;6-微柱。
具体实施方式
本发明提供了一种微生物检测装置及检测方法,能有效解决传统微生物形态学检测方法中耗时、耗人力、准确性低和不能长时间记录图像信息,图像分割困难的技术缺陷。
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
材料:
菌株:大肠杆菌mc4100大肠杆菌bw25113
培养基:
lb培养基:胰蛋白胨(tryptone)10g/l,酵母提取物(yeastextract)5g/l,氯化钠(nacl)10g/l。
m9培养基:
(1)先配制1m的mgso4:mgso4·7h2o2.46g加双蒸水10ml溶解,高压灭菌备用;
(2)配制1m的cacl2:cacl2·6h2o2.191g加双蒸水10ml溶解,高压灭菌备用;
(3)再配制5×m9盐溶液:na2po4·7h2o12.8g,kh2po43.0g,nacl0.5g,nh4cl1.0g加双蒸水200ml溶解,121度灭菌15分钟,备注:以上三样分别配制,分别装瓶,可以一起送去高压。
(4)配制20%的葡萄糖溶液:4g葡萄糖加双蒸水20ml溶解,0.22微米滤器过滤除菌;
(5)无菌操作配制m9培养基5×m9盐溶液200ml1m的mgso42ml20%的葡萄糖溶液20ml1m的cacl20.1ml加灭菌双蒸水至1000ml。
cmos成像系统:
器材:广州明美显微镜ml32、尼康相机d7100、飞利浦高清显示屏、kds-100-ce恒流注射泵、常州翔天恒温载物台、希捷移动硬盘、智诚恒温培养箱zdp-a2080a、硬盘2t及硬盘盒、时立tboxpro录制盒。
软件:尼康cameracontrolpro、adobeillustrator、matlab。
注射器:2.5ml(若干)、1ml(若干)、500µl(2支)、50µl(1支)。
滤膜:0.22µm。
本发明使用的原料均为市售。
实施例1
如图1~4所示,本实施例公开了一种用于微生物实时培养观察的微室微流控芯片,所述微流控芯片包括芯片主体和与其一体化塑型的pdms膜,所述芯片主体包含4条微流通道,所述微流通道由依次连通的进液口1、主通道2和出液口3组成;所述主通道1的中间部分为微流控芯片的微室区,所述主通道1的中间段为折线型,相互之间的夹角均为90°,所述折线型主通道在拐角处沿液流方向向外延伸形成环形通道并形成围堰结构的微室4,微室4靠近主通道的一端设置有t型角5;所述微室4与主通道1间的通道上设置有微柱6;所述微室4的围堰为半封闭、不完全封闭或全封闭,其开口均设置在微室远离主通道的一端,所述芯片主体上设置有至少三个上述不同类型的微室4。
作为一种具体的实施方式,所述微室区共有8个微室,其中,4-1,4-4均为半封闭设计的微室,其直径可分为250µm,260µm和150µm,160µm四种;4-2,4-5为不完全封闭的微室,其直径分别为260µm和160µm;4-3,4-6为完全封闭微室,其直径为250µm,150µm。直径为250µm~260µm的微室适用于20倍物镜下进行观察,150µm~160µm适用于40倍物镜下进行观察。
作为一种具体的实施方式,所述半封闭微室的开口大小为微室圆周长的三分之一。
作为一种具体的实施方式,所述不完全封闭微室的开口大小略大于细菌的直径,为8µm。
作为一种具体的实施方式,主通道1的宽度为100µm,环形通道的直径为360µm,其与相邻主通道的距离为300µm。
作用一种具体的实施方式,主通道深度为35µm,微室深度为8µm。
本实施例的微流控芯片设置有独立培养的微室,微室根据不同的功能采用不同的三种设计;其中半封闭的微室作为观察微室,用于细菌生长的培养观察,由于采用半封闭的设计,当培养基在通过环形通道时可与微室内的细菌充分混合,从而适用于细菌生长的培养观察;不完全封闭的微室作为趋化性追踪微室,适用于细菌的生长观察及趋化性追踪,当不同的培养基通过环形通道时,由于微室与环形通道为不完全封闭,因此微室内的细菌可感知环形通道流过的培养基,从而产生趋化运动;完全封闭的微室则作为生物膜测量微室,由于环形通道与微室之间没有任何开口,因此细菌均在微室外围通道生长,整个微室起到微柱黏附作用。另外,微柱为多柱形传动结构,其与t型角起到阀门的作用,通过利用微柱黏附作用,起到传送菌液及培养基到环形通道和微室的作用,t型角同时起到分流作用,使液流具有方向性,可以从环形通道的一端流入从另一端流出;同时,每个微室的围堰也具有阀门的作用,保证细菌和培养基可以流经环形通道和微室。所述微室微流控芯片可通过将细菌在不同的三种微室中进行培养,根据不同的需求同时进行观察。
所述微室微流控芯片的具体制备参数详见图5,其制备工艺按照本领域常规技术进行。
实施例2
如图6所示,本实施例公开了一种微生物生长图像检测微室微流控系统,包括显微镜、恒流注射泵、注射器、恒温载物台、实施例1所述微室微流控芯片、收集器、cmos视频检测组件、视频记录仪、移动硬盘和显示器;所述恒温载物台置于显微镜载物上;所述微室微流控芯片置于恒温载物台上,为芯片提供恒定的培养温度,大小适配于显微镜和芯片;所述cmos视频检测部件通过连接固定于显微镜上方,所述cmos视频检测组件用于配套测量所述微室微流控芯片中每个微室内细菌的形态学变化;所述微室微流控芯片的进液口连接有恒流注射泵,恒流注射泵上设置有注射器;所述微室微流控芯片的出液口连接有收集器;视频记录仪连接显分别和coms视频检测组件、移动硬盘和显示器相连接。
作为一种具体的实施方式,所述cmos视频检测组件包括运算单元,运算单元是基于中值滤波原理和对应的分割公式和系数,用于获得微生物清晰的灰度图像信息。
作为一种具体的实施方式,所述运算单元是基于mat2gray函数和imfilter函数进行图像滤波,图像分割采用bwareaopen函数和bwareaclose函数以及环形分割公式s=(r2-r2)。
具体为采用imfilter函数(实现线性空间滤波函数),参数设置为‘corr’即相关和‘replicate’即图像大小通过复制外边界的值来扩展,平均滤波窗口大小为30,最小滤波像素阈值0.035,使用imfilter函数前先采用mat2gray函数将图像矩阵归一化,即,所有数据除以最大值,矩阵最大值为1,从而将矩阵数据归一化在0到1之间,便于后期参数的设定。
bwareaopen函数(matlab)和bwareaclose函数,参数阈值p分别为0.3和5000,邻域为8。
作为一种具体的实施方式,所述cmos视频检测组件为数码相机;优选为尼康d7100相机,可实现传输像素为1080p,频率10帧/秒的高速记录单元,能够清晰准确的记录高速运动的微生物,获得更为可靠的图像信息,而且价格相对与同等性能的工业相机,价格低廉。配套的图像滤波和分割算法,mat2gray函数和imfilter函数可对图像进行滤波,去除图像噪点,平滑背景的不均一,而bwareaopen函数和bwareaclose函数可分割去除图像中过小和过大面积非微生物的图形结构,从而获得准确真实的图形数据,环形分割公式s=(r2-r2)可实现对生物膜区域的分割。
作为一种具体的实施方式,所述显微镜为荧光显微镜,荧光模块为ccd荧光灯,可发射蓝光、红光、绿光。
应用例1细菌生长培养观察
1、活化大肠杆菌mc4100过夜。
2、打开注射泵设置参数,注射泵参数为规格2.5ml,流速4ml/h,培养基体积2.5ml,用2.5ml一次性针管吸取菌液待用。
3、打开电源开关,同时设置相机参数(实时取景,感光度h1,视野dx),显微镜参数(物镜40x,相称40,光强最大,接口0.6)视频记录仪参数(hdmi,1080p)恒温载物台参数(42℃),恒温培养箱参数(37℃),将芯片与进出样品管联通,用特制芯片固定夹固定芯片,手动对焦,对焦后锁焦。
4、经注射器针头接入进样管管口,打开注射泵,同时打开视频记录仪开始记录视频。
5、观察菌液进入情况,待菌液集中满微室后,设置注射泵参数为流速2ml/h,换取新的lb(内加一定浓度的环丙沙星培养液冲洗管道内残余菌液,时间为1小时。
6、重新设置注射泵参数为流速1ml/h,进入稳定培养阶段。
7、视频记录完成后,取出移动硬盘,关掉电源,并用30%双氧水高速冲洗芯片,注射泵参数为流速5ml/h。
8、处理图像信息
从图像记录(图7)及分割结果(图8)中可是看出,本发明成功记录到大肠杆菌mc4100在加入环丙沙星后的异型生长过程,形态的变化清晰可见,细菌发生丝化生长,为长杆状,图9所示结果为图8的平均灰度值统计,结果为平滑的对数生长模型曲线,因此本系统可以准确的获得细菌的形态学信息和生长曲线。
应用例2细菌的生长观察及趋化性追踪
1、用m9培养基活化大肠杆菌bw25113过夜。
2、打开注射泵设置参数,注射泵参数为规格2.5ml。流速4ml/h,lb培养基体积2.5ml,用2.5ml一次性针管吸取菌液待用。
3、打开电源开关,同时设置相机参数(实时取景,感光度h1,视野dx),显微镜参数(物镜40x,相称40,光强最大,接口0.6)视频记录仪参数(hdmi,1080p)恒温载物台参数(42℃),恒温培养箱参数(37℃),将芯片与进出样品管联通,用特制芯片固定夹固定芯片,手动对焦,对焦后锁焦。
4、经注射器针头接入进样管管口,打开注射泵,同时打开视频记录仪开始记录视频。
5、观察菌液进入情况,待菌液集中满微室后,设置注射泵参数为流速2ml/h,换取新的lb培养液冲洗管道内残余菌液,时间为1小时。
6、重新设置注射泵参数为流速0ul/h,进入稳定培养阶段。
7、视频记录完成后,取出移动硬盘,关掉电源,并用30%双氧水高速冲洗芯片,注射泵参数为流速5ml/h。
8、处理图像信息
从图像记录(图10)及分割结果(图11)中可以看出,本发明成功记录到大肠杆菌bw25113在从营养匮乏的m9培养基向营养丰富的lb培养基运动的去趋化运动过程,图12中部分菌的其运动轨迹真实的反映了其运动过程。
应用例3细菌生物膜测量
1、活化大肠杆菌mc4100-egfp(简称wt),mc4100-egfp耐药菌(简称rcip),过夜。
2、打开注射泵设置参数,注射泵参数为规格2.5ml,流速4ml/h,培养基体积2.5ml,用2.5ml一次性针管吸取菌液待用。
3、打开电源开关,同时设置相机参数(实时取景,感光度h1,视野dx),显微镜参数(物镜20x,相称20,光强最大,接口0.6)视频记录仪参数(hdmi,1080p)恒温载物台参数(42℃),恒温培养箱参数(37℃),将芯片与进出样品管联通,用特制芯片固定夹固定芯片,手动对焦,对焦后锁焦。
4、经注射器针头接入进样管管口,打开注射泵,同时打开视频记录仪开始记录视频。
5、观察菌液进入情况,待菌液集中满微室后,设置注射泵参数为流速2ml/h,换取新的lb培养液冲洗管道内残余菌液,时间为1小时。
6、重新设置注射泵参数为流速1ml/h,进入稳定培养阶段。
7、视频记录完成后,取出移动硬盘,关掉电源,并用30%双氧水高速冲洗芯片,注射泵参数为流速5ml/h。
8、编写程序处理图像信息。
从图像记录及分割结果(图13)中可以看出,本发明系统成功记录到大肠杆菌的生物膜形成,并且统计学检验后,图14的结果表明表明已知生物膜形成较强的rcip菌株的实测生物膜明显高于wt菌株,说明本发明可应用于细菌生物膜的形成检测。
综上,本发明一种微生物生长图像检测微室微流控系统可以成功实现微生物形态学生长信息的获取,并可以用于微生物的生长追踪,趋化性的研究,生物膜的形成研究等邻域,可实现实时、准确、快速高频、高分辨率记录微生物的图像信息,并且对应的cmos运算模块可以准确的分割出真实的微生物形态学信息和数据信息,为后其研究的个性化研究提供了良好的基础,也微生物图像检测领域提供了一款高效廉价的系统。
- 还没有人留言评论。精彩留言会获得点赞!