成花素基因GmFT2a的应用的制作方法
本发明属于生物技术领域,涉及基因的新应用,具体涉及成花素基因gmft2a在促进豆科植物生物固氮,提高氮、磷效率方面的新应用。
背景技术
大豆是典型的生物固氮作物。然而,固氮器官——根瘤的形成是发挥生物固氮作用的基础。由此,研究大豆结瘤固氮的生理与分子调控机制、挖掘大豆生物固氮潜力,对大豆固氮高效的遗传改良和以及分子育种等方面均具有重要意义。
开花是植物从营养生长过渡到生殖生长的典型标志,亦是大豆产量形成的基本要素。其中,floweringlocust(ft)是植物开花途径中最重要的整合因子,对成花转变起着至关重要的作用。研究表明,ft基因主要在叶片中被诱导表达,合成的蛋白质由叶片经过维管束移动到茎顶端组织与floweringlocusd(fd)和14-3-3蛋白相互作用形成复合体,共同促进下游开花基因的表达,从而促进开花。虽然,调控植物开花是ft基因的主要功能,但由于不同植物适应各自的生态环境,不同植物的ft及其同源基因也进化出不同的生物学功能。短日照条件下,通过促进马铃薯的一个ft同源基因hd3a的表达,可继而促进块茎的形成;番茄的single-flowertruss(sft)不仅调控开花,同时对坐果也有显著的促进作用。
大豆固氮器官——根瘤是在宿主根系上与微生物互作的特化器官。结瘤过程受到地上部-根系的系统信号调控。在叶片合成的ft是否通过维管组织运输到根系/根瘤,调控大豆结瘤过程,进而影响植物的养分效率。同时,大豆是严格的短日照作物,即在短日条件下比在长日条件下开花明显提前,说明成花素ft基因在长、短日照条件下存在不同的调控模式。那么,在不同光周期下,ft与大豆结瘤又存在怎样的调控关系。目前,对于ft的功能研究主要集中在地上部的开花过程,关于ft与地下部根系及豆科特有的根瘤之间的调控关系的研究还未见报道。
技术实现要素:
本发明的目的在于提供一种成花素基因gmft2a在促进豆科植物生物固氮,提高氮、磷效率方面的应用。
为实现上述目的,本发明采用如下技术方案:
本发明要求保护成花素基因gmft2a在促进豆科植物生物固氮,提高氮、磷效率方面的应用。
所述成花素基因gmft2a主要在根瘤发育后期表达,其蛋白主要定位于根瘤皮层细胞的细胞核和细胞质中。
所述成花素基因gmft2a具体的应用方法是将含成花素基因gmft2a的过表达载体转入豆科植物中,获得过量表达gmft2a的整株转基因豆科植物。gmft2a可以从叶片移动到根瘤,且过量表达的gmft2a在长、短日照条件下均能显著增加豆科植物根瘤数量、重量和固氮酶活性,提高植株氮、磷含量,并最终增加转基因植物的生物量;而降低gmft2a表达的近等基因系则显著抑制了豆科植物结瘤、氮、磷营养及生物量。
发明人的研究将为包括大豆在内的豆科作物氮、磷养分高效和光周期广适性的高产分子育种提供基因资源。
本发明的有益之处在于:本发明对增加包括大豆在内的豆科作物根瘤数目、重量、固氮酶活性,提高植株氮、磷养分效率,增加转基因植株的生物量具有重要意义,对发展减肥增效可持续生态农业具有重要的指导和实践意义,并可为高产高效及光周期广适性的大豆遗传改良提供基因资源。此外,本发明内容丰富了成花素基因的生物学功能及其在生物固氮调控机理方面的理论知识。
附图说明
图1为gmft2a的表达模式分析;
图2为gmft2a启动子驱动gus表达的组织定位分析;
图3为gmft2a在根瘤中的蛋白定位分析;
图4为嫁接试验分析gmft2a的移动性;
图5为过量表达gmft2a转基因大豆的鉴定分析;
图6为不同光周期下过量表达gmft2a对转基因大豆结瘤的影响;
图7为不同光周期下过量表达gmft2a对转基因大豆生物量及氮、磷含量的影响;
图8为gmft2a近等基因系材料的结瘤比较分析;
图9为gmft2a近等基因系材料的生物量及氮、磷含量比较分析。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
一、成花素基因gmft2a的表达模式及组织定位分析
1.成花素基因gmft2a的表达模式分析
gmft2a基因的开放阅读框长度为531bp,编码176个氨基酸的蛋白,属于pebp家族中的一个亚家族。为了明确gmft2a是否在根瘤中及在不同生长期的不同组织中表达,首先分析了其表达模式。
大豆种子willimas82用3%(v/v)h2o2表面消毒一分钟,在1/2全营养液润湿的石英砂中催芽萌发7d,接种根瘤菌1h后转移到低氮营养液[(ln:530μmnh4no3+kno3+ca(no3)2·4h2o)]中处理。植物生长在长日照(ld:14h白天/10h黑夜)可控温室下进行。分别收获接种处理第5d、7d、14d、21d、30d和40d的根、根瘤、茎、叶、花等组织,并抽提rna,反转录成cdna,进一步用定量pcr检测gmft2a的表达模式。以大豆的看家基因ef-1a作为内参。用于定量pcr检测基因表达量的引物分别为:
大豆ef-1a基因的引物为:
ef-1af:5’-tgcaaaggaggctgctaact-3’(seqidno:1)
ef-1ar:5’-cagcatcaccgttcttcaaa-3’(seqidno:2)
gmft2a基因的引物为:
gmft2a-qf:5’-atcccgatgcacctagccca-3’(seqidno:3)
gmft2a-qr:5’-gcatacacggtctccctaccca-3’(seqidno:4)
定量pcr反应程序为:将rna反转录所得的cdna稀释50倍作为定量pcr反应模板。试验中采用20μl反应体系,包括:10μl的starttopgreenqpcrsupermix(trans),各0.6μl的10μm正反向引物,2μl稀释的cdna,最后mili-q水补至20μl。
定量pcr反应条件为:95℃变性1min,然后94℃裂解15s,60℃结合15s,72℃延伸30s并进行40次循环。
相对表达量是gmft2a的表达与大豆看家基因表达的比值。计算采用2-△△ct方法。
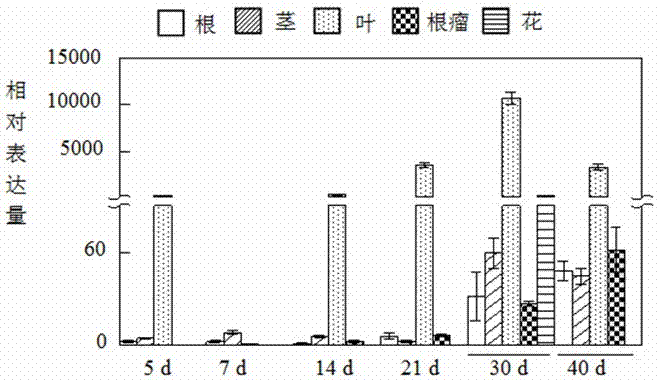
图1为gmft2a的表达模式分析。
由图1可见,gmft2a主要在叶片中表达,随着根瘤生长发育至14d时,gmft2a的mrna随着根瘤生长发育而在根瘤中逐渐积累;在接种后30d时,gmft2a在根瘤中的表达增加,暗示gmft2a可能参与根瘤发育过程。
gmft2a基因启动子克隆、载体构建及组织定位分析
按照常规方法,提取大豆叶片基因组dna,并以其为模板,用上游特异引物和下游特异引物扩增gmft2a启动子2326bp片段,pcr片段回收,通过bamhi和ecori对目的载体ptf102进行双酶切后,利用重组酶连接,转化大肠杆菌,单克隆测序无误后,抽质粒转化发根农杆菌k599备用。其中,
上游特异引物为:
5’-ctatgacatgattacgaattcttccccttatttcctatccta-3’(seqidno:5)
下游特异引物为:
5’-gactgacctacccggggatccgggatagtgtgcacactagtt-3’(seqidno:6)
通过农杆菌介导的利用大豆下胚轴注射转化法获得转基因毛状根。待毛根长出3-4cm后将主根剪掉,保留从愈伤组织处长出来的毛状根,gus染色检测后,将阳性转基因毛状根浸泡在根瘤菌菌液中1h,并移入砂-蛭石等比例混合的花盆中,隔天浇上述低氮营养液处理至25d。分别收获接种根瘤菌处理根和根瘤进行gus染色分析,基因表达的组织定位进一步通过石蜡切片进行观察。
图2为gmft2a启动子驱动gus表达的组织定位分析,其中i-iv为对照组织;v-viii为gmft2a启动子驱动gus的组织定位(i和v为整株根系及根瘤;ii和vi为局部根系;iii和vii为根瘤原基;iv和viii为生长25d的根瘤横切图)。
由图2可见,与组成型表达的对照相比(i-iv),gmft2a主要在根系中柱(vi)、根瘤原基(vii)及根瘤皮层细胞(viii)中表达。说明gmft2a可能参与根瘤起始及皮层发育进程。
二、gmft2a在根瘤中的蛋白定位分析
为了明确gmft2a在根瘤中的蛋白定位,将gmft2a开放阅读框去掉终止密码子序列用上游特异引物和下游特异引物扩增,回收产物长度为528bp,并利用bamhi酶切plgfp表达载体,构建成n端融合表达载体。进一步利用重组酶连接,转化大肠杆菌,单克隆测序无误后,抽质粒转化发根农杆菌k599备用。其中,
上游特异引物为:
5’-gggctcgagaagcttggatccatgcctagtggaagt-3’(seqidno:7)
下游特异引物为:
5’-ctgcagccgcggttaggatccttagtataacctccttc-3’(seqidno:8)
利用大豆下胚轴注射转化法,获得转基因毛状根。待毛根长出3-4cm后将主根剪掉,保留从愈伤组织处长出来的毛状根,经过gfp荧光检测后,将阳性转基因毛状根浸泡在根瘤菌菌液中1h,并移入砂-蛭石等比例混合的花盆中,隔天浇上述低氮营养液处理至14d。收获根瘤进行振荡切片,并在共聚焦显微镜下观察荧光信号。
图3为gmft2a在根瘤中的蛋白定位分析,图中标尺为20µm。
由图3可见,组成型表达对照gfp的信号在根瘤皮层细胞中均有表达,与之相比,gmft2a主要在根瘤皮层细胞的细胞核及可能定位于细胞质中。
三、嫁接试验分析gmft2a的移动性
为了明确gmft2a是否从叶片运输到根瘤而进一步调控大豆结瘤,首先利用嫁接试验分析了gmft2a的移动性。将35s:gmft2a-gfp与野生型大豆种子萌发至4d,在茎基部将其切割,并用劈接法将接穗和砧木进行嫁接。恢复1周后,接种根瘤菌并转移到砂-蛭石等比例混合的花盆中,隔天浇上述低氮营养液。分别收获14d、21d、30d和40d的根瘤进行切片及共聚焦显微镜观察gfp信号。
图4为嫁接试验分析gmft2a的移动性。其中,图4(a)为接穗为gmft2a融合gfp的转基因大豆而砧木为野生型;图4(b)为接穗与砧木均为野生型对照,图中标尺为20µm。
由图4可见,与接穗与砧木均为野生型的对照相比,gmft2a可以从地上部运输到根瘤中,且生长14d时根瘤中gfp信号最强;当接种后21d时正值植株开花期,根瘤中gfp信号与对照相比没有明显差异;生长至30d和40d时,根瘤中gfp信号又有明显增强。说明gmft2a在大豆开花前和开花后均可从地上部移动到地下部,参与调控大豆结瘤过程。
四、不同光周期下过量表达gmft2a对转基因大豆结瘤的影响
将转基因及野生型大豆的三出复叶涂抹除草剂,未涂抹一侧用记号笔标记,对转基因阳性苗进行初筛。同时,顶端、叶、花、根及大(直径>2mm)、中(直径=2mm)和小(直径<2mm)根瘤用于分析gmft2a的表达量。
对于过量表达gmft2a对大豆结瘤功能分析试验:gmft2a过量表达转基因及野生型大豆种子表面消毒并于石英砂中萌发7d,将长势一致的幼苗接种根瘤菌1h后,移入短日照(sd:12h白天/12h黑夜)和长日照(ld:14h白天/10h黑夜)环境中,在上述低氮营养液中生长30d,然后收获根瘤样品进行相关生理指标测定,包括:根瘤数目、根瘤干重和固氮酶活性。生物量的测定:将根部的根瘤摘下计数后,用万分之一天平称取重量(所有样品在105℃烘箱杀青30分钟后置于75℃烘干至恒重,称取干重);固氮酶活性的测定:将根瘤摘下放入8ml青霉素小瓶中,密封,抽出1ml空气,并打入1ml乙炔,反应2h后,利用0.5mnaoh终止反应,取0.3ml气体注入气相色谱中检测生成乙烯的量。
图5为过量表达gmft2a转基因大豆的鉴定分析(wt代表野生型大豆;ox代表过量表达gmft2a的转基因大豆),其中,图5(a)为叶片涂抹除草剂检测的阳性苗;图5(b)为定量pcr分析gmft2a的表达效果;图中*表示显著水平0.01<ρ≤0.05时,差异显著;**表示显著水平0.001<ρ≤0.01时,差异显著性介于显著与极显著之间;***表示显著水平ρ≤0.001时,差异极显著。
由图5可见,与野生型大豆叶片相比,转基因大豆叶片表现出明显的抗性(叶片未坏死);且转基因大豆的gmft2a在顶端、叶片、花和根瘤中均显著高于野生型,可用于后期试验。
图6为不同光周期下过量表达gmft2a对转基因大豆根瘤的影响(wt代表野生型大豆,ox代表gmft2a过量表达株系;sd代表短日照条件,ld代表长日照条件),其中,图6(a)为根瘤表型图片;图6(b)为根瘤数目;图6(c)为根瘤干重;图6(d)为固氮酶活性;图中*表示显著水平0.01<ρ≤0.05时,差异显著;**表示显著水平0.001<ρ≤0.01时,差异显著性介于显著与极显著之间;***表示显著水平ρ≤0.001时,差异极显著。
由图6可见,gmft2a的过量表达能显著促进长、短日照条件下大豆结瘤,明显增加根瘤数目和根瘤干重,并提高根瘤的固氮能力,显著提高转基因根瘤的固氮酶活性。说明gmft2a能够调控根瘤生长发育,增加根瘤数目和固氮能力。
五、不同光周期下过量表达gmft2a对转基因大豆生长及氮、磷含量的影响
将上述转基因材料进行收获,并测定植株生物量和养分状况。其中,植株生物量的测定:采用百分之一天平称量地上部和根部样品重量(所有样品在105℃烘箱杀青30分钟后置于75℃烘干至恒重,称取干重)。植株氮、磷测定:植株氮和磷含量采用连续流动分析仪(型号为san++,产自荷兰)测定,首先称取植株样品0.2g左右,加入5ml浓硫酸消解后用蒸馏水定容至50ml,并将样品稀释4倍制成待测液。待测液流入检测器并将比色信号输入电脑,由flowaccess软件计算结果。植株养分含量用单位植株氮、磷量表示,计算公式为:氮含量(mg/plant)=氮浓度(mg/g)×植株干重(g/plant);磷含量(mg/plant)=磷浓度(mg/g)×植株干重(g/plant)。
图7为不同光周期下过量表达gmft2a对转基因大豆生物量及氮、磷含量的影响(wt代表野生型大豆,ox代表gmft2a过量表达株系;sd代表短日照条件,ld代表长日照条件),其中,图7(a)为植株表型;图7(b)为植株干重;图7(c)为植株氮含量;图7(d)为植株磷含量;图中*表示显著水平0.01<ρ≤0.05时,差异显著;**表示显著水平0.001<ρ≤0.01时,差异显著性介于显著与极显著之间。
由图7可见,过量表达gmft2a显著促进了大豆生长,明显增加了长、短日照条件下植株生物量,并提高了植株的养分效率,显著提高了转基因大豆的氮含量和磷含量。
六、不同光周期下gmft2a近等基因系材料的结瘤比较分析
为了进一步明确gmft2a对大豆结瘤的调控,利用其近等基因系材料进行结瘤试验。其中,5-5wt是gmft2a正常表达的材料;而在5-6nil中,gmft2a第一内含子中含有965bp转座子插入,使其表达量有明显的下降。将5-5wt和5-6nil近等基因系大豆种子表面消毒,并播种于石英砂中7d,将长势一致的幼苗进行根瘤菌接种1h,并分别转移至短日照(sd:12h白天/12h黑夜)和长日照(ld:14h白天/10h黑夜)条件下,于上述低氮营养液中生长30d。收获根瘤样品进行相关生理指标测定,包括:根瘤数目、根瘤干重和固氮酶活性(方法同上)。
图8为gmft2a近等基因系材料的结瘤比较分析,其中,图8(a)为根瘤表型图片;图8(b)为gmft2a在近等基因系中的表达量;图8(c)为根瘤数目;图8(d)为根瘤干重;图8(e)为固氮酶活性;图中*表示显著水平0.01<ρ≤0.05时,差异显著;**表示显著水平0.001<ρ≤0.01时,差异显著性介于显著与极显著之间;***表示显著水平ρ≤0.001时,差异极显著。
由图8可见,与5-5wt材料相比,gmft2a在5-6nil材料中的表达量显著下降;进而,5-6nil材料中的根瘤数目和根瘤干重在长、短日照下均明显低于5-5wt材料。同时,降低gmft2a的表达量显著抑制了大豆根瘤固氮能力,其固氮酶活性在不同光周期条件下均显著低于5-5wt材料。说明gmft2a与大豆根瘤生长发育及固氮能力密切相关。
七、不同光周期下gmft2a近等基因系材料的生物量及氮、磷含量比较分析
将上述近等基因材料收获并按上述方法测定植株生物量及氮、磷含量。
图9为gmft2a近等基因系材料的生物量及氮、磷含量比较分析,其中,图9(a)为植株干重;图9(b)为植株氮含量;图9(c)为植株磷含量;图中*表示显著水平0.01<ρ≤0.05时,差异显著;**表示显著水平0.001<ρ≤0.01时,差异显著性介于显著与极显著之间;***表示显著水平ρ≤0.001时,差异极显著。
由图9可见,与5-5wt材料相比,5-6nil材料在长、短日照条件下的生物量、氮和磷含量均明显下降。说明gmft2a表达的下调显著抑制了大豆结瘤和固氮能力,进而抑制了大豆生长和养分效率。
综上所述,成花素基因gmft2a具有调控大豆结瘤固氮,提高氮、磷养分效率的新功能。在低氮处理接种根瘤菌条件下,成花素基因gmft2a过量表达的转基因大豆的根瘤数量、重量、固氮酶活性、氮/磷含量及生物量在不同光周期处理下均显著高于对照株系;而降低gmft2a表达量的遗传材料,表现相反结果。说明gmft2a在培育高效结瘤固氮转基因豆科植物,提高农作物的氮、磷养分效率以及提高农作物光周期广适性及产量等方面具有积极的应用意义。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
sequencelisting
<110>福建农林大学
<120>成花素基因gmft2a的应用
<130>1
<160>8
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>artificial
<220>
<223>1
<400>1
tgcaaaggaggctgctaact20
<210>2
<211>20
<212>dna
<213>artificial
<220>
<223>2
<400>2
cagcatcaccgttcttcaaa20
<210>3
<211>20
<212>dna
<213>artificial
<220>
<223>3
<400>3
atcccgatgcacctagccca20
<210>4
<211>22
<212>dna
<213>artificial
<220>
<223>4
<400>4
gcatacacggtctccctaccca22
<210>5
<211>42
<212>dna
<213>artificial
<220>
<223>5
<400>5
ctatgacatgattacgaattcttccccttatttcctatccta42
<210>6
<211>42
<212>dna
<213>artificial
<220>
<223>6
<400>6
gactgacctacccggggatccgggatagtgtgcacactagtt42
<210>7
<211>36
<212>dna
<213>artificial
<220>
<223>7
<400>7
gggctcgagaagcttggatccatgcctagtggaagt36
<210>8
<211>38
<212>dna
<213>artificial
<220>
<223>8
<400>8
ctgcagccgcggttaggatccttagtataacctccttc38
- 还没有人留言评论。精彩留言会获得点赞!