人缺血型肾损伤临床检测用NGAL的活性抗原和高亲和力抗体的制作方法
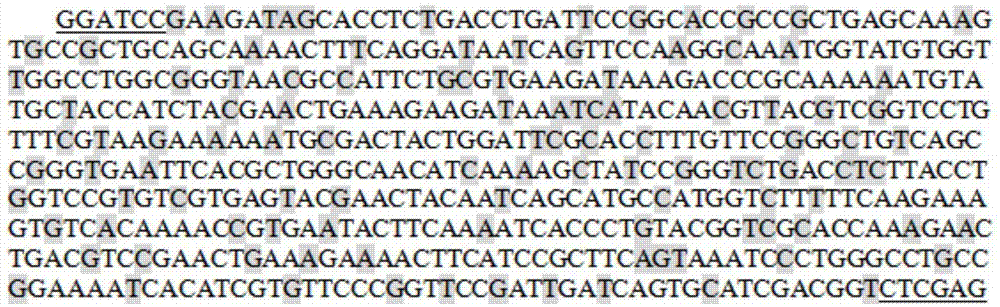
本发明涉及生物技术领域,特别是涉及一种人缺血型肾损伤临床检测用ngal的活性抗原和高亲和力抗体。
背景技术
人中性粒细胞明胶酶相关脂质运载蛋白(ngal)是一种从人中性粒细胞β颗粒发现的分泌型糖蛋白,属于lipocalin蛋白家族。ngalcdna的翻译产物为197个氨基酸残基肽链,其中前19个氨基酸是前导序列(leadersequence),余下178个氨基酸为成熟肽段(maturepeptide),二者构成相对分子质量为25kda的蛋白质,具有脂质运载蛋白家族典型的桶装结构,可以结合和运输多种小分子物质,从而发挥重要的生物功能。2003年,mishra等首次提出了ngal与缺血型肾损伤密切相关。此后,更多的相关研究表明血液和尿液中ngal可以作为判断急性肾损伤的早期诊断指标。近年来,国内外学者还发现它参与了其他多种疾病的发生发展,可作为肾脏疾病、肿瘤、炎症等多种疾病的一个新型敏感的生物学标志物。目前的抗原制备采用常规密码子编码,抗原表达效率比较低。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种人缺血型肾损伤临床检测用ngal的活性抗原和高亲和力抗体,用于解决现有技术中ngal抗原表达率低等问题。
为实现上述目的及其他相关目的,本发明第一方面提供一种如seqidno.1所示的核苷酸序列。
本发明第二方面提供含有上述序列的重组载体。
在本发明的一些实施例中,所述重组载体选自pw28质粒。
本发明第三方面提供含有上述重组载体的重组菌。
在本发明的一些实施例中,所述重组菌为重组大肠杆菌。
本发明第四方面提供由上述核苷酸序列表达的重组蛋白。
本发明第五方面提供一种抗ngal多克隆抗体,由上述重组蛋白作为抗原免疫动物后,分离纯化得到。
在本发明的一些实施例中,所述动物为兔。
本发明第六方面提供一种抗ngal单克隆抗体,由上述重组蛋白作为抗原免疫动物后,将动物细胞与sp2/0细胞融合,将融合后的细胞进行培养,得到所述抗ngal单克隆抗体。
在本发明的一些实施例中,所述被免疫动物为小鼠,免疫小鼠后,取小鼠脾细胞与sp2/0细胞融合。
本发明第七方面提供上述核苷酸序列、重组载体、重组菌、重组蛋白在制备抗ngal抗体中的应用。
如上所述,本发明的一种人缺血型肾损伤临床检测用ngal的活性抗原和高亲和力抗体,具有以下有益效果:本发明通过人工合成经密码子优化的ngal基因,构建原核表达重组质粒pw28-ngal,iptg诱导表达后分离纯化并分析在溶液中的聚集状态;获得的rhngal抗原免疫兔子制备多克隆抗体,免疫小鼠筛选高效价的特异性单克隆抗体并鉴定抗体亚型;proteing亲合柱纯化,等温滴定量热法及非竞争elisa法检测抗体的亲和力,sds-page分析纯度;最后运用westernblot、免疫荧光和免疫组化对抗体进行鉴定。结果显示,高效获得高纯度ngal重组蛋白,主要以单体形式存在;成功制备兔多抗,同时筛选获得6株高效价单克隆抗体;其中,25号单抗为igg1亚型,余者均属igg2a亚型,且19、35号单抗的亲和常数分别为3.06×109、2.14×109。sds-page分析表明纯度均大于90%。进一步的鉴定结果表明制备的抗体皆具有良好免疫反应性及特异性,且单抗的特异性明显高于多抗。
附图说明
图1显示为本发明实施例中密码子优化后设计的ngal基因序列图。
图2显示为本发明实施例中pw28-ngal重组质粒双酶切鉴定结果图。
图3显示为本发明实施例中ngal纯化结果图。
图4显示为本发明实施例中凝胶层析检测ngal在溶液中的聚集形式图。
图5显示为本发明实施例中抗ngal抗体纯化结果图。
图6显示为本发明实施例中抗ngal抗体免疫荧光结果图(荧光显微镜×400)。
图7显示为本发明实施例中单克隆抗体的免疫组化染色图(×400)。
图8显示为本发明实施例中ngal抗体特异性鉴定图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
须知,下列实施例中未具体注明的工艺设备或装置均采用本领域内的常规设备或装置;所有压力值和范围都是指绝对压力。
此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
实施例1
1材料及方法
1.1材料
1.11质粒、菌株、细胞和实验动物
e.colidh5α和e.colib834由本实验室(感染性疾病分子生物学教育部重点实验室)保存,载体质粒pw28由pet-28a(购自novagen公司)改造而来,人胚胎肾细胞293由本实验室保存。2只新西兰雄兔、4只spfbalb/c雌性小鼠、5只spf雄性裸鼠购自重庆医科大学动物中心。
1.12实验试剂及仪器
dl2000dnamarker、蛋白质marker、各种限制性内切酶(bamhⅰ和xhoⅰ)、质粒抽提试剂盒、t4dna连接酶及buffer购自promega公司,bca试剂盒购自碧云天公司。hrp标记的山羊抗小鼠igg二抗、bsa、购自bio-world公司。荧光标记的羊抗鼠igg二抗及dapi染剂购自武汉三鹰公司。imdm完全培养基(含15%血清)、hat、ht、2.2%甲基纤维素均购自sigma公司。抗体亚型鉴定试剂盒购自southernbiotech。
chemidoctmtouch化学发光成像仪、蛋白质电泳及湿转装置购自bio-rad公司,eps-300核酸电泳仪购自eppendorf公司,pcr仪、nanod1000微量分光光度计购自thermo公司,多功能微孔板检测仪购自biotek公司,超声波处理系统购sonics公司,蛋白质超滤系统购自micon公司。ni2+-nta亲和层析柱、hiloadsuperdex75凝胶层析柱、proteing亲和层析柱及填料购自gehealthcare公司。等温滴定量热仪购自malvern公司。
1.2方法
1.21pw28-ngal重组质粒的构建
根据genbank(nm004012)得到人ngal成熟肽段cdna序列,利用optimumgenetm软件分析其稀有密码子并采用大肠杆菌(e.coli)偏爱密码子优化人工合成基因序列,并分别在其5'和3'末端引入bamhⅰ和xholⅰ限制性酶切位点,密码子优化后设计的ngal基因序列如图1所示,图1中下划线部分为酶切位点,阴影部分为改变的碱基序列。合成的ngal序列与cdna相比,部分碱基不同但编码的氨基酸序列相同,可以使目的基因在大肠杆菌中更好地表达。将目的基因和pw28载体分别用限制性内切酶bamhⅰ和xholⅰ酶切。经糖原沉淀法纯化后的酶切产物用t4dna连接酶在16℃连接16h,转化至大肠杆菌e.colidh5α后涂布于50mg/l卡那霉素的lb平板上37℃过夜培养。挑取单克隆菌落放大后进行菌液pcr鉴定。选取阳性菌送至华大基因测序。
1.2.2ngal的表达
将测序成功的重组质粒转化至e.colib834表达菌株中,涂布法铺于含60mg/l卡那霉素的lb平板上,37℃恒温培养16h,挑取单菌落于lb液体培养基中,37℃,200r/min,摇床培养至od600nm约为0.2,加入iptg(诱导剂,终浓度为1mmol/l)继续培养,4h后离心分离菌体,用15%sds-page蛋白电泳鉴定,选取目的基因表达量及诱导效果最佳的菌落。然后对得到的菌种进行表达条件(如培养温度、时间、iptg浓度等)的优化,并最终选取以下条件:将已经初步放大的菌液按1∶100体积比接种至lb液体培养基中,37℃,200r/min,摇床培养至od600nm≈0.8时,加入诱导剂iptg(终浓度0.3mmol/l),于16℃恒温条件下诱导表达16h。
1.2.3ngal的纯化
用bindingbuffer(10mmol/lpbsph8.0,300mmol/lnacl)重悬菌体,充分混匀,冰水浴中进行超声破菌:0℃,超声4s,间隔6s,振幅28%,超声时间15min。将破菌液高速低温离心(4℃,12000r/min,30min),取上清以6s/滴的流速穿过由bindingbuffer平衡过的ni2+-nta亲和层析柱,再用250mlwashingbuffer(30mmol/l咪唑,10mmol/lpbsph8.0,300mmol/lnacl)洗脱杂蛋白质,最后用50mlelutionbuffer(500mmol/l咪唑,10mmol/lpbsph8.0,300mmol/lnacl)洗脱目的蛋白质。以pbs缓冲液超滤后利用凝胶层析法进一步纯化,并分析ngal在pbs溶液中的聚集状态。先用标准蛋白质:溶菌酶(14.4kd)、胰凝乳蛋白质酶原(25kd)、鸡卵清蛋白质(43kd)、牛血清蛋白质(67kd)对hiloadsuperdex75凝胶层析柱进行标定,然后再测定ngal重组蛋白,流速为1.0ml/min。将ngal的洗脱液用15%sds-page电泳,收集纯度高的部分进行超滤,浓缩所得的蛋白,再用15%sds-page电泳,imagej软件灰度扫描分析纯度,bca法测定浓度,最后分装冻存于-80℃备用。另外,根据洗脱曲线记录的标准蛋白质及ngal洗脱体积,计算出ngal在pbs溶液(10mmol/lpbs,ph7.4)中的分子量大小并分析其在溶液中的聚集形式。
1.2.4抗ngal多克隆抗体的制备
将制备的蛋白与等体积弗氏完全佐剂混匀乳化,免疫2只重约2kg的新西兰大白兔,14d后用弗氏不完全佐剂乳化的蛋白加强免疫,此后每周1次,共5次。首次蛋白剂量500μg,其余250μg。第1次免疫前采血并分离血清作为阴性对照,末次免疫10d后颈动脉采血分离血清,加入叠氮化钠后于-80℃保存。利用proteing亲和层析法纯化多抗。sds-page电泳分析纯度,bca法测抗体浓度。用标准的elisa方法测定纯化前后的效价,包被的抗原为纯化的ngal蛋白,一抗从1:1000倍比稀释至1:1024000,每样品设2个复孔,二抗为hrp标记的山羊抗兔igg(5000倍稀释),显色底物为tmb。
1.2.5抗ngal单克隆抗体的制备
用纯化的蛋白作为免疫原对小鼠进行常规免疫。效价达标后,冲击免疫。处死小鼠用常规方法进行融合,具体是取小鼠脾细胞,采用peg法,使其与sp2/0细胞融合,融合后的细胞转到半固体培养基(含hat)中培养,生长的单克隆挑到96孔培养板中进行培养并采用elisa法初筛,再以southernbiotech公司抗体亚型测定试剂盒进行亚类鉴定,筛选出igg类型的阳性杂交瘤细胞株。使用小鼠腹腔诱生法制备含大量单克隆抗体的腹水并利用proteing亲和柱纯化。sds-page蛋白电泳分析其纯度,bca法测浓度。间接elisa法测定纯化后抗体效价。利用等温滴定量热仪监测抗原抗体结合时的热量变化,反映并分析抗体的亲和力;非竞争elisa法再次测定抗体亲和力。
1.2.6抗人ngal抗体的鉴定
293细胞采用常规免疫荧光技术制片,用激光共聚焦镜观察。hepg2细胞裸鼠皮下成瘤后组织切片,进行常规免疫组化染色分析(immunohistochemistryassay,ihc)。iptg诱导前后pw28-ngal的总蛋白、纯化后的重组蛋白、293细胞蛋白裂解液及小鼠肝癌组织经sds-page电泳后电转移(100v,90min)至硝酸纤维膜,5%脱脂奶粉封闭2h,分别孵育纯化后的ngal抗体(1:500、1:1000、1:2000),4℃过夜,tbst洗膜5次,每次8min,hrp标记的山羊抗兔igg(1:5000室温反应1h)后,tbst洗膜5次,每次8min,ecl显色。
本研究所涉及的动物实验均符合重庆医科大学实验动物伦理委员会所制定的伦理学标准。
2.结果
2.1质粒构建
用限制性内切酶bamhⅰ和xhoⅰ将构建的pw28-ngal重组质粒进行双酶切,酶切产物用1%琼脂糖凝胶电泳,结果得到了两条分别约为534bp和5329bp的条带吗,与预期结果一致,见图2。将测定的基因序列与所设计的ngal序列用dnaassist软件进行比对分析,结果表明所插入的序列与设计的ngal基因序列完全吻合,重组质粒构建成功。
2.2蛋白表达与纯化
本研究利用大肠杆菌原核表达ngal的重组抗原,目的蛋白未经糖基化修饰,因此,表达的ngal分子量约为23kd,比理论值略小。sds-page电泳如图3显示,目的蛋白可溶性上清大量表达,经密码子优化获得的ngal实现了高效上清表达(约60mg/llb)。经过ni2+柱亲和纯化,500mmol/l咪唑条件下洗脱,所得蛋白分子量与重组蛋白质表观分子量相符合;imagej软件灰度扫描其纯度在85%以上。再经分子筛hiloadsuperdex75凝胶层析柱纯化后,纯度可达95%,bca法测得浓度为30.4mg/ml分装后冻存于-80℃备用。
2.3ngal的聚集状态
用已知分子量的标准蛋白质(溶菌酶、胰凝乳蛋白质酶原、鸡卵清蛋白、胎牛血清蛋白)对hiloadsuperdex75凝胶层析柱进行定标,根据洗脱曲线将洗脱体积和相应分子量进行拟合可得:logmw=-0.01712×ve+6.01667(r2值为0.9726)。同等条件下,用hiloadsuperdex75凝胶层析柱过ngal蛋白样品,其洗脱体积约为96.6ml,见图4。结合拟合公式计算得其在溶液中分子量约为23kd,提示ngal在pbs溶液(10mmol/lpbs,ph7.4)中主要以单体形式存在。与人体内天然存在的ngal蛋白聚集形式一致。
2.4抗人ngal抗体的制备
本研究以纯化的rhngal包板,对挑选的单克隆进行两次间接elisa筛选,得到14株高效价阳性杂交瘤细胞株。使用抗体分型检测试剂对细胞上清进行亚类鉴定,最后得到6株igg类型的阳性杂交瘤细胞株并大量培养及冻存,其中25号为igg1亚型,8、11、19、23、35号为igg2a亚型。取效价最高的两株细胞,小鼠腹腔诱生制腹水并用proteing柱纯化,得到单抗19、单抗35。以样品孔od值与阴性对照孔od值之比大于2.1为判断标准,测得多抗1、多抗2、单抗19、单抗35纯化前后的效价,见表1;bca法测得纯化后的4只抗体浓度分别为2.11mg/ml、1.98mg/ml、2.6mg/ml和2.03mg/ml;经sds-page电泳分析,如图5,抗体的纯度皆超过90%,可以满足后续实验要求;等温滴定量热法(isothermaltitrationcalorimetry,itc)测得ngal单克隆抗体19、35的亲和常数分别为3.06×109、2.14×109,非竞争elisa结果为2.62×109、1.72×109,二者基本一致。
表1抗体效价滴度
2.5抗人ngal抗体的鉴定
选用纯化后的多抗1、多抗2、单抗19和单抗35分别在293细胞行免疫荧光染色,结果显示四支抗体皆可与细胞中的ngal结合,呈现绿色荧光并主要分布于细胞浆中,见图6。小鼠肝癌组织免疫组化结果表明所制抗体皆能够在小鼠成瘤组织切片中呈阳性反应,阳性在细胞内外均有分布,并且主要定位于肝癌细胞胞浆中,见图7,与报道的ngal在肿瘤组织的定位一致。
分别以iptg未诱导、诱导的细菌总蛋白、纯化后的蛋白、293细胞裂解液及小鼠肝癌组织为研究对象进行蛋白电泳,采用兔抗rhngal多克隆抗体或鼠抗rhngal单克隆抗体为一抗,hrp标记的羊抗鼠igg为二抗,进行免疫印迹分析,westernblot结果显示,在约23kd处均出现清晰可见的条带,见图8。该结果表明,所制备的抗ngal抗体可同rhngal及天然ngal蛋白呈现强的特异性反应。上述实验证实了抗ngal抗体都具有较好的特异性及免疫反应性,且单抗的特异性远强于多抗。
3.讨论
ngal主要存在于中性粒细胞、单核巨噬细胞和脂肪细胞,在肾、骨髓、前列腺、肝脏、结肠、胃、支气管、胰腺及胸腺等组织中以低水平表达。生理状况下,ngal在血、尿液中的浓度极低。肾损伤、肿瘤、炎症、缺血、外科手术等都能诱导ngal表达量上调。基础和临床研究都表明,ngal与缺血型急性肾损伤密切相关,即在肾脏发生急性损伤时,ngal在血、尿中的含量明显升高,而从肾脏缺血到ngal出现只小于2h,而当治疗后,血清中的ngal的水平又可以明显下降。因此,ngal可以作为急性肾损伤的早期诊断指标之一。近年来,大量的研究比较了ngal与血清肌酐(scr)、半胱氨酸蛋白酶抑制剂c(cysc)、α1-微球蛋白(α1-mg)、尿微量清蛋白(alb)、n-乙酰-β-d氨基葡萄糖苷酶(nag酶)等常用指标在肾损伤的反映作用,基本确认ngal是目前最具有应用前景的早期肾损伤标志物。ngal还可以联合血浆b型钠尿(b-typenatriureticpeptide,bnp)来预测及评价心衰术后肾功能衰竭发生风险,预测敏感度为90%,特异度为99%。此外,其他如食管癌、乳腺癌、肺腺癌及细菌感染等疾病的ngal值也有不同程度的升高。现已有的ngal高灵敏度检测方法主要有化学发光微粒子免疫分析法、双抗体夹心免疫荧光层析法、胶乳增强免疫比浊法等,均被国外垄断,仪器、试剂均需进口,成本昂贵、购买周期长,使用受限。而ngal作为一项有意义的检验指标,值得在临床上广泛推广应用。研制国产试剂可大大降低成本,本研究的主要目的即是为此试剂的研发做前期工作。
目前,何莹等用293细胞真核表达纯化的rhngal做抗原表达的rhngal经过糖基化修饰,但表达量极低,纯化非常难,制备成本高昂。barasch等在大肠杆菌中由于表达量低(小于10mg/ml),有大量的包涵体形成,抗原准备的效率比较低,成本也比很高。在此,本发明首先基于生物信息学分析ngal蛋白成熟肽段的基因序列,将其中的稀有密码子替换成大肠杆菌偏爱密码子,但保持氨基酸序列不变,使目的基因能在大肠杆菌中更高效地表达出目的蛋白,ngal表达效率由barasch等报道的10mg/l大幅度提高至60mg/l。纯化所得的重组ngal蛋白在溶液中主要以单体形式存在,与真核表达制备的抗原一致,预示抗原具有良好的生物学活性。
本研究利用高效制备的具有生物学活性的高纯度ngal获得了高效价的2株兔多克隆抗体和2株小鼠单克隆抗体,效价皆大于105。由于itc对单抗亲和力的检测效能远高于常规的非竞争性elisa法,故而单抗19和单抗35的亲和常数分别为3.06×109、2.14×109。此外,本研究组将获得的ngal抗体在293细胞中做免疫荧光检测,结果表明,制备的抗体能特异性地识别真核细胞内的ngal蛋白,可用于细胞内源性检测。随后通过免疫组化检测ngal在小鼠肝癌组织中的表达,结果发现在肝癌组织中阳性染色主要位于细胞质,与免疫荧光结果中ngal在细胞内的定位一致。为进一步验证所制ngal抗体的特异性,本研究对大肠杆菌破菌液、293细胞蛋白裂解液及小鼠肝癌组织进行westernblot分析,结果表明所制备的抗体与原核表达的rhngal、真核细胞及小鼠组织中的天然ngal抗原均可以发生特异性结合。因此,本研究所制的抗体效价高、特异性强,均具有广泛的应用前景。其中,制备的多抗成本低廉且亲和力较高,而单抗则拥有更强的特异性。
综上所述,为深化了解ngal蛋白对其相关疾病临床上的诊断、治疗和预后具有重要的意义,而这依赖于大量的ngal蛋白及其抗体。本发明利用密码子优化技术高效表达制备了ngal重组蛋白,获得了其高效价多克隆抗体和高特异性单克隆抗体,为ngal的病理生理作用等功能研究提供了良好的实验材料,为ngal临床免疫检测诊断试剂的进一步奠定了有力的基础。
参考文献
[1]singere,markól,paragasn,etal.neutrophilgelatinase-associatedlipocalin:pathophysiologyandclinicalapplications.[j].actaphysiologica,2013,207(4):663.
[2]chakrabortys,kaurs,guhas,etal.themultifacetedrolesofneutrophilgelatinaseassociatedlipocalin(ngal)ininflammationandcancer[j].biochimicaetbiophysicaacta,2012,1826(1):129-69.
[3]paragasn,qiua,zhangq,etal.thengalreportermousedetectstheresponseofthekidneytoinjuryinrealtime.[j].naturemedicine,2011,17(2):216-222.
[4]gasparif,cravedip,mandalàm,etal.predictingcisplatin-inducedacutekidneyinjurybyurinaryneutrophilgelatinase-associatedlipocalinexcretion:apilotprospectivecase-controlstudy.[j].nephronclinicalpractice,2010,115(2):c154.
[5]haasem,bellomor,devarajanp,etal.accuracyofneutrophilgelatinase-associatedlipocalin(ngal)indiagnosisandprognosisinacutekidneyinjury:asystematicreviewandmeta-analysis[j].americanjournalofkidneydiseasestheofficialjournalofthenationalkidneyfoundation,2009,54(6):1012.
[6]nuntagowatc,leelawatkr.ngalknockdownbysirnainhumancholangiocarcinomacellssuppressedinvasionbyreducingngal/mmp-9complexformation[j].clinical&experimentalmetastasis,2010,27(5):295-305.
[7]马玉国,赵红丽,任秀华,等.急性肾损伤的检测指标ngal的研究进展[j].国际检验医学杂志,2013,34(14):1842-1844.
[8]baraschj,hollmenm,dengr,etal.disposalofironbyamutantformoflipocalin2[j].naturecommunications,2016,7:12973.
[9]bolignanod,donatov,lacquanitia,etal.neutrophilgelatinaseassociatedlipocalin(ngal)inhumanneoplasias:anewproteinentersthescene[j].cancerlett,2010,288(1):10-16.
[10]makrisk,rizosd,kafkasn,etal.neurophilgelatinase-associatedlipocalinasanewbiomarkerinlaboratorymedicine[j].clinchemlabmed,2012,50(9):1519-1532.
[11]zhangy,fany,meiz.ngalandngalroverexpressioninhumanhepatocellularcarcinomatowardamolecularprognosticclassification.[j].cancerepidemiology,2012,36(5):e294-e299.
[12]subhankarchakraborty,sukhwinderkaur,sushovanguha,etal.themultifacetedrolesofneutrophilgelatinaseassociatedlipocalin(ngal)ininflammationandcancer.biochimbiophysacta,2012,1826(1):129-169.
[13]heised,rentschk,braeuera,etal.comparisonofurinaryneutrophilglucosaminidase-associatedlipocalin,cystatinc,andα1-microglobulinforearlydetectionofacuterenalinjuryaftercardiacsurgery.eurjcardiothoracsurg,2011,39(1):38-43.
[14]nielsense,schjoedtkj,astrupas,etal.neutrophilgelatinase-associatedlipocalin(ngal)andkidneyinjurymolecule1(kim1)inpatientswithdiabeticnephropathy:across-sectionalstudyandtheeffectsoflisinopril.diabetmed,2010,27(10):1144-1150
[15]fuwj,xiongsl,fangyg,etal.urinarytubularbiomarkersinshort-termtype2diabetesmellituspatients:across-sectionalstudy.endocrine,2012,41(1):82-88.
[16]prabhua,sujathadi,ninanb,etal.neutrophilgelatinaseassociatedlipocalinasabiomarkerforacutekidneyinjuryinpatientsundergoingcoronaryarterybypassgraftingwithcardiopulmonarybypass.annvascsurg,2010,24(4):525-531
[17]zhangh,xul,xiaod,etal.upregulationofneutrophilgelatinase-associatedlipocalininoesophagealsquamouscellcarcinoma:significantcorrelationwithcelldifferentiationandtumourinvasion[j].journalofclinicalpathology,2007,60(5):555.
[18]bauerm,eickhoffjc,gouldmn,etal.neutrophilgelatinase-associatedlipocalin(ngal)isapredictorofpoorprognosisinhumanprimarybreastcancer.[j].breastcancerresearch&treatment,2008,108(3):389-97.
[19]roudkenarmh,halabianr,ghasemipourz,etal.neutrophilgelatinase-associatedlipocalinactsasaprotectivefactoragainsth(2)o(2)toxicity[j].archivesofmedicalresearch,2008,39(6):560-566.
[20]floth,smithkd,satos,etal.lipocalin2mediatesaninnateimmuneresponsetobacterialinfectionbysequestratingiron[j].nature,2004,432(7019):917-921.
[21]何莹,郑怡麟,陈安,等.抗人ngal单克隆抗体的制备及其定量检测方法的建立[j].免疫学杂志,2013,29(1):50-54.
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
sequencelisting
<110>重庆医科大学
<120>人缺血型肾损伤临床检测用ngal的活性抗原和高亲和力抗体
<130>pcqby182129
<160>1
<170>patentinversion3.5
<210>1
<211>546
<212>dna
<213>artificial
<220>
<223>ngal基因序列
<400>1
ggatccgaagatagcacctctgacctgattccggcaccgccgctgagcaaagtgccgctg60
cagcaaaactttcaggataatcagttccaaggcaaatggtatgtggttggcctggcgggt120
aacgccattctgcgtgaagataaagacccgcaaaaaatgtatgctaccatctacgaactg180
aaagaagataaatcatacaacgttacgtcggtcctgtttcgtaagaaaaaatgcgactac240
tggattcgcacctttgttccgggctgtcagccgggtgaattcacgctgggcaacatcaaa300
agctatccgggtctgacctcttacctggtccgtgtcgtgagtacgaactacaatcagcat360
gccatggtctttttcaagaaagtgtcacaaaaccgtgaatacttcaaaatcaccctgtac420
ggtcgcaccaaagaactgacgtccgaactgaaagaaaacttcatccgcttcagtaaatcc480
ctgggcctgccggaaaatcacatcgtgttcccggttccgattgatcagtgcatcgacggt540
ctcgag546
- 还没有人留言评论。精彩留言会获得点赞!