一种高纯度格列美脲的制备方法与流程
本发明涉及药物制备领域,具体是一种高纯度格列美脲的制备方法。
背景技术:
医药行业是我国国民经济的重要组成部分,是传统产业和现代产业相结合,医药行业对于保护和增进人民健康、提高生活质量,为计划生育、救灾防疫、军需战备以及促进经济发展和社会进步均具有十分重要的作用。医药工作者对于药物潜心研究,研制出了许多治疗人类疾病的药物,格列美脲就是其中一种。
格列美脲化学名为1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰]-3-(反式-4-甲基环己基)-脲,结构式如下:
格列美脲是磺酰脲类降糖药,由德国hoechst开发。1995年格列美脲在瑞典上市,商品名为amaryl。1996年格列美脲在美国上市,用于治疗ii型糖尿病。格列美脲是fda批准的首个可与胰岛素同时使用的磺酰脲类降糖药,具有高效、长效的优点,是目前临床评价最好的磺酰脲类降糖药。
hoechst最早于1980年在专利us4379785中披露格列美脲的合成工艺,到目前为止关于格列美脲合成工艺的专利和文献发表数量众多。后发表文献中合成路线大部分基于hoechst的早期路线进行改进。格列美脲的主流合成路线如下。
1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺,结构式为
1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺的纯度对成品格列美脲的纯度影响很大,1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺带入的邻位磺酰化杂质和间位磺酰化杂质带入成品之后很难除去。wo2006/103690报道了格列美脲的公斤级制备工艺,在该专利中,为了纯化中间体1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺进行了两次重结晶,以56%的收率获得了纯度99.5%的1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺,其中间位和邻位异构体含量均在0.2%左右。该中间体的纯化一直是技术难点,如何才能以较高的收率得到纯度99.5%以上,异构体含量较低的产物。
hoechst日本分公司1997年发表的文献actacryst.(1997).c53,329-331披露了格列美脲的i晶型,熔点207℃。
文献stppharmasci.,13(4):281–286.披露了格列美脲的ii晶型,熔点为207℃,具有140℃的相变温度,140℃之后转化为i晶型。
文献journalofpharmaceuticalsciences,.101,2012,794对这两种晶型的溶出速度进行了对比,ii晶型明显优于i晶型。但是目前尚未有可以制备出高纯度、高产率、晶型正确且制剂产品质量较好的格列美脲生产工艺。
技术实现要素:
本发明的目的在于提供一种高纯度格列美脲的制备方法,以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:
一种高纯度格列美脲的制备方法,具体步骤如下:
步骤一,将1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺和碳酸钾和加入混合溶剂中并且升温至溶解;
步骤二,将步骤一的溶液进行降温析晶,过滤即得到1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰]-3-(反式-4-甲基环己基)-脲。
作为本发明进一步的方案:混合溶剂为2-丁酮和丙酮的混合溶剂。
作为本发明进一步的方案:1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺为3-乙基-4-甲基-3-吡咯啉-2-酮和2-苯乙基异氰酸酯在甲苯和惰性气体保护气氛下得到3-乙基-4-甲基-2-氧代-n-苯乙基-2,5-二氢-1h-吡咯-1-酰胺,3-乙基-4-甲基-2-氧代-n-苯乙基-2,5-二氢-1h-吡咯-1-酰胺再与hso3cl反应得到1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰氯,1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰氯再与氨水反应得到。
作为本发明进一步的方案:惰性气体保护气氛为氮气气氛或者氢气气氛。
作为本发明进一步的方案:步骤二中降温析晶的析出晶体加入适量二氯甲烷中并且在15~20℃打浆。
与现有技术相比,本发明的有益效果是:本发明的制备方法得到的格列美脲,纯度大于99.9%,产率高,杂质研究充分并可控,晶型正确且制剂产品质量较好,可以满足人们的使用需求。
附图说明
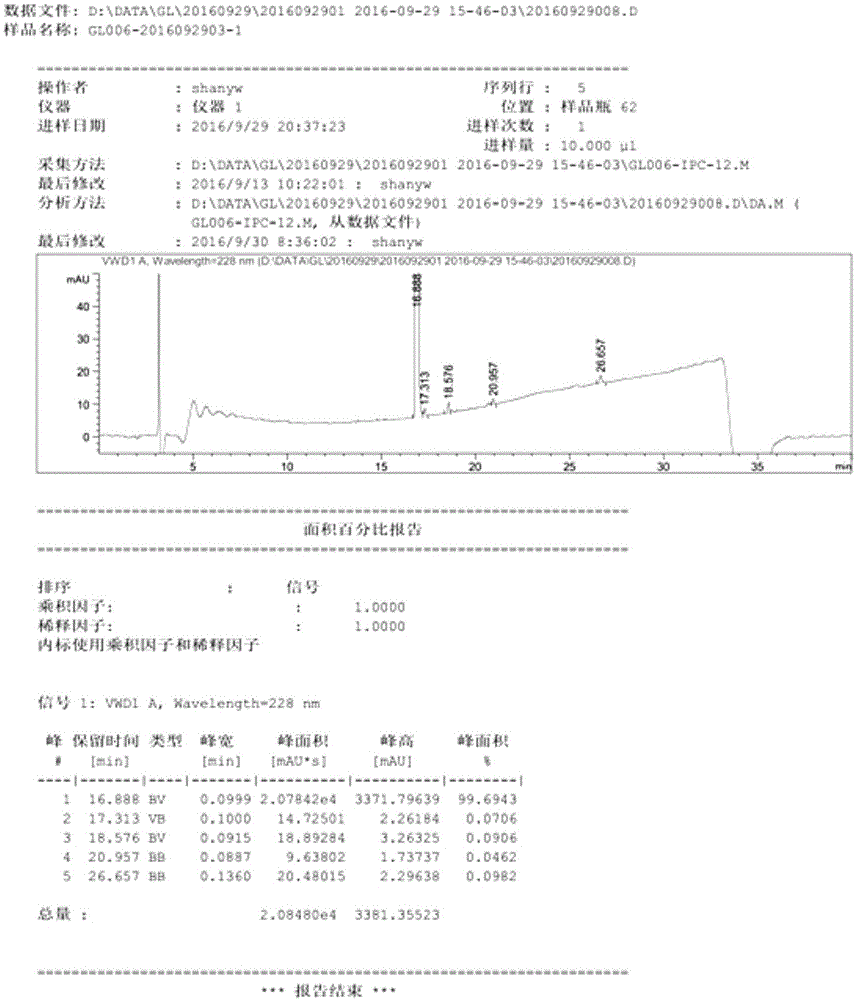
图1为高纯度格列美脲的制备方法中1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺的hplc谱图。
图2为高纯度格列美脲的制备方法中格列美脲粗品的hplc谱图。
图3为高纯度格列美脲的制备方法中格列美脲精制品的hplc谱图。
图4为高纯度格列美脲的制备方法的背景文献中文献actacryst.(1997).c53,329-331披露的格列美脲的i晶型的xrpd谱图。
图5为高纯度格列美脲的制备方法的背景文献中文献stppharmasci.,13(4):281–286.披露了格列美脲的ii晶型的xrpd谱图。
具体实施方式
下面结合具体实施方式对本专利的技术方案作进一步详细地说明。
实施例
一种高纯度格列美脲的制备方法,具体步骤如下:
步骤一,制备3-乙基-4-甲基-2-氧代-n-苯乙基-2,5-二氢-1h-吡咯-1-酰胺:预先将甲苯除水,分子筛保存,把甲苯、3-乙基-4-甲基-3-吡咯啉-2-酮和2-苯乙基异氰酸酯加入到三口烧瓶中,氮气置换下升温至回流反应,约4个小时hplc监测反应结束,对反应产物稍稍降温,在水浴温度50℃下减压浓缩,从而除去甲苯,浓缩干之后,加入丙酮,室温搅拌1个小时,降温至0℃左右析晶2-3小时,过滤,滤饼用少量正庚烷淋洗并且抽干,在45℃烘箱中减压烘干,得到3-乙基-4-甲基-2-氧代-n-苯乙基-2,5-二氢-1h-吡咯-1-酰胺,3-乙基-4-甲基-2-氧代-n-苯乙基-2,5-二氢-1h-吡咯-1-酰胺的收率80%以上,纯度98%以上,反应过程为
步骤二,制备1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰氯:将hso3cl加入反应瓶并且用氮气保护,将3-乙基-4-甲基-2-氧代-n-苯乙基-2,5-二氢-1h-吡咯-1-酰胺溶解在二氯甲烷中并且在室温下缓慢滴入hso3cl中,滴加完毕后在30-35℃保温反应半小时,待3-乙基-4-甲基-2-氧代-n-苯乙基-2,5-二氢-1h-吡咯-1-酰胺完全反应,生成大极性中间体,继续在30-35℃保温反应5小时,将反应液滴加入其体积倍10倍的冰水中,冰水的温度低于10℃进行淬灭,淬灭完成后,浓缩除去二氯甲烷,浓缩结束后加入其体积倍15倍的冰水,控制温度10℃左右析晶1小时,抽滤,滤饼用水冲洗,抽干,待用,反应过程为
步骤三,制备1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺:将上一步的滤饼转移至反应瓶,加入氨水,室温搅拌反应16小时,hplc监测反应结束,抽滤并且将滤饼用水冲洗两次,抽干,在45℃真空干燥,得
步骤四,制备格列美脲粗品:将丙酮和2-丁酮加入反应瓶,搅拌下加入
步骤五,格列美脲精制:将格列美脲粗品加入适量二氯甲烷中,在15~20℃打浆2小时,抽滤,45℃真空干燥至恒重,得格列美脲精制品,收率85%以上,纯度99.9%以上。
本发明提供纯度99.70%以上、异构体含量0.10%以下的1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺制备方法,总收率大于80%。1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺制备工艺有两个难点,第一个难点是1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰氯产物纯度较低,性转差,过滤困难。本发明发现使用二氯甲烷作为助溶剂可以有效改善反应,提高产物纯度;后处理阶段通过控制结晶溶剂比例可以得到良好的固体形态,具体的是先加一部分水分散,除去助溶剂,然后再加入一部分水析晶。第二个难点就是1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺的纯化,该步骤的纯度直接影响成品格列美脲的纯度。上一步累积的异构体杂质和其他杂质会被带入到下一步,成品除杂难度较大,需要在这一步进行有效的纯化。1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺纯化体系筛选部分结果见表1:
表1
实验发现2-丁酮-水混合溶剂体系可以极高的效率除去异构体及其他杂质。所研究的有关物质见表2:
表2
本发明提供纯度99.90%以上的格列美脲制备方法,根据本发明的实施方案,反应直接得到的格列美脲粗品纯度大于99.50%,精制后纯度大于99.90%。成品格列美脲合成工艺难点是起始原料1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺在反应中残留较多,1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺同时也是主要的降解产物,需要在原料药中严格控制其含量。中间体1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺溶解性较差,重结晶纯化难度较大,最好在反应中降低其含量。原研工艺采用丙酮作为反应溶剂,丙酮的优点是副反应少,杂质含量低。根据前一步骤1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺重结晶筛选的经验,2-丁酮-水体系对该化合物精制效果最好,可以推测1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺在2-丁酮中有良好的溶剂化作用。用2-丁酮替换丙酮进行反应之后,可以在反应体系内将中间体1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺彻底消耗,hplc显示反应液中1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺残留量低于0.3%,但是缺点是副反应多,杂质含量大。
混合溶剂往往会同时结合两种溶剂体系的优点,同时回避两种溶剂体系的缺点。采用丙酮/2-丁酮混合溶剂体系进行格列美脲的制备,可以结合丙酮和2-丁酮两种溶剂体系的优点。反应杂质含量低,原料转化率高,采用高纯度的起始原料1-[4-[2-(3-乙基-4-甲基-2-氧代-3-吡咯啉-1-甲酰胺基)-乙基]-苯磺酰胺进行反应,得到的格列美脲粗品纯度即在99.5%以上,典型纯度为99.7%。所采用的分析方法定入了数十个有关物质,包括工艺杂质、降解产物、苯环取代异构体、顺反异构体,液相色谱条件经过方法学验证。
根据本发明得到格列美脲成品,结晶型态为ii晶型。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 还没有人留言评论。精彩留言会获得点赞!