一种氘代色氨酸羟化酶抑制剂的晶型的制作方法
本发明属于药物化学领域,具体涉及一种氘代色氨酸羟化酶抑制剂的晶型及其制备方法。
背景技术:
药物物质的化学稳定性、固态稳定性和“贮存期限”在药物的制备中是特别重要的因素。鉴别能够方便地制备、配制和施用至患者的药物的形式就显得重要。理想的药物物质和含有它的组合物在评估期内能被有效贮存,而不显示活性成分物理化学性状(例如化学组成、密度、吸湿度、溶解度和溶出度等)的明显变化。
已知无定形药物物质并不能很好地解决以上问题。例如无定形药物物质通常难以处理和配制、提供不可靠的溶解度,并且通常发现无定形态物理与化学性质不稳定。
解决上述问题的办法主要有两种,其一是通过使药物分子成盐,尤其是使含氮原子的药物分子成盐,比如盐酸盐,能使氢正离子提供空轨道与氮上的孤对电子成键,从而使氮原子不易被氧化,增加了药物分子的稳定性;其二是找到稳定的晶型,许多上述问题可以得到解决。
因此,对式(i)所示的氘代色氨酸羟化酶抑制剂晶型进行研究具有重要意义。
技术实现要素:
本发明的目的在于提供一种式(i)所示的氘代色氨酸羟化酶抑制剂的新晶型。
具体的,本发明的一个目的是提供式i化合物的一种新晶型,命名为晶型a。
本发明提供的晶型a的特点如下所示:
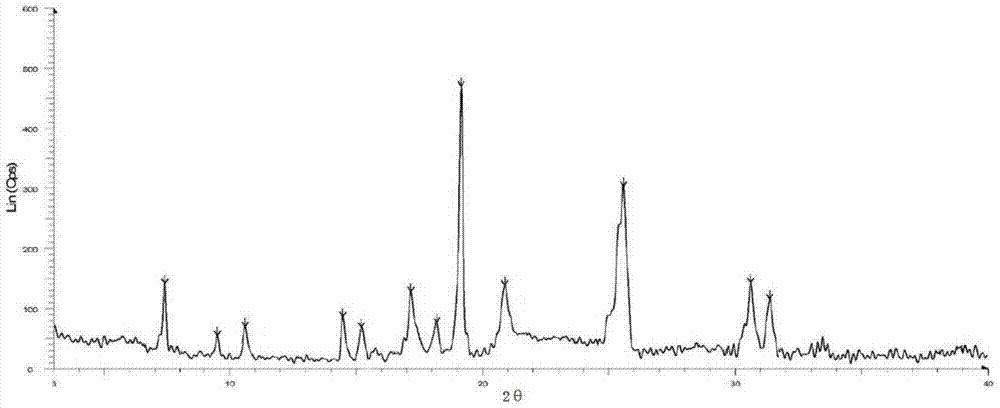
式i化合物晶型a的粉末在x射线衍射图谱中,在2θ角为7.36°±0.2°,9.52°±0.2°,10.66°±0.2°,14.54°±0.2°,15.29°±0.2°,17.28°±0.2°,18.15°±0.2°,19.27°±0.2°,20.96°±0.2°,25.34°±0.2°,30.62°±0.2°,31.38°±0.2°处具有特征峰。
更进一步的,本发明提供的晶型a,其特征还在于,其x射线粉末衍射图基本如图1所示。
本发明提供的晶型a,其特征在于,在加热至153℃开始出现吸热峰,晶型a的熔点为185℃,所述的dsc升温速率为10℃/min。其差示扫描量热法(dsc)曲线如图2所示。
本发明的另一个目的是提供了式i化合物晶型a的制备方法,其特征在于,将化合物i粉末加入到一种或几种溶剂的混合体系中加热溶解并冷却结晶得到。所述的溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺或n-甲基吡咯烷酮中的一种。所述的加热温度为溶剂回流温度。式i化合物与所述溶剂的质量比为1:10~30。
进一步地,将式i’化合物加入到n-甲基吡咯烷酮中,加热使固体完全溶解,搅拌2h,冷却至室温,继续搅拌1h。抽滤干燥,用乙醚淋洗滤饼,干燥,得到晶型a。
本发明的另一个目的是提供一种包含有效治疗量的式i化合物的晶型a和其药学上可接受的载体组成的药用组合物。药学上可接受的载体包括赋形剂、稀释剂、分散剂、悬浮剂、表面活性剂、等渗剂、增稠剂、乳化剂、防腐剂、固体粘合剂、着色剂、释放剂、甜味剂、包衣衣料、矫味剂、抗氧化剂或润滑剂等。
本发明的药物组合物可以是任何可接受的口服剂型,其包括但不限于胶囊剂、片剂、丸剂、粉剂、粒剂、水制悬浮液或溶液。
本发明的药物组合物可以是注射剂,其包括但不限于无菌注射剂或油脂性的悬浮液或乳液。
本发明的药物组合物可以是通过局部的或经皮肤给药的剂型包括软膏、糊剂、乳剂、洗剂、凝胶剂、粉剂、溶液、喷雾剂、吸入剂或贴片。
本发明的药物组合物具体的有效剂量。具体的有效剂量水平对于任何一个特殊的患者或有机体将取决于许多因素包括被治疗的病症和病症的严重性,具体化合物的活性,所用的具体组合物,患者的年龄、体重、健康状况、性别和饮食习惯,给药时间,给药途径和所用具体化合物的排泄速率,治疗的持续时间,药物应用于联合用药或与有特效的化合物联用,以及其他一些药学领域公知的因素。
更进一步的,本发明所述的药用组合物中,式i化合物的晶型a可用于制备治疗类癌综合症腹泻的用途。
根据本发明提供的制备方法所得的晶型a,经过研磨、压片后的x-射线粉末衍射检测显示2θ的衍射角未发生变化,表明在制剂过程中晶型不会发生变化。
附图说明
图1:式i化合物晶型a的x射线粉末衍射(xrpd)图。纵轴表示峰强度,横轴表示衍射角(2θ)。
图2:式i化合物晶型a的差示扫描量热法(dsc)曲线。纵轴表示w/g,横轴表示温度℃。
具体实施方式
实施例1:晶型a的制备
把2g式(i)化合物加入到25gn-甲基吡咯烷酮中,开启搅拌,在加热回流状态下搅拌2h,停止加热,搅拌冷却至室温后,继续搅拌1h。将所得悬浮液抽滤,滤饼用少量乙醚洗涤,收集滤饼,在45℃下真空干燥,得1.6g式i化合物晶型a的晶体。dsc测试熔点:185℃。
通过x-射线粉末衍射测试,使用cu-kα辐射,具有以下以角度2θ表示的特征峰:7.36°±0.2°,9.52°±0.2°,10.66°±0.2°,14.54°±0.2°,15.29°±0.2°,17.28°±0.2°,18.15°±0.2°,19.27°±0.2°,20.96°±0.2°,25.34°±0.2°,30.62°±0.2°,31.38°±0.2°。
实施例2:含量稳定性试验
对式i化合物晶型a晶体进行了含量稳定性研究;:[高温(60℃)、高湿(90%±5%)、光照(4500lx)]、加速试验(温度40℃±2℃、相对湿度75%±5%)和长期试验(温度25℃±2℃、相对湿度60%±10%)对样品进行高效液相色谱法检测含量,试验结果如下所示:
实施例3:晶型稳定性试验
对式i化合物晶型a晶体进行了稳定性研究;:[高温(60℃)、高湿(90%±5%)、光照(4500lx)]、加速试验(温度40℃±2℃、相对湿度75%±5%)和长期试验(温度25℃±2℃、相对湿度60%±10%)及经研磨、压片后对样品进行x射线粉末衍射测试,试验结果如下所示:
试验结果表明:本品经研磨、压片后的xrpd主要2θ角未发生显著变化,说明本品在制剂过程中晶型稳定性较好。另本品在加速试验6个月和长期留样12个月后,晶型也没有发生显著变化,说明本品晶型在存储过程中晶型稳定,符合药用需求。
实施例4:溶解性试验
取300mg样品,加入到1ml水中,在25±5℃温度下超声振荡,观察溶解情况。如无目视可见的溶质颗粒,即视为完全溶解;若有目视可见的溶质颗粒,则视为析出。记录溶解情况,结果为:300mg/ml制样完全溶解,2小时无析出。结果表明晶型a的溶解性良好。
- 还没有人留言评论。精彩留言会获得点赞!