一种富马酸卢帕替芬的杂质C及其制备方法和检测方法与流程
本发明属于药物化学
技术领域:
,具体涉及一种新发现的富马酸卢帕替芬的杂质及其制备方法和检测方法。
背景技术:
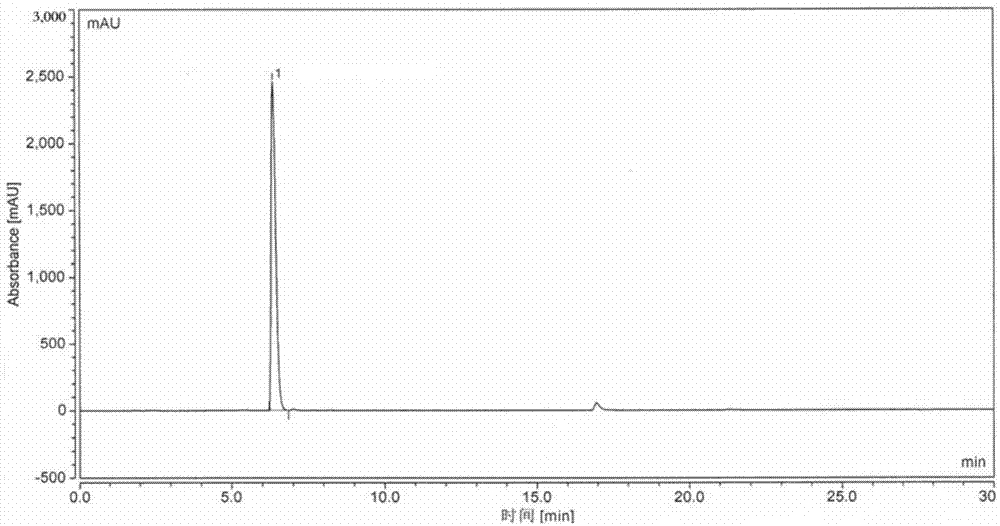
:富马酸卢帕替芬,结构式如1所示,与富马酸酮替芬(结构式如10所示)比较,其优势在于:(1)去除了酮替芬氮原子上导致镇静作用的甲基,保留了其母核的抗组织胺和稳定肥大细胞作用;(2)引入3-吡啶甲基功能团,有助于抗血小板激活因子和抑制嗜酸细胞。因此,富马酸卢帕替芬具有多重抗过敏作用:抗组胺作用、肥大细胞稳定作用、抗血小板活化因子作用、抗嗜酸性粒细胞作用,同时其中枢镇静的副作用更小。富马酸卢帕替芬以酮替芬为起始原料,合成工艺路线方案为按照上述工艺路线合成了富马酸卢帕替芬,但是对其进行质量检测和有关成分检测时,发现了随反应带入的新的未见报道的杂质。因此,有必要对所述杂质进行研究,明确其结构,建立检测方法,从而保证富马酸卢帕替芬的质量和用药安全。技术实现要素:针对现有技术中存在的上述问题,本发明提供一种新的化合物。该化合物是富马酸卢帕替芬的中间体——卢帕替芬的叔胺位置与富马酸发生形成内盐的副反应,从而形成的内盐化合物,在本发明中也被称为“富马酸卢帕替芬杂质c”。该化合物由于与富马酸卢帕替芬结构相近,可能被带入到最终的产物及后续的制剂中。发明人制备了该化合物并建立了其检测方法,为富马酸卢帕替芬原料药及其制剂的有效质量控制夯实了基础。为了实现上述发明目的,本发明采用了如下的技术方案:一种式ⅰ所示化合物,式ⅰ所示化合物可出现于富马酸卢帕替芬的制备过程中,可能作为杂质存在于富马酸卢帕替芬中。在本发明中,术语“式ⅰ所示化合物”与“富马酸卢帕替芬杂质c”、“式ⅰ所示新杂质”以及其类似术语可互换使用。本发明的另一个目的在于提供所述式ⅰ所示化合物的制备方法,该制备方法包括式ⅱ所示化合物在碱存在的条件下,与式ⅲ所示化合物在有机溶剂中反应生成式ⅰ所示化合物;其中,lg代表离去基团。优选地,所述lg选自-f、-cl、-br、-i和-o-so2r中的一种或多种,其中r选自-cf3、-ch3、和甲苯基中的一种或多种。优选地,所述式iii所示化合物为溴代丁二酸。优选地,所述式ⅱ所示化合物与所述式ⅲ所示化合物的摩尔比为1:1.0~6.0;优选为1:1.5~3.0。优选地,所述式ⅲ所示化合物与所述碱摩尔比为1:2~10;优选为1:4~7。优选地,所述式ⅱ所示化合物与所述有机溶剂的质量体积比(g:ml)为1:10~50;优选为1:30。优选地,所述碱为有机碱和/或无机碱。优选地,所述有机碱选自三乙胺、吡啶、甲醇钠、乙醇钠、叔丁醇钠和叔丁醇钾中的一种或多种。优选地,所述无机碱选自氢氧化钠、氢氧化钾、碳酸钠、碳酸氢钠、碳酸钾和碳酸铯中的一种或多种。更优选地,所述碱为三乙胺。优选地,所述有机溶剂选自卤代烃类溶剂、醇类溶剂、芳烃类溶剂和酯类溶剂中的一种或多种。优选地,所述卤代烃类溶剂选自氯仿、二氯甲烷和四氯化碳中的一种或多种。优选地,所述醇类溶剂为乙醇和/或甲醇。优选地,所述芳烃类溶剂为甲苯和/或二甲苯。优选地,所述酯类溶剂为乙酸乙酯和/或乙酸丁酯。更优选地,所述有机溶剂为二氯甲烷。优选的,反应温度为30-40℃。优选地,所述制备方法包括以下步骤:(1)将式ⅱ所示化合物投入所述有机溶剂中,室温下搅拌溶清,再加入所述碱和式ⅱ所示化合物,搅拌溶清,加热,hplc或tlc监控至反应结束;(2)室温下,向步骤(1)得到的反应液加入醇类水溶液,洗涤反应液,静置分液,取下层有机相,重复洗涤,每次醇类水溶液的用量约是所述反应液体积的1/3;合并有机相,浓缩至干,得到浓缩物;(3)将步骤(2)得到的浓缩物,用少量二氯甲烷溶解,硅胶柱层析纯化,hplc或tlc监控,合并纯度在99.0%及以上的流份,浓缩至干,干燥,即得。优选地,步骤(2)中,所述醇类溶剂选自乙醇、甲醇、丙醇、异丙醇、丁醇、戊醇中的一种或多种。更优选地,所述醇类溶剂为50%(v/v)乙醇水溶液。优先地,步骤(2)中,洗涤次数为2-3次。优选地,步骤(2)中,浓缩温度为30-50℃。优选地,步骤(3)中,所述浓缩液与硅胶的质量比1.0-3.0:100;更优选为1.5:100。优选地,步骤(3)中,硅胶柱层析的洗脱剂由有机溶剂a和有机溶剂b组成,梯度洗脱,a:b=1:2→20:2(v/v);其中,所述有机溶剂a选自三氯甲烷、二氯甲烷、石油醚和乙醚中的一种,所述有机溶剂b选自甲醇、乙醇、乙酸乙酯和丙酮中的一种。更优选的,所述有机溶剂a为二氯甲烷,所述有机溶剂b为甲醇。优选地,步骤(3)中,干燥温度为50-60℃。作为一个优选的实施方案,本发明所述式ⅰ所示化合物的制备方法包括如下步骤:(1)将式ⅱ所示化合物投入二氯甲烷,室温下搅拌溶清,再加入三乙胺、式iii所示化合物,搅拌溶清,加热反应,hplc监控反应至结束;其中,式ⅱ所示化合物与二氯甲烷的质量体积比(g:ml)为1:30,式ⅱ所示化合物与式ⅲ所示化合物的摩尔比为1:1.5~3.0,式ⅲ所示化合物与三乙胺的质量体积比为1:4~7;(2)向步骤(1)得到的反应液加入50%乙醇水溶液,洗涤反应液,静置分液,取下层有机相;重复洗涤2-3次,合并有机相,30-50℃浓缩至干,得到浓缩物;(3)将步骤(2)得到的浓缩物,用少量二氯甲烷溶解,硅胶柱层析纯化,所述浓缩物与硅胶的质量比为1.5:100;用体积比1:2→20:2的二氯甲烷-甲醇梯度洗脱,hplc监控流份纯度,合并纯度在99.0%及以上的流份,浓缩至干,50-60℃干燥,即得式ⅰ所示化合物。上述式ⅱ化合物,可采用富马酸卢帕替芬制备方法(例如,如下文所描述的制备方法)获得的中间体卢帕替芬;所述式ⅲ化合物可采用市售获得。本发明还有一个目的在于提供ⅰ所示化合物以及按照上述制备方法制备得到的式ⅰ所示化合物的检测方法,所述检测方法采用高效液相色谱法,色谱条件为:固定相:十八烷基硅烷键合硅胶;流动相:流动相a为体积比450~550:10的乙腈-水,流动相b为体积比450~550:10的0.01mol/l的乙酸铵水溶液-乙腈,进行梯度洗脱,梯度洗脱程序见下表:时间(min)流动相a(v/v%)流动相b(v/v%)02080157327257327262080302080流速:0.5-1.5ml/min;优选为1.0ml/min;色谱柱柱温:15~40℃;优选为30℃;检测波长:200~400nm;优选为300nm。优选地,所述流动相a,乙腈与水的体积比为500:10。优选地,所述流动相b,乙酸铵与乙腈的体积比为500:10。优选地,所述检测方法,还包括供试品溶液的制备:精密称取供试品,加入50(v/v)%的乙腈水溶液溶解并稀释至刻度,摇匀,配制成0.01~1mg/ml的溶液,即得。优选地,所述检测方法还包括对照品溶液的制备:精密称取式i所示化合物,加入50(v/v)%的乙腈水溶液溶解并稀释至刻度,摇匀,配制成0.01mg/ml的溶液,即得。作为一个优选的实施方案,所述式i所示化合物的检测方法,具体包括以下步骤:(i)色谱条件的建立:色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;柱温:30℃;流动相:流动相a为体积比500:10的乙腈-水,流动相b为体积比500:10的0.01mol/l的乙酸铵水溶液-乙腈,进行梯度洗脱,梯度洗脱程序见下表:时间(min)流动相a(v/v%)流动相b(v/v%)02080157327257327262080302080流速:1.0ml/min;检测波长:300nm;(ii)供试品溶液制备:精密称取供试品加入50(v/v)%的乙腈水溶液溶解并稀释至刻度,摇匀,配制成0.01~1mg/ml的溶液,即得;(iii)对照品溶液制备:精密称取式i所示化合物,加入50(v/v)%的乙腈水溶液溶解并稀释至刻度,摇匀,配制成0.01mg/ml的溶液,即得;(iv)测定:分别吸取所述供试品溶液和所述对照品溶液20μl,注入高效液相色谱仪,记录色谱图,测量供试品溶液色谱图上各吸收峰的峰面积,计算式i所示化合物的含量。此外,本发明还有一个目的在于提供上述检测方法在富马酸卢帕替芬有关物质检测中的应用;其中,所述供试品为通过如下方法制备得到的富马酸卢帕替芬:(a)室温下,将酮替芬与二氯乙烷混合搅拌至清,冷却后滴加1-氯甲酸氯乙酯,加热回流反应后,tlc监测,反应结束,浓缩至干;再加入甲醇进行醇解,加热至反应结束后,浓缩得到浓缩液;(b)将步骤(a)得到的浓缩液经正相硅胶柱纯化分离,甲醇-二氯甲烷梯度洗脱,甲醇的体积百分比浓度由1%递增至5%,收集主成分,浓缩至干,得到式iv所示化合物,(c)室温下,将步骤(b)得到的式iv所示化合物和三氯甲烷混合搅拌,后加入三乙胺、dmap继续搅拌,体系温度不再升高后,15℃下投料式v所示化合物,后搅拌反应,液相色谱监控反应进程,反应结束后,反应液备用;(d)室温下,将步骤(c)得到的所述反应液分别经5%的nahco3水溶液和水洗涤,于50-70℃下干燥、过滤、浓缩,得到浓缩液;(e)将步骤(d)得到的所述浓缩液经硅胶柱纯化分离,甲醇-二氯甲烷梯度洗脱,甲醇的体积百分比浓度由1%递增至5%,收集主成分,浓缩至干,即得到式ii所示化合物(即卢帕替芬),(f)在乙醇二氯甲烷溶液中加入富马酸,35℃下搅拌溶解至清,加入步骤(e)得到的所示式ii所示化合物,过滤,搅拌冷却,后于0~6℃下搅拌15h,抽滤至干,70℃烘干,得到式1所示的富马酸卢帕替芬,作为一个优选的实施方案,所述富马酸卢帕替芬通过包括以下步骤的制备方法制备得到:(a)室温下,将酮替芬(sm19.85g,64.03mmol),与二氯乙烷(100ml)混合搅拌至清,冷却后滴加1-氯甲酸氯乙酯(10.4ml,96.05mmol),加热回流反应后,tlc监测,反应结束,浓缩至干;再加入甲醇醇解,加热反应结束后,进行浓缩至干;(b)将步骤(a)得到的浓缩液溶解经正相硅胶柱纯化分离,甲醇-二氯甲烷梯度洗脱,甲醇的体积百分比浓度由1%递增至5%,收集主成分,浓缩至干,呈泡沫状固体即式iv所示化合物,m=14.74g,收率:78.0%;(c)室温下,将步骤(b)制备得到的式3所示化合物(14.74g,49.9mmol)和三氯甲烷(320ml)混合,60~80转/min下搅拌,后加入三乙胺(34.8ml,249.6mmol),dmap(0.61g,4.99mmol),继续搅拌30min,观察反应体系温度不再升高,再缓慢投料式v所示化合物(5-甲基-3-(溴甲基)吡啶溴酸盐)(39.8g,149.7mmol),反应温度超过25℃则停止加料,待温度低于25℃则继续加料,加料结束后,打开加热装置,升温至35℃,继续反应2-4h,高效液相监控反应情况至反应结束,反应液备用;(d)室温下,将步骤(c)得到的反应液分别经5%的nahco3溶液(320ml)和水(320ml)洗涤,于50~70℃下干燥5~7h、过滤、浓缩,得到浓缩液;其中,所述步骤(c)得到的反应液、nahco3溶液和水的体积比为1:1:1;(e)将步骤(d)得到的浓缩液经正相硅胶柱纯化分离,甲醇-二氯甲烷溶液梯度洗脱,甲醇的体积百分比浓度由1%递增至5%,收集主成分,浓缩至干,呈泡沫状固体即式ii所示化合物(即卢帕替芬),m=10.0g,收率:50.0%;(f)在250ml50%的乙醇二氯甲烷溶液中加入2.90g富马酸,35℃下搅拌溶解至清,加入步骤(e)得到的10.0g式2所示化合物,溶清过滤,浓缩至总体积的50~60%,搅拌冷却至28℃保温0.5h,搅拌冷却至15℃保温0.5h,0~6℃下搅拌15h,抽滤至干,70℃烘干5h,获得浅黄色固体富马酸卢帕替芬(式1所示化合物),称重m=8.39g,收率:65.1%。与现有技术相比,本发明具有以下有益效果:本发明提供的式ⅰ所示化合物是一种尚未见报道的富马酸卢帕替芬的新杂质,可以将该新杂质应用于检测富马酸卢帕替芬原料药或其制剂样品的相关物质含量,从而有利于质量控制,完善富马酸卢帕替芬或其制剂的质量标准,为临床用药提供保障。此外,所述式ⅰ所示化合物的制备方法具有反应稳定、条件温和、操作简单、产品纯度高等优点。附图说明下面结合附图对本发明做进一步说明。图1示出了实施例1制备得到的式i所示化合物的hplc图谱,其中1号峰为所述化合物的吸收峰,保留时间6.350min。图2示出了实施例2制备得到的式i所示化合物的hplc图谱,其中1号峰为所述化合物的吸收峰,保留时间6.350min。图3示出了实施例3制备得到的式i所示化合物的hplc图谱,其中1号峰为所述化合物的吸收峰,保留时间6.340min。图4示出了实施例5得到的hplc图谱,其中1号峰为式i所示化合物的吸收峰,保留时间6.470min,2号峰为富马酸卢帕替芬的吸收峰,保留时间16.953min。具体实施方式以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的原料、试剂材料等,如无特殊说明,均为市售购买产品。其中,部分仪器设备的情况如下:仪器:高效液相色谱仪(安捷伦1260高效液相色谱仪),恒温磁力搅拌器(长城科工贸hwcl-5),旋转蒸发仪(ika),鼓风干燥箱(上海三发科学仪器dhg-9070型),球形冷凝器,分液漏斗(1000ml),茄型瓶(500ml)若干。下述实施例中的所述式ⅱ化合物,可采用富马酸卢帕替芬制备方法获得其中间体卢帕替芬;所述式ⅲ化合物(其中,-lg:代表离去基团为-br),可采用市售获得。实施例1:式ⅰ所示化合物的制备(i)将式ⅱ所示化合物(10.0g,25.0mmol)和二氯甲烷(300ml)投入反应容器,室温下搅拌溶清,再加入三乙胺(20.0ml,150.0mmol)和溴代丁二酸(10.0g,50.0mmol),搅拌溶清,加热反应,hplc监控反应至结束;(ii)向步骤(i)得到的反应液加入50%乙醇水溶液100ml,洗涤反应液,静置分液,取下层有机相;重复洗涤2次,合并有机相;30-50℃浓缩至干,得到浓缩物。(iii)将步骤(ii)得到的浓缩物,用少量二氯甲烷溶解,硅胶柱纯化,上样量浓缩物:硅胶=1.5:100(w/w);用体积比1:2→20:2的二氯甲烷-甲醇梯度洗脱,洗脱的分离液分段收集,hplc监控纯度;合并纯度在99.0%及以上的收集液,浓缩至干,50-60℃干燥,得到淡黄色晶体,即式ⅰ所示化合物,m=3.84g,收率:29.8%。1h-nmr(500mhz,cd3od)δ:2.23-2.81(m,4h),2.36-2.68(m,4h),2.50(s,3h),3.22-3.48(m,2h),3.66(s,2h),3.70(s,2h),5.50(s,1h),7.13(d,1h),7.17(m,1h),7.18(m,1h),7.20(m,1h),7.30(t,1h),7.74(d,1h),8.30(s,1h),8.76(s,1h),,8.78(s,1h).13c-nmr(75.43mhz,cd3od)δ:191.22,175.27,171.64,150.03,147.14,144.69,143.45,143.43,142.41,140.00,139.71,139.47,138.49,133.93,133.75,131.78,130.50,130.32,129.81,128.49,127.87,75.02,59.05,55.53,49.51,41.00,32.22,18.31.esi-ms(m/s):m/z517.17.实施例2:式ⅰ所示化合物的制备(i)将式ⅱ所示化合物(10.0g,25.0mmol)和二氯甲烷(300ml)投入反应容器,室温下搅拌溶清,再加入三乙胺(15.0ml,112.5mmol)、溴代丁二酸(7.5g,37.5mmol),搅拌溶清,加热反应,hplc监控至反应结束;(ii)向步骤(i)得到的反应液加入50%乙醇水溶液100ml,洗涤反应液,静置分液,取下层有机相;重复洗涤1次,合并有机相;30-50℃浓缩至干,得到浓缩物。(iii)将步骤(ii)得到的浓缩物,用少量二氯甲烷溶解,硅胶柱纯化,上样量浓缩物:硅胶=2.0:100(w/w);用体积比1:2→20:2的二氯甲烷-甲醇梯度洗脱,洗脱的分离液分段收集,hplc监控纯度;合并纯度在99.0%及以上的收集液,浓缩至干,50-60℃干燥8-10h,得到淡黄色晶体,即式ⅰ所示化合物,m=2.65g,收率:20.6%。1h-nmr(500mhz,cd3od)δ:2.23-2.81(m,4h),2.36-2.68(m,4h),2.50(s,3h),3.22-3.48(m,2h),3.66(s,2h),3.70(s,2h),5.50(s,1h),7.13(d,1h),7.17(m,1h),7.18(m,1h),7.20(m,1h),7.30(t,1h),7.74(d,1h),8.30(s,1h),8.76(s,1h),,8.78(s,1h).13c-nmr(75.43mhz,cd3od)δ:191.22,175.27,171.64,150.03,147.14,144.69,143.45,143.43,142.41,140.00,139.71,139.47,138.49,133.93,133.75,131.78,130.50,130.32,129.81,128.49,127.87,75.02,59.05,55.53,49.51,41.00,32.22,18.31.esi-ms(m/s):m/z517.17.实施例3:式ⅰ所示化合物的制备(i)将式ⅱ所示化合物(10.0g,25.0mmol)和二氯甲烷(300ml)投入反应容器,室温下搅拌溶清,再加入三乙胺(23.3ml,150.0mmol)、溴代丁二酸(15.0g,75.0mmol),搅拌溶清,加热反应,hplc监控至反应结束;(ii)向步骤(i)得到的反应液加入50%乙醇水溶液150ml,洗涤反应液,静置分液,取下层有机相;重复洗涤3次,合并有机相;30-50℃浓缩至干,得到浓缩物。(iii)将步骤(ii)得到的浓缩物,用少量二氯甲烷溶解,硅胶柱纯化,上样量浓缩物:硅胶=3.0:100(w/w);用体积比1:2→20:2的二氯甲烷-甲醇梯度洗脱,洗脱的分离液分段收集,hplc监控纯度;合并纯度在99.0%及以上的收集液,浓缩至干,50-60℃干燥,得到淡黄色晶体,即式ⅰ所示化合物,m=3.00g,收率:23.3%。1h-nmr(500mhz,cd3od)δ:2.23-2.81(m,4h),2.36-2.68(m,4h),2.50(s,3h),3.22-3.48(m,2h),3.66(s,2h),3.70(s,2h),5.50(s,1h),7.13(d,1h),7.17(m,1h),7.18(m,1h),7.20(m,1h),7.30(t,1h),7.74(d,1h),8.30(s,1h),8.76(s,1h),,8.78(s,1h).13c-nmr(75.43mhz,cd3od)δ:191.22,175.27,171.64,150.03,147.14,144.69,143.45,143.43,142.41,140.00,139.71,139.47,138.49,133.93,133.75,131.78,130.50,130.32,129.81,128.49,127.87,75.02,59.05,55.53,49.51,41.00,32.22,18.31.esi-ms(m/s):m/z517.17.实施例4:富马酸卢帕替芬的制备(a)室温下,将酮替芬(sm19.85g,64.03mmol),与二氯乙烷(100ml)混合搅拌至清,冷却后滴加1-氯甲酸氯乙酯(10.4ml,96.05mmol),加热回流反应后,tlc监测,反应结束,浓缩至干;再加入甲醇醇解,加热反应结束后,进行浓缩至干;(b)将步骤(a)得到的浓缩液溶解经正相硅胶柱纯化分离,梯度洗脱(洗脱剂:甲醇-二氯甲烷溶液1%-5%),收集主成分,浓缩至干,呈泡沫状固体即式3所示化合物,m=14.74g,收率:78.0%;(c)室温下,将步骤(b)制备得到的式3所示化合物(14.74g,49.9mmol)和三氯甲烷(320ml)混合,60~80转/min下搅拌,后加入三乙胺(34.8ml,249.6mmol),dmap(0.61g,4.99mmol),继续搅拌30min,观察反应体系温度不再升高,再缓慢投料式ii所示化合物(5-甲基-3-(溴甲基)吡啶溴酸盐)(39.8g,149.7mmol),设置15℃,反应温度超过25℃则停止加料,待温度低于25℃则继续加料,加料结束后,打开加热装置,升温至35℃,继续反应2-4h,高效液相监控反应情况至反应结束,反应液备用;(d)室温下,将步骤(c)得到的反应液分别经5%的nahco3溶液(320ml)和水(320ml)洗涤,于50-70℃下干燥5-7h、过滤、浓缩,得到浓缩液;其中,所述步骤(c)得到的反应液、nahco3溶液和水的体积比为1:1:1;(e)将步骤(d)得到的浓缩液经正相硅胶柱纯化分离,梯度洗脱(洗脱剂:甲醇-二氯甲烷溶液1%-5%),收集主成分,浓缩至干,呈泡沫状固体即式2所示化合物,m=10.0g,收率:50.0%;(f)在250ml50%的乙醇二氯甲烷溶液中加入2.90g富马酸,35℃下搅拌溶解至清,加入步骤(e)得到的10.0g式2所示化合物,溶清过滤,浓缩至总体积的50-60%,搅拌冷却至28℃保温0.5h,搅拌冷却至15℃保温0.5h,0-6℃下搅拌15h,抽滤至干,70℃烘干5h,获得浅黄色固体富马酸卢帕替芬(式1所示化合物),称重m=8.39g,收率:65.1%。实施例5:采用高效液相色谱法测定实施例4制备的富马酸卢帕替芬中的式i所示化合物含量:色谱条件:色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;柱温:30℃;流动相:流动相a为体积比500:10的乙腈-水,流动相b为体积比500:10的0.01mol/l的乙酸铵水溶液-乙腈,进行梯度洗脱,梯度洗脱程序见下表时间(min)流动相a(v/v%)流动相b(v/v%)02080157327257327262080302080流速:1.0ml/min;检测波长:300nm。供试品溶液制备:精密称取实施例4制备的富马酸卢帕替芬50mg,置50ml容量瓶中,加入50%的乙腈水溶液溶解并稀释至刻度,摇匀,即得。对照品溶液:精密称取实施例1制备的式i所示化合物对照品10mg,置于100ml容量瓶中,加入50%的乙腈水溶液溶解并稀释至刻度,摇匀,将上述溶液稀释10倍即得。测定:分别吸取供试品溶液和对照品溶液20μl,注入高效液相色谱仪,记录色谱图,hplc图谱见图1;测量供试品溶液色谱图上各吸收峰的峰面积,按照公式1计算式i所示化合物的含量:t%=ax*f*/wx*100%(1),其中:t%:式i所示化合物的含量,ax:富马酸卢帕替芬峰面积wx:富马酸卢帕替芬称样量,f:校正因子,通过公式2计算得到:f=wr*x/(ar*s)(2),其中,wr:对照品的称量,x:标示量,ar:对照品峰面积,s:稀释倍数。所述供试品溶液中如有与式i所示化合物保留时间一致的杂质,按外标法计算,不得过0.5%。结论:经上述分析方法检测,所述富马酸卢帕替芬主峰保留时间t=16.953min,式i所示化合物的相对主峰保留时间t=6.345-6.357min(δt=0.37),能够与主峰实现基线分离,能够精确计算供试品中式i所示化合物的含量。经计算含量为0.223%。本发明所述检测方法能够排除相邻杂质峰的干扰,确定富马酸卢帕替芬杂质c——式i所示化合物在色谱图中的位置,并准确计算所述富马酸卢帕替芬杂质c的含量,进而对所述富马酸卢帕替芬及其制剂的质量进行有效控制。实施例6:本发明所述富马酸卢帕替芬杂质c(式i所示化合物)的检测方法的方法学考察:1、精密度实验采用和实施例5相同的操作步骤和条件,精密量取同一对照品溶液,于同一天内连续进样5次,每次20μl,分别测定杂质c的峰面积(mau*s),得出精密度见表1,表明精密度好。表1:精密度实验结果2、稳定性实验采用和实施例5相同的操作步骤和条件,取同一供试品溶液,分别于配制后的0,2,4,8,16,24h进样分析,每次20μl,分别测定新杂质式i所示化合物的峰面积积分值(mau*s),见表2,表明供试品溶液在24小时内稳定。表2:稳定性实验结果3、重复性试验采用和实施例5相同的操作步骤和条件,制备样品,分别测定杂质c(式i所示化合物)的平均含量(mg/g)和rsd,见表3,结果表明,本法重现性良好。表3:重复性实验结果本实施例的结果表明,本发明提供的富马酸卢帕替芬杂质c(式i所示化合物)的检测方法精密度和稳定性好。实施例7:本发明所述富马酸卢帕替芬中的杂质c(式i所示化合物)的检测方法的梯度洗脱条件的选择和优化:方法1色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;流动相:流动相a为体积比为500:10乙腈-水溶液,流动相b为体积比为500:10的0.01mol/l的乙酸铵-乙腈溶液,流动相a和流动相b按照1:1的固定体积比进行洗脱;流动相流速:1.0ml/min;色谱柱柱温:25℃;波长:300nm。方法2色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;流动相:流动相a为体积比为500:10的乙腈-水溶液,流动相b为体积比为500:10的0.01mol/l的乙酸铵-乙腈溶液,进行梯度洗脱,梯度洗脱程序见下表:时间(min)流动相a(v/v%)流动相b(v/v%)0~640606~20703020~25703025~26406026~334060流动相流速:1.0ml/min;色谱柱柱温:35℃;波长:300nm。方法3色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;流动相:流动相a为体积比为500:10的乙腈-水溶液,流动相b为体积比为500:10的0.01mol/l的乙酸铵-乙腈溶液,进行梯度洗脱,梯度洗脱程序见下表:时间(min)流动相a(v/v%)流动相b(v/v%)0~15307015~20802020~25802025~26307026~333070流动相流速:1.0ml/min;色谱柱柱温:30℃;波长:300nm。方法4色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;流动相:流动相a为体积比为500:10的乙腈-水溶液,流动相b为体积比为500:10的0.01mol/l的乙酸铵-乙腈溶液,进行梯度洗脱,梯度洗脱程序见下表:时间(min)流动相a(v/v%)流动相b(v/v%)0~15208015~20653520~25653526~332080流动相流速:1.0ml/min;色谱柱柱温:30℃;波长:300nm。方法5色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;流动相:流动相a为体积比为500:10的乙腈-水溶液,流动相b为体积比为500:10的0.01mol/l的乙酸铵-乙腈溶液,进行梯度洗脱,梯度洗脱程序见下表:流动相流速:1.0ml/min;色谱柱柱温:30℃;波长:300nm。方法6色谱柱:以十八烷基硅烷键合硅胶为填充剂的c18色谱柱;流动相:流动相a为体积比为500:10的乙腈-水溶液,流动相b为体积比为500:10的0.01mol/l的乙酸铵-乙腈溶液,进行梯度洗脱梯度洗脱程序见下表:时间(min)流动相a(v/v%)流动相b(v/v%)02080157327257327262080302080流动相流速:1.0ml/min;色谱柱柱温:30℃;波长:300nm。各方法的检测结果及结论分别见表4和表5。表4上述方法1-6检测结果对比表5上述方法1-6检测结果结论实施例8:采用本发明的检测方法对3批次富马酸卢帕替芬中的杂质c(式i所示化合物)含量进行测定。按照实施例4所述方法制备3批富马酸卢帕替芬,采用和实施例5相同的操作和条件,制备对照品和供试品溶液,按实施例5的测定方法,测得富马酸卢帕替芬中杂质c(式i所示化合物)的含量,结果见表6。表63批富马酸卢帕替芬中的杂质c含量测定结果从表6的数据可以看出,按照本发明实施例4所述方法制备的富马酸卢帕替芬,其中的确存在杂质c(式i所示化合物)。因此,有必要建立对杂质c的检测方法及其含量限量,从而保证富马酸卢帕替芬的质量和后续临床用药的安全。总之,以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1