BRAF基因V600E突变数字PCR检测体系的优化方法及检测产品与流程
本发明涉及检测人类braf基因v600e突变的数字pcr检测产品及其优化方法,属于生物
技术领域:
。
背景技术:
:braf基因属于raf基因家族的一员,是ras通路的下游基因,该基因家族有还有另外两个基因:araf、craf。braf基因位于7q34染色体,长度约为190kb,由18个外显子组成。braf基因在ras-raf-mek-erk信号转导通路中发挥重要作用,其编码蛋白有cr1、cr2、cr3三个保守区域,其中cr1、cr2具有调节催化活性的功能,cr3为激酶区域,为atp激活区和结合位点。braf基因通过有丝蛋白激酶通路中的丝氨酸/苏氨酸蛋白激酶来发挥作用,将细胞表面的受体和ras蛋白通过mek与erk得以与细胞核内的转录因子连接,促使多种因子参与到调节细胞的生长、分化以及凋亡等过程中。raf基因家族中,braf基因发生突变频率最高,人类癌症中约有8%发生了braf突变。braf基因突变的类型超过了45种,主要突变位置位于该基因的蛋白酶激活区域,braf基因15号外显子的第1799核苷酸t-a的突变最为常见,可使其编码的蛋白质发生v600e的突变,该突变站braf突变的90%以上。在癌细胞中,braf基因发生v600e突变,使mek-erk通路持续激活,促使细胞持续增值,抑制细胞凋亡,进而导致肿瘤细胞的持续发展。因为braf基因位于级联信号传导途径的下游,braf基因突变与表皮生长因子受体抑制剂的药效有关。西妥昔昔单抗和帕尼单抗作用于肿瘤细胞的表面的表皮生长因子受体,从而抑制肿瘤细胞的增殖。无braf基因突变的患者可从西妥昔昔单抗和帕尼单抗等靶向单抗药物治疗中获益,而对于braf存在突变的患者则无疗效。因此,在使用此类抗肿瘤药物时,对braf基因v600e突变进行检测成为一种需要。传统的针对对基因特定位点的突变检测常用的方法有一代测序和qpcr,但其灵敏度较低,因此需要具备高突变比例的组织标本进行检测,不适合实时检测监控。血浆游离dna(cfdna)是存在于血浆中的一种小片段dna,平均长度在180bp,由体细胞产生释放进入血液。ctdna是由肿瘤细胞释放进入血液的片段化dna,因此,可通过检测ctdna中的突变信息反应肿瘤细胞的突变信息。对cfdna中的ctdna的检测成为检测肿瘤突变的一种途径。cfdna用于肿瘤突变检测优势在于操作无创,可实现实时检测和动态监测,克服肿瘤组织的异质性。然而,ctdna所占cfdna的含量极低,低于百分之一,传统检测方法无灵敏且准确的检测出血浆游离dna中所包含突变信息。数字pcr(dpcr)的出现革新了传统pcr检测的发展,极大的提高了检测的灵敏度。通过统计大量的单拷贝反应微滴,大大的提高了准确度和精密度。由于dpcr统计的是单个分子总数,理论上能做到每个反应单位为单拷贝模板。因此,数字pcr可以达到绝对定量。技术实现要素:本发明要解决的技术问题是提供一种可以使得数字pcr反应体系检测的准确度有更高的braf基因v600e突变数字pcr检测体系的优化方法,以及通过该优化方法优化后的检测产品。本发明为解决上述技术问题提出的一种技术方案是:一种braf基因v600e突变数字pcr检测体系的优化方法,所述检测体系包括上游引物、下游引物、野生型探针、突变型探针、野生型模板和突变型模板;所述上游引物的核苷酸序列如seqidno.1所示,所述下游引物的核苷酸序列如seqidno.2所示,所述野生型探针的核苷酸序列如seqidno.3所示,所述突变型探针的核苷酸序列如seqidno.4所示;所述野生型模板是酶切后的正常人体gdna,所述突变型模板是酶切后的插入braf基因v600e突变片段的突变质粒;将突变型模板和野生型模板按1:50至1:200的拷贝数比例配制成中突变频率标准品,采用数字pcr以中突变频率标准品为模板进行反应,根据反应数据制作数据统计图,选定野生型的荧光区域和突变型的荧光区域,突变型的荧光区域与野生型的荧光区域中荧光信号拷贝数的比值与中突变频率标准品中突变型模板和野生型模板的拷贝数比例相同;采用数字pcr以野生型模板为模板进行反应,突变型的荧光区域中出现的荧光信号拷贝数即为该检测体系的背景阈值。将突变型模板和野生型模板按1:1至1:10的拷贝数比例配制成高突变频率标准品,采用实时荧光定量pcr以低突变频率标准品为模板进行反应,根据反应终点荧光值和初始荧光值与探针使用浓度的关系,优化野生型探针和突变型探针的使用浓度。所述反应终点荧光值和初始荧光值与探针使用浓度的关系是反应终点荧光值与初始荧光值的比值越大,且反应终点荧光值与初始荧光值的差值越大,则野生型探针和突变型探针的使用浓度越好。将突变型模板和野生型模板按1:1000至1:10000的拷贝数比例配制成低突变频率标准品,采用数字pcr以低突变频率标准品为模板进行反应,若突变型的荧光区域中出现的荧光信号拷贝数大于所述背景阈值的2.5倍,则该检测体系的灵敏度达到低突变频率标准品的拷贝数比例相同的值。所述野生型探针和突变型探针是mgb探针,所述野生型探针和突变型探针的3’端均为nfq基团。所述野生型探针的5’端为vic基团,所述突变型探针的5’端为fam基团。本发明为解决上述技术问题提出的一种技术方案是:采用上述的优化方法优化后的braf基因v600e突变数字pcr检测产品。所述上游引物和下游引物在反应体系中的终浓度为900nm,所述野生型探针和突变型探针在反应体系中的终浓度为200nm。所述野生型探针和突变型探针是mgb探针,所述野生型探针和突变型探针的3’端均为nfq基团;所述野生型探针的5’端为vic基团,所述突变型探针的5’端为fam基团。本发明具有积极的效果:(1)本发明的braf基因v600e突变检测体系,采用的标准品是用酶切后的正常人体gdna和酶切后的插入braf基因v600e突变片段的突变质粒按拷贝数比例配制而成,不同突变频率标准品起到不同的作用。标准品采用gdna和质粒可以最大程度的还原检测样本的特征,给体系的优化提供了很多的基础,在体系优化中起到决定性的作用。(2)本发明的braf基因v600e突变检测体系通过中突变频率标准品的数字pcr检测结果确定野生型的荧光区域和突变型的荧光区域,使得数据统计的结果更加准确。本发明的braf基因v600e突变检测体系通过野生型模板的数字pcr检测结果确定检测体系的背景阈值,检测样本的突变拷贝数时,突变拷贝数等于检测结果减去背景阈值,可以使得结果更加准确。(3)本发明的braf基因v600e突变检测体系通过低突变频率标准品的数字pcr检测结果,可以确定检测体系的灵敏度。(4)本发明的braf基因v600e突变检测体系通过高突变频率标准品的传统实时荧光pcr检测结果进行探针浓度优化,根据反应前荧光强度(f0)与反应后荧光强度(fn)差值和比值较大的反应体系为标准,选择合适的探针浓度,该方法结果准确,成本较低。(5)本发明的braf基因v600e突变检测体系的引物探针为自行设计,探针为mgb探针,探针序列更短,特异性好。引物探针经过多重组合优化选定,扩增效率高,灵敏度高。(6)本发明的优化后的braf基因v600e突变检测体系快速,高效,成本较低,准确度高可根据血浆中微量的v600e突变ctdna快速准确的监测出肿瘤患者braf基因的v600e突变,是将数字pcr平台用于ctdna的检测,能及时监测患者新的基因突变的发生,为临床治疗方案的制定和调整提供依据。附图说明图1为实施例1的试剂盒检测全野生型模板的反应数据结果图;图2为实施例1的试剂盒检测突变野生比为0.01的模板的反应数据结果图;图3为实施例1的试剂盒检测突变野生比为0.0001的模板的反应数据结果图。具体实施方式下面通过实施例对本发明进行具体的描述,有必要在此指出的是以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,该领域的技术人员可以根据上述本
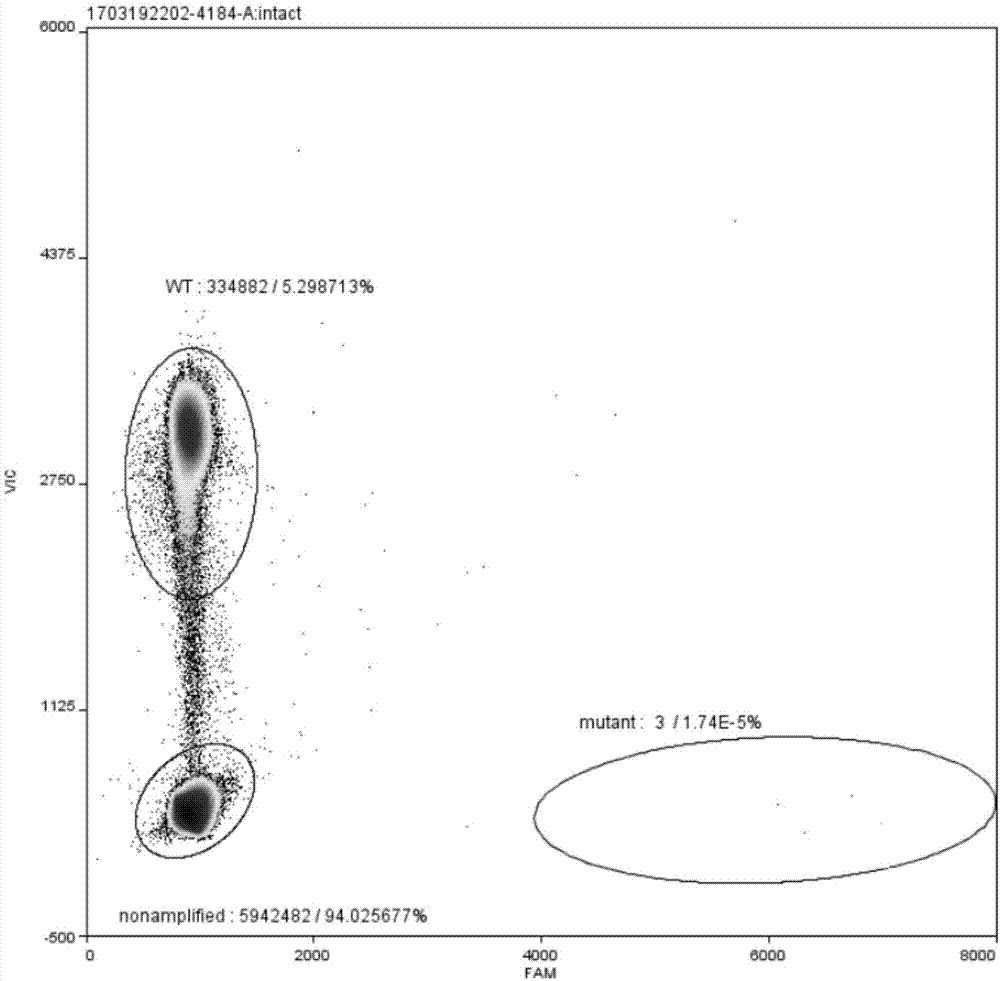
发明内容对本发明作出一些非本质的改进和调整。下述实施例中,若非特意表明,所用的试剂均为分析纯,所用试剂均可从商业渠道获得。文中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著的科学出版社2002年出版的《分子克隆实验指南》一书中所述的条件,或按照制造商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。主要试剂:所有试剂购买自正规厂家,主要试剂包括:taqmangenotypingmastermix(2×)(appliedbiosystems)、25×dropletstabilizer(raindance)、afai内切酶(takara,1116a)、10×tbuffer(takara,1116a)与0.1%bsa(takara,1116a)、质粒小量提取试剂盒(d1100,北京索莱宝科技有限公司)、axyprepmultisourcegenomicdnaminiprepkit(ap-mn-ms-gdna-50g,康宁生命科学有限公司)等。主要仪器:pcr仪(厂家:excellbio)、3.0荧光定量仪、高速离心机、漩涡震荡仪、冰箱、灭菌锅、移液枪、raindropsource(raindancetechnologies)、raindropsense(raindancetechnologies)等。实施例1本实施例的braf基因v600e突变数字pcr检测试剂盒包括上游引物(braf-v600e-f)、下游引物(braf-v600e-r)、野生型探针(braf-v600e-wt)和突变型探针(braf-v600e-mt)、酶切后的正常人体gdna和酶切后的突变质粒。引物和探针为自行设计,经过多重组合优化,引物探针中包括突变质粒中所插入的突变片段的同源区域。引物探针均由上海百力格生物技术有限公司合成,引物和探针的核苷酸序列如表1所示。表1引物探针序列表名称sequence(5’—3’)seqno.braf-v600e-fctactgttttcctttacttactacacctcaga1braf-v600e-ratccagacaactgttcaaactgatg2braf-v600e-wtctagctacagtgaaatc3braf-v600e-mttagctacagagaaatc4野生型探针(braf-v600e-wt)的5’端为vic荧光基团,野生型探针(braf-v600e-wt)的3’端为nfq基团。突变型探针(braf-v600e-mt)的5’端为fam荧光基团,野生型探针(braf-v600e-wt)的3’端为nfq基团。本实施例采用酶切后的正常人体gdna作为野生型模板,酶切后的含有v600e突变插入片段的质粒作为突变模板,突变质粒中所插入片段为人源的braf基因,片段大小为200bp。本实施例将野生型模板和突变型模板按不同的拷贝数比例配制成理论突变频率的模板,制备方法如下:1.样本抽提。采用试剂盒(axyprepmultisourcegenomicdnaminiprepkit)提取一名无braf突变的健康人的血细胞dna,具体的操作参见试剂盒产品说明书。采用试剂盒(质粒小量提取试剂盒)提取人工构建的成功导入具braf突变v600e突变与野生型核酸片段的质粒工程菌,具体的操作参见试剂盒产品说明书。2.gdna和突变质粒的浓度测定。采用3.0对抽提后的dna浓度测定,具体步骤如下:1)向样本管加入1μlqubitdsdnahsreagent和199μlqubitdsdnahsbuffer,漩涡混匀4s;2)向已添加工作液的样品管内吸取1μl工作液,加入1μl的dna样本,漩涡混匀4s,每管的最终体积是200μl;3)所有管在室温避光孵育2分钟;4)在3.0主屏上点击“dna”键,然后选择dsdnahighsensitivity分析模式;5)把样本管放入3.0中,盖上盖子,点击read;6)选择calculateinitial初始浓度,然后选择volumeofsampleused:1μl,此时显示的结果为样本初始浓度,单位ng/μl;7)读取下一个样本:取出qubit3.0荧光光度计中样本;8)用同样的方法测定突变质粒的浓度。3.标准品的制备。1)dna模板酶切片段化。gdna和突变质粒分别进行酶切反应。gdna的酶切反应体系如表2所示。表2gdna酶切反应体系表成分用量试剂名称10×tbuffer5μlafai0.5μl0.1%bsa5μl血细胞gdna39.5μl突变质粒的酶切反应体系如表3所示。表3突变质粒的酶切反应体系表成分用量10xsebuffer5μlbsa5μlecorⅰ0.5μl质粒dna39.5μl酶切后磁珠法回收:a.将50μl的酶切产物转移到1.5ml的ep管中,向ep管中加入90μl的ampurexpreagent磁珠,吹打混匀,静置5min。b.将ep管至于磁力架上,至磁珠分离,弃溶液。c.200μl的浓度为80%的乙醇水溶液清洗2遍,晾干。d.52μl的dh2o洗脱磁珠,至于磁力架,待磁珠分离。e.转移50μl的dna溶液至于一新ep管,加入50μl磁珠,静置5min。f.置于磁力架,待磁珠分离,用200μl的80%浓度为80%的乙醇水溶液洗涤2次,晾干。g.用12μl的dh2o洗脱磁珠,转移9.4μl的溶液置于一新的pcr管中,用于接下来的实验。取1μl进行3.0定量。2)标准品的配制。①酶切后的gdna根据每纳克300拷贝进行计算,逐级稀释到2.0×106copies/μl。②酶切后的突变质粒拷贝数浓度按如下公式:9.12×108×质粒浓度(ng/μl)÷质粒长度;逐级稀释到2.0×106copies/μl、2.0×104copies/μl、2.0×102copies/μl。③配制体系优化用标准品:分别取等量的浓度为2.0×104copies/μl的酶切后的gdna与酶切后的突变质粒混匀,得到突变野生比为1:1的高突变频率标准品模板。取10μl的浓度为2.0×106copies/μl的酶切后的gdna,加入10μl浓度为2.0×104copies/μl的酶切后的突变质粒得到突变野生比为0.01的中突变频率标准品模板。取10μl的浓度为2.0×106copies/μl的酶切后的gdna,加入10μl浓度为2.0×102copies/μl的酶切后的突变质粒得到突变野生比为0.0001的低突变频率标准品模板。本实施例采用实时荧光定量(qpcr)反应进行探针浓度的优化。根据试验条件固定上游引物和下游引物在反应体系中的终浓度为900nm,探针浓度按如下方案进行优化实验:先将野生型探针(braf-v600e-wt)和突变型探针(braf-v600e-mt)的终浓度按表4所示的浓度,分成9个试验组。表4探针浓度分组表根据表5所示的qpcr反应体系组分表,配制qpcr反应体系,模板采用突变野生比为1:1的高突变频率标准品模板。表5qpcr反应体系组分表根据表6所示的qpcr反应程序进行qpcr反应。表6qpcr反应程序表对qpcr反应结果进行数据分析,qpcr反应结果如表7所示。根据fn/fn0值越大且fn-fn0差值越大,检测体系的信噪比越高、准确度越高,挑选2-2组,也即野生型探针和突变型探针反应的终浓度为200nm时,反应体系最适合后续的数字pcr反应。表7qpcr反应结果本实施例的braf基因v600e突变数字pcr检测试剂盒,检测样本一般为血液,也可以为能提取核酸的任意形式的样品,包括但不限于:全血、血清、血浆和组织样品;组织样品包括但不限于:石蜡包埋组织、新鲜组织和冰冻切片。本实施例的braf基因v600e突变数字pcr检测试剂盒,在使用时,根据表8所示的dpcr反应体系组分表,配制dpcr反应体系,模板采用突变野生比为0.01的中突变频率标准品模板。表8dpcr反应体系组分表进行dpcr反应,dpcr反应程序如表9所示。表9dpcr反应程序表设置循环扩增从95℃变性到58℃退火,降温梯度为0.4℃每秒。3)数据读取与分析raindancesense进行数据的读取,对原始数据的分析采用raindropanalystⅱ(v1.0.0)软件进行分析,步骤如下:a.打开raindropanalystⅱ,点击“addsample”将原始fcs数据文件导入软件;b.首先选定突变野生比为0.01样本的原始数据进行分析;c.分别选定阴性点集合、野生点集合和突变点集合,点解“applyspectralcompensation”按钮,将纵坐标设置成fam荧光信号值,将横坐标设置成vic设置成信号值。软件即可自动根据将阴性点集合、野生性点集合和突变性点集合荧光强度调整三种集合的位置区域;d.采用“ellipticalgate”框选并调整聚集点的区域,尽可能使阳性突变点数比阴性点数为0.01;e.选定其他样本数据,将突变野生比为0.01的样本数据分析方法与参数应用于所有样本,得出其他样本分析结果。数据分析时,根据反应数据制作数据统计图,如图2所示,选定野生型的荧光区域(图中左侧的两个圈)和突变型的荧光区域(图中右侧的一个圈),野生型的荧光区域与突变型的荧光区域中荧光信号拷贝数的比值为1:100。使用本实施例的试剂盒时,需要首先用突变野生比为0.01的中突变频率标准品为模板,确定野生型的荧光区域和突变型的荧光区域的位置,该位置适用于后续反应。采用上述一样的反应体系和反应程序,模板采用全野生型模板,得到数据,进行分析,根据反应数据制作数据统计图,如图1所示,野生型的荧光区域和突变型的荧光区域与图2中的位置一致。理论上,突变型的荧光区域应该没有荧光信号,但是实际使用时,试剂盒即使模板采用全野生型模板,也会有一定的背景阈值,此处的背景阈值为3个拷贝数。采用上述一样的反应体系和反应程序,模板采用低突变频率标准品,得到数据,进行分析,根据反应数据制作数据统计图,如图3所示,野生型的荧光区域和突变型的荧光区域与图2中的位置一致。突变型的荧光区域出现了33个拷贝数的荧光信号,大于所述背景阈值3个拷贝数的2.5倍,所以该试剂盒的灵敏度可达到万分之一,特异性较好、信噪比高。采用上述一样的反应体系和反应程序,模板采用患者的血液,得到数据,进行分析,根据反应数据制作数据统计图,野生型的荧光区域和突变型的荧光区域与图2中的位置一致,突变型的荧光区域中的荧光信号拷贝数减去背景阈值3个拷贝数得到最终的突变拷贝数。上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而这些属于本发明的精神所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。序列表<110>上海赛安生物医药科技股份有限公司<120>braf基因v600e突变数字pcr检测体系的优化方法及检测产品<160>4<170>siposequencelisting1.0<210>1<211>32<212>dna<213>人工序列(无)<400>1ctactgttttcctttacttactacacctcaga32<210>2<211>25<212>dna<213>人工序列(无)<400>2atccagacaactgttcaaactgatg25<210>3<211>17<212>dna<213>人工序列(无)<400>3ctagctacagtgaaatc17<210>4<211>16<212>dna<213>人工序列(无)<400>4tagctacagagaaatc16当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1