EGR-1基因在制备治疗脓毒症药物中的用途及相关药物的制作方法
本发明涉及生物技术领域,特别是涉及egr-1基因在制备治疗脓毒症药物中的用途及相关药物。
背景技术:
dna-rna和rna-rna杂交对核酸功能的许多方面起重要作用,包括dna复制、转录和翻译。杂交对于检测具体核酸或改变核酸表达的各种技术也很重要。反义核苷酸,例如,通过杂交至靶rna而破坏基因表达,从而干扰rna剪接、转录、翻译和复制。反义dna还具有dna-rna杂交体作为核糖核酸酶h消化底物的特征,这种活性存在于大多数的细胞类型中。反义分子可以被运送进入细胞(例如寡脱氧核苷酸(odns)),或者他们可由内源基因表达为rna分子。
脓毒症(sepsis)为宿主对感染的反应失调而致的危及生命的器官功能障碍,严重时可进展为脓毒症休克,是重症监护病房最主要的死亡原因。脓毒症发病机制复杂,涉及感染、炎症、免疫、凝血、基因多态性、组织损伤以及宿主对不同感染病原微生物及其毒素的异常反应等多个方面,与机体多系统、多器官病理生理改变密切相关。目前,对脓毒症的治疗除了早期目标导向治疗、抗感染、脏器支持等治疗外还未出现根本性突破,而针对脓毒症的治疗仍然更多集中于纠正脓毒症引起的病理生理后果上。
早期生长反应因子1(earlygrowthresponsegene-1,egr-1)属即刻早期基因家族一员。在调控细胞的生长、分化、发育和增殖等方面发挥重要作用,目前,没有将egr-1基因用于脓毒症的报道。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明提供egr-1基因在制备治疗脓毒症药物中的用途及相关药物。
本发明第一方面公开了一种人egr-1基因表达抑制剂在制备脓毒症治疗药物中的用途。
进一步的,所述脓毒症选自内毒素血症。
进一步的,所述人egr-1基因表达抑制剂是指对于人egr-1基因具有抑制效果的分子。
进一步的,所述抑制剂可以为核酸分子、碳水化合物、脂类、小分子化学药、抗体药、多肽、蛋白或干扰慢病毒。
所述核酸分子包括但不限于:反义寡核苷酸、双链rna(dsrna)、核酶、核糖核酸内切酶iii制备的小干扰rna(esirna)或者短发夹rna(shrna)。
优选的,所述核酸分子为反义寡核苷酸,所述反义寡核苷酸为为单链dna,并含有能够在严紧条件下与egr-1基因杂交的核苷酸序列。
进一步的,所述反义寡核苷酸为用硫原子将磷酸骨架上的非成键氧原子取代后得到的核苷酸衍生物。
所述反义寡核苷酸序列与egr-1基因中的5-20个连续的核苷酸序列基本互补。较佳的,所述反义寡核苷酸序列与与egr-1基因中的10-18个连续的核苷酸序列基本互补;所述反义寡核苷酸序列与与egr-1基因中的13、14或15个连续的核苷酸序列基本互补。
更进一步的,反义寡核苷酸的序列如seqidno:2所示,具体为5’-cttggccgctgccat-3’。
较佳的,所述egr-1基因中的靶序列含有seqidno:1所示序列。
所述脓毒症治疗药物含有有效量的人egr-1基因的表达抑制剂。
所述脓毒症治疗药物为能够特异性抑制egr-1基因的转录或翻译,或能够特异性抑制egr-1蛋白的表达或活性的分子,从而降低外周血单个核细胞中egr-1基因的表达水平,达到减轻脓毒症的炎症反应,减缓肝肺损伤,降脓毒症死亡率的目的。
所述脓毒症治疗药物的施用量为足够降低人egr-1基因的转录或翻译,或者足够降低人egr-1蛋白的表达或活性的剂量。以使人egr-1基因的表达至少被降低50%、80%、90%、95%或99%。
采用前述脓毒症治疗药物治疗脓毒症的方法,主要是通过降低人egr-1基因的表达水平来达到治疗的目的。具体的,治疗时,将能有效降低人egr-1基因表达水平的物质给药于患者。
所述脓毒症治疗药物还包括药学上可接受的载体、稀释剂或赋形剂。
在制备这些组合物时,通常将活性成分与赋形剂混合,或用赋形剂稀释,或包在可以胶囊或药囊形式存在的载体中。当赋形剂起稀释剂作用时,它可以是固体、半固体或液体材料作为赋形剂、载体或活性成分的介质。因此,组合物可以是片剂、丸剂、粉剂、溶液剂、糖浆剂、灭菌注射溶液、冻干粉等。合适的赋形剂的例子包括:乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、等。制剂还可包括:湿润剂、乳化剂、防腐剂(如羟基苯甲酸甲酯和丙酯)、甜味剂等。
优选的,脓毒症治疗药物为冻干粉形式。
该药物组合物的应用为脓毒症的治疗提供了一种方法,具体为一种预防或治疗对象脓毒症的方法,包括将有效剂量的所述的药物组合物施用于对象中。进一步的,所述脓毒症选自内毒素血症。
所述药物组合物用于预防或治疗对象脓毒症时,需要将有效剂量的所述的药物组合物施用于对象中。采用该方法,治疗对象的内毒素血症的炎症反应减轻,肝肺损伤减缓。
所述药物组合物的给药方式可为静脉注射。有效剂量为:10mg/kg-50mg/kg。
在一种实施方式中,有效剂量为10mg/kg-20mg/kg。
在一种实施方式中,有效剂量为20mg/kg-25mg/kg。
在一种实施方式中,有效剂量为25mg/kg-30mg/kg。
在一种实施方式中,有效剂量为30mg/kg-40mg/kg。
在一种实施方式中,有效剂量为40mg/kg-50mg/kg。
优选的,有效剂量为25mg/kg。
所述方法的对象可以为动物,较佳的,可以为哺乳动物,具体的,可以是灵长类动物,如人、猴等。
本发明的第二方面,提供一种抑制egr-1基因表达的核酸分子,所述核酸分子包含:反义寡核苷酸,所述反义寡核苷酸为单链dna,并含有能够在严紧条件下与egr-1基因杂交的核苷酸序列。
进一步的,所述反义寡核苷酸为用硫原子将磷酸骨架上的非成键氧原子取代后得到的核苷酸衍生物。
所述反义寡核苷酸序列与egr-1基因中的5-20个连续的核苷酸序列基本互补。较佳的,所述反义寡核苷酸序列与与egr-1基因中的10-18个连续的核苷酸序列基本互补;所述反义寡核苷酸序列与与egr-1基因中的13、14或15个连续的核苷酸序列基本互补。
更进一步的,反义寡核苷酸的序列如seqidno:2所示,具体为5’-cttggccgctgccat-3’。
较佳的,所述egr-1基因中的靶序列含有seqidno:1所示序列。
进一步的,所述egr-1基因来源于人。
本发明第三方面公开了所述的核酸分子可用于制备预防或治疗脓毒症的药物中的应用。
本发明的egr-1基因反义寡核苷酸可用于抑制egr-1基因的表达,进一步地可以用作治疗脓毒症的药物或制剂。当用作治疗脓毒症的药物或制剂时,是将安全有效量的所述核酸分子施用于哺乳动物。具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明第四方面,公开了一种用于预防或治疗脓毒症的药物组合物,其有效物质含有前述的核酸分子。
进一步的,所述药物组合物含有1~99wt%所述反义寡核苷酸以及药学上可接受的载体、稀释剂或赋形剂。
在制备这些组合物时,通常将活性成分与赋形剂混合,或用赋形剂稀释,或包在可以胶囊或药囊形式存在的载体中。当赋形剂起稀释剂作用时,它可以是固体、半固体或液体材料作为赋形剂、载体或活性成分的介质。因此,组合物可以是片剂、丸剂、粉剂、溶液剂、糖浆剂、灭菌注射溶液、冻干粉等。合适的赋形剂的例子包括:乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、等。制剂还可包括:湿润剂、乳化剂、防腐剂(如羟基苯甲酸甲酯和丙酯)、甜味剂等。
该药物组合物的应用为脓毒症的治疗提供了一种方法,具体为一种预防或治疗对象脓毒症的方法,包括将有效剂量的所述的药物组合物施用于对象中。进一步的,所述脓毒症选自内毒素血症。
所述药物组合物用于预防或治疗对象脓毒症时,需要将有效剂量的所述的药物组合物施用于对象中。采用该方法,治疗对象的内毒素血症的炎症反应减轻,肝肺损伤减缓。
所述药物组合物的给药方式可为静脉注射。所述药物组合物的给药方式可为静脉注射。有效剂量为:10mg/kg-50mg/kg。
在一种实施方式中,有效剂量为10mg/kg-20mg/kg。
在一种实施方式中,有效剂量为20mg/kg-25mg/kg。
在一种实施方式中,有效剂量为25mg/kg-30mg/kg。
在一种实施方式中,有效剂量为30mg/kg-40mg/kg。
在一种实施方式中,有效剂量为40mg/kg-50mg/kg。
优选的,有效剂量为25mg/kg。
所述方法的对象可以为动物,较佳的,可以为哺乳动物,具体的,可以是灵长类动物,如人、猴等。
如上所述,本发明的egr-1基因在制备治疗脓毒症药物中的用途及相关药物,具有以下有益效果:本发明中的药物组合物可减轻内毒素血症的炎症反应,降低内毒素血症的死亡率,以及保护肝肺等脏器功能,来治疗脓毒症。
附图说明
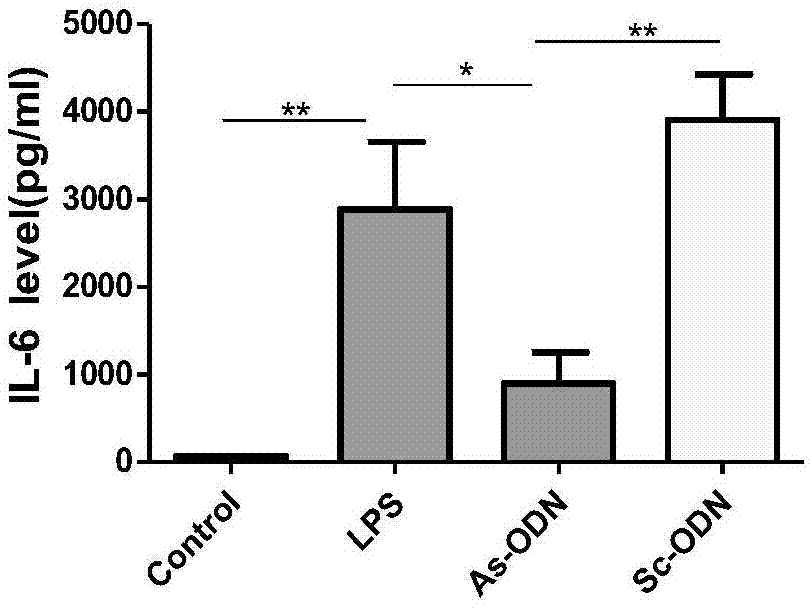
图1为小鼠血清炎症因子il-6表达水平(*p<0.05、**p<0.01、***p<0.001);
图2为小鼠血清炎症因子il-1β表达水平(*p<0.05、**p<0.01、***p<0.001);
图3为小鼠血清炎症因子tnf-α表达水平(*p<0.05、**p<0.01、***p<0.001);
图4为各组小鼠肺组织he染色情况(a.lpsb.controlc.lps+egr-1as-odnd.lps+egr-1sc-odn);
图5为各组小鼠肝组织he染色情况(a.controlb.lpsc.lps+egr-1as-odnd.lps+egr-1sc-odn);
图6为各组小鼠死亡率统计。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。
实施例1egr-1反义寡核苷酸(as-odn)用于治疗脓毒症的动物学实验
1.实验材料
spf级c57bl/6雄性7-8w小鼠(体重:20±3g)、egr-1as-odn及egr-1错配核苷酸(sc-odn)由takara宝生物公司合成,寡核苷酸的序列分别为:
5’-cttggccgctgccat-3’(seqidno.2),
5’-taccgtcgccgtgct-3’(seqidno.3)、
lps(sigma,l-2880,o55:b5)。
2.脂多糖lps诱导的内毒素血症小鼠模型的建立
spf级c57bl/6雄性7-8w小鼠(体重:20±3g),腹腔注射lps15mg/kg,6小时。
3.实验分组
36只c57bl/6小鼠随机分为四组:
①正常对照组(空白组)
②内毒素组(lps组)
③egr-1反义寡核苷酸+lps组(egr-1as-odn+lps)
④egr-1错配寡核苷酸+lps组(egr-1sc-odn+lps)
4.实验步骤:
小鼠称重,egr-1as-odn+lps组、egr-1sc-odn+lps组分别腹腔注射egr-1as-odn、egr-1sc-odn25mg/kg,1小时后lps组、egr-1as-odn+lps组、egr-1as-odn+lps组分别腹腔注射lps15mg/kg,6小时后眼球采血于肝素抗凝管,收集小鼠肝肺组织进行下一步实验。同时准备36只小鼠,按上述分组,观察各组小鼠药物干预后3天生存率及生存时间。
5.检测血清中tnf-α、il-6、il-1β表达水平
小鼠抗凝血予3000rpm,10min,rt离心后收取上清,elisa检测上清中炎症因子il-6、il-1β、tnf-α的表达水平。操作步骤:取标准品50ul或血清样品10ul+样品稀释液40ul至96孔微量反应板,封孔膜覆盖后37℃孵育90min后,弃去孔内液体,加入100ul生物素化的一抗稀释液,37℃摇床孵育60min后弃去液体,洗涤液洗涤3次,1min/次,加入100ulhrp-链霉亲和素溶液,37℃摇床孵育30min后弃去液体并洗涤5min共5次,加入90ultmb一步化底物试剂,37℃摇床避光孵育25min后加入90ul终止液,立即酶标仪检测a450吸光度并绘制标准曲线,计算血清样本炎症因子含量。
6.组织病理学检查
取小鼠肝肺组织进行he染色,操作步骤:4%多聚甲醛固定标本,石蜡包埋切片,he染色后光学显微镜观察组织病理改变情况。
实验结果:
1.egr-1as-odn预处理减轻内毒素血症小鼠炎症反应
如图1-3,elisa结果显示,lps组、egr-1sc-odn+lps组的血清il-6、il-1β、tnf-α水平与对照组相比均明升高,而egr-1as-odn预处理则明显降低炎症因子释放,il-6、il-1β、tnf-α水平均下降。
2.egr-1as-odn预处理对内毒素血症小鼠肝肺脏器起保护作用
如图4,肺组织he染色显示,正常小鼠肺组织中肺泡结构完整、肺泡腔内无异物、肺泡隔薄、无炎症细胞浸润。造模后小鼠肺组织结构紊乱、大量肺泡腔塌陷、肺泡隔增厚、炎性浸润增多。egr-1as-odn预处理组肺组织肺泡结构破坏减少,只见少量炎症细胞浸润。
如图5,肝组织he染色显示,空白对照组小鼠肝小叶结构清晰完整,无炎症细胞浸润。lps造模小鼠切片显示肝小叶失去正常结构,肝细胞浑浊肿胀,空泡变性,结构破坏,间隔显示炎细胞浸润。egr-1as-odn预处理组肝细胞损伤明显减轻,炎症细胞浸润减少,肝小叶结构基本正常。
3.egr-1as-odn预处理降低内毒素血症小鼠死亡率
如图6,小鼠死亡统计结果显示,lps组小鼠20小时死亡率高达100%,与lps组相比,egr-1as-odn预处理组小鼠20小时死亡率为44.4%,,明显改善内毒素小鼠存活情况。
实施例2
本发明还参照了实施例1采用其他剂量的药物对小鼠注射进行试验,并检测了小鼠血清中tnf-α、il-6、il-1β表达水平与死亡率等。具体如下:
剂量1、与实施例1的不同之处在于:步骤4中,egr-1as-odn+lps组、egr-1sc-odn+lps组分别腹腔注射egr-1as-odn、egr-1sc-odn10mg/kg,其他均相同。
(1)采用与实施例1中相同的方法检测小鼠血清中tnf-α、il-6、il-1β表达水平,表明il-6、il-1β、tnf-α水平均下降,但下降率小于实施例1。
(2)采用与实施例1中相同的方法检测小鼠死亡率,小鼠死亡统计结果显示,lps组小鼠20小时死亡率高达100%,与lps组相比,egr-1as-odn预处理组小鼠20小时死亡率为77.8%,明显改善内毒素小鼠存活情况。
剂量2、与实施例1的不同之处在于:步骤4中,egr-1as-odn+lps组、egr-1sc-odn+lps组分别腹腔注射egr-1as-odn、egr-1sc-odn20mg/kg,其他均相同。
(1)采用与实施例1中相同的方法检测小鼠血清中tnf-α、il-6、il-1β表达水平,表明il-6、il-1β、tnf-α水平均下降,但下降率小于实施例1,但大于剂量1。
(2)采用与实施例1中相同的方法检测小鼠死亡率,小鼠死亡统计结果显示,lps组小鼠20小时死亡率高达100%,与lps组相比,egr-1as-odn预处理组小鼠20小时死亡率为77.8%,明显改善内毒素小鼠存活情况。
剂量3、与实施例1的不同之处在于:步骤4中,egr-1as-odn+lps组、egr-1sc-odn+lps组分别腹腔注射egr-1as-odn、egr-1sc-odn30mg/kg,其他均相同。
(1)采用与实施例1中相同的方法检测小鼠血清中tnf-α、il-6、il-1β表达水平,表明il-6、il-1β、tnf-α水平均下降,但下降率小于实施例1,但大于剂量1且大于剂量2。
(2)采用与实施例1中相同的方法检测小鼠死亡率,小鼠死亡统计结果显示,lps组小鼠20小时死亡率高达100%,与lps组相比,egr-1as-odn预处理组小鼠20小时死亡率为66.7%,明显改善内毒素小鼠存活情况。
剂量4、与实施例1的不同之处在于:步骤4中,egr-1as-odn+lps组、egr-1sc-odn+lps组分别腹腔注射egr-1as-odn、egr-1sc-odn40mg/kg,其他均相同。
(1)采用与实施例1中相同的方法检测小鼠血清中tnf-α、il-6、il-1β表达水平,表明il-6、il-1β、tnf-α水平均下降,但下降率小于实施例1、剂量2和剂量3,但大于剂量1。
(2)采用与实施例1中相同的方法检测小鼠死亡率,小鼠死亡统计结果显示,lps组小鼠20小时死亡率高达100%,与lps组相比,egr-1as-odn预处理组小鼠20小时死亡率为66.7%,明显改善内毒素小鼠存活情况。
剂量5、与实施例1的不同之处在于:步骤4中,egr-1as-odn+lps组、egr-1sc-odn+lps组分别腹腔注射egr-1as-odn、egr-1sc-odn50mg/kg,其他均相同。
(1)采用与实施例1中相同的方法检测小鼠血清中tnf-α、il-6、il-1β表达水平,表明il-6、il-1β、tnf-α水平均下降,但下降率小于实施例1、剂量2、剂量3和剂量4,但大于剂量1。
(2)采用与实施例1中相同的方法检测小鼠死亡率,小鼠死亡统计结果显示,lps组小鼠20小时死亡率高达100%,与lps组相比,egr-1as-odn预处理组小鼠20小时死亡率为77.8%,明显改善内毒素小鼠存活情况。
综上所述,egr-1as-odn可减轻内毒素血症小鼠的炎症反应,减缓肝肺损伤,降低内毒素血症小鼠死亡率,对脓毒症具有一定的治疗作用。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
序列表
<110>广东医科大学附属医院
<120>egr-1基因在制备治疗脓毒症药物中的用途及相关药物
<160>3
<170>siposequencelisting1.0
<210>1
<211>15
<212>dna
<213>人工序列(artificialsequence)
<400>1
gaaccggcgacggta15
<210>2
<211>15
<212>dna
<213>人工序列(artificialsequence)
<400>2
cttggccgctgccat15
<210>3
<211>15
<212>dna
<213>人工序列(artificialsequence)
<400>3
taccgtcgccgtgct15
- 还没有人留言评论。精彩留言会获得点赞!