一种人羊膜间充质干细胞的高效分离、扩增方法与流程
本发明涉及一种干细胞的分离、扩增方法,具体涉及一种人羊膜间充质干细胞的高效分离、扩增方法,属于生物技术领域。
背景技术:
间充质干细胞具有自我复制,多向分化和免疫调节的生物学特性,已经成为研究热点。骨髓来源的间充质干细胞研究虽多,但其采样势必通过创伤性获得,并且随着个体的成长,其质量和数量有所下降。目前,国内外研究人员已经能够从脐带,脐血,牙髓中获得间充质干细胞,但获得的细胞数量有限。寻求一种高效分离间充质的方法,且组织来源方便,不受伦理道德约束,是必然的发展趋势。胎盘组织作为再生医学最有价值的细胞来源,且不受伦理道德约束。羊膜比胎盘具有更丰富的间充质干细胞,已成为各研究者青睐的对象。
羊膜组织结构复杂,包括上皮细胞层、基底膜、致密层、纤维细胞层及海绵层,而羊膜间充质干细胞位于羊膜的最内层。目前羊膜间充质干细胞的分离方法种类繁多,且或得的细胞纯度及活性结果不一。
本研究通过两步酶消化法,首先用胰蛋白酶和edta去除羊膜上皮干细胞,再用胶原酶ⅰ和dnaseⅰ,消化分离获得羊膜间充质干细胞。
目前,分离羊膜间充质干细胞的方法主要是酶解法。羊膜组织结构复杂,单纯的酶解并不能将羊膜间充质干细胞和羊膜上皮细胞的分开,很难获得高纯度的间充质干细胞系;其次也有使用细胞刮刀去除羊膜上皮细胞后,再进行羊膜间充质干细胞的分离,这种方法容易造成污染,并且分离羊膜上皮细胞也不彻底;还有利用组织分离器,获得羊膜组织匀浆,再进行酶消化,操作相对繁琐,并且成本较高。
技术实现要素:
本发明的目的在于,提供一种人羊膜间充质干细胞的高效分离、扩增方法,以克服现有技术所存在的上述缺点和不足。
本发明所需要解决的技术问题,可以通过以下技术方案来实现:
一种人羊膜间充质干细胞的高效分离、扩增方法,其特征在于,包括:
一、试剂
二、两步酶消化法分离羊膜间充质干细胞
三、羊膜间充质干细胞传代培养。
进一步,一种人羊膜间充质干细胞的高效分离、扩增方法,包括:
一、试剂
1.胎盘保存液及清洗液
注射用青霉素和硫酸链霉素用注射用生理盐水配置成每毫升1万单位的储存液,即为1%的双抗储存液;
500ml的注射用生理盐水加入5ml的双抗储存液,再加入2ml注射用硫酸庆大霉素,即配置成胎盘保存液或清洗液;
2.胰蛋白酶储存液
称取0.5g的胰蛋白酶,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为0.5%(m/v)的胰蛋白酶储存液;
3.edta储存液
称取0.2gedta二钠,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为0.2%(m/v)的edta储存液;
4.胶原酶ⅰ储存液
称取1g胶原酶ⅰ,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为1%(m/v)的胶原酶ⅰ储存液;
5.dnaseⅰ储存液
称取0.2gdnaseⅰ,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为0.2%(m/v)的dnaseⅰ储存液;
6.培养基及原代培养基
培养基为lonza通用型无血清培养基,按使用说明添加血清替代品及l-谷氨酰胺。原代培养基每50ml添加1%的双抗储存液500μl,添加200μl的注射用硫酸庆大霉素;
二、两步酶消化法分离羊膜间充质干细胞
1.胎盘运输
孕妇分娩后的胎盘(须经产妇本人同意),置于含有保存液的胎盘储存盒中,2~8摄氏度及时运送回实验室。样本接收室检查运输温度,胎盘盒是否完整,避免出现污染,并对其进行编号;
2.羊膜分离组织分离
将胎盘置于不锈钢托盘中,用清洗液清洗1次;用手将围绕脐带周围胎盘子面的羊膜撕下,放入培养皿中,用手术剪将带有血渍的边缘剪掉,加入75%的医用酒精进行漂洗,再放入新的培养皿中,加入清洗液清洗,并用组织剪剪成1×1cm2大小的组织块,再用清洗液清洗一遍,转移至50ml离心管中,每管含羊膜组织10ml,1300rpm/min离心5min;
3.羊膜上皮细胞分离
离心结束后,弃上清,每管加入胰蛋白酶储存液3ml,edta储存液3ml,补充生理盐水至30ml,此时胰蛋白酶的浓度和edta的浓度分别为0.05%和0.02%。145rpm/min,37℃振荡消化15min;
消化结束后,加入适量生理盐水,1300rpm/min离心5min;弃上清。再重复上述胰蛋白酶和edta消化的步骤;
4.羊膜间充质干细胞分离
上述消化结束后,加入适量生理盐水,1300rpm/min离心5min;弃上清。将羊膜组织放入培养皿中,用清洗液清洗两次;
将羊膜组织放入新的50ml离心管中,每管约含组织10ml,并剪碎羊膜组织1-3mm;加入胶原酶ⅰ2ml,dnaseⅰ2ml,补充生理盐水至20ml,此时胶原酶ⅰ和dnaseⅰ的浓度分别为0.1%和0.02%。145rpm/min,37℃振荡消化60min;
消化结束后,加入适量生理盐水,1300rpm/min离心5min;弃上清及组织。每管加入10ml原代培养基接种于10cm的培养皿中培养;
5.原代换液
培养至第3天,进行第一次半换液,第6天根据实际情况进行半换或全换液,以后每隔3天全换液;
三、羊膜间充质干细胞传代培养
观察原代细胞融合度60%以上即可传p1代,接种密度为8000~10000个/cm2;以后细胞融合度达80%以上即可传代。传代为完全培养基,无需添加双抗或庆大霉素。
本发明的有益效果:
本发明研究的方法,与现有的羊膜间充质干细胞分离方法相比,使用两步酶消化法分离羊膜间充质干细胞,第一步去除羊膜上皮细胞,且消化两次,使羊膜上皮细胞去除的更充分,获得的羊膜间充质干细胞纯度更高,并且操作简单,无需组织及细胞过滤,使用dnaseⅰ避免羊膜间充质干细胞进入消化粘液中而无法分离,获得的干细胞数量更多。整个分离过程无动物源性成分,安全性好,便于后续的研究应用。
附图说明
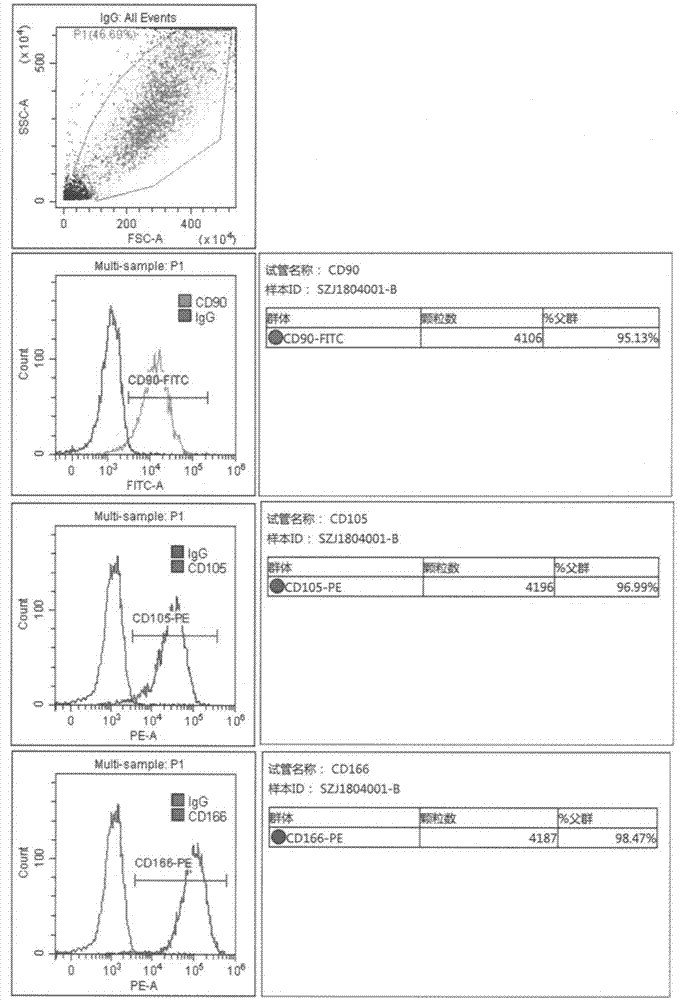
图1为本发明的流式检测图。
图2为本发明原代,p1,p2,p3各代次的培养图片。注:左上原代第15天,右上p1第3天,左下p2第3天,右下p3第3天。
附图标记:
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
实施例1
一种人羊膜间充质干细胞的高效分离、扩增方法,
一、试剂
1.胎盘保存液及清洗液
注射用青霉素和硫酸链霉素用注射用生理盐水配置成每毫升1万单位的储存液,即为1%的双抗储存液。500ml的注射用生理盐水加入5ml的双抗储存液,再加入2ml注射用硫酸庆大霉素,即配置成胎盘保存液或清洗液;
2.胰蛋白酶储存液
称取0.5g的胰蛋白酶,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为0.5%(m/v)的胰蛋白酶储存液;
3.edta储存液
称取0.2gedta二钠,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为0.2%(m/v)的edta储存液;
4.胶原酶ⅰ储存液
称取1g胶原酶ⅰ,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为1%(m/v)的胶原酶ⅰ储存液;
5.dnaseⅰ储存液
称取0.2gdnaseⅰ,溶解于100ml生理盐水中,0.22μm滤膜过滤,即为0.2%(m/v)的dnaseⅰ储存液;
6.培养基及原代培养基
培养基为lonza通用型无血清培养基,按使用说明添加血清替代品及l-谷氨酰胺。原代培养基每50ml添加1%的双抗储存液500μl,添加200μl的注射用硫酸庆大霉素;
二、两步酶消化法分离羊膜间充质干细胞
1.胎盘运输
孕妇分娩后的胎盘(须经产妇本人同意),置于含有保存液的胎盘储存盒中,2~8摄氏度及时运送回实验室。样本接收室检查运输温度,胎盘盒是否完整,避免出现污染,并对其进行编号。
2.羊膜分离组织分离
将胎盘置于不锈钢托盘中,用清洗液清洗1次;用手将围绕脐带周围胎盘子面的羊膜撕下,放入培养皿中,用手术剪将带有血渍的边缘剪掉,加入75%的医用酒精进行漂洗,再放入新的培养皿中,加入清洗液清洗,并用组织剪剪成1×1cm2大小的组织块,再用清洗液清洗一遍,转移至50ml离心管中,每管含羊膜组织10ml,1300rpm/min离心5min;
3.羊膜上皮细胞分离
离心结束后,弃上清,每管加入胰蛋白酶储存液3ml,edta储存液3ml,补充生理盐水至30ml,此时胰蛋白酶的浓度和edta的浓度分别为0.05%和0.02%。145rpm/min,37℃振荡消化15min。消化结束后,加入适量生理盐水,1300rpm/min离心5min;弃上清。再重复上述胰蛋白酶和edta消化的步骤;
4.羊膜间充质干细胞分离
上述消化结束后,加入适量生理盐水,1300rpm/min离心5min;弃上清。将羊膜组织放入培养皿中,用清洗液清洗两次。将羊膜组织放入新的50ml离心管中,每管约含组织10ml,并剪碎羊膜组织1-3mm。加入胶原酶ⅰ2ml,dnaseⅰ2ml,补充生理盐水至20ml,此时胶原酶ⅰ和dnaseⅰ的浓度分别为0.1%和0.02%。145rpm/min,37℃振荡消化60min。消化结束后,加入适量生理盐水,1300rpm/min离心5min;弃上清及组织。每管加入10ml原代培养基接种于10cm的培养皿中培养;
5.原代换液
培养至第3天,进行第一次半换液,第6天根据实际情况进行半换或全换液,以后每隔3天全换液;
三、羊膜间充质干细胞传代培养
观察原代细胞融合度60%以上即可传p1代,接种密度为8000~10000个/cm2。以后细胞融合度达80%以上即可传代。传代为完全培养基,无需添加双抗或庆大霉素。p3代取细胞量1.0~1.2×106cell/ml进行细胞表面标志物检测。
流式检测羊膜间充质干细胞表面标志物
1)取单细胞悬液,1200rpm/min,离心5min;
2)用pbs重悬细胞沉淀,调节细胞浓度为1.0~1.2×106cell/ml;
3)加抗体cd90、cd105、cd166,轻轻吹打混匀,4℃避光孵育30min,同时设置同型对照;
4)加1mlpbs于流式检测管中,1200rpm,5min,弃上清;
5)加100ulpbs,轻轻吹打混匀,上机检测。
结果:羊膜间充质干细胞三种表面标志物cd90-95.13%、cd105-96.99%、cd166-98.47%,阳性率均在95%以上,图1为本发明的流式检测图,如图1所示。
原代培养第15天细胞融合度80%以上,如图2左上所示,p1代第3天如图2右上所示,p2代第3天如图2左下所示,p3代第3天如图2右下所示。
本研究的方法,与现有的羊膜间充质干细胞分离方法相比,使用两步酶消化法分离羊膜间充质干细胞,第一步去除羊膜上皮细胞,且消化两次,使羊膜上皮细胞去除的更充分,获得的羊膜间充质干细胞纯度更高,并且操作简单,无需组织及细胞过滤,使用dnaseⅰ避免羊膜间充质干细胞进入消化粘液中而无法分离,获得的干细胞数量更多。整个分离过程无动物源性成分,安全性好,便于后续的研究应用。
以上对本发明的具体实施方式进行了说明,但本发明并不以此为限,只要不脱离本发明的宗旨,本发明还可以有各种变化。
- 还没有人留言评论。精彩留言会获得点赞!