一种快速测定植物蔗糖合成酶活性的方法与流程
本发明涉及酶活性的测定方法,具体地说,涉及一种快速测定植物蔗糖合成酶活性的方法。
背景技术:
蔗糖是植物光合作用产物由叶片向“库”器官运输的主要物质形式。蔗糖合成酶主要通过控制蔗糖的合成与分解,直接影响植物库强以及蔗糖的输入与积累,是蔗糖参与各个代谢活动途径一种必不可少的关键酶。对于玉米而言,其积累的可溶性糖有蔗糖、葡萄糖、果糖几种,其中蔗糖占了绝大部分,是总糖的60%~77%。而且甜玉米、糯玉米等许多食用玉米的口感、品质均很大程度上由蔗糖决定。另外,蔗糖合成酶在调控淀粉的合成方面也有重要作用,蔗糖合成酶作为首要的代谢酶为淀粉的合成提供前体物质udpg。而籽粒中淀粉的含量是衡量许多作物产量与品质的重要指标。中性洗涤纤维是衡量青贮玉米品质的重要评价指标。目前普遍认为蔗糖合成酶在调控青贮玉米中中性纤维中起到关键作用。
蔗糖合成酶以游离果糖为受体,反应生成蔗糖,主要是蔗糖分解与核苷酸葡萄糖合成的系统。因此,蔗糖合成酶活与蔗糖积累和葡萄糖合成密切相关。研究表明,蔗糖合成酶与玉米的淀粉含量息息相关,而且会影响甜玉米的口感品质,另外对于青贮玉米,蔗糖合成酶活性与其秸秆中性洗涤纤维(dnf)呈正相关。测定蔗糖合成酶活性对作物产量的提高和品质改良都有重要的指导意义。
在植物体中蔗糖合成酶的存在形式主要有两种,大部分蔗糖合成酶是在植物细胞质中以可溶性的状态存在,而少部分则是以不可溶的状态附着在细胞膜上。蔗糖合成酶既可以催化蔗糖的合成也可以催化蔗糖的分解,且该酶在分解方向的km值较高,当蔗糖浓度高时有利于反应向分解方向进行。测定蔗糖合成酶的酶活性既可以通过其合成反应也可以在分解方向上测定,目前大多数的蔗糖合成酶活性测定均是利用其合成反应。采用的测定方法主要是将提取的粗酶液直接与底物反应生成蔗糖,蔗糖在盐酸与间苯二酚反应可以分解成果糖与葡萄糖显色,再用分光光度计测定吸光值从而测出蔗糖合成酶活性的方法进行测定。因粗酶液未经纯化,杂质较多,对测定结果会产生较大影响。另外,用分光光度计进行测定时,若样本量较大,更换样品时比色皿的清洗也比较耗时。因此,有必要开发一种快速便捷的测定方法,以期达到优化蔗糖合成酶活性测定方法的目的。
技术实现要素:
本发明的目的是提供一种快速测定植物蔗糖合成酶活性的方法。
为了实现本发明目的,本发明提供一种快速测定植物蔗糖合成酶活性的方法,包括以下步骤:
1)酶的提取:从植物中提取酶,得到粗酶液;
2)酶的纯化;利用离心式去盐柱对粗酶液进行纯化;
3)酶促反应:将纯化后所得酶液加入底物udpg和果糖中,进行酶促反应生成蔗糖,反应结束后,用糖度计测定反应产物的白利度值,根据蔗糖白利度与百分比浓度对照表得到蔗糖的浓度,根据蔗糖的浓度计算出蔗糖合成酶的酶活力。
前述的方法,步骤1)酶提取的具体方法如下:取植物组织1-2g(优选2g),剪碎放入研钵中,加入液氮研磨至粉碎,取8-12ml(优选12ml)hepes-naoh提取缓冲液和少许石英砂加入研钵中,充分研磨搅拌,转入离心管中,于4℃、12000rpm离心30min,取上清液,即得粗酶液。
其中,所述hepes-naoh提取缓冲液中含有50mmol/lhepes、1mmol/ledta、10mmol/lmgcl2、2.5mmol/ldtt、0.05%triton-x100和0.5mg/mlbsa,ph7.5。
前述的方法,步骤2)酶纯化的具体方法如下:将离心式去盐柱放入2ml离心管,然后将hepes-naoh提取缓冲液加入离心式去盐柱内,于4℃、1000g离心2min,重复3-5次以润洗离心式去盐柱;
润洗后,将离心式去盐柱换上新的2ml离心管,取1ml粗酶液加入润洗后的离心式去盐柱内,于4℃、1000g离心4min,收集酶液,用于后续酶促反应。
本发明中,离心式去盐柱优选spin-outtmgt-1200。
前述的方法,步骤3)进行酶促反应的具体方法如下:向hepes-naoh反应液中加入200μl酶液,30℃保温30min;然后100℃放置4min;然后加入2mol/lnaoh200μl,100℃放置10min。
其中,所述hepes-naoh反应液的配方为:50mmol/l果糖100μl、50mmol/ludpg100μl、10mmol/lmgcl250μl、透析缓冲液100μl。
所述透析缓冲液的配方为:50mmol/lhepes、1mmol/ledta、10mmol/lmgcl2、2.5mmol/ldtt、0.5mg/mlbsa。
本发明中,所述植物包括但不限于玉米。
本发明特别适合于快速测定玉米叶片(特别是玉米幼苗叶片)中蔗糖合成酶的活性。
本发明利用糖度计直接测量生成的蔗糖含量。糖度计的原理为:一种介质进入到另一种介质时会产生折射现象,且入射角正弦之比恒为定值,这个比值为折光率。在某一温度和环境下,生成蔗糖溶液的浓度与其对某波长的光波的折射率具有对应的关系,用这种折光计方法原理测量待测样液的折光率,直接读出可溶性固形物含量,测定结果以蔗糖质量百分浓度表示,若制品中含有非蔗糖物质,其测定结果为近似值。糖度计测出的结果用brix(白利度)来表示,是指产品中的可溶性固形物的含量,100g蔗糖溶液中的蔗糖溶度。然后根据蔗糖白利度与百分比浓度对照表,即可得出蔗糖的浓度。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明利用不同纯化方法以及酶活性测定方法分别对不同玉米材料的蔗糖合成酶活性进行测定,筛选出最简便、经济、快捷的测定方案。以hepes-naoh为提取缓冲液,从玉米幼苗的叶片中提取蔗糖合成酶获粗酶液,用离心式去盐柱或透析袋进行纯化,再用糖度计或分光光度计测定蔗糖合成酶活性。离心式去盐柱的纯化方法可以代替传统的透析袋纯化方法从而节省透析时间;纯化后的酶液,用糖度计和分光光度计测定的结果一致,糖度计的分辨率较高。本发明利用离心式去盐柱纯化结合糖度计的测定方法,可以替代传统的透析袋纯化结合分光光度计的测定方法,不仅可以省去透析时间,实现批量测定的统一标准;同时还能省出分光光度计测定时大量比色皿的清洗时间。
附图说明
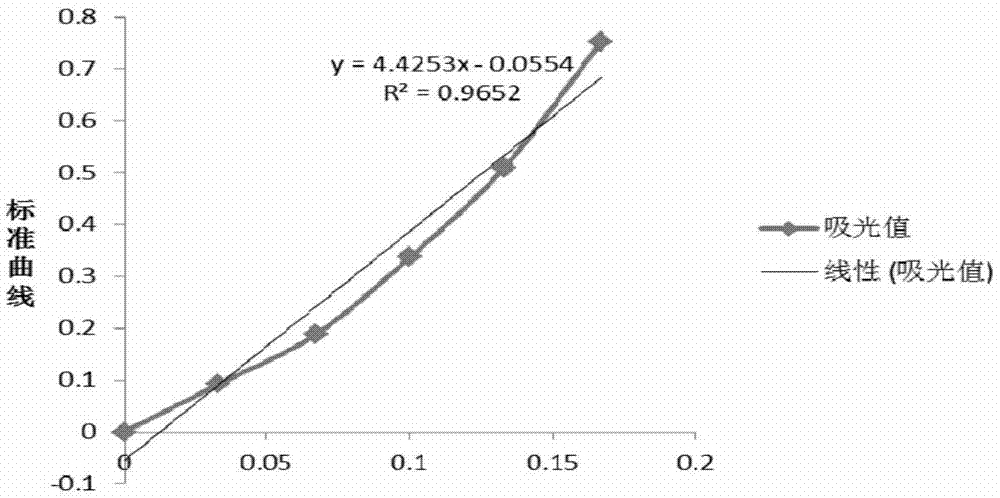
图1为本发明实施例1中根据不同浓度蔗糖溶液绘制的标准曲线。
图2为本发明实施例1中不同测定方法测得的蔗糖合成酶粗酶活性。
图3为本发明实施例1中不同测定方法测得的透析袋纯化过的蔗糖合成酶活性。
图4为本发明实施例1中不同测定方法测得的离心式去盐柱纯化过的蔗糖合成酶活性。
图5为本发明实施例1中用糖度计测得的不同的纯化方法的蔗糖合成酶酶活性。
图6为本发明实施例1中用分光光度计测得的不同的纯化方法的蔗糖合成酶酶活性。
图7为本发明实施例1中五个玉米品种蔗糖合成酶酶活性比较。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
以下实施例中,离心式去盐柱为spin-outtmgt-1200。
实施例1快速测定玉米幼苗叶片蔗糖合成酶活性的方法
1、实验材料
玉米自交系:2193、zyq061、zyq268、zyq335。
玉米杂交种:北农青贮368。
2、实验方法
2.1粗酶的制备
分别称取2g新鲜的玉米幼苗叶片,剪碎放入研钵中,加入液氮研磨至粉碎。取12mlhepes-naoh(ph7.5)提取缓冲液(含50mmol/lhepes、1mmol/ledta、10mmol/lmgcl2、2.5mmol/ldtt、0.05%triton-x100、0.5mg/mlbsa)以及少许石英砂加入研钵中,充分研磨搅拌,转入15ml离心管中。提取缓冲液低温(4℃,12000rpm)离心30min,取上清液,即为粗酶液。
2.2粗酶的纯化
离心式去盐柱纯化方法:将压实树脂片的离心式去盐柱放入2ml离心管,将上述hepes-naoh提取缓冲液缓慢加入离心式去盐柱,低温(4℃、1000g)离心2min,重复3-5次以润洗去盐柱。给去盐柱换上新的2ml离心管,取1ml粗酶液缓慢加入润洗过的去盐柱中心,低温(4℃、1000g)离心4min,收集酶液。
透析袋纯化方法:将粗酶液加入透析袋中,然后将透析袋放入250mlhepes-naoh(ph7.5)透析液(含50mmol/lhepes、1mmol/ledta、10mmol/lmgcl2、2.5mmol/ldtt、0.5mg/mlbsa)中,浸泡过夜。
2.3酶促反应
向hepes-naoh反应液(50mmol/l果糖100μl、50mmol/ludpg100μl、10mmol/lmgcl250μl、透析缓冲液(50mmol/lhepes、1mmol/ledta、10mmol/lmgcl2、2.5mmol/ldtt、0.5mg/mlbsa)100μl中加入200μl酶液,30℃下保温30min。
然后,100℃沸水浴下保存4min。加入200μl2mol/l的naoh。在100℃沸水浴下保存10min。用水代替反应液中的udpg作为对照。
2.4酶活测定
2.4.1糖度计测定
将糖度计用对照归零,用移液枪吸取反应液使其覆盖住糖度计的镜面,赶走气泡,即可读数,读数即为溶液的白利度值。
2.4.2分光光度计测定
向反应液中加入2ml30%盐酸混匀,80℃保温10min。加1ml0.1%间苯二酚,80℃保温10min,流水冷却后在480nm下比色。
酶活力单位定义为:在上述条件下,每克样品干质量所含的总酶量,在一个小时内能催化生成蔗糖的量为一个活力单位(mmol/h/gfw)。
2.5标准曲线的制作
标准曲线的制定:蔗糖在80℃下烘干至恒重,称取1g,加水溶解,定容至250ml,蔗糖标准液为4mg/ml。取6个试管按表1精确配置。混匀后,沸水浴10min,冷却加入1.5ml30%盐酸,0.5ml0.1%间苯二酚混匀,在80℃水浴锅中水浴10min,冷却后定容至12ml,在480nm下比色。以含糖量为横坐标,以吸光值为纵坐标,绘制标准曲线,求出标准曲线方程。表1为蔗糖含量标准曲线绘制表。
表1蔗糖含量标准曲线绘制表
3.结果与分析
3.1标准曲线
按照上述标准曲线绘制方法,做出一定浓度梯度的蔗糖溶液并在与盐酸和间苯二酚加热的条件下显色,在分光光度计下读取吸光值(表2),并绘制成标准曲线见图1。
表2标准曲线吸光值
3.2不同测定方法蔗糖合成酶活性变化
根据表3的实验数据可以看出五个材料的玉米叶片在糖度计和分光光度计两种测量方法下测得的蔗糖合成酶酶活性存在极显著差异,糖度计测得的酶活性明显高于分光光度计测得的酶活性。
表3不同测定方法测得的蔗糖合成酶酶活性(单位:μmol/h/gfw)
图2是不同测定方法测得的蔗糖合成酶粗酶活性,图3是不同测定方法测得的透析袋纯化过的蔗糖合成酶活性,图4是不同测定方法测得的离心式去盐柱纯化过的蔗糖合成酶活性。
根据图2、图3、图4的折线图可以看出,图2、3用糖度计和分光光度计分别对不同玉米材料中未经纯化和透析袋纯化的蔗糖合成酶活性进行测定比较,发现无任何规律。而图4中经过离心式去盐柱纯化后的酶液,分别用分光光度计和手持数显糖度计进行测定,结果显示,无论使用哪种测定方法,在不同玉米材料中的测定结果趋势基本一致。
3.3不同纯化方法蔗糖合成酶活性变化
用不同的纯化方法测得的蔗糖合成酶酶活性见表4。用不同的纯化方法测得的蔗糖合成酶酶活性见表5。
表4用不同的纯化方法测得的蔗糖合成酶酶活性(糖度计法,单位:μmol/h/gfw)
表5用不同纯化方法测得的蔗糖合成酶酶活性(分光光度计法,单位:μmol/h/gfw)
由表4、表5实验数据以及图5、图6的折线图趋势可以看出,无论是分光光度计和糖度计哪一种测定方法,其蔗糖合成酶活性变化趋势基本一致。而且使用离心式去盐柱纯化后的酶活性普遍高于透析袋纯化后的酶活性,可见离心式去盐柱的纯化效果更为理想。
从图6可以看出,分光光度计测定的未经纯化的酶液的酶活与纯化后的酶液的酶活相比,趋势相反。即纯化酶液中,玉米杂交种368中的酶活比自交系中(2193、zyq268、zyq335、zyq061)的活性要高,而粗酶液中,杂交种和自交系的差异不明显,甚至杂交种中的酶活要低于自交系。这可能是因为分光光度计对酶液的纯度要求较高。
3.4五种玉米材料的蔗糖合成酶活性比较
按照使用糖度计法测得的离心式去盐柱纯化后的蔗糖合成酶活性(图7)对玉米自交系2193、zyq061、zyq268、zyq335和杂交种368这五种玉米材料在幼苗期的蔗糖合成酶活性进行比较。通过图7实验数据可以看出这五个玉米材料中除了杂交品种368蔗糖合成酶酶活性相对较高以外,剩下四个品种的酶活性相差不大。未经纯化的粗酶液使用糖度计测得的酶活性并无规律可循,分析其原因可能在于手持数显糖度计是通过测定溶液的折光率求出溶液的浓度(含糖量的多少)。因为溶液中的可溶性固形物含量与折光率在一定条件下(同一温度、压力)成正比。而未经纯化的粗酶液因含杂质较多,对测定结果的影响很大。而纯化后的酶液,分别用分光光度计和手持数显糖度计进行测定,结果显示,无论使用哪种测定方法,在不同玉米材料中的测定结果趋势基本一致。而且,离心式去盐柱纯化后的酶液符合程度很高,因此就本发明的材料而言,离心式去盐柱的分辨率更高。离心式去盐柱纯化后的酶液,无论采用哪种测定方法,均表现为,玉米杂交种368中的蔗糖合酶的酶活比自交系中(2193、zyq268、zyq335、zyq061)的活性要高,说明用去盐式离心柱的纯化方法结合糖度计的测定方法,可以替代传统的透析袋纯化方法结合分光光度计的测定方法。这样不仅可以省去透析时间,实现批量测定的统一标准;同时还能省出分光光度计测定时大量比色皿的清洗时间。
本发明通过对玉米自交系2193、zyq061、zyq268、zyq335和杂交品种青贮368这五个玉米材料,采取透析袋和离心式去盐柱这两种不同的纯化方法,以及糖度计、分光光度计两种不同的测定方法,分别测定蔗糖合成酶活性,结果进行比较,离心式去盐柱的纯化方法加糖度计的测定方法相对最为快速、便捷、安全。蔗糖合成酶在蔗糖的分解方向担负着重要的作用,除此之外,也为淀粉和纤维素的合成提供前体物质udpg,所以作为玉米糖代谢途径的一个重要酶,蔗糖合成酶的研究对于玉米的品质和产量的提升都有重大的意义。本发明对蔗糖合成酶活性的测定方法进行了较为全面的研究,通过科学的试验方法和系统的比较,筛选出了最为准确、经济的测定方法,对于今后玉米蔗糖合成酶的研究奠定了基础。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献
[1]komastua,takanokuray,moriguchit,differentialexpressionofthreesucrose-phosphatesynthaseisoformsduringaccumulationincitrusfruit(citrusunshiumarc)[j].plantsci,1999,140:169~178
[2]卢合全,沈法富,刘凌霄,孙维方.植物蔗糖合成酶功能与分子生物学研究进展[j].中国农学通报,2007,21(7):34~37
[3]崔彦宏,周海,李伯航.甜玉米籽粒的营养品质及影响因素[j].河北农业大学学报,1996,19(4):99~104
[4]whittinghamcp,keysaj,birdif.theenzymologyofsucrosesynthesisinleaves[a].gibbsm,latzkoe.encyclopediaofplantphysiology:newseriesvol6[c].berlin:springer-verlag,1979.313~326
[5]朱瑾,郝玉兰,张秋芝,南张杰,李莹莹,李素坤,潘金豹.青贮玉米秸秆中性洗涤纤维与蔗糖合成酶活性之间的关系[j].中国农学通报,2010,26(12):63~66
[6]brownrmjr,saxenaim,kudlickak.cellulosebiosynthesisinhigherplants[j].trendsinplantscience,1996(5):149~155
[7]ruanyl,choureyps,delmerdp,etal.thedifferentialexpressionofsucrosesynthaseinrelationtodiversepatternsofcarbonpartitioningindevelopingcottonseed[j].plantphysiology1997,115:375~385
[8]张志良,瞿伟菁.植物生理学实验指导[m].3版.北京高等教育出版社,2004:128~129.
[9]高向阳,徐凤彩,赵亚华,梅志弘.普通玉米和超甜玉米苗期蔗糖合成酶与磷酸蔗糖合成酶的活力比较[j].华南农业大学学报,2001,22(2):46~48
[10]薛应龙,夏镇澳.植物生理学实验手册[m].上海:上海科技出版社,1985.146~150
[11]颜昌翔,徐向东.一种高精度数字式糖度计[j].光学仪器,1998,20(4):34~36
- 还没有人留言评论。精彩留言会获得点赞!