一种用于乙型肝炎病毒基因分型检测的组合物、试剂盒及其方法与流程
本发明涉及医学检验领域,具体涉及一种用于乙型肝炎病毒基因分型检测的组合物、试剂盒及其方法。
背景技术:
乙型肝炎病毒(hepatitisbvirus,hbv)作为一种累积感染全球20亿以上人口的病原体,严重危害着受感染人群的肝健康,每年约有100万人死于hbv感染所致的肝衰竭、肝硬化和原发性肝细胞癌(hcc)。hbv属嗜肝dna病毒科(hepandnaviridae),其基因组为双链dna,呈不完全闭合环状。依据hbv全基因序列核苷酸异源性≥8%,或s基因异源性≥4%这一原则,将hbv分为a~i型9种基因型。该9种不同的基因型在全球范围内呈差异性地域分布,在我国主要以b、c基因型及少量d基因型为主。
hbv研究的早期,主要采用血清亚型区分不同hbv毒株;随分子生物学研究的发展,相比血清亚型,hbv基因分型被发现能更准确地反映不同病毒株之间的异源性,且不同基因型的hbv的致病机理不同,导致不同基因型感染所致的乙型肝炎的病情进展、临床症状、预后、治疗方案及治疗效果都有所差异。例如,不同基因型hbv对病情进展和干扰素抗病毒治疗的效果不同,b基因型感染者比c基因型感染者更早出现hbeag血清学转换,较少进展为慢性肝炎、肝硬化和原发性肝细胞癌;而在hbeag阳性患者中,b基因型感染者对干扰素抗病毒治疗的应答率高于c基因型感染者,a基因型感染者的应答率高于d基因型感染者。
hbv全基因组长约3.2kb,对其全基因组进行测序是hbv基因分型的金标准,该方法结果可靠、直接,但耗时长,且费用偏高,不适宜广泛开展,故依据s基因核苷酸异源性≥4、同源性<96%的标准对s基因测序结果进行分型演变为简化版本的hbv测序分基因型的方法,但费用高、费时的固有缺点仍然无法避免。其他临床上用于hbv基因分型的方法还包括限制性片段长度多态性分析(rflp)、线性探针杂交检测、反向杂交法、基因芯片、荧光pcr等多种方法,其中荧光pcr法无需对扩增产物进行开盖处理,避免了诸多方法中杂交步骤所可能造成的污染的风险,且荧光pcr法可避免测序分型法对不同基因型混合感染漏检的情况。荧光pcr法虽简便快捷,但目前临床所用的荧光pcr分型检测产品通常需进行至少2管pcr检测才能区分3种或3种以上hbv基因型,又或者现有的乙肝病毒荧光pcr分型检测产品灵敏度不高、准确性差。
技术实现要素:
为解决上述问题,本发明提供了一种用于乙型肝炎病毒基因分型检测的组合物、试剂盒及其方法。
一种用于乙型肝炎病毒基因分型检测的组合物,其特征在于:该组合物包括引物组和探针组;
所述引物组包括:
引物1:其具有如seqidno.1所示的核苷酸序列,
引物2:其具有如seqidno.2所示的核苷酸序列,
引物3:其具有如seqidno.4所示的核苷酸序列,
引物4:其具有如seqidno.5所示的核苷酸序列,
引物5:其具有如seqidno.7所示的核苷酸序列,
引物6:其具有如seqidno.8所示的核苷酸序列;
所述探针组包括:
探针b:其具有如seqidno.3所示的核苷酸序列,
探针c:其具有如seqidno.6所示的核苷酸序列,
探针d:其具有如seqidno.9所示的核苷酸序列。
本发明一个优选实施方案中,所述探针组中的探针分别标记不同的荧光发光基团。更优选地,所述荧光发光基团选自最大发射波长为518nm、538~555nm、574~575nm、602~615nm、640nm、660~667nm或690nm的荧光发光基团。
本发明另一个优选实施方案中,所述荧光发光基团为fam、tet、joe、cy3、cy5、cy5.5、lluorescein、rhodamine、rhodaminered、rhodamine6g、orengongreen488、orengongreen500、orengongreen514、texasred、tamra、inosine、hex、fitc、acridineorange、rox或vic。
在一种实施方式中,上述组合物应用于制备用于乙型肝炎病毒基因分型检测的试剂盒。
在另一种实施方式中,一种用于乙型肝炎病毒基因分型检测的试剂盒,所述试剂盒含有上述用于乙型肝炎病毒基因分型检测的组合物。
本发明一个优选实施方案中,所述试剂盒还包括dna聚合酶、dntps、pcr反应缓冲液和添加剂;所述添加剂为海藻糖和甲酰胺。
本发明另一个优选实施方案中,所述添加剂是由1m海藻糖和甲酰胺按体积比为1.3:0.8混合而成的混合物。
在另一种实施方式中,一种乙型肝炎病毒基因分型检测的方法,该方法的pcr反应体系为:
所述引物组包括:
引物1:其具有如seqidno.1所示的核苷酸序列,
引物2:其具有如seqidno.2所示的核苷酸序列,
引物3:其具有如seqidno.4所示的核苷酸序列,
引物4:其具有如seqidno.5所示的核苷酸序列,
引物5:其具有如seqidno.7所示的核苷酸序列,
引物6:其具有如seqidno.8所示的核苷酸序列;
所述探针组包括:
探针b:其具有如seqidno.3所示的核苷酸序列,
探针c:其具有如seqidno.6所示的核苷酸序列,
探针d:其具有如seqidno.9所示的核苷酸序列。
本发明一个优选实施方案中,该反应体系还包括2.1μl的添加剂。
本发明更进一步的优选实施方案中,所述添加剂为1m海藻糖和甲酰胺按体积比为1.3:0.8混合而成的混合物。
下面将详细地解释本发明。
基于hbv在我国的地理分布特点呈南方以b基因型为主,北方以c基因型为主,d基因型多分布在新疆、西藏、宁夏等少数民族聚集地,其他基因型鲜有发现的特点,本发明设计了靶向b、c、d基因型的核苷酸特异探针,建立了利用扩增曲线和ct值检测hbv基因型的荧光pcr方法。
本发明提供了一种用于区分hbv的b、c、d三种基因的检测组合物、试剂盒及方法。本发明从美国国立卫生研究院(nih)的基因序列数据库(genbank)中下载hbv的b、c、d全基因组序列,用欧洲生物信息研究所(eml-ebi)的序列比对软件(muscle)对上述已下载的已分型的基因组序列进行比对分析,根据分析结果选定引物探针设计区域,然后按照引物探针的设计原则,利用primerpremier5.0和primerexpress3.0软件协同进行引物探针的设计,上下游引物和探针均设计在含有特异性碱基的序列区域。本发明设计的引物扩增出的扩增片段通过美国国立生物技术信息中心(ncbi)的primer-blast验证扩增片段确为hbv的目的基因型。本发明的检测方法和检测试剂盒是针对提取血清样本中的dna进行的检测,在进行pcr反应体系配制时,加入血清dna,在荧光pcr仪中运行三重荧光pcr程序,扩增目的片段,根据扩增曲线和ct值判断基因型,实现对hbv的分型。
本发明优选在探针b的5’端标记cy5荧光基团,探针c的5‘端标记vic荧光基团,探针d的5’端标记fam荧光基团,b、c、d基因型的探针3’端均标记淬灭基团。
本发明的pcr反应体系具体为:10×pcrbuffer4μl,10μmb基因型上游引物、10μmb基因型下游引物、10μmc基因型上游引物、10μmc基因型下游引物、10μmd基因型上游引物、10μmd基因型下游引物各0.4μl,10μmb基因型探针、10μmc基因型探针、10μmd基因型探针各0.2μl,40mmdntps0.8μl,dna聚合酶0.5μl,dna模板(样本)25μl,总体积40μl。
该pcr反应体系中还包括添加剂2.1μl,添加剂为海藻糖和甲酰胺,更具体地,所述添加剂为1m海藻糖和甲酰胺按体积比为1.3:0.8混合而成的混合物。
该pcr的反应程序为:95℃5min,然后按95℃15s→60℃30s进行40个循环,在60℃收集荧光信号,荧光通道选择cy5、vic及fam。
与现有检测方法相比,本发明的显著优点在于:本发明的检测方法具有高灵敏度的特点,能够在低病毒载量的情况下区分b、c、d基因型,并且检测准确性极高,对临床指导用药有实际意义;此外,本发明建立的三重荧光pcr法,操作简便,只需在一管pcr反应体系中进行,克服了以往检测产品需分管进行检测的缺点,降低成本,更能提高临床机构中设备的利用率和单次实验的通量,简化临床检测人员的操作流程。综上所述,本发明的乙肝病毒荧光pcr检测方法具有操作简单、灵敏度高、准确性好、成本低的优势,适合于大规模的临床开展。
附图说明
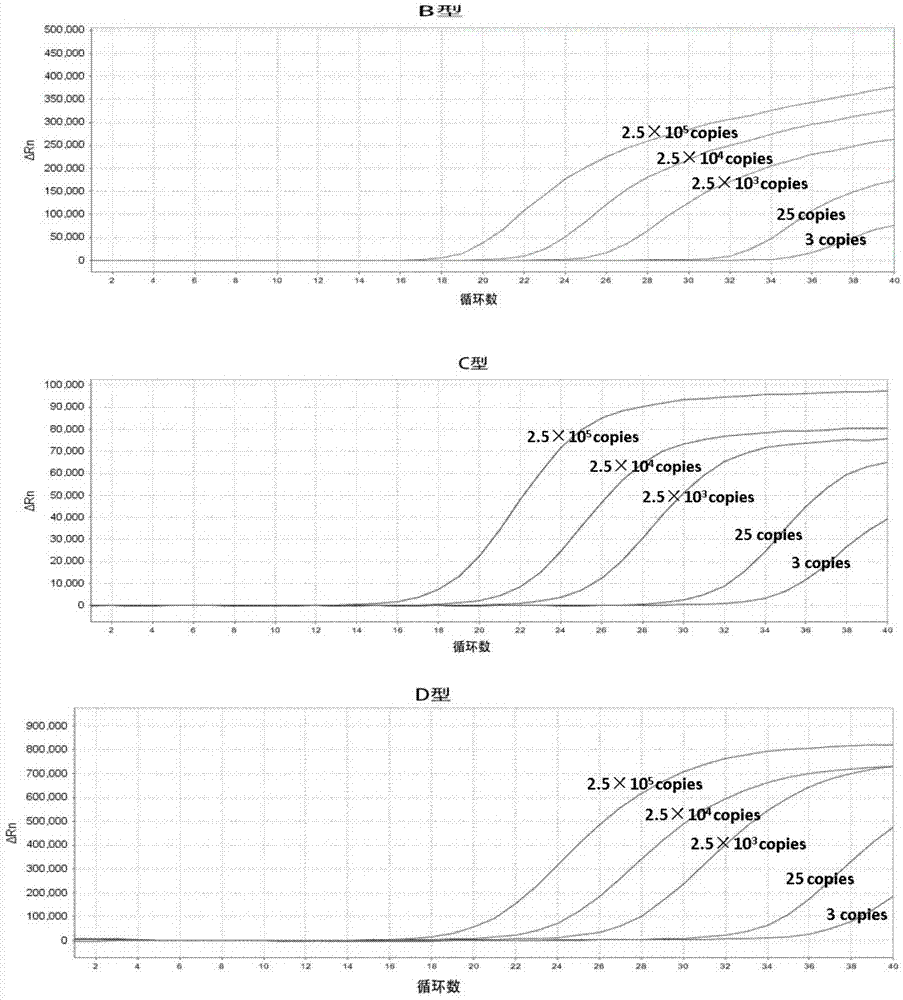
图1为本发明实施例1中不同稀释倍数hbv的b、c、d基因型质粒为样本检测得到的扩增曲线;
图2为本发明实施例1中以hbv的b、c、d基因型质粒为样本检测的标准曲线;
图3为实施例2中以hbv的b基因型质粒为样本分别用添加和不添加添加剂的pcr反应液进行扩增的扩增曲线;
图4为实施例2中以hbv的c基因型质粒为样本分别用添加和不添加添加剂的pcr反应液进行扩增的扩增曲线;
图5为实施例2中以hbv的d基因型质粒为样本分别用添加和不添加添加剂的pcr反应液进行扩增的扩增曲线;
图6为本发明实施例4中以hbv的b/c/d混合型作为阳性检测临床样本检测得到的扩增曲线。
具体实施方式
为了使本领域技术领域人员更好地理解本申请中的技术方案,下面将结合下面结合实施例对本发明作进一步说明,显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都应当属于本申请保护的范围。
定义
depc水是用depc(diethylpyrocarbonate,焦碳酸二乙酯)处理过并经高温高压灭菌的miliq纯水,无色液体。经检测不含杂质rna、dna和蛋白质。
术语“保守序列”是指具有高度相似性或同一性的分子序列,这些序列可以是核酸序列(如rna或dna序列),蛋白质序列,蛋白质结构或糖类中的序列。这些序列高度相似,却来自不同的物质或同一生物体产生的不同分子。从跨种保留的角度来看,这种序列的存在意味着在形成不同物种的进化过程中,有一段特殊的基因序列被保留了下来。通过分析不同进化极端生物体的基因组发现,不同生物体的基因组中有些序列有惊人的相似,这些相似的序列就是所谓的保守序列。
术语“比对”是指为了进行系统发生分析而将同源分子序列进行并列的任何的系列技术。
术语“样品”是指来自任何受试者的生物样品,它用于检测是否存在一种或多种疾病,例如流感病毒或者其它呼吸道症状或疾病。这种样品可以包括来自皮肤或任何器官、血液、血浆、黏液、唾液等的组织样品。
术语“探针”是指可在合适的条件下与扩增的靶标核酸选择性杂交的寡核苷酸。探针序列可以为正义(例如,互补)序列(+)或者是编码链/正义链的反义(例如,反向互补)序列(-)。在动力学pcr形式中,检测探针可由具有5’报告染料(r)和3’猝灭染料(q)的寡核苷酸组成。荧光报告染料(即,fam(6-羧基荧黄素)等)典型地位于3’末端。在扩增和检测过程中检测探针作为taqman探针。
此处所用术语“核酸”是指多核苷酸,例如脱氧核糖核酸(dna),适当时候也指核糖核酸(rna)。该术语也应理解为包括由核苷酸类似物所组成的rna或dna的等价物、类似物,以及可应用在所述技术方案中的单链(正义或反义)及双链多核苷酸。
本文所用术语“标记”是指任何可用于提供可检测(优选地为可定量的)信号的原子或分子,可与核酸或蛋白质通过共价键或非共价相互作用(例如,通过离子或氢键、或通过固定化、吸附等)连接。标记通常通过荧光、化学发光、放射性、比色法、质谱、x射线衍射或吸收、磁力、酶活性等提供所检测的信号。标记的实施例包括荧光团、发色团、放射性原子(特别是32p和125i)、电子致密试剂、酶和具有特定结合物的配体。
本发明的甲酰胺是一种无色透明液体,该甲酰胺中甲酰胺含量≥99.5%。
本发明试剂盒中,含有pcr反应液、酶混合液、阳性质控品、阴性质控品和内标。pcr反应液中含有用于乙型肝炎病毒基因分型检测的组合物、dntps、pcr反应缓冲液和添加剂;所述添加剂为海藻糖和甲酰胺。
实施例1
本实施例以已知序列的b基因型、c基因型和d基因型的质粒作为hbv不同基因型的参考品为模板,利用本发明所述三重荧光pcr检测上述质粒,具体步骤如下:
(1)配制pcr反应体系
(2)加入质粒模板
向上述pcr反应液中分别加入连续十倍稀释的b基因型、c基因型和d基因型质粒,加入量为25μl。
(3)pcr扩增检测
用abi7500(appliedbiosystems)运行如下的扩增程序,选择cy5,vic,fam通道(分别对应b基因型、c基因型和d基因型),在60℃时收集荧光信号:
(4)结果分析
b基因型、c基因型和d基因型质粒在上述pcr扩增体系中均只在所述基因型对应的荧光通道得到典型的s型曲线,具体见图1,说明本发明中的引物探针不会产生b/c/d基因型之间的交叉检出,特异性好;且上述质粒的ct值与各基因型质粒的浓度呈良好的线性关系,具体见图2,说明本发明中的引物探针具有良好的扩增效率。
实施例2
本实施例通过在pcr反应体系中添加添加剂,以提高本发明所述方法对实施例1中所述b基因型、c基因型、d基因型的质粒检出的灵敏度,具体步骤如下:
(1)配制含添加剂的pcr反应体系
(2)加入质粒模板
向上述pcr反应液中分别浓度约为50copies/ml的b基因型、c基因型和d基因型质粒,加入量为25μl,重复数为2。
(3)pcr扩增检测
用abi7500(appliedbiosystems)运行如下的扩增程序,选择cy5,vic,fam通道(分别对应b基因型、c基因型和d基因型),在60℃时收集荧光信号:
(4)结果分析
向实施例1中所述的pcr反应液中加入海藻糖及甲酰胺后,扩增体系对浓度约为50coipes/ml的各基因型质粒的检出ct值均提前,灵敏度更高,且检出率(2/2)亦有提高,具体见图3~5。
实施例3
本实施例运用本发明试剂盒检测199例临床hbv阳性血清样本,并以z品牌乙型肝炎病毒基因分型检测试剂盒(荧光pcr法)(仅b/c/d分型,不能区分混合型)作为对照,利用本发明所建立的三重荧光pcr法检测199例临床样本的步骤如下:
(1)提取血清样本dna
利用迈克生物核酸(dna)提取试剂盒(磁珠法)进行dna提取,步骤如下:
a.取离心管分别标记,每管各加入10μl核酸提取试剂①;
b.每管均加入200μl待测样本,盖上管盖,振荡混匀5秒,瞬时离心;
c.每管加入300μl核酸提取试剂②、8μl核酸提取试剂③与2μl内标的混合液,振荡混匀10秒,室温静置10分钟;
d.瞬时离心,将离心管置于磁性分离器上,3分钟后将溶液缓慢吸出丢弃(注意不要碰到吸附于管壁的棕色物);
e.每管加入400μl核酸提取试剂④和50μl核酸提取试剂⑤,振荡混匀5秒,瞬时离心后将离心管再次置于磁性分离器上;
f.约3分钟后,上清液分为两层,将吸头伸入离心管底部,从底部开始缓慢将管内液体完全吸出丢弃;瞬时离心30秒后将离心管置于磁性分离器上;
g.约3分钟后,将管底残余液体彻底吸出丢弃;
h.每管加入30μl核酸提取试剂⑥,振荡混匀使离心管壁的棕色残留物完全洗脱于溶液中,然后60℃干浴10分钟;
i.瞬时离心,将离心管置于磁性分离器上静置3分钟,转移上清至新的1.5ml离心管,所得上清即为提取的核酸dna。
提取的核酸应在2h内用于pcr扩增。
(2)配制pcr反应体系
取出试剂盒各组分,恢复至室温,混合后瞬时离心,配制201份(199+2阳性阴性对照)pcr反应体系,具体如下:
上述的pcr反应液是由用于乙型肝炎病毒基因分型检测的组合物、dntps、pcr反应缓冲液和添加剂按比例混合而成,混合比例参考实施例2中的pcr反应体系;酶混合液中含dna聚合酶。
按15μl分装至pcr八联管。
(3)pcr扩增检测
向pcr八联管中加入核酸样本,按顺序设置阴性质控品、阳性质控品及样本名称,用abi7500(appliedbiosystems)运行如下的扩增程序,选择cy5,vic,fam通道,在60℃时收集荧光信号:
(4)检测结果判读(根据扩增曲线及ct值判断)
在b/c/d混合型作为阳性对照,见图6,及阴性对照正常的前提下,进行结果判读,具体如下表:
表1为不同结果的判读
(5)结果分析
共检测199例hbv阳性临床血清样本,其中d基因型的检测结果,本发明中所述方法与z品牌试剂盒检测结果完全一致,共14例;本发明检出58例c基因型,其中57例与z品牌试剂盒一致,另有1例z品牌试剂盒检出为b基因型;本发明检出126例b基因型,其中121例与z品牌试剂盒完全一致,另外5例z品牌试剂盒检出为b/c/d之外的基因型。综上所述,结合下表,本发明与z品牌试剂盒相比,b基因型符合率96.03%,c基因型符合率98.28%,d基因型符合率100%,b/c/d之外的基因型符合率100%,总符合率96.98%。
表2为本发明试剂盒与其他试剂盒的检测结果对比
实施例4
对实施例3中检测的与其他品牌基因分型检测结果不一致的样本利用另外的引物对进行pcr测序验证,具体如下:
(1)配制hbv-bc型通用测序引物pcr反应液
其中,hbv-bc型通用测序引物如下:
(2)加入样本核酸
向上述pcr反应液中分别加入1μl需测序验证的样本核酸(本发明检测为b型,z品牌检测为其它基因型的样本核酸;本发明检测为c型,z品牌检测为b型的样本核酸)。
(3)pcr扩增
用bio-radc1000pcr仪运行如下的扩增程序
(4)基因分型分析
利用美国国立生物技术信息中心(ncbi)的在线基因分型软件,对测序结果进行分析。
(5)结果如表3所示
表3为与其他品牌检测结果不同的样本的测序结果
检测结果显示:本发明试剂盒检出为c基因型但z品牌试剂盒检出b基因型的样本为c基因型;本发明试剂盒检出为b基因型但z品牌试剂盒检出其它基因型的样本为b基因型。综上,即本发明对上述199例临床样本的检测的结果与测序结果一致。因此可以认为本发明的检测准确性高。
综上,本发明的试剂盒检测结果准确性较高。
应该理解到披露的本发明不仅仅限于描述的特定的方法、方案和物质,因为这些均可变化。还应理解这里所用的术语仅仅是为了描述特定的实施方式方案的目的,而不是意欲限制本发明的范围,本发明的范围仅受限于所附的权利要求。
本领域的技术人员还将认识到,或者能够确认使用不超过常规实验,在本文中所述的本发明的具体的实施方案的许多等价物。这些等价物也包含在所附的权利要求中。
序列表
<110>迈克生物股份有限公司
<120>一种用于乙型肝炎病毒基因分型检测的组合物、试剂盒及其方法
<130>mb20181044
<160>9
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
gcagtggaactccaccacttt21
<210>2
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>2
agggtccccagtcttcgat19
<210>3
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>3
ccagttcaggaacagtgagccctgc25
<210>4
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>4
ggactcataaggtgggaaactttact26
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
agggcccacatattgttgac20
<210>6
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctgaktggcaaactccctcytttcctc27
<210>7
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>7
tcttcaaccaccagcacgg19
<210>8
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>8
cccactcccataggaattttc21
<210>9
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>9
tatccctcctgttgctgtaccaaacct27
- 还没有人留言评论。精彩留言会获得点赞!