在环状分子上具备具有聚环氧烷链或其衍生物的取代基的聚轮烷和其制造方法与流程
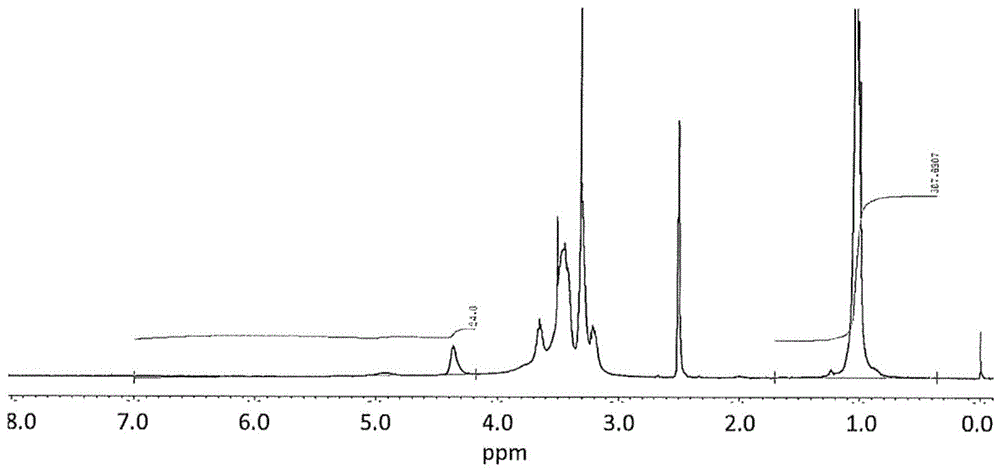
本发明涉及:在环状分子上具备具有聚环氧烷链或其衍生物的取代基的聚轮烷、具有该聚轮烷的材料和该聚轮烷的制造方法。
背景技术:
:聚轮烷由于环状分子相对于轴分子可移动的特殊的结构而备受关注,通过在环状分子上具备各种取代基,从而使其特性发生变化。例如,专利文献1和2公开了如下技术:对聚轮烷的环状分子赋予由单体接枝聚合而成的接枝链。具体而言,专利文献1公开了一种聚轮烷,其是聚轮烷的环状分子被-m-a、-m-b和-c的修饰基团所修饰而成的。此处公开了,m为式iv或式v所示的平均聚合度(n)为1~20的修饰基团,该修饰基团为聚酯或聚酰胺结构、具体地为聚己内酯或聚己内酰胺。另外,专利文献2公开了一种聚轮烷,该聚轮烷的环状分子具有自由基聚合引发位点。公开了一种聚轮烷,其具有通过该自由基聚合引发位点而由自由基聚合性单体聚合而成的接枝链。由单体的聚合形成的接枝链具体为聚丙烯酸酯链。进而,专利文献3公开了一种交联聚轮烷,其是聚轮烷彼此通过化学键键合而成的,公开了该聚轮烷的环糊精的一部分羟基通过非离子性键合基团而键合。作为非离子性键合基团,公开了2-羟基丙基。另外,专利文献4公开了聚轮烷的环糊精的一部分羟基被式(1)所示的取代基、例如2-羟基丁基取代基等所取代。然而,专利文献1~4缺乏耐水解性且在耐久性上存在问题,和/或存在缺乏与聚轮烷以外的材料的相容性·亲和性的问题。即,专利文献1或专利文献2中,即使环状分子具有接枝链,也为聚酯结构或聚酰胺结构(专利文献1),或为聚丙烯酸酯结构(专利文献2),缺乏耐水解性且在耐久性上存在问题。另外,专利文献3和4中,由于环状分子不具有接枝链,因此无法得到与期望材料的相容性、亲和性。现有技术文献专利文献专利文献1:wo2009/145073。专利文献2:wo2009/136618。专利文献3:wo2005/080469。专利文献4:wo2013/099842。技术实现要素:发明要解决的问题因此,本发明的目的在于,提供:具有耐久性、特别是耐水解性、且保持与期望的材料例如除了聚轮烷以外的聚合物材料的相容性的聚轮烷。另外,在上述目的的基础上,本发明的目的在于,提供:具有该聚轮烷的材料。进而,除上述目的之外,或在上述目的的基础上,本发明的目的在于,提供:具有该聚轮烷的交联体。另外,除上述目的之外,或在上述目的的基础上,本发明的目的在于,提供:具有该聚轮烷、该材料和/或该交联体的成型品。进而,除上述目的之外,或在上述目的的基础上,本发明的目的在于,提供:该聚轮烷、该材料、该交联体和/或该成型品的制造方法。用于解决问题的方案本发明人等发现了如下发明。<1>一种聚轮烷,其特征在于,其为在环状分子的开口部被直链状分子以穿串状包接而成的准聚轮烷的两端以前述环状分子不会脱离的方式配置封端基而得到的聚轮烷,环状分子具有下述式i所示的取代基,(式i中,r1为选自由-ch3、-ch2-ch3、-ch2-o-ch3、-ch2-o-ch2-ch3和-ch2-o-ch-(ch3)2、-苯基组成的组中的至少1种基团,r2为选自由h、-ch3、-oconh-(ch2)3-ch3、-oconh-c18h37和-coch3组成的组中的至少1种基团,n为加成于环状分子上的聚环氧烷链或其衍生物的表观上的聚合度,其值为1.1~10.0)。<2>上述<1>中,n的值可以为2.0~8.0,优选3.0~6.0。<3>上述<1>或<2>中,r1可以为选自由-ch3、-ch2-ch3和-ch2-o-ch2-ch3组成的组中的至少1种基团,优选为选自由-ch3和-ch2-ch3组成的组中的至少1种基团。<4>上述<1>~<3>中的任一者中,r2可以为选自由h、-oconh-(ch2)3-ch3、-oconh-c18h37和-coch3组成的组中的至少1种基团,优选为选自由h和-oconh-(ch2)3-ch3组成的组中的至少1种基团。<5>一种聚轮烷b的制造方法,其通过具备如下工序从而得到环状分子具有上述式i所示的取代基的聚轮烷b:工序(a),准备在环状分子的开口部被直链状分子以穿串状包接而成的准聚轮烷的两端以前述环状分子不会脱离的方式配置封端基而得到的聚轮烷a;和工序(b),使下述式ii(式ii中,r1具有与上述相同的定义)所示的化合物与聚轮烷a反应,在环状分子上设置上述式i(式i中,r1、r2和n具有与上述相同的定义)所示的取代基。<6>上述<5>的(b)工序中,可以在i)超强碱或ii)聚合引发剂的存在下进行反应。<7>一种材料,其含有上述<1>~<4>中的任一聚轮烷。<8>一种材料,其为具有上述<1>~<4>中的任一聚轮烷和除了上述<1>~<4>中的任一聚轮烷以外的物质的材料,前述聚轮烷的至少一部分与前述物质的至少一部分直接结合或间接结合。<9>一种成型品,其是具有上述<1>~<4>中的任一聚轮烷而形成的。<10>一种成型品,其是具有上述<7>或<8>的材料而形成的。发明的效果根据本发明,可以提供:具有耐久性、特别是耐水解性、且保持与期望的材料例如除了聚轮烷以外的聚合物材料的相容性的聚轮烷。另外,根据本发明,在上述效果的基础上,可以提供:具有该聚轮烷的材料。进而,根据本发明,除上述效果之外,或在上述效果的基础上,可以提供:具有该聚轮烷的交联体。另外,根据本发明,除上述效果之外,或在上述效果的基础上,可以提供:具有该聚轮烷、该材料和/或该交联体的成型品。进而,根据本发明,除上述效果之外,或在上述效果的基础上,可以提供:该聚轮烷、该材料、该交联体和/或该成型品的制造方法。附图说明图1为示出实施例4中得到的聚轮烷a4的1h-nmr(dmso-d6)的谱图的图。图2为示出比较例1中得到的聚轮烷c1的1h-nmr(dmso-d6)的谱图的图。具体实施方式以下,对本申请中记载的发明详细进行说明。<本发明的聚轮烷>本申请提供:环状分子具备具有聚环氧烷链或其衍生物的取代基、具体而言下述式i所示的取代基的聚轮烷。由于具有上述式i所示的取代基,因而该取代基不同于聚酯结构或聚酰胺结构,具有耐水解性,因此本发明的聚轮烷能够具备耐久性。另外,通过具有下述式i所示的取代基、即聚环氧烷链或其衍生物,从而能够发挥如下效果。i)对溶剂的溶解性改善,使用本发明的聚轮烷时可以使用各种溶剂。ii)可以保持聚轮烷与期望的材料的相容性。具体而言能够保持本发明的聚轮烷与除了该聚轮烷以外的聚合物的相容性。由此,可以期待与期望的材料例如除了聚轮烷以外的聚合物的配混、共混的扩展、材料的复合化等所带来的高功能化。iii)能够控制具有本发明的聚轮烷的材料的力学特性。例如通过与聚环氧烷链或其衍生物的柔软性的协同效果,可以期待该柔软性的改善、耐热性改善、介电常数等的特性改善。上述式i中,n为加成于环状分子上的聚环氧烷链或其衍生物的表观上的聚合度。所加成的聚环氧烷链或其衍生物有时存在离差,因此,n的值用小数点表示。n的值可以为1.1~10.0,优选2.0~8.0、更优选3.0~6.0。n的值可以由本发明的聚轮烷的1h-nmr的测定结果即1h-nmr谱图算出。然而,1h-nmr谱图中,由于大量的峰重叠而难以算出实际的聚合度。因此,将n定义为表观上的聚合度。作为n的算出方法,以如下情况为例进行说明,所述情况为:使原料聚轮烷a(以下,有时简记作“聚轮烷a”)与环氧烷单体或其衍生物(以下,有时简记作“单体c”)反应,得到本发明的、环状分子具备具有聚环氧烷链或其衍生物的取代基的聚轮烷b(以下,有时简记作“改性聚轮烷b”)。另外,对原料聚轮烷a的环状分子为α-环糊精(以下,简记作“α-cd”)的情况进行说明。n与如下所示的“加成率”为相同的数值。此处,“加成率”是指,相对于原料“聚轮烷a”中的环状分子即α-cd的羟基的数量,“改性聚轮烷b”中的“单体c”的数量。要反应的“单体c”为具有环氧乙烷基(环氧基)的结构,多个单体可以依次与1个羟基反应。因此,产生加成率相对于原料的羟基超过100%的情况。上述情况下,对原料“聚轮烷a”的环状分子即α-cd羟基的至少一部分赋予聚环氧烷链或其衍生物。例如,加成率120%的情况下,平均而言α-cd的18个羟基的20%加成于多个“单体c”。此处,实际上,参照本发明的聚轮烷中得到的1h-nmr谱图的同时对“加成率”进行说明。图1为后述的实施例4中得到的、本发明的聚轮烷、即具有聚环氧丙烷链的聚轮烷的1h-nmr谱图。该谱图中,1ppm处的峰源自环氧丙烷基的-ch3。将1ppm处的峰的积分值设为l。另外,4.2~6.5ppm处的峰源自多种h,具体而言,源自“α-cd的羟基的h”、“反应了的环氧丙烷的末端羟基的h”和“α-cd的葡萄糖位点的c1的h”。将4.2~6.5ppm处的峰的积分值设为m。如果将环氧丙烷的加成率设为y,则1ppm处的峰(源自环氧丙烷基的-ch3)的积分值l为“y×3×18”。另一方面,4.2~6.5ppm处的峰的积分值m为源自“α-cd的羟基的h”的“(1-y)×18”、与源自“反应了的环氧丙烷的末端羟基的h”的“y×18”、与源自“α-cd的葡萄糖位点的c1的h”的“6”的合计。积分值l与m的比率为以下的式子,分别代入测定结果(l为307.69、m为24.0),从而可以算出加成率y。l:m=(y×3×18):{(1-y)×18+y×18+6}54y:24=307.69/24.0。加成率y=5.69(569%)。如上述,加成率为与n相同的值,因此,表观的聚合度n成为5.69。图2为后述的比较例1中得到的聚轮烷的1h-nmr谱图。由1ppm处的峰的积分值l(26.88)和4.2~6.5ppm处的峰的积分值m(24.0)算出加成率y=0.497(50%),表观的聚合度n成为0.5。需要说明的是,也可以由“改性聚轮烷b”的重均分子量与“原料聚轮烷a”的重均分子量之差、即“重均分子量的增加量”;和“原料聚轮烷a”的“包接率”(每一分子“改性聚轮烷b”中的α-cd的数量)来测定加成率、即表观的聚合度n。然而,由于“改性聚轮烷b”和“原料聚轮烷a”的极性的差异、它们对gpc的溶剂的溶解性的差异等,由“重均分子量的增加量”算出加成率可以说缺乏准确性。需要说明的是,“包接率”可以如下求出。“包接率”表示如下值:“原料聚轮烷a”和“改性聚轮烷b”中,实际配置的环状分子(α-cd)相对于环状分子(α-cd)以最高密度配置的情况下的个数的比率。此处,α-cd的最高密度(最大包接量)由直链状分子的长度和环状分子的厚度来确定。直链状分子为聚乙二醇(peg)的情况下,可以由macromolecules1993,26,5698-5703中记载的方法求出。聚乙二醇的-(o-ch2-ch2)2-的2个重复单元的量相当于α-cd的分子厚度。例如,数均分子量35000的peg的情况下,α-cd的最大包接量成为35000/88=398个,数均分子量35000的peg上包接有398个的α-cd的情况下,包接率成为100%。“α-cd的包接率”如下求出:将上述α-cd的最大包接量时的peg的h作为基准,由1h-nmr,根据源自α-cd的h与peg的h的积分值之比求出。式i中,r1为选自由-ch3、-ch2-ch3、-ch2-o-ch3、-ch2-o-ch2-ch3和-ch2-o-ch-(ch3)2、-苯基组成的组中的至少1种基团,优选选自由-ch3、-ch2-ch3和-ch2-o-ch2-ch3组成的组中的至少1种基团,更优选选自由-ch3和-ch2-ch3组成的组中的至少1种基团。式i中,r2为选自由h、-ch3、-oconh-(ch2)3-ch3、-oconh-c18h37和-coch3组成的组中的至少1种基团,优选选自由h、-oconh-(ch2)3-ch3、-oconh-c18h37和-coch3组成的组中的至少1种基团,更优选选自由h和-oconh-(ch2)3-ch3组成的组中的至少1种基团。本发明的聚轮烷除具有上述式i所示的取代基之外,还具有环状分子、直链状分子和封端基而形成,其是在环状分子的开口部被直链状分子以穿串状包接而成的准聚轮烷的两端以环状分子不会脱离的方式配置封端基而形成的。以下,对作为聚轮烷中所含的各构成要素的、环状分子、直链状分子和封端基进行说明。<<环状分子>>环状分子只要为环状、具有开口部、可被直链状分子以穿串状包接就没有特别限定。环状分子依赖于期望的后述的材料、期望的后述的交联体、期望的后述的成型品等,可以具有羟基(-oh基)。羟基(-oh基)依赖于期望的材料、期望的交联体、期望的成型品的特性等,可以直接结合于环状分子的环状骨架,也可以通过第1间隔物与环状骨架结合。另外,环状分子依赖于期望的材料、期望的交联体、期望的成型品的特性等,可以具有:其他基团例如1)甲氧基、乙氧基、乙酰基、丁基氨基甲酰基那样的疏水性修饰基团;2)选自由-nh2、-cooh和-sh组成的组中的基团;3)选自由丙烯酰基、甲基丙烯酰基、苯乙烯基、乙烯基、亚乙烯基、含马来酸酐的官能团的聚合性基团组成的组中的基团;等。作为环状分子,例如可以为选自由α-环糊精、β-环糊精和γ-环糊精组成的组。<<直链状分子>>直链状分子只要是能在使用的环状分子的开口部以穿串状包接就没有特别限定。例如,作为直链状分子,选自由聚乙烯醇、聚乙烯基吡咯烷酮、聚(甲基)丙烯酸、纤维素系树脂(羧甲基纤维素、羟乙基纤维素、羟丙基纤维素等)、聚丙烯酰胺、聚环氧乙烷、聚乙二醇、聚丙二醇、聚乙烯醇缩醛系树脂、聚乙烯基甲醚、聚胺、聚乙烯亚胺、酪蛋白、明胶、淀粉等和/或它们的共聚物、聚乙烯、聚丙烯、以及与其它烯烃系单体的共聚树脂等聚烯烃系树脂、聚酯树脂、聚氯乙烯树脂、聚苯乙烯、丙烯腈-苯乙烯共聚树脂等聚苯乙烯系树脂、聚甲基丙烯酸甲酯、(甲基)丙烯酸酯共聚物、丙烯腈-丙烯酸甲酯共聚树脂等丙烯酸类树脂、聚碳酸酯树脂、聚氨酯树脂、氯乙烯-乙酸乙烯酯共聚树脂、聚乙烯醇缩丁醛树脂等;以及它们的衍生物或改性物、聚异丁烯、聚四氢呋喃、聚苯胺、丙烯腈-丁二烯-苯乙烯共聚物(abs树脂)、尼龙等聚酰胺类、聚酰亚胺类、聚异戊二烯、聚丁二烯等聚二烯类、聚二甲基硅氧烷等聚硅氧烷类、聚砜类、聚亚胺类、聚乙酸酐类、聚脲类、聚硫化物(polysulfide)类、聚磷腈类、聚酮类、聚亚苯基类、聚卤代烯烃类、以及它们的衍生物组成的组为宜。例如选自由聚乙二醇、聚异戊二烯、聚异丁烯、聚丁二烯、聚丙二醇、聚四氢呋喃、聚二甲基硅氧烷、聚乙烯、聚丙烯、聚乙烯醇及聚乙烯基甲醚组成的组为宜。特别适宜为聚乙二醇。直链状分子的重均分子量为1000以上,优选为3000~100000,更优选为6000~50000为宜。聚轮烷中,(环状分子、直链状分子)的组合适宜为(源自α-环糊精、源自聚乙二醇)。<封端基>封端基只要是配置于准聚轮烷的两端、以使用的环状分子不会脱离的方式发挥作用的基团就没有特别限定。例如,作为封端基,选自由:二硝基苯基类、环糊精类、金刚烷基类、三苯甲基类、荧光素类、倍半硅氧烷类、芘类、取代苯类(作为取代基,可举出:烷基、烷氧基、羟基、卤素、氰基、磺酰基、羧基、氨基、苯基等,但并不限定于这些。取代基可以存在1个或存在多个。)、任选被取代的多核芳香族类(作为取代基,可举出与上述相同的物质,但并不限定于这些。取代基可以存在1个或存在多个。)、以及甾体类组成的组。需要说明的是,优选为选自由:二硝基苯基类、环糊精类、金刚烷基类、三苯甲基类、荧光素类、倍半硅氧烷类、以及芘类组成的组,更优选为金刚烷基类或环糊精类为宜。<具有本发明的聚轮烷的材料>本申请提供具有上述本发明的聚轮烷的材料。该材料可以具有除了上述本发明的聚轮烷以外的物质。作为该物质,可以举出能与聚轮烷结合的物质、例如聚(甲基)丙烯酸酯、聚酰胺、聚酯、聚醚、聚烯烃、聚二烯、聚硅氧烷、聚苯乙烯、聚氨酯、聚脲、聚碳酸酯、聚酰胺酸和它们的衍生物等,但不限定于这些。对于本发明的材料,该物质的至少一部分与本发明的聚轮烷的至少一部分直接结合或间接结合而形成交联体。此处,“能间接结合的物质”是指:使用交联剂等夹杂物质,通过该交联剂等夹杂物质而能与聚轮烷结合的物质。另一方面,“能直接结合的物质”是指:在不使用上述夹杂物质的情况下,在热、催化剂、引发剂等的存在下,能与聚轮烷结合的物质。例如,该物质为聚丙烯酸的情况下,在催化剂的存在下,能与聚轮烷直接结合。另外,该物质为丙二醇的情况下,在聚丙二醇与本发明的聚轮烷的羟基之间,通过作为交联剂的六亚甲基二异氰酸酯那样的多官能异氰酸酯化合物而能间接结合。需要说明的是,作为交联剂,只要为使聚轮烷与除了聚轮烷以外的物质反应且具有官能团的化合物就没有特别限定。作为交联剂的例子,可以举出多官能异氰酸酯化合物、多官能羧酸、多官能羧酸酐、多官能环氧化合物、多官能碳二亚胺、多元醇、多胺等,但不限定于这些。<具有本发明的聚轮烷的成型品>本申请提供:具有上述本发明的聚轮烷而形成的成型品。另外,本申请提供:具有上述材料而形成的成型品。进而,本申请提供:具有上述材料、特别是交联体而形成的成型品。这些成型品可以具有对成型品赋予期望的特性的各种成分。作为这些成分,可以举出增塑剂、表面活性剂、uv吸收剂、颜料、抗氧化剂、抗菌剂、粘度调节剂、增强纤维、微粒、阻燃剂等,但不限定于这些。本发明的聚轮烷、材料、交联体和/或成型品出于其特性有各种应用。作为应用,例如可以举出粘合剂·粘接剂、耐裂纹性膜、防振·抑振·隔振材料、涂料、涂覆剂、密封材料、墨添加物·粘结剂、电绝缘材料、电气·电子部件材料、光学材料、摩擦控制剂、化妆品材料、橡胶添加剂、树脂改性·增韧剂、流变控制剂、增稠剂、纤维、医疗用生物材料、机械·汽车材料、建筑材料、衣服·运动用品等,但不限定于这些。<本发明的聚轮烷的制造方法>上述本发明的聚轮烷可以通过如下方法而制造。即,通过具备如下工序从而可以得到作为本发明的聚轮烷的聚轮烷b:工序(a),准备在环状分子的开口部被直链状分子以穿串状包接而成的准聚轮烷的两端以环状分子不会脱离的方式配置封端基而得到的聚轮烷a;工序(b),使下述式ii(式ii中,r1具有与上述相同的定义)所示的化合物与前述聚轮烷a反应,在环状分子上设置下述式i(式i中,r1、r2和n具有与上述相同的定义)所示的取代基。<<工序(a)>>工序(a)为准备聚轮烷a的工序。该工序可以通过以往公知的方法而进行,例如,可以以wo2005/052026或wo2013/147301中记载的方法准备聚轮烷a。需要说明的是,通过市售购买聚轮烷a,从而可以进行工序(a)。<<工序(b)>>工序(b)为使上述式ii所示的化合物与聚轮烷a反应,在环状分子上设置上述式i所示的取代基的工序。需要说明的是,r2为除了h以外的情况下,可以在使上述式ii所示的化合物与聚轮烷a反应后,对其末端羟基(r=h的末端羟基)的全部或一部分赋予相应的r基。工序(b)可以依赖于使用的聚轮烷a、使用的化合物来确定反应条件,但可以在i)超强碱的存在下或在ii)聚合引发剂的存在下进行反应。作为i)超强碱,可以举出磷腈碱、胍碱、含磷二环有机非离子超强碱(proazaphosphatran)、金属碱,但不限定于这些。特别优选使用磷腈碱。另外,使用超强碱的情况下,作为其条件,可以举出20℃~100℃、常压或加压的条件下,但不限定于这些。作为ii)聚合引发剂,可以举出四正丁基氟化铵,但不限定于这些。另外,使用聚合引发剂时,可以与强碱组合而使用。作为该强碱,可以举出二氮杂双环十一碳烯(dbu)、1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)、三甲胺、n,n-二甲基-4-氨基吡啶、氢氧化钠、氢氧化钾等,但不限定于这些。另外,使用聚合引发剂的情况下,作为其条件,可以举出20℃~100℃、常压或加压的条件下,但不限定于这些。工序(b)可以使用进一步的溶剂,也可以不使用进一步的溶剂。使用进一步的溶剂的情况下,作为该溶剂,可以举出二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺、n-甲基-2-吡咯烷酮、甲苯、二甲苯、甲乙酮等,但不限定于这些。工序(b)可以在常压~加压下进行反应,加压时能够促进反应。反应温度依赖于使用的聚轮烷a、使用的化合物、使用的溶剂等,但可以在室温~130℃下进行。<本发明的材料的制造方法>可以使用上述中得到的、本发明的聚轮烷来制造材料。材料的制造方法依赖于除了本发明的聚轮烷以外使用的物质。例如,作为除了本发明的聚轮烷以外使用的物质,可以举出上述物质,使用它们的情况下,如上述,本发明的聚轮烷的至少一部分与该物质的至少一部分能够直接结合或间接结合,能够形成交联体。如果示例使用丙二醇作为该物质的情况进行说明,则(c)-1.在作为交联剂的六亚甲基二异氰酸酯那样的多官能异氰酸酯化合物的存在下,使本发明的聚轮烷与除了上述聚轮烷以外的物质、具体而言与丙二醇和六亚甲基二异氰酸酯那样的多官能异氰酸酯化合物反应,从而本发明的聚轮烷的至少一部分与丙二醇的至少一部分可以通过六亚甲基二异氰酸酯那样的多官能异氰酸酯化合物间接结合,能够形成交联体。需要说明的是,交联剂可以使用上述物质。另外,(c)-2.在催化剂、引发剂的存在下,使本发明的聚轮烷与除了上述聚轮烷以外的物质反应,从而本发明的聚轮烷的至少一部分与该物质的至少一部分能够直接结合,也能够形成交联体。实施例以下,基于实施例对本发明进一步详细地进行说明,但本发明不限定于本实施例。以下的实施例中,依据wo2005/052026或wo2013/147301中记载的方法准备聚轮烷apr20(直链状分子:pegmw20000、环状分子:α-cd、封端基:金刚烷基、重均分子量mw=83600)。另外,依据wo2005/052026或wo2013/147301中记载的方法准备聚轮烷apr35(直链状分子:pegmw35000、环状分子:α-cd、封端基:金刚烷基;重均分子量mw=95000)。(实施例1)在反应容器中,使聚轮烷apr2070g溶解于1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)10ml、1n四正丁基氟化铵(tbaf)7.5ml的混合溶液,边搅拌边在室温(25℃)下滴加环氧丙烷40ml。在室温下持续搅拌72小时后,将得到的反应产物用透析膜进行纯化并干燥,得到纯化物a130g。以1h-nmr进行分析,结果环氧丙烷的加成率为113%(相对于α-cd的羟基)。因此,确认了对α-cd的至少一部分羟基赋予了聚环氧丙烷接枝链。如上述,加成率与n为相同的值,因此,n=1.1。(实施例2)实施例1中,使用dbn20ml代替dbn10ml,使搅拌为48小时,除此之外,通过与实施例1同样的方法得到纯化物a232g。以1h-nmr进行分析,结果环氧丙烷的加成率为112%(相对于α-cd的羟基)。因此,确认了对α-cd的至少一部分羟基赋予了聚环氧丙烷接枝链。n=1.1。(实施例3)实施例1中,使搅拌为144小时,除此之外,通过与实施例1同样的方法得到纯化物a338g。以1h-nmr进行分析,结果环氧丙烷的加成率为204%(相对于α-cd的羟基)。因此,确认了对α-cd的至少一部分羟基赋予了聚环氧丙烷接枝链。n=2.0。(实施例4)将聚轮烷apr201g导入至环氧丙烷20ml,边搅拌边导入dbn2ml、1ntbaf1ml。以30℃持续反应72小时后,将得到的反应产物用透析膜进行纯化并干燥,得到纯化物a43.3g。以1h-nmr进行分析,结果环氧丙烷的加成率为570%(相对于α-cd的羟基)。以gpc测定,结果重均分子量mw:168000、分散mw/mn:1.2。确认了对α-cd的羟基赋予聚环氧丙烷接枝链。n=5.7。(比较例1)使聚轮烷apr3510g溶解于1.5nnaoh水溶液50ml,缓慢滴加环氧丙烷200g后,以25℃反应72小时。将反应液用盐酸中和,用透析膜纯化并干燥,得到纯化物c111.5g。以1h-nmr进行分析,结果环氧丙烷的加成率为50%。n为0.5。(实施例5)将聚轮烷apr205g导入至环氧丁烷50ml,边搅拌边导入dbn10ml、1ntbaf5ml。以50℃持续反应72小时后,对得到的反应产物进行3次水洗并干燥,得到纯化物a512.0g。以gpc测定,结果重均分子量mw:173000、分散mw/mn:1.2。以1h-nmr进行分析,结果环氧丁烷的加成率为131%(相对于α-cd的羟基)。确认了对α-cd的羟基赋予了聚环氧丁烷接枝链。n=1.3。(实施例6)将聚轮烷apr205g导入至环氧丁烷50ml,边搅拌边导入三乙胺40ml、1ntbaf20ml。以50℃持续反应48小时后,对得到的反应产物进行3次水洗并干燥,得到纯化物a613g。以gpc测定,结果重均分子量mw:133000、分散mw/mn:1.3。以1h-nmr进行分析,结果环氧丁烷的加成率为116%(相对于α-cd的羟基)。确认了对α-cd的羟基赋予了聚环氧丁烷接枝链。n=1.2。(实施例7)将聚轮烷apr205g导入至乙基缩水甘油醚200ml,边搅拌边导入dbn10ml、1ntbaf20ml。以60℃持续反应48小时后,对得到的反应产物进行3次水洗并干燥,得到纯化物a718g。以gpc测定,结果重均分子量mw为191000,分散mw/mn为1.3。以1h-nmr进行分析,结果乙基缩水甘油醚的加成率为112%(相对于α-cd的羟基)。确认了对α-cd的羟基赋予了-(ch2ch(och2ch3)o)n-h接枝链。n=1.1。(实施例8)使聚轮烷apr201g溶解于二甲基亚砜(dmso)10ml,导入至环氧丙烷10ml,边搅拌边导入dbn2ml、1ntbaf1ml。以30℃持续反应72小时后,对得到的反应产物进行3次水洗并干燥,得到纯化物a83.2g。以gpc测定,结果重均分子量mw:168000、分散mw/mn:1.3。以1h-nmr进行分析,结果环氧丙烷的加成率为142%(相对于α-cd的羟基)。确认了对α-cd的羟基赋予了聚环氧丙烷接枝链。n=1.4。(比较例2)实施例8中,不使用dbn,除此之外,通过与实施例8同样的方法得到纯化物c20.8g。以gpc测定,结果重均分子量mw:81600、分散mw/mn:1.3。以1h-nmr进行分析,结果环氧丙烷的加成率为0%(相对于α-cd的羟基)。即,反应未进行。(实施例9)使聚轮烷apr351g溶解于dmso10ml,导入磷腈p4-叔丁基0.8m己烷溶液(aldrich制)1.34ml、环氧丁烷5g,以60℃反应20小时。对产物进行3次水洗并干燥,得到纯化物a93.1g。通过gpc分析,重均分子量mw:258000、mw/mn:1.3。以1h-nmr进行分析,结果环氧丁烷的加成率为126%(相对于α-cd的羟基)。确认了对α-cd的羟基赋予了聚环氧丁烷接枝链。n=1.3。(比较例3)实施例9中,使用二氮杂双环十一碳烯(dbu)1ml代替磷腈p4-叔丁基0.8m己烷溶液(aldrich制)1.34ml,除此之外,通过与实施例9同样的方法得到纯化物c31.3。通过gpc分析,重均分子量mw::125000、mw/mn:1.3。以1h-nmr进行分析,结果环氧丁烷的加成率为23.1%(相对于α-cd的羟基)。即,n=0.23。(实施例10)使用实施例4中得到的纯化物a4与比较例1中得到的纯化物c1,进行了对各种材料的溶解性、相容性。按照以下的基准进行评价。○如下:对于对象材料,纯化物溶解2wt%以上,相容。×如下:对于对象材料,纯化物不溶。将其结果示于表1。需要说明的是,ppg400、ppg700、ppg1000为数均分子量400、700、1000的聚丙二醇(和光纯药制)。由表1表明,作为本发明的聚轮烷的纯化物a1与比较例1的纯化物c1相比,对ppg材料的相容性飞跃性地得到了改善。[表1]表1针对作为本发明的聚轮烷的纯化物a1与比较例1的纯化物c1的跟各溶剂的相容性材料a1c1ppg400○×ppg700○×ppg1000○a)×a)水○b)○a)在加热下溶解·相容b)表示下限临界溶液温度(lcst)。(实施例11)在反应容器中放入1,3-双(异氰酸根合甲基)环己烷(三井化学株式会社制takenate600)9.0g,在氮气气流下边搅拌边升温至80℃。对上述反应容器缓慢滴加聚丙二醇700(和光纯药制)7.1g后,进一步搅拌3小时,得到具有在两末端经异氰酸酯基改性的聚丙二醇的聚合物16g(聚合物p)。将所得聚合物p0.5g与实施例4中得到的具有聚环氧丙烷接枝链的聚轮烷2.0g迅速混合,得到均匀的混合液。将该溶液涂布于玻璃基板,以80℃加热固化30分钟。得到柔软且透明的弹性体片。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1