新型两歧双歧杆菌菌株和菌株来源的多糖
本发明涉及一种诱导调节性t(treg)细胞的两歧双歧杆菌,一种源自两歧双歧杆菌的多糖,和一种产生所述多糖的益生菌菌株;并且更具体地涉及一种包含β-1-6-葡聚糖作为活性成分的多糖,一种产生β-1-6-葡聚糖的益生菌菌株,一种包含所述多糖或所述菌株作为活性成分的、用于减轻免疫疾病或炎性疾病的食物或治疗剂,一种通过用所述多糖或所述菌株处理来产生诱导的调节性t(itreg)细胞的方法,以及一种包含通过所述方法产生的诱导的调节性t细胞的、用于预防或治疗免疫疾病或炎性疾病的细胞治疗剂。
背景技术:
在哺乳动物的胃肠道中,构成“微生物群”的许多细菌物种是共生的。微生物群的变化与各种疾病(如过敏性疾病以及自身免疫障碍和胃肠道炎性障碍)密切相关。与不含特定病原体(spf)的小鼠相比,无菌(gf)小鼠显示出对淋巴组织形成有异常应答和免疫应答(macpherson和harris,naturereviewsimmunology4:478-485,2004),并且可以通过引入共生微生物克服这些现象(mazmanian等人,cell122:107-118,2005)。肠道微生物调节cd4t细胞特定谱系例如t辅助17(th17)细胞或调节性t(treg)细胞的发育和分化(ivanov和honda,cellhostµbe12:496-508,2012;wu和wu,gutmicrobes3:4-14,2012)(atarashi等人,science331:337-341,2011;macpherson和harris,naturereviewsimmunology4:478-485,2004;round和mazmanian,naturereviewsimmunology9:313-323,2009)。treg细胞是cd4+t细胞的具有抑制功能的亚组,并以转录因子foxp3的表达为特征(s.hori等人,science299:1057-1061,2003)。treg细胞通常在胸腺中形成(ntreg),但也可以在正常cd4+细胞附近发生(ptreg)。
近来,已表明微生物群落的各个物种可形成宿主的免疫组分。换言之,treg和th17细胞相互作用,以调节宿主对各种抗原的免疫应答。例如,分节丝状细菌(sfb)在小肠中强烈诱导th17细胞,所述th17细胞促进全身自身免疫性并且在宿主对抗肠道病原体中起重要作用(gaboriau-routhiau等人,immunity31:677-689,2009;ivanov等人,cell139:485-498,2009;wu等人,immunity32:815-827,2010)。相比之下,已知一些构成肠道菌群的菌株和一些益生菌菌株可影响小鼠结肠中的treg细胞的分化、积累和功能(tanoue,t等人,naturereviewsimmunology16:295-309,2016)。与其他器官相比,在消化固有层(lp)中,尤其是在大肠中,发现了更多的表达转录因子foxp3(叉头盒p3)的cd4+调节性t细胞(treg)(atarashi等人,science331:337-341,2011)。多项研究表明,粘膜foxp3+treg的数量和功能受到某些肠道细菌的存在影响。属于梭菌iv、xiva和xviii簇的17种菌株的混合物改善了小鼠大肠中的treg细胞的分化、积累和功能(atarashi等人,nature500:232-236,2013)。每天用益生细菌(即双歧杆菌和乳杆菌)处理的小鼠通过诱导treg展现出改变的炎症状态(digiacinto等人,thejournalofimmunology174:3237-3246,2005;karimi等人,americanjournalofrespiratoryandcriticalcaremedicine179:186-193,2009;lyons等人,clinical&experimentalallergy40:811-819,2010)。人类共生的脆弱拟杆菌定殖于小鼠增强了产生treg细胞的th1和il-10(round和mazmanian,pnas107:12204-12209,2010;telesford等人,gutmicrobes6:234-242,2015)。先前的研究表明,irt5作为五种益生细菌的混合物,可以诱导treg细胞并抑制各种免疫疾病(chae等人,plosone7,e52119,2012;kwon等人,clinicalimmunology146:217-227,2013;kwon等人,pnas107:2159-2164,2010)。但是,treg细胞产生的基本分子机制尚不清楚。各种研究表明,细菌产生的代谢产物或细胞壁组分可以促进treg细胞的分化。例如,已经报道丁酸盐是由梭菌诱导结肠treg细胞的主要效应分子(furusawa等人,nature504:446-450,2013)。多糖a(psa)作为脆弱拟杆菌的两性离子多糖,已被鉴定为用于诱导产生treg的il-10的重要免疫调节剂(mazmanian等人,cell122:107-118,2005;ochoa-reparaz等人,thejournalofimmunology185:4101-4108,2010)。向患者给予不足的主要微生物可修复失调的微生物的失调。例如,据报道将粪便微生物群(fmt)从健康供体转移至患者对胃肠道疾病具有有益的作用。但是,由于安全问题,尚未批准将fmt作为一般治疗方法。另外,据报道,摄入足够量的包括益生菌在内的安全细菌可减轻各种免疫疾病。但是,有益微生物可能会根据患者的免疫状态而有所不同。一些患者需要抑制过度激活的免疫应答(即过敏或自身免疫疾病),而一些患者需要加强免疫系统(即癌症或病毒感染)。例如,当向类风湿性关节炎动物模型给予th17诱导型益生细菌双歧杆菌属时,关节炎症状加重(tzeguantan,113(50):e8141-e8150,2016)。因此,鉴定有益的微生物并发现其效应物的机制具有重要的治疗意义。
各种超免疫疾病,例如自身免疫和过敏性疾病,可以通过体内treg细胞的增强来调节。在本发明中,通过出于改善由稳定微生物诱导的treg细胞的目的筛选益生菌候选菌株,将两歧双歧杆菌pri1选择作为最佳候选。使用无菌小鼠(gf小鼠)系统鉴定了此细菌诱导产生食物性抗原或共生诱导的调节性t细胞(itreg细胞)的能力。两歧双歧杆菌pri1来源的效应分子包括作为代谢产物的丁酸盐以及乙酸盐。另外,根据本发明,源自两歧双歧杆菌pri1的细胞表面β葡聚糖/半乳聚糖多糖(csgg)在功能上抑制肠道炎症。
因此,诸位发明人进行了广泛的努力以发现诱导具有治疗免疫调节性疾病和炎性免疫疾病潜力的treg细胞的机制,结果是诸位发明人发现,所选择的益生细菌的细胞表面β葡聚糖/半乳聚糖多糖(csgg)是能够诱导产生itreg细胞的主要效应分子,并且确认由csgg诱导的itreg细胞能够抑制结肠炎,从而完成了本发明。
公开内容
技术问题
本发明的目的是提供包含诱导调节性t(treg)细胞的β-1-6-葡聚糖作为活性成分的多糖,以及产生所述多糖的益生菌菌株。
本发明的另一个目的是提供用于免疫调节的组合物,其包含所述多糖或菌株作为活性成分。
本发明的另一个目的是提供用于预防、治疗或减轻免疫疾病或炎性疾病的药物组合物和食物,所述药物组合物和食物包含所述多糖或菌株作为活性成分。
本发明的另一个目的是提供预防或治疗免疫疾病或炎性疾病的方法,所述方法包括给予包含所述多糖或菌株作为活性成分的组合物。
本发明的另一个目的是提供组合物在预防或治疗免疫疾病或炎性疾病中的用途,所述组合物包含所述多糖或菌株作为活性成分。
本发明的另一个目的是提供包含所述多糖或菌株作为活性成分的免疫抑制剂或免疫治疗剂。
本发明的另一个目的是提供使用所述多糖或菌株产生诱导的调节性t(itreg)细胞的方法。
本发明的另一个目的是提供用于预防、治疗或减轻免疫疾病或炎性疾病的细胞治疗剂,其中包含通过所述方法产生的诱导的调节性t(itreg)细胞作为活性成分。
本发明的另一个目的是提供预防或治疗免疫疾病或炎性疾病的方法,所述方法包括给予包含通过所述方法产生的诱导的调节性t细胞(itreg)作为活性成分的细胞治疗剂。
本发明的另一个目的是提供细胞治疗剂在预防或治疗免疫疾病或炎性疾病中的用途,其中所述细胞治疗剂包含通过所述方法产生的诱导的调节性t细胞(itreg)作为活性成分。
技术方案
为了实现上述目的,本发明提供了产生β-1-6-葡聚糖的新型益生菌菌株。
本发明还提供了包含β-1-6-葡聚糖作为活性成分的多糖。
本发明还提供了用于免疫调节的组合物,其包含所述多糖或菌株作为活性成分。
本发明还提供了用于预防或治疗免疫疾病或炎性疾病的药物组合物和治疗剂,所述药物组合物和治疗剂包含所述多糖或菌株作为活性成分。
本发明还提供了用于预防或减轻免疫疾病或炎性疾病的食物,其包含所述多糖或菌株作为活性成分。
本发明还提供了预防或治疗免疫疾病或炎性疾病的方法,所述方法包括给予包含所述多糖或菌株作为活性成分的组合物。
本发明还提供了组合物在预防或减轻免疫疾病或炎性疾病中的用途,其中所述组合物包含所述多糖或菌株作为活性成分。
本发明还提供了包含所述多糖或菌株作为活性成分的免疫抑制剂或免疫治疗剂。
本发明还提供了产生诱导的调节性t(itreg)细胞的方法,所述方法包括:用所述多糖或菌株处理树突细胞(dc)以获得调节性树突细胞(rdc);以及将所述rdc与cd4+t细胞共培养以诱导调节性t(treg)细胞。
本发明还提供了用于预防、治疗或减轻免疫疾病或炎性疾病的治疗剂,其包含通过所述方法产生的诱导的调节性t(itreg)细胞作为活性成分。
本发明还提供了预防或治疗免疫疾病或炎性疾病的方法,所述方法包括给予包含通过所述方法产生的诱导的调节性t(itreg)细胞作为活性成分的细胞治疗剂。
本发明还提供了细胞治疗剂在预防或治疗免疫疾病或炎性疾病中的用途,其中所述细胞治疗剂包含通过所述方法产生的诱导的调节性t(itreg)细胞作为活性成分。
附图说明
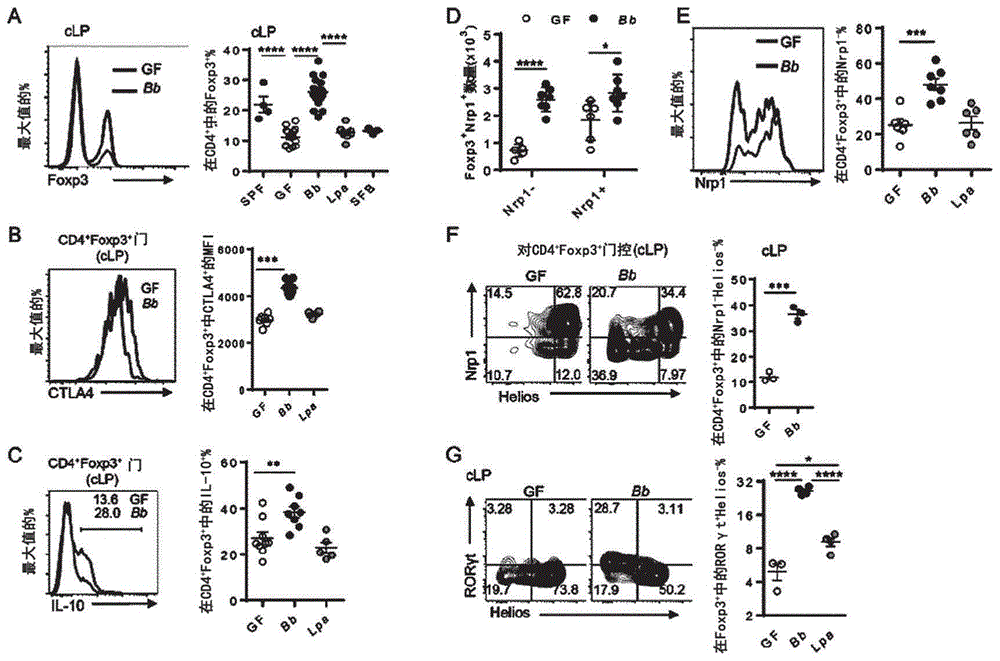
图1展示了由两歧双歧杆菌单定殖引起的结肠固有层中treg群体的增加。图1a至1c展示了在gf小鼠结肠或定殖有lpa或bb的小鼠结肠(clp)的treg细胞中cd4+foxp3+细胞、ctla4+和il10+的流式细胞术和百分比分析结果。图1d至1f展示了在定殖有细菌的gf小鼠的结肠中不同类型的treg细胞的绝对数量以及代表性流式细胞术图和信号。象限中的数字表示细胞百分比,并且图形中的圆圈表示与每个参数相对应的单独小鼠,数据表示3至5个独立实验(n≥3只小鼠),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01,***p<0.001,****p<0.0001(学生t检验)。
图2展示了确认两歧双歧杆菌pri1为treg诱导型细菌的结果。图2a和2b展示了在被选作促进treg诱导的细菌菌株的候选益生菌菌株两歧双歧杆菌pri1(bb)中的代表性il-10/il-12细胞因子(图2a)和foxp3表达(图2b)的比例,其中将具有指定菌落形成单位(cfu)滴度的每个细菌菌株与总肠系膜淋巴结(mln)细胞孵育72小时,然后通过elisa或流式细胞术分析细胞因子水平或foxp3表达。图2c展示了在定殖后3周使用dna-cy5探针(eub338,红色),通过histo-fish染色对两歧双歧杆菌pri1(bb)在gf小鼠肠间隙中的定位分析。图2d展示了gf小鼠、bb单定殖的小鼠(bb)和spf小鼠的盲肠图片(左)和盲肠重量(右)。图2e展示了测量gf小鼠或bb单定殖的小鼠(bb)的盲肠和粪便中丁酸盐和乙酸盐水平的结果。图2f示出了在gf小鼠、定殖有sfb或lpa的小鼠、和spf小鼠的结肠固有层(clp)中cd4+foxp3+t细胞的流式细胞术图。象限中的数字表示细胞百分比,图形中的圆圈表示与每个参数相对应的单独小鼠,数据代表3至5个独立实验(n≥3只小鼠)(两歧双歧杆菌:bb;嗜酸乳杆菌:lac;干酪乳杆菌:lca;罗伊乳杆菌:lre;副干酪乳杆菌:lpa;分节丝状细菌:sfb),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01,***p<0.001(学生t检验)。
图3展示了两歧双歧杆菌单定殖对treg细胞的产生和表型的影响。图3a展示了在spf小鼠、gf小鼠或单定殖有bb、sfb或lpa的小鼠的小肠固有层(silp)、mln、pln和脾脏中cd4+foxp3+t细胞的频率。图3b和3c展示了在单定殖有对应细菌的小鼠的clp或silp中cd4+cd103+foxp3+(图3b)和cd4+cd44hicd62llofoxp3+t细胞(图3c)的流式细胞术图和频率,其中图和频率表示为百分比。象限中的数字表示细胞百分比,图形中的圆圈表示与每个参数相对应的单独小鼠,数据表示3至5个独立实验(n≥3只小鼠),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01(学生t检验)。
图4展示了由两歧双歧杆菌单定殖引起的其他淋巴器官中treg群体的增加,其中细胞是从gf小鼠或在bb或lpa单定殖后3周时的小鼠的淋巴器官分离的。图4a和4b展示了在所示淋巴组织中helios-和nrp1-treg群体的频率。图4c和4d展示了来自gf小鼠或单定殖有bb或lpa的小鼠的所示器官的helios-foxp3+细胞(图4c)或rorγt+helios-foxp3+treg细胞(图4d)的流式细胞术图和频率,其中图和频率表示为百分比。象限中的数字表示细胞百分比,图形中的圆圈表示与每个参数相对应的单独小鼠,数据表示3至5个独立实验(n≥3只小鼠),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01(学生t检验)。
图5显示两歧双歧杆菌单定殖促进了ptreg细胞的新生长。图5a展示了用于分析在bb单定殖后ptreg细胞的新产生的实验策略。图5b和5c展示了将从cd45.1+foxp3gfp报告小鼠分选的幼稚cd4+foxp3-t细胞转移到gf小鼠中并以bb单定殖小鼠3周后获得的结果,通过在clp(图5b)和silp(图5c)中的gfp表达来分析foxp3+treg群体。图5d展示了通过在所示淋巴器官中的gfp表达来测量foxp3+treg群体的频率的结果。图5e展示了将从cd45.1+foxp3gfp报告小鼠分选的幼稚cd4+foxp3-t细胞转移到spf小鼠中并每隔一天饲喂小鼠模拟物(pbs)或bb(5x108cfu)持续3周之后,对clp中的foxp3+treg细胞进行分析的结果。数据表示3至5个独立实验(n≥3只小鼠),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01(学生t检验)。
图6展示了食物性抗原以及定殖两歧双歧杆菌对微生物群反应性treg细胞的诱导。图6a和6b展示了在将thy1.1+foxp3gfp小鼠的经ctv标记的幼稚cd4+ot-ii+foxp3-t细胞过继到gf小鼠或预先定殖14天的gf小鼠中然后每隔一天饲喂小鼠ova(20mg)持续7天之后,对供体(thy1+ot-ii)细胞的clpcd4+foxp3+群体进行分析的结果,图6a和6b分别展示了体内产生的treg细胞的facs图和频率。图6c至6e展示了将从cbirtgcd45.1+foxp3gfp小鼠分选的幼稚cd4+cbir+foxp3-t细胞过继到spfrag1-/-受体中然后每天饲喂bb或pbs直到实验结束之后,对体重、结肠长度、和组织病理学变化的测量和分析结果(分别为c、d、和e)。图6f至6g展示了在模拟物或bb定殖的小鼠的clp中cbir+cd45.1+foxp3+treg细胞(图6f)和ifn-γ+细胞(图6g)的流式细胞术图和频率。图6h展示了在分选gf或bb-gf小鼠的cd4+细胞并用ctv标记细胞然后在gf小鼠和定殖有bb或lpa的小鼠的粪便抗原的存在下培养细胞连同已去除了t细胞的脾脏apc之后3天,通过facs对于和所示抗原对应的treg细胞的相对增殖分析的结果。图6i展示了比较bb单定殖的小鼠与gf小鼠的结肠、mln和脾脏的treg中tcr-cdr3区域的43条固有α链和61条固有β链的频率分布的结果。象限中的数字表示细胞百分比,图形中的圆圈表示与每个参数相对应的单独小鼠,数据表示3至5个独立实验(n≥3只小鼠),并且所有条形图均显示平均值±sem,并且*p<0.05,**p<0.01,***p<0.001(学生t检验)。
图7展示了食物性抗原以及两歧双歧杆菌定殖对微生物群反应性treg细胞的诱导。图7a展示了用于确定在gf小鼠或bb定殖的gf小鼠中响应于食物性抗原(ova特异性otiit细胞)而诱导的ova特异性ptreg细胞的实验策略。图7b展示了用于确定源自饲喂pbs或bb的rag1-/-spf小鼠的微生物群特异性ptreg细胞(鞭毛蛋白特异性cbirt细胞)的实验策略。图7c展示了在饲喂pbs或bb的rag1-/-spf小鼠(向其中转移了cbir幼稚t细胞)的clp中cd4+foxp3-或cd4+foxp3+t细胞的rorγ、gata3和t-bet群体分析。图7d展示了用于确定在单定殖有bb或lpa的小鼠或gf小鼠的粪便抗原的组合的存在下bb诱导的treg增殖的实验策略。图7e展示了在筛选gf小鼠或单定殖有bb的小鼠的全部结肠cd4+细胞并用ctv标记细胞然后在gf或单定殖有bb或lpa的小鼠的粪便抗原的组合的存在下培养细胞连同已去除了t细胞的脾脏细胞(apc)之后3天,通过facs对于和所示抗原对应的treg细胞的相对增殖分析的结果。数据表示3个独立实验(n≥3只小鼠),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01(学生t检验)。
图8展示了两歧双歧杆菌单定殖对treg细胞的tcr谱库的影响。图8a展示了比较从gf小鼠或bb单定殖的小鼠的不同器官(结肠、mln和脾脏)获得的treg细胞谱库的α链和β链的香农多样性(shannondiversity)的结果。图8b展示了α链和β链的热图,其示出bb单定殖的小鼠和gf小鼠的结肠treg细胞中前85个tcr-cdr3区域的频率,“共同”标记物(28种肽)的cdr3区域指示每个组中读取计数的存在,色调指示发现给定tcr的相对频率。图8c展示了由双向条形图表示的典型tcr-cdr3α区域的频率分布:大肠中85个,mln中1469个,以及脾脏中1381个,并且图8d展示了由双向条形图表示的典型tcr-cdr3β区域的频率分布:结肠中118个,mln中1724个,以及脾脏中1381个。
图9展示了两歧双歧杆菌的细胞表面β-葡聚糖/半乳聚糖多糖(csgg)的treg细胞诱导介导。图9a展示了两歧双歧杆菌的细胞表面β-1,6-葡聚糖(csβg)多糖的结构;glcp:吡喃葡萄糖。图9b展示了β-1,6-葡聚糖处理对csgg诱导的itreg细胞的作用。图9c展示了在gf小鼠或者定殖有bb或lpa或每隔一天经受腹膜内注射csgg(100μg/剂)持续3周的gf小鼠中treg细胞的群体和表型。图9d展示了确认通过将用csgg预处理的dc与健康供体的pbmc的幼稚cd4+t细胞一起共培养来对剂量依赖性人cd4+cd25+foxp3+treg诱导的结果。图9e展示了对经模拟物或csgg处理的cd11c+dc的rna序列分析。图9f展示了通过培养源自经模拟物或csgg预处理的小鼠的幼稚cd4+t细胞和cd11c+dc连同次优itreg产物而获得的结果,其中通过流式细胞术测定cd4+foxp3+treg细胞群体。图9g展示了在培养幼稚cd4+t细胞连同用模拟物或csgg预处理的野生型或tlr2缺陷型cd11c+dc后获得的培养上清液中测量tgfβ1水平的结果。数据表示至少3个独立实验,并且所有条形图均显示平均值±sem,并且*p<0.05,**p<0.01,***p<0.001(学生t检验)。
图10展示了通过两歧双歧杆菌的dc依赖性机制促进treg细胞诱导。图10a展示了在gf小鼠或bb单定殖的小鼠的整个结肠中针对hprt的归一化细胞因子的相对mrna表达的定量结果。图10b至10d展示了gf小鼠或bb单定殖的小鼠的clp-dc(mhcii+cd11c+cd11b+cd103+f4/80-)的相对mrna表达水平。图10e展示了在dc:t共培养系统中体外诱导treg的实验策略。图10f展示了响应于脾脏cd11c+dc和各种量的bb(cfu)滴定,foxp3+细胞的剂量依赖性诱导和t细胞的存活。图10g展示了在次优treg诱导条件(抗cd3:0.1μg/ml;tgf-β:0.1ng/ml;il-2:100单位/ml)下,在将bb或lpa预处理的脾脏cd11c+dc与幼稚cd4+t细胞一起共培养3天后,分析活细胞中foxp3+treg细胞的结果,通过对培养上清液的elisa分析来测定il-10分泌。数据表示3至5个独立实验(n≥3只小鼠),所有图形均显示平均值±sem,*p<0.05,**p<0.01(学生t检验),并显示了cd4+foxp3+treg细胞的代表性流式细胞术和平均频率。
图11展示了将β-葡聚糖/半乳聚糖多糖(csgg)确认为由两歧双歧杆菌诱导的treg细胞的核心效应分子的结果。图11a展示了在次优treg诱导条件下将用一部分两歧双歧杆菌预处理的脾脏cd11c+dc与幼稚cd4+t细胞一起共培养后3天,通过facs对foxp3+treg细胞分析的结果。图11b展示了在将用指示量的总细胞表面多糖(tcsps)预处理的脾脏cd11c+dc与幼稚cd4+t细胞一起共培养后3天,通过facs对foxp3+treg细胞分析的结果。图11c展示了从两歧双歧杆菌的总细胞表面多糖(tcsps)分离的中性(csgg)或带负电荷的多糖(pgβg)的结构(glcp:吡喃葡萄糖,galp:吡喃半乳糖,galf:呋喃葡萄糖,gro:甘油;n=重复单元,每种多糖的相对丰度以%(mol/mol)指示)。图11d展示了在中性(csgg;5μg/ml)与带负电荷(pgβg:100μg/ml)的多糖之间比较cd4+foxp3+treg诱导活性的结果(与tcsps(100μg/ml)相比)。图11e展示了β-1,6-葡聚糖酶、β-1,4-半乳聚糖酶和β-1,4-葡聚糖酶处理对经csgg诱导的itreg细胞(csgg;50μg/ml)的诱导的影响。图11f展示了在次优treg诱导条件(抗cd3:0.1μg/ml;α-cd28:0.1μg/ml;tgf-β:0.1ng/ml;il-2:100单位/ml)下,用无dc的csgg(50μg/ml)处理幼稚cd4+t细胞后获得的结果。数据表示3至5个独立实验(n≥3只小鼠),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01(学生t检验);
图12展示了体外和体内csgg的treg细胞诱导增强。图12a展示了在次优treg诱导条件下,将幼稚cd4+t细胞与用细菌或csgg预处理的cd11c+dc一起共培养后,在体外cd4+foxp3+群体的产生。图12b展示了在gf小鼠或通过每隔一天向gf小鼠腹膜内注射bb、lpa或csgg(100μg/剂)持续3周而单定殖的小鼠中的cd4+foxp3+群体。图12c和12d展示了每隔一天向gf小鼠腹膜内注射csgg(100μg/剂)或pbs持续3周后,分析淋巴器官中所示treg细胞群体的频率的结果。数据表示3至5个独立实验(n≥3只小鼠),并且所有图形均显示平均值±sem,并且*p<0.05,**p<0.01,***p<0.001(学生t检验)。
图13展示了通过产生tlr2依赖性调节性dc来促进csgg对itreg的诱导。图13a展示了在将经模拟物或csgg预处理的cd11c+dc与幼稚cd4+t细胞共培养后获得的培养上清液中,确认细胞因子水平的结果。图13b展示了在bb或csgg处理后,抗tgfβab处理对体外cd4+foxp3+treg诱导的影响。图13c展示了在将csgg预处理的il-10-/-ko小鼠或野生型cd11c+dc与野生型幼稚cd4+t细胞共培养后3天测量itreg诱导的结果。图13d展示了分析rna序列数据的结果,以确定在csgg处理后编码tlr亚型的基因的表达。图13e展示了在次优itreg产生条件下,将幼稚cd4+t细胞与经模拟物或csgg预处理的小鼠来源的cd11c+dc共培养3天后,通过流式细胞术测量cd4+foxp3+treg细胞诱导的结果。图13f展示了在将野生型cd11c+dc或经模拟物或csgg预处理的tlr2缺陷型cd11c+dc与幼稚cd4+t细胞共培养后,测量培养上清液中il-10和ifnγ细胞因子水平的结果。图13g展示了在针对c型凝集素的封闭抗体的存在下用模拟物或csgg预处理cd11c+dc然后将细胞与幼稚cd4+t细胞一起共培养之后,通过流式细胞术检查itreg诱导的结果。图13h展示了在将经野生型或csgg预处理的dectin1-/-或dectin2-/-ko小鼠的cd11c+dc与幼稚cd4+t细胞一起共培养后3天,测量itreg诱导的结果。数据表示至少3个独立实验,并且所有条形图均显示平均值±sem,并且*p<0.05(学生t检验)。
图14展示了csgg诱导的itreg细胞的肠道炎症抑制功能。图14a至14c展示了在将从thy1.1+foxp3gfp报告小鼠中分离的幼稚cd4+foxp3-t细胞以与itreg细胞的所示组合过继并共转移至rag1-/-受体中之后获得的结果,其中测量了体重、结肠长度和结肠组织的病理变化。图14d展示了在实验结束时分析从clp转移的treg细胞的foxp3稳定性的结果,其中转移后分选的cd4+foxp3gfp+细胞的纯度为98%或更高。图14e至14g展示了在将从cd45.1+foxp3gfp报告小鼠分离的cd4+foxp3-t细胞过继转移至rag1-/-小鼠中然后向小鼠腹膜内给予pbs或csgg(100μg/ml)后获得的结果,其中测量了体重、结肠长度和结肠组织的病理变化。图14h展示了在实验结束时分析clp中效应t细胞的ifnγ产生的结果。数据表示至少3个独立实验,并且所有条形图均显示平均值±sem,并且*p<0.05,**p<0.01,***p<0.001,****p<0.0001(学生t检验)。
图15展示了csgg诱导的itreg细胞的肠道炎症抑制功能。图15a展示了在对ctv标记的幼稚应答者thy1.1+cd4+foxp3-t细胞进行分选和共培养后获得的结果,其中在体外产生cd45.1+cd4+foxp3+itreg细胞作为来自脾细胞(已去除了经标记的cd45.2+小鼠的t细胞)的经模拟物或csgg处理的纯化apc,并通过流式细胞术分析应答t细胞的增殖。图15b展示了ntreg和在体外由模拟物、bb或csgg诱导的itreg细胞所抑制的过继转移rag1-/-结肠炎的结肠长度。图15c展示了通过腹膜内给予模拟物(pbs)或csgg(100μg/剂)由过继的幼稚t细胞诱导的rag1-/-结肠炎的结肠长度。图15d展示了在模拟物或csgg处理的过继转移的rag1-/-小鼠的mln中的cd4+cd45.1+foxp3+treg群体。数据表示至少2个独立实验,并且所有条形图均显示平均值±sem,并且*p<0.05(学生t检验)。
具体实施方式
除非另外定义,本文所用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。通常,本文中使用的命名法是熟知的并且是本领域中通常使用的。
本发明显示,人共生细菌两歧双歧杆菌pri1(两歧双歧杆菌)能够增强幼稚cd4t细胞向抑制炎性结肠炎的功能活性foxp3+itreg细胞的分化。细胞表面来源的β-葡聚糖/半乳聚糖多糖(csgg)是一种活性分子,在诱导itreg细胞时涵括了整个细菌的功能。csgg的作用机制是由树突细胞(dc)中的tlr2/il-10调节途径的诱导介导。
由于共生微生物的失调与许多疾病的发展密切相关,因此由treg诱导型微生物在体内促进treg细胞可以实现对各种炎性疾病的控制。肠道微生物在维持免疫稳态中起着重要作用,并且这种肠道微生物失调可引起与免疫抑制性foxp3+t调节性(treg)细胞功能受损相关的炎性疾病。尽管已知一些共生微生物可增强treg细胞的诱导(tanoue,t等人,naturereviewsimmunology16:295-309,2016),但控制此过程(即treg细胞由细菌诱导的分子机制、抗原特异性和靶细胞)的“效应分子”尚未可知。
因此,在本发明中,选择为一般公认安全物质(gras)的益生菌候选菌株,并选择对食物性抗原或共生细菌具有多种tcr特异性的两歧双歧杆菌pri1(两歧双歧杆菌)作为treg诱导型细菌的最佳候选。两歧双歧杆菌pri1于2017年5月19日保藏在韩国典型培养物保藏中心(保藏号:kctc13270bp)。另外,已经确认两歧双歧杆菌及其细胞表面来源的β-葡聚糖/半乳聚糖多糖(csgg)是诱导treg的主要组分,并且具体而言,csgg高效地再现了整个细菌的活性并通过tlr2依赖性机制部分地介导了调节性树突细胞,并在小鼠和人类中均起作用,从而诱导treg细胞。由两歧双歧杆菌诱导的或由纯化的csgg诱导的treg细胞对结肠炎显示出稳定而有力的治疗或抑制能力。
因此,本发明涉及产生β-1-6-葡聚糖的新型菌株。
另外,一方面,本发明涉及包含β-1-6-葡聚糖作为活性成分的多糖。
在本发明中,多糖可以进一步包括β-1-4-半乳聚糖、β-1-6-半乳聚糖或β-半乳呋喃聚糖,并且这些多糖可以单独使用。具体而言,多糖可以是以β-1-6-葡聚糖为主要组分的复合物,也可以是单一物质。
另外,可以按相对于总多糖而言5-50:2-15:2-15:1-5的摩尔比,更优选按10-20:3-10:3-10:2-4的摩尔比,以及最优选按18:5:5:2的摩尔比包含β-1-6-葡聚糖、β-1-4-半乳聚糖、β-1-6-半乳聚糖和β-半乳呋喃聚糖,但是本发明不限于此。多糖可以包括相对于100wt%总值而言5-50wt%的β-1-6-葡聚糖、2-15wt%的β-1-4-半乳聚糖、2-15wt%的β-1-6-半乳聚糖和1-5wt%的β-半乳呋喃聚糖。优选地,多糖可包括相对于100wt%总值而言10-20wt%的β-1-6-葡聚糖、3-wt%的β-1-4-半乳聚糖、3-10wt%的β-1-6-半乳聚糖和2-4wt%的β-半乳呋喃聚糖,并且可以按相对于100wt%总值而言18wt%、5wt%、5wt%和2wt%的量包括每种多糖。
在本发明中,多糖优选具有约3-5kda、更优选4kda的分子量,但不限于此,只要它是具有100kda以下的各种分子量的任何混合物即可。
在本发明中,多糖的电荷可以是中性的。
在本发明中,多糖可以诱导调节性t(treg)细胞,并且调节性t(treg)细胞优选为cd4+foxp3+treg细胞,但不限于此。
调节性t(treg)细胞的诱导可以由树突细胞(dc)介导。另外,调节性t细胞(treg)可以增加对il-10和tgf-β产生的诱导。
在本发明中,多糖优选源自两歧双歧杆菌菌株,更优选源自具有与两歧双歧杆菌pri1有至少99%同源性的碱基序列的菌株,并且最优选源自两歧双歧杆菌pri1(kctc13279bp)菌株,但不限于此。
在本发明中,具有与两歧双歧杆菌pri1有至少99%同源性的碱基序列的菌株可以是两歧双歧杆菌a8或两歧双歧杆菌lmg11582。
在本发明中,多糖优选具有抗炎或免疫功能调节活性,并且更优选具有免疫抑制活性,但不限于此。如果人们不正确地服用益生菌,则具有肠道创伤(如肠道出血等)的人可能会有副作用,并且在此类情况下,给予多糖时可取得治疗作用。
另一方面,本发明涉及产生β-1-6-葡聚糖多糖的菌株。
在本发明中,菌株优选为两歧双歧杆菌,但不限于此,只要菌株产生csgg多糖即可。另外,在本发明中,两歧双歧杆菌优选具有与两歧双歧杆菌pri1有至少99%同源性的碱基序列,并且更优选为两歧双歧杆菌pri1(kctc13279bp),但不限于此。
在本发明中,菌株可以进一步产生β-1-4-半乳聚糖、β-1-6-半乳聚糖或β-半乳呋喃聚糖,但不限于此。
在本发明中,菌株可以诱导调节性t细胞(treg),并且调节性t(treg)细胞可优选为cd4+foxp3+treg细胞,但不限于此。另外,菌株可以增加il-10和tgf-β产生的诱导。
调节性t(treg)细胞的诱导可以由dc介导。
在本发明中,菌株优选具有抗炎或免疫功能调节活性,并且更优选具有抑制超免疫性的活性,但不限于此。
具体而言,菌株产生csgg多糖,因此通过各种抗原(例如食物,其他肠道细菌,或细菌来源的物质)诱导抗原特异性treg,因此菌株可用于炎症或免疫疾病的治疗。
另一方面,本发明涉及用于免疫调节的组合物,其包含β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株作为活性成分。
在本发明中,多糖可以进一步包括β-1-4-半乳聚糖、β-1-6-半乳聚糖或β-半乳呋喃聚糖,但不限于此。
在本发明中,多糖或菌株可以诱导调节性t(treg)细胞,并且调节性t(treg)细胞优选为cd4+foxp3+treg细胞,但不限于此。另外,多糖或菌株可以增加il-10和tgf-β产生的诱导。
调节性t(treg)细胞的诱导可以由dc介导。
如本文所用,术语“免疫调节”是指缓解血液中的免疫失衡并维持免疫稳态。维持免疫稳态是指对作为抑制免疫的机制的免疫耐受和促进免疫应答的免疫进行平衡的状况,并且维持这种状况是治疗免疫疾病、尤其是自身免疫疾病的必要因素。
另一方面,本发明涉及包含β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株作为活性成分的免疫抑制剂或免疫治疗剂。
如本文所用,术语“免疫抑制剂”是指用于减少或阻断宿主产生抗体的能力(体液免疫应答)或引起针对抗原作用的细胞免疫应答的能力的各种物质。
另外,本发明的术语“免疫疗法”是指通过诱导机体的免疫系统的激活或抑制应答来抵抗疾病的治疗。最有代表性的免疫疗法是癌症免疫疗法,它诱导免疫活性并杀死癌细胞,并且对于诸如自身免疫疾病、炎性肠病(ibd)和过敏等由异常免疫应答诱导的疾病,可以通过免疫抑制剂进行免疫治疗。
因此,在本发明中,可以以相同的含义使用“免疫抑制剂”和“免疫治疗剂”。
在另一方面,本发明涉及用于预防或治疗免疫疾病或炎性疾病的药物组合物,其包含β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株作为活性成分。
在本发明中,多糖可以进一步包括β-1-4-半乳聚糖、β-1-6-半乳聚糖或β-半乳呋喃聚糖,但不限于此。
在本发明中,多糖或菌株可以诱导调节性t(treg)细胞,并且调节性t(treg)细胞优选为cd4+foxp3+treg细胞,但不限于此。另外,多糖或菌株可以增加il-10和tgf-β产生的诱导。
调节性t(treg)细胞的诱导可以由dc介导。
另外,免疫调节性组合物可以用作用于调节免疫活性和预防、改善或治疗免疫疾病目的的药物组合物或保健功能食物。在这方面,可以根据使用目的适当地调节其量和形式。
用于免疫调节的组合物可展现出免疫刺激作用和超免疫抑制作用。免疫刺激作用是增加巨噬细胞中tnf-α的表达或增强脾细胞增殖能力以促进免疫力的作用。过度免疫抑制作用是通过抑制由脾细胞中的非特异性刺激物引起的淋巴细胞过表达来抑制过度免疫的作用。
通过根据本发明的组合物预防或治疗的“免疫疾病”可以是选自以下的任何一种:皮炎、过敏、鼻炎、痛风、强直性脊柱炎、风湿热、狼疮、纤维肌痛、腱围炎(peritendinitis)、1型糖尿病、硬皮病、神经退行性疾病、2型糖尿病、矽肺、动脉粥样硬化、白癜风、结膜炎和自身免疫疾病,但不限于此。
通过根据本发明的组合物预防或治疗的“自身免疫疾病”可以是选自以下的任何一种:类风湿性关节炎、系统性硬皮病、特应性皮炎、银屑病、哮喘、格林-巴利综合征、重症肌无力、皮肌炎、多肌炎、多发性硬化、自身免疫脑脊髓炎,结节性多动脉炎性结节、颞动脉炎、儿童糖尿病、斑秃、天疱疮、口疮性口炎、克罗恩病、和贝切特病,但不限于此。
通过根据本发明的组合物预防或治疗的“炎性疾病”统指以炎症为主要病变的疾病,并且可以是选自以下的任何一种:肿胀、过敏、哮喘、结膜炎、牙周炎、鼻炎、中耳炎(tympanitis)、咽喉痛、扁桃体炎、肺炎、胃溃疡、胃炎、克罗恩病、结肠炎、痔疮、痛风、强直性脊柱炎、风湿热、狼疮、纤维肌痛、银屑病性关节炎、骨关节炎、类风湿性关节炎、关节周炎、腱炎、腱鞘炎、肌炎、肝炎、膀胱炎、肾炎、舍格伦综合症(sjogren'ssyndrome)、重症肌无力和多发性硬化,但不限于此。
如本文所用,术语“预防”是指通过给予根据本发明的药物组合物抑制或延迟免疫疾病或炎性疾病发作的所有作用。
如本文所用,术语“治疗”是指通过给予根据本发明的药物组合物改善或有益地改变免疫疾病或炎性疾病症状的所有作用。
根据本发明的药物组合物展现出活性成分的免疫刺激作用,或通过超免疫抑制作用对各种免疫疾病的预防或治疗和抗炎作用。
药物组合物除了作为活性成分的β-1-6-葡聚糖、β-1-4-半乳聚糖、β-1-6-半乳聚糖和β-半乳呋喃聚糖(csgg)或者产生所述多糖的两歧双歧杆菌菌株以外,还可以包含药物组合物中常用的合适的载体、赋形剂和稀释剂。
组合物中可包含的载体、赋形剂和稀释剂包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶橡胶、藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、甲基羟基苯甲酸酯、丙基羟基苯甲酸酯、滑石、硬脂酸镁、矿物油等。在配制组合物时,通常使用稀释剂或赋形剂,例如填充剂、增量剂、粘合剂、润湿剂、崩解剂和表面活性剂。
根据本发明的药物组合物可以通过根据常规方法将其配制成各种形式来使用。合适的配制品包括口服制剂,例如片剂、丸剂、散剂、颗粒剂、糖衣片剂、硬或软胶囊、溶液、悬浮液或乳液;注射剂;气雾剂等;外用制剂;栓剂;和无菌注射液,但不限于此。
可以使用药学上惰性的有机或无机载体将根据本发明的药物组合物制备成合适的配制品。即,当配制品为片剂、包衣片剂、糖衣片剂和硬胶囊形式时,有机或无机载体可包括乳糖、蔗糖、淀粉或其衍生物、滑石、碳酸钙、明胶、或硬脂酸或其盐。此外,当配制品为软胶囊形式时,有机或无机载体可包括植物油、蜡、脂肪、以及半固态和液态多元醇。另外,当配制品为溶液或糖浆形式时,有机或无机载体可以包括水、多元醇、甘油、植物油等。
除了上述载体外,根据本发明的药物组合物还可以包括防腐剂、稳定剂、润湿剂、乳化剂、增溶剂、甜味剂、着色剂、渗透压控制剂、抗氧化剂等。
以药学有效量给予根据本发明的药物组合物。如本文所用,术语“药学有效量”是指足以按适用于医学治疗的合理效益/风险比来治疗疾病的量,并且可以根据包括患者疾病类型、疾病的严重程度、药物的活性、对药物的敏感性、给药时间、给药途径、排泄率、治疗时间、和共同给予的药物在内的因素以及其他在医学领域熟知的因素来确定有效剂量水平。可以将根据本发明的药物组合物作为单独的治疗剂或与其他治疗剂组合给予,可以与常规治疗剂依序或同时给予,并且可以按单剂量或多剂量给予。重要的是,考虑到以上描述的全部因素,以使作用最大化而没有副作用的最小量给予药物组合物,这可由本领域普通技术人员容易地确定。
可以将根据本发明的组合物与免疫相关蛋白,特别是自身免疫相关蛋白或过敏相关蛋白组合来给予。所述蛋白质的具体例子包括自身免疫疾病中涉及的自身抗原。例如,所述蛋白质可以包括类风湿性关节炎中涉及的自身抗原,例如热休克蛋白(hsp)、瓜氨酸化的丝聚蛋白、葡萄糖-6-磷酸异构酶、p205、胶原蛋白等;i型糖尿病中涉及的自身抗原,例如胰岛素、锌转运蛋白8蛋白(znt8)、胰腺和十二指肠同源框1(pdx1)、嗜铬粒蛋白a(chga)、和胰岛淀粉样多肽(iapp);和重症肌无力中涉及的自身抗原,例如乙酰胆碱受体。除了自身免疫疾病中已知的所有类型的自身抗原外,蛋白质还可以包括已知会引起食物过敏的各种过敏原,例如花生、牛奶、鸡蛋、树生坚果、豆、甲壳动物(例如虾等)、鱼来源的物质等等。
可以将本发明的药物组合物通过各种途径给予受试者。可以通过例如皮下注射、静脉内注射、肌内注射、子宫内硬膜外注射或脑室内注射来给予药物组合物。根据作为活性成分的药物的类型连同各种相关因素(例如待治疗的疾病,给药途径,患者的年龄、性别和体重,疾病的严重程度)确定本发明的药物组合物。
可以根据剂型容易地选择根据本发明的药物组合物的给予方法,并且可以口服或肠胃外给予药物组合物。剂量可根据患者的年龄、性别和体重,疾病的严重程度以及给药途径而有所不同。
在另一方面,本发明涉及用于预防或治疗免疫疾病或炎性疾病的治疗剂,其包含β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株作为活性成分。
在另一方面,本发明涉及预防或治疗免疫疾病或炎性疾病的方法,其包括给予包含β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株作为活性成分的组合物。
在本发明中,多糖可以进一步包括β-1-4-半乳聚糖、β-1-6-半乳聚糖或β-半乳呋喃聚糖。
在另一方面,本发明涉及组合物用于预防或治疗免疫疾病或炎性疾病的用途,其中所述组合物包含β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株作为活性成分。
在本发明中,多糖可以进一步包括β-1-4-半乳聚糖、β-1-6-半乳聚糖或β-半乳呋喃聚糖。
根据本发明的药物组合物不仅提供优异的免疫增强和超免疫抑制作用,而且因此具有低毒性和副作用,因此药物组合物甚至可以安全地用于长期给药以用于治疗或预防免疫疾病的目的。
根据本发明的两歧双歧杆菌或csgg可在体内诱导多种抗原特异性treg细胞,因此可用作口服抗性佐剂。
在另一方面,本发明涉及用于预防或减轻免疫疾病或炎性疾病的食物,其包含β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株作为活性成分。
在本发明中,多糖可以进一步产生β-1-4-半乳聚糖、β-1-6-半乳聚糖或β-半乳呋喃聚糖,但不限于此。
用于预防或减轻免疫疾病或炎性疾病的食物可以是具有通过增强免疫活性或者抑制或减轻过度免疫来维持免疫功能稳态的活性的保健功能食物。
在本发明中,多糖或菌株可以诱导调节性t(treg)细胞,并且调节性t(treg)细胞可以优选是cd4+foxp3+treg细胞,但不限于此。
调节性t(treg)细胞的诱导可以由dc介导,并且可以诱导il-10和tgf-il-10和tgf-β的产生。
如本文所用,术语“食物”包括所有一般意义上的食物,例如肉类、香肠、面包、巧克力、糖果、小吃、糖果甜点、比萨、拉面、其他面条、胶、乳制品(包括冰淇淋)、各种汤、饮料、茶、饮品、酒精饮料、维生素复合物、保健功能食物、保健食物等。
术语“保健功能食物”具有与“特殊保健用途的食物(foshu)”相同的含义,并且是指经过加工以在营养供给之外还展现有效生物调节作用并具有优异的药物和医学作用的食物。如本文所用,术语“功能性”是指控制用于人体结构和功能的营养物或提供可用于保健用途的作用,例如心理作用等。本发明的食物可以通过本领域中通常使用的方法来制备,并且可以通过添加本领域中通常添加的原料和成分来进行制备。另外,食物的配制也可以在没有限制的情况下进行,只要所述配制品被认为是食物即可,并且根据本发明的保健功能食物可以是散剂、颗粒剂、片剂、胶囊、或饮料形式。
术语“保健食物”是指与普通食物相比具有有效的健康维持或促进作用的食物,并且“保健补充食物”是指用于保健补充目的的食物。在一些情况下,术语“保健功能食物”、“保健食物”和“保健补充食物”可互换使用。
食物组合物可以进一步包括是生理学上可接受的载体,并且载体的类型不受特别限制,并且可以是本领域中通常使用的任何载体。
另外,组合物可以包括通常用于食物组合物中以改善气味、味道、视力等的其他成分。例如,组合物可以包括维生素a、c、d、e、b1、b2、b6和b12,烟酸,生物素,叶酸,泛酸等。组合物还可以包括诸如锌(zn)、铁(fe)、钙(ca)、铬(cr)、镁(mg)、锰(mn)、铜(cu)、铬(cr)等矿物质。另外,组合物可以包括氨基酸,例如赖氨酸、色氨酸、半胱氨酸、缬氨酸等。
另外,组合物可以包括食物添加剂,例如:防腐剂(山梨酸钾、苯甲酸钠、水杨酸、脱氢乙酸钠等),杀菌剂(漂白粉和高级漂白粉、次氯酸钠等),抗氧化剂(丁基羟基茴香醚(bha)、丁基羟基甲苯(bht)等),着色剂(焦油色等),固色剂(亚硝酸钠等),漂白剂(亚硫酸钠),调味品(msg等),甜味剂(甘素、甜蜜素、糖精钠等),香料(香兰素、内酯等),溶胀剂(明矾、d-酒石酸氢钾等),增强剂,乳化剂,增稠剂(淀粉粘附剂),成膜剂,胶基剂,消泡剂,溶剂,调理剂等。添加剂可以根据食物的类型选择,并且可以按适当的量使用。
根据本发明的组合物,除了csgg多糖或产生所述多糖的菌株外,还可以包含饮食学上可接受的食物补充添加剂,并且可以与其他食物或食物成分组合使用,并且可以根据通用方法适当地使用。活性成分的混合量可以根据使用目的(预防、保健或治疗)适当地确定。
在另一方面,本发明涉及产生诱导的调节性t(itreg)细胞的方法,其包括以下步骤:(a)用β-1-6-葡聚糖多糖或产生所述多糖的两歧双歧杆菌菌株处理树突细胞(dc),以获得调节性树突细胞(rdc);和(b)将rdc与cd4+t细胞共培养以诱导调节性t(treg)细胞。
在本发明中,调节性t(treg)细胞可以是cd4+foxp3+treg细胞。另外,调节性t(treg)细胞可增加il-10和tgf-β的产生。
在本发明中,步骤(b)可以通过用抗cd3抗体、il-2和tgf-β刺激来诱导调节性t(treg)细胞。
在本发明中,树突细胞和cd4+t细胞可以源自外周血单核细胞(pbmc),但不限于此。
在另一方面,本发明涉及用于预防或治疗免疫疾病或炎性疾病的细胞治疗剂,其包含通过所述方法产生的诱导的调节性t细胞(itreg)为活性成分。
在另一方面,本发明涉及预防或治疗免疫疾病或炎性疾病的方法,所述方法包括给予细胞治疗剂,所述细胞治疗剂包含通过所述方法产生的调节性t(itreg)细胞作为活性成分。
在另一方面,本发明涉及细胞治疗剂在预防或治疗免疫疾病或炎性疾病中的用途,其中所述细胞治疗剂包含通过所述方法产生的诱导的调节性t(itreg)细胞作为活性成分。
在本发明中,调节性t(treg)细胞可以是cd4+foxp3+treg细胞。另外,调节性t(treg)细胞可增加il-10和tgf-β的产生。
在本发明中,免疫疾病或炎性疾病优选为炎性结肠炎,但不限于此。
两歧双歧杆菌是母乳喂养婴儿的肠道微生物区系的主要细菌成员之一,并且此细菌的缺乏与儿童过敏、哮喘和自身免疫疾病有关。一些商业益生菌产品包含两歧双歧杆菌,但功效尚不清楚,并且一些双歧杆菌属物种可具有有害作用,例如使类风湿性关节炎的进展恶化(pnas,113(50):e8141-e8150,2016)。因此,可以看到共生细菌的某些组分对免疫系统具有有益的作用。本发明证明了从两歧双歧杆菌pri1纯化的csgg在刺激treg细胞方面非常有效并且可以抑制结肠炎进展,因此细菌细胞壁多糖的免疫调节作用被认为对于选择用于治疗免疫和过敏性疾病的益生细菌特别有用。
通过用两歧双歧杆菌接种spf小鼠或用其定殖gf小鼠,可使幼稚cd4+细胞分化为具有nrp1-foxp3+、helios-foxp3+或nrp1-helios-foxp3+表型且表达高水平il-10和ctla4的外周诱导treg(itreg)细胞。
在本发明中,提出了两歧双歧杆菌可以在体内诱导ptreg产生的两个平行机制。
首先,通过两歧双歧杆菌单定殖提高丁酸盐水平可以通过直接靶向t细胞或通过诱导调节性dc表型来间接促进treg的产生(y.furusawa等人,nature504:446-450,2013;n.arpaia等人,nature504:451-455,2013)。即,两歧双歧杆菌刺激结肠treg细胞的诱导的分子机制可以由至少两种类型的效应分子-代谢产物(丁酸盐)和细胞表面多糖(csgg)介导。先前的研究表明,在短链脂肪酸(scfa)中,作为由共生微生物产生的发酵产物的丁酸盐是itreg诱导物的常见效应分子之一。向spf小鼠给予产丁酸盐细菌(丁酸梭菌;atarashi等人,nature500:232-236,2014)或丁基化淀粉可通过增加foxp3基因座的增强子和启动子区域中的组蛋白h3乙酰化导致结肠treg细胞增加(yukihirofurusawa等人,nature504:446-450,2013)。但是,尚不清楚直接来源于肠道微生物的物质是否能够诱导cd4+foxp3+treg细胞。
在本发明的一种实施方案中,通过两歧双歧杆菌定殖使gf小鼠的盲肠大小正常化,并且发现盲肠和粪便中丁酸盐的水平显著增加。除丁酸盐外,细胞表面来源的β-葡聚糖/半乳聚糖多糖(csgg)被鉴定为模拟所有细菌treg诱导活性的关键效应分子。带负电的多糖pgβg(磷酸甘油-β-半乳呋喃)是从细胞表面分离出的另一种多糖,不具有treg诱导活性。pgβg增强了th1/th17应答。pgβg的化学结构与两歧双歧杆菌亚种pennsylvanicumdsm20239的脂磷壁酸(lta)非常相似(fisherw.,eur.j.biochem.165(3):639-646,1987)。革兰氏阳性细菌的lta通常具有促炎活性,并且在消除lta时,益生菌乳酸细菌的抗炎能力增强(saralebeer,trendsinmicrobiology,2012年1月,20卷,1期)。这些结果表明,源自同一细菌的细菌多糖的结构可以差异性地调节免疫应答,因此,阐明在源自共生细菌的多糖的结构与功能之间的相关是重要的。
其次,源自两歧双歧杆菌细胞表面的csgg通过dc依赖性机制诱导treg细胞(v.k.raker等人,frontiersinimmunology6:569,2015)。dc在csgg和两歧双歧杆菌诱导的itreg产生中起重要作用。两歧双歧杆菌和csgg(是其效应分子)可以通过tlr/il-10途径将dc表型诱导为调节性dc(rdc)。两歧双歧杆菌定殖或csgg处理可增加全结肠和clp-dc(mhcii+cd11c+cd11b+cd103+f4/80-cdf)中il-10、tgf-β、gm-csf和其他treg诱导因子的表达水平。在各种toll受体(tlr)中,dc的tlr2在csgg诱导的抗性信号的检测和传递中起着重要的作用,并且显示tlr2敲除的dc在csgg诱导的treg细胞产生方面是重要缺陷(与tlr2dc相比,约35%的treg细胞群)。其他研究也表明,cd4t细胞(roundjl,2011science)或dc(suryasarathidasgupta,cellhostandmicrobes,2014)的tlr2在识别细菌来源的多糖以产生il-10中起重要作用。除了tlr2,其他受体也可参与csgg诱导的itreg产生,因为tlr2kodc仍会诱导treg细胞。clr可能不参与,因为c型凝集素受体(clr)抑制剂不会降低csgg诱导的treg产生。需要进一步的研究来确定哪些受体或其组合参与csgg的识别和抗性信号向t细胞的传递。tgf-β和il-10可以是通过dc中的csgg-tlr2信号传导来分化treg细胞的关键效应分子。添加tgf-β阻断抗体可完全消除csgg诱导的treg细胞。免疫调节性细胞因子il-10在csgg诱导的treg细胞产生中起重要作用。tlr2kodc产生水平低得多的il-10,并且在诱导treg细胞中显示出降低的活性。这些结果表明,il-10是各种免疫应答中免疫调节的主要调节物(lochner等人,thejournalofexperimentalmedicine205:1381-1393,2008)。
此外,两歧双歧杆菌定殖或csgg的给药不仅增加rorγt+foxp3+treg细胞,而且还增加cd103+,这表明csgg治疗可以诱导肠道treg细胞(b.yang等人,mucosalimmunology9:444-457,2016;e.sefik等人,science349:993-997,2015)。两歧双歧杆菌的定殖可以诱导食物和植物反应性treg细胞,从而不仅抑制食物中毒,还抑制植物的调节异常。因此,可以认为由两歧双歧杆菌或csgg诱导的rorγt+foxp3+treg细胞属于高度抑制的肠道特异性效应treg(m.esposito等人,thejournalofimmunology185:7467-7473,2010;d.m.tartar等人,thejournalofimmunology184:3377-3385,2010)。
与共生革兰氏阴性细菌脆弱拟杆菌的主要免疫调节分子荚膜多糖a(psa)相比,csgg具有非常不同的特征(neerajk.surana等人,immunolrev.245(1):13-26,2012)。csgg和psa二者均需要tlr2/il-10信号传导以诱导treg细胞,但treg细胞的特征却大不相同。脆弱拟杆菌的psa或外膜囊泡(omv)主要诱导il-10高调节性t细胞,但不诱导foxp3+treg细胞(cellhostµbe124:509-520,2012;cell,122(1):107-18,2005;pnas.107(27):12204-9,2010),并且没有cd4+foxp3+treg细胞产生的直接证据。psa还诱导高水平的ifn-γ高th1产生(round等人,science332:974-977,2011;shen等人,cellhostµbe12:509-520,2012)。psa诱导的treg细胞具有表型,例如foxp3-il-10高ifnγ高(j.l.round等人,science332:974-977,2011;y.shen等人,cellhostµbe12:509-520,2012),但多数csgg诱导的treg细胞显示foxp3+il-10高ifnγ低。psa通过激活抗原呈递细胞来促进il-12分泌,并诱导树突细胞的激活而不是诱导抗性(cell,122(1):107-18,2005)。csgg诱导产生高水平il-10和ctla4的nrp1-helios-foxp3+和rorγt+foxp3+treg细胞。
在本发明的一个实施方案中,在体外和体内在gf小鼠中在脆弱拟杆菌与两歧双歧杆菌pri1之间比较了treg诱导的活性。单定殖有脆弱拟杆菌的小鼠显示foxp3+treg细胞没有增加,而在cd4+细胞中则显示ifnγ+il-10高。通过流式细胞术和elisa进行的细胞因子分析显示,在脆弱拟杆菌处理组中il-10和ifn-γ的表达水平高。此外,两歧双歧杆菌诱导foxp3+itreg细胞,而脆弱拟杆菌具有诱导il-10高tr1细胞而非foxp3treg细胞的高潜力。此外,没有直接证据表明给予psa或脆弱拟杆菌可以增强cd4+foxp3+treg细胞。
此外,在次优treg诱导条件下,psa处理的dc主要诱导foxp3-ifnγ+il-10高细胞,而csgg处理的dc产生foxp3+ifnγ-il-10高细胞。psa不能诱导抗原特异性treg细胞,因为它被加工并被呈递给与mhcii分子结合的t细胞(b.a.cobb等人,cellularmicrobiology7:1398-1403,2005)。相反,csgg很难加载到mhcii上,因此可诱导对食物性抗原或共生细菌有应答的多种抗原特异性treg细胞。这些功能差异可能由化学结构和机制方面的差异介导。psa具有独特的两性离子花样,它们交替包含带正电荷和带负电荷的糖残基。根据这样的电荷和大小,psa在t细胞刺激中具有不同的活性。天然psa的平均分子量为约130kda,并且其很小的片段(5000da片段)没有活性,但是据报道17.1kda片段(约22个重复单元)具有抑制结肠炎的功能(kalka-mollwm,等人jimmunol.164:719-724,2000)。psa通过tlr-2被吸收到dc中,被适当切割,然后与mhcii分子结合以与识别psa的t细胞相互作用,从而诱导特定辅助t细胞的分化(cobbba等人,cellmicrobiol.7:1398-1403,2005)。在这种情况下,由psa诱导的treg即tr1免疫调节性细胞对psa具有特异性,并且这种现象对未来的抗原特异性treg细胞诱导具有限制。csgg是一种中性多糖,平均约4000da,并且与psa不同,它主要通过调节dc特性而不是直接作用于t细胞来起作用。这种作用机制差异表明通过csgg处理来诱导各种抗原特异性treg细胞的可能性。即,在将处理的psa加载到mhcii上时,仅可产生psa特异性treg细胞。另一方面,csgg通过诱导dc的表型变化而不是通过内吞作用介导的加工和加载到mhcii上而导致rdc。
在本发明的一个实施方案中,在向gf小鼠给予csgg时,在clp和mln中cd4+nrp-foxp3+treg细胞显著增强。因此,用各种抗原处理的两歧双歧杆菌或csgg可以诱导抗原特异性treg细胞,例如食物性抗原特异性或共生细菌抗原特异性treg细胞。一个有趣的结果是bb定殖或给予csgg增强了大肠中rorγt+foxp3+treg细胞的水平。此外,与模拟itreg相比,用bb或csgg诱导的ibreg细胞具有更高的能够抑制肠炎的rorγt+foxp3+treg细胞群体。与结肠炎模型的模拟itreg细胞相比,由bb或csgg诱导的itreg细胞在foxp3基因座的cns2中显示出持续的foxp3表达,并具有较高的脱甲基化状态(50%至60%)。因此,认为由bb或csgg诱导的rorγt+foxp3+treg细胞属于肠道特异性效应treg(esposito等人,jimmunology185:7467-7473,2010;tartar等人,jimmunology184:3377-3385,2010;bhyang等人,mucosalimmunology9:444-457,2016)。通过研究先天免疫细胞在此过程中的作用,可以进一步研究bb或csgg处理增强rorγt+foxp3+treg细胞的基本机制。
本发明证明两歧双歧杆菌pri1及其效应分子csgg促进itreg细胞的产生。两歧双歧杆菌属于放线菌,已经在人的肠道中得到特异性鉴定,并且已显示是母乳喂养婴儿内脏微生物群的重要细菌成员之一(turroni等人,appliedandenvironmentalmicrobiology75:1534-1545,2009)。与自然分娩相比,剖宫产导致双歧杆菌属缺乏,其与儿童过敏、哮喘和自身免疫疾病相关联。与健康对照相比,ibd患者粪便中两歧双歧杆菌的比例较小(wang等人,journalofclinicalmicrobiology52:398-406,2014;verma等人,journalofclinicalmicrobiology48:4279-428,2010)。在各种类型的共生细菌中,双歧杆菌属在其调节宿主应答的能力方面通常比乳杆菌属具有更强的抗炎特性。然而,共生细菌的免疫调节作用是菌株特异性的,并且功能菌株的鉴定仍然是一个很大的挑战。例如,在相同的脆弱拟杆菌中,产生脂多糖的菌株会增加炎症信号并恶化疾病进展(walterj.lukiw等人,frontmicrobiol7:1544,2016)。另一方面,已知产生psa的菌株抑制炎性疾病。因此,确定每个相同物种如何具有不同的免疫学特性非常重要。作为鉴定菌株特异性免疫调节特异性的方法,存在一种鉴定细菌来源的物质及其免疫学特征并将这些物质用作功能标记物的方法。例如,丁酸盐可以是treg诱导型细菌的标记物,因为丁酸促进肠系膜treg细胞的分化(yukihirofurusawa等人,nature504:446-450,2013;liaohy等人,scientificreports,6:20481,2016)。另一种方法是通过比较基因组分析来鉴定与已知菌株具有高度遗传同源性的菌株(c.prestonneff,cellhostµbe,20(4):535-547,2016)。在本发明中,在两歧双歧杆菌菌株中,发现a8(99.97%)和lmg11582(99.98%)具有最高的碱基相似度和参与csgg合成的直系同源基因。已知ipla20015和a8菌株在人pbmc培养系统中作为treg增强型细菌。作为体外比较treg诱导活性的结果,a8菌株显示出与本发明菌株相似的活性,但是具有低碱基同源性(98.9%)并且缺乏与csgg合成相关联的一些直系同源基因的atcc29521展现出低得多的treg诱导活性。
在本发明中,确认了两歧双歧杆菌或csgg的给予可用作口服抗性佐剂,从而在体内诱导各种抗原特异性treg细胞。另外,两歧双歧杆菌或csgg处理诱导rdc而不干扰mhcii中的抗原呈递。因此,确认了在与自体免疫或过敏相关蛋白组合给予两歧双歧杆菌或csgg时,诱导了抗原特异性treg细胞,从而抑制了疾病进展。所述蛋白质的具体例子包括自身免疫疾病中涉及的自身抗原。例如,所述蛋白质可以包括类风湿性关节炎中涉及的自身抗原,例如热休克蛋白(hsp)、瓜氨酸化的丝聚蛋白、葡萄糖-6-磷酸异构酶、p205、胶原蛋白等;i型糖尿病中涉及的自身抗原,例如胰岛素、锌转运蛋白8蛋白(znt8)、胰腺和十二指肠同源框1(pdx1)、嗜铬粒蛋白a(chga)、和胰岛淀粉样多肽(iapp);和重症肌无力中涉及的自身抗原,例如乙酰胆碱受体。除了自身免疫疾病中已知的所有类型的自身抗原外,蛋白质还可以包括已知会引起食物过敏的各种过敏原,例如花生、牛奶、鸡蛋、树生坚果、豆、甲壳动物(例如虾等)、鱼来源的物质等等。
本发明涉及能够通过诱导或产生调节性t(treg)细胞来治疗超免疫疾病的细胞表面β-葡聚糖/半乳聚糖(csgg)多糖、以及表达所述细胞表面β-葡聚糖/半乳聚糖(csgg)多糖的两歧双歧杆菌pri1,并且由两歧双歧杆菌pri1表达的细胞表面β-葡聚糖/半乳聚糖(csgg)多糖与熟知的益生细菌的多糖不同,并且已发现csgg是诱导益生细菌的cd4+foxp3+treg细胞形成的重要物质,并通过产生tlr2介导的dc的机制展现出治疗炎性肠病或超免疫疾病的作用。在本发明中,鉴定了由两歧双歧杆菌pri1表达的细胞表面β-葡聚糖/半乳聚糖(csgg)多糖的具体结构式,并且首次发现csgg是诱导调节性t(treg)细胞的主要激动剂。本发明的csgg的β-d-葡聚糖的结构为β-1-6-葡聚糖,其功能与为已知的β-d-葡聚糖结构的2-取代的-(1,3)-β-d-葡聚糖完全不同。尽管已知的β-d-葡聚糖具有益生功能,但是本发明的β-1-6-葡聚糖本身具有免疫调节功能。另外,诸如多糖a(psa)之类的多糖不具有诱导除psa特异性treg之外的抗原特异性treg的能力,而产生csgg的菌株能够针对源自各种抗原(即食物、其他肠道细菌、和细菌本身)的物质诱导treg,因此psa和csgg在其结构和机制方面完全不同。很难将细胞表面上的多糖归纳为单一物质,但是本发明已经鉴定了结构差异如何与功能相关。即,csgg本身是由本发明的细菌产生的物质,是活性指示物,其可以代表诱导treg的细菌本身的功能。
csgg可以充当treg型细菌的新功能标记物,并且csgg或产生csgg的两歧双歧杆菌可以用作抗性诱导佐剂,以开发针对自身免疫和过敏性疾病的特定免疫疗法。
实施例
在下文中,将参考以下实施例更加详细地描述本发明。对于本领域的普通技术人员清楚的是,提供这些实施例仅是为了更具体地解释本发明,而并非旨在限制根据本发明的主旨的本发明的范围。
材料和方法
1.小鼠和细菌菌株
1-1:小鼠
在postech生物技术中心的动物设施中对小鼠进行管理,并且所有实验程序均已通过postech机构动物护理和使用委员会(iacuc)批准。无菌c57bl/6(b6)小鼠获得自andrewmacpherson(伯恩大学,瑞士)和davidartis(当时在宾夕法尼亚大学,当前在康奈尔大学,美国)博士,并由postech建立,并保持在无菌柔性膜隔离器(classbiologicalcleanltd.,美国)中。每月通过盲肠内容物监测gf状态。foxp3-egfp、tlr2-/-、tlr4-/-、tlr6-/-、和myd88-/-动物购自杰克逊实验室(jacksonlaboratory)。通过tagonicexchange程序获得c57bl/6-cd45a(ly5a)-rag1-/-tcrot-ii(rag1-/-ot-iitcr转化体)和rag1-/-小鼠。cbir小鼠获得自o.elsona(阿拉巴马大学伯明翰分校,伯明翰,al35294,美国;yingzicong,pnas,19256-19261,doi:10.1073/pnas.0812681106)。根据性别和年龄使用6周龄至12周龄的小鼠。
1-2:细菌
在补充有0.1%l-半胱氨酸的mrs培养基(bd,difco)中厌氧培养两歧双歧杆菌pri1和其他两歧双歧杆菌菌株,在mrs培养基中培养副干酪乳杆菌(l.paracasei)。为了进行单定殖,将细菌(5x108cfu/200μl)口服给予无菌(gf)小鼠。
2.来自两歧双歧杆菌的细胞表面多糖的纯化
收获培养的两歧双歧杆菌pri1,并用pbs洗涤两次。使用稍微修改过的现有方法进行细胞表面多糖的纯化(d.l.kasper等人,journalofbacteriology153:991-997,1983)。在68℃进行酸性苯酚(sigma-aldrich)处理,以提取包衣多糖,然后进行醚处理以去除残留的苯酚,并在蒸馏水中透析3天。为了除去核酸和蛋白质,在37℃下用dnasei(roche)和rnase(sigma-aldrich)处理过夜,然后在37℃下用链霉蛋白酶(来自灰色链霉菌的蛋白酶,sigma-aldrich)处理过夜。乙酸处理后,进行离心以除去沉淀物。添加冷却的乙醇以沉淀多糖,然后在蒸馏水中透析3天并冻干。将纯化的多糖溶解在水中,并使用hplc柱(tskgelg5000pwxl,东曹(tosho))进行凝胶过滤。进行阴离子交换色谱(hiprepqff16/10,gehealthcare)以进一步分离中性和带负电荷的多糖。通过酸酚分析来测定多糖的浓度(m.dubois等人,analyticalchemistry28:350-356,1956)。
3.通过16srrna基因分析进行细菌定殖分析
为了确认单定殖,使用nucleospindnastool(macherey-nagel)从小鼠的粪便或腔内容物分离细菌的基因组dna。
使用c1000接触式热循环仪(biorad)进行pcr分析,并使用下表1的引物。
[表1]
4.通过荧光原位杂交(fish)进行的细菌定殖测定
用两歧双歧杆菌pri1进行3周的单定殖后,处死小鼠,并将小肠分为3个区段:十二指肠(在幽门远端处1cm至3cm之内);十二指肠;空肠(距特赖茨氏韧带2cm至4cm之内);和回肠(在隔膜瓣处的1cm至3cm内)。使用用于组织学分析的carnoy溶液将小肠切片和结肠各固定1cm。滴下carnoy固定溶液(3:1甲醇:冰醋酸),将细胞悬浮液以500xg离心5分钟,然后将沉淀重新悬浮在carnoy固定溶液中(choolani等人,2007)。将用carnoy溶液固定化的石蜡包埋式切片脱蜡并与cy5标记的两歧双歧杆菌16srrna荧光探针(seqidno:5:bbif,5'-ccacaatcacatgcgatcatg-3')(dinoto等人,2006)杂交。将得到的探针与含有100ng探针的杂交缓冲液(100nmtris,ph7.2,0.9mnacl,0.1%sds)在45℃的加湿室中杂交16小时。将玻片在100ml预热(37℃)杂交缓冲液中洗涤15分钟,用10ml预热(37℃)洗涤溶液(100mmtris,ph7.2,0.9mnacl)洗涤15分钟(smith等人,2011),然后用4',6-二脒基-2-苯基吲哚(dapi)对dna进行免疫染色。将玻片用水洗涤并风干,然后用荧光显微镜(ix70,奥林巴斯,东京,日本)获取图像。
5.结肠炎的t细胞递送模型
根据先前报道的方法(a.izcue等人,annualreviewofimmunology27:313-338,2009;f.powrie等人,immunity3:171-174,1995)通过过继转移幼稚cd4+t细胞诱导结肠炎。将连同由两歧双歧杆菌pri1(bb)、csgg或模拟物处理诱导的itreg细胞(2×105)一起分选的幼稚cd4+cd62lhicd44lofoxp3gfp-t细胞(>99%纯度,1×106)静脉转移到rag1-/-小鼠中。通过每周两次称重来监测结肠炎的进展,并在小鼠体重达到初始体重的25%时确定实验结束。使用treg细胞作为阳性对照,将离体分离的cd4+foxp3gfp+treg细胞(2×105)与幼稚t细胞共递送至rag1-/-小鼠中。通过在实验结束时测量结肠长度和组织学评价来确定结肠炎的严重程度。还分析了treg细胞和细胞因子水平。
6.体内过继转移
将分选的幼稚多克隆cd4+cd62lhicd44lofoxp3gfp-t细胞(>99.5%纯度)(1×106)静脉内转移到gfc57bl/6小鼠中,并口服给予单一菌株。过继转移后三周将小鼠处死。为了分析treg细胞响应于食物性抗原的tcr特异性,在过继转移前将从ot-iicd4+cd62lhicd44lofoxp3gfp-t细胞分离的幼稚t细胞(1×106)静脉转移至单定殖有两歧双歧杆菌pri1的gfc57bl/6小鼠中持续2周,并且每隔一天饲喂ova(20mg/剂/小鼠)持续7天。为了分析treg细胞响应于共生细菌的tcr特异性,将经分选(>99.5%纯度)的幼稚cbircd4+cd62lhicd44lofoxp3gfp-t细胞(1×106)静脉递送至在spf条件下维持的c57bl/6小鼠中,并饲喂两歧双歧杆菌pri1(5x108cfu/剂)每周三次,直到实验完成。过继转移后三周将小鼠处死。
7.dc依赖性体外诱导itreg细胞
将结肠lpdc(mhcii+cd11c+cd11b+cd103+f4/80-)、脾脏总dc(tdc;mhcii+cd11c+)、脾脏cd8α+(mhcii+cd11c+cd11b-)和脾脏cd8α-(mhcii+cd11c+cd11b+)dc通过细胞分选或cd11c磁珠(miltenyibiotech)纯化。将分离的dc在含有10%fbs、5%青霉素/链霉素、2mml-谷氨酰胺、1mm丙酮酸钠、非必需氨基酸和β-me的完全rpmi1640培养基中培养。将脾脏dc(2x104)接种到96孔板中,并培养2小时,然后与所指示细菌、两歧双歧杆菌pri1的分化细胞部分或两歧双歧杆菌pri1的纯化多糖培养10小时至12小时。将细胞进行洗涤,并在次优treg诱导条件(0.1μg/ml抗cd3、100uil-2和0.1ngtgfβ)下,与幼稚cd4+t细胞(2x105)共培养3天。分别通过elisa和流式细胞术测定细胞因子或treg细胞的水平。
8.人类样品用于通过csgg处理进行dc分化和itreg细胞诱导
研究得到了韩国亚洲大学医院(ajouuniversityhospital)的机构审查委员会(irb)的批准(ajirb-bmr-smp-17-155),并且通过ficoll-hypaque梯度(lymphoprep,奈科明(nycomed),挪威)从健康供体中获得外周血单核细胞(pbmc)。使用cd14微珠试剂盒(miltenyibiotech)通过阳性选择从pbmc(cd14+>95%)中分离出单核细胞。在补充有10%热灭活fcs和抗生素的rpmi-1640培养基(2mml-谷氨酰胺、25mmhepes;biowhittaker)中在24孔板中在rhil-4(35ng/ml)和gm-csf(70ng/ml)(r&dsystems,英国)的存在下培养5x105个单核细胞/ml,持续7天。在第2天和第5天,将0.5ml培养基替换为含有gm-csf和il-4的新鲜培养基。在第7天,回收未成熟dc,并用模拟物或不同量的csgg预处理14小时。接下来,将细胞与从人pbmc分离的幼稚cd4+t细胞在次优treg诱导条件(0.1μg/ml抗cd3、100uil-2和0.1ngtgfβ)下培养3天。通过流式细胞术确定treg细胞的水平。
9.rna序列的数据可用性
从用模拟物或csgg(100μg/ml)刺激4小时的脾脏cd11c+dc中提取总rna,并通过ribospintmii(geneallbiotechnology)纯化。使用nanodrop2000tm(thermofisherscientific)进行rna定量和质量控制。使用truseq链式mrna样品制备试剂盒(illumina)进行文库制备,并使用nextseq500测序系统进行rna测序。rna序列数据保存在geneexpressionomnibus(ncbi)数据存储中,登录号为geo:rna序列数据:gse98947。
10.rna分离和实时定量rt-pcr
使用m-mlv逆转录酶(promega,麦迪逊,威斯康星州,美国),将使用trizol试剂(invitrogen)从结肠和clpdc分离的总rna进行逆转录,以制备cdna。使用以下引物组(表2)和chromo4检测器(biorad)对合成的cdna进行定量实时pcr(qrt-pcr)。
[表2]
所有qrt-pcr程序均在相同条件下进行40个循环:在95℃持续5分钟,在95℃持续30秒,在62℃持续30秒,以及在72℃持续30秒。将数据归一化为hprt表达水平的值。结果描述为治疗组之间每个基因的相对表达水平。
11.淋巴细胞分离和流式细胞术
使用细胞分离器从mln、pln和脾脏中纯化幼稚cd4+t细胞(纯度为98%或更高)。沿纵向方向打开小鼠的大肠和小肠,并通过用pbs洗涤除去粘液。将大肠切成小块,并在37℃下与10mmedta、20mmhepes、1mm丙酮酸钠、3%fbs和不含ca2+和mg2+的pbs摇动培养20分钟。用剃刀将组织研磨成较小的块,并在含有3%fbs、20mmhepes、1mm丙酮酸钠和0.5mg/ml胶原酶d(roche)和dnasei(sigma)的rpmi1640培养基中在37℃摇动培养45分钟。酶处理后,使用100μm细胞过滤器用含有10mmedta的冷pbs过滤上清液。将细胞置于percolltm(gehealthcare)梯度(顶部40%percoll,底部75%percoll),并在2000rpm下不间断离心20分钟。取层中的在40%与75%之间的细胞,并用含有10%fbs(hyclone)、pen/strep、β-me、丙酮酸钠和2.0mml-谷氨酰胺的rpmi培养基(hyclonesh30027.01)洗涤两次,并用于facs染色。首先使用live/dead可固定活力染料(ebioscience)或pi在pbs中对细胞悬浮液进行活/死染色。此后,在含有1%fbs(gibco)和edta(sigma-aldrich)的缓冲液中进行进一步染色。在含有0.2%牛血清白蛋白的pbs中进行表面染色20分钟。对于细胞内转录因子染色,将细胞用固定/透化缓冲液(ebioscience)和1x透化/洗涤缓冲液(ebioscience)进行染色。为了进行细胞内细胞因子分析,在37℃下使用golgiplug(bdbiosciences,0.5μl/样品)用500ng/ml的离子霉素(calbiochem)和100ng/ml的pma(calbiochem)再刺激纯化的固有层淋巴细胞持续4至5小时。将细胞固定在ic固定缓冲液(ebioscience)中,并在透化/洗涤缓冲液(ebioscience)中被赋予通透性,然后用il-10、il-13、ifn-γ和il-17a抗体染色。
使用了以下抗体克隆。cd4(rm4-5)、cd44(im7)、cd62l(mel-14)、cd45.1(a20)、cd45.2(104)、cd90.1(thy1.1)(ox-7)、cd90.2(thy1.2)(30-h12)、cd103(2e7)、vα2(b20.1)、foxp3(fjk-16s)、ctla4(uc10-4b9)、nrp1(3e12)、helios(22f6)、t-bet(4b10)、rorγt(afkjs-9)、gata-3(16e10a23)、il-10(jes5-16e3)、il-13(ebio13a)、ifn-γ(xmg1.2)、il-17a(17b7)、cd11c(n418)、cd11b(m1/70)、f4/80(bm8)、mhcii(m5/114.15.2)。
为进行流式细胞术分选,将死细胞排除并且对种群用如下进行门控:lpdc(cd45+mhcii+cd11c+cd11b+cd103+f4/80-)、spdc(mhcii+cd11c+cd11b+cd8α+或mhcii+cd11c+cd11b+cd8α-)、幼稚cd4+t细胞(cd4+cd45.1+cd62lhicd44lofoxp3gfp-)、幼稚ot-iitcr转基因t细胞(cd4+cd90.1+ot-ii+cd62lhicd44lofoxp3gfp-)、cbirtcr转基因幼稚t细胞(cd4+cd45.1+cd62lhicd44lofoxp3gfp-)。
使用moflo-xdp进行细胞分选,使用配备有五个激光器的lsrfortessa流式细胞仪(bdbiosciences)进行流式细胞术。使用facsdiva软件(bdbiosciences)和flowjo软件分析数据。
12.使用cdr3高通量测序进行tcr谱库分析
从gf小鼠或单定殖两歧双歧杆菌pri1持续3周的小鼠的分选cd4+foxp3gfp+treg细胞中提取总rna。使用isogen试剂盒(nippongene)通过fvd染色排除死细胞。使用repertoiregenesis公司的无偏tcr谱库分析技术进行新一代测序。通过现有方法进行衔接子-连接pcr(r.yoshida等人,immunogenetics52:35-45,2000)。用superscriptiii逆转录酶(invitrogen)合成第一双链cdna,与5'衔接子寡核苷酸连接,然后使用对衔接子和tcrα恒定区或tcrβ恒定区特异的引物进行pcr扩增。在扩增tcrα和tcrβcdna之后,使用nexteraxtindexkitv2seta(illumina)添加索引(条形码)序列。使用illuminamiseq配对末端平台(2×300bp)进行测序。使用来自repertoiregenesis公司的谱库分析(repertoireanalysis)软件进行数据处理。使用来自internationalimmunogeneticsinformationsystem(imgt)数据库(http://www.imgt.org)的参考序列的可能数据集来分配tcr序列。除去低得分序列后,使用由repertoiregenesis公司(茨城(ibaraki),日本)开发的生物信息学软件进行tcr谱库分析。与其他序列读段不同的序列读段被定义为唯一序列读段(usr)。相同的usr的副本号由rg软件自动计算。
13.tgf-β中和对itreg细胞体外产生的作用
将脾脏mhcii+cd11c+dc(2×104)接种到圆底96孔板中持续2小时,然后用两歧双歧杆菌pri1或csgg培养12小时。将细胞洗涤,并在0.1μg/ml抗cd3(bdbioscience)、100uil-2(peprotech)和0.1ng/mltgf-β的存在下或在不存在15μg/ml抗tgf-β抗体(r&d)的情况下与幼稚cd4+t细胞(2×105)共培养。培养3天后,使用流式细胞术分析cd4+foxp3+t细胞的群体。
14.体外抑制测定
将体外产生的cd45.1+cd4+foxp3gfpitreg细胞分选并与经脉冲处理的反应性细胞(thy1.1+cd4+foxp3-)在37℃下培养10分钟。将用ctv标记的细胞用pbs洗涤两次并立即使用。去除了t细胞的脾细胞(1×105)、ctv脉冲反应性细胞(5×104),并在圆底96孔板中将指示量的itreg细胞与0.5μg/ml抗cd3混合。将细胞培养4天,并通过流式细胞术分析其增殖以确定ctv强度的稀释度。通过比较单独的应答细胞百分比,将抑制率(%)计算为分裂细胞的总百分比。
15.组织学
通过采用h&e染色进行的组织学分析来评价实验性结肠炎的临床状况。收集结肠并固定在10%甲醛中。固定后,将组织包埋到石蜡块中,切成3μm厚度,并用苏木精(sigma-aldrich)和伊红(sigma-aldrich)染色。
16.统计分析
使用graphpadprism软件(拉荷亚(lajolla),加利福尼亚州)进行统计分析,并使用未配对的学生t检验评价对照组与实验组之间的差异。数据表示为平均值±sem。对于treg细胞和实验性结肠炎的体内稳定性分析,采用bonferroni多重比较检验使用双向方差分析进行统计分析。认为p<0.05具有显著性。
实施例1:treg诱导型细菌筛选
由免疫调节性微生物在体内增强treg细胞使得能够调节与炎性障碍相关联的失调。为了在视为安全的微生物中鉴定treg诱导型细菌,使用先前报道的离体筛选系统(kwon等人,pnas107:2159-2164,2010,kimje,jfunctfoods.350-362,2015)对200株或更多的益生菌菌株进行筛选。
将每种细菌菌株与foxp3报告小鼠的肠系膜淋巴结(mln)细胞在抗生素
结果是,选定两歧双歧杆菌pri1(两歧双歧杆菌;bb)作为foxp3+treg诱导型细菌(参见图2a和2b)的最佳候选者,并且选定副干酪乳杆菌坚韧亚种467(lactobacillusparacaseisub.tolerans467)(l.paracasei;lpa)作为不诱导免疫应答的对照菌株。选定的两歧双歧杆菌pri1于2017年5月19日保藏在韩国生物科学与生物技术研究所的韩国典型培养物保藏中心(保藏号:kctc13270bp)。
实施例2:由两歧双歧杆菌诱导treg细胞
检查了两歧双歧杆菌是否能够在体内诱导treg细胞。
分节丝状细菌(sfb)被用作th17诱导型对照细菌。通过将两歧双歧杆菌(bb)单一给予到无菌(gf)小鼠,所述细菌稳定地定殖在结肠中(参见图2c),并且增大的盲肠大小被归一化为与正常spf小鼠相似的大小(参见图2d)。这意味着bb的纤维消化活性。此外,诸如丁酸盐和乙酸盐等短链脂肪酸(scfa)是膳食纤维发酵的最终产物,因此,定殖有bb的小鼠展现出丙酸盐水平没有变化,而盲肠和粪便中乙酸盐和丁酸盐水平显著增加(参见图2e)。
与副干酪乳杆菌(lpa)或spf不同,定殖两歧双歧杆菌(bb)3周的gf小鼠展现出在结肠固有层(clp)中foxp3+treg细胞的频率急剧增加(参见图1a和2f)。另外,treg细胞在其他器官例如肠系膜淋巴结(mln)、脾脏、小肠固有层(silp)和外周淋巴结(ln)中略有增加(参见图3a)。在定殖有两歧双歧杆菌(bb)的gf小鼠的结肠固有层(clp)中的treg细胞展现出显著更高比例的cd103+和记忆表型(cd62llocd44hi)(参见图3b和3c),并且还展现出高水平的ctla4和il-10(参见图1b和1c)。
实施例3:由bb新产生的itreg
由于treg细胞可以进一步分化为胸腺来源的treg(ttreg)或外周诱导的treg(ptreg或itreg),因此通过分析treg细胞中的helios和nrp1表达来跟踪treg的起源。
为了将helios+npr1+胸腺来源的treg(ttreg)与helios-npr1-外周来源的treg(ptreg)(在体外培养条件下生产的情况下称为“itreg”)区分开来,观察ikaros家族转录因子helios和神经毡蛋白1(nrp1)的表达(j.m.weiss等人,thejournalofexperimentalmedicine209:1723-1742,2012;e.m.shevach等人,immunologicalreviews259:88-102,2014;j.p.edwards等人,thejournalofimmunology193:2843-2849,2014)。
结果是,在定殖有两歧双歧杆菌的clp中,nrp1+ttreg细胞略有增加,但是在所有器官中nrp1-和heliosloptreg细胞增加得更多(参见图1d至1f和图4a至4c)。另外,大部分新产生的ptreg表达转录因子rorgt(参见图1g和4d),并且这通过与微生物的相互作用而被上调(b.yang等人,mucosalimmunology9:444-457,2016;e.sefik等人,science349:993-997,2015)。
接下来,为了确认由bb定殖诱导的treg细胞的增加不是现有treg细胞的扩增,而是从外周组织的幼稚cd4+t细胞新产生的,进行了过继转移实验。通过将从foxp3gfp分选的经等位基因标记的幼稚cd4+cd45.1+foxp3-cd62lhicd44lot细胞过继转移到单定殖有两歧双歧杆菌的gf小鼠中,来确定两歧双歧杆菌诱导的treg细胞的外周起源(参见图5a)。
作为3周后的供体细胞分析的结果,在定殖有两歧双歧杆菌(clp)的gf小鼠的肠道中显示供体细胞中的大部分foxp3+treg细胞(参见图4a至4d)。在给予两歧双歧杆菌3周的spf小鼠中,类似地增加了ptreg细胞的诱导(参见图5e)。这些结果表明给予两歧双歧杆菌使得能够主要从结肠中的幼稚cd4t细胞新生产itreg。
实施例4:ptreg细胞的tcr特异性分析
分析在两歧双歧杆菌的存在下产生的ptreg细胞的tcr特异性。测试了两歧双歧杆菌定殖是否促进食物性抗原中的ptreg细胞,即两歧双歧杆菌定殖是否可以增加食物性抗原反应性itreg细胞的产生。将ova特异性tcr转化的ot-ii小鼠的经ctv标记的幼稚cd4+thy1.1+foxp3-t细胞过继转移到gf小鼠中,然后对小鼠定殖bb或不定殖,然后提供口服ova蛋白。即,将ot-ii.thy1.1+foxp3gfp小鼠的经ctv标记的ova特异性幼稚cd4+细胞过继转移到给予了ova蛋白的正常或两歧双歧杆菌定殖的gf小鼠中(参见图7a)。
结果是,如先前观察到的(k.s.kim等人,science351:858-863,2016),正常gf宿主中一小部分扩增的ot-ii细胞上调了silp和clp中的foxp3(参见图6a和6b)。即,与饲喂ova的gf小鼠相比,定殖有bb的小鼠主要在clp中展现出thy1.1+ot-ii-specificfoxp3+treg细胞和宿主来源的treg细胞的显著增加。具体而言,在定殖有两歧双歧杆菌的小鼠中,供体ot-ii细胞上调foxp3的效率在clp中提高了2倍至3倍,但在silp和mln中没有变化(参见图6b)。
实施例5:微生物群特异性ptreg细胞的生产
为了确定两歧双歧杆菌定殖是否促进微生物群特异性ptreg细胞的产生,使用了识别细菌鞭毛蛋白的cbirtcr转基因小鼠(y.cong等人,thejournalofimmunology165:2173-2182,2000)。从cd45.1+foxp3gfp背景上的cbir转基因小鼠中分选出幼稚cd4+foxp3-t细胞,并过继转移到spfrag1-/-受体中,然后每隔一天提供模拟物(pbs)或两歧双歧杆菌,持续5周(参见图7b)。
结果是,仅cbirt细胞的对照spfrag1-/-受体显示出结肠炎的显著体征,如进行性体重减轻(参见图6c)、少量treg细胞(参见图6f)、高比例的cd4+ifnγ-和rorγ-+foxp3-t细胞(参见图6g和7c)、结肠变短(参见图6d)以及粘膜增厚(参见图6e)等所指示的。在注射cbirt细胞并组合给予两歧双歧杆菌的宿主中,几乎没有这些各种病理体征(参见图6c至6g和7c)。
实施例6:itreg细胞对两歧双歧杆菌本身的特异性
为了测试两歧双歧杆菌诱导的ptreg细胞是否对两歧双歧杆菌本身具有特异性,将定殖有两歧双歧杆菌的gf小鼠的总结肠cd4+t细胞与使用来自正常gf小鼠和定殖有两歧双歧杆菌或副干酪乳杆菌的gf小鼠的粪便抗原预处理的脾脏apc共培养,并在3天后,分析这些细胞的t细胞增殖(ctv稀释)(参见图7d)。
结果是,多数treg细胞在体外培养条件下死亡,而定殖有两歧双歧杆菌的gf小鼠的foxp3+treg细胞在用两歧双歧杆菌ag处理的apc刺激时维持foxp3表达和增殖(参见图6h和7e)。
此外,通过对分选自结肠、mln和脾脏的foxp3+treg细胞的α-链和β-链进行测序比较了gf和两歧双歧杆菌单定殖的小鼠的tcr特异性。
结果是,尽管两种treg细胞在α-链和β-链中均显示出相似的多样性模式(参见图8a),但是来自两歧双歧杆菌定殖的小鼠的结肠treg细胞显示出在gf对照中不存在的单独tcr模式(参见图6i和8a至8d)。总体而言,这些结果表明两歧双歧杆菌诱导功能活跃的cd4+foxp3+treg细胞,这些细胞对食物性抗原和/或共有微生物群和两歧双歧杆菌本身具有广泛的tcr特异性。
实施例7:两歧双歧杆菌定殖造成rdc的诱导和新的ptreg分化增强
检查了两歧双歧杆菌的定殖是否诱导了调节性树突细胞(rdc)的群体,所述群体可增强新的ptreg分化。
由于将幼稚t细胞分化为itreg细胞需要免疫调节性细胞因子环境,因此测试了两歧双歧杆菌的定殖是否在结肠中诱导了致耐受的环境。与gf小鼠相比,从bb定殖的小鼠分离的clp-dc(mhcii+cd11c+cd11b+cd103+f4/80-)和总结肠细胞不仅显著增加抑制分子如il10、csf2、tgfβ1、ido、ptgs2、pdcd1的mrna表达,而且显著增加共刺激分子cd86和cd40的mrna表达(参见图10a至10d)。这表明bb的定殖可以诱导促进itreg细胞分化的调节性树突细胞(rdc)。
另外,通过以下方式进行了体内模拟实验:将分选的clp-dc与两歧双歧杆菌培养10至12小时,然后洗涤,然后在次优treg诱导条件下与幼稚cd4+foxp3-t细胞共培养3天。用两歧双歧杆菌预处理clp-dc的结果是,与模拟物处理组或用副干酪乳杆菌(lpa)处理的对照相比,对itreg细胞和il-10的产生及其增殖的诱导增加了(参见图10e至10g)。
实施例8:两歧双歧杆菌的效应分子的鉴定
8-1:两歧双歧杆菌的效应分子
使用体外系统,进行了广泛实验,以鉴定两歧双歧杆菌来源的促进itreg分化的效应分子。由于两歧双歧杆菌为厌氧的,并且在与dc共培养期间几乎不可存活,因此测试了bb的某些细胞组分是否为具有itreg诱导活性的效应分子。
结果是,在细胞壁、细胞膜和胞质溶胶的各个部分中,只有细胞表面提取物有效地诱导treg细胞。用rnase、dnase、链霉蛋白酶处理细胞表面提取物或在高温下煮沸不会降低treg诱导活性,这表明多糖可以是效应分子。实际上,总细胞表面多糖(tcsps)以剂量依赖性方式诱导treg细胞(参见图11a和11b)。
通过离子排阻色谱分离tcsps,然后对以低离子强度洗脱的级分进行深入nmr分析。
结果是,两歧双歧杆菌的细胞表面多糖由量不同(摩尔/摩尔)的至少5个种类组成(参见图11c);β-1-6-葡聚糖(18%)、β-1-4-半乳聚糖(5%)、β-1-6-半乳聚糖(5%)、β-半乳呋喃聚糖(2%)、磷酸甘油-β-半乳呋喃(pgβg)(64%)。多糖pgβg在总多糖中最丰富(64%),平均分子量为8000da,并带负电,而其余四种多糖(β-1-6-葡聚糖、β-1-4-半乳聚糖、β-1-6-半乳聚糖和β-半乳呋喃聚糖)具有相似的分子量(平均约4000da),并且不再单独分离。
接下来,测试了多糖或pgβg的中性混合物中哪种多糖具有体外诱导treg细胞的活性。结果是,仅中性多糖而非带负电荷的多糖pgβg诱导treg细胞(参见图11d)。
因此,源自两歧双歧杆菌的中性多糖的混合物称为“细胞表面β-葡聚糖/半乳聚糖(csgg)”。
8-2:鉴定csgg对treg的诱导
在csgg多糖中,细胞表面β-1-6-葡聚糖(csβg)可以是关键的效应分子,因为在用β-1,6-葡聚糖酶处理后,csgg诱导的itreg细胞的水平以剂量依赖性方式降低(参见图9a、9b和11e)。此外,在不存在dc的情况下csgg和幼稚cd4+t细胞的共培养不能诱导itreg细胞,由此表明csgg通过dc依赖性来诱导treg细胞(参见图11f)。
接下来,测试了csgg是否可以在体外和体内重现完整细菌诱导treg细胞的能力。csgg处理的dc以剂量依赖性方式与两歧双歧杆菌处理的dc一样有效地诱导foxp3+itreg细胞(参见图12a)。向gf小鼠腹膜内注射csgg(100μg/剂)3次,持续3周,结果是,在clp和mln中诱导了cd4+foxp3+和nrp1-rorγt+treg细胞,类似于两歧双歧杆菌定殖的小鼠(参见图9c、12b、和12c)。这些treg细胞与来自对照gf小鼠的treg细胞相比,展现出更高比例的cd103+和激活的表型cd44hicd62llofoxp3+(参见图12d)。而且,源自健康供体的pbmc的人dc和幼稚cd4t细胞与csgg的共培养以剂量依赖性方式诱导了cd25+foxp3+treg细胞(参见图9d)。
8-3:csgg合成基因同源性和treg诱导活性
如所知,乳酸细菌的抗过敏作用取决于菌株,并且受th1/th2细胞因子表达和平衡的影响(fujiwarad等人,intarchallergyimmun.135(3):205-215,2004),由于益生细菌的功能活性对物种是非特异性的而是菌株特异性的,因此测试了所有两歧双歧杆菌菌株是否都能诱导itreg细胞,或是否仅与根据本发明的两歧双歧杆菌pri1菌株具有高碱基同源性的菌株具有itreg诱导活性。对根据本发明的两歧双歧杆菌pri1菌株进行了全基因组测序(genbank登录号;cp018757),并且比较了与csgg合成相关的预期直系同源基因和其他两歧双歧杆菌基因组的碱基同源性和treg诱导活性。
结果是,本发明的两歧双歧杆菌pri1展现出与其他两歧双歧杆菌菌株的高度同源性。具体而言菌株a8(lopezp等人,plosone,6(9):e24776,2011)具有与本发明的两歧双歧杆菌pri1菌株相似的活性,但在与csgg合成有关的一些直系同源基因中展现出缺陷以及更低的treg诱导活性。
实施例9:csgg产生rdc的机制
如在用两歧双歧杆菌定殖的小鼠的clp-dc中观察到的,测试了csgg处理是否诱导一般dc表型修饰为调节性dc(rdc)。即,为了鉴定通过csgg产生rdc的基本机制,对用csgg处理4小时的cd11c+dc进行了rna序列分析。
结果是,与模拟物对照治疗相比,csgg治疗显著增强了rdc相关标记物如ifna2、pdcd1、tgfβ1、csf2、ptgs2、il10和il27的mrna和蛋白质水平(参见图9e和13a)。
csgg处理还显著增加了il-10和tgf-β的蛋白质水平,同时降低了ifn-γ的水平。与il-10相比,tgf-β可起关键作用,因为添加抗tgfβ中和抗体能使得由两歧双歧杆菌或csgg处理诱导的iteg产生几乎完全被阻断(参见图13b和13c)。csgg处理选择性地增加了tlr2表达(参见图13d),并且由于tlr2-/-或myd88-/-dc展现出csgg介导的itreg诱导的显著降低(参见图9f、9g和13e),因此在dc的各种模式识别受体中,tlr2和myd88可以是参与csgg识别和信号传导的主要分子。tlr2缺陷型dc诱导培养物中tgfβ1和il-10的减少(参见图9g),但展现ifnγ水平无变化(参见图13f)。c型凝集素受体(clr)可不参与csgg介导的itreg细胞产生(参见图13g和13h)。
实施例10:csgg诱导的treg细胞的功能
在体外和体内检查了csgg诱导的treg细胞的功能。
由于itreg细胞在炎症状态下通常不起作用或不稳定,因此测试了通过csgg处理所诱导的并在体外产生的itreg细胞的免疫抑制活性。将cd45.1+cd4+foxp3-幼稚t细胞与经模拟物或csgg处理的dc培养2天,然后分选以纯化cd45.1+cd4+foxp3+itreg。将ctv标记的应答者cd45.2+cd4+foxp3-t细胞与cd45.1+treg细胞以不同的比率共培养,然后通过facs分析其增殖。
结果是,在体外条件下,在csgg处理的dc的存在下产生和分选的itreg细胞与和经模拟物处理的dc培养的细胞相比,展现出显著增强的免疫抑制能力(参见图15a)。
为了测试体内treg细胞的抑制活性,使用了结肠炎的t细胞转移模型。将幼稚cd4+t细胞单独或与经等位基因标记的(cd45.1+)itreg细胞相组合转移到rag1-/-淋巴细胞减少症小鼠中(参见图14a)。
结果是,共注射模拟物诱导的itreg细胞无效,并且不能抑制结肠炎的体征。单独给予幼稚t细胞的小鼠在3周内也展现出结肠炎的严重体征和体重减轻。相反,两歧双歧杆菌或csgg诱导的itreg细胞的转移显著降低了结肠炎的发展并显著减轻了体重减轻(参见图14a至14d和15b)。
实施例11:给予csgg抑制结肠炎发展
为了检查给予csgg本身是否可抑制结肠炎发展,将从cd45.1+foxp3gfp小鼠分选出的幼稚cd4+foxp3-t细胞过继转移至spfrag1-/-宿主小鼠中,然后腹膜内给予pbs或csgg(100μg/剂),每周三次,直到实验结束。
结果是,转移有幼稚t细胞并随后进行pbs处理的小鼠产生了严重的结肠炎,而给予csgg的小鼠显著减轻了体重减轻并显著降低了组织学分析的结肠炎进展(参见图14e至14g和15c)。csgg处理的保护作用与总foxp3+treg细胞的增加和产生ifn-γ的效应t细胞的频率减少相关(参见图14h和15c)。这些结果表明,通过csgg处理所诱导的cd4+foxp3+treg细胞能够抑制炎性结肠炎的进展。
保藏号
保藏组织名称:韩国生物科学与技术研究所
保藏号:kctc13270bp
保藏日期:2017年5月19日
实用性
根据本发明的多糖,例如细胞表面β葡聚糖/半乳聚糖多糖(csgg),和产生csgg的两歧双歧杆菌pri1(kctc13270bp)可以通过各种抗原诱导treg细胞,因此菌株、csgg或诱导的treg细胞可用于预防或治疗免疫疾病或炎性疾病。
尽管已经参考具体特征详细描述了本发明,但是对于本领域技术人员来说清楚的是,此描述仅用于优选实施方案并且不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等同物来限定。
文本文件
所见所附序列表。
布达佩斯条约关于用于专利程序的国际认可的微生物保藏
国际表格
原始保藏情况下的证明
其按照细则7.1颁布
至:im,sin-hyeog
浦项工科大学校产学协力团
韩国庆尚北道浦项市南区青岩路77号37673
表格bp/4(kctc表格17)单页
序列表
<110>基础科学研究院
浦项工科大学校产学协力团
<120>新型两歧双歧杆菌菌株和菌株来源的多糖
<130>pp-b2060
<150>kr10-2017-0075079
<151>2017-06-14
<160>27
<170>kopatentin3.0
<210>1
<211>19
<212>dna
<213>人工序列
<220>
<223>eub-f
<400>1
tcctacgggaggcagcagt19
<210>2
<211>26
<212>dna
<213>人工序列
<220>
<223>eub-r
<400>2
ggactaccagggtatctaatcctgtt26
<210>3
<211>21
<212>dna
<213>人工序列
<220>
<223>bibif-(正向)
<400>3
ccacatgatcgcatgtgattg21
<210>4
<211>19
<212>dna
<213>人工序列
<220>
<223>bibif-(反向)
<400>4
ccgaaggcttgctcccaaa19
<210>5
<211>21
<212>dna
<213>人工序列
<220>
<223>bbif
<400>5
ccacaatcacatgcgatcatg21
<210>6
<211>21
<212>dna
<213>人工序列
<220>
<223>hprt(正向)
<400>6
ttatggacaggactgaaagac21
<210>7
<211>22
<212>dna
<213>人工序列
<220>
<223>hprt(反向)
<400>7
gctttaatgtaatccagcaggt22
<210>8
<211>20
<212>dna
<213>人工序列
<220>
<223>il-10(正向)
<400>8
ataactgcacccacttccca20
<210>9
<211>20
<212>dna
<213>人工序列
<220>
<223>il-10(反向)
<400>9
tcatttccgataaggcttgg20
<210>10
<211>19
<212>dna
<213>人工序列
<220>
<223>tgf-b(正向)
<400>10
ctcccgtggcttctagtgc19
<210>11
<211>22
<212>dna
<213>人工序列
<220>
<223>tgf-b(反向)
<400>11
gccttagtttggacaggatctg22
<210>12
<211>22
<212>dna
<213>人工序列
<220>
<223>il-b(正向)
<400>12
caaccaacaagtgatattctcc22
<210>13
<211>20
<212>dna
<213>人工序列
<220>
<223>il-b(反向)
<400>13
tgccgtctttcattacacag20
<210>14
<211>20
<212>dna
<213>人工序列
<220>
<223>csf2(正向)
<400>14
agggtctacggggcaatttc20
<210>15
<211>23
<212>dna
<213>人工序列
<220>
<223>csf2(反向)
<400>15
ggcagtatgtctggtagtagctg23
<210>16
<211>21
<212>dna
<213>人工序列
<220>
<223>pd-l1(正向)
<400>16
gctccaaaggacttgtacgtg21
<210>17
<211>21
<212>dna
<213>人工序列
<220>
<223>pd-l1(反向)
<400>17
tgatctgaagggcagcatttc21
<210>18
<211>21
<212>dna
<213>人工序列
<220>
<223>ido(正向)
<400>18
gctttgctctaccacatccac21
<210>19
<211>19
<212>dna
<213>人工序列
<220>
<223>ido(反向)
<400>19
caggcgctgtaacctgtgt19
<210>20
<211>22
<212>dna
<213>人工序列
<220>
<223>cox2(正向)
<400>20
tggctgcagaattgaaagccct22
<210>21
<211>22
<212>dna
<213>人工序列
<220>
<223>cox2(反向)
<400>21
aaaggtgctcggcttccagtat22
<210>22
<211>21
<212>dna
<213>人工序列
<220>
<223>cd80(正向)
<400>22
acccccaacataactgagtct21
<210>23
<211>21
<212>dna
<213>人工序列
<220>
<223>cd80(反向)
<400>23
ttccaaccaagagaagcgagg21
<210>24
<211>20
<212>dna
<213>人工序列
<220>
<223>cd86(正向)
<400>24
tgtttccgtggagacgcaag20
<210>25
<211>23
<212>dna
<213>人工序列
<220>
<223>cd86(反向)
<400>25
cagctcactcaggcttatgtttt23
<210>26
<211>18
<212>dna
<213>人工序列
<220>
<223>cd40(正向)
<400>26
ccttgcactgtgaggaga18
<210>27
<211>20
<212>dna
<213>人工序列
<220>
<223>cd40(反向)
<400>27
cttcgcttacaacgtgtgct20
pct/ro/134表
- 还没有人留言评论。精彩留言会获得点赞!