高通量高效细胞转染的方法及装置与流程
优先权声明
本申请根据美国专利法第35编第119条(e)的规定,要求2018年8月31日提交的序列号为62/725,382的美国临时专利申请的优先权,并通过引用将其全部内容合并与此。
背景技术:
生物学、医学、药物研究和其他领域的许多应用都涉及将遗传物质引入细胞的技术。当应用细菌或非动物真核细胞(包括植物细胞)时,经常使用术语“转化”。“转染”几乎总是指真核细胞的研究,而“转导”通常适用于病毒介导的基因转移到真核细胞中。
感兴趣的材料不仅可以包括dna、sirna、mrna、rnp复合物,还可以包括小分子或蛋白质,例如抗体。在许多情况下,这种“货物”材料的转移涉及在细胞膜上打开瞬时孔隙或“洞”,以允许其吸收,从而改变或从基因上修饰细胞。
常用于暂时透化细胞的技术是电穿孔。当进行电穿孔时要考虑的参数包括细胞特性(例如细胞大小、形状、膜结构、表面电荷)、细胞环境以及所施加电场的属性(例如,脉冲强度、脉冲数量、脉冲持续时间、脉冲形状和/或频率)。通常认为,电穿孔过程中的膜透化发生在所施加的电场诱导跨膜电势的阈值或“电穿孔阈值”之后,并且在给定的施加的电场下,存在成功电穿孔所需的脉冲数量和脉冲长度的阈值。schwan方程和相关推导常用于估计细胞的跨膜电位,该电位根据相关实验参数而开发,包括外加电场、细胞大小、介质电导率、细胞质和细胞膜以及膜厚度(analyticaldescriptionoftransmembranevoltageinducedbyelectricfieldsonspheroidalcells,biophysicaljournal,第79卷,2000年8月,670-679页)。
技术实现要素:
传统上,通过电穿孔对细胞进行的基因修饰是使用比色杯进行的批量处理。不太普遍的,可能采用批量配置的一些缺少自动化功能的商业设备。
例如,现有的电穿孔过程通常使用专门的低电导率缓冲液,这可能会对细胞活力产生负面影响,尤其是在长时间暴露的情况下。因此,批量加工需要若干缓冲液更换和清洗步骤,这使得该方法耗费大量人力,并且难以扩大规模以满足不断增长的大批量生产需求。手动洗涤和/或过滤步骤也很慢,因此细胞仍会暴露在电穿孔缓冲液中达数分钟至约一小时的时间。这些步骤通常与细胞流失(细胞回收率低)有关。高通量转染系统同样缺乏。
随着细胞疗法趋向于使用同种异体而非自体细胞来源进行大规模生产,使用批量方法对细胞疗法进行生物处理变得越来越棘手。
此外,市售的电穿孔装置会使生物制品与电极直接接触而暴露,从而由于局部加热和法拉第副产物(水合氢离子、羟基离子、氯、自由基和电极分解副产物(例如,铝离子和微粒))而造成潜在损坏。没有微流体,许多传统的电穿孔方法无法将热量从热敏感的生物实体中转移,或者不能有效地进行转移。在某些情况下,细胞(或其他基质)和有效载荷(货物)缺乏共定位,导致效率低下和(有价值的)材料损失。
因此,需要至少解决上述一些问题的设备和方法。
本文描述了以无需人工干预、自动化、高通量、连续的过程进行遗传物质或其它材料向细胞转移的方法。
一些实施方案依赖于微流体动力学鞘流结构,并且包括将细胞从含有诸如细胞培养基的侧流输送至包含电穿孔缓冲液的中央流的装置。电穿孔可以在组件中进行,在组件中,两个或多个微流体通道以平行结构配置提供,并且在组件中,各层可以堆叠在一起以形成层压型结构。每个微流体通道都配有一对电极,电极的结构最好能承受长期、连续和高通量的操作。
在一个实施方案中,所述装置是系统的一部分,所述系统包括共用储器、用于将流体驱动到储器和/或从储器驱动流体的泵送系统、用于电穿孔的电压发生器和用于系统的部分或完全自动化的控制器。至少可以使用一个培养箱来储存细胞。具体操作包括搅拌以防止细胞沉淀。
其它实施方案的特征在于将来自培养箱的细胞导入一种装置的方法,在所述装置中,将细胞从细胞培养条件驱动到电穿孔缓冲液中并进行电穿孔。然后可以将含有货物的细胞转移回培养条件下和/或收集。在具体实施方案中,将含有效载荷的细胞施用于需要诊断、预防或治疗的受试者。
在某些方面,本发明可用于细胞疗法的生物制造。例如,本文所述的设备和技术可用于mrna对原代t细胞的电转染。在其它方面,使用本文所述方法得到的含货物细胞被施用于需要治疗、预防或诊断的受试者。
实施本发明可以解决常规系统遇到的问题,并且可以具有许多优点。例如,本文所述的设备和技术可将细胞暴露于非理想条件(电穿孔缓冲液,室温)的持续时间和与常规缓冲液更换相关的细胞和/或遗传物质的损失减少或最小化。例如,研究表明,在室温下长时间暴露于电穿孔缓冲液中(约30分钟或更长时间)会对转染效率和细胞健康产生不利影响。本文公开的方法可以使这些类型的暴露减少到小于1分钟,或者可以以连续的方式精确地控制细胞在溶液中的停留时间在精准的期望时长内(例如,溶液a中20分钟,溶液b中3分钟,溶液c中1分钟)。
在许多实施方案中,在将货物转移到细胞或其它膜结合型基质的整个过程中,例如转染过程,细胞处理是自动化的。因此,与现有的商业装置相反,作为工艺流程的一部分,本文所述的系统可以在细胞培养条件下以自动化方式容纳细胞。不再使用细胞离心和再悬浮的方式手动进行缓冲液更换。相反,在其许多方面,本发明提供了实现缓冲区交换的自动化方式。同样可以是被转移的细胞和/或材料能够被保护而不与电穿孔电极直接接触的装置。
通过本文所述的技术,可以以高通量和延长的时间周期连续处理大量的细胞。多个微流体通道的组件(例如,本文所述的平行装置)可使用共同组件(例如共用储器、泵送系统、电场发生器等)以简化总体布局。
本发明的稳健、灵活和通用的实施方案可应用或适应于各种类型的货物、细胞或其它膜结合型基质(如其它类型的囊泡或外泌体结构)。尽管本文公开的电穿孔和/或其它组件可以是一次性的(例如,在一次使用之后),但是所呈现的设计产生了足够坚固且牢固的可重复使用的装置。
本文所述的原理也可用于去除容纳在细胞或其它膜结合型基质中的一些或全部内容物;也就是说,打开孔并允许内容物被动地或通过主动机制(例如听觉或电泳力)扩散出去。
通常,根据一个方面,本发明的特征在于一种将有效载荷导入细胞的方法。所述方法包括将细胞从第一培养箱引导至包含多个微流体装置的组件,将细胞从细胞培养基中驱入电穿孔介质,以鞘流结构向电穿孔介质中细胞施加电场,其中电穿孔介质在中央流中流动,以转移或允许有效载荷转移至细胞中。
在实施方案中,所述方法可以进一步包括将含有有效载荷的细胞从电穿孔流体驱动到细胞培养液中。此外,含有有效载荷的细胞储存在第二培养箱中。
通常,将含有有效载荷的细胞施用于需要诊断、预防或治疗的受试者。
一般而言,根据另一方面,本发明的特征在于一种制备用于免疫疗法的细胞的方法,所述方法包括将细胞从第一缓冲液(其中第一缓冲液为细胞培养基)转移到电穿孔缓冲液中,然后通过电穿孔使细胞透化。这允许有效载荷转移到透化的细胞中。然后,将含有有效载荷的细胞传送到第二个缓冲液中。本发明需要一种自动且连续的流动模式,并且吞吐量可以为每分钟至少400万个细胞。
一般而言,根据另一方面,本发明的特征在于一种用于使货物自动且连续地流动以转移到细胞中的系统。所述系统包括:用于储存细胞的第一培养箱;电穿孔组件,包括支撑以平行结构配置的多个微流体通道的层;第一缓冲液交换器,用于将细胞从细胞培养基驱入电穿孔介质中;第二缓冲液交换器,用于将细胞从电穿孔介质驱入培养基;及控制器。
优选地,所述系统包括用于将电穿孔缓冲液输送至电穿孔组件、用于将细胞输送至第一缓冲液交换器和/或用于将细胞从第二缓冲液交换器输送至第二培养箱的泵系统。此外,每个微流体通道可以具有三叉入口和出口,其可以被配置为支撑中央流和侧鞘流。
一般而言,根据另一方面,本发明的特征在于电穿孔组件,包括:通道层,包括以平行结构配置的至少两个微流体通道;电极层,包括用于每个微流体通道的一对电极;端口层,用于流体连接到微流体通道的三叉入口和出口,其中所述各层以层压型结构堆叠。
一般而言,根据另一方面,本发明的特征在于一种用于将货物大量转移到细胞中的系统,所述系统包括:将细胞保持在所需温度的培养箱、防止细胞在培养箱中沉淀的搅拌设备、将细胞转移至电穿孔缓冲液中的缓冲液交换器、对电穿孔缓冲液中细胞进行电穿孔以转移货物的流式电穿孔装置、以及从流式电穿孔装置中接收细胞的培养箱。
搅拌设备可以包括在细胞贮存器内的叶轮。此外,可以在培养箱和缓冲液交换器之间使用泵。并且,使电穿孔缓冲液流入缓冲液交换器的泵是有帮助的。同样的,在培养箱和缓冲液交换器之间放置一个流体电容器也很有帮助的。
现在将参照附图更具体地描述并在权利要求书中指出本发明的上述和其他特征,包括各种新颖的构造细节和部件组合以及其他优点。应当理解,体现本发明的特定方法和设备是以举例说明的方式示出的,而不是对本发明的限制。在不脱离本发明范围的情况下,本发明的原理和特征可以用于各种实施例。
附图说明
在附图中,不同视图的附图标记指代相同的部分。附图不一定是按比例绘制的;相反,附图重点在于说明本发明的原理。附图中:
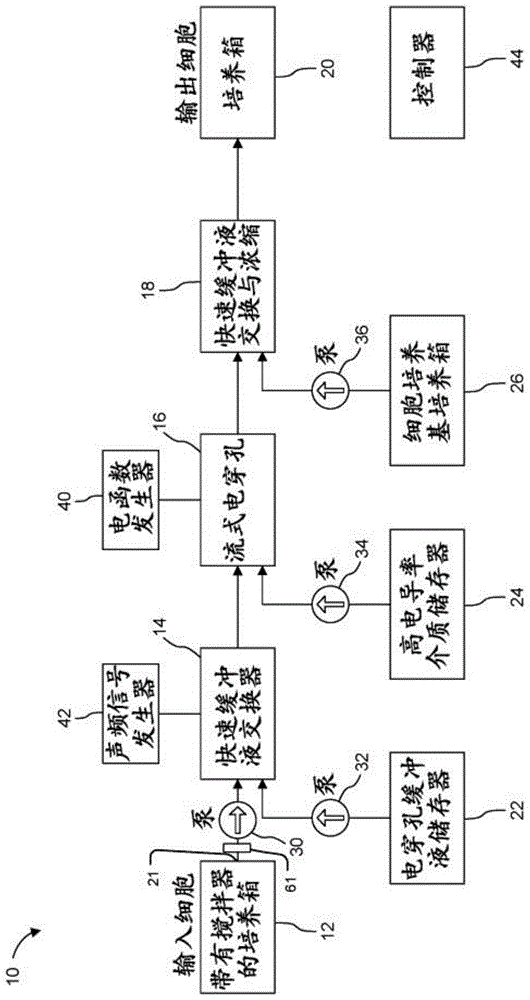
图1是示出了用于细胞的无需人工干预、连续流动转染装置的示意图。
图2a是搅拌器装置的示意图,所述搅拌器装置可用于防止保存在培养箱中的细胞沉淀。
图2b是图2a中装置的分解图。
图2c是可用于图2a中搅拌器装置的叶轮的透视图。
图2d是可用于图1的系统中的流体电容器的分解图。
图2e是图2d中组装的流体电容器的透视图。
图2f、图2g和图2h是图2d和图2e中流体电容器的板部件的透视图。
图3示出了被配置为支持使用中央流和侧流的流动装置设备组件的俯视图。
图4a为可用于细胞电穿孔的声学驱动的快速缓冲液交换装置的示意图。
图4b、图4c和图4d是声学驱动、快速缓冲液交换装置和电穿孔装置的示意图。
图5a(声学关闭)和图5b(声学激活)是演示声学驱动的快速缓冲液交换过程的显微图像。
图6是电穿孔组件中部件的分解图。
图7和图8是包括图6所示部件的电穿孔组件的透视图。
图9至图13是图6至图8中的部件的俯视图。
图14a和图14b分别显示了根据本文所述方法进行电穿孔的t细胞转染效率及活力数据。
图15示出了从两个供体获得并根据本文所述方法进行电穿孔的细胞活力及转染效率。
具体实施方式
现在将参考附图更全面地描述本发明,在附图中示出了本发明的说明性实施例。然而,本发明可以以多种不同的形式实施,并且不应该被解释为限于本文所阐述的实施例;相反,提供这些实施例是为了使本公开全面和完整,并将本发明的范围充分传达给本领域技术人员。
如本文所用,术语“和/或”包括一个或多个相关联的所列项目的任何和所有组合。此外,除非另有明确说明,单数形式和冠词“一”、“一个”和“所述”也包括复数形式。还应当理解,当在本说明书中使用术语“包括”、“含有”、“包含”和/或“由...组成”时,指定所陈述的特征、整数、步骤、操作、元件和/或组件的存在,但是不排除一个或多个其他特征、整数、步骤、操作、元件、组件和/或其组合的存在或添加。此外,应当理解,当包括组件或子系统的元件被称为和/或被示为连接或耦合到另一元件时,它可以直接连接或耦合到另一元件,或者可以存在中间元件。
应当理解,尽管本文使用诸如“第一”和“第二”之类的术语来描述各种元件,但是这些元件不应当被这些术语所限制。这些术语仅用于区分一个元素与另一个元素。因此,下面讨论的元件可以被称为第二元件,并且类似地,在不脱离本发明的教导的情况下,第二元件可以被称为第一元件。
除非另有定义,本文使用的所有术语(包括技术和科学术语)具有与本发明所属领域的普通技术人员通常理解的相同含义。还应当理解,诸如在常用词典中定义的那些术语应当被解释为具有与其在相关领域的上下文中的含义一致的含义,并且除非在此明确定义,否则不会以理想化或过度形式化的意义来解释。
本发明总体上涉及将一种或多种材料或试剂(在本文中称为“货物”或“有效载荷”)转移至细胞内或转移到细胞外的方法。在许多情况下,所述细胞是真核细胞,通常具有约10至约100微米(μm)的直径。货物也可以转移到其他膜结合型基质或从其他膜结合型基质移出,例如脂质体、外泌体、胶束等。
货物材料的实例包括但不限于小分子、染色体、dna、rna(例如mrna、sirna、grna、ssrna),其他遗传物质、低聚物(oligomers)、生物标志物、蛋白质、转座子、生物分子复合物、小分子、治疗剂等。货物通常是用于治疗、预防或诊断人或动物受试者疾病的试剂。
在本发明的许多方面,本发明涉及一种系统,所述系统支持货物向细胞或其它基质的无需人工干预、连续地流动转移。系统中进行的过程可以部分或完全自动化。
如图1所示,例如,系统10,包括几个部件或模块:培养箱12、(第一)缓冲液交换器14、电穿孔组件16、(第二)缓冲液交换器18和(第二)培养箱20。所述系统还可以包括一个或多个储存器,例如储存器22、储存器24和储存器26,以及泵30、泵32、泵34和泵36。电穿孔所需的电压由电函数发生器40提供,声能通过声频信号发生器42提供。所述系统由控制器44控制。通常,控制器是计算机系统(如单板计算机系统)中的微处理器。在其他情况下,控制器具有集成存储器、模数转换器和数模转换器的微控制器。
培养箱12和培养箱20(分别设置在电穿孔组件16的上游和下游)中的一个或两个可以是台式培养箱,其被用于在电穿孔之前和/或之后容纳细胞,并且可以具有约0.3升至约50升(l)的内部容积。在许多情况下,一个或两个培养箱都有小型化设计。
通常,培养箱12和/或培养箱20设有用于将细胞转移到培养箱和/或从培养箱中移出的装置。
例如,培养箱12可配有容纳细胞容器或储存器(烧瓶、锥形管等)的空间。所述容器可以是密封的无菌容器,例如血袋。在说明性实例中,其提供以105~5×108细胞/ml的浓度悬浮于高电导率(例如,约1~2s/m)的培养缓冲液,如texmacs或rpmi(roswellparkmemorialinstitute)t细胞培养基。
可以包括闭合回路或其他合适的布置来控制细胞培养条件,例如,培养箱温度(通常保持在37℃)、培养箱气体成分(例如,co2和/或湿度水平)、用于代谢或通常处理读数(ph、o2等)的传感器等等。
可容纳在培养箱12中的细胞的实例包括悬浮细胞,例如原代t细胞、nk细胞、造血干细胞或贴壁细胞(例如mscs、cho细胞)和许多其他细胞。在一些实施方案中,培养箱12和/或20被设计或适配于支持膜结合型基质,例如脂质体、外泌体、胶束等。本领域已知的用于保持这些靶标稳定的合适的缓冲液和条件可以通过实验选择和/或确定。
对于在培养基中可能不悬浮的细胞(或其他膜结合型基质),培养箱可配有搅拌机构,用于在容纳细胞的容器中产生(平缓)运动,从而减少、最小化或防止沉淀或下沉。这有助于确保输送到下游操作(介质交换和电穿孔)的细胞浓度受到控制并保持一致。下面参考图2描述一个说明性设计。
在某些情况下,并不是单独应用培养箱开始和结束该过程(参见,例如,图1中的元件12和20),而是整个系统容纳在培养箱室中。
在本文所描述的许多实施方案中,电穿孔组件16支持例如在微流体通道中使用鞘流结构以连续方式进行的电穿孔过程。一个具体的实施方案使细胞和货物在中央流或流中接触,所述中央流或流通常利用低电导率流体,在本文中也称为电穿孔流体。中央流在通常采用高电导率流体的两股鞘流(也称为“侧流”或“支流”)之间流动。中心流体和侧流体之间的电导率差异导致电场(由电函数发生器40提供)集中在流的中心(低电导率)区域,从而有效地增强了电场强度,并防止中央流中的细胞与电极发生物理接触。
考虑到用于细胞培养的优选培养基通常具有高电导率,并且上述鞘流布置优选在电穿孔期间将细胞置于低电导率介质中,系统10使用缓冲液交换器14将细胞从细胞介质转移至电穿孔缓冲液介质。在许多实施例中,由图1中的组件14所示的快速缓冲器交换。图1涉及声学上将细胞从一个流动流驱动到另一个流,声音频率通过部件42产生。
电穿孔后,可以将细胞从电穿孔介质转移到细胞培养基中。图1中所示的一种方法应用缓冲液交换模块18,其还可以包括细胞浓缩功能。传统上,细胞浓缩通常采用离心法在间歇过程中完成,但也可采用声电泳(acoustophoresis)、双向电泳、电泳法、惯性效应或集成多孔膜或筛网在流动结构中完成。
在一个实施方案中,缓冲液交换器14和18中的至少一个是快速缓冲交换设备和细胞集中器。另一个实施方案利用这样的设计:其中一个或两个缓冲液交换(切换)模块和电穿孔组件16(其可以采用上述鞘流结构)被集成到单个装置中。在另一个实施方案中,在与电穿孔装置分离的装置中进行至少一次缓冲液交换。在所述方法的一个实例中,缓冲液交换器14、流式电穿孔组件16和缓冲液交换器18通过导管(例如,合适的管)彼此连接,导管可以在这些部件之间提供流体连通。
本发明的一些方面在设备14和18中采用声学驱动的快速缓冲液交换。在其他方面,在至少一个缓冲液交换器中使用非声学驱动的缓冲液交换。一种实施方案利用声学驱动的缓冲液交换器14和非声学驱动的缓冲液交换器18。
声学驱动的缓冲液交换器的结构和操作细节在申请日为2019年3月20日、申请号为16/359,626、标题为“acoustically-drivenbufferswitchingformicroparticles”的美国专利申请中记载,该专利通过引用合并于此。可用于获得非声学驱动的缓冲液交换的技术包括但不限于惯性技术、具有集成多孔膜或筛网的微通道或基于扩散的技术(diffusionbasedtechniques)。
在培养箱20中收集输出细胞。在一个实例中,这些细胞是含有mrna的原代人t细胞。此类细胞可用于基因编辑或瞬时治疗系统(mrnacar-t)。在其它实例中,输出细胞用于生产蛋白质或细胞外囊泡(例如,经修饰的cho细胞或mscs)。
在整个系统中,流量由泵系统驱动(启动),包括通常为蠕动设计的商用的现成泵。可以采用其他合适类型的泵。通常,使用一个泵来驱动细胞悬液从第一培养室流出,并以一定流速流经整个系统,所述流速为例如从100μl/min至2ml/min。系统中发生的每个缓冲液交换都需要一个额外的泵。名义上,至少需要两个泵:一个涉及将细胞移入电穿孔缓冲液中,另一个随后将细胞返回培养缓冲液中。为了防止设备之间的流速差异,可以在作为镇流器设备之间放置流体电容器或容器。在这种情况下,每个微流体装置都有自己的泵组来控制流速。
在系统10中,使用泵26从培养箱12中取出待电穿孔的细胞,泵26可以是能够控制流体流动的注射泵。系统10还包括储存器22和泵32,例如,注射泵,用于将电穿孔缓冲液供应到电穿孔装置16中。用于鞘流的高电导率流体可通过泵34从储存器24中添加,例如,注射器泵。使用泵36将细胞培养基从储存器26供应到缓冲液交换器18中,例如,注射器泵。
系统10提供了关于容纳要结合到细胞中(或结合到其它类型的膜结合型基质中)的货物的贮存器的各种选择。在使用原代人t细胞的一个实施例中,电穿孔缓冲液中的mrna可从储存器22流入介质交换器14中,该介质交换器在细胞流入电穿孔装置16之前将细胞转移到载有mrna的电穿孔介质中。其它装置提供货物,例如质粒dna、单链线性dna、双链线性dna、线性化质粒dna、单链供体寡核苷酸(single-strandeddonoroligonucleotides)、核糖核蛋白(例如,与向导rna复合的cas9蛋白)、蛋白质或来自储器22的小分子。细胞也可以手动悬浮在装载货物的电穿孔介质中,引入培养箱12,并直接流入流式电穿孔装置16中。
可以将硅橡胶或其他合适的管道用于一些或所有连接,以在各个模块(组件)之间提供流体连通。
控制器44可以包括一个或多个计算机、硬件、软件、传感器、接口等。用于控制系统10或其组件的操作,以达到部分或完全自动化。在许多实施方案中,控制器44控制用于电穿孔的电参数和/或缓冲液交换装置14中及任选地缓冲液交换器18中所应用的声频率。控制器44可以监测或控制培养箱参数、泵30、32、34和/或36中的一个或多个的操作、上述中央流和/或鞘流的流量和参数等。
下面对可以包括在系统10和/或其操作中的各种实施例进行进一步地描述。
例如,如上所述,系统10可以利用一个或多个搅拌器来防止存于培养箱中的细胞沉淀。图2a和图2b中给出了一个示例。这些附图示出了前端搅拌器装置11,其可以容纳在培养箱12中(图1)。搅拌设备11包括将合适的细胞缓冲液中的细胞供应到缓冲液交换器14的细胞储存器13(图1)和叶轮15,用于搅拌细胞并防止细胞沉淀。在特定实施方案中,细胞贮存器13包括圆柱形(管状)上部17和圆锥形下部19。出口21在细胞储存器13的圆锥形下部19与图1a中的泵30之间提供流体连通。盖子23盖住圆柱形上部17的顶部开口。
细胞储存器13的容积可以为约15ml至约1l。
在许多情况下,选择合适的叶轮设计时考虑了保护细胞免受细胞储存器中过度剪切力的同时促进充分搅拌的需要,以减少、最小化或完全防止细胞沉入细胞储存器底部。在图2a和图2b的特定实施例中,叶轮15具有类似于细胞贮存器13的轮廓,并且包括上部25和锥形下部27,如图2c所示。在图2c的实施例中,叶轮是薄的扁平结构,其构造成装配在细胞贮存器13内。锥形部分25和27的相对长度以及其他参数可以通过实验进行优化。此外,也可以采用其他类型的叶轮。
叶轮15通过磁耦合器31连接到电机29。
电机、磁耦合器和细胞贮存器可以安装在平台33上,在一些实施方案中,平台33由铝制线路板制成。细胞储存器13由稳定板35稳定,而保持板37将细胞储存器13保持在盖23处。保持板37可以具有u形开口,例如用于装载和卸载细胞储存器并在搅拌期间保持其稳定。稳定板35和保持板37可以使用支柱或其他合适的方式安装在平台33上。在图2a和图2b的实施例中,装置11包括3个可为6英寸长的公母立柱39。
可包括3个螺钉43的电动机子组件41使用例如可为3英寸长的公母立柱45安装在保持板37上。电动机使磁铁旋转,磁铁与叶轮磁耦合,使叶轮在细胞储存器中旋转,且不直接接触。
用于操作叶轮15的参数考虑了保护细胞免于过度剪切的需求,同时保持细胞免于下沉和沉淀在细胞储存器的底部。在具体的实施方案中,叶轮15以每分钟160转的速度运行,并向细胞施加约2dyne/cm2的最大剪切应力。重要的是,剪切应力保持在10dyne/cm2以下。
如果使用蠕动泵将流体从出口21驱出,则可将顺应性结构置于管线中以抑制由泵产生的流动振荡,从而向上游装置提供平滑的流动。顺应性结构可以是例如流体电容器,即具有由顺应材料(例如响应于流体压力而变形的聚合物膜)制造的底板和/或顶板的微通道。图2d(流体电容器61的分解图)和图2e(组装的流体电容器的透视图)示出了一个实例。从这些附图可以看出,流体电容器61包括由两个聚合物膜(即片材69(sheets69))分开的顶部板(顶板)63、中间板65和底部板(底板)67,所述两个聚合物膜可以由例如高纯度、高温硅橡胶或另一种合适的材料制成。顶板63、第一片材69、中间板65、第二片材69和底板67通过可拧入螺纹孔73的螺钉71固定在一起。也可以采用其他将板和片材夹紧在一起的结构。端口75提供与其它系统组件之间的流体连通。在一个实施例中,出口21(图2a和图2b)连接到第一(入口)端口75,而第二(出口)端口75连接到泵30(图1)。
图2f、图2g和图2h分别展示了板63、65和67。更详细地,微通道77穿过中间板65被切割。通过孔79容纳螺钉71,而通过孔81被构造成适于入口/出口75。
在操作过程中,流过微通道77的流体夹在片材69之间,片材69是柔韧的,并且可以适应体积波动以使流动平滑。
图3是示例性电穿孔组件16的俯视图,该电穿孔组件16可支撑诸如上述的鞘流结构。该装置包括微流体中心通道46,其在图3中具有三分叉入口(元件46a、46b和46c)和三分叉出口(中的元件46a'、46b'和46c')。
微流体通道46可以在基底52中制造,例如硬塑料(对于许多材料,其使得装置为一次性的)。实例包括但不限于环烯烃共聚物(coc)热塑性塑料、聚酰亚胺膜如
通道尺寸为宽度500μm~3mm,长度1cm~5cm,高度125μm~500μm。一对共面的菱形电极(48a和48b)被图案化到微通道底部下面的聚合物层上,具有由聚合物层中的切口限定的方形引线或焊片区域,暴露电极以用于外部访问。掩蔽层放置在电极层和微流体通道46之间,具有切口,所述切口限定暴露于微通道中的流体的电极部分。通常,电极由电化学稳定的材料形成,例如铂金属(pt)。电极中暴露于通道中的流体的部分具有100~250μm的宽度和8~45mm的长度,并且通过连接到方形焊片(图3中的元件50a和50b)与电函数发生器40连接。
在诸如图3的装置中,可以调节中央流与侧流的相对流量。在一个示例中,调节相对流量,使得电极仅与侧流接触。总流量范围为375μl/min至6ml/min。在特定示例中,侧流与中心流的流量比通常在1:0.5至1:1(单侧:中心)的范围内。当包含中央流的溶液的电导率远低于包含侧流的溶液的电导率时(例如10倍或更大),中央流主导电路的电阻,使得在电极上施加电压时,大部分电压在中央流两端下降。
电压(来自图1中的电函数发生器40)被施加在方形焊片50a和50b上,并且可以采取周期为10纳秒(ns)到10毫秒(ms)的正弦曲线的形式,或者采用脉冲宽度为10ns到10ms的脉冲序列的形式。施加电压的幅度可以变化,以便在中央流两端产生约2~1000千伏/米的电场,脉冲宽度在10ns至10ms之间。脉冲序列的频率也可以变化,例如从每细胞停留时间一个脉冲到每细胞停留10个脉冲或更多。
如图3中的装置,可以支持使用不同的缓冲液。在特定实施例中,鞘侧流的特征在于高电导率(σ),例如,约1至约2s/m的范围;而中央鞘流具有低的σ,在10至1000μs/cm。该方法与适用于细胞培养的缓冲液和/或适用于电穿孔的缓冲液的使用兼容。
因此,在一种实施方案中,细胞在其优选的缓冲液中通过中央鞘流46c提供。两个侧流46a和46b由图1中的泵34从高电导率介质储存器24供给。这种细胞优选缓冲液通常具有高σ,例如约10000至约20000μs/cm的范围。
低σ电穿孔缓冲液在中央流46c中流动,并由图1中的泵32从电穿孔容器22中提供。
在进入电穿孔组件16(图3)之前,来自培养箱12的细胞流入图4a中的声学缓冲液交换器的侧流端口110,在此处他们被例如,声学驱动或推动,而从高电导率侧鞘流到中央流,其包含低σ电穿孔缓冲液和货物。结果,细胞悬浮在中央电穿孔缓冲液(其随后被输送到组件16的中央流端口46c)中。将细胞从一个缓冲液储存器驱动到另一个缓冲液储存器的声能由声频信号发生器42提供给附接到通道基底152的声学换能器154。
在电穿孔操作(在图1和3中所示的电穿孔组件16中进行)之后,含有货物的产品细胞可在中央流中保持悬浮,并可从出口46c'收集。从出口46a'和46b'得到的流体作为废料处理或再循环利用。在其他实施方案中,第二缓冲液交换器(参见图1中的缓冲液交换器18)将含货物的产品细胞从中央流的低σ电穿孔缓冲液中移动到侧流的高σ流体中。在这种结构中,可以从出口46a'和46b'收集含有货物的产品细胞。来自出口46c'的流体作为废料处理或导入收集装置以重复利用。
如图4a示例性示出了(第一)缓冲液交换器14的一种装置,用于将细胞从含有高电导率细胞缓冲液的鞘流转移到中央流中流动的低电导率电穿孔缓冲液中。通过细胞入口110将细胞引入优选的介质中,即细胞缓冲液中。液体流(stream)通过泵30从培养箱12中提供。输入入口的介质被分成两个细胞子通道110a、110b。细胞子通道110a、110b在图中y轴方向上彼此分散,然后随着它们在正x轴方向上前进而汇聚。细胞从鞘细胞缓冲液被声学驱动到声学聚焦区119中的中央电穿孔缓冲液中。电穿孔缓冲液由泵32从电穿孔缓冲液容器22中提供。声能由声频信号发生器42提供给附接到通道基底152的声学换能器154。从中心出口121收集输出细胞,而细胞缓冲液在出口123a和123b处作为废料收集或引导至收集装置以重复利用。如前所述,在一种装置中,来自出口121的输出细胞被供应到图3的电穿孔组件16的中心鞘流46c处。
图4b示出了用于细胞电穿孔的两级声学驱动的快速缓冲液交换系统100,所述系统执行图1中描述的第一缓冲液交换器14、电穿孔组件16和第二缓冲液交换器18的功能。
该示例包括两个或更多个连接的微通道102、104。通常,通道由一个或多个硬质聚合物基板108(例如聚苯乙烯)或其它硬质基板(例如硅、玻璃和石英)制成。这里描述了典型的双通道系统,但也可以增加其他通道。
在图示的示例中,每个微通道102、104中被构造于单独的基板108-1、108-2中。
每个微通道102、104支撑鞘或共流,中央流124和流126在两侧。在特定的示例中,中央流124的组成不同于侧流126的组成。在层流状态下保持流动,因此流之间的混合最小。
为了保持这种层流,中央流124和鞘流或侧流126的流体速度使得系统中的雷诺数re在汇聚区域127中的三分叉入口区域中很小(re<<~2000)。优选地,re小于500,更优选地小于10。
微通道102、104的横截面可以是矩形,其宽度和高度在100μm至1000μm的范围内。各微通道102、104的长度范围为5mm到30mm。
然而,其他实施例也是可能的。另一个实例具有同心流体几何形状,其中鞘流126在所有侧面上围绕中央流124。诸如细胞10,最初被引入到一个或多个鞘流126中的诸如在入口110的输入区域处,直径可以从100nm到25μm。例如,t细胞,一种用于电穿孔转染的典型微粒,大小范围约为6μm至12μm。
在一个应用中,系统100将细胞快速移入和移出专用电穿孔缓冲液,每个微通道具有两个入口110、112和一个三叉出口114。电穿孔缓冲液通过入口112直接引入第一微通道102,并形成或包含中央流。电穿孔缓冲液由图1中的泵32从电穿孔缓冲液容器22中提供。细胞在其优选介质(即细胞缓冲液)中通过细胞入口110引入。细胞通过泵30从培养箱12中供给。输入入口的介质被分成两个单元子通道110a、110b。单元子通道110a、110b在y轴方向上彼此发散,然后随着它们在正x轴方向上前进而汇聚。
细胞缓冲液和电穿孔缓冲液通常因细胞能在各自缓冲液中存活时间长短而彼此不同。t细胞的细胞缓冲液的一个实例是texmacs(由miltenyibiotecinc.出售)或rpmi(由thermofisherscientificinc.出售)。这种细胞缓冲液通常含有与细胞渗透压和营养物质相匹配的生理盐浓度。另一方面,电穿孔缓冲液的一个实例是btx低电导率缓冲液(btx出售)。这种电穿孔缓冲液通常具有较低的盐浓度以降低电导率,但添加了糖以减少对细胞的渗透冲击(osmoticshock)。
细胞子通道110a、110b在从子通道112a流出的电穿孔缓冲液的任一侧上朝向彼此汇聚,以在汇聚区域127中产生三叉入口。以这种方式,所有三个子通道110a、110b、112a将它们的流递送到切换通道125中。包含细胞的流126作为流的两个侧鞘流在中央流124周围汇聚。
在第一微通道102的另一远端,切换通道125将流输送到发散区域129中的双侧出口子通道130a、130b。这里,子通道130a、130b随着它们在x轴方向上前进而在y轴方向上彼此分开,并且也与中心出口子通道132分开。双侧出口子通道130a、130b主要从原始鞘输入流126输送流,并且作为废料离开或被收集以再利用。
中央出口的子通道132承载来自切换通道的中央流。它含有电穿孔缓冲液中的细胞10。
这里,也优选保持层流。发散区域129内的流体速度使得系统中的雷诺数re在发散区域129中的三叉出口区域中很小(re<<~2000)。优选地,re小于500,更优选地小于10。
第一微通道102的中央出口的子通道132将流引导至第二微通道104的入口134,第二微通道入口104优选地制造在单独的基板108-2中。第二微通道入口134分叉为两个细胞子通道134a、134b。单元子通道134a、134b在y轴方向上彼此发散,然后随着它们在正x轴方向上前进而重新汇聚。
将细胞的优选培养基或辅助培养基(可能含有不同的待转染的生物标志物或货物)引入第二微通道104的另一入口116。该培养基由图1中的泵36从细胞培养基容器26中提供。电穿孔的细胞子通道134a、134b在细胞缓冲液子通道116a的任一侧上朝向彼此汇聚,所述细胞缓冲液子通道116a在正x轴方向上运送流动培养基。
电穿孔的细胞子通道134a、134b和细胞缓冲液子通道116a将它们的流输送到第二转换通道140中。在此,细胞10从侧流162被引导到第二微通道104的第二切换通道140的中央流160。如前所述,雷诺数re在汇聚区127中的三叉入口区域中很小(re<<~2000)。优选地,re小于500,更优选地小于10。
可以从第二微通道104的中央出口子通道142处收集细胞。将从微通道142收集的细胞转移到图1所示的培养箱20中。双侧出口子通道144a、144b位于切换通道140的末端,且位于中心出口子通道142的任一侧,将流体运送至作为废料离开或收集装置以供再利用。
或者,根据所需的缓冲液交换次数,可将细胞导向另外的微通道等。通常输入流速范围为1μl/min至1ml/min。
在一个示例中,使用氰基丙烯酸酯粘合剂将基板108-1、108-2结合到分离的锆钛酸铅压电换能器118-1、118-2,并且其比微通道短。换能器118-1、118-2连接到图1所示的声频信号发生器42的单独驱动器150-1、150-2并由其驱动。每一个驱动器都包括由声频信号发生器驱动的射频放大器,所述声频信号发生器产生激励相应通道102、104的正弦信号。所述设备配置已显示为支持900至990khz之间的声共振频率,其中在每个开关通道125、140的宽度上产生稳定的压力波。换能器和微通道基底也优选安装在作为散热器的铝板上。热电冷却器(tec)元件和底板位于铝板下方。微通道附近的传感器顶部连接有热敏电阻,热敏电阻与tec一起连接到tec控制器,构成闭合回路温度控制系统。温度优选保持在约26℃。
隔音器146防止来自每个声波换能器118-1、118-2中的声能影响另一个微通道。这防止了两个微通道之间的串扰,并允许对它们分别被驱动和调谐。在本示例中,通过在单独的基板108-1、108-2中制造微通道102、104,然后用弹性管连接基板以避免声串扰来实现隔音。
这些换能器118-1、118-2由图1的声频信号发生器42的单独驱动器150-1、150-2致动。例如,每个驱动器都施加单独可调的正弦变化电压。选择频率,使得在相应微通道102、104的每个切换通道125、140的宽度上(横向于流体流动方向)产生稳定的驻压波。以这种方式,在图1的两级听觉驱动的快速缓冲器交换系统100中,换能器118-1、118-2分别驱动(第一)缓冲交换器14(图1)和第二缓冲交换器18(图4b)的操作。
对于基本聚焦模式,流体中只有一个压力节点。声辐射压力沿压力节点的方向对细胞施加力。这导致细胞迁移出侧流并进入中央流,朝向通道横截面的中心线。在第一微通道102中,该作用导致细胞移出它们的优选缓冲液并进入电穿孔缓冲液,在此它们被电穿孔。在第二微通道104中,该作用导致细胞移出电穿孔缓冲液并回到它们优选的或新的缓冲液中。这导致细胞在电穿孔缓冲液中的停留时间为数秒或更短。
在图4b的两级听觉驱动的快速缓冲器交换系统100中,一对电穿孔电极120驱动电穿孔组件16的操作(图1)。电穿孔电极120可以位于第一微通道102的三叉入口和三叉出口之间的区域中;例如在三分叉入口和三分叉出口中间。如果需要进行多个阶段的电穿孔,需要多个连续的有效载荷,也可以在第二个微通道和任何附加的微通道中制造电极,只要最终的微通道将细胞返回到它们优选的缓冲液中即可。放置电极120使得细胞在被聚焦到转换通道125中的中央流124中的电穿孔缓冲液中之后通过电穿孔场。电极由图1所示的电函数发生器40驱动。
可以使用光刻工艺将电极120图案化到转换通道125的底面、顶面或侧壁上。电极面积(尤其是通道沿流动轴的尺寸(图4b中x轴方向))和流速决定了细胞在电场中的停留时间。停留时间可以选择从100μs到大约1s不等。可选地,可以使用“远程电极”,包括从开放端口到主通道的流体连接,以及放置在端口中的线状电极(这种配置需要法拉第电流通过电极)。建立ac(例如,周期/脉冲宽度范围为10ns至100s的正弦曲线或脉冲序列)或dc电场,并在细胞流经该设备时保持激活状态。针对具体的细胞类型,将磁场强度调节至足以实现透化的值,通常在2~200kv/m范围内。
可以将货物混合到在入口112引入第一微通道102的电穿孔缓冲液中,或者与引入细胞入口110的优选细胞缓冲液中的细胞混合。前者能够通过调整进入第二个微通道的时间来调整细胞对货物的暴露时间。
在一些实施例中,单独的微通道被分别制造,通过聚合物管道流体地连接,并且单独被声学致动。单个微通道甚至可以制造在同一基质上,并使用单个压电换能器一起驱动。在一些实施例中,来自第一微通道102的双侧出口子通道130a、130b中的包含细胞的优选介质的“废料”流被引导并经由第二微通道104的入口116耦合到中央流中(而不是第二泵将介质直接输送到第二微通道的中央流中)。在一些实施例中,多个顺序微通道与用于引入细胞和缓冲液的歧管(manifolds)平行布置,从而增加吞吐量。
图4c和4d示出了快速缓冲液交换系统100的两个替代实施例。此处,在复合微通道106中,细胞被汇聚到用于电穿孔的中央流中,然后汇聚回到用于收集的外部流(这里称为“去聚焦”)。
更详细地,电穿孔缓冲液(由图1中的泵32从电穿孔缓冲液储存器22中提供)通过入口112直接引入复合微通道106,并包括鞘流的中央流,如图4c所示。在它们的优选介质中的细胞(由图1中的泵30从培养箱20提供)通过细胞入口110引入。引入入口的介质被分成两个细胞子通道110a、110b。细胞子通道110a、110b在y轴方向上彼此分散,然后随着它们在正x轴方向上前进而汇聚。
细胞子通道110a、110b在电穿孔缓冲液子通道112a的任一侧上朝向彼此汇聚,以产生三叉入口。以这种方式,子通道110a、110b、112a将它们的流输送到复合转换通道125中。包含细胞的流126在中央流124周围汇聚,作为如前述实施例中的流的两个侧鞘流。
在第一微通道102的另一远端,转换通道125将流输送到双侧出口子通道130a、130b,所述双侧出口子通道随着它们在x轴方向上前进而在y轴方向上彼此分开。双侧出口子通道130a、130b主要从原始鞘流126输送流,但在此示例中,细胞已转移至双侧出口子通道130a、130b上游的鞘流126中。
长的复合转换通道125被一组电穿孔电极120分成两个区域,电穿孔电极120位于通道的任一侧,沿x轴测量,与三叉入口相距距离为l1,所述距离可以例如在20至40mm的范围内。通道宽度w的范围从420到740μm。频率f1处的声学致动由图1中的声频信号发生器42提供,频率f1通常在400至1000khz的范围内。并且由第一驱动器150-1施加到第一声波换能器118-1,并用于将细胞驱动到电穿孔电极120上游的中央低电导率流。在电极120下游的区域中,不同的频率f2,通常比f1大1.5至2.5倍,例如(由第二声频信号发生器提供,例如,类似于图1中的声频信号发生器42)由第二驱动器150-2施加到第二声波换能器118-2,其用于将细胞驱动出中央流。
微通道102的远端处的中心出口子通道132承载来自转换通道的中央流的流,如作为废料或回收。
在图4c中使用单个声学驱动频率,但是电极120下游的通道更宽,具有比w1(电极120上游的宽度)大1.5至2.5倍的宽度w2。这改变了通道中声波的节点结构,并实现了将细胞导向侧流的类似方式。
在图4c和图4d的两个实施例中,基板108的宽度t相对于流体通道w、w1、w2的宽度是一个重要参数。其范围从550μm到1050μm。
在又一个实施方案中,微通道继续位于压电换能器(或表面声波换能器)的顶部,以产生作用于一个或多个微通道中的微粒(或细胞)的声驻波模式。然而,该实施方案没有使用在流体中产生电场的一组电穿孔电极。这种配置,即,没有电穿孔电极,可用于例如“洗涤”细胞或将它们从一种介质转移到另一种介质中。它可以很好地替代常规方法,常规方法包括在离心机中旋转微粒(细胞),去除上清液,加入第二种缓冲液,然后再悬浮微粒。
图5a和图5b示出了演示声学驱动的快速缓冲液交换的显微镜图像。当音响关闭时(图5a),侧流中的细胞通过而不会发生偏转并保留在它们的缓冲液中。当音响系统启动时(图5b),细胞从侧流偏转到中央流,中央流可以包括不同的缓冲液或包含不同的试剂。
在本发明的一些实施方案中,图1所示的系统采用电穿孔组件16,所述电穿孔组件16基本上由至少一个微通道装置(设备)组成或至少包括一个微通道装置(设备),如图3所示。
电穿孔组件还可以包括两个或更多个(即多个或几个)在下文中进一步描述的平行结构配置的电穿孔装置。这种组件不仅可用于图1所示的高通量、高效率的连续流动系统,也在其它系统中或独立地作为(或其它靶标,如外泌体等)流式电穿孔装置,用于转染已经用常规方法(例如,离心和再悬浮)装载到合适的低电导率电穿孔缓冲液中的细胞。在这种装置中,转染的细胞在输出端收集,并手动返回培养或储存条件。进一步的实施方案在不采用声学驱动的缓冲液交换系统中利用具有平行通道的电穿孔组件。
图6是组件200的分解图,组件200包括若干层或板(即层210、230、250、270和290),在图8-12中进一步描述。这些层可以如图7(俯视图)和图8(仰视图)所示的堆叠结构层叠。在一种实施方式中,通过固化设置在相邻板之间的合适的粘合膜来制备层压材料。
转向各个层,图9所示的为观察层210,包括开口212,所述开口212为焊接到电极(48a和48b)提供通道,并且可以具有10毫米(mm或密耳(mil))的厚度。在一个示例中,层210由
图10示出了包括多个(图中示出了四个)流体微通道的流体通道层230,每个微通道具有用于中央流和侧流的三叉入口和出口以及微流体中央通道46,基本上如参照图2b所述。
上述特定实施方案具有四个平行的流体微通道。在优选的装置中,这些将被并行使用以处理来自单个普通培养箱12的细胞。平行微通道的使用允许更高的处理量,例如高于每分钟400万个细胞。
一般而言,微通道不能简单地做得更宽,因为电场被最佳地放置在几个甚至单个单元上。因此,在进一步的实施方式中,在单个组件200中制造更多数量的平行流体微通道。一个实施方案包括至少10个、20个、30个、40个、50个或更多个流体微通道,这些微通道在输入的共用培养箱12之间并行操作,以向共用的输出培养箱20输出经修饰的细胞。
更详细地,每个流体微通道具有三分叉入口232a、232b和232c以及三分叉出口232a'、232b'和232c'。插入这些入口/出口并用环氧树脂密封的皮下不锈钢管(例如,标称25规格管,0.4英寸长)可作为引入细胞和流体的装置的接口。可以将塑料管(例如,内径为0.38mm,乙烯基)压装到不锈钢管上。如图所示,流体微通道布置为平行结构。流体通道板230可以具有大约10密耳的厚度,并且可以由例如
优选地,通道,特别是微流体中心通道46,通过形成贯穿整个通道层的槽而在流体通道层230中制造。对于槽可以使用不同的技术。在当前的实施方式中,槽通过激光加工形成。列举几个实例,其他选择是机械研磨和光刻工艺。
图11中所示的层为电极框架250,设置有电极槽(或沟槽)254a和254b。使用如前所述的制造技术贯穿电极框架250形成这些槽。所述槽使得每个菱形电极的近侧(长)边缘与微流体中心通道46中的流体之间能够流体连通。电极框架可由
图12示出了电极层270,包括形成共面菱形电极对(48a和48b)的四对菱形金属化272a和272b。金属化可以通过在例如5密耳的
如图13示出了端口板290,例如,由3/32”厚的
为了在组装和制造期间正确定向,层210、230、250、270和290可以由腔室297标记。所述层优选彼此粘附。在一个示例中,在激光加工之前,将r/flex1000片材等粘合膜粘贴到一些层上。然后,例如,在高温和高压下固化粘合片材。
诸如系统10(图1)的系统,可选地包括一个或多个上述子组件(例如,参考图2~图4d和图6~图13),可按如下方式操作。将诸如血袋之类的细胞容器引入第一培养箱12中,并附接到防止细胞由于沉淀而沉降的搅拌装置。硅橡胶管在血袋和第一快速缓冲液交换模块之间形成流体连接,蠕动泵30驱动细胞流进入缓冲液交换器。在缓冲液交换器的入口处,液流分叉形成鞘流的外部流。第二泵32(例如,注射泵)驱动电穿孔缓冲液的流动,进入缓冲液交换装置中鞘流的中央流,所述电穿孔缓冲液含有从储存器22输送至细胞的货物(mrna、pdna、rnp等)。压电致动器驱动的声场由连接到设备的声频信号发生器42驱动,从而将细胞从外部流驱动到中央流,再进入包含货物的低电导率电穿孔缓冲液。然后,整个鞘流进入流式电穿孔模块(可直接集成到缓冲液交换器中),在此与外部流接触的电极被通电以使细胞暴露于电场。在其它装置中,进入电穿孔组件的仅仅是中央流,新配的高电导率缓冲液被引入侧流。然后,外部液流流出作为废料,而中央流被引入第二缓冲液交换器。在第二缓冲液交换器的入口处,来自电穿孔模块的流分叉以形成鞘流的外部流。泵36(例如,注射泵)将细胞培养物或回收缓冲液从细胞培养基贮存器26泵入第二快速缓冲液交换器中以形成鞘流的中心。然后,由声频信号发生器42驱动的压电致动器驱动的声场将细胞从外部流驱动到中央流中,使细胞返回到可以与第一培养箱中血袋中的初始缓冲液相同或不同的培养缓冲液中。随后,细胞流入第二培养箱20中的收集储存器。
为了促进或增强有效载荷向透化细胞的转移,施加声能(例如,使用超声波发生器)可以增加细胞与货物材料之间的碰撞,从而增加细胞与货物材料接触并将货物导入细胞中的可能性。使用机械搅拌或其他合适的方法也可以提高细胞与货物之间的碰撞率。这在声学缓冲液交换模块中自然发生,但是可以在图3所示的流式电穿孔装置中添加额外的声学搅拌(例如,使用结合到装置外部的压电换能器)。
一些实施方案提供了在细胞返回到培养箱中的培养缓冲液之前进行多次缓冲液交换和/或多次导入事件(多次电穿孔操作)。这可能需要额外的缓冲液交换模块、流式电穿孔模块和泵。将细胞转移到电穿孔缓冲液中、电穿孔以及细胞从电穿孔缓冲液转移回合适的细胞培养缓冲液中,这些转移中的至少一些可以整合到单个模块中。
在许多实施方案中,在系统10中执行的过程以连续的方式进行。由于系统可以是模块化的,因此可以根据应用程序进行定制。例如,一些过程可能只需要一次缓冲液交换,而另一些过程可能需要几次连续的缓冲液交换和几次电穿孔事件,以依次输送多个有效载荷。
在其它实施方案中,细胞和/或试剂被多次循环利用。
本文所述的原理也可用于去除容纳在细胞或其它膜结合型基质中的一些或所有内容物;即打开孔并允许内部内容物被动地或通过主动机制扩散出去。
与常规的批量电穿孔技术一样,本文所述的流动装置保持与小批量细胞的电穿孔兼容。然而,这是费时和费力的劳动,对于大规模加工而言将是棘手的。
本文所述的设备和技术可增加吞吐量和/或提高将货物转移至细胞或其它膜结合型基质的效率。如上所述,在电穿孔过程之前、期间和之后,采取各种措施来保护细胞,从而提高细胞活力。
因此,在一些实施方案中,细胞电穿孔可以以每分钟处理至少400万个细胞的吞吐量进行,例如每分钟约400万~约5000万个细胞的吞吐量。遗传物质如mrna对原代人t细胞的转染效率可高达90%(细胞存活率降低幅度小于5%),在约65%~约90%的范围内,如通过流式细胞术测量的荧光报告蛋白的表达所示。在某些情况下,通过提高货物浓度、通过促进细胞和货物之间的碰撞、增加电场强度(可能以生存能力为代价)和/或优化电穿孔缓冲液,可以提高将货物导入细胞的效率。
例如通过流式细胞术测量的细胞存活率可以高达初始细胞存活率的95%,例如约80%~约95%。
这里描述的特征与放大生产及商业制造的目标一致,因此,这里描述的实施方案可以得到许多应用。示例包括但不限于生产自体或异体car-t、异体或自体tcr、trnc细胞、修饰的tils、car-nkts、car-nks、car-macs、car-cik或修饰的γ-δ细胞。本文所述的特征还可用于工程化负载货物的外泌体,或产生基因修饰的干细胞或悬浮细胞以治疗遗传性疾病或病症。
一个说明性应用涉及细胞疗法的生物制造。
基于过继细胞转移的免疫疗法的最新发展增加了对改进的细胞生物加工和基因递送技术的需求。例如,美国食品和药物管理局(fda)已批准将经修饰以表达嵌合抗原受体(car)基因的t细胞用于某些血液系统癌症的治疗。然而,由于目前car-t细胞的治疗剂的生产链基于慢病毒的基因传递转导。而这些载体制造复杂且昂贵,有效载荷量有限。由于它们以不受控制的方式将遗传信息整合到基因组中,因此,这种方法也带来了安全问题。
为了解决其中一些问题,进行了下面的非限制性实施例以研究将本文所述的实施方案制造用于细胞疗法的原代人t细胞的电转染的可行性。
实施例
使用例如以上附图6~图13中所述的组件进行实验。
更详细地说,所述组件是通过将一叠机械加工的薄聚合物层层压在一起而构成。然后在常规数控(cnc)铣床或紫外激光切割机上加工聚醚酰亚胺(pei)片材。每层均配有一层粘合剂。
为了验证本发明理念,简化了所使用的装置,不包括缓冲液交换功能。而是通过引导含有原代人t细胞和mcherry编码的mrna(cleancapmcherrymrna,trilinkbiotechnologies,圣地亚哥,加利福尼亚州)的低电导率电穿孔缓冲液通过中心入口(图3中入口46c)建立微流体动力学鞘流结构。通过双侧入口(图3中的46a,46b)提供高电导率的培养缓冲液。
细胞和介质分别通过上游和下游端的端口进入和离开微通道。在流体入口和出口处插入不锈钢(ss)管,并用环氧树脂固定。每个入口和出口采用三叉式设计,可产生稳定的鞘流结构,其中细胞在低电导率介质中进入中心入口,高电导率缓冲液在中央流周围的双侧入口中流动。溅射沉积在通道底部上的金属电极通过焊接引线连接到外部控制电路。图案化电极的几何形状为矩形,并且被布置成仅与鞘液接触。这种布置有助于电场在低电导率介质的宽度上集中(在高电导率缓冲液容器上的电位差可以忽略不计),并防止细胞与电极和通道侧壁的物理接触。据信这可促进细胞恢复和活力。
进行实验以研究电场脉冲强度、脉冲持续时间和施加的脉冲数如何影响mrna转染原代人t细胞的转染效率以及相应的细胞存活率和总体细胞恢复的变化。发现较高的电场脉冲强度和较长的暴露时间可提高转染效率。根据一组数据发现,在67kv/m及以下的电场强度下未观察到转染。在所有情况下,从102kv/m开始,转染效率随着电场强度的增加而增加。这表明在这种特定装置中,将mrna转染入原代人t细胞的临界电场强度在67kv/m和102kv/m之间。
一般而言,数据表明可以以连续流动的方式对细胞进行电穿孔。每分钟可处理高达8×106个原代细胞,同时通过对mrna递送24小时后的荧光报告基因(mcherry)的表达进行测定,电穿孔效率达到72%。通过电穿孔过程观察到细胞存活率仅降低9%,细胞系统的总回收率为61%。
在具体实施例中,原代人t细胞在btx电穿孔介质中保持0、15或60分钟后,使用商业批量电穿孔系统进行电穿孔。数据如图14a和图14b所示,示出了3个独立健康供体重复试验的平均值。误差线代表平均值的标准误差。如图14a所示,当t细胞在含有mrna的btxpress培养基中保持15分钟时,电穿孔后24小时通过流式细胞术测量可见转染效率降低,并且如果保持时间增加到60分钟则进一步降低。
在电穿孔后24小时通过流式细胞术测量的转染后活力(图14b)随着保持时间的增加而降低,但是该降低不具有统计学意义。
图15显示了根据本发明的方面,从两个不同供体得到的细胞通过连续流中进行同样的电穿孔后的活力和转染效率(以细胞的百分比表示)。
虽然已经参照本发明的优选实施例具体示出和描述了本发明,但是本领域技术人员将理解,在不脱离所附权利要求所涵盖的本发明的范围的情况下,可以在形式和细节上进行各种改变。
- 还没有人留言评论。精彩留言会获得点赞!