一种生物催化合成4-取代噁唑烷酮化合物的方法与流程
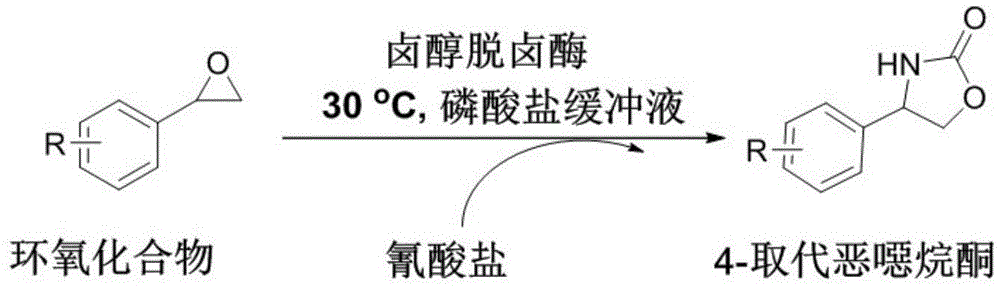
本发明属于生物工程技术领域,尤其涉及一种生物酶法合成4-取代噁唑烷酮化合物的方法;具体地说,本发明是关于利用生物酶催化环氧化合物和氰酸盐在温和条件下反应合成4-取代噁唑烷酮化合物的一种生物催化技术。
背景技术:
抗生素和人工合成的抗菌药物是目前人类治疗微生物感染性疾病的首选药物。据统计,临床上用于预防性抗菌药物处方占抗菌药物总消耗量的一半以上。近年来,抗生素的过多使用甚至滥用导致细菌的耐药性问题日益严重,特别是以“耐甲氧西林金黄色葡萄球菌(mrsa)和表皮葡萄球菌(mrse)”、“耐青霉素肺炎链球菌(pbsp)”和“耐万古霉素的肠球菌(vre)”为代表的革兰氏阳性菌的耐药性问题最为严重。这些耐药菌的出现和变异,极大地降低了现有药物的治疗效果,导致患者的治疗时间显著加长,同时也在一定程度上提高了感染死亡的风险。这些抗药菌的感染给临床治疗带来了极大的困难,现有的抗菌药物已经不能满足临床上的需要,设计与开发新型的抗生素药物是解决细菌耐药性问题的迫切需求。
噁唑烷酮是一类重要的杂环化合物,广泛用于医药中间体和精细化学品的合成。噁唑烷酮类化合物也是一类新型的治疗细菌性感染的抗菌药物,可抑制蛋白质合成的起始阶段,并且很少出现交叉耐药性。2000年4月,第一个噁唑烷酮类抗生素利奈唑胺(linezolid)在美国批准上市,用于治疗多重耐药革兰氏阳性菌引起的感染。利奈唑胺随后被证实是治疗革兰氏阳性菌引起的严重感染的一个重要抗生素药物。随后,在2014年6月,美国fda批准另一种噁唑烷酮类抗生素特地唑胺(tedizolid)上市,用于治疗皮肤感染。此外,雷得唑来(radezolid,rx-1741)对多数革兰氏阳性菌和部分革兰氏阴性菌都具有较好的抗菌活性,正处于ii期临床试验。由于噁唑烷酮抗生素的独特作用机制以及利奈唑胺和特地唑胺的成功上市与良好的治疗效果,围绕噁唑烷酮骨架开发新型抗生素是解决细菌耐药性的一个重要途径。因此,与之相相对应的噁唑烷酮类化合物的绿色和高效合成也是相关药物开发和应用的重点工作。
目前已经发展了多种制备噁唑烷酮的合成技术,这些方法通常以氨基醇、炔丙基胺、炔丙基胺、氮杂环丙烷和环氧化物为原料。环氧化物廉价易得,因而以环氧化物为原料的合成途径具有较大的吸引力和应用前景。生物催化技术是利用来源于生物体内的酶作为催化剂,来完成特定的有机化学反应。由于生物催化反应具有反应条件温和,转化效率高和选择性高等优点,可实现化合物的绿色合成,并已广泛用于许多医药化学品及其中间体的合成。截止目前,关于生物催化合成噁唑烷酮的技术非常少。2005年dickb.janssen报道了利用来源于agrobacteriumradiobacterad1的卤醇脱卤酶hhec催化环氧化合物与氰酸盐反应合成5-取代噁唑烷酮化合物(organicletters10.12(2008):2417-2420)。然而,目前已报道的卤醇脱卤酶催化剂在催化氰酸根离子对环氧化合物进行开环反应的过程中,均表现出高度的β-进攻开环区域选择性,即得到的噁唑烷酮化合物均为5-取代的噁唑烷酮。因此,开发新型的具有α-进攻开环区域选择性的卤醇脱卤酶催化剂,为4-取代的噁唑烷酮提供一种高效绿色的合成方法,具有重要的工业应用价值。
技术实现要素:
本发明的目的是为了补充现存技术存在的缺陷而提供工艺简单、具有很好应用前景的一种生物催化合成4-取代噁唑烷酮化合物的方法。
本发明通过以下技术方案来实现:
一种生物催化合成4-取代噁唑烷酮化合物的方法,该方法包括以下步骤:
步骤一:先使用生物催化剂催化环氧化物与氰酸盐反应;
步骤二:再经开环和自发环化过程,形成4-取代噁唑烷酮化合物。
所述的生物催化剂为重组表达的卤醇脱卤酶。
所述的生物催化剂为重组卤醇脱卤酶工程菌的发酵菌体或其破碎后的粗酶液。
所述的卤醇脱卤酶基因来源于ilumatobactercoccineus菌株,氨基酸序列的ncbi登陆号为ban03849.1,属于短链脱氢还原酶家族。人工合成的基因序列如seqidno.1所示,氨基酸序列如seqid,no.2所示。
所述的生物催化剂催化环氧化物与氰酸盐反应条件为:ph为6.0-9.0的缓冲溶液,反应温度为25-45℃,环氧底物的浓度为0-50mmol/l,重组大肠杆菌干细胞浓度为5-20g/l,氰酸盐与环氧底物的当量比为6:1-1:1,反应时间为6-24小时。
作为优选,所述缓冲溶液的ph值为7.5,缓冲溶液为磷酸氢二钠-磷酸二氢钾。
作为优选,所述的氰酸盐为氰酸钠或氰酸钾;更优选为氰酸钠。作为优选,所述的氰酸盐与环氧底物的添加量摩尔比为4:1-1:1;更为优选为3:1。
作为优选,所述的反应温度为20-30℃,反应时间为6-24小时;更为优选为30℃,时间为10-12小时。
作为优选,所述环氧底物的添加量为5-50mmol/l,更为优选为30mmol/l。
作为优选,所述生物催化剂形式为静息细胞,其添加浓度为10-15gdcw/l。
采用上述技术方案的有益效果是:
本发明与现有噁唑烷酮合成技术相比,本发明是首次利用具有高度α-进攻开环区域选择性的卤醇脱卤酶来催化环氧化合物与氰酸盐反应合成4-取代噁唑烷酮化合物的生物催化技术,将在4-取代噁唑烷酮药物及其中间体的绿色制造中具有广阔的应用前景。
附图说明
图1为本发明中卤酶催化环氧底物合成4-取代噁唑烷酮化合物的反应通式。
具体实施方式
以下实施例旨在阐述而不是限制本发明的范围。化合物的核磁共振氢谱和碳谱用安捷伦400mhz核磁共振波谱仪测定,所用试剂均为分析纯或化学纯。
实施例1:
4-苯基噁唑烷酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解108微升环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。77%产率,1hnmr(400mhz,cdcl3)δ7.38(m,5h),6.21(s,1h),4.95(t,j=7.8hz,1h),4.72(t,j=8.7hz,1h),4.17(t,j=7.8hz,1h).13cnmr(100mhz,cdcl3)δ160.0,139.6,129.3,128.9,126.1,72.7,56.5。
所述4-苯基-恶噁烷-2-酮化学式为:
实施例2:
4-(3-氟苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解102微升3-氟环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。66%产率,1hnmr(400mhz,cdcl3)δ7.35(dd,j=13.6,7.3hz,1h),7.10(d,j=7.5hz,1h),7.03(m,2h),6.89(s,1h),4.96(t,j=7.7hz,1h),4.71(t,j=8.7hz,1h),4.17-4.09(m,1h).13cnmr(100mhz,cdcl3)δ162.7(d,j=246.0hz),160.3,142.3(d,j=7.0hz),131.0(d,j=8.0hz),121.7(d,j=3.0hz,),115.8(d,j=21.0hz),113.1(d,j=22.0hz),72.3,56.0(d,j=2.0hz)。
所述4-(3-氟苯基)-恶噁烷-2-酮化学式为:
实施例3:
4-(3-氯苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解108微升3-氯环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。65%产率,1hnmr(400mhz,cdcl3)δ7.32(m,3h),7.24-7.15(m,1h),6.83(s,1h),4.99-4.88(t,j=7.8hz,1h),4.70(t,j=8.7hz,1h),4.12(dd,j=8.3,7.0hz,1h).13cnmr(100mhz,cdcl3)δ160.2,141.8,135.1,130.6,129.0,126.3,124.2,72.3,56.0。
所述4-(3-氯苯基)-恶噁烷-2-酮化学式为:
实施例4:
4-(3-溴苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解119微升3-溴环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。46%产率,1hnmr(400mhz,cdcl3)δ7.45(m,2h),7.27-7.21(m,2h),6.64(s,1h),4.98-4.83(t,j=7.8hz,1h),4.69(t,j=8.7hz,1h),4.11(dd,j=8.4,6.9hz,1h).13cnmr(100mhz,cdcl3)δ160.0,142.0,132.0,130.9,129.2,124.7,123.3,72.3,55.9。
所述4-(3-溴苯基)-恶噁烷-2-酮化学式为:
实施例5:
4-(3-甲基苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解112微升3-甲基环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。65%产率,1hnmr(400mhz,cdcl3)δ7.25(t,j=7.7hz,1h),7.10(dd,j=14.3,7.8hz,3h),6.55(s,1h),4.94-4.81(t,j=7.8hz,1h),4.66(t,j=8.7hz,1h),4.12(dd,j=8.5,6.9hz,1h),2.34(s,3h).13cnmr(100mhz,cdcl3)δ160.2,139.6,139.0,129.5,129.1,126.7,123.1,72.6,56.4,21.4。
所述4-(3-甲基苯基)-恶噁烷-2-酮化学式为:
实施例6:
4-(4-氟苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解101微升4-氟环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。67%产率,1hnmr(400mhz,cdcl3)δ7.29(m,2h),7.06(t,j=8.5hz,2h),6.71(s,1h),4.94(t,j=7.8hz,1h),4.69(t,j=8.7hz,1h),4.11(dd,j=8.2,7.3hz,1h).13cnmr(100mhz,cdcl3)δ162.9(d,j=247.0hz),160.2,135.4(d,j=3.0hz),127.9(d,j=8.0hz),116.2(d,j=22.0hz),72.6,55.9。
所述4-(4-氟苯基)-恶噁烷-2-酮化学式为:
实施例7:
4-(4-氯苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解108微升4-氯环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。70%产率,1hnmr(400mhz,cdcl3)δ7.36(d,j=8.4hz,2h),7.26(d,j=8.6hz,2h),6.25(s,1h),4.97-4.88(t,j=7.7hz1h),4.70(t,j=8.7hz,1h),4.11(dd,j=8.4,7.0hz,1h).13cnmr(100mhz,cdcl3)δ159.8,138.1,134.9,129.5,127.6,72.5,56.0。所述4-(4-氯苯基)-恶噁烷-2-酮化学式为:
实施例8:
4-(4-溴苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解119微升4-溴环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。58%产率,1hnmr(400mhz,cdcl3)δ7.51(d,j=8.3hz,2h),7.20(d,j=8.3hz,2h),6.66(s,1h),4.91(t,j=7.8hz,1h),4.70(t,j=8.7hz,1h),4.10(dd,j=8.3,7.1hz,1h).13cnmr(100mhz,cdcl3)δ160.1,138.7,132.4,127.8,122.8,72.4,55.9。
所述4-(4-溴苯基)-恶噁烷-2-酮化学式为:
实施例9:
4-(4-甲基苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解112微升4-甲基环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。47%产率,1hnmr(400mhz,cdcl3)δ7.25-7.14(m,4h),6.25(s,1h),4.91(t,j=7.7hz,1h),4.69(t,j=8.5hz,1h),4.14(t,j=7.6hz,1h),2.35(s,3h).13cnmr(100mhz,cdcl3)δ160.0,138.7,136.6,129.9,126.1,72.8,56.3,21.2。
所述4-(4-甲基苯基)-恶噁烷-2-酮化学式为:
实施例10:
4-(4-氯甲基苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解123微升4-氯甲基环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。43%产率,1hnmr(400mhz,cdcl3)δ7.42(d,j=8.0hz,2h),7.33(d,j=8.1hz,2h),6.41(s,1h),4.96(t,j=7.8hz,1h),4.72(t,j=8.7hz,1h),4.58(s,2h),4.15(dd,j=8.4,7.1hz,1h).13cnmr(100mhz,cdcl3)δ160.0,139.9,138.3,129.5,126.6,72.5,56.1,45.7。
所述4-(4-氯甲基苯基)-恶噁烷-2-酮化学式为:
实施例11:
4-(4-氰基苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解110微升4-氰基环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。32%产率,1hnmr(400mhz,cdcl3)δ7.69(d,j=7.9hz,2h),7.46(d,j=7.8hz,2h),6.88(d,j=12.6hz,1h),5.04(t,j=7.7hz,1h),4.77(t,j=8.8hz,1h),4.13(t,j=7.6hz,1h).13cnmr(100mhz,cdcl3)δ160.1,144.9,133.1,126.9,118.3,112.8,72.0,56.0。
所述4-(4-氰基苯基)-恶噁烷-2-酮化学式为:
实施例12:
4-(4-叔丁基苯基)-恶噁烷-2-酮合成:向30ml磷酸氢二钠-磷酸二氢钾(50mm,ph7.5)缓冲液中加入0.45g(干重)重组卤醇脱卤酶,176mg氰酸钠;用300微升二甲基亚砜(作为助溶剂)溶解160微升4-叔丁基环氧苯乙烷,并加入缓冲液中。将反应液置于30℃控温摇床中,以250rpm转速反应12小时。反应结束后用乙酸乙酯(2×30ml)萃取反应液,将有机相用无水硫酸钠干燥后减压浓缩,经硅胶柱层析纯化(乙酸乙酯:石油醚=1:1),减压旋蒸,得白色固体。29%产率,1hnmr(400mhz,cdcl3)δ7.40(d,j=8.2hz,2h),7.25(d,j=8.2hz,2h),6.07(s,1h),4.92(t,j=7.8hz,1h),4.69(t,j=8.6hz,1h),4.21-4.13(t,j=7.8hz,1h),1.30(s,9h).13cnmr(100mhz,cdcl3)δ152.1,136.5,126.2,126.0,72.7,56.3,34.8,31.4。
所述4-(4-叔丁基苯基)-恶噁烷-2-酮化学式为:
序列表
<110>遵义医学院
<120>一种生物催化合成4-取代噁唑烷酮化合物的方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>792
<212>dna
<213>卤醇脱卤酶(ilumatobactercoccineus)
<400>1
atggccagcaatgcagaaaatcgtccggttgcactgattacaatggcaaccggttatgtt60
ggtccggcactggcacgtacaatggccgatcgtggttttgatctggttctgcatggtaca120
gccggtgatggtacaatggttggtgttgaagaaagttttgatagccagattgccgatctg180
gcaaaacgtggtgcagatgttctgaccattagtgatgttgatctgaccacacgtaccggt240
aatcagagcatgattgaacgtgttctggaacgttttggtcgtctggatagcgcatgtctg300
gtgaccggtctgattgttaccggcaaatttctggatatgaccgatgatcagtgggcaaaa360
gttaaagcaaccaacctggatatggtttttcatggtctgcaggcagttctgcctccgatg420
gttgcagccggtgcaggtcagtgtgttgtttttaccagcgcaaccggtggtcgtccggat480
ccgatggtgagcatttatggtggcacccgtgccggtgcaaatggtattgttcgtgcagtt540
ggtctggaacatgcacgtcatggtgttcaggttaatgcaattggcaccaactatatggat600
tttccgggttttctgaaagcaagccgtgcagatggtgatccggaacgtcgtgcaatgatt660
gaagcacaggttccgctgcgtcgtctgggtacgatggatgaactgagcagcgttaccgca720
ggtctgctggatggtagcaatcgttttcagacaggtcagttttttgattttagcggtggt780
tggggtgcataa792
<210>2
<211>263
<212>prt
<213>氨基酸(aminoacid)
<400>2
metalaserasnalagluasnargprovalalaleuilethrmetala
151015
thrglytyrvalglyproalaleualaargthrmetalaasparggly
202530
pheaspleuvalleuhisglythralaglyaspglythrmetvalgly
354045
valglugluserpheaspserglnilealaaspleualalysarggly
505560
alaaspvalleuthrileseraspvalaspleuthrthrargthrgly
65707580
asnglnsermetilegluargvalleugluargpheglyargleuasp
859095
seralacysleuvalthrglyleuilevalthrglylyspheleuasp
100105110
metthraspaspglntrpalalysvallysalathrasnleuaspmet
115120125
valphehisglyleuglnalavalleuproprometvalalaalagly
130135140
alaglyglncysvalvalphethrseralathrglyglyargproasp
145150155160
prometvalseriletyrglyglythrargalaglyalaasnglyile
165170175
valargalavalglyleugluhisalaarghisglyvalglnvalasn
180185190
alaileglythrasntyrmetasppheproglypheleulysalaser
195200205
argalaaspglyaspprogluargargalametileglualaglnval
210215220
proleuargargleuglythrmetaspgluleuserservalthrala
225230235240
glyleuleuaspglyserasnargpheglnthrglyglnphepheasp
245250255
pheserglyglytrpglyala
260
- 还没有人留言评论。精彩留言会获得点赞!
- 液滴水平及向上分选、原滴上浮、注物平走式微流控芯片的制造方法与工艺
- 液滴水平及向下分选、原滴下沉、注物平走式微流控芯片的制造方法与工艺
- 液滴多路分选、原滴下沉、注物平走或上浮式微流控芯片的制造方法与工艺
- 一种通过改变液滴密度实现液滴分选的微流控方法与流程
- 液滴水平及向上分选、原滴平走、注物上浮式微流控芯片的制造方法与工艺
- 液滴多路分选、原滴上浮、注物平走或下沉式微流控芯片的制造方法与工艺
- 液滴向上及向下分选、原滴下沉、注物上浮式微流控芯片的制造方法与工艺
- 一种真菌催化甾体生物转化的方法与流程
- 异丁香酚单加氧酶活性聚集体的构建方法及转化异丁香酚生产香草醛的方法与流程
- 一种来源于宏基因组的低温酯酶、编码基因及其应用的制造方法与工艺