一种斑马鱼胚胎单细胞悬液的制备方法与流程
本发明属于生物技术领域,具体涉及一种斑马鱼胚胎单细胞悬液的制备方法。
背景技术:
随着测序技术的发展,测序成本不断下降,转录组学与基因组学等生物组学技术在医学、环境、食品等多领域得到越来越多的应用。但传统的转录组学(bulkrnaseq)与基因组学测序(bulkdnaseq)所获得是生物组织(器官)的整体状态。对组成生物组织(器官)的不同类型细胞进行一个“均一”的分析,并不利于研究复杂的生物过程。尤其是对免疫学,肿瘤学,遗传学的研究来说,传统测序无法获取有效信息。随着mars-seq、cytoseq、drop-seq、indrop等技术的出现,使得对单个细胞内核酸分别测序成为可能,即单细胞测序(singlecellrna/dnaseq),而制备一份高质量的单细胞悬液是保障测序质量的决定因素。同时,流式细胞术,原代细胞培养等重要技术手段在应用的过程中,首先也需要制备单细胞悬液。
目前单细胞悬液的制备方法主要可以分为酶解法,机械破碎,螯合剂处理以及上述方法组合使用。farrell等人1通过快速剧烈震荡离心管,将斑马鱼胚胎制成单细胞悬液。机械破碎一般耗时较酶解法短利于提高活力,但细胞分散效果差,多团聚体,并且对细胞造成物理损伤。raj等人2采用商品化试剂盒制备了斑马鱼脑部组织单细胞悬液,对细胞起分散作用的主要是木瓜蛋白酶。或是多种酶连续配合消解3,常用的酶类有胶原蛋白酶,胰酶,弹性蛋白酶,木瓜蛋白酶以及透明质酸酶等。这类方法制得的细胞分散好,但在每次终止酶消化后均需对细胞进行多次离心洗涤,耗时长,吹吸重悬过程对细胞损伤大。而将机械的方法与酶解或者螯合剂组合使用,能够相对缩短整个悬液制备时间,也较纯机械破碎或酶解法温和。如spanjaard等人4,采用温和型酶tryple孵育,并且每隔5分钟使用移液器对斑马鱼幼鱼、脑部组织以及肝胰腺组织进行吹吸,以制备相应单细胞悬液。briggs等人5则采用羟乙基磺酸钠(sodiumisethionate)、焦磷酸钠以及caps配置而成的缓冲液进行孵育,同时辅以机械涡旋制备了非洲爪蛙胚胎单细胞悬液。
悬液的制备方式多种多样,但目前多开发应用于制备人类肿瘤、生物组织(器官)等的单细胞悬液。针对鱼类胚胎制备方法尚且不多,尤其是鱼类胚胎还包被有起保护作用的绒毛膜,需先去除绒毛膜,才能进行后续操作。根据briggs等人5描述其在分散非洲爪哇胚胎细胞时,尝试了cmfm(calciummagnesiumfreemedia),newport分散液(newportdissociationmedia),胰蛋白酶-edta,tryple,细胞消化液,木瓜蛋白酶和胶原酶等的消解,均未获得较好的结果。可见胚胎细胞分散方法无法全盘借鉴生物组织(器官)分散方法。
斑马鱼是一类实验室常用模式生物,由于其便于实验室养殖、繁殖周期短、产卵量大、体外受精与发育、胚体透明,加之其基因组与人类基因组同源性高达70%,这些都使得其具有其他模式生物无可比拟的优势。而胚胎作为生物体发育的起始,能够帮助研究人员探索生物体发育的全过程,必然会在未来得到更多的应用。因此开发一种快速高效的斑马鱼胚胎单细胞悬液制备方法十分有必要。
1.farrell,j.a.;wang,y.;riesenfeld,s.j.;shekhar,k.;regev,a.;schier,a.f.,single-cellreconstructionofdevelopmentaltrajectoriesduringzebrafishembryogenesis.science2018,360,(6392),979-+.
2.raj,b.;wagner,d.e.;mckenna,a.;pandey,s.;klein,a.m.;shendure,j.;gagnon,j.a.;schier,a.f.,simultaneoussingle-cellprofilingoflineagesandcelltypesinthevertebratebrain.naturebiotechnology2018,36,(5),442-+.
3.magness,s.t.;puthoff,b.j.;crissey,m.a.;dunn,j.;henning,s.j.;houchen,c.;
kaddis,j.s.;kuo,c.j.;li,l.;lynch,j.;martin,m.g.;may,r.;niland,j.c.;olack,b.;
qian,d.;stelzner,m.;swain,j.r.;wang,f.;wang,j.;wang,x.;yan,k.;yu,j.;wong,m.h.,amulticenterstudytostandardizereportingandanalysesofffluorescence-activatedcell-sortedmurineintestinalepithelialcells.americanjournalofphysiology-gastrointestinalandliverphysiology2013,305,(8),g542-g551.
4.spanjaard,b.;hu,b.;mitic,n.;olivares-chauvet,p.;janjuha,s.;ninov,n.;junker,j.p.,simultaneouslineagetracingandcell-typeidentificationusingcrispr-cas9-inducedgeneticscars.naturebiotechnology2018,36,(5),469-+.
5.briggs,j.a.;weinreb,c.;wagner,d.e.;megason,s.;peshkin,l.;kirschner,m.w.;
klein,a.m.,thedynamicsofgeneexpressioninvertebrateembryogenesisatsingle-cellresolution.science2018,360,(6392),980-+.
技术实现要素:
本发明所要解决的技术问题是提供一种斑马鱼胚胎单细胞悬液的制备方法,以解决目前未有快速高效的斑马鱼胚胎单细胞悬液制备方法。本发明采用分散酶(dispase),实现了短时间内消化分散斑马鱼胚胎细胞,制备高质量单细胞悬液。
为解决上述技术问题,本发明采用的技术方案如下:
一种斑马鱼胚胎单细胞悬液的制备方法,顺序进行如下步骤:
(1)取斑马鱼胚胎,加入pronasee的水溶液;
(2)37℃孵育4~5min;
(3)使用2ml一次性滴管轻轻吹吸胚胎使绒毛膜剥落,移入1.5ml无酶离心管中,并快速吸走pronasee;
(4)加入e3培养基洗涤,移除,反复3~5遍;
(5)加入冰上预冷的分散酶;
(6)37℃孵育2-5min,孵育期间间歇震荡;
(7)加入fbs终止消化;
(8)将步骤(7)得到的悬液过70μm筛网,将滤液再过40μm筛网;
(9)过筛后的悬液200~500×g离心3~5min;
(10)取冰上预冷的含1%的bsa的hbss重悬细胞;
(11)200~500×g离心步骤(10)得到的悬液3~5min;
(12)重复步骤(10)和(11)清洗一次;
(13)取冰上预冷的iesc重悬细胞,即得。
步骤(1)中,所述的pronasee的水溶液,pronasee的浓度为0.5~2.0mg/ml。
步骤(1)中,pronasee的水溶液的加入体积为斑马鱼胚胎体积的2~5倍。
步骤(4)中,所述的e3培养基配方为:5mmnacl,0.17mmkcl,0.33mmcacl2·h2o,0.33mmmgso4·7h2o,溶剂为水。
步骤(4)中,e3培养基每次的使用量是1~2ml。
步骤(5)中,所述的分散酶为dispase溶于hbss中,浓度为0.4~1.0u/ml。
步骤(5)中,对于每个斑马鱼胚胎,分散酶的使用体积为10~20μl。
步骤(7)中,fbs的使用体积为步骤(5)中分散酶体积的10~20%。
步骤(10)中,所述的含1%的bsa的hbss的使用体积为10~20μl/个斑马鱼胚胎。
步骤(13)中,iesc的使用体积视后续实验要求而定,例如,40枚10hpf阶段的胚胎使用500μliesc重悬可获得浓度为106cell/ml的单细胞悬液。
有益效果:本发明采用在链霉蛋白酶(pronasee)去除绒毛膜后,使用分散酶分散细胞来制备单细胞悬液。整个过程在20分钟内完成,相对现有文献报道缩短了分散过程,减少了细胞碎片化、团聚体,提高了细胞活力和胚胎单细胞悬液的质量。
附图说明
图1为细胞活力百分比图。
图2为细胞实物图。
图3为细胞悬液粒径分布图。
图4为hoechst荧光探针染色后的细胞悬液。
具体实施方式
根据下述实施例,可以更好地理解本发明。本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
以下实施例材料来源如下:
pronasee(mce,美国);
e3培养基(5mmnacl,0.17mmkcl,0.33mmcacl2·h2o,0.33mmmgso4·7h2o);分散酶(dispase,源叶生物,中国);
hbss(stemcell,加拿大);
fbs(gibco,澳大利亚);
iesc培养基(advanceddmem/f12(gibco,美国)中添加n2(1x,lifetechnologies,美国),b27(不含维生素a,1x,lifetechnologies,美国),10mmhepes(gibco,美国),10μmy27632(sigma,usa),100μg/ml青霉素/链霉素双抗溶液(mrc,中国)和2mml-谷氨酰胺(gibco,美国))。
以下实施例所使用的检测设备如下:
tc20全自动细胞计数仪(bio-rad,美国);
倒置荧光显微镜(nikon,日本)。
实施例1:
一种斑马鱼胚胎单细胞悬液的制备方法,顺序进行如下步骤:
(1)取40枚斑马鱼胚胎,加入1mg/mlpronasee的水溶液;pronasee的水溶液的加入体积为斑马鱼胚胎体积的3倍。
(2)37℃孵育5min。
(3)使用2ml一次性滴管轻轻吹吸胚胎使绒毛膜剥落,移入1.5ml无酶离心管中,并快速吸走pronasee。
(4)加入1.5mle3培养基洗涤,移除,反复3~5遍(清洗pronasee)。
(5)加入500μl冰上预冷的分散酶;所述的分散酶为dispase溶于hbss中,浓度为0.6u/ml。
(6)37℃孵育2min,孵育期间间歇震荡(约每隔15sec)。
(7)加入100μlfbs终止消化。
(8)将步骤(7)得到的悬液过70μm筛网,将滤液再过40μm筛网。
(9)过筛后的悬液300×g离心3min。
(10)取500μl冰上预冷的含1%的bsa的hbss重悬细胞。
(11)300×g离心步骤(10)得到的悬液3min。
(12)重复步骤(10)和(11)清洗一次。
(13)取500μl冰上预冷的iesc重悬细胞,即得。
得到的产品分别进行细胞活力及分散效果检测,结果见图1~4。
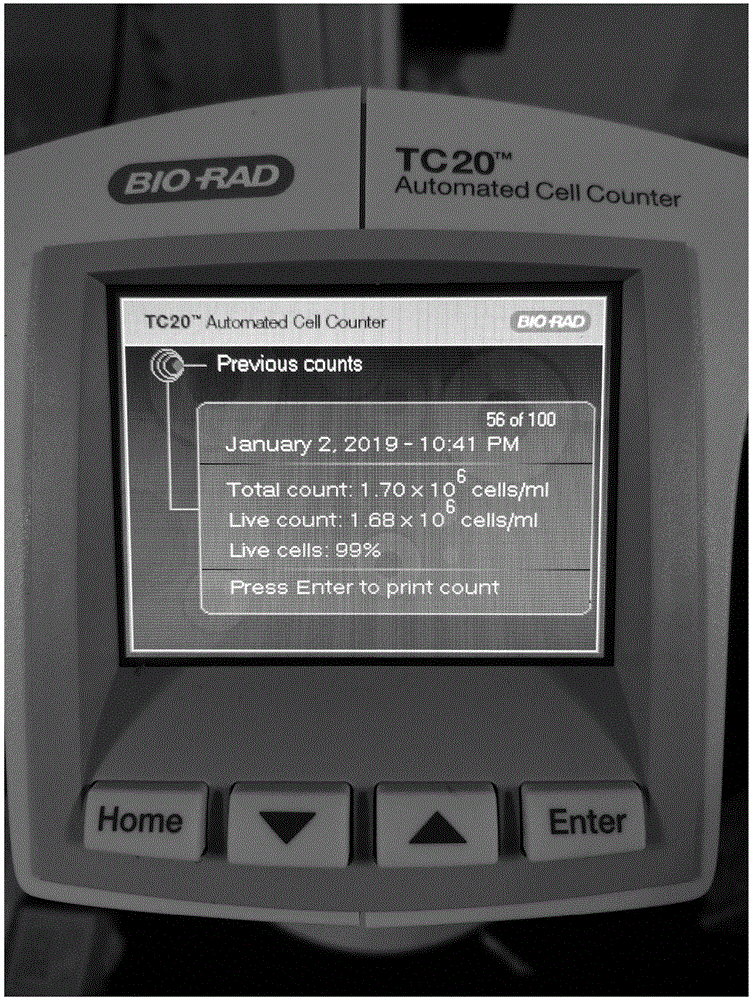
图1为细胞活力百分比图,展示的是悬液中的细胞总量(1.7x106个/ml),活细胞数(1.68x106个/ml),活细胞的比例为99%。
图2为自动计数仪导出的细胞实物图,可以看出本发明方法得到的重悬细胞碎片少,细胞分散好。
图3为细胞悬液粒径分布图,主要是观察细胞的大小,过小可能是碎片多,过大团聚多。本实施例结果中粒径分布图峰值出现在10μm及13μm(出现两个峰值可能是细胞分化所致,原始卵细胞分裂而成的细胞粒径较大,逐渐分化而体积缩小,数量变多),图3表明绝大部分为单细胞,小粒径碎片,与大粒径团聚体几乎无分布。
图4为单细胞悬液荧光探针照片(hoechst探针标记活细胞,放大倍数为4),由图4可以看出活细胞数量以及无团聚体,基本都是单个活细胞。
- 还没有人留言评论。精彩留言会获得点赞!