一种毛囊EMIs微环境模型的构建方法与流程
本发明属于毛囊技术领域,尤其涉及一种毛囊emis微环境模型的构建方法。
背景技术:
目前,业内常用的现有技术是这样的:
毛囊,毛发之处。每一根毛发在皮肤上所产生的一个表皮凹陷,称毛孔。通常在每个毛孔或毛囊内生长一根头发(但也有生长2-3根的)。毛囊向下伸入真皮约有一厘米深度,它是由包绕毛发与表皮相连的上皮鞘,以及皮脂腺和立毛肌所组成的一个结构比较复杂的器官附件组织。毛囊实际上是由结缔组织和上皮两部分所组成,除了具有结缔组织和血管的真皮乳头(毛乳头)外,毛囊其余部分都是由表皮细胞分化而来。毛囊开口起始于皮肤表面,而每个毛囊又和一个或多个腺胞相连。每个腺胞解离成富含脂质的物质,却又通过一个共同和毛囊相通连的皮脂腺导管将分泌物运送到皮肤表面排出。
随着组织工程及再生医学的发展,毛囊生物学领域近年来在毛囊细胞移植重建方面进行了大量的研究并取得了一定进展,通过组织工程技术重建再生毛囊已成为治疗毛发缺失的理想选择。虽然目前的组织工程技术可通过毛囊细胞疗法在裸鼠体内实现鼠源性毛囊的再生和人鼠杂合毛囊的重建,但由于存在物种之间和细胞所需微环境上的差异,仍无法实现人毛囊的体外重建。此外,从医学伦理学的角度出发,无论是以何种方式将动物来源的组织或细胞作为毛囊再生的供体,还是利用其在人体内进行毛囊重建均存在诸多限制。因此,如何构建出毛囊类器官(hair-follicleorganoid)甚至完整的人毛囊(humanhairfollicle),是秃发性疾病治疗的研究热点和难点。
正常情况下,毛囊的形态发生及发育的过程主要由上皮-间质的相互作用(epithelial-mesenchymalinteractions,emis)所主导,这一诱导毛囊形成的微环境主要是由毛囊间质(真皮层)的来源毛乳头细胞(dermalpapillacells,dpcs)和毛囊上皮(表皮层)来源的干细胞(follicularstemcells,fscs)参与,同时还受到上皮-间质内的信号通路(wnts、fgfs等)的调控。
由于dpcs在毛囊的形态发生过程中具有诱导fscs分化形成毛发结构的生理学功能,因此是毛囊再生及重建的关键种子细胞。尽管目前的组织工程技术已能实现毛囊种子细胞的分离及培养。但是,由于离体与在体环境之间存在巨大差异,使得体外培养的dpcs其诱导毛发再生的能力会随着传代次数的增加而逐渐丧失。因此,目前毛囊重建方面的困难在于难以获得充足的且具有毛囊诱导(hairinduction)功能的细胞,同时也进一步限制了dpcs的临床应用。
在生理情况下,细胞正常的生长、增殖、分化和功能的维持需要一个适宜的微环境(microenvironment/niche),这一特殊的生理环境主要是由细胞与细胞间(cell-cellinteraction)、细胞与细胞外基质(extracellularmatrix,ecm)间相互作用(cell-ecminteraction)所构成,这些微环境成分共同对细胞的增殖、分化、粘附以和生理学功能的发挥等方面起到主导及调控作用。
基于上述内容,我们认为:通过将具备较强毛发诱导能力的hdpcs仿生微组织和能在dpcs诱导下分化为毛干结构的fscs共同进行三维共培养,能模拟体内正常毛囊形态发生及发育过程中上皮-间质的相互作用(emis),有望在体外构建出仿生化的毛囊诱导微环境。若这方面的研究取得突破,不仅可为研究毛囊形态发生、毛囊相关疾病的发病机理和秃发治疗药物的筛选提供实验模型,还可为体外构建和培育毛囊类器官用于秃发性疾病的临床治疗提供科学依据。
综上所述,现有技术存在的问题是:秃发性疾病治疗的研究热点和难点是如何构建出毛囊类器官(hair-follicleorganoid)甚至完整的人毛囊(humanhairfollicle)。
解决上述技术问题的难度:
目前毛囊重建方面的困难在于难以获得充足的且具有毛囊诱导(hairinduction)功能的细胞,同时也进一步限制了dpcs的临床应用。
解决上述技术问题的意义:
通过将具备较强毛发诱导能力的hdpcs仿生微组织和能在dpcs诱导下分化为毛干结构的fscs共同进行三维共培养,能模拟体内正常毛囊形态发生及发育过程中上皮-间质的相互作用(emis),有望在体外构建出仿生化的毛囊诱导微环境。若这方面的研究取得突破,不仅可为研究毛囊形态发生、毛囊相关疾病的发病机理和秃发治疗药物的筛选提供实验模型,还可为体外构建和培育毛囊类器官用于秃发性疾病的临床治疗提供科学依据。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种毛囊emis微环境模型的构建方法。
本发明是这样实现的,一种毛囊emis微环境模型的构建方法,具体包括以下步骤:
步骤一:毛囊种子细胞的分离和获取:采用显微解剖结合酶消化后再离心过滤的方法以高效分离毛乳头并获得人毛乳头细胞(hdpcs);同时采用精细显微分离结合酶消化的技术方法获得高纯度的人毛囊干细胞(hfscs);
步骤二:毛囊emis微环境模型的构建:采用微阵列三维悬滴培养平台的基础上,将hdpcs微组织、hfscs以不同组合方式构建,并从共培养条件上进一步优化筛选出最佳的毛囊emis微环境模;
步骤三:毛囊emis微环境模型的体外生物学验证:通过形态学、组织学、细胞生物学、细胞空间排列分布、毛发诱导和毛干分化表型、上皮-间质细胞相互作用信号通路机制进行体外的生物学验证和系统评价;
步骤四:毛囊emis微环境模型的体内生物学验证:通过显微操作将其移植于裸鼠进行体内诱导重建,移植后从毛囊组织学、毛干特性及成分、毛囊周期、毛囊内细胞排列分布进行体内的生物学验证和系统评价。
进一步,步骤一中,hdpcs的分离和培养:
取行面部除皱、毛发移植或头皮软组织扩张术患者术中多余的头皮毛囊组织标本,采用显微解剖结合酶消化过滤的方法进行人头皮毛囊毛乳头组织的分离,将获取的人毛乳头(hdps)采用常规的二维原代培养进行短期的体外扩增获得人毛乳头细胞(hdpcs)。
进一步,步骤一中,hfscs的分离和培养:
取面部除皱、毛发移植或头皮软组织扩张术患者术中多余的头皮毛囊组织样本,采用显微分离结合酶纯化的方法挑选毛囊上皮隆突区(bulge区)组织进行人毛囊上皮来源干细胞(hfscs)的原代培养,对获得的细胞进行常规的体外扩增和细胞鉴定。
进一步,步骤二中,人毛囊emis微环境模型的构建:
96孔微阵列三维悬滴培养平台,以高通量的培养方式构建不同组合类型的仿生三维共培养体系:
(1)模型1:将hdpcs与hfscs按一定比例预混合后接种至悬滴板内进行三维共培养,培养一定时间,形成“单纯混合型”仿生微组织混合体(hdpcs-hfscsmixedmicrotissues);
(2)模型2:分别将hdpcs和hfscs通过三维悬滴培养同时构建成仿生微组织,然后按一定比例接种至悬滴板内以均匀混合两种微组织,共培养一定时间,形成“紧密接触型”仿生微组织混合体(hdpcs-hfscscloselycontactedmicrotissues);
(3)模型3:先将hdpcs通过三维悬滴培养构建成仿生微组织后,再加入一定比例的hfscs,共培养一定时间,形成内层为hdpcs仿生微组织、外层为hfscs包裹的“核心包绕型”仿生微组织混合体(hdpcs-hfscscore-shellstructuredmicrotissues);
(4)模型的优化:主要从以下几个方面对培养条件进行优化和筛选:
①hdpcs与hfscs的接种数量:将hdpcs和hfscs的接种密度设置为0.25×104/孔、0.5×104/孔、1×104/孔、2×104/孔;
②hdpcs与hfscs接种的相互比例:根据细胞接种的数量,将hdpcs与hfscs接种数量间的相互比例设置为1:1、1:2、1:4分别进行共培养;
③混合培养基的相互配比:将间充质干细胞培养基(msc-m)与上皮细胞培养基(k-sfm)通过1:1、1:2、1:4的不同配比制成混合条件培养基,将共培养的换液时间设置为每天或每2天换液1次;
综合以上几方面指标,筛选出最适宜的共培养条件和模型,进行后续的体外检测及体内动物实验。
进一步,步骤三中,毛囊emis微环境模型的体外生物学验证:
(1)形态学:
1)细胞接种培养后,分别选取特定时间点于倒置相差显微镜下观察实验各组模型中毛囊三维细胞的生长形态及毛囊类器官的构建情况;
2)对构建的毛囊类器官取材进行扫描电镜(sem)和透射电镜(tem)检查,进一步观察其微观结构;
(2)组织学:
1)采用h&e染色观察构建的模型中毛囊类器官结构的完整性、其内细胞的形态和分布情况;步骤如下:
①毛囊类器官培养物的收集取材:细胞培养一段时间后,采用200μl的加样器枪头轻轻吸出培养孔中的培养基,并用pbs冲洗3次,之后采用显微镊或微量药勺小心从孔板内取出带有毛囊类器官的胶体,或采用细胞回收液作用、离心后收集;
②制作毛囊类器官的冰冻切片:将收集到的毛囊类器官结构以oct方式包埋,用恒冷箱切片机切片(片厚10μm),将冰冻切片贴于载玻片后采用冷丙酮固定,然后行常规h&e或免疫荧光染色;
③冰冻切片的h&e或免疫荧光染色:染色过程按标准流程进行;
④正置显微镜下观察结果。
2)采用碱性磷酸酶(alp)免疫组化染色观察所构建的毛囊类器官内hdpcs毛发诱导标记物alp的表达情况,按试剂盒说明书进行操作。
(3)细胞生物学:
1)细胞活性:采用live/dead检测毛囊类器官内的细胞存活情况,依照live/dead试剂盒说明书进行染色操作,于倒置荧光显微镜下观察结果;
2)细胞增殖:采用brdu染色检测毛囊类器官培养物内的细胞增殖情况。依照brdu的说明书进行操作,步骤如下:
①毛囊类器官组织标本的收集、冰冻切片制作:方法同前,将获取的毛囊组织冰冻切片采用丙酮于-20℃下固定10min,pbs冲洗2次,取与二抗同源的10%血清封闭20min;
②免疫荧光染色:滴加brdu一抗(兔抗人)至切片,4℃过夜;滴加二抗(羊抗兔,fitc标记),37℃45min,pbs冲洗2次,dab显色;
③正置荧光显微镜下观察切片内brdu表达阳性的细胞数量;
3)细胞凋亡:采用tunel法检测细胞凋亡情况;步骤如下:
①标本的收集、冰冻切片的制作:方法同前,过程略;
②依照tunel试剂盒中的产品说明书进行操作,过程略;
③正置荧光显微镜下观察切片内tunel表达阳性的细胞量;
(4)细胞排列分布:分别采用dio和cm-dil活细胞染色标记hdpcs和hfscs,依照所筛选出的最佳条件进行培养,选择接种共培养后0h、1d、4d、7d和14d的时间点,于倒置荧光显微镜下观察构建的培养模型中两种细胞的生长及排列分布情况;
(5)毛发诱导和毛发分化表型分析:采用qrt-pcr、westernblot和免疫荧光检测构建的毛囊类器官内hdpcs的毛发诱导表型和hfscs的毛干分化情况;步骤如下:
1)选取dpcs毛发诱导标记物alp、β-catenin、wnt10b进行qrt-pcr检测;通过免疫荧光和westernblot来验证上述毛发诱导表型标记物的蛋白表达,综合分析hdpcs毛发诱导能力的变化情况;
2)选取hfscs毛干分化标记物keratin5、内根鞘的keratin71和毛皮质的trichohyalin(ae15)进行qrt-pcr、免疫荧光和westernblot检测其分子表达水平,综合分析hfscs诱导后的毛干分化情况;
(6)毛囊上皮-间质相互作用(emis)机制分析:结合毛囊形态发生及发育过程中emis所介导的经典wnt/β-catenin信号通路,对筛选出的最佳微环境模型给予wnt信号通路的激动剂和阻断剂处理,观察信号通路上调或下调后对emis微环境模型的影响及其机制;
综合分析毛囊emis微环境内细胞-细胞相互作用的分子机制。
进一步,步骤四中,人毛囊emis微环境模型的体内生物学验证:
基于微环境模型所构建的毛囊类器官,将其移植于裸鼠进行体内的毛囊诱导重建,检测其是否具备可移植性和功能性,同时评价移植后的毛囊诱导重建及生长发育情况;
(1)实验步骤:采用显微移植技术进行毛囊类器官组织的裸鼠体内移植,移植3-4周后取材检测;
(2)检测内容:
1)组织学:取材行h&e、brdu/tunel等免疫组化染色,观察毛囊及毛干的诱导情况、重建率、细胞增殖情况和毛囊组织结构的完整性等指标;
2)毛囊及毛干形态结构:sem检测重建出的毛囊及毛干的微观形态结构;
3)毛干性质:对毛发结构标记物如内根鞘的keratin5、外根鞘的keratin71和毛干皮质的trichohyalin(ae15)进行免疫组化染色,明确毛干的组成性质;
4)毛发周期:通过拔毛实验观察毛囊生长周期情况,绘制周期-时间曲线;
5)毛囊细胞排列分布:三维共培养时预先对hdpcs与hfscs进行活细胞染色,通过免疫荧光示踪并观察移植后重建毛囊内两种细胞成分的空间分布排列及生长情况。
综上所述,本发明的优点及积极效果为:
将具备较强毛发诱导能力的hdpcs仿生微组织和能在dpcs诱导下分化为毛干结构的fscs共同进行三维共培养,模拟体内正常毛囊形态发生及发育过程中上皮-间质的相互作用(emis)。
附图说明
图1是本发明实施例提供的毛囊emis微环境模型的构建方法流程图。
图2是本发明实施例提供的“单纯混合型”仿生微组织混合体模型图。
图3是本发明实施例提供的“紧密接触型”仿生微组织混合体模型图。
图4是本发明实施例提供的“核心包绕型”仿生微组织混合体模型图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细说明;
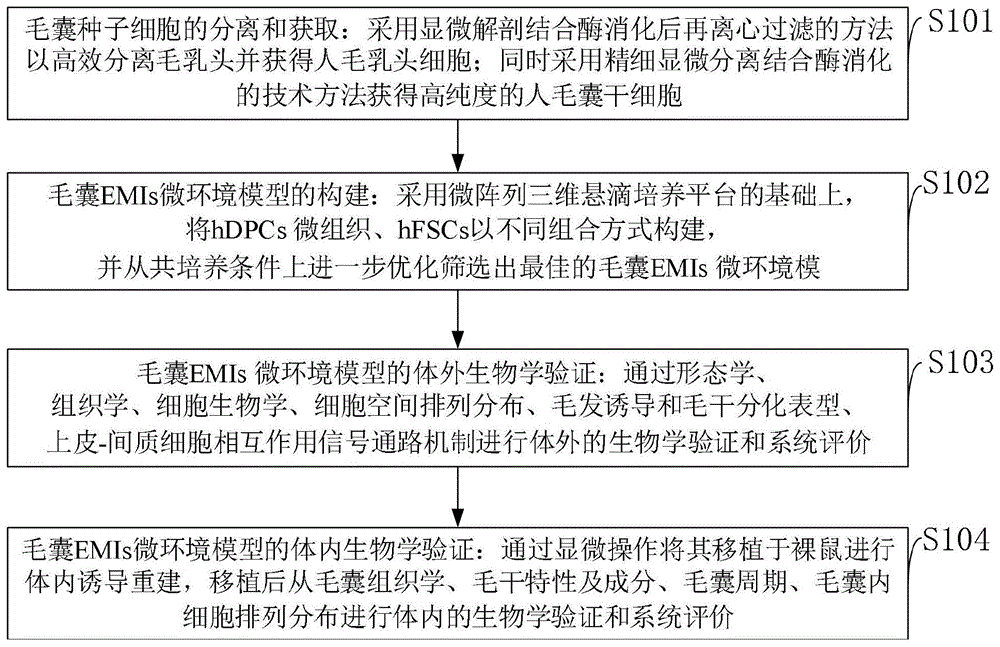
如图1所示,本发明实施例提供的毛囊emis微环境模型的构建方法,具体包括以下步骤:
s101:毛囊种子细胞的分离和获取:采用显微解剖结合酶消化后再离心过滤的方法以高效分离毛乳头并获得人毛乳头细胞(hdpcs);同时采用精细显微分离结合酶消化的技术方法获得高纯度的人毛囊干细胞(hfscs);
s102:毛囊emis微环境模型的构建:采用微阵列三维悬滴培养平台的基础上,将hdpcs微组织、hfscs以不同组合方式构建,并从共培养条件上进一步优化筛选出最佳的毛囊emis微环境模;
s103:毛囊emis微环境模型的体外生物学验证:通过形态学、组织学、细胞生物学、细胞空间排列分布、毛发诱导和毛干分化表型、上皮-间质细胞相互作用信号通路机制进行体外的生物学验证和系统评价;
s104:毛囊emis微环境模型的体内生物学验证:通过显微操作将其移植于裸鼠进行体内诱导重建,移植后从毛囊组织学、毛干特性及成分、毛囊周期、毛囊内细胞排列分布进行体内的生物学验证和系统评价。
步骤s101中,本发明实施例提供的hdpcs的分离和培养:
取行面部除皱、毛发移植或头皮软组织扩张术患者术中多余的头皮毛囊组织标本,采用显微解剖结合酶消化过滤的方法进行人头皮毛囊毛乳头组织的分离,将获取的人毛乳头(hdps)采用常规的二维原代培养进行短期的体外扩增获得人毛乳头细胞(hdpcs)。
步骤s101中,本发明实施例提供的hfscs的分离和培养:
取面部除皱、毛发移植或头皮软组织扩张术患者术中多余的头皮毛囊组织样本,采用显微分离结合酶纯化的方法挑选毛囊上皮隆突区(bulge区)组织进行人毛囊上皮来源干细胞(hfscs)的原代培养,对获得的细胞进行常规的体外扩增和细胞鉴定。
步骤s102中,本发明实施例提供的人毛囊emis微环境模型的构建:通过96孔微阵列三维悬滴培养平台,以高通量的培养方式构建不同组合类型的仿生三维共培养体系:
(1)模型1:将hdpcs与hfscs按一定比例预混合后接种至悬滴板内进行三维共培养,培养一定时间,形成“单纯混合型”仿生微组织混合体(hdpcs-hfscsmixedmicrotissues),见图2;
(2)模型2:分别将hdpcs和hfscs通过三维悬滴培养同时构建成仿生微组织,然后按一定比例接种至悬滴板内以均匀混合两种微组织,共培养一定时间,形成“紧密接触型”仿生微组织混合体(hdpcs-hfscscloselycontactedmicrotissues),见图3;
(3)模型3:先将hdpcs通过三维悬滴培养构建成仿生微组织后,再加入一定比例的hfscs,共培养一定时间,形成内层为hdpcs仿生微组织、外层为hfscs包裹的“核心包绕型”仿生微组织混合体(hdpcs-hfscscore-shellstructuredmicrotissues),见图4;
(4)模型的优化:主要从以下几个方面对培养条件进行优化和筛选:
①hdpcs与hfscs的接种数量:将hdpcs和hfscs的接种密度设置为0.25×104/孔、0.5×104/孔、1×104/孔、2×104/孔;
②hdpcs与hfscs接种的相互比例:根据细胞接种的数量,将hdpcs与hfscs接种数量间的相互比例设置为1:1、1:2、1:4分别进行共培养;
③混合培养基的相互配比:将间充质干细胞培养基(msc-m)与上皮细胞培养基(k-sfm)通过1:1、1:2、1:4的不同配比制成混合条件培养基,将共培养的换液时间设置为每天或每2天换液1次;
综合以上几方面指标,筛选出最适宜的共培养条件和模型,进行后续的体外检测及体内动物实验。
步骤s103中,本发明实施例提供的毛囊emis微环境模型的体外生物学验证:
(1)形态学:
1)细胞接种培养后,分别选取特定时间点于倒置相差显微镜下观察实验各组模型中毛囊三维细胞的生长形态及毛囊类器官的构建情况;
2)对构建的毛囊类器官取材进行扫描电镜(sem)和透射电镜(tem)检查,进一步观察其微观结构;
(2)组织学:
1)采用h&e染色观察构建的模型中毛囊类器官结构的完整性、其内细胞的形态和分布情况;步骤如下:
①毛囊类器官培养物的收集取材:细胞培养一段时间后,采用200μl的加样器枪头轻轻吸出培养孔中的培养基,并用pbs冲洗3次,之后采用显微镊或微量药勺小心从孔板内取出带有毛囊类器官的胶体,或采用细胞回收液作用、离心后收集;
②制作毛囊类器官的冰冻切片:将收集到的毛囊类器官结构以oct方式包埋,用恒冷箱切片机切片(片厚10μm),将冰冻切片贴于载玻片后采用冷丙酮固定,然后行常规h&e或免疫荧光染色;
③冰冻切片的h&e或免疫荧光染色:染色过程按标准流程进行;
④正置显微镜下观察结果。
2)采用碱性磷酸酶(alp)免疫组化染色观察所构建的毛囊类器官内hdpcs毛发诱导标记物alp的表达情况,按试剂盒说明书进行操作。
(3)细胞生物学:
1)细胞活性:采用live/dead检测毛囊类器官内的细胞存活情况,依照live/dead试剂盒说明书进行染色操作,于倒置荧光显微镜下观察结果;
2)细胞增殖:采用brdu染色检测毛囊类器官培养物内的细胞增殖情况。依照brdu的说明书进行操作,步骤如下:
①毛囊类器官组织标本的收集、冰冻切片制作:方法同前,将获取的毛囊组织冰冻切片采用丙酮于-20℃下固定10min,pbs冲洗2次,取与二抗同源的10%血清封闭20min;
②免疫荧光染色:滴加brdu一抗(兔抗人)至切片,4℃过夜;滴加二抗(羊抗兔,fitc标记),37℃45min,pbs冲洗2次,dab显色;
③正置荧光显微镜下观察切片内brdu表达阳性的细胞数量;
3)细胞凋亡:采用tunel法检测细胞凋亡情况;步骤如下:
①标本的收集、冰冻切片的制作:方法同前,过程略;
②依照tunel试剂盒中的产品说明书进行操作,过程略;
③正置荧光显微镜下观察切片内tunel表达阳性的细胞量;
(4)细胞排列分布:分别采用dio和cm-dil活细胞染色标记hdpcs和hfscs,依照所筛选出的最佳条件进行培养,选择接种共培养后0h、1d、4d、7d和14d的时间点,于倒置荧光显微镜下观察构建的培养模型中两种细胞的生长及排列分布情况;
(5)毛发诱导和毛发分化表型分析:采用qrt-pcr、westernblot和免疫荧光检测构建的毛囊类器官内hdpcs的毛发诱导表型和hfscs的毛干分化情况;步骤如下:
1)选取dpcs毛发诱导标记物alp、β-catenin、wnt10b进行qrt-pcr检测;通过免疫荧光和westernblot来验证上述毛发诱导表型标记物的蛋白表达,综合分析hdpcs毛发诱导能力的变化情况;
2)选取hfscs毛干分化标记物keratin5、内根鞘的keratin71和毛皮质的trichohyalin(ae15)进行qrt-pcr、免疫荧光和westernblot检测其分子表达水平,综合分析hfscs诱导后的毛干分化情况;
(6)毛囊上皮-间质相互作用(emis)机制分析:结合毛囊形态发生及发育过程中emis所介导的经典wnt/β-catenin信号通路,对筛选出的最佳微环境模型给予wnt信号通路的激动剂和阻断剂处理,观察信号通路上调或下调后对emis微环境模型的影响及其机制;
综合分析毛囊emis微环境内细胞-细胞相互作用的分子机制。
步骤s104中,本发明实施例提供的人毛囊emis微环境模型的体内生物学验证:基于微环境模型所构建的毛囊类器官,将其移植于裸鼠进行体内的毛囊诱导重建,检测其是否具备可移植性和功能性,同时评价移植后的毛囊诱导重建及生长发育情况;
(1)实验步骤:采用显微移植技术进行毛囊类器官组织的裸鼠体内移植,移植3-4周后取材检测;
(2)检测内容:
1)组织学:取材行h&e、brdu/tunel等免疫组化染色,观察毛囊及毛干的诱导情况、重建率、细胞增殖情况和毛囊组织结构的完整性等指标;
2)毛囊及毛干形态结构:sem检测重建出的毛囊及毛干的微观形态结构;
3)毛干性质:对毛发结构标记物如内根鞘的keratin5、外根鞘的keratin71和毛干皮质的trichohyalin(ae15)进行免疫组化染色,明确毛干的组成性质;
4)毛发周期:通过拔毛实验观察毛囊生长周期情况,绘制周期-时间曲线;
5)毛囊细胞排列分布:三维共培养时预先对hdpcs与hfscs进行活细胞染色,通过免疫荧光示踪并观察移植后重建毛囊内两种细胞成分的空间分布排列及生长情况。
证明部分(具体实施例/实验/仿真/药理学分析/能够证明本发明创造性的正面实验数据、证据材料、鉴定报告、商业数据、研发证据、商业合作证据等)
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!