一种检测粘度的荧光探针及其制备方法和应用与流程
本发明属于分析化学技术领域,具体涉及一种检测粘度的荧光探针及其应用。
背景技术:
脂质滴(lipiddroplets,lds)是为所有生物体储存脂质的细胞器。它们包含一层围绕中性脂质核心的两性脂质。lds参与了许多生物过程,如能量储存和调节、脂肪酸转运和脂质信号分子控制。因此,在细胞水平上监测lds对发展荧光团具有重要意义。
在水性细胞胞质溶胶中,lds是油-水乳剂的分散相,储存甘油三酯、甾醇酯和视黄酯。lds的粘度不同于胞质溶胶的粘度。因此,在生理条件下,构建荧光探针来检测lds的粘度变化具有重要的意义。一个理想的测量粘度的荧光探针应该包含两个单位。一种是荧光团,它负责反馈由于粘度变化引起的荧光变化;另一种是分子转子,它是能够旋转的粘度敏感部分。这种分子转子通常包含一个共轭域,可以在非粘性或低粘度溶液中自由旋转,使电子激发态染料的弛豫过程通过非辐射跃迁的形式进行,导致荧光的明显猝灭或荧光寿命的缩短。随着溶液的粘度增加,旋转过程受粘度环境抑制,从而降低了非辐射途径的可能性,导致荧光强度的增加或荧光寿命的显著延长。因此,这种带有荧光团和转子的探针应可用于检测粘度。
到目前为止,文献中很少报道用于监测lds的粘度的探针。然而,所报道的探针具有相对较短的吸收和发射波长,这可能会对细胞造成损害,也可能受到生物成像中背景荧光的影响。近红外荧光团的荧光发射波长在650-900纳米范围内,具有良好的组织穿透能力,对生物样品的光损伤最小,自荧光低的优点。然而,近红外荧光探针检测lds的粘度还没有报道。因此,需要设计荧光探针来监测具有近红外发射的lds的粘度变化。
技术实现要素:
针对目前缺乏能够进行深层次穿透的近红外荧光探针的问题,本发明提供一种检测近红外发射的粘度荧光探针,穿透层次深,能够用于细胞和生物体中检测粘度变化。
本发明的另一目的是提供一种上述荧光探针在检测溶液中或生物细胞内粘度变化的应用。
为实现上述目的,本发明采用如下技术方案。
一种检测粘度的荧光探针,化学名称为2-(苯并[d]噻唑-2-基)-3-(11-氧代-2,3,6,7-四氢-1h,5h,11h-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-10-基)丙烯腈,简称hy,其化学结构式如式(i)所示:
式(i)。
上述荧光探针的制备方法,包括以下步骤:
(1)在n2保护下,dmf与pocl3室温搅拌得到混合液,将化合物1的dmf溶液滴加到混合液中,室温下搅拌,再加热反应,反应液分离纯化获得化合物2:
(2)荧光探针(hy)的制备:氮气保护下,将化合物2与2-苯并噻唑乙腈在哌啶存在下于无水乙醇中加热反应,分离提纯得探针纯品:
步骤(1)中,所述化合物1、dmf和pocl3的物质的量比为1:6.5:20.5
步骤(1)中,所述加热温度为60℃。
步骤(1)中,所述加热反应时间为12h。
步骤(1)中,所述分离纯化步骤为:反应结束后,将混合物缓慢滴加到冰水中,然后利用20%naoh溶液调节ph值到中性以产生沉淀。抽滤后得到滤饼,在无水乙醇中重结晶,得纯品化合物2。
步骤(2)中,所述化合物2和2-苯并噻唑乙腈的物质的量比为1:1。
步骤(2)中,所述加热温度为78℃。
步骤(2)中,所述加热反应时间为6h。
步骤(2)中,所述分离纯化步骤为:反应结束之后,真空除溶剂,得粗产品,然后使用柱层析(洗脱剂:二氯甲烷:甲醇=10:1)对粗产品进行纯化,得荧光探针。
反应式如下:
一种上述荧光探针在检测溶液、细胞或生物体中粘度的应用。
本发明的机理如下:
本发明提供了一类用于检测粘度荧光探针的探针,由于探针中“苯并噻唑”部分与“久洛尼定”部分通过单键相连,所以在低粘度的情况下,苯并噻唑可以通过单键自由旋转,使整个探针分子不共平面,探针几乎没有荧光,即荧光处于“关闭”状态;当在粘度比较大的体系中时,由于苯并噻唑的自由旋转受到限制,使得整个探针分子共平面,探针就会发出很强的荧光,即荧光开关被打开。所以,通过这种“开关型”荧光探针可以检测不同的粘度。
本发明具有以下优点:
本发明所提供的区分不同粘度的荧光探针,具有较高的灵敏度,良好的光学稳定性以及对粘度特异性响应。该探针的发射光谱在近红外区域,实现了在细胞内和炎症小鼠粘度的检测,对细胞和组织光损伤小、穿透层次深。同时,本发明提供了该探针的合成方法,步骤简单、纯化方便、收率高。
附图说明
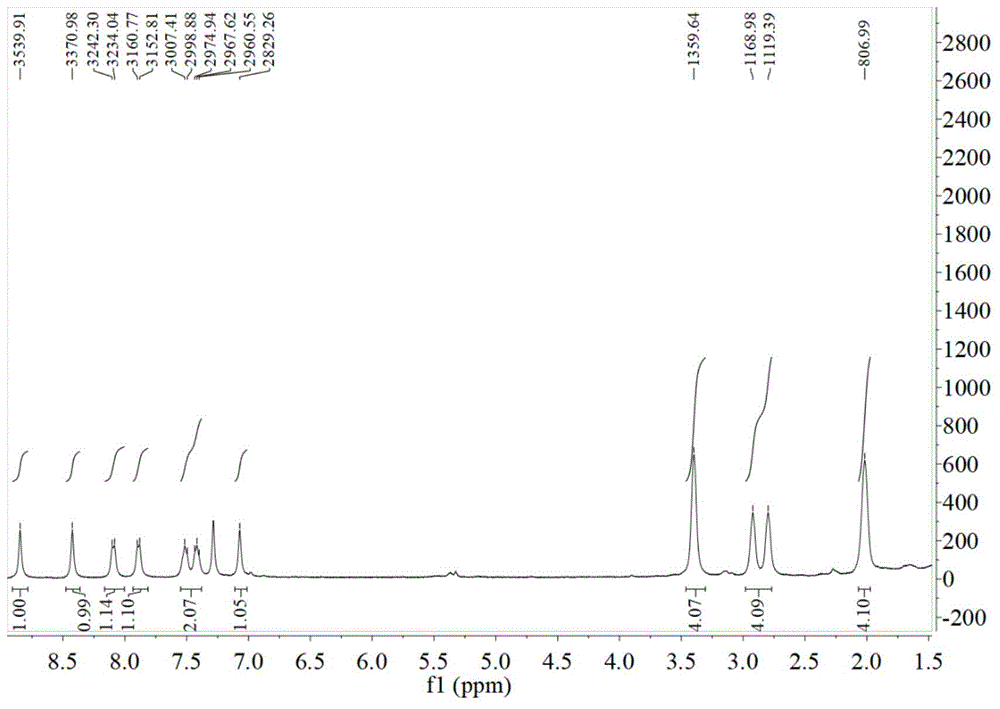
图1是探针的1hnmr谱;
图2是探针的13cnmr谱;
图3是探针在不同粘度体系中的发射光谱;
图4是是荧光探针对不同物质的选择性图谱;
图5是探针的细胞成像应用;
图6是探针在炎症小鼠体内的成像应用。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
实施例1荧光探针的合成
(1)化合物11-氧代-2,3,6,7-四氢-1h,5h,11h-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-10-丙醛(2)的合成:
在25ml圆底烧瓶中,将新蒸馏的dmf(2.0ml)滴加到pocl3(2.0ml)中,并在n2保护下搅拌30分钟得到混合液。然后将中间(1)1mmol溶解于10mldmf后滴加到混合液中,室温下反应30分钟,升温至60℃继续反应12小时。反应结束后,将混合物缓慢滴加到冰水(100ml)中,然后利用20%naoh溶液调节ph值到7以产生沉淀。抽滤后得到滤饼,在无水乙醇中重结晶,得纯品中间体(2),产率85%;
(2)化合物hy:2-(苯并[d]噻唑-2-基)-3-(11-氧代-2,3,6,7-四氢-1h,5h,11h-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-10-基)丙烯腈的合成:
化合物11-氧代-2,3,6,7-四氢-1h,5h,11h-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-10-丙醛(2)1mmol与2-苯并噻唑乙腈(3)1mmol在哌啶(0.5ml)存在下于无水乙醇(10ml)中加热78℃回流,6小时后停止反应,冷却至室温,减压过滤,滤饼用冰乙醇洗涤2-3次,真空干燥,残渣通过柱层析分离,淋洗剂为二氯甲烷/甲醇(v/v=10:1),得到化合物2-(苯并[d]噻唑-2-基)-3-(11-氧代-2,3,6,7-四氢-1h,5h,11h-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-10-基)丙烯腈(hy),产率:52%。产物的1hnmr和13cnmr谱图如图1和图2所示。
1hnmr(400mhz,cdcl3)δ8.85(s,1h),8.42(s,1h),8.09(d,j=8.3hz,1h),7.89(d,j=8.0hz,1h),7.55(m,2h),7.07(s,1h),3.40(s,4h),2.86(d,j=49.6hz,4h),2.02(s,4h).
13cnmr(101mhz,cdcl3)δ161.57,153.78,152.45,148.87,142.66,140.84,134.68,127.69,126.63,125.65,123.53,121.44,119.90,117.18,110.75,108.79,106.31,102.14,50.49,50.06,29.70,27.35,21.12,20.14,19.97。
实施例2荧光探针在不同粘度体系中的荧光光谱
配制浓度为1mm实施例1所得荧光探针的二甲基亚砜(dmso)的测试母液待用。测试液中,分别取3ml不同比例甘油与甲醇的溶剂(甘油:甲醇=0:10,1:9,2:8,3:7,4:6,5:5,6:4,7:3,8:2,9:1,10:0),然后加入探针母液(终浓度为10μm),进行荧光扫描(激发波长540nm,检测波段550-750nm),测得各体系中相对荧光强度,如图3所示。由图3可知,随着溶剂粘度的增加,相对荧光强度变强。
实施例3荧光探针对不同离子的选择性
配制浓度为1mm实施例1所得荧光探针的二甲基亚砜(dmso)的测试母液待用。预先准备13份5ml的5μm荧光探针pbs溶液(含5%甲醇,ph7.45),然后分别向所述12份体系中依次加入50μl浓度为100μm的干扰物质的pbs溶液,另一份加入甘油。进行荧光检测(λex=540nm);结果见图4,其中,1-13分别为甘油、过氧化氢、次氯酸钠、一氧化氮、羟基自由基、过氧化二叔丁基、过氧化二叔丁醇、谷胱甘肽、维生素c、硝酸钠、cys、hcy和gsh。由图4可知,相对于这些离子,探针的荧光光谱主要受粘度的影响。
实施例4荧光探针在活细胞中的成像应用
配制浓度为1mm实施例1所得荧光探针的二甲基亚砜(dmso)的测试母液待用。将适当密度的hela细胞接种到灭菌的35mm成像培养皿中,在co2培养箱(温度为37℃,5%co2)中培养,待细胞贴壁后,第一组加入10μm粘度荧光探针hy孵育半小时后进行生物成像(激发波长:561nm,发射波长:570-620nm);第二组先加入10μm粘度刺激物莫能菌素(monensin),40分钟后再加入10μm粘度荧光探针hy,孵育半小时后进行生物成像;第三组先加入10μm粘度刺激物制霉菌素(nystatin),40分钟后加入10μm粘度荧光探针hy,孵育半小时后进行生物成像;成像结果如图5所示。通过分析比较可以看出无论在单光子还是在双光子条件下,在只有探针的情况下细胞只发微弱的光;在加有探针以及粘度刺激物(莫能菌素,制霉菌素)的情况下细胞发出强烈的红光。因此不同粘度的细胞可以通过本发明合成的探针进行细胞成像来区分。
实施例5荧光探针在小鼠体内成像
配制浓度为1mm实施例1所得荧光探针的二甲基亚砜(dmso)的测试母液待用。
炎症是由激活的炎性细胞或免疫细胞介导的一个多重级联过程,炎症通常可诱导产生粘液,可能增加生物系统的粘度。用小鼠腹腔注射脂多糖(lps)构建炎症小鼠模型,用于检测炎症小鼠的粘度变化。4周大的balb/c雌性小鼠被用于体内成像的粘度变化。通过使用perkinelemerivisluminaiii系统,带540纳米激发滤波器以及640纳米的发射滤波器。我们进行两组实验。用健康小鼠作为对照组,向小鼠腹腔中注射探针(10μm)后进行成像得到图6a;另外一组健康小鼠,先向其腹腔注射lps(100μl1mg/ml),经过24小时,小鼠出现发炎症状后,再向其腹腔中注射探针(10μm)进行成像。如图6所示,健康小鼠基本上没有荧光变化。相比之下,炎症小鼠表现出很强的荧光发射,显示探针hy可以检测炎症小鼠的粘度变化。
- 还没有人留言评论。精彩留言会获得点赞!