一种豆渣和纳豆芽孢杆菌混合发酵产酶的方法与流程
本发明属微生物发酵
技术领域:
,具体涉及一种豆渣和纳豆芽孢杆菌混合发酵产酶的方法。
背景技术:
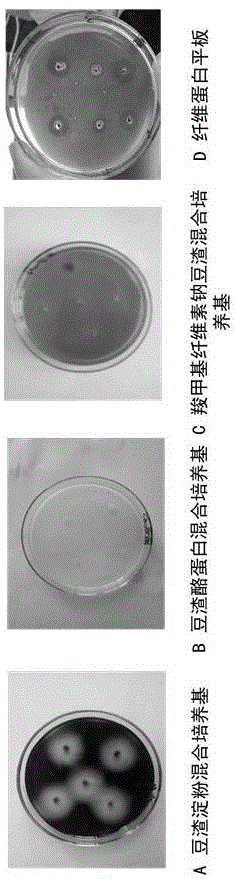
:随着我国农业加工业的快速发展,农副产物也随之大量产生。据悉中国每年大豆总产量约为1400~1500万吨,其所产湿豆渣约为5000多万吨。由于其含水量大,可溶性差且口感粗糙,大部分豆渣都被遗弃或用作动物饲料。但豆渣中仍含有大量的营养物质如碳水化合物、蛋白质、纤维素等。面对严重的资源浪费问题,越来越多的学者开始对豆渣的改性进行研究。其中包括物理方法(低温超微粉碎、超临界萃取等)、化学方法(酸碱法、离子液体法)和生物方法(酶解法、发酵法)。其中微生物发酵方法优点众多,其既可以避免化学方法带来的副作用又可以比物理方法更节约成本。微生物发酵除了在豆渣的营养特性和物理性质上会有一些改变外,还能够生产高附加值产品。纳豆芽孢杆菌(bacillusnatto),属于枯草芽孢杆菌的一个亚种,属于革兰氏阳性杆菌,在其生长过程中可能够分解大分子物质,同时可产生多种营养和活性成分以及分泌多种胞外酶,如纳豆激酶,淀粉酶等。纳豆激酶是一种具有溶栓性的丝氨酸蛋白酶,其包含275个氨基酸、分子量大概在27.3~35.0kda、等电点8.6、在ph5.5~9.0具有较好的稳定性。相对于医学上尿激酶、链激酶等药剂,其具有生产成本低、安全性高的优势。纳豆激酶具有安全性高、成本低、生产工艺简单、口服有效期和体内半衰期长等特点,是非常有前景的新一代溶栓性药物。目前,纳豆激酶的生产主要还是通过对大豆的发酵,但近几年越来越多的学者采用不同底物进行发酵生产纳豆激酶,如木豆、红豆、鹰嘴豆、蚕豆等也可作为培养基生产纳豆激酶。同时农副产物用于生产纳豆激酶提高其附加值的研究也越来越广泛,尤其是粮食与油脂副产物作为培养基应用最为广泛。纳豆激酶的开发主要问题集中于菌种筛选、发酵培养基及条件的优化、基因工程改良和提取纯化等四个方面。纳豆激酶的生产主要是通过固态发酵,但由于液态发酵低成本及简便性也越来越多的被应用。在提高酶活性方面,主要是有选择发酵底物和发酵条件的优化两种方法。α-淀粉酶来源十分广泛,可源于动物、植物、微生物。虽然其来源不同,但其主要作用都是分解淀粉、多糖或糖原的内部的α-1,4糖苷键,最终产生麦芽糖、葡萄糖、短链糊精等低分子糖。由于其在分解过程中淀粉的粘度会急剧下降,因此也被称为液化酶。目前,α-淀粉酶制剂制备最为简单有效的方法就是通过微生物发酵的方法来生产,发酵的方法包括深层发酵和固态发酵。其主要发酵菌种包括两类,一类是枯草杆菌(bacilussubtilis),另一类是霉菌如黄曲霉(aspergillustamari)、黑曲霉(aspergillusniger)等。技术实现要素:本发明目的是提供一种豆渣和纳豆芽孢杆菌混合发酵产酶的方法。一种豆渣和纳豆芽孢杆菌混合发酵产酶的方法,它包括:1)接种:将活化的纳豆芽孢杆菌,按接种量3~10%接种到豆渣培养基中;2)发酵:在36~38℃、摇床转速150~200rpm下发酵30~40小时,得粗酶液;3)分离纯化:盐析初步纯化,再用柱层析二次纯化;4)干燥;步骤1)所述的豆渣培养基是重量比为1:3~6的豆渣和水混合,灭菌;步骤1)所述的接种量为9%;步骤1)所述的活化,是纳豆芽孢杆菌菌液按照3%的接种量接入配制好的lb培养基中,在37℃下、以120rpm摇床培养12h后,将培养基于9500rpm/min的高速冷冻离心机中离心10min,制得菌泥,并用无菌水来重新溶解,调整菌液浓度在107cfu/ml;步骤2)所述的发酵,在37℃、摇床转速170rpm下发酵36h;步骤3)所述的盐析,用70%硫酸铵盐析;所述的柱层析,用葡聚糖凝胶柱层析;步骤4)所述的干燥为喷雾干燥。本发明提供了一种豆渣和纳豆芽孢杆菌混合发酵产酶的方法,它包括:1)接种:将活化的纳豆芽孢杆菌,按接种量3~10%接种到豆渣培养基中;2)发酵:在36~38℃、摇床转速150~200rpm下发酵30~40小时,得粗酶液;3)分离纯化:盐析初步纯化,再用柱层析二次纯化;4)干燥;本发明提高了豆渣的利用率,同时液态发酵也更方便于实际工业生产,其纯化分离步骤简单;发酵后的纳豆激酶粗酶液酶活可达到189.3iu/mg,α-淀粉酶酶活可达到7.8u/mg;经过电泳试验验证纳豆激酶分子质量为29kda,其纯化倍数可达到8.97倍,比酶活达到1663.9iu/mg;α-淀粉酶的分子质量63kda,其纯化倍数达到5.12倍,比酶活达到39.93u/mg。附图说明图1产酶种类鉴定结果;图2不同培养基在不同时间段纳豆芽孢杆菌活菌数及酶活力的变化结果;图3不同培养基产酶趋势的sds-page验证试验结果;图4发酵时间对纳豆激酶和α-淀粉酶酶活性的影响;图5接种量对纳豆激酶和α-淀粉酶酶活性的影响;图6固液比对纳豆激酶和α-淀粉酶酶活性的影响;图7摇床转速对纳豆激酶和α-淀粉酶酶活性的影响;图8发酵温度对纳豆激酶和α-淀粉酶酶活性的影响;图9不同浓度硫酸铵对纳豆激酶和α-淀粉酶酶活性的影响;图10sephadexg-200凝胶层析图谱;图11sds-page和native-page的分析结果。具体实施方式实施例1培养基的制备1、豆渣淀粉混合培养基:可溶性淀粉2g,琼脂粉8g,豆渣10g,去离子水1000ml,ph7.0~7.2,121℃灭菌20min;2、豆渣酪蛋白混合培养基:琼脂粉20g,干酪素3g,豆渣10g,去离子水1000ml,ph7.0~7.2,121℃灭菌20min;3、羧甲基纤维素钠豆渣混合培养基:羧甲基纤维素钠10g,琼脂粉8g,豆渣10g,去离子水1000ml,ph7.0~7.2,121℃灭菌20min;4、玉米豆粕培养基:玉米粉80g,豆粕40g,磷酸氢二钠8g,硫酸铵4g,氯化钙2g,氯化铵1.5g,去离子水1000ml,ph7.0-7.2,121℃灭菌20min;5、lb培养基:牛肉膏3g,蛋白胨10g,氯化钠5g,葡萄糖10g,去离子水1000ml,ph7.2~7.4,121℃灭菌20min。实施例2菌种的活化将实验室保藏的纳豆芽孢杆菌菌液按照3%的接种量接入配制好的lb培养基中进行活化,其经过在预设温度37℃的摇床中以120rpm培养12h后,将培养基于9500rpm/min的高速冷冻离心机中离心10min,制得菌泥,并用无菌水来重新溶解,调整菌液浓度在107cfu/ml作为发酵剂。实施例3纳豆芽孢杆菌发酵豆渣产酶鉴定参照孙妍等《产蛋白酶和纤维素酶纳豆芽孢杆菌益生菌株的筛选及其生长特性研究》的方法,对纳豆芽孢杆菌发酵豆渣产酶进行鉴定;首先将活化后的纳豆芽孢杆菌菌悬液分别接种在打好孔的豆渣淀粉混合培养基平板,豆渣酪蛋白混合培养基平板,纤维素钠豆渣混合培养基平板中,然后将其放置在37℃恒温培养箱中培养24h;然后将豆渣淀粉混合培养基用碘液进行媒染,若培养基中圆孔周围未变蓝,则说明豆渣可促进该纳豆芽孢杆菌产生α-淀粉酶将淀粉分解;将豆渣酪蛋白混合培养基用福林酚试剂进行媒染,若培养基上出现透明圈,则证明豆渣可促进纳豆芽孢杆菌产生蛋白酶活性将蛋白分解;将羧甲基纤维素钠豆渣混合培养基先用0.2%的刚果红染色30min,再用蒸馏水和1mol/l的nacl依次洗去染液,用5%(v/v)的醋酸进行固定,若出现透明圈说明在纳豆芽孢杆菌在培养过程中分泌纤维素酶;根据纤维蛋白平板法来确定豆渣培养基发酵是否产生纳豆激酶;结果见图1;由图1可以清晰的看出:豆渣淀粉混合培养基和纤维蛋白平板上产生了明显的溶解圈,说明淀粉与纤维蛋白被酶分解;而豆渣酪蛋白混合培养基和羧甲基纤维素钠豆渣混合培养基上未见明显变化,说明酶液无法分解蛋白和纤维素;综上可知纳豆芽孢杆菌以豆渣为底物发酵主要产α-淀粉酶和纳豆激酶两种酶。实施例4酶活性的测定1、纳豆激酶的酶活性的测定纤维蛋白平板法来进行改良并测定纳豆激酶活性;取20ml的预先配制并在50℃保温的含有2%琼脂的生理盐水,向其中加入2ml的ph7.4的磷酸盐缓冲液配制而成的7.5mg/ml的纤维蛋白原,稍后200μl的250u/ml的凝血酶,静置待其凝固,在凝固平板上打孔,向内打入10μl酶液,并在37℃培养箱培养18h后进行直径的测量。将尿激酶标准品的酶活力在50~350iu之间按照等梯度稀释,然后将其打入纤维蛋白平板培养,最终以溶解圈直径大小为纵坐标与其所对应的酶活力单位为横坐标建立线性回归关系,得到线性关系良好的回归方程y=0.0023x+0.8207,r2=0.996。本文中纳豆芽孢杆菌发酵豆渣后所得酶液活力即可通过将纤维蛋白平板上所产生的溶解圈直径代入线性回归方程得到。其酶蛋白含量通过bca(bicinchoninicacid)试剂盒来测定。2、α-淀粉酶的酶活性的测定参考国标gb1886.174-2016来进行改良并测定α-淀粉酶的酶活性;(1)所用试剂的配制:2%的可溶性淀粉:取2g的可溶性淀粉加于100ml蒸馏水中,在沸水浴中搅拌溶解至澄清状态。磷酸缓冲液(ph6.0):称取45.23g磷酸氢二钠和8.07g柠檬酸用水溶解并稀释至1000ml并调节其ph值。原碘液:称取1g碘和22g碘化钾,用少量蒸馏水溶解并定容到500ml容量瓶中,然后贮存在棕色瓶中。稀碘液:吸取2ml原碘液加入20g碘化钾,用蒸馏水溶解并定容到500ml容量瓶中,然后贮存在棕色瓶中。盐酸溶液[c(hcl)=0.1mol/l]:按gb/t601配制。以上所用试剂均购于北京化工厂且皆为分析纯。(2)酶活性的测定方法:用移液枪吸取1280μl的2%可溶性淀粉溶液,向其中加入320μl的ph6.0的磷酸盐缓冲液在40℃水浴锅中预热8min达到反应最适ph和温度,然后加入1000μl的酶液在40℃水浴锅中继续反应30min,反应后取1ml的反应液加入500μl的0.1mol/l的hcl终止反应,再向其加入5ml的稀碘液进行显色反应,用酶标仪在660nm处测定吸光值。同时以蒸馏水代替粗酶液重复如上步骤作为空白对照。其酶蛋白含量通过bca(bicinchoninicacid)试剂盒来测定。(3)α-淀粉酶的酶活性的定义:在上述反应条件下,每分钟2%可溶性淀粉的显蓝程度降低1%所需要酶液的量定义为淀粉酶一个活力单位。其计算公式如下:α-淀粉酶酶活性=(d0-d)×100×稀释倍数/(d0×30)式中,d0为空白值吸光度,d为样品吸光度,100为系数%,30为酶液与可溶性淀粉反应的时间。实施例5纳豆芽孢杆菌发酵不同培养基生产纳豆激酶和α-淀粉酶的对比1.纳豆芽孢杆菌在不同培养基中的菌落数及产酶活性对比将达到107cfu/ml活菌数的纳豆芽孢杆菌菌液以相同的接种量分别接入到干物质含量一致的豆渣培养基,玉米豆粕培养基,lb培养基中,并在相同温度,相同转速的摇床中培养,然后每隔12h分别取三种液体培养基离心取上清液进行及α-淀粉酶及纳豆激酶活力的测定,同时取部分上清液进行10倍梯度系列的稀释,选择2~3个合适梯度进行平板均匀的涂布,每个梯度进行三次平行试验并取平均值进行活菌落计数。如图2所示,三种培养基的活菌数均在发酵12~60h区间呈上升趋势,在60h后菌落数开始下降,此外豆渣培养基活菌数一直高于其他两种培养基,这说明豆渣培养基能较好的促进纳豆芽孢杆菌的生长。在产酶方面,可看出lb基础培养基均为产生纳豆激酶活性和α-淀粉酶活性,而其它两种培养基的产酶趋势基本一致。综合考虑,豆渣培养基的原料更为简单且成本较低。由此可知,用豆渣为底物发酵生产酶制剂是一种可行的方法。2.sds-page电泳验证性试验1)样品的预处理:将不同发酵时间段的三种培养基制得的粗酶液分别进行-80℃预冻,然后将其真空冷冻干燥,采用ph7.4的磷酸盐缓冲液进行重新溶解并控制其蛋白含量为2mg/ml;2)分离胶的制备:本试验所用电泳试剂均源自于北京鼎国昌盛生物技术有限责任公司所生产的sds-page凝胶配置试剂盒,其分离胶制胶浓度为10%(5ml凝胶体积配方:1.9ml的蒸馏水,1.7ml的30%丙烯酰胺混合液,1.3ml的1.5mol/ltris(ph8.8),0.05ml的10%sds,0.05ml的10%过硫酸铵,0.002ml的temed),将分离胶混匀后倒入电泳仪并采用20%的乙醇进行压实,等待约30min,凝胶充分聚合形成明显边界,将乙醇倒出;3)浓缩胶的制备:本实验采用浓缩胶的制胶浓度为5%(2ml凝胶体积配方:1.4ml的蒸馏水,0.33ml的30%丙烯酰胺混合液,0.25ml的1.0mol/ltris(ph6.8),0.02ml的10%sds,0.02ml的10%过硫酸铵,0.002ml的temed),将浓缩胶加至分离胶上端到玻璃板顶端,将梳子小心插入并保证梳子底部与玻璃板顶端平齐且两端无气泡,并在两端涂抹凡士林密封以保证无气体进入和制胶的均匀性;4)电泳上样及电泳跑样条件:将各样品与的5×sds-page上样缓冲液1:4混合均匀,在100℃水浴锅中煮沸5min以保证蛋白充分变性。在每个泳道进样10μl样品,将5×tris-甘氨酸电极缓冲液(15.1gtris,94g甘氨酸,5gsds充分溶解至1000ml蒸馏水中,调节ph至8.3,按照1:4稀释为1×tris-甘氨酸电泳缓冲液,并将上好样的凝胶上下浸泡在经电极缓冲液,在80v电压条件下跑约3-5h结束电泳;5)染色脱色:将凝胶完整取下用考马斯亮蓝r-250浸泡染色1h,稍后将100ml冰醋酸和50ml甲醇溶液混匀并以蒸馏水定容至1000ml制得脱色液,将浸染后的凝胶每隔40min进行1次脱色,待3次脱色完成后用凝胶成像仪成像,观察试验结果。如图3所示,lb培养基各个时间段均未有明显的条带,这与酶活的测定结果是一致的。豆渣培养基和玉米豆粕培养基的sds-page结果都显示在29kda和63kda有两条条带,根据初步3.2.1产酶趋势的结果可初步判定29kda为纳豆激酶的蛋白条带,63kda为α-淀粉酶的蛋白条带。此外豆渣培养基的条带较少,大大减少了分离纯化的难度。实施例6纳豆芽孢杆菌发酵豆渣生产纳豆激酶和α-淀粉酶的单因素试验将纳豆芽孢杆菌接种在豆渣培养基中进行液态发酵,分别考察了发酵时间、接种量、固液比、摇床转速、发酵温度五个因素对其产生的纳豆激酶和α-淀粉酶的酶活性的影响。经各单因素试验筛选后,为下一步响应面优化试验提供前期试验基础。一、发酵时间对纳豆激酶和α-淀粉酶酶活性的影响在灭菌后固液比1:5的豆渣培养基接种纳豆芽孢杆菌菌液8%(v/w),放入预设温度为37℃摇床中以120rpm分别培养12、24、36、48、60h,每组进行三组平行试验,然后将培养基以9000rpm/min离心10min取上清液测定α-淀粉酶和纳豆激酶的活性;由图4可知,纳豆激酶在24h后才开始出现纳豆激酶活力,在36h后开始有略微的下降;α-淀粉酶活力同样随着发酵时间的增加逐渐趋于平稳,这可能是因为随着时间的增加,营养物质的消耗越来越多,代谢产物不断的积累会对菌体的生长产生影响,最终导致酶的分泌逐渐趋于稳定。鉴于两种酶都在36h后出现酶活力下降趋势,36h作为后续的响应面优化中心点较为合理。二、接种量对纳豆激酶和α-淀粉酶酶活性的影响在灭菌后固液比为1:5的豆渣培养基中分别按2%、4%、6%、8%、10%的纳豆芽孢杆菌菌液的接种量进行接菌,放入预设温度为37℃摇床中以120rpm培养36h,每组进行三组平行试验,然后将培养基以9000rpm/min离心10min取上清液测定α-淀粉酶和纳豆激酶的活性;由图5可知,纳豆激酶和α-淀粉酶活力都先随着接种量的增加成正相关增长,而纳豆激酶和α-淀粉酶又分别在接种量6%和8%后出现明显下降趋势,这是由于随着接种量的加大,发酵越完全,菌体细胞分泌胞外酶活跃。而在菌体达到一定密度后营养物质代谢旺盛,氧气量也随着不足,不利于酶的合成,由于α-淀粉酶酶活力在接种量6%与接种量8%时酶活力相差较大,而纳豆激酶酶活力在接种量8%时略有降低但仍然很高,接种量8%为后续的响应面优化中心点较为合理。三、固液比对纳豆激酶和α-淀粉酶酶活性的影响分别按固液比为1:3、1:5、1:7、1:9、1:11配制豆渣培养基,并在灭菌后按菌液体积与豆渣质量比接种纳豆芽孢杆菌8%,放入预设温度37℃摇床中以120rpm培养36h,每组进行三组平行试验,然后将培养基以9000rpm/min离心10min取上清液测定α-淀粉酶和纳豆激酶的活性;由图6可知,纳豆激酶在固液比1:3至1:5区间酶活力较高,在之后酶活力显著下降,从工业成本角度来讲液态发酵更易操作,因此在固液比1:5时对纳豆激酶的制备较为合适;α-淀粉酶活力在固液比1:5之前较为平稳,而后期的活力增加和减少的不稳定性可能是由于纳豆激酶的产生及液体比例的变化导致ph的变化。从成本及两种酶活力趋势考虑来讲,后续试验皆采用固液比1:5进行发酵制酶。四、摇床转速对纳豆激酶和α-淀粉酶酶活性的影响在灭菌后固液比为1:5的豆渣培养基接种纳豆芽孢杆菌菌液8%(v/w),放入预设温度为37℃摇床中分别以100、120、140、160、180rpm培养36h,每组进行三组平行试验,然后将培养基以9000rpm/min离心10min取上清液测定α-淀粉酶和纳豆激酶的活性;纳豆芽孢杆菌是一种需氧菌,摇床转速与发酵氧气量相关,因此摇床转速对菌体的生长及酶的分泌有着很大的影响。由图7可知,纳豆激酶酶活性在摇床转速140~160rpm之间较为平稳,而在180rpm达到最大;α-淀粉酶活力在前期随着摇床转速提高而提高,直到180rpm时酶活力开始降低,这可能因为摇床转速提高导致温度升高不利于酶的合成。从需氧量及温度角度考虑,160rpm作为后续的响应面优化中心点较为合适。五、发酵温度对纳豆激酶和α-淀粉酶酶活性的影响在灭菌后固液比为1:5的豆渣培养基接种纳豆芽孢杆菌菌液8%(v/w),分别放入预设温度为35、36、37、38、39℃摇床中以120rpm培养36h,每组进行三组平行试验,然后将培养基以9000rpm/min离心10min取上清液测定α-淀粉酶和纳豆激酶的活性;由图8可知,纳豆激酶酶活性在发酵温度37℃时达到最高,α-淀粉酶酶活性在38℃时达到最高。但由于38℃时纳豆激酶酶活下降显著,而α-淀粉酶酶活性在37℃时与其最高酶活相差较小,37℃作为后续试验的发酵温度是一种节约成本且保证同时两种较高酶活的选择。实施例7纳豆芽孢杆菌发酵豆渣生产纳豆激酶和α-淀粉酶响应面优化试验根据单因素试验结果,选取了时间,转速,接种量三个主要因素进行box-behnken中心组合设计三因素三水平响应面分析试验,对纳豆芽孢杆菌液态发酵豆渣产α-淀粉酶活性,纳豆激酶活性的工艺进一步优化;结果见表1。表1box-behnken试验结果通过design-expert8.05.b软件进行回归分析,可得到二次回归模型的方差分析,二次多项式回归方程如下:y1=160.67-12.15*a+63.94*b+16.63*c-3.20*a*b+23.66*a*c+9.59*b*c-51.97*a2-27.68*b2-20.00*c2;y2=7.80+0.42*a+0.96*b-0.16*c-0.81*a*b-0.053*a*c-0.28*b*c-0.40*a2-2.47*b2+0.24*c2。式中y1为纳豆激酶活力,y2为α-淀粉酶活力纳豆激酶活力,a为发酵时间,b为摇床转速,c为接种量。由方差分析,我们可以分析得到两组模型的p值均小于0.01皆为极显著,失逆项p值均大于0.05皆为不显著说明两组建模成立,且r2值分别为0.9000和0.9288说明模型拟合度较好;由两表的回归模型的显著性分析可知,对于纳豆激酶活性而言摇床转速影响极显著,其次为接种量,然后为发酵时间。对于α-淀粉酶活性影响的因素中,摇床转速为显著,且各因素影响由强到弱依次为摇床转速,发酵时间,接种量。经过响应面优化试验可以得出最优条件为35.88h,摇床转速169.95rpm,接种量8.98%,此时纳豆激酶和α-淀粉酶的酶活力预测值分别为191.33u/mg和7.58u/mg。根据试验实际控制条件,将发酵时间调整为36h,摇床转速调整为170rpm,接种量调整为9%,在此条件下进行三次纳豆芽孢杆菌液态发酵豆渣平行试验。最终纳豆激酶酶活力为189.3±1.7iu/mg,α-淀粉酶酶活力为7.8±0.24u/mg与响应面预测值相符,说明该优化条件可应用到下步生产纯化之中。实施例8纳豆激酶和α-淀粉酶分离纯化1、不同浓度硫酸铵对纳豆激酶和α-淀粉酶酶活性的影响取20ml经最优发酵条件下生产的粗酶液,采用固体加入法向其中加入硫酸铵固体,在添加过程中要注意控制速度,并在4℃条件下磁力搅拌以期硫酸铵达到充分溶解饱和的效果。最终分别配制成饱和度为50%、60%、70%、80%和90%的硫酸铵溶液,并在4℃条件下静止一夜析出蛋白。然后在9500rpm条件下离心10min得到蛋白,将蛋白用ph7.4的磷酸盐缓冲液复溶至20ml并分别测定纳豆激酶和α-淀粉酶的酶活性,并将测定所得最大酶活性定义为100%,绘制盐析曲线。由图3-9可知,纳豆激酶在硫酸铵饱和度达到60%时,残余的相对酶活性最大。而α-淀粉酶在60~70%期间残余的相对酶活性有显著性的上升,其后的硫酸铵饱和度的残余相对酶活性也呈下降趋势。考虑到同一工艺过程中同时生产较高酶活性的纳豆激酶和α-淀粉酶便捷性,本试验采用了70%的硫酸铵浓度,这样既保证了α-淀粉酶的酶活性,又纳豆激酶的活性不会有显著性的影响。2、sephadexg-200柱层析(1)样品预处理:首先为了提高柱层析工作效率去除盐析后酶液中含有的大量的so42-离子,需将盐析后的酶液进行透析。将酶液加入事先处理好的透析袋(8000-12000分子量)中,将其放入蒸馏水中在4℃条件下透析。并每隔1h换次透析液,采用1%bacl2检测溶液中的so42-,直到无沉淀产生。将透析后的粗酶液进行聚乙二醇浓缩得到柱层析的上样液。(2)柱料的处理:将sephadexg-200柱料用沸水煮至1h,并放置蒸馏水充分溶胀,除去漂浮至上方的杂质及细小颗粒。然后取30.0cm×φ1.5cm的层析柱关闭其出水口并向其注入三分之一柱高的ph7.4的磷酸盐缓冲液,然后缓慢加入溶胀好的柱料,同时打开出水口使其自然沉降至距柱顶三分之一处,之后不断通过ph7.4的磷酸盐缓冲液冲洗进行柱平衡。(3)加样、洗脱及收集:将样品加入柱料上方,待其完全走入柱料,采用ph7.4的磷酸盐缓冲液以1.5ml/min速度进行洗脱,并在280nm处产生吸收峰开始来收集,将收集后的酶液进行真空冷冻干燥备用。在经过上步的硫酸铵盐析初步纯化后,需将纳豆激酶和α-淀粉酶进行分离。因此对上步所得的酶液进行了透析除盐,然后聚乙二醇浓缩,最后经sephadexg-200进行柱层析分离。分离结果如图10所示,可以看出粗酶液经过柱层析可在280nm处产生两个明显的吸收峰,在4.5min开始出现第一个吸收峰,保留时间5min,间隔7min后开始出现第二个吸收峰。经洗脱液收集后进行两种酶活性的测定,最终确定第一个峰为α-淀粉酶,而第二个峰为纳豆激酶。证明sephadexg-200产生了较好的分离效果。将每一步骤所得的酶液取40ml,分别测定其蛋白含量和酶活性,得到其比酶活、纯化倍数、蛋白回收率。如表2和表3所示,纳豆激酶从粗酶液到sephadexg-200柱层析后,纯化倍数达到了8.97倍,比酶活达到1663.9iu/mg,蛋白回收率为14.4%。α-淀粉酶纯化后的最终比酶活达到39.93u/mg,纯化倍数达到5.12倍,蛋白回收率为24.8%。表2纳豆激酶纯化结果纯化步骤总酶活(iu)总蛋白(mg)比酶活(iu/mg)纯化倍数蛋白回收率(%)粗酶液12948.1268.4189.31100盐析初步纯化7185.8329.2246.091.3055.8透析、浓缩7091.9516.8422.142.2354.7sephadexg-200柱层析1830.291.11663.98.9714.4表3α-淀粉酶纯化结果纯化步骤总酶活(u)总蛋白(mg)比酶活(u/mg)纯化倍数蛋白回收率(%)粗酶液536.468.47.81100盐析初步纯化355.629.212.171.5666.2透析、浓缩32816.819.522.561.1sephadexg-200柱层析133.13.3339.935.1224.83、酶蛋白的sds-page电泳鉴定及native-page电泳验证性试验native-page电泳采用8%的分离胶(5ml凝胶体积配方:2.3ml的蒸馏水,1.3ml的30%丙烯酰胺混合液,1.3ml的1.5mol/ltris(ph8.8),0.05ml的10%过硫酸铵,0.002ml的temed)和5%的浓缩胶(2ml凝胶体积配方:1.4ml的蒸馏水,0.33ml的30%丙烯酰胺混合液,0.25ml的1.0mol/ltris(ph6.8),0.02ml的10%过硫酸铵,0.002ml的temed),同时为了保持酶活性,样品的处理采用与不含sds的2×native-page上样缓冲液1:1的比例混合处理,电极缓冲液中同样也不含有sds变性剂;在跑电泳时也需将电泳槽在冰浴中进行防止温度过高导致酶变性,最终待120v条件下跑完电泳后,将凝胶取出浸泡于2%的可溶性淀粉溶液中并在40℃培养箱中培养2h,稍后用稀碘液进行显色反应,若无颜色部分为α-淀粉酶蛋白条带;结果如图11所示,将粗酶液经过盐析和透析的纯化步骤以后,sds-page电泳上仅在分子量29kda和63kda处有两条蛋白条带,说明杂蛋白已经较好的去除。同时经过柱层析所得收集到的峰1和峰2洗脱液分别在63kda和29kda处出现单一条带。经native-page电泳验证,盐析和透析后的样品同样仅有两条蛋白条带,经过碘液显示反应证明上端63kda的蛋白条带为α-淀粉酶。实施例9纳豆激酶的酶学特异性研究1、纳豆激酶酶促反应的最适温度及其保温稳定性(1)最适反应温度:将分离纯化后的纳豆激酶酶液打入纤维蛋白平板中,分别将接入纳豆激酶的纤维平板放入30、37、40、45、50℃培养箱中保温18h,然后测定溶解圈直径,计算出纳豆激酶酶活性,并将最大纳豆激酶残余酶活性定义为相对酶活100%;(2)保温稳定性:将分离纯化后的纳豆激酶酶液分别放入30、37、40、45、50℃水浴锅中进行保温,然后分别在20、40、60、80、100、120min取样,并均接入纤维蛋白平板中放置于37℃恒温培养箱中保温18h,,然后测定溶解圈直径,计算出纳豆激酶酶活性,并将最大纳豆激酶残余酶活性定义为相对酶活100%;结果表明,纳豆激酶在37℃时相对酶活性达到最大,为最适酶促反应温度;而在其后的反应温度相对酶活不断的下降,在50℃时酶活下降最为显著约为最适反应温度的一半;而在保温稳定性方面,可以看出除50℃条件下反应2h后的相对酶活有较大降低外,其他四个温度纳豆激酶都能保持稳定的酶活。2、纳豆激酶酶促反应最适ph及其在不同ph条件下的稳定性(1)最适ph:将纯化后的纳豆激酶酶液按照1:1的比例分别与ph为4.0、5.0、6.0、7.0、8.0、9.0的磷酸缓冲液均匀混合,接入纤维蛋白平板中放置于37℃恒温培养箱中保温18h,测定纳豆激酶酶活性,将最大纳豆激酶残余酶活性定义为相对酶活100%;(2)ph稳定性:将纯化后的纳豆激酶酶液按照1:1的比例分别与ph为4.0、5.0、6.0、7.0、8.0、9.0的磷酸缓冲液均匀混合,其后放入37℃水浴锅保温并分别在20、40、60、80、100、120min取样,测定纳豆激酶酶活性,并将最大纳豆激酶残余酶活性定义为相对酶活100%;纳豆激酶在ph6.0~7.0期间段相对酶活较高,能保持在90%以上;在ph4.0~5.0和ph8.0~9.0时相对酶活性较低,均在60%以下,这说明该纳豆激酶在中性条件下比较适宜酶促反应;最终确定其最适反应ph为7.0。通过观察不同ph条件下保持120min的变化可以看出纳豆激酶均无明显的相对酶活变化,这说明该酶具有较好的耐酸耐碱稳定性。3、金属离子对纳豆激酶的影响取900μl的纯化后的酶液分别与100μl的50mm金属离子溶液(mg2+、k+、na+、ca2+、ba2+、zn2+、cu2+、al3+、fe3+)混合均匀制成含金属离子5mm的酶液,以蒸馏水代替金属离子溶液作为空白对照并将其纳豆激酶残余酶活性定义为相对酶活100%;结果显示,该酶并无明显的金属离子激活作用,仅ba2+有微弱的激活作用。mg2+、k+、na+、ca2+、zn2+对其并无明显的影响,说明该酶对多数金属离子有较好的稳定性。cu2+、al3+、fe3+对纳豆激酶酶活性具有抑制作用,其中fe3+抑制作用最大。实施例10α-淀粉酶的酶学特异性研究1、α-淀粉酶酶促反应的最适温度及其保温稳定性(1)最适反应温度:参照2.2.5酶活测定方法,将纯化后的酶液适当稀释加入可溶性淀粉溶液中,并分别在30、40、50、60、70、80℃水浴锅中进行反应30min后测定α-淀粉酶的酶活性,并以最大残余酶活为相对酶活100%;(2)保温稳定性:将纯化后的酶液分别放在30、40、50、60、70、80℃水浴锅中保温,其后分别在20、40、60、80、100、120min取样适当稀释,测定α-淀粉酶的酶活性,并以最大残余酶活为相对酶活100%;结果表明α-淀粉酶在30~40℃时相对酶活较好,在50~80℃时酶活显著下降,最终确定最适酶促反应温度为40℃,属于中温性淀粉酶。α-淀粉酶的温度稳定性由图可知,在80min以内30~50℃进行酶促反应的α-淀粉酶具有较好的稳定性。60℃保温到80min后相对酶活趋于稳定在45%。70~80℃期间酶液保温40min相对酶活就已经显著下降,在80℃保温60min时α-淀粉酶就已经无酶活。2、α-淀粉酶酶促反应最适ph及其在不同ph条件下的稳定性(1)最适ph:在可溶性淀粉与酶液反应前,分别向1280μl的2%可溶性淀粉溶液中加入320μl的ph为4.0、5.0、6.0、7.0、8.0、9.0的磷酸缓冲液,待其在40℃水浴锅中预热8min后加入酶液测定α-淀粉酶酶活并将其最大残余酶活性定义为相对酶活100%;(2)ph稳定性:将纯化后的酶液按照1:1的比例分别与ph为4.0、5.0、6.0、7.0、8.0、9.0的磷酸缓冲液均匀混合,其后放入40℃水浴锅保温并分别在20、40、60、80、100、120min取样,最终测定各样品α-淀粉酶酶活并将其最大残余酶活性定义为相对酶活100%;结果表明α-淀粉酶的酶促反应在ph6.0的条件下相对酶活显著的上升,在ph7.0后出现了明显的下降趋势。说明该α-淀粉酶淀粉酶属于中性淀粉酶,酶促反应的最适反应ph为6.0。在ph稳定性方面也可看出该酶在ph6.0~7.0期间保温2h对酶活无明显的影响。此外相对比而言,该酶更为耐碱性。在ph4.0和ph5.0条件下分别保温80min和120min后进行酶促反应基本消失酶活性,而在ph8.0和ph9.0条件下保温2h相对酶活分别下降至24%和消失。3、金属离子对α-淀粉酶的影响取900μl的纯化后的酶液分别与100μl的50mm金属离子溶液(mg2+、k+、na+、ca2+、ba2+、zn2+、cu2+、al3+、fe3+)混合均匀制成含金属离子5mm的酶液,同时以蒸馏水代替金属离子溶液作为空白对照并将其α-淀粉酶残余酶活定义为相对酶活100%;结果表明,金属离子对α-淀粉酶的酶活性影响较大,其中ba2+、mg2+、al3+激活作用最为显著;na+、ca2+对酶活性基本无影响;k+、zn2+、cu2+对酶活性有微弱的抑制性作用;fe3+对酶活性抑制作用最强,使酶活性大量损失至原先的一半以下。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1