一种用于筛选作用于鱼尼丁受体的药物的荧光探针的制作方法
本发明属于荧光探针领域,特别涉及一种用于筛选作用于鱼尼丁受体的药物的荧光探针。
技术背景
分布于细胞质内的内质网/肌质网(er/sr)膜上的鱼尼丁受体是负责钙离子释放的主要通道。在哺乳动物中,其分为3个亚型,即ryr1,ryr2,ryr3,他们主要分别位于骨骼肌、心肌和脑组织中。与哺乳动物相比,鸟类、两栖动物和鱼类只有两个鱼尼丁受体,即ryra和ryrb。ryra受体类似于哺乳动物的ryrl亚型,而ryrb则更接近于ryr3亚型。而鱼尼丁受体在昆虫中只有一种:ryr,经过研究发现,在不同昆虫之间鱼尼丁受体在氨基酸序列上非常类似,但与哺乳动物相比则具有很大的差异性。鱼尼丁受体ryr在农药研究中的重要性主要体现在昆虫鱼尼丁受体与哺乳动物存在这种结构差异,因此针对昆虫的鱼尼丁受体ryr设计获得的昆虫鱼尼丁受体抑制剂或激动剂可以作为绿色农药的杀虫剂保护农作物并且不危害人类健康。目前为了筛选作用于昆虫鱼尼丁受体的药物,一般采用测试昆虫细胞钙离子流的方法,这种方法中使用非常昂贵的钙离子结合指示剂,例如:fura-2,fura-4等,根据细胞内钙离子流的变化来判断药物是否作用于昆虫的钙离子通道,但这种方法的缺点是不能判断药物是否选择性作用于昆虫的鱼尼丁受体,因为调控昆虫细胞钙离子浓度的通道除ryr之外还有电压门控性钙离子通道,代谢型离子通道,g蛋白偶联受体,还有1,4,5-三磷酸肌醇受体ip3r等(apicultureofchina,2011年10-12月中旬刊第62卷,p12-15)。
综上所述,如果能够获得对昆虫鱼尼丁受体选择性识别,并带有荧光特性的探针化合物,将能够为筛选针对昆虫鱼尼丁受体的药物提供新方法。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种靶向昆虫鱼尼丁受体的用于筛选作用于鱼尼丁受体的药物的荧光探针。
本发明的第二个目的是提供一种用于筛选作用于鱼尼丁受体的药物的荧光探针的用途。
本发明的技术方案概述如下:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,结构式如式(i)所示:
其中,
r1选自氢原子,甲基,f,cl或br;
r2选自(a-1)、(a-2)、(a-3)或(a-4);
r3为(a-5);
r1选自氢原子或cl;r2选自(a-1)、(a-2)、(a-3)或(a-4);r3选自(a-5)。
较好地,r1选自氢原子;r2选自(a-1)、(a-2)、(a-3)或(a-4);r3选自(a-5)。
较好地,r1选自cl;r2选自(a-1)、(a-2)、(a-3)或(a-4);r3选自(a-5)。
上述荧光探针筛选作用于鱼尼丁受体的药物的用途。
本发明具有以下的有益效果:
本发明的用于筛选作用于鱼尼丁受体的药物的荧光探针,能够直接与昆虫细胞体系中存在的ryr受体特异性结合,并能够被其他的昆虫鱼尼丁受体结合药物所置换,从而能够用于筛选与昆虫ryr受体相互作用的药物。
附图说明
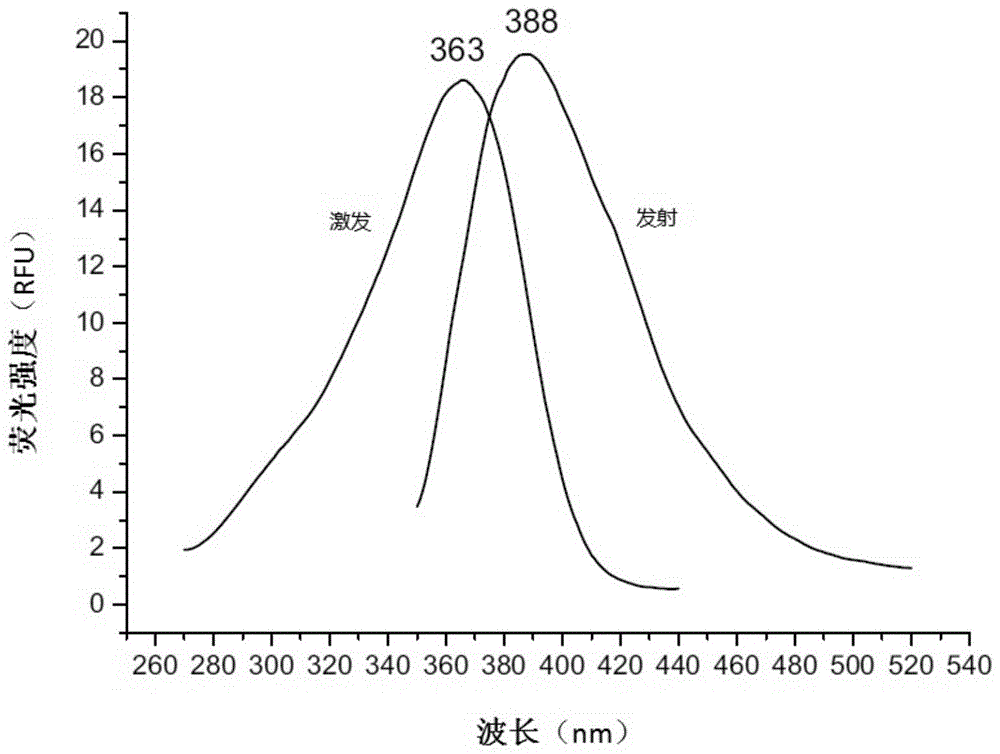
图1为荧光探针i-a1的激发及发射荧光谱图;
图2为荧光探针i-a2的激发及发射荧光谱图;
图3为荧光探针i-a3的激发及发射荧光谱图;
图4为荧光探针i-a4的激发及发射荧光谱图;
图5为荧光探针i-a1-1的激发及发射荧光谱图;
图6为荧光探针i-a2-1的激发及发射荧光谱图;
图7为荧光探针i-a3-1的激发及发射荧光谱图;
图8为荧光探针i-a4-1的激发及发射荧光谱图。
具体实施方式
本发明的设计理念是提供一种用于筛选作用于鱼尼丁受体的药物的荧光探针,荧光探针含有邻苯二甲酸二酰胺结构,能够被鱼尼丁受体有效识别,当体系中存在与鱼尼丁受体相互作用的未知药物分子时,未知药物分子与荧光探针产生竞争而导致荧光强度的变化,从而通过测试荧光探针在细胞体系中产生的荧光信号变化,达到发现和筛选昆虫ryr特异性农药的目的。
本发明用于筛选作用于鱼尼丁受体的药物的荧光探针可以通过下述方法合成制备而获得:
r1选自氢原子,甲基,f,cl或br;
r2选自(a-1)、(a-2)、(a-3)或(a-4);
r3为(a-5);
邻苯二甲酸酐原料与r2nh2反应时一般在适当溶剂中在室温或加热条件下反应。
适当的溶剂可以是n,n-二甲基甲酰胺(dmf),二氯甲烷(dcm),甲苯,四氢呋喃以及吡啶等有机溶剂。
反应的温度一般为室温至100℃反应3小时至48小时,较好地在室温至80℃反应3-24小时即可完成。
所取得的目标产物可以通过硅胶柱分离、重结晶、或者使用半制备液相色谱分离获得。
第二步的酰胺化反应通常在高氯酸和乙酸酐的存在下搅拌加热数小时,然后将得到的固体中间产物与r3nh2在有机碱存在下在有机溶剂中进行缩合。高氯酸和乙酸酐的用量通常为500毫克苯甲酸反应物使用0.28毫升高氯酸和2.3毫升乙酸酐,反应温度一般为室温至100℃,反应时间为3小时至24小时,较好地在室温至60℃反应3-12小时即可得到沉淀析出完成中间产物的制备。析出的中间产物经乙醚洗涤后即可进行下一步反应。固体中间产物与r3nh2的缩合反应所使用的溶剂可以是n,n-二甲基甲酰胺(dmf),甲苯,四氢呋喃以及吡啶等,所使用的有机碱可以是4-二甲氨基吡啶,二乙胺,二异丙基乙胺等。反应温度一般为室温至80℃,反应时间为2小时至48小时。通常在室温反应12小时即可完成。反应产物通过在乙醚中析出过滤即可完成。
用于筛选作用于鱼尼丁受体的药物的荧光探针,其结构式(i)中的r3还可以选自表1列举的具有不同激发波长的其他荧光团:
表1
下面能过实施例对本发明作进一步说明,但不限制本发明。
实施例1
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物2-(叔丁基氨基甲酰基)苯甲酸(中间体s-1-1)的制备:
将邻苯二甲酸酐(1.48g)分散于12毫升无水二氯甲烷中,在30℃下,向所得悬浮液中缓慢加入(a-1)-nh2(0.73g)并搅拌3h。过滤生成的沉淀物,用石油醚和乙酸乙酯进行洗涤,得到白色固体1.83g。
收率83%。
2)荧光探针i-a1的制备:
将2-(叔丁基氨基甲酰基)苯甲酸(500mg)溶于2.3毫升乙酸酐中,在30℃下,向所得悬浮液中缓慢加入0.28毫升高氯酸并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(540mg)溶于7毫升无水四氢呋喃中,加入7-氨基-4-甲基香豆素(374mg)和0.74毫升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到白色固体(467mg)。
收率55%。
1hnmr(600mhz,dmso)δ10.68(s,1h),7.84(s,1h),7.79(s,1h),7.74(d,j=8.7hz,1h),7.60(dd,j=18.8,6.4hz,2h),7.55–7.50(m,3h),6.27(s,1h),2.41(s,3h),1.30(s,9h).
esi-hrms:(m/z)401.1462.[m+na]+
实施例2:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物2-(叔戊基氨基甲酰基)苯甲酸(中间体s-2-1)的制备:
将邻苯二甲酸酐(592mg)分散于4.7毫升无水二氯甲烷中,在30℃下,向所得悬浮液中缓慢加入(a-2)-nh2(348mg)并搅拌3h。反应完成后减压旋干二氯甲烷,硅胶色谱法(石油醚:乙酸乙酯=2:1)纯化,得到白色固体489mg。
收率52%。
2)荧光探针i-a2的制备:
将2-(叔戊基氨基甲酰基)苯甲酸(258mg)溶于1.4毫升乙酸酐中,在30℃下,向所得悬浮液中缓慢加入0.14毫升高氯酸并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(286mg)溶于3.9毫升无水四氢呋喃中,加入7-氨基-4-甲基香豆素(189mg)和0.37毫升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到白色固体(260mg)。
收率62%。
1hnmr(600mhz,dmso)δ10.71(s,1h),7.84(s,1h),7.74(d,j=8.7hz,1h),7.67(s,1h),7.57(m,5h),6.27(s,1h),2.42(s,3h),1.70(q,j=7.4hz,2h),1.24(s,6h),0.82(t,j=7.5hz,3h).
esi-hrms:(m/z)415.1609.[m+na]+
实施例3:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物2-(2,4,4-三甲基戊烷-2-基氨基甲酰基)苯甲酸(中间体s-3-1)的制备:
将邻苯二甲酸酐(1.48g)分散于12毫升无水二氯甲烷中,在30℃下,向所得悬浮液中缓慢加入(a-3)-nh2(1.29g)并搅拌3h。反应完成后减压旋干二氯甲烷,硅胶色谱法(二氯甲烷:甲醇=50:1)纯化,得到白色固体1.71g。
收率62%。
2)荧光探针i-a3的制备:
将2-(2,4,4-三甲基戊烷-2-基氨基甲酰基)苯甲酸(500mg)溶于2.3毫升乙酸酐中,在30℃下,向所得悬浮液中缓慢加入0.28毫升高氯酸并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(500mg)溶于6.5毫升无水四氢呋喃中,加入7-氨基-4-甲基香豆素(292mg)和0.58毫升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到白色固体(422mg)。
收率54%。
1hnmr(600mhz,dmso)δ10.70(s,1h),7.84(s,1h),7.74(d,j=8.7hz,1h),7.69(s,1h),7.55(m,5h),6.27(s,1h),2.41(s,3h),1.78(s,2h),1.33(s,6h),0.97(s,9h).
esi-hrms:(m/z)457.2079.[m+na]+
实施例4:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物2-((4-甲基-2-氧代-2h-色烯-7-基)氨甲酰基)苯甲酸(中间体s-4-1)的制备:
将邻苯二甲酸酐(148mg)分散于1.2毫升无水二氯甲烷和1毫升无水四氢呋喃中,在30℃下,向所得悬浮液中缓慢加入(a-5)-nh2(175mg)并搅拌3h。过滤生成的沉淀物,用石油醚和乙酸乙酯进行洗涤,得到白色固体264mg。
收率82%。
2)荧光探针i-a4的制备:
将2-((4-甲基-2-氧代-2h-色烯-7-基)氨甲酰基)苯甲酸(100mg)溶于6.7毫升无水四氢呋喃中,在30℃下,向所得悬浮液中缓慢加入128.5微升无水三乙胺和64.5微升三氟乙酸酐并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(88mg)溶于814微升无水四氢呋喃中,加入2-氨基-2-甲基-1-丙醇(31mg)和120微升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到白色固体(108mg)。
收率89%。
1hnmr(600mhz,dmso)δ10.72(s,1h),7.84(s,1h),7.75(d,j=8.6hz,1h),7.62(d,j=11.9hz,3h),7.55(d,j=2.7hz,3h),6.28(s,1h),4.70(s,1h),3.45(d,j=5.2hz,2h),2.42(s,3h),1.24(s,6h).
esi-hrms:(m/z)417.1402.[m+na]+
实施例5:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物2-(叔丁基氨基甲酰基)-3-氯苯甲酸(中间体s-5-1)的制备:
将3-氯邻苯二甲酸酐(913mg)分散于7.3毫升无水二氯甲烷中,在30℃下,向所得悬浮液中缓慢加入(a-1)-nh2(365mg)并搅拌3h。反应完成后减压旋干二氯甲烷,硅胶色谱法(石油醚:乙酸乙酯=2:1)纯化,得到白色固体742mg。
收率58%。
2)荧光探针i-a1-1的制备:
将2-(叔丁基氨基甲酰基)-3-氯苯甲酸(742mg)溶于4毫升乙酸酐中,在30℃下,向所得悬浮液中缓慢加入412.5微升高氯酸并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(622mg)溶于9毫升无水四氢呋喃中,加入7-氨基-4-甲基香豆素(386mg)和764微升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到白色固体(566mg)。
收率47%。
1hnmr(600mhz,dmso)δ10.56(s,1h),8.04(s,1h),7.81(s,1h),7.75(d,j=8.5hz,1h),7.61(m,3h),7.51(t,j=7.7hz,1h),6.28(s,1h),2.41(s,3h),1.27(s,9h).
esi-hrms:(m/z)435.1051.[m+na]+
实施例6:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物3-氯-2-(叔戊基氨基甲酰基)苯甲酸(中间体s-6-1)的制备:
将3-氯邻苯二甲酸酐(913mg)分散于7.3毫升无水二氯甲烷中,在30℃下,向所得悬浮液中缓慢加入(a-2)-nh2(435mg)并搅拌3h。反应完成后减压旋干二氯甲烷,硅胶色谱法(石油醚:乙酸乙酯=2:1)纯化,得到白色固体810mg。
收率60%。
2)荧光探针i-a2-1的制备:
将3-氯-2-(叔戊基氨基甲酰基)苯甲酸(810mg)溶于4.4毫升乙酸酐中,在30℃下,向所得悬浮液中缓慢加入0.45毫升高氯酸并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(776mg)溶于11毫升无水四氢呋喃中,加入7-氨基-4-甲基香豆素(463mg)和915微升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到白色固体(354mg)。
收率28%。
1hnmr(600mhz,dmso)δ10.58(s,1h),7.90(s,1h),7.82(s,1h),7.75(d,j=8.5hz,1h),7.61(dd,j=20.1,7.8hz,3h),7.51(d,j=7.8hz,1h),6.28(s,1h),2.42(s,3h),1.67(dd,j=14.2,6.9hz,2h),1.21(s,6h),0.83(t,j=7.3hz,3h).
esi-hrms:(m/z)449.1226.[m+na]+
实施例7:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物3-氯-2-((4-甲基-2-氧代-2h-色烯-7-基)氨基甲酰基)苯甲酸(中间体s-7-1)的制备:
将3-氯邻苯二甲酸酐(182.5mg)分散于1.2毫升无水二氯甲烷和1毫升无水四氢呋喃中,在30℃下,向所得悬浮液中缓慢加入(a-5)-nh2(175mg)并搅拌3h。过滤生成的沉淀物,用石油醚和乙酸乙酯进行洗涤,得到白色固体292mg。
收率82%。
2)荧光探针i-a3-1的制备:
将3-氯-2-((4-甲基-2-氧代-2h-色烯-7-基)氨基甲酰基)苯甲酸(200mg)溶于13.34毫升无水四氢呋喃中,在30℃下,向所得悬浮液中缓慢加入232.2微升三乙胺和116.6微升三氟乙酸酐并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(147mg)溶于1.3毫升无水四氢呋喃中,将2-氨基-2-甲基-1-丙醇换成2,4,4-三甲基-2-戊胺(67mg)加入反应液并加入180微升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到白色固体(133mg)。
收率51%。
1hnmr(600mhz,dmso)δ10.53(s,1h),7.82(m,2h),7.76(d,j=8.7hz,1h),7.60(m,3h),7.51(t,j=7.8hz,1h),6.29(s,1h),2.42(s,3h),1.67(s,2h),1.32(s,6h),0.91(s,9h).
esi-hrms:(m/z)491.1674.[m+na]+
实施例8:
一种用于筛选作用于鱼尼丁受体的药物的荧光探针,用下述方法制成:
1)化合物3-氯-2-((4-甲基-2-氧代-2h-色烯-7-基)氨基甲酰基)苯甲酸(中间体s-7-1)的制备:
将3-氯邻苯二甲酸酐(182.5mg)分散于1.2毫升无水二氯甲烷和1毫升无水四氢呋喃中,在30℃下,向所得悬浮液中缓慢加入(a-5)-nh2(175mg)并搅拌3h。过滤生成的沉淀物,用石油醚和乙酸乙酯进行洗涤,得到白色固体292mg。
收率82%。
2)荧光探针i-a4-1的制备:
将3-氯-2-((4-甲基-2-氧代-2h-色烯-7-基)氨基甲酰基)苯甲酸(200mg)溶于13.34毫升无水四氢呋喃中,在30℃下,向所得悬浮液中缓慢加入232.2微升三乙胺和116.6微升三氟乙酸酐并搅拌4h。过滤生成的沉淀物,用乙醚进行洗涤。将白色沉淀物(147mg)溶于1.3毫升无水四氢呋喃中,加入2-氨基-2-甲基-1-丙醇(46mg)和180微升无水三乙胺,将反应混合物在室温条件下搅拌过夜。过滤生成的沉淀物,用乙醚进行洗涤,得到黄色固体(166mg)。
收率69%。
1hnmr(600mhz,dmso)δ10.71(s,1h),7.95(s,1h),7.79(d,j=23.6hz,2h),7.59(d,j=66.9hz,4h),6.29(s,1h),4.56(s,1h),3.43(s,2h),2.42(s,3h),1.23(s,6h).
esi-hrms:(m/z)451.1006.[m+na]+
实验证明,用3-甲基邻苯二甲酸酐、3-氟邻苯二甲酸酐或3-溴邻苯二甲酸酐替代本实施例的氯邻苯二甲酸酐,其他同本实施例,分别获得相应的产物。
试验例1:荧光探针的荧光光谱表征实验
将荧光探针用dmso溶解,pbs缓冲液稀释成50μm,用thermoscientificvarioskanlux荧光酶标仪测定荧光探针的荧光光谱,以确定本发明荧光探针的荧光激发和发射波长。
测试结果如表2及图1至图8所示:
表-2:
本发明所提供的荧光探针测试结果表明,荧光探针的激发波长范围为:347nm至363nm,发射波长范围为:388nm;
试验例2:本发明荧光探针在筛选ryr靶向型药物的应用
1,探针及实验药物的制备
1)称取1mg荧光探针,根据其分子量使用分析纯二甲基亚砜(dmso)将荧光探针配制成20mm溶液,然后用pbs稀释成10-100μm的检测试剂。
2)当所使用的荧光探针在稀释过程中出现不溶解时,可通过提高dmso的体积百分比使探针充分溶解配制透明溶液。dmso的最高体积百分比控制在0.5%以下。
3)所配制的荧光探针试剂,一般在使用前配制,或者配置后置于-20℃冷冻避光保存。
4)测试药物采用已知的ryr靶向型化合物:氟苯虫酰胺(购自sigma-aldrich)。氟苯虫酰胺采用与荧光探针同样的方法配制成10-100μm的药物试剂。
2,细胞培养及鱼尼丁受体转染
昆虫细胞sf9以及细胞培养基sf900iii购自invitrogen。
细胞培养
①细胞复苏
1)37℃水浴复苏,将细胞转移至15ml离心管,加10ml左右sf900iii培养基。
2)400g,5min离心,弃上清
3)新鲜sf900iii培养基重悬,终密度为8×105/ml左右
4)27℃,120rpm悬浮培养
②细胞传代
sf9悬浮培养倍增时间为24h-36h,在sf900iii无血清培养基中最大密度可达4×106/ml
1)取一定量细胞悬液,400g,5min离心,弃上清
2)新鲜sf900iii培养基重悬,终密度为5×105/ml左右
3)27℃,120rpm悬浮培养
sf9-ryr细胞:
sf9-ryr细胞即转染昆虫ryr受体后的sf9昆虫细胞。
针对sf9昆虫细胞的ryr转染依据文献报道的方法实施、获得和检测(pesticidebiochemistryandphysiology,volume84,issue3,march2006,pages196-214)。
3,本发明的荧光探针与鱼尼丁受体结合实验
使用本发明荧光探针化合物,分别与未转染昆虫ryr受体的sf9细胞(sf9细胞),以及转染昆虫ryr受体后的细胞(sf9-ryr细胞)共培养。通过检测荧光探针结合ryr之后的荧光强度,与未转染ryr的细胞相比较,能够确认所合成的荧光探针与昆虫鱼尼丁受体是否特异性结合。
在96孔板中分别铺设1x104sf9转染细胞和未转染ryr细胞。待细胞过夜贴壁后,分别加入10μm终浓度的荧光探针溶液于27度培养15分钟。每个浓度设复孔5个,同时设空白对照组不添加细胞只添加荧光探针溶液。冰冷pbs洗3遍,转移到酶标板中测量荧光强度。表3中的荧光强度表示实际测得的细胞荧光强度减去空白荧光信号的数值。即,平均荧光强度=(每个药物浓度下测得的每个复孔荧光强度取平均值)-(空白对照组各个复孔测得的荧光强度平均值)。取小数点后2位。
表3
表3结果表明,由于本发明荧光探针与ryr形成特异性结合,与未转染ryr的细胞相比,细胞荧光强度明显不同。
4,本发明的荧光探针在筛选ryr靶向药物中的应用
1),在细胞培养箱中,在不同的96孔板中分别铺设1x104的sf9-ryr细胞。待细胞过夜贴壁后,分别加入10μm终浓度的荧光探针溶液于27度培养60分钟。每个浓度设复孔5个,同时设空白对照组不添加细胞只添加荧光探针溶液。冰冷pbs洗3遍,转移到酶标板中测量荧光强度。
2),另一组96孔板中,将药物氟苯虫酰胺终浓度10μm的溶液,预先处理细胞60分钟(27度培养),然后直接加入本发明探针终浓度10μm的溶液继续培养15分钟。冰冷pbs洗3遍,转移到酶标板中测量荧光强度。
平均荧光强度=(每个药物浓度下测得的每个复孔荧光强度取平均值)-(空白对照组各个复孔测得的荧光强度平均值)。取小数点后2位。
荧光探针在sf9-ryr细胞中的荧光强度,以及事先与氟苯虫酰胺培养再经本发明探针处理后的sf9-ryr细胞内荧光强度测试结果如下:
表4:
表4中结果显示,本发明荧光探针在ryr转染的sf9昆虫细胞(sf9-ryr细胞)中能够被ryr靶向型药物置换,导致本发明探针在昆虫细胞内的荧光强度大幅降低。说明本发明探针针对ryr高表达的昆虫细胞具有特异性,因此能够针对高表达ryr受体的细胞进行荧光检测和针对作用于ryr受体的药物进行筛选。
- 还没有人留言评论。精彩留言会获得点赞!