多巴胺D2受体选择性激动剂及其在疾病治疗中的应用的制作方法
本发现属于生命科学中结构药理学研究领域,具体为一种多巴胺d2受体选择性激动剂的发现及其在疾病治疗中的应用。
背景技术:
多巴胺受体属于g蛋白偶联受体家族,目前已分离出五种多巴胺受体,根据它们的生物化学和药理学性质,可分为d1类和d2类,其中d1类受体包括d1和d5亚型,可激活腺苷酸环化酶,增加细胞内环化腺苷酸(camp)浓度;d2类受体包括d2、d3和d4亚型,对腺苷酸环化酶有抑制作用,还与细胞内其它第二信使系统相关联,包括激活钾通道、抑制钙通道及转换磷脂酰肌醇。多项研究证实drd2是精神疾病重要的药物靶点,阻断drd2是治疗精神分裂症阳性症状的主要环节;而激活drd2是治疗精神分裂症阴性症状的主要环节。drd2拮抗剂可以诱发动物强直,而drd2激动剂可以诱发实验动物的活动亢进和呆板运动,故drd2也与运动密切相关。
帕金森病(parkinson’sdisease,pd)作为一种常见的运动障碍疾病普遍存在于中老年人群中,我国65岁以上人群pd的患病率大约是1.7%。帕金森病最主要的病理特征为中脑黑质纹状体系统多巴胺(dopamine,da)能神经元变性死亡,由此而引起纹状体多巴胺含量显著性减少而致病。帕金森病主要的临床表现为静止性震颤、运动迟缓、肌强直和姿势步态障碍。左旋多巴(levodopa,l-dopa)作为多巴胺前体,是帕金森病治疗的最主要药物,其通过提高多巴胺水平,缓解运动障碍,但是患者在长期或大量用药后常可出现运动波动或异动症等新的运动障碍。多巴胺受体激动剂虽然不是左旋多巴类的神经递质但其可直接刺激多巴胺受体位点,起到类似于左旋多巴抗帕金森病的作用,而且其可以克服左旋多巴不足以及药物副作用明显的问题,因此多巴胺受体激动剂已经成为左旋多巴的替代之选并同时成为目前发展最快的帕金森病治疗药物。
目前,所有多巴胺受体激动剂都通过激活drd2发挥治疗帕金森病的作用,同时,靶向drd2的激动剂药物也可以用来治疗其他如注意缺陷多动障碍、垂体瘤、高催乳素血症、多动腿综合症、阴性精神分裂症等低多巴胺相关疾病。但是,由于d2类受体具有高度相似性,因而临床上没有选择性的drd2激动剂,大多数药物在作用于drd2的同时也会对d3和d4两个亚型起作用而产生运动障碍或致幻等相应的副作用。
因此,寻找一种drd2选择性激动剂以降低药物副作用对于治疗帕金森病等低多巴胺相关疾病而言至关重要。
技术实现要素:
本发明的目的是提供一种drd2选择性激动剂及其在疾病治疗中的应用,以帕金森病为例。
本发明的第一方面,提供了一种式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体:
式中:
r1为氢、卤素、羟基、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c1-c6环烷氧基、取代或未取代的c2-c6烯氧基;
r2为氢、卤素、硝基、氰基、羟基;
r3和r4分别独立地为氢、卤素、羟基、取代或未取代的c1-c6烷基、取代或未取代的c3-c6环烷基;
r5为氢、卤素、羟基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基)、取代或未取代的c3-c6环烷基;
r6为氢或
r7为氢、卤素、羟基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基);
r8为氢、卤素、羟基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基);
r9为氢、卤素、羟基、c6-c10芳基、c6-c10杂芳基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基);
或,
r8、r9和相邻的c原子形成取代或未取代的3-8元碳环基(包括芳基和非芳基);或r8、r9和相邻的c原子形成含1-3个选自杂原子o、s、n的取代或未取代的4-8元杂环基;
其中r1、r3、r4、r5、r6、r7、r8、r9中,所述取代指具有1个、2个、3个或4个选自下组的取代基:卤素、硝基、氰基、羟基。
在另一优选例中,所述异构体选自下组:对映异构体、非对映异构体、互变异构体。
在另一优选例中,所述r1选自下组:氢、羟基、ch3o-、c2h5o-、c3h7o-、c4h9o-、ch2=chch3o-、c2h4fo-、c4h7o-、(ch3)2cho-。
在另一优选例中,所述r3为氢或ch3-。
在另一优选例中,所述r4为氢或ch3-。
在另一优选例中,所述r5为氢或ch3-或c2h5-或c3h7-。
在另一优选例中,所述r6为hoc2h4-或(ch3)2c(ho)-。
在另一优选例中,所述r6为
在另一优选例中,所述r6为
在另一优选例中,所述r6为
在另一优选例中,所述r6为
r7为氢;
r8为ch3-,r9为ch3-;或r8、r9和相邻的c原子形成3元饱和碳环、4元饱和碳环、5元饱和碳环、6元饱和碳环、苯环、7元饱和碳环、8元饱和碳环、双氟取代的6元饱和碳环、含一个o原子的6元饱和杂环。
在另一优选例中,所述式i化合物选自下组:
在另一优选例中,所述式i化合物为
本发明的第二方面,提供了一种药物组合物,所述药物组合物包括:
(a)式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体;和(b)药学上可接受的载体;
式中,各基团的定义如上所述。
在另一优选例中,所述药物组合物为用于治疗低多巴胺相关疾病(例如帕金森病)的药物组合物。
在另一优选例中,所述低多巴胺相关疾病选自下组:帕金森、注意缺陷多动障碍、垂体瘤、高催乳素血症、多动腿综合症、阴性精神分裂症、或其组合。
在另一优选例中,所述的药物组合物还包括:左旋多巴(l-dopa)、卡比多巴(carbidopa)、苄丝肼(benserazide)、溴隐亭(bromocriptine)、吡贝地尔(piribedil)、二氢麦角隐亭(dihydroergocryptine)、普拉克索(pramipexole)、罗匹尼罗(ropinirole)、罗替戈汀(rotigotine)、阿朴吗啡(apomorphine)、或其组合。
在另一优选例中,所述药物组合物中含有治疗有效量的式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体。
在另一优选例中,所述药物组合物的剂型为注射剂、片剂、胶囊剂、丸剂、悬浮剂或乳剂。
在另一优选例中,所述药物组合物的剂型为口服剂型、经皮剂型、静脉或肌肉注射剂型。
本发明的第三方面,提供了本发明的第一方面所述的式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体的用途,用于制备药物组合物或制剂,所述药物组合物或制剂用于:
(i)激动多巴胺受体,上调多巴胺受体活性;
(ii)治疗低多巴胺相关疾病。
在另一优选例中,所述组合物或制剂用作多巴胺受体激动剂和/或上调多巴胺受体活性。
在另一优选例中,所述多巴胺受体选自下组:多巴胺d1类受体、多巴胺d2类受体。
在另一优选例中,所述多巴胺d2类受体包括d2、d3和d4亚型。
在另一优选例中,所述多巴胺受体为多巴胺d2类受体d2亚型(drd2)。
在另一优选例中,所述低多巴胺相关疾病选自下组:帕金森、注意缺陷多动障碍、垂体瘤、高催乳素血症、多动腿综合症、阴性精神分裂症。
在另一优选例中,所述的药物组合物中含有0.001-99wt%的式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体,按组合物的总重量计。
在另一优选例中,所述的药物组合物中含有0.1-90wt%的式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体,按组合物的总重量计。
在另一优选例中,所述的药物组合物中含有1-80wt%的式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体,按组合物的总重量计。
本发明的第四方面,提供了本发明的第一方面所述i所示化合物的制备方法,当r3,r4至少一者为氢时,采用如下方法制备:在有机溶剂(如四氢呋喃,乙醇等)中,将如式ii所示的中间体化合物和胺
其中r1-r6的定义如前所述。
本发明的第五方面,提供了一种体外非治疗性的上调多巴胺受体活性的方法,所述方法包括步骤:在式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体存在下,培养所述细胞,从而在所述细胞中上调多巴胺受体活性。
在另一优选例中,所述上调为选择性上调,所述式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体对drd2的选择性高于drd3。
在另一优选例中,所述上调为选择性上调,所述式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体对drd2的选择性是drd3的2-20倍左右。
在另一优选例中,所述上调为选择性上调,所述式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体对drd2的选择性是drd3的12-18倍(如15倍)。
本发明的第六方面,提供了一种药盒,所述药盒包含:
(1)一容器,以及位于所述容器内的活性成分,所述活性成分为式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体,以及药学上可接受的载体;
式中,各基团的定义如上所述;
以及(2)任选的使用说明书,所述说明书记载了将所述活性成分用于选自下组的一种或多种应用:
(i)激动多巴胺受体,上调多巴胺受体活性;
(ii)治疗低多巴胺相关疾病。
在另一优选例中,所述多巴胺受体选自下组:多巴胺d1类受体、多巴胺d2类受体。
在另一优选例中,所述多巴胺d2类受体包括d2、d3和d4亚型。
在另一优选例中,所述多巴胺受体为多巴胺d2类受体d2亚型(drd2)。
在另一优选例中,所述药盒中还包括额外的治疗低多巴胺相关疾病(例如帕金森)的药物。
本发明的第七方面,提供了一种治疗低多巴胺相关疾病的方法,所述方法包括:对需要治疗的对象施用治疗有效量的式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体、或其药物组合物或制剂,和/或本发明的第二方面所述的药物组合物。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1选择性多巴胺d2受体激动剂(+)-(r)-i-4的结构。基于drd2受体的结构信息,经过不断优化设计,通过化学方法合成了一种drd2选择性激动剂(+)-(r)-i-4。此小分子相对分子质量为317.43。
图2多巴胺d2受体激动剂(+)-(r)-i-4选择性的鉴定。
(a)drd2激动剂(+)-(r)-i-4在g蛋白信号通路中显示出drd2选择性。在293t细胞中分别转染drd2、drd3和drd4,用此激动剂刺激转染后的细胞,检测细胞内camp水平变化以响应g蛋白信号通路变化,进而揭示其对多巴胺受体的激动作用。如图2a所示,此激动剂对drd4没有作用,对drd3发挥部分激活作用(emax=52.44%),对drd2发挥几乎完全激活作用(emax=94.46%),进一步观察发现,此激动剂在drd2中发挥作用时的ec50值为0.45nm,在drd3中发挥作用时的ec50值为7.12nm,由此可见,对于激活多巴胺受体下游g蛋白信号通路而言,此激动剂对drd2具有选择性,选择性是drd3的15倍左右。
(b)drd2激动剂(+)-(r)-i-4在β-arrestin信号通路中显示出drd2选择性。在htla细胞中分别转染drd2、drd3和drd4,用此激动剂刺激转染后的细胞,检测细胞内β-arrestin水平变化以响应β-arrestin蛋白信号通路变化,进而揭示其对多巴胺受体的激动作用。如图2b所示,此激动剂对drd4没有作用,对drd3发挥部分激活作用(emax=21.41%),对drd2发挥几乎完全激活作用(emax=99.61%),进一步观察发现,此激动剂在drd2中发挥作用时的ec50值为48.80nm,在drd3中发挥作用时的ec50值为808.42nm,由此可见,对于激活多巴胺受体下游β-arrstin信号通路而言,此激动剂对drd2具有选择性,选择性是drd3的15倍左右。
图3多巴胺d2受体激动剂(+)-(r)-i-4对多巴胺能神经元起到保护作用。
drd2激动剂(+)-(r)-i-4可以在大脑黑质区缓解由1-甲基-4-苯基-1,2,3,6-四氢吡啶mptp诱导的多巴胺合成酶酪氨酸羟化酶(th)的表达量减少(图3a-d),揭示了其在黑质区对多巴胺能神经元有保护作用,且其所需作用的剂量优于目前临床上用于治疗帕金森病的药物普拉克索(图3e)。(n.s.,统计学无显著性差异,*p<0.05,**p<0.01,***p<0.001,****p<0.0001)。
具体实施方式
本发明人以结构为基础不断优化设计,通过广泛而深入的研究,首次意外地发现了一种drd2选择性激动剂,其具有drd2完全激动剂、drd3部分激动剂和无drd4激动剂的特性,其对drd2的选择性是drd3的15倍左右,表明其在帕金森病的治疗中具有潜在作用。体外动物模型(例如利用mptp诱导帕金森病小鼠模型)实验证明,上述激动剂可对帕金森模型小鼠的大脑黑质区多巴胺能神经元起到保护作用。在此基础上完成了本发明。
具体地,本发明以帕金森病为例揭示了其在治疗低多巴胺相关疾病中的应用。本发明提供的drd2选择性激动剂,可以作为一种药物来治疗帕金森病,且其高度选择性可大幅度的降低副作用的产生,给帕金森病患者带来更优药物选择。同时,也预示其在其他如注意缺陷多动障碍、垂体瘤、高催乳素血症、多动腿综合症、阴性精神分裂症等低多巴胺相关疾病治疗中的潜在作用。
术语
本发明所述“卤素”是指指f、cl、br和i。
本发明所述“c1-c6烷基”是指具有1-6个碳原子的直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、或类似基团。
术语“c1-c6烷氧基”指具有1-6个碳原子的直链或支链烷氧基,例如甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、仲丁氧基、叔丁氧基、戊氧基、或类似基团。
术语“c2-c6烯氧基”指具有2-6个碳原子的直链或支链烯氧基,例如乙烯氧基、丙烯氧基、丁烯氧基、异丁烯氧基、戊烯氧基、或类似基团。
术语“c3-c6环烷基”指具有3-6个碳原子的环烷基,例如环丙基、环丁基、环戊基、环己基、或类似基团。
术语“3-8元碳环基”是指具有3-8个c原子的饱和或不饱和碳环基团,例如环丙烷基、环丁烷基、环戊烷基、环己烷基、环庚烷基、环辛烷基、苯基、或类似基团。
术语“4-8元杂环基”是指具有1-3个选自o、s、n的杂原子的杂环烷基,如含有1个o原子的c5或c6杂环烷基,含有1个n原子的c5或c6杂环烷基,含有1个s原子的c5或c6杂环烷基。
术语“取代”是指具有1个、2个、3个或4个选自下组的取代基:卤素(例如f或cl)、硝基、氰基、羟基。
术语“c6-c10芳基”指具有6-10个碳原子的芳基,包括单环或二环芳基,例如苯基、萘基,或类似基团。
术语“c6-c10杂芳基”指具有1-10个碳原子的杂芳基,例如吡咯基、吡啶基、呋喃基,或类似基团。
活性成分
在本发明中,“本发明化合物”、“活性成分”和“本发明活性成分”可互换使用,指式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体。
典型地,本发明中,活性成分如下通式i所示结构,
式中:
r1为氢、卤素、羟基、取代或未取代的c1-c6烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c1-c6环烷氧基、取代或未取代的c2-c6烯氧基;
r2为氢、卤素、硝基、氰基、羟基;
r3和r4分别独立地为氢、卤素、羟基、取代或未取代的c1-c6烷基、取代或未取代的c3-c6环烷基;
r5为氢、卤素、羟基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基)、取代或未取代的c3-c6环烷基;
r6为氢或
r7为氢、卤素、羟基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基);
r8为氢、卤素、羟基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基);
r9为氢、卤素、羟基、c6-c10芳基、c6-c10杂芳基、取代或未取代的c1-c6烷基(如甲基、乙基、丙基);
或,
r8、r9和相邻的c原子形成取代或未取代的3-8元碳环基(包括芳基和非芳基)或含1-3个选自o、s、n的杂原子的取代或未取代的4-8元杂环基;
其中r1、r3、r4、r5、r6、r7、r8、r9中,所述取代指具有1个、2个、3个或4个选自下组的取代基:卤素、硝基、氰基、羟基。
在本发明的一个优选例中,r1选自下组:氢、羟基、ch3o-、c2h5o-、c3h7o-、c4h9o-、ch2=chch3o-、c2h4fo-、c4h7o-、(ch3)2cho-。
在本发明的又一个优选例中,r3为氢或ch3-。
在本发明的另一个优选例中,r4为氢或ch3-。
在本发明的另一个优选例中,r5为氢或ch3-或c2h5-或c3h7-。
在本发明的另一个优选例中,r6为hoc2h4-或(ch3)2c(ho)-。
在另一优选例中,所述r6为
在另一优选例中,所述r6为
在另一优选例中,所述r6为
在本发明的另一个优选例中,r6为
r7为氢;
r8为ch3-,r9为ch3-;或r8、r9和相邻的c原子形成3元饱和碳环、4元饱和碳环、5元饱和碳环、6元饱和碳环、苯环、7元饱和碳环、8元饱和碳环、双氟取代的6元饱和碳环、含一个o原子的6元饱和杂环。
在本发明的另一个优选例中,代表性的活性成分为选自下组的化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体:
药学上可接受的盐或药物前体
本发明涉及的化合物还包括如式i所示的化合物药学上可以接受的盐。
如本文所用,术语“药学上可接受的盐”指本发明化合物与药学上可接受的无机酸和有机酸所形成的盐,无机酸包括:盐酸、氢溴酸、磷酸、硝酸、硫酸;有机酸包括:甲酸、乙酸、丙酸、丁二酸、萘二磺酸(1,5)、亚细亚酸、草酸、酒石酸、乳酸、水杨酸、苯甲酸、戊酸、二乙基乙酸、丙二酸、琥珀酸、富马酸、庚二酸、己二酸、马来酸、苹果酸、氨基磺酸、苯丙酸、葡糖酸、抗坏血酸、烟酸、异烟酸、甲磺酸、对甲苯磺酸、柠檬酸,以及氨基酸。术语“药学上可接受的盐”也可以指本发明化合物的钠盐、钾盐或铵盐
如本文所用,术语“药学上可接受的药物前体”指在体外无活性,但能够在生物体内转化为式i所示活性物质,从而发挥其药理作用的化合物。
药物组合物
本发明还提供了一种药物组合物,其具有显著的治疗低多巴胺相关疾病(例如帕金森)功效,其中含有治疗有效量的所述式i化合物或其药学上可接受的盐(如盐酸盐),以及一种或多种药学上可接受的载体。
在本发明的另一优选例中,所述低多巴胺相关疾病选自下组:帕金森、注意缺陷多动障碍、垂体瘤、高催乳素血症、多动腿综合症、阴性精神分裂症。
在本发明的另一优选例中,所述的药物组合物还包括:左旋多巴(l-dopa)、卡比多巴(carbidopa)、苄丝肼(benserazide)、溴隐亭(bromocriptine)、吡贝地尔(piribedil)、二氢麦角隐亭(dihydroergocryptine)、普拉克索(pramipexole)、罗匹尼罗(ropinirole)、罗替戈汀(rotigotine)、阿朴吗啡(apomorphine)。
在本发明的另一优选例中,所述的药物组合物中含有治疗有效量的式i所示的化合物的药学上可接受的盐,以及一种或多种药学上可接受的载体。
可将化合物本身或其药学上可接受的盐与可药用赋形剂、稀释剂等的混合物以片剂、胶囊、颗粒剂、散剂或糖浆剂的形式口服给药或以注射剂的形式非口服给药。该药物组合物优选含有重量比为0.01%-99%的本发明的式i化合物或其药学上可接受的盐作为活性成分,更优选含有重量比为0.1%-90%的活性成分。
上述制剂可通过常规制药方法制备。可用的药用辅剂的例子包括赋形剂(例如糖类衍生物如乳糖、蔗糖、葡萄糖、甘露糖醇和山梨糖醇;淀粉衍生物如玉米淀粉、土豆淀粉、糊精和羧甲基淀粉;纤维素衍生物如结晶纤维素、羟丙基纤维素、羧甲基纤维素、羧甲基纤维素钙、羧甲基纤维素钠;阿拉伯胶;右旋糖酐;硅酸盐衍生物如偏硅酸镁铝;磷酸盐衍生物如磷酸钙;碳酸盐衍生物如碳酸钙;硫酸盐衍生物如硫酸钙等)、粘合剂(例如明胶、聚乙烯吡咯烷酮和聚乙二醇)、崩解剂(例如纤维素衍生物如羧甲基纤维素钠、聚乙烯吡咯烷酮)、润滑剂(例如滑石、硬脂酸钙、硬脂酸镁、鲸蜡、硼酸、苯甲酸钠、亮氨酸)、稳定剂(对羟基苯甲酸甲酯、对羟基苯甲酸丙酯等)、矫味剂(例如常用的甜味剂、酸味剂和香料等)、稀释剂和注射液用溶剂(例如水、乙醇和甘油等)。
本发明的化合物、其药学上可接受的盐或前药,或其药物组合物的给药量随患者的年龄、性别、种族、病情等的不同而不同。一般成人的日给药量为大约10mg-2000mg,优选50mg-1000mg。
多巴胺受体
多巴胺受体属于g蛋白偶联受体家族,目前已分离出五种多巴胺受体,根据它们的生物化学和药理学性质,可分为d1类和d2类,其中d1类受体包括d1和d5亚型,可激活腺苷酸环化酶,增加细胞内环化腺苷酸(camp)浓度;d2类受体包括d2、d3和d4亚型,对腺苷酸环化酶有抑制作用,还与细胞内其它第二信使系统相关联,包括激活钾通道、抑制钙通道及转换磷脂酰肌醇。由于多巴胺受体两个家族内部不同亚型的相似性使得多巴胺配体化合物虽然很容易将d1类和d2类家族区分开来但大多数化合物不能区分相同家族的受体亚型。
多项研究证实drd2是精神疾病重要的药物靶点,阻断drd2是治疗精神分裂症阳性症状的主要环节;而激活drd2是治疗精神分裂症阴性症状的主要环节。drd2拮抗剂可以诱发动物强直,而drd2激动剂可以诱发实验动物的活动亢进和呆板运动,故drd2也与运动密切相关。
本发明针对drd2发明了一种药物组合物,通过激动drd2进而激活其相应功能用以治疗帕金森病等低多巴胺相关疾病。
在本发明的一个优选例中,所述多巴胺受体选自下组:多巴胺d1类受体、多巴胺d2类受体。
在本发明的又一个优选例中,所述多巴胺d2类受体包括d2、d3和d4亚型。
在本发明的又一个优选例中,所述多巴胺受体为多巴胺d2类受体d2亚型(drd2)。
治疗低多巴胺相关疾病的药物组合物或制剂
本发明提供了治疗低多巴胺相关疾病的方法,所述方法包括:对需要治疗的对象施用治疗有效量的式i所示化合物,或其药学上可接受的盐、或其同位素衍生物、或其异构体、或其溶剂化物、或其代谢产物、或其药物前体、或其药物组合物或制剂。
在本发明的一个优选例中,所述的药物组合物包括:(a)治疗有效量的式i化合物;和(b)药学上可接受的载体。
在另一优选例中,所述药物组合物或制剂还包括选自下组的组分:左旋多巴(l-dopa)、卡比多巴(carbidopa)、苄丝肼(benserazide)、溴隐亭(bromocriptine)、吡贝地尔(piribedil)、二氢麦角隐亭(dihydroergocryptine)、普拉克索(pramipexole)、罗匹尼罗(ropinirole)、罗替戈汀(rotigotine)、阿朴吗啡(apomorphine)、或其组合。
在本发明的一个优选例中,所述低多巴胺相关疾病选自下组:帕金森、注意缺陷多动障碍、垂体瘤、高催乳素血症、多动腿综合症、阴性精神分裂症、或其组合。
在本发明的又一优选例中,所述药物组合物的剂型为注射剂、片剂、胶囊剂、丸剂、悬浮剂或乳剂。
在本发明的又一优选例中,所述药物组合物的剂型为口服剂型、经皮剂型、静脉或肌肉注射剂型。
在另一优选例中,所述式i化合物的有效浓度为0.01nm/l-1mm/l,较佳地为0.1nm/l-500μm/l,最佳地为1nm/l-100μm/l。
本发明还提供了一种治疗低多巴胺相关疾病的药物组合物或制剂的制备方法,所述方法包括:将治疗有效量的式i化合物与药学上可接受的载体混合,从而形成药物组合物或制剂。
典型地,对被治疗对象施用治疗有效量的式i化合物或包括式i化合物的药物组合物或制剂,可以治疗或缓解低多巴胺相关疾病(例如帕金森)。
drd2选择性激动剂及其用途
本发明提供一种drd2选择性激动剂。
在本发明的一个优选例中,发明人基于drd2与拮抗剂haloperidol复合物结构,在其基础上不断优化设计,并通过化学方法合成了一种drd2选择性激动剂。
在本发明的另一个优选例中,发明人将d2类受体三个亚型drd2、drd3和drd4分别转染细胞,给予细胞上述drd2选择性激动剂刺激,下游gi以及β-arrestin信号通路的反响程度证实了此激动剂是一个不激活drd4、部分激活drd3、完全激活drd2的drd2选择性激动剂,且其对drd2的选择性是drd3的15倍左右。
本发明的另一优选例中,将此drd2选择性激动剂作用于帕金森病动物模型,证实了其在帕金森病治疗中的作用,并以帕金森病为例揭示其在低多巴胺相关疾病中的应用。
在本发明的另一优选例中,发明人对经过mptp以及激动剂注射的小鼠进行大脑切片与组织形态观察,切片染色酪氨酸羟化酶(th)以观察大脑黑质区域多巴胺神经元数量变化,结果证实drd2选择性激动剂可对多巴胺能神经元起到保护作用,因而揭示其可在治疗帕金森病中发挥重要作用。
具体地,发明人首次发现了一种drd2选择性激动剂,其不激活drd4,部分激活drd3,对drd2的选择性是drd3的15倍左右。同时,发明人在帕金森病动物模型中证实了上述激动剂可保护帕金森模型小鼠大脑黑质区域的多巴胺能神经元。
典型地,发明人提供了一种治疗帕金森病的药物,且其高度选择性可极大的降低副作用的产生,给帕金森病患者的治疗带来了新的希望,同时,以帕金森病为例,发明人也揭示了其可以治疗其他如注意缺陷多动障碍、垂体瘤、高催乳素血症、多动腿综合症、阴性精神分裂症等低多巴胺相关疾病的可能性。
本发明的主要优点在于:
本发明首次发现了一种drd2选择性激动剂,其具有drd2完全激动剂、drd3部分激动剂和无drd4激动剂的特性,极大程度上降低副作用的同时在治疗帕金森病等低多巴胺疾病中发挥重要作用。
下面的具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如(sambrook和russell等人,分子克隆:实验室手册(molecularcloning-alaboratorymanual)(第三版)(2001)cshl出版社)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
材料和方法
本发明发现了一种drd2选择性的激动剂,并揭示了其在疾病治疗中的应用,以帕金森病为例。具体操作如下:通过化学方法合成drd2选择性的激动剂,在细胞水平对激动剂的选择性进行验证,最后将其应用于帕金森病小鼠模型的治疗中,发现其可减轻帕金森小鼠的运动功能障碍,可作为治疗帕金森病的药物,给帕金森病患者的治疗带来了新的希望,因而揭示其治疗低多巴胺相关疾病的可能性。
1.多巴胺d2受体选择性激动剂的合成
基于drd2受体的结构信息,经过不断优化设计,通过化学方法合成了一种drd2选择性激动剂。
2.细胞培养
人肾上皮细胞293t培养在含有10%胎牛血清(fbs)的dmem培养液中,培养皿置于37℃,5%co2条件下进行培养。待细胞贴满培养皿后,用移液枪吸走培液,pbs1ml缓慢清洗去除多余的血清,加入800μl0.25%胰酶,将细胞置于恒温箱中消化2min,取出细胞于显微镜下观察,细胞变圆并在皿底自由游动,加入2ml含有血清的培养液终止消化,用1ml枪轻轻吹打细胞使之分散成为单细胞,最后按照实验需要继续传代培养或者进一步实验。
3.细胞转染
转染前一天,10厘米培养皿中长满的293t细胞以1:4分到6厘米培养皿中进行传代。20小时后,待细胞密度达到50%-70%时,准备转染。取500μl150mmnacl于干净ep管中,向其中加入3μg质粒,同时,pei以质粒的4倍量加入到其中,充分混匀。室温孵育20分钟。500μl转染溶液悬空滴加到培养皿中,轻轻摇动使之混匀。
4.基于荧光素酶的camp报告基因检测
第一天,6厘米培养皿以3μg多巴胺受体、3μgglo质粒和24μlpei进行转染。第二天,消化长满的细胞,以一个长满细胞的6厘米培养皿细胞量铺一个384孔板,每孔30μl培液。第三天,加药检测。首先,从细胞房中拿出384孔板去除培液,每孔加入20ul药物缓冲液。从左到右依次加入10μl不同的药物,保证药物终浓度由下到上梯度递减,每种处理三个重复,最后,每孔加入10ul荧光素酶底物,上机检测。
5.β-arrestin招募实验
第一天,6厘米培养皿以3μg多巴胺受体tango质粒以及12μlpei进行转染。第二天,消化长满的细胞,以一个长满细胞的6厘米培养皿细胞量铺一个384孔板,每孔30μl培液。第三天,细胞房超净工作台中从左到右依次向384孔板的细胞中加入10μl不同的药物,保证药物终浓度由下到上梯度递减,每种处理三个重复。第四天,从细胞房中拿出384孔板去除培液,每孔加入20μl荧光素酶底物,上机检测。
6.酪氨酸氧化酶(th)免疫组织化学染色
c57bl/6j小鼠(9-11月,23-27克每只小鼠)分为9组,每组5-7只小鼠。1)对照,2)mptp,3)普拉克索(2.5mg/kg),4)(+)-(r)-i-4(2.5mg/kg),5)mptp+普拉克索(0.5mg/kg),6)mptp+普拉克索(2.5mg/kg),7)mptp+(+)-(r)-i-4(0.1mg/kg),8)mptp+(+)-(r)-i-4(0.5mg/kg),9)mptp+(+)-(r)-i-4(2.5mg/kg)。生理盐水、普拉克索或(+)-(r)-i-4按照每组的剂量每天一次腹腔注射小鼠三天,后经过共10天每天一次的mptp(30mg/kg)以及每组相应浓度的每天一次药物腹腔注射后,将其安乐死,经心脏灌注并断头处死,剖离小鼠脑部并用4%多聚甲醛固定。对老鼠脑部进行冠状切片,将后固定的脑在30%蔗糖中脱水并制备成40μm厚的切片。用0.1m生理盐水(ph=7.4)洗涤切片,0.3%h2o2温育1小时以淬灭内源性过氧化物酶活性,并用二氨基联苯胺(dab)组织化学试剂盒中提供的封闭缓冲液封闭1小时。接下来,将切片与酪氨酸羟化酶(th)抗体(1:1500)在4℃温育48小时。然后,将切片与第二生物素缀合的驴抗兔抗体(1:1000)孵育1小时后,再与抗生物素蛋白-hrp(1:1000)一起温育。最后,加入dab2分钟以显示th阳性免疫标记。用axioscan.z1(zeiss)拍摄切片,并使用image-proplus7.0(mediacybernetics)分析th阳性细胞计数。
实施例1一种多巴胺d2受体选择性激动剂的发现与鉴定
发明人基于d2受体结构信息,经过不断优化设计,通过化学方法合成了一种drd2选择性激动剂(图1)。发明人选取受体下游两条信号通路,g蛋白信号通路和β-arrestin信号通路,作为受体激动程度的指标,在细胞水平对其选择性进行验证。
结果(图2)显示,此激动剂在两条信号通路中的表现情况类似,无论是对于激活多巴胺受体下游g蛋白信号通路而言还是对于激活多巴胺受体下β-arrestin信号通路而言,此激动剂都无法激活drd4,对drd3都发挥部分激活作用,对drd2都发挥完全激活作用,且此激动剂在drd3中发挥作用时的ec50值是drd2中发挥作用时15倍左右,由此可见,此激动剂对drd2具有选择性,选择性是drd3的15倍左右。
实施例2多巴胺d2受体选择性激动剂在治疗帕金森病动物模型中的应用
发明人在mptp诱导的帕金森病小鼠模型中检测了drd2激动剂的神经元保护作用,与此同时,帕金森病药物普拉克索作为阳性对照。结果(图3)显示,此激动剂可以在大脑黑质区缓解由mptp诱导的多巴胺合成酶酪氨酸羟化酶(th)的表达量减少,揭示了其在黑质区对多巴胺能神经元有保护作用,且其作用效果优于目前临床上用于治疗帕金森病的药物普拉克索(drd2/drd3/drd4激动剂),这进一步暗示了此drd2激动剂具有更有效治疗帕金森病的潜能。
实施例31-(((1-(苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-1)盐酸盐的制备
步骤1:将原料2-乙酰基苯并呋喃ii-1(120mg,0.75mmol)溶于无水四氢呋喃(15ml),依次加入1-(氨基甲基)环己醇(116mg,0.90mmol)和乙酸(90mg,1.5mmol)。升温至60℃,反应24小时后,加入三乙酰氧基硼氢化钠(317mg,1.5mmol),继续反应2小时。将反应液冷却至室温,加入甲醇(5ml),搅拌10分钟。减压蒸除溶剂,剩余固体用flash柱层析分离纯化(0-5%甲醇/二氯甲烷),得到无色油状物i-1(52mg,收率25%)。
步骤2:将上述步骤1所得化合物i-1(52mg)溶于甲醇和二氯甲烷混合溶剂(1:10,5ml)中,加入2m盐酸乙醚溶液(2ml)。搅匀2-5分钟后将溶剂减压蒸除,得到白色固体i-1盐酸盐(58mg,收率98%)。1hnmr(800mhz,cd3od)δ7.66(d,j=7.8hz,1h),7.55(d,j=8.3hz,1h),7.39–7.36(m,1h),7.29(t,j=7.5hz,1h),7.08(s,1h),4.78(q,j=6.9hz,1h),2.92和2.88(abq,j=12.8hz,2h),1.82(d,j=7.0hz,3h),1.67–1.57(m,4h),1.55–1.39(m,5h),1.32–1.26(m,1h)。hrms(esi)c17h24no2+[m+h]+计算值:274.1802,实测值:274.1806。
实施例41-(((1-(7-羟基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-2)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“2-乙酰基-7-羟基苯并呋喃ii-2”,其余所需原料,试剂及制备方法同实施例3,得白色固体化合物(i-2)盐酸盐。1hnmr(600mhz,cd3od)δ7.02–6.96(m,2h),6.91(s,1h),6.70(dd,j=7.3,1.5hz,1h),4.65(q,j=7.0hz,1h),2.84–2.78(m,2h),1.71(d,j=7.0hz,3h),1.57–1.47(m,4h),1.46–1.29(m,5h),1.24–1.19(m,1h).hrms(esi)c17h24no3+[m+h]+计算值:290.1751,实测值:290.1749。
实施例51-(((1-(7-甲氧基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-3)盐酸盐的制备
步骤1:将2-乙酰基-7-羟基苯并呋喃(200mg,1.1mmol),碘甲烷(242mg,1.7mmol)和碳酸钾(314mg,2.3mmol)置于微波反应瓶中,加入n,n-二甲基甲酰胺(15ml)。该混合物于微波反应器中加热到110℃,反应40分钟。待反应冷却至室温,加水稀释,乙酸乙酯萃取,饱和食盐水洗后分层,将有机层溶剂减压蒸除,剩余物用flash柱层析分离纯化(0-50%乙酸乙酯/石油醚),得到浅黄色固体ii-3(170mg,收率79%)。1hnmr(800mhz,cdcl3)δ7.49(d,j=3.4hz,1h),7.27(dd,j=7.9,0.8hz,1h),7.22(dd,j=10.3,5.4hz,1h),6.95(d,j=7.4hz,1h),4.03(s,3h),2.63(s,3h).hrms(esi)c11h11o3+[m+h]+计算值:191.0703,实测值:191.0697。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-甲氧基苯并呋喃-2-基)乙-1-酮ii-3”,其余所需原料,试剂及制备方法同实施例3,得白色固体化合物(i-3)的盐酸盐。1hnmr(800mhz,cd3od)δ7.23–7.19(m,2h),7.06(s,1h),6.96(dd,j=6.3,2.6hz,1h),4.78(q,j=7.0hz,1h),3.98(s,3h),2.92和2.88(abq,j=12.7hz,2h),1.82(d,j=7.0hz,3h),1.66–1.57(m,4h),1.54–1.39(m,5h),1.33–1.27(m,1h).hrms(esi)c18h26no3+[m+h]+计算值:304.1907,实测值:304.1907。
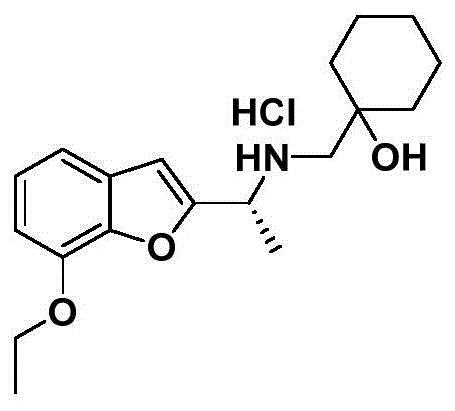
实施例61-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-4)盐酸盐的制备
步骤1:将实施例5步骤1中原料“碘甲烷”替换成“碘乙烷”,其余所需原料,试剂及制备方法同实施例5,得黄色固体化合物ii-4。1hnmr(800mhz,cdcl3)δ7.48(s,1h),7.26(dd,j=7.6,1.0hz,1h),7.20(dd,j=10.4,5.4hz,1h),6.94(d,j=7.8hz,1h),4.28(q,j=7.0hz,2h),2.63(s,3h),1.53(t,j=7.0hz,3h).hrms(esi)c12h13o3+[m+h]+计算值:205.0859,实测值:205.0867。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,其余所需原料,试剂及制备方法同实施例3,得白色固体化合物(i-4)盐酸盐。1hnmr(600mhz,cd3od)δ7.21–7.17(m,2h),7.04(s,1h),6.94(dd,j=6.9,2.0hz,1h),4.76(q,j=7.0hz,1h),4.24(q,j=7.0hz,2h),2.89和2.88(abq,j=12.7hz,2h),1.81(d,j=7.0hz,3h),1.67–1.57(m,4h),1.55–1.49(m,1h),1.48–1.39(m,7h),1.35–1.27(m,1h).hrms(esi)c19h28no3+[m+h]+计算值:318.2064,实测值:318.2073。
实施例71-(((1-(7-丙氧基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-5)盐酸盐的制备
步骤1:将实施例5步骤1中原料“碘甲烷”替换成“1-溴丙烷”,其余所需原料,试剂及制备方法同实施例5,得黄色固体化合物ii-5。1hnmr(800mhz,cdcl3)δ7.48(d,j=3.5hz,1h),7.27–7.24(m,1h),7.21–7.18(m,1h),6.94(dd,j=7.8,0.6hz,1h),4.17(t,j=6.6hz,2h),2.63(s,3h),1.97–1.87(m,2h),1.10(t,j=7.4hz,3h).hrms(esi)c13h15o3+[m+h]+计算值:219.1016,实测值:219.1012。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-丙氧基苯并呋喃-2-基)乙-1-酮ii-5”,其余所需原料,试剂及制备方法同实施例3,得浅黄色固体化合物(i-5)盐酸盐。1hnmr(800mhz,cd3od)δ7.23–7.15(m,2h),7.05(s,1h),6.94(dd,j=7.4,1.5hz,1h),4.78(q,j=6.9hz,1h),4.14(t,j=6.4hz,2h),2.92和2.89(abq,j=12.6hz,2h),1.89–1.84(m,2h),1.82(d,j=7.0hz,3h),1.66–1.57(m,4h),1.54–1.38(m,5h),1.32–1.27(m,1h),1.09(t,j=7.5hz,3h).hrms(esi)c20h30no3+[m+h]+计算值:332.2220,实测值:332.2211。
实施例81-(((1-(7-丁氧基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-6)盐酸盐的制备
步骤1:将2-乙酰基-7-羟基苯并呋喃(168mg,0.95mmol),1-溴丁烷(196mg,1.4mmol)和碳酸钾(395mg,2.9mmol)置于反应瓶中,加入乙腈(20ml)。加热到80℃,反应过夜。待反应冷却至室温,加水稀释,乙酸乙酯萃取,饱和食盐水洗后分层,将有机层溶剂减压蒸除,剩余物用flash柱层析分离纯化(0-30%乙酸乙酯/石油醚),得到浅黄色固体ii-6(193mg,收率87%)。1hnmr(800mhz,cdcl3)δ7.48(s,1h),7.26–7.25(m,1h),7.20(t,j=7.8hz,1h),6.94(d,j=7.5hz,1h),4.21(t,j=6.6hz,2h),2.63(s,3h),1.91–1.85(m,2h),1.58–1.54(m,2h),1.01(t,j=7.4hz,3h).hrms(esi)c14h17o3+[m+h]+计算值:233.1172,实测值:233.1163。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-丁氧基苯并呋喃-2-基)乙-1-酮ii-6”,其余所需原料,试剂及制备方法同实施例3,得白色固体化合物(i-6)盐酸盐。1hnmr(800mhz,cd3od)δ7.21–7.17(m,2h),7.05(s,1h),6.94(dd,j=7.4,1.5hz,1h),4.78(q,j=6.9hz,1h),4.18(t,j=6.3hz,2h),2.92和2.89(abq,j=12.7hz,2h),1.85–1.79(m,5h),1.66–1.58(m,4h),1.58–1.54(m,2h),1.54–1.39(m,5h),1.32–1.27(m,1h),1.01(t,j=7.4hz,3h).hrms(esi)c18h26no3+[m+h]+计算值:346.2377,实测值:346.2381。
实施例91-(((1-(7-烯丙氧基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-7)盐酸盐的制备
步骤1:将实施例8步骤1中原料“1-溴丙烷”替换成“烯丙基溴”,反应温度“80℃”替换成“室温”,其余所需原料,试剂及制备方法同实施例8,得黄色油状物ii-7。1hnmr(800mhz,cdcl3)δ7.48(s,1h),7.28(d,j=7.8hz,1h),7.20(t,j=7.9hz,1h),6.96(d,j=7.8hz,1h),6.17–6.11(m,1h),5.50–5.46(m,1h),5.35–5.32(m,1h),4.80–4.78(m,2h),2.63(s,3h).hrms(esi)c13h13o3+[m+h]+计算值:217.0859,实测值:217.0866。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-烯丙氧基苯并呋喃-2-基)乙-1-酮ii-7”,其余所需原料,试剂及制备方法同实施例3,得浅黄色固体化合物(i-7)盐酸盐。1hnmr(800mhz,cd3od)δ7.25–7.19(m,2h),7.06(s,1h),6.98(dd,j=7.9,1.1hz,1h),6.18–6.11(m,1h),5.50–5.47(m,1h),5.33–5.30(m,1h),4.78(q,j=7.0hz,1h),4.77–4.75(m,2h),2.92和2.91(abq,j=12.7hz,2h),1.83(d,j=7.0hz,3h),1.67–1.58(m,4h),1.55–1.40(m,5h),1.37–1.29(m,1h).hrms(esi)c20h28no3+[m+h]+计算值:330.2064,实测值:330.2065。
实施例101-(((1-(7-(2-氟乙氧基)苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-8)盐酸盐的制备
步骤1:将2-乙酰基-7-羟基苯并呋喃(150mg,0.85mmol),2-氟乙醇(65mg,1.02mmol)和三苯基膦(335mg,1.28mmol)溶于四氢呋喃(10ml)。室温下缓慢滴加偶氮二甲酸二乙酯(222mg,1.28mmol),并于室温下反应过夜。减压蒸除溶剂,剩余物用flash柱层析分离纯化(0-30%乙酸乙酯/石油醚),得到浅黄色油状物ii-8(120mg,收率63%)。1hnmr(800mhz,cdcl3)δ7.48(d,j=3.4hz,1h),7.31(d,j=7.9hz,1h),7.21(t,j=7.9hz,1h),6.98(d,j=7.9hz,1h),4.85(dt,j=47.4,4.2hz,2h),4.49(dt,j=27.7,4.2hz,2h),2.63(s,3h).hrms(esi)c12h12fo3+[m+h]+计算值:223.0765,实测值:223.0770。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-(2-氟乙氧基)苯并呋喃-2-基)乙-1-酮ii-8”,其余所需原料,试剂及制备方法同实施例3,得黄色固体化合物(i-8)盐酸盐。1hnmr(800mhz,cd3od)δ7.25(dd,j=7.8,1.1hz,1h),7.21(t,j=7.8hz,1h),7.07(s,1h),6.98(dd,j=7.9,1.1hz,1h),4.82–4.81(m,1h),4.79(q,j=7.0hz,1h),4.76–4.74(m,1h),4.46–4.44(m,1h),4.42–4.39(m,1h),2.92和2.88(abq,j=12.7hz,2h),1.82(d,j=7.0hz,3h),1.66–1.57(m,4h),1.54–1.38(m,5h),1.32–1.26(m,1h).hrms(esi)c19h27fno3+[m+h]+计算值:336.1969,实测值:336.1977。
实施例111-(((1-(7-异丙氧基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-9)盐酸盐的制备
步骤1:将实施例8步骤1中原料“1-溴丙烷”替换成“2-溴丙烷”,其余所需原料,试剂及制备方法同实施例8,得黄色油状物ii-9。1hnmr(800mhz,cdcl3)δ7.48(s,1h),7.27–7.26(m,1h),7.19(t,j=7.9hz,1h),6.96(d,j=7.8hz,1h),4.87–4.79(m,1h),2.63(s,3h),1.44(d,j=6.1hz,6h).hrms(esi)c13h15o3+[m+h]+计算值:219.1016,实测值:219.1006。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-异丙氧基苯并呋喃-2-基)乙-1-酮ii-9”,其余所需原料,试剂及制备方法同实施例3,得浅黄色固体化合物(i-9)盐酸盐。1hnmr(800mhz,cd3od)δ7.21–7.16(m,2h),7.05(s,1h),6.95(dd,j=7.7,1.3hz,1h),4.83(hept,j=6.1hz,1h),4.78(q,j=6.9hz,1h),2.93和2.89(abq,j=12.8hz,2h),1.82(d,j=7.0hz,3h),1.67–1.57(m,4h),1.54–1.39(m,5h),1.37(t,j=6.3hz,6h),1.33–1.27(m,1h).hrms(esi)c20h30no3+[m+h]+计算值:332.2220,实测值:332.2225。
实施例121-(((1-(7-(环丙甲氧基)苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-10)盐酸盐的制备
步骤1:将实施例8步骤1中原料“1-溴丙烷”替换成“溴甲基环丙烷”,其余所需原料,试剂及制备方法同实施例8,得黄色固体ii-10。1hnmr(800mhz,cdcl3)δ7.48(s,1h),7.27–7.26(m,1h),7.19(t,j=7.9hz,1h),6.94(d,j=7.8hz,1h),4.05(d,j=7.0hz,2h),2.64(s,3h),1.41–1.36(m,1h),0.70–0.65(m,2h),0.43–0.38(m,2h).hrms(esi)c14h14o3+[m+h]+计算值:231.1016,实测值:231.1025。
步骤2:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-(环丙甲氧基)苯并呋喃-2-基)乙-1-酮ii-10”,其余所需原料,试剂及制备方法同实施例3,得浅黄色固体化合物(i-10)盐酸盐。1hnmr(800mhz,cd3od)δ7.20(dd,j=7.9,1.2hz,1h),7.17(t,j=7.8hz,1h),7.05(s,1h),6.91(dd,j=7.7,1.2hz,1h),4.79(q,j=6.9hz,1h),4.04–3.98(m,2h),2.92和2.88(abq,j=12.7hz,2h),1.82(d,j=7.0hz,3h),1.67–1.58(m,4h),1.54–1.39(m,5h),1.33–1.27(m,1h),0.66–0.62(m,2h),0.40–0.37(m,2h).hrms(esi)c21h30no3+[m+h]+计算值:344.2220,实测值:344.2230。
实施例13n-苯甲基-1-(7-乙氧基苯并呋喃-2-基)乙胺(i-11)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“苯甲胺”,其余所需原料,试剂及制备方法同实施例3,得白色固体化合物(i-11)盐酸盐。1hnmr(800mhz,cd3od)δ7.47–7.41(m,5h),7.23–7.18(m,2h),7.07(s,1h),6.95(dd,j=7.6,1.3hz,1h),4.79(q,j=6.9hz,1h),4.25(q,j=7.0hz,2h),4.20和4.08(abq,j=13.2hz,2h),1.83(d,j=7.0hz,3h),1.47(t,j=7.0hz,3h).hrms(esi)c19h22no2+[m+h]+计算值:296.1645,实测值:296.1639。
实施例142-((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)乙醇(i-12)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“乙醇胺”,其余所需原料,试剂及制备方法同实施例3,得浅黄色油状物(i-12)盐酸盐。1hnmr(800mhz,cd3od)δ7.21–7.16(m,2h),7.04(s,1h),6.92(dd,j=7.6,1.2hz,1h),4.79(q,j=6.9hz,1h),4.23(q,j=7.0hz,2h),3.83–3.75(m,2h),3.12–3.08(m,1h),3.05–3.00(m,1h),1.81(d,j=7.0hz,3h),1.45(t,j=7.0hz,3h).hrms(esi)c14h20no3+[m+h]+计算值:250.1438,实测值:250.1428。
实施例151-((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)-2-甲基-2-丙醇(i-13)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“1-氨基-2-甲基-2-丙醇”,其余所需原料,试剂及制备方法同实施例3,得黄色固体(i-13)盐酸盐。1hnmr(800mhz,cd3od)δ7.22–7.17(m,2h),7.05(s,1h),6.93(dd,j=7.6,1.4hz,1h),4.79(q,j=6.9hz,1h),4.23(q,j=7.0hz,2h),2.92和2.89(abq,j=12.5hz,2h),1.82(d,j=7.0hz,3h),1.45(t,j=7.0hz,3h),1.27(s,3h),1.25(s,3h).hrms(esi)c16h24no3+[m+h]+计算值:278.1751,实测值:278.1753。
实施例161-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)环丙醇(i-14)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“1-(氨基甲基)环丙醇”,其余所需原料,试剂及制备方法同实施例3,得黄色固体(i-14)盐酸盐。1hnmr(800mhz,cd3od)δ7.21–7.16(m,2h),7.03(s,1h),6.93(dd,j=7.4,1.5hz,1h),4.83(q,j=7.0hz,1h),4.23(q,j=7.0hz,2h),3.08和3.04(abq,j=13.2hz,2h),1.82(d,j=6.9hz,3h),1.45(t,j=7.0hz,3h),0.89–0.83(m,2h),0.73–0.70(m,1h),0.67–0.63(m,1h).hrms(esi)c16h22no3+[m+h]+计算值:276.1594,实测值:276.1597。
实施例171-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)环丁醇(i-15)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“1-(氨基甲基)环丁醇”,其余所需原料,试剂及制备方法同实施例3,得棕色固体(i-15)盐酸盐。1hnmr(800mhz,cd3od)δ7.22–7.18(m,2h),7.04(s,1h),6.95(dd,j=7.2,1.6hz,1h),4.77(q,j=7.0hz,1h),4.25(q,j=7.0hz,2h),3.11和3.07(abq,j=12.7hz,2h),2.17–2.06(m,4h),1.81(d,j=7.0hz,3h),1.76–1.70(m,1h),1.51–1.48(m,1h),1.46(q,j=7.3hz,3h).hrms(esi)c17h24no3+[m+h]+计算值:290.1751,实测值:290.1756。
实施例181-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)环戊醇(i-16)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“1-(氨基甲基)环戊醇”,其余所需原料,试剂及制备方法同实施例3,得黄色固体(i-16)盐酸盐。1hnmr(800mhz,cd3od)δ7.21–7.17(m,2h),7.05(s,1h),6.93(dd,j=7.6,1.4hz,1h),4.80(q,j=7.0hz,1h),4.23(q,j=7.0hz,2h),3.04和3.01(abq,j=12.6hz,2h),1.85–1.79(m,5h),1.77–1.72(m,2h),1.66–1.55(m,4h),1.45(t,j=7.0hz,3h).hrms(esi)c18h26no3+[m+h]+计算值:304.1907,实测值:304.1916。
实施例191-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)环庚醇(i-17)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“1-(氨基甲基)环庚醇”,其余所需原料,试剂及制备方法同实施例3,得黄色固体(i-17)盐酸盐。1hnmr(800mhz,cd3od)δ7.21–7.17(m,2h),7.05–7.03(m,1h),6.94(dt,j=7.5,1.7hz,1h),4.77(q,j=6.4hz,1h),4.24(q,j=7.0hz,2h),2.90和2.87(abq,j=12.7hz,2h),1.81(d,j=7.0hz,3h),1.73–1.56(m,8h),1.52–1.47(m,2h),1.46(t,j=7.0hz,3h),1.39–1.30(m,2h).hrms(esi)c20h30no3+[m+h]+计算值:332.2220,实测值:332.2221。
实施例201-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)环辛醇(i-18)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“1-(氨基甲基)环辛醇”,其余所需原料,试剂及制备方法同实施例3,得黄色固体(i-18)盐酸盐。1hnmr(800mhz,cd3od)δ7.22–7.17(m,2h),7.05(s,1h),6.94(d,j=7.4hz,1h),4.78(q,j=6.9hz,1h),4.24(q,j=7.0hz,2h),2.90和2.89(abq,j=12.8hz,2h),1.82(d,j=7.0hz,3h),1.79–1.75(m,2h),1.65–1.58(m,8h),1.50–1.38(m,7h).hrms(esi)c21h32no3+[m+h]+计算值:346.2377,实测值:346.2376。
实施例214-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)四氢吡喃-4-醇(i-19)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“4-(氨基甲基)四氢吡喃-4-醇盐酸盐”,其余所需原料,试剂及制备方法同实施例3,得白色固体(i-19)盐酸盐。1hnmr(800mhz,cd3od)δ7.22–7.17(m,2h),7.07(s,1h),6.94(dd,j=7.5,1.4hz,1h),4.80(q,j=6.9hz,1h),4.23(q,j=7.0hz,2h),3.77–3.71(m,2h),3.70–3.64(m,2h),2.97和2.92(abq,j=12.8hz,2h),1.83(d,j=6.9hz,3h),1.69–1.61(m,2h),1.61–1.56(m,2h),1.45(t,j=7.0hz,3h).hrms(esi)c18h26no4+[m+h]+计算值:320.1856,实测值:320.1858。
实施例221-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)-4,4-二氟环己醇(i-20)盐酸盐的制备
将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“1-(7-乙氧基苯并呋喃-2-基)乙-1-酮ii-4”,“1-(氨基甲基)环己醇”替换成“1-(氨基甲基)-4,4-二氟环己醇盐酸盐”,其余所需原料,试剂及制备方法同实施例3,得白色固体(i-20)盐酸盐。1hnmr(800mhz,cd3od)δ7.22–7.17(m,2h),7.07(s,1h),6.93(dd,j=7.5,1.3hz,1h),4.80(q,j=6.9hz,1h),4.23(q,j=7.0hz,2h),3.00和2.94(abq,j=12.9hz,2h),2.14–2.03(m,2h),1.94–1.86(m,2h),1.83(d,j=7.0hz,3h),1.82–1.74(m,2h),1.67–1.59(m,2h),1.45(t,j=7.0hz,3h).hrms(esi)c19h26f2no3+[m+h]+计算值:354.1875,实测值:354.1883。
实施例231-((((1-(7-乙氧基苯并呋喃-2-基)甲基)胺基)甲基)环己醇(i-21)盐酸盐的制备
步骤1:将7-乙氧基苯并呋喃-2-甲酸(cas:206559-61-7,300mg,1.45mmol),2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐(830mg,2.18mmol)和碳酸氢钠(367mg,4.36mmol)混悬于n,n-二甲基甲酰胺(15ml),加入n,o-二甲基羟胺盐酸盐(170mg,1.75mmol),室温反应2小时。加水稀释,乙酸乙酯萃取,饱和食盐水洗后分层,将有机层溶剂减压蒸除,剩余物用flash柱层析分离纯化(0-3%甲醇/二氯甲烷),得到浅黄色固体ii-11(330mg,收率91%)。
1hnmr(800mhz,cdcl3)δ7.46(s,1h),7.23(d,j=7.8hz,2h),7.17(t,j=7.8hz,1h),6.89(d,j=7.8hz,1h),4.27(q,j=7.0hz,2h),3.84(s,3h),3.41(s,3h),1.50(t,j=7.0hz,3h)。
步骤2:将中间体ii-11(328mg,1.32mmol)溶于无水四氢呋喃(20ml),氩气保护,将反应液冷却至-78℃。缓慢滴加二异丁基氢化铝正己烷溶液(1.0m,2.6ml),并于-78℃温度下反应4小时。滴加饱和酒石酸钾钠水溶液(2ml)淬灭反应,升至室温反应搅拌1小时,抽滤,滤液用乙酸乙酯萃取,饱和食盐水洗后,将有机层溶剂浓缩,剩余物用flash柱层析分离纯化(0-30%乙酸乙酯/石油醚),得到浅黄色固体ii-12(165mg,收率66%)。1hnmr(800mhz,cdcl3)δ9.91(s,1h),7.54(s,1h),7.30(dd,j=7.9,1.0hz,1h),7.23(t,j=7.9hz,1h),6.97(dd,j=7.9,1.0hz,1h),4.28(q,j=7.0hz,2h),1.52(t,j=7.0hz,3h)。
步骤3:将实施例3步骤1中原料“2-乙酰基苯并呋喃ii-1”替换成“7-乙氧基苯并呋喃-2-甲醛ii-12”,其余所需原料,试剂及制备方法同实施例3,得白色固体(i-21)盐酸盐。1hnmr(800mhz,cd3od)δ7.21–7.17(m,2h),7.07(s,1h),6.93(dd,j=7.6,1.3hz,1h),4.48(s,2h),4.24(q,j=7.0hz,2h),3.02(s,2h),1.69–1.59(m,4h),1.56–1.51(m,1h),1.50–1.44(m,7h),1.36–1.31(m,1h).hrms(esi)c18h26no3+[m+h]+计算值:304.1907,实测值:304.1916。
实施例241-((((1-(7-乙氧基苯并呋喃-2-基)甲基)(甲基)胺基)甲基)环己醇(i-22)盐酸盐的制备
将中间体i-21(34mg,0.11mmol)溶于乙腈(15ml),依次加入碳酸钾(46mg,0.34mmol)和碘甲烷(24mg,0.17mmol),升至80℃反应过夜。将溶剂减压蒸除,剩余物用flash柱层析分离纯化(0-3%甲醇/二氯甲烷),得到浅黄色油状物(30mg,收率84%)。上述油状物按照实施例3步骤2的盐酸盐制备方法得黄色固体(i-22)盐酸盐。1hnmr(800mhz,cd3od)δ7.25–7.19(m,3h),6.97(dd,j=7.7,1.2hz,1h),4.72–4.61(m,2h),4.25(q,j=7.0hz,2h),3.45和3.14(abq,j=13.6hz,2h),3.09(s,3h),1.72–1.66(m,2h),1.65–1.49(m,4h),1.48–1.45(m,4h),1.40–1.36(m,1h),1.33–1.26(m,2h).hrms(esi)c19h28no3+[m+h]+计算值:318.2064,实测值:318.2057。
实施例251-((((1-(7-乙氧基苯并呋喃-2-基)甲基)(丙基)胺基)甲基)环己醇(i-23)盐酸盐的制备
将中间体i-21(30mg,0.10mmol)溶于无水四氢呋喃(10ml),依次加入丙醛(57mg,1mmol),乙酸(6mg,0.1mmol)和三乙酰氧基硼氢化钠(42mg,0.2mmol),室温反应1小时。将溶剂减压蒸除,剩余物用flash柱层析分离纯化(0-30%乙酸乙酯/石油醚),得到浅黄色油状物(20mg,收率59%)。上述油状物按照实施例3步骤2的盐酸盐制备方法得黄色固体(i-23)盐酸盐。1hnmr(800mhz,cd3od)δ7.26–7.18(m,3h),6.96(dd,j=7.7,1.1hz,1h),4.74–4.67(m,2h),4.25(q,j=7.0hz,2h),3.41和3.18(abq,j=13.8hz,2h),3.29–3.21(m,2h),1.94–1.88(m,2h),1.73–1.60(m,4h),1.56–1.48(m,3h),1.46(t,j=7.0hz,3h),1.44–1.38(m,1h),1.34–1.28(m,2h),1.02(t,j=7.4hz,3h).hrms(esi)c21h32no3+[m+h]+计算值:346.2377,实测值:346.2377。
实施例261-(((1-(7-乙氧基苯并呋喃-2-基)乙基)胺基)甲基)环己醇(i-4)的手性拆分
化合物i-4采用手性高效液相色谱法制备分离,具体实验条件如下:使用chiralpakod-h手性制备分离柱(od-5a-10um-300g自装柱,25cm×5.0cm),流动相为正己烷/异丙醇=90/10(体积比),流速为60ml/min,检测波长λ为254nm,温度为35℃。i-4右旋异构体(+)-i-4为第一流出组分,i-4左旋异构体(-)-i-4为第二流出组分。将上述i-4右旋或左旋异构体按照实施例3步骤2的盐酸盐制备方法得(+)-i-4盐酸盐或(-)-i-4盐酸盐。
(+)-i-4盐酸盐表征:白色固体。1hnmr(800mhz,cd3od)δ7.22–7.18(m,2h),7.04(s,1h),6.94(dd,j=7.2,1.7hz,1h),4.77(q,j=7.0hz,1h),4.24(q,j=7.0hz,2h),2.91和2.89(abq,j=12.7hz,2h),1.82(d,j=7.0hz,3h),1.67–1.57(m,4h),1.55–1.50(m,1h),1.48–1.41(m,7h),1.33–1.29(m,1h).hrms(esi)c19h28no3+[m+h]+计算值:318.2064,实测值:318.2060。[α]d20+0.4(c1.0,meoh)。x-ray单晶衍射验证其为r构型。
(-)-i-4盐酸盐表征:白色固体。1hnmr(800mhz,cd3od)δ7.21–7.18(m,2h),7.03(s,1h),6.94(dd,j=7.1,1.8hz,1h),4.75(q,j=7.2hz,2h),4.24(q,j=7.0hz,2h),2.91–2.86(m,2h),1.81(d,j=6.9hz,3h),1.68–1.57(m,4h),1.55–1.50(m,1h),1.48–1.41(m,7h),1.33–1.28(m,1h).hrms(esi)c19h28no3+[m+h]+计算值:318.2064,实测值:318.2058。[α]d20-0.3(c1.0,meoh)。
讨论
由于d2类受体的高度相似性,设计drd2选择性的激动剂或拮抗剂显得尤为困难,本发明以结构为导向通过化学方法合成了drd2选择性激动剂,以帕金森病为例揭示了其在疾病治疗中的作用。
临床上,多巴胺受体激动剂被认为是帕金森病患者的首选,用以减缓帕金森病的进展速度。目前在人体中使用的所有多巴胺受体激动剂均同时靶向d2样受体的三个亚型,因而具有许多副作用,如运动障碍,幻觉和强迫行为。最近的研究表明,drd4是一种主要的d2样受体亚型,参与谷氨酸能传递的多巴胺能抑制。因此,多巴胺激动剂诱导的运动障碍与帕金森病治疗中drd4的激活密切相关。另一方面,drd3在腹侧纹状体和其他边缘区域富集,暗示其可能在心理和情绪功能中发挥作用。此外,drd3不限于腹侧纹状体,其在整个纹状体中显示出与drd2类似的广泛分布,也暗示了其在运动功能中的可能作用。还有人提出drd3的激活与临床试验中运动障碍的发生有关。因而,迫切需要寻找一种drd2选择性激动剂以降低药物副作用,这对于治疗帕金森病而言至关重要。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!