一种光学纯度的(R)-4-丙基-二氢呋喃-2-酮的制备方法与流程
本发明涉及一种光学纯度的(r)-4-丙基-二氢呋喃-2-酮的制备方法,属于化学原料药中间体制备技术领域。
背景技术:
(r)-4-丙基-二氢呋喃-2-酮是新型抗癫痫药物布瓦西坦的一个关键中间体,结构式如式1所示,布瓦西坦(brivaracetam)是比利时优时比(ucb)有限公司研制的第三代抗癫痫药物。结构式如式2所示:
式1
式2
布瓦西坦分别于2016年1月14日和2016年2月18日货的欧洲药品管理局(ema)与美国食品药品管理局(fda)的上市批准,主要用于16岁患者及以上的部分性癫痫发作的辅助治疗,商品名为briviact®。作为第三代抗癫痫药物,布瓦西坦是左乙拉西坦的结构衍生物,与上一代药物左乙拉西坦相比,布瓦西坦药有相似的化学结构和作用机制,是自2013年以来fda批准的首个治疗部分性癫痫发作的抗癫痫药物。布瓦西坦是一种高选择性高亲和性的突出小泡蛋白2a配体,通过与其结合来影响突触功能,同时还可以作为一种高亲和性的钠通道抑制剂来提高抗癫痫活性。目前布瓦西坦良好的药理学活性、临床疗效及安全性已经展现出良好的应用和市场前景,有望成为继左乙拉西坦之后抗癫痫领域又一重磅药物。
目前布瓦西坦的主要合成路线如下反应式所示:
而化合物1就成为了制备布瓦西坦的关键中间体,化合物1的合成目前主要有酶法、手性源法及拆分法,具体路线如下所示:
路线一,以丙基丙二酸二甲酯(6)为起始原料,经过与溴乙酸叔丁酯的取代、脱羧反应得到中间体3,然后通过来自枯草芽孢杆菌的蛋白酶c催化拆分得到光学纯度的中间体8,中间体8在经过还原、合环得到化合物1。本路线手心中性的建立采用了酶催化拆分法,可进行公斤及放大,但合成路线较长,物料利用率较低。
路线二,以(r)-环氧氯丙烷(10)为原料,在甲醇钠作用下与丙二酸二乙酯反应得到中间体11,11与乙基溴化镁选择性开环得到化合物12,然后在氯化锂作用下水解脱羧得到目标化合物1。该路线原料便宜易得,但每一步反应都需要柱层析分离纯化,工艺不适合工业化生产。
路线三,以乙醛酸和正戊醛为原料,在吗啉的作用下合环得到中间体15,然后经硼氢化钠脱去羟基得到4-丙基-2-呋喃酮(16),再经钯碳催化还原双键得到消旋体17,消旋体17经过s-苯乙胺拆分得到目标化合物1。该路线原料廉价易得,后处理简单,但是拆分步骤收率较低,物料浪费严重。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种绿色、易于工业化放大、成本低的光学纯度的布瓦西坦中间体(r)-4-丙基-二氢呋喃-2-酮的制备方法。
本发明所采用的技术方案是:
一种光学纯度的(r)-4-丙基-二氢呋喃-2-酮的制备方法,其合成路线如下:
将化合物4-丙基-2-呋喃酮利用不对称还原得到化合物1(r)-4-丙基-二氢呋喃-2-酮,所述化合物4-丙基-2-呋喃酮的化学纯度≥98%;
具体包括以下步骤:(1)将铜催化剂、手性双膦配体、碱和溶剂加入到的反应器中,在氮气保护下,降温至-25℃;
(2)将硅烷还原剂和溶剂混合,得到硅烷还原剂混合溶液,硅烷还原剂混合溶液匀速地滴加到反应器中,50-70分钟滴加完毕,保持-25℃搅拌2-3小时;
(3)将化合物4-丙基-2-呋喃酮的甲苯溶液在-25℃下,匀速滴加到步骤(2)的反应器中,1-2小时滴加完毕后继续保持-25℃反应5-6小时;
(4)待体系升温,升至18-35℃后,向反应器中加入乙酸乙酯,用质量浓度10%的盐酸水溶液洗涤有机相,再用水洗涤有机相,有机相用无水硫酸钠干燥,减压除去溶剂,高真空蒸馏收集56℃馏分得化合物1(r)-4-丙基-二氢呋喃-2-酮。
进一步的,铜催化剂、手性双膦配体、碱、硅烷还原剂、4-丙基-2-呋喃酮的质量比为4:1:12:143:83;步骤(1)中铜催化剂和溶剂的体积比为1:63;步骤(2)中硅烷还原剂和溶剂的体积比为1:2。
进一步的,步骤(3)中4-丙基-2-呋喃酮的甲苯溶液为每200g化合物4-丙基-2-呋喃酮溶于1l甲苯中。
进一步的,步骤(4)中加入乙酸乙酯的体积:步骤(1)和步骤(2)溶剂总体积为5:6;步骤(4)中加入乙酸乙酯、10%的盐酸水溶液、水洗涤有机相加入水的体积比为5:2:1,减压除去溶剂过程真空度为0.08-01mpa,减压除去溶剂的温度30-60℃,时间为1-3小时,高真空蒸馏真空度为0.5-1.0mmhg,蒸馏温度为50-60℃。
进一步的,所述步骤(1)和步骤(2)中的溶剂为甲苯、乙醚、四氢呋喃、正己烷或二氯甲烷。
进一步的,所述铜催化剂为氯化亚铜和氯化铜。
进一步的,所述手性双膦配体为s-binap、s-tol-binap或s-segphos。
进一步的,所述硅烷还原剂为聚甲基氢硅氧烷、甲基苯基含氢硅油、二苯基硅烷、三乙基硅烷或叔丁基二甲基硅烷。
进一步的,所述碱为叔丁醇钠、乙醇钠、甲醇钠或叔丁醇钾。
进一步的,所述化合物4-丙基-2-呋喃酮和手性双膦配体的摩尔比为200-1000:1。
本发明的有益效果:
本发明采用一种简单易行的不对称催化法合成目标产物。此方法较生物酶法、拆分外消旋体法、天然手性源合成法等其他方法具有优越地制备光学活性化合物的性能。本发明生产工艺简单,物料的利用率高,生产容量大;不需要得到混旋的4-丙基-二氢呋喃-2-酮再进行拆分,产率高,产物的分离较其他方法相比较更容易;发明中使用的催化剂配体简单易得且容易修饰;反应中的氢源自便宜、易得到、无毒害且安全的含氢硅烷还原剂,反应不需要高温高压,操作绿色环保。整个过程生产成本低,操作简单,易于工业化放大,最终产物光学纯度高。
附图说明
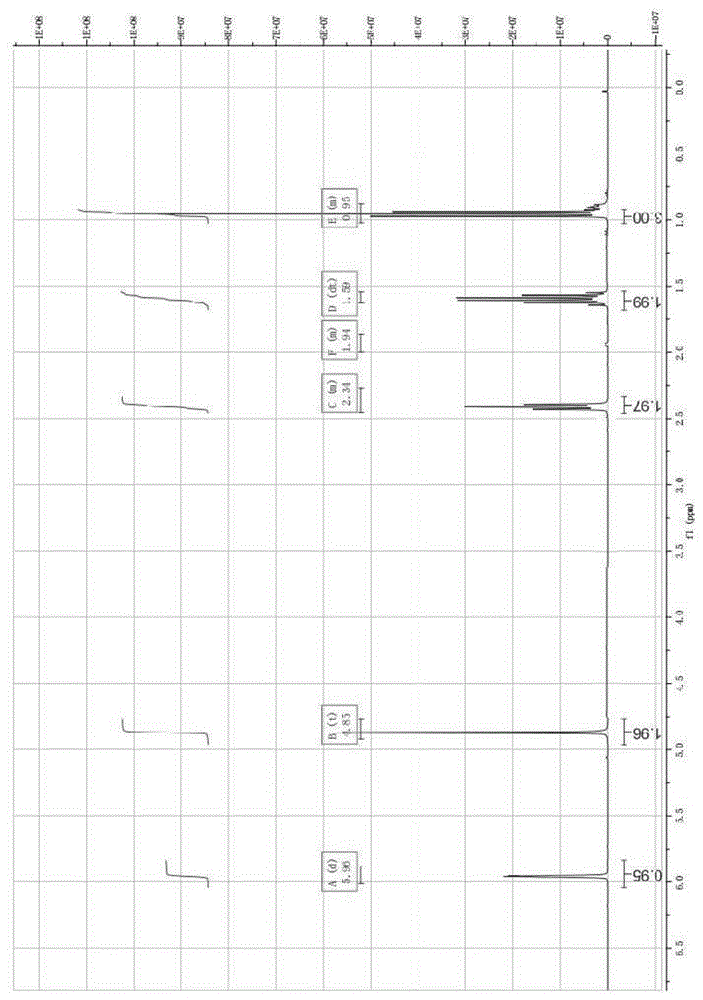
图1为本发明实施例1化合物4-丙基-2-呋喃酮的h-nmr谱图;
图2为本发明实施例1化合物4-丙基-2-呋喃酮的化学纯度gc谱图;
图3为本发明实施例1化合物(r)-4-丙基-二氢呋喃-2-酮的h-nmr谱图;
图4为本发明实施例1化合物(r)-4-丙基-二氢呋喃-2-酮的化学纯度gc谱图;
图5为本发明实施例1化合物(r)-4-丙基-二氢呋喃-2-酮的光学纯度gc谱图。
具体实施方式
以下实施例用于说明本发明,但这些实施例仅限于说明本发明的目的,而不以任何形式限制本发明的范围。
实施例1
将4.8g二水合氯化铜,1.2gs-binap,14g叔丁醇钠和300ml正己烷加入到3000ml的四口瓶中,在氮气保护下,将体系降温至-25℃,然后将聚甲基氢硅氧烷的正己烷溶液(171ml聚甲基氢硅氧烷溶于300ml正己烷)缓慢匀速地滴加到上述体系中,1小时滴加完毕,保持-25℃搅拌3小时。将化合物16(4-丙基-2-呋喃酮)的甲苯溶液(100g化合物16溶于500ml甲苯)在此温度下,缓慢匀速滴加到上述反应体系中,约2小时滴加完毕后继续保持此温度反应5小时。待体系升温至室温后,向反应系中加入500ml乙酸乙酯,用200ml10%的盐酸水溶液洗涤有机相,用100ml水洗涤有机相,有机相用无水硫酸钠干燥,减压除去溶剂,减压除去溶剂过程真空度为0.08-01mpa,减压除去溶剂的温度30-60℃,时间为1-3小时,高真空蒸馏(约0.5mmhg)收集56℃馏分得化合物1(r)-4-丙基-二氢呋喃-2-酮86g,收率84.6%,化学纯度98.2%,光学纯度96.3%。
表1化合物4-丙基-2-呋喃酮的化学纯度gc谱图检测条件
表2化合物4-丙基-2-呋喃酮的化学纯度gc谱图检测结果
表3化合物(r)-4-丙基-二氢呋喃-2-酮的化学纯度gc谱图检测条件
表4化合物(r)-4-丙基-二氢呋喃-2-酮的化学纯度gc谱图检测结果
表5化合物(r)-4-丙基-二氢呋喃-2-酮的光学纯度gc谱图检测条件
表6化合物(r)-4-丙基-二氢呋喃-2-酮的光学纯度gc谱图检测结果
实施例2
将4.8g二水合氯化铜,1.2gs-tol-binap,14g叔丁醇钠和300ml正己烷加入到3000ml的四口瓶中,在氮气保护下,将体系降温至-25℃,然后将聚甲基氢硅氧烷的正己烷溶液(171ml聚甲基氢硅氧烷溶于300ml正己烷)缓慢匀速地滴加到上述体系中,1小时滴加完毕,保持-25℃搅拌2小时。将化合物16(4-丙基-2-呋喃酮)的甲苯溶液(100g化合物16溶于500ml甲苯)在此温度下,缓慢匀速滴加到上述反应体系中,1小时滴加完毕,1小时滴加完毕后继续保持此温度反应5小时。待体系升温至室温后,向反应系中加入500ml乙酸乙酯,用200ml10%的盐酸水溶液洗涤有机相,用100ml水洗涤有机相,有机相用无水硫酸钠干燥,减压除去溶剂,减压除去溶剂过程真空度为0.08-01mpa,减压除去溶剂的温度30-60℃,时间为1-3小时,高真空蒸馏(约0.5mmhg)收集56℃馏分得化合物1(r)-4-丙基-二氢呋喃-2-酮87.5g,收率86.1%,化学纯度98.3%,光学纯度97.1%。
实施例3
将4.8g二水合氯化铜,1.2gs-segphos,14g叔丁醇钠和300ml正己烷加入到3000ml的四口瓶中,在氮气保护下,将体系降温至-25℃,然后将聚甲基氢硅氧烷的正己烷溶液(171ml聚甲基氢硅氧烷溶于300ml正己烷)缓慢匀速地滴加到上述体系中,约1小时滴加完毕,保持-25℃搅拌3小时。将化合物16(4-丙基-2-呋喃酮)的甲苯溶液(100g化合物16溶于500ml甲苯)在此温度下,缓慢匀速滴加到上述反应体系中,2小时滴加完毕后继续保持此温度反应5小时。待体系升温至室温后,向反应系中加入500ml乙酸乙酯,用200ml10%的盐酸水溶液洗涤有机相,用100ml水洗涤有机相,有机相用无水硫酸钠干燥,减压除去溶剂,减压除去溶剂过程真空度为0.08-01mpa,减压除去溶剂的温度30-60℃,时间为1-3小时,高真空蒸馏(约0.5mmhg)收集56℃馏分得化合物1(r)-4-丙基-二氢呋喃-2-酮85.5g,收率84.1%,化学纯度99.3%,光学纯度98.8%。
实施例4
将4.8g二水合氯化铜,1.2gs-segphos,14g乙醇钠和300ml正己烷加入到3000ml的四口瓶中,在氮气保护下,将体系降温至-25℃,然后将聚甲基氢硅氧烷的正己烷溶液(171ml聚甲基氢硅氧烷溶于300ml正己烷)缓慢匀速地滴加到上述体系中,约1小时滴加完毕,保持-25℃搅拌2小时。将化合物16(4-丙基-2-呋喃酮)的甲苯溶液(100g化合物16溶于500ml甲苯)在此温度下,缓慢匀速滴加到上述反应体系中,1小时滴加完毕后继续保持此温度反应5小时。待体系升温至室温后,向反应系中加入500ml乙酸乙酯,用200ml10%的盐酸水溶液洗涤有机相,用100ml水洗涤有机相,有机相用无水硫酸钠干燥,减压除去溶剂,减压除去溶剂过程真空度为0.08-01mpa,减压除去溶剂的温度30-60℃,时间为1-3小时,高真空蒸馏(约0.5mmhg)收集56℃馏分得化合物1(r)-4-丙基-二氢呋喃-2-酮85.3g,收率83.9%,化学纯度99.1%,光学纯度98.6%。
实施例5
将4.8g二水合氯化铜,1.2gs-segphos,14g乙醇钠和300ml正己烷加入到3000ml的四口瓶中,在氮气保护下,将体系降温至-25℃,然后将甲基苯基含氢硅油的正己烷溶液(180ml甲基苯基含氢硅油溶于300ml正己烷)缓慢匀速地滴加到上述体系中,约1小时滴加完毕,保持-25℃搅拌3小时。将化合物16(4-丙基-2-呋喃酮)的甲苯溶液(100g化合物16溶于500ml甲苯)在此温度下,缓慢匀速滴加到上述反应体系中,2小时滴加完毕后继续保持此温度反应5小时。待体系升温至室温后,向反应系中加入500ml乙酸乙酯,用200ml10%的盐酸水溶液洗涤有机相,用100ml水洗涤有机相,有机相用无水硫酸钠干燥,减压除去溶剂,减压除去溶剂过程真空度为0.08-01mpa,减压除去溶剂的温度30-60℃,时间为1-3小时,高真空蒸馏(约0.5mmhg)收集56℃馏分得化合物1(r)-4-丙基-二氢呋喃-2-酮85.2g,收率84.0%,化学纯度99.2%,光学纯度98.5%。
最后应说明的是,以上实施例仅用以说明本发明的技术方案,而非对其限制,尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中机构技术特征进行等同替换,而这些修改或者替换,并不使相应技术方案的本质脱离本发明实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!