一种具有抗消化系统癌症作用的霍山石斛多糖的制作方法
本发明涉及中草药多糖领域,具体涉及一种具有抗消化系统癌症作用的霍山石斛多糖。
背景技术:
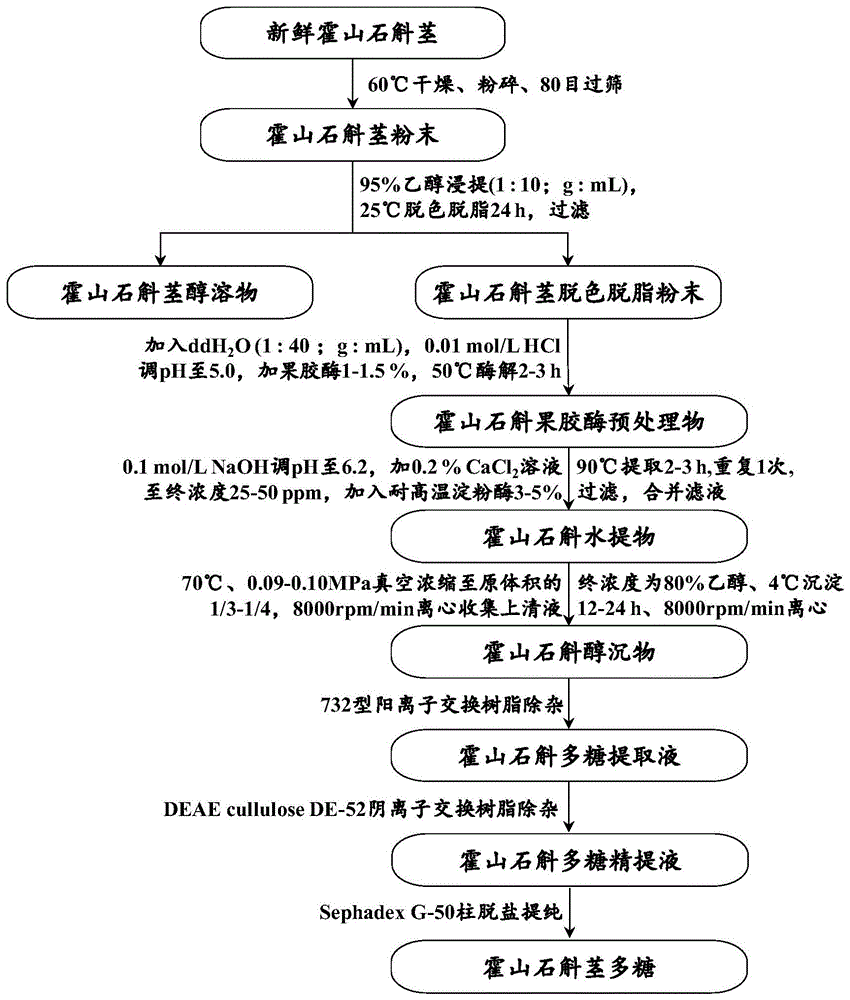
:癌症是严重威胁人类健康和生命安全的全球性疾病之一,其中胃癌、肝癌、结直肠癌、等消化系统癌症的发病率与死亡率呈逐年增长趋势,结直肠癌的发病率为10.2%,胃癌发病率为5.7%,分列全球新发癌症发病率的第三和第五位,而结直肠癌、胃癌、肝癌的死亡率分别为9.2%、8.2%和8.2%,分列全球癌症死亡率第二至四位。目前,包括消化系统癌症在内的癌症治疗仍以手术为主,辅以放、化疗,但存在治疗时间长、毒副作用大、治愈率低等诸多问题,且在治疗过程中,相当一部分患者中出现营养不良、体质羸弱、免疫力下降等症状,使临床治疗效果受到很大影响。中草药在抗癌抑癌方面具有多靶点、多途径、低毒性、作用久等诸多优势,特别是在癌症术后放化疗期间,中草药制剂有减毒、增效、增敏的作用,尤其对癌症晚期患者可起到缓解病情、提高生命质量、延长生命、甚至有抑制肿瘤生长的效果。因此,从中草药中发现抗癌活性化合物一直是抗癌新药研究领域的热点之一。霍山石斛(dendrobiumhuoshanense)属兰科石斛属多年生药用植物,是我国药用石斛中特有的传统名贵中药材,文献记载其药用历史超过2000年,具有“除痹下气,补五脏虚劳赢瘦,强阴,久服,厚肠胃”的功效。现代药理学研究表明,多糖是霍山石斛的主要活性成分,不仅具有增强机体免疫力、抗氧化、降血糖、保肝等功能,而且表现出显著的抗癌活性,显示霍山石斛多糖在抗癌新药开发方面的前景。多糖的化学结构是其抗癌活性的基础。虽然目前已有报道涉及霍山石斛多糖的结构鉴定,但目前与抗癌相关的霍山石斛多糖几乎都是从霍山石斛培养物或茎中提取的粗多糖,迄今不清楚霍山石斛抗癌活性多糖的化学结构,更缺乏适合的提取纯化工艺制备化学结构明确、组成成分均一的抗癌活性多糖,这些都限制了霍山石斛多糖抗癌新药的研发。针对上述问题,从霍山石斛的厚肠胃功效出发,借助有机波谱解析技术和生化分离技术从霍山石斛中制备出结构明确、具有抗消化系统癌症作用的均一活性多糖无疑对霍山石斛多糖抗癌药物研发具有重要意义。技术实现要素:为了解决霍山石斛在抗癌新药研发方面缺乏结构明确的活性成分,本发明的一个目的是提供一种具有抗消化系统癌症作用的霍山石斛多糖;本发明的另一个目的是提供一种具有抗消化系统癌症作用的霍山石斛多糖的制备方法。所述霍山石斛多糖为组成均一的乙酰化葡甘聚糖,由吡喃型葡萄糖(glcp)和吡喃型甘露糖(manp)按摩尔比1:3的比例组成,其可重复一级结构单元含有→4)-β-d-glcp-(1→、→4)-β-d-manp-(1→和→4)-3-o-acetyl-β-d-manp-(1→三种糖残基,所述三种糖残基的连接方式如下所示:其相对分子质量为2.59×105da,乙酰基含量为2.78%,所述霍山石斛多糖为首次从霍山石斛茎中分离获得。上述的一种具有抗消化系统癌症作用的霍山石斛多糖的制备操作步骤如下:(1)将新鲜的霍山石斛茎于60℃下烘干,粉碎,80目过筛;按料液比1g:10ml加入95%乙醇,在25℃、50rpm/min转速下搅拌处理24h,过滤,倾去乙醇,滤渣自然风干,得脱色脱脂的霍山石斛茎粉末;(2)将脱色脱脂的霍山石斛茎粉末按料液比1g:40ml与蒸馏水混合均匀,用0.1mol/l盐酸溶液(hcl)调ph值至5.0,按霍山石斛茎粉末质量分数1~1.5%的量加入果胶酶,在50℃、50rpm/min转速下搅拌酶解2~3h,得霍山石斛果胶酶预处理物;(3)向霍山石斛果胶酶预处理物中加入浓度0.1mol/l氢氧化钠溶液(naoh),调整ph值至6.2,再加入浓度0.2mol/l的氯化钙(cacl2)溶液至氯化钙终浓度为25~50ppm(溶质质量占全部溶液质量的百万分比),按霍山石斛茎粉末质量分数3~5%的量加入耐高温淀粉酶,在90℃、50rpm/min转速下搅拌提取2~3h,抽滤过滤,收集滤液,滤渣再按料液比1g:40ml加入蒸馏水,在90℃、50rpm/min转速下搅拌重复提取2~3h,抽滤过滤,收集滤液,合并两次滤液,得霍山石斛水提物;(4)将霍山石斛水提物于70.0℃、0.09~0.10mpa真空度下减压浓缩至原体积的1/3~1/4,于4℃、8000rpm/min下离心20min,收集上清液,加入适量95%的乙醇,使乙醇的终浓度为80%,4℃下沉淀12~24h,于4℃、8000rpm/min下离心20min,收集沉淀,得霍山石斛醇沉物;(5)取霍山石斛醇沉物,用适量去离子水溶解至多糖浓度为1mg/ml,按30~50g/l的添加量加入732型阳离子交换树脂,50rpm/min转速下搅拌处理2~3h,过滤,收集滤液,得霍山石斛多糖提取液;(6)取霍山石斛多糖提取液,上阴离子交换树脂deaecellulosede-52柱,以去离子水按2ml/min流速进行洗脱,通过苯酚-硫酸比色法检测洗脱液中多糖含量,收集含多糖洗脱液,得霍山石斛多糖精提液;(7)取霍山石斛多糖精提液,上sephadexg-50柱脱盐提纯,以去离子水按0.5ml/min流速进行洗脱,通过苯酚-硫酸比色法检测洗脱液中多糖含量,收集含多糖洗脱液,经真空冷冻干燥,得霍山石斛茎多糖。其中,步骤(2)所述果胶酶的酶活为40000u/g。其中,步骤(3)所述高温淀粉酶的酶活为40000u/g。所述霍山石斛多糖在制备抗胃癌、结直肠癌、肝癌等消化系统癌症药物中的应用。一种具有抗消化系统癌症作用的霍山石斛多糖对胃癌、结直肠癌、肝癌等癌症具有显著的抑癌活性,在动物实验中给予该多糖的荷瘤小鼠,其癌细胞生长被有效抑制,且其生命特征明显优于未给予该多糖的荷瘤小鼠。所述药物制剂形式是任何供药用的口服剂型,所述的药物制剂形式包括片剂、胶囊剂、口服液、颗粒剂、丸剂、散剂等。与现有技术相比,本发明的有益技术效果体现在以下方面:(1)本发明一种具有抗消化系统癌症作用的霍山石斛多糖,具有明确的化学结构,为霍山石斛多糖抗消化系统癌症作用的构效关系研究及抗消化系统癌症药物的研发奠定了可靠的物质基础。(2)本发明将果胶酶和耐高温淀粉酶水解果胶及淀粉的工艺与阳离子交换树脂和阴离子交换树脂去除蛋白质及脱盐纯化的工艺相结合制备具有抗消化系统癌症作用的霍山石斛多糖,工艺条件温和、操作简单、环境友好,获得的多糖纯度高、结构稳定,最大程度地保持了多糖抗消化系统癌症的活性,适合工业规模生产。(3)本发明一种具有抗消化系统癌症作用的霍山石斛多糖,具有良好的治疗消化系统癌症效果,能够显著抑制胃癌、肝癌、结直肠癌的生长与增殖,同时没有毒副作用,在抗消化系统癌症新药研发和应用方面有巨大的前景。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明一种具有抗消化系统癌症作用的霍山石斛多糖的制备工艺流程图;图2为本发明一种具有抗消化系统癌症作用的霍山石斛多糖的uv扫描图;图3为本发明一种具有抗消化系统癌症作用的霍山石斛多糖的hpgpc图;图4为本发明一种具有抗消化系统癌症作用的霍山石斛多糖的ft-ir图;图5为本发明一种具有抗消化系统癌症作用的霍山石斛多糖的单糖组成分析hplc图;注:a.单糖标准品pmp衍生物;b.霍山石斛多糖水解后pmp衍生物;1:甘露糖;2:pmp;3:鼠李糖;4:内标;5:葡萄糖;6:半乳糖;7:阿拉伯糖;图6为本发明一种具有抗消化系统癌症作用的霍山石斛多糖的甲基化分析图;注:a.霍山石斛多糖甲基化糖醇乙酸酯衍生物tic图;b.糖醇乙酸酯衍生物10.415min质谱图(2,3,6-me3-manp);c.糖醇乙酸酯衍生物11.485min质谱图(2,3,6-me3-glcp);图7为本发明一种具有抗消化系统癌症作用的霍山石斛多糖的nmr图;注:a.298k氢谱;b.328k氢谱;c.碳谱;d.hsqc谱;e.1h-1hcosy谱;f.hmbc谱;图8为本发明一种具有抗消化系统癌症作用的霍山石斛多糖对mfc胃癌荷瘤小鼠的抑瘤作用图;图9为本发明一种具有抗消化系统癌症作用的霍山石斛多糖对ct26.wt结直肠癌荷瘤小鼠的抑瘤作用图;图10为本发明一种具有抗消化系统癌症作用的霍山石斛多糖对hepa1-6肝癌荷瘤小鼠的抑瘤作用图。具体实施方式下面结合附图和具体的实施例,对发明作进一步的说明。本发明的特点和优点将随着描述而更清楚,但这些示例性的实施例仅仅用来说明本发明,并不对本发明的范围构成任何限制。实施例1参见图1,一种具有抗消化系统癌症作用的霍山石斛多糖的制备操作步骤如下:(1)将新鲜的霍山石斛茎于60℃下烘干,粉碎,80目过筛;按料液比1g:10ml加入95%乙醇,在25℃、50rpm/min转速下搅拌处理24h,过滤,倾去乙醇,滤渣自然风干,得脱色脱脂的霍山石斛茎粉末;(2)将脱色脱脂的霍山石斛茎粉末按料液比1g:40ml与蒸馏水混合均匀,用0.1mol/l盐酸溶液(hcl)调ph值至5.0,加入酶活为40000u/g,添加量为霍山石斛茎粉末质量分数1.5%的果胶酶,在50℃、50rpm/min转速下搅拌酶解2h,得霍山石斛果胶酶预处理物;(3)向霍山石斛果胶酶预处理物中加入浓度0.1mol/l氢氧化钠溶液(naoh),调整ph值至6.2,再加入浓度0.2mol/l的氯化钙(cacl2)溶液至氯化钙终浓度为50ppm(溶质质量占全部溶液质量的百万分比),同时加入酶活为40000u/g,添加量为霍山石斛茎粉末质量分数5%的耐高温淀粉酶,在90℃、50rpm/min转速下搅拌提取2h,抽滤过滤,收集滤液,滤渣再按料液比1g:40ml加入蒸馏水,在90℃、50rpm/min转速下搅拌重复提取2h,抽滤过滤,收集滤液,合并两次滤液,得霍山石斛水提物;(4)将霍山石斛水提物于70.0℃、0.10mpa真空度下减压浓缩至原体积的1/4,于4℃、8000rpm/min下离心20min,收集上清液,加入适量95%的乙醇,使乙醇的终浓度为80%,4℃下沉淀24h,于4℃、8000rpm/min下离心20min,收集沉淀,得霍山石斛醇沉物;(5)取霍山石斛醇沉物,用适量去离子水溶解至多糖浓度为1mg/ml,按50g/l的添加量加入732型阳离子交换树脂,50rpm/min转速下搅拌处理2h,过滤,收集滤液,得霍山石斛多糖提取液;(6)取霍山石斛多糖提取液,上阴离子交换树脂deaecellulosede-52柱,以去离子水按2ml/min流速进行洗脱,通过苯酚-硫酸比色法检测洗脱液中多糖含量,收集含多糖洗脱液,得霍山石斛多糖精提液;(7)取霍山石斛多糖精提液,上sephadexg-50柱脱盐提纯,以去离子水按0.5ml/min流速进行洗脱,通过苯酚-硫酸比色法检测洗脱液中多糖含量,收集含多糖洗脱液,经真空冷冻干燥,得霍山石斛茎多糖。所得霍山石斛多糖为组成均一的乙酰化葡甘聚糖,由吡喃型葡萄糖(glcp)和吡喃型甘露糖(manp)按摩尔比1:3的比例组成,其可重复一级结构单元含有→4)-β-d-glcp-(1→、→4)-β-d-manp-(1→和→4)-3-o-acetyl-β-d-manp-(1→三种糖残基,所述三种糖残基的连接方式如下所示:其相对分子质量为2.59×105da,乙酰基含量为2.78%。经上述步骤处理,一种具有抗消化系统癌症作用的霍山石斛多糖的提取率为13.12±1.23%。实施例2一种具有抗消化系统癌症作用的霍山石斛多糖的理化性质分析如下:(1)采用苯酚-硫酸法测定实施例1所得霍山石斛多糖的碳水化合物含量经测定,实施例1所得的霍山石斛多糖中碳水化合物含量为97.20±2.56%,所用仪器为v1100分光光度仪。(2)采用uv扫描测定实施例1所得的霍山石斛多糖的紫外吸收参见图2,经检测,所得到的霍山石斛多糖的uv扫描谱中无色素、蛋白和核酸的吸收峰,所用仪器为tu-1901型紫外可见分光光度仪,扫描范围为190~400nm。(3)采用碱性羟胺比色法测定实施例1所得的霍山石斛多糖的乙酰基含量测定原理是:多糖的乙酰基与羟胺反应生成乙酰肟羟酸,乙酰肟羟酸再与fe3+生成可溶性红色络合物羟肟酸铁,然后基于羟肟酸铁在500nm处具有特征吸收峰,用分光光度计测定羟肟酸铁在500nm处的吸光度求出乙酰基含量。将0.1mol/l的盐酸羟胺溶液和1.5mol/l的naoh溶液按1:1混合后,立即用移液管吸取7份10ml此溶液分别至50ml容量瓶中,再各吸取5ml含100、200、300、400、500μg乙酰基的β-五乙酰葡萄糖标准溶液及5ml含1mg多糖的溶液加到上述6个50ml容量瓶中,空白加去离子水,充分混匀,静置20min后分别加入2mol/l的hcl溶液5ml,混匀后静置20min,再分别滴加0.37mol/l的fecl3溶液10ml,并用去离子水定容,显色10min后用分光光度计在500nm处测吸光度,制作标准曲线,并依据标准曲线计算乙酰基含量。经检测,实施例1所得到的霍山石斛多糖的乙酰基含量为2.78±0.23%,所用仪器为v1100分光光度仪。(4)采用hpgpc法测定实施例1所得的霍山石斛多糖的均一性和相对分子量首先测定分子量分别为5000、25000、80000、150000、420000、670000的dextran系列葡聚糖标准品在相同条件下的保留时间,利用agilentgpc数据分析软件制作分子量标准曲线,然后根据标准曲线计算多糖样品的相对分子量mw。测试条件:agilent1260infinity系统;tskg5000pwxl(7.8×300mm)色谱柱;流动相双蒸水;进样量20μl;流速0.5ml/min;柱温30℃;示差折检测器。参见图3,经检测,实施例1所得到的霍山石斛多糖为均一多糖,其相对分子质量为2.59×105da。(5)采用红外光谱仪分析实施例1所得的霍山石斛多糖的特征基团称取2.0mg左右干燥的多糖样品,用少许干燥的kbr粉末混合压片后在nicolet67型傅里叶红外光谱仪上扫描分析,扫描范围为4000cm-1~400cm-1。参见图4,经检测,实施例1所得到的霍山石斛多糖具有多糖的特征峰,3396cm-1附近出现的宽而强的峰归属于-oh的拉伸振动;2932cm-1和2886cm-1附近的峰归属于c-h的拉伸振动;1400cm-1和1200cm-1之间的峰归属于对称的c-h弯曲振动;1250cm-1和950cm-1之间的峰归属于多糖的吡喃糖环中c-o-c和c-o-h的c-o振动;1732cm-1和1250cm-1附近的峰归属于o-乙酰基的c=o和c-o振动;895cm-1附近的峰表明β-构型的存在;874cm-1和810cm-1附近的峰为甘露糖的特征峰。实施例3一种具有抗消化系统癌症作用的霍山石斛多糖的化学结构鉴定如下:(1)采用pmp柱前衍生hplc法测定实施例1所得的霍山石斛多糖的单糖组成校正因子的测定:精确称取盐酸氨基葡萄糖适量,加水制成每1ml含12mg的溶液,作为内标溶液;另准确称取葡萄糖、甘露糖对照品各10mg,分别置100ml容量瓶中,精密加入内标溶液1ml,加水适量使溶解并稀释至刻度,摇匀,吸取400μl,加0.5mol/l的pmp(1-苯基-3-甲基-5-比唑啉酮)甲醇溶液与0.3mol/l的naoh溶液各400μl,混匀,70℃水浴反应100min后,再加0.3mol/l的hcl溶液500μl,混匀,用chcl3洗涤3次,每次2ml,弃去chcl3洗液,水层离心后,取上清液10μl,进行hplc测定,计算校正因子。校正因子(f)=(as/cs)/(ar/cr),式中:as为内标物质的峰面积,ar为对照品的峰面积,cs为内标物质的浓度,cr为对照品的浓度。单糖组成的测定:取1mg/ml的多糖溶液900μl和6.0024mg/ml内标(盐酸氨基葡萄糖)溶液100μl于10ml安瓿瓶中,加3.0mol/l的盐酸溶液0.5ml,封口,混匀,于110℃下水解1h,放冷,用3.0mol/l的naoh溶液调节ph值至中性,吸取400μl,照校正因子的测定方法,自“加0.5mol/l的pmp甲醇溶液”起,依法操作,取上清液10μl,进行hplc测定,计算各单糖的含量。单糖的含量(cx)=f(ax/(as/cs)),式中:ax为样品的峰面积,as为内标物质的峰面积,cx为样品的浓度,cs为内标物质的浓度,f为校正因子。测试条件:agilent1260infinity系统;agilentxdb-c18柱(250mm×4.6mm)色谱柱;流动相乙腈-0.02mol/l乙酸铵溶液(20:80);进样量10μl;流速1ml/min;柱温25℃;紫外检测器;检测波长250nm。经检测,实施例1所得到的霍山石斛多糖由葡萄糖和甘露糖组成,其中,图5中a为单糖标准品pmp衍生物hplc谱图,图5中b为霍山石斛多糖水解后衍生物hplc谱图,通过两图对照,霍山石斛多糖所含葡萄糖和甘露糖的摩尔比为1:3。(2)采用甲基化分析实施例1所得的霍山石斛多糖的糖苷键类型称取20mg充分干燥后的多糖,加入5ml无水二甲基亚砜(dmso)充分溶解,随后加入在液氮中充分研磨的naoh粉末,超声50min(保持温度在40℃以下),再加入1ml无水碘甲烷(边加边振荡),超声水浴中反应1h,加适量蒸馏水终止反应,乙酸中和后流水透析24h,蒸馏水透析24h,浓缩、冷冻干燥,重复上述操作步骤,直至红外光谱检测多糖羟基吸收峰消失为止,得完全甲基化样品。取完全甲基化样品置于10ml安瓿瓶中,加入2mol/l三氟乙酸4ml,封管,于110℃下水解4h,室温冷却,将水解液转移至旋蒸瓶内蒸干后,多次加入适量甲醇蒸干,以彻底除去残留的三氟乙酸,之后加入双蒸水3ml、硼氘化钠30mg,超声1min,于摇床上室温条件下反应3h,用25%的乙酸中和未反应的硼氘化钠,并将反应液置于旋转蒸发仪上蒸干,再于110~120℃烘箱中放置10min除去残余水分;向反应液中依次加入4ml的乙酸酐与3ml的吡啶,密塞后于110~120℃下乙酰化反应1h;反应结束后,反应液旋转蒸发仪上蒸干,重复多次加入适量甲苯蒸干,以除去残余的乙酸酐和吡啶,再用适量的氯仿萃取乙酰化产物,萃取物用无水硫酸钠去除残余水分,进行gc-ms测定。检测条件:agilentgc7890a-msd5975c系统;hp-5毛细管柱(30mm×0.32mm×250nm);进样口温度280℃;柱温程序为150℃保持1min后以10℃/min的速度升至200℃、之后以4℃/min升至270℃;he流速1ml/min;离子源温度150℃;火焰离子检测器。经检测,如图6中a所示,实施例1所得到的霍山石斛多糖甲基化产物在气相色谱中出现两个甲基化衍生物离子峰,其保留时间分别为10.415min、11.485min。如图6中b、c所示,通过联机检索各质谱图,确定各质谱的归属,并根据部分甲基化糖醇乙酸酯衍生物的裂解规律归属质谱图中的初级碎片和次级碎片,解析获得霍山石斛多糖的糖苷键类型为1,4-linkedglcp和1,4-linkedmanp,两者的比例为1:2.88。(3)采用nmr法测定实施例1所得的霍山石斛多糖的化学结构特征取多糖100mg完全溶于95%的d2o中,冷冻干燥,反复交换三次,随后溶解于纯度99.9%的含有dss(葡聚糖硫酸钠盐)的d2o中,0.22μm水系膜过滤后,装入核磁管中,进行nmr测定。检测条件:vnmrs600超导核磁共振波谱仪;onenmrprobe(5mm)探头;1h谱工作频率599.81mhz;13c谱工作频率150.84mhz;25℃和55℃下分别测定1h谱,55℃下测定13c、cosy、hsqc、hmbc谱。参见图7,经检测,实施例1所得到的霍山石斛多糖是由→4)-β-d-glcp-(1→、→4)-β-d-manp-(1→和→4)-3-o-acetyl-β-d-manp-(1→三种糖残基组成的重复结构单元所构成,其中图7中a为298k氢谱图(1hnmr图),图7中b为328k氢谱图(1hnmr图),附图7中c为碳谱图(13cnmr图),图7中d为异核单量子关系谱图(hsqc图),图7中e为同核化学位移相关谱图(1h-1hcosy图),图7中f为多键碳氢关系谱图(hmbc图),三种糖残基的化学位移分析见表1,具体的核磁谱图结构分析如下。表1一种具有抗消化系统癌症作用的霍山石斛多糖c和h的化学位移糖残基123456(a)→4)-β-d-glcp-(1→c105.4975.4976.7780.2477.7263.12gh4.523.333.623.633.563.91/3.82(b)→4)-β-d-manp-(1→c102.8772.6174.8279.1877.7763.07mh4.754.113.723.783.503.72/3.98(c)→4)-3-o-acetyl-β-d-manp-(1→c101.9971.3078.4975.7076.6863.07m3h4.774.184.783.963.523.72/3.98综合上述所述分析可得如下结果:霍山石斛多糖为组成均一的乙酰化葡甘聚糖,相对分子质量为2.59×105da,乙酰基(acetyl)含量为2.78%;单糖组成分析及甲基化结果表明本发明中的霍山石斛多糖含有吡喃型葡萄糖(glcp)和吡喃型甘露糖(manp),其摩尔比为1:3;核磁分析结果表明糖残基构型为β型,其可重复一级结构单元含有→4)-β-d-glcp-(1→、→4)-β-d-manp-(1→和→4)-3-o-acetyl-β-d-manp-(1→三种糖残基,所述三种糖残基的连接方式如下所示:实施例4参见附图8,一种具有抗消化系统癌症作用的霍山石斛多糖的抗胃癌作用分析如下:(1)动物喂养及小鼠胃癌荷瘤模型建立balb/c雄性小鼠72只,6周龄,于spf级动物房中在温度23±2℃、相对湿度50%-60%、12h光照和12h黑暗条件下适应性喂养,期间小鼠可以自由摄取水和食物;一周后,取12只小鼠作为正常组,剩余小鼠均于右腋下接种小鼠mfc胃癌细胞(购于中国医学科学院基础医学研究所),每只接种0.2ml(细胞密度为2.5×107个/ml),且压迫注射点,并于spf动物房中继续饲养。(2)动物分组及给药干预接种mfc胃癌细胞1d后,荷瘤小鼠随机分为5组,每组12只,分别为模型组、5-氟尿嘧啶组(5-fu,20mg/kg·d)、以及霍山石斛多糖高、中、低剂量组,随后灌胃给药,连续30d。依据《中华人民共和国药典》推荐成人石斛使用低剂量6g/60kg·d的标准,按5倍、10倍及20倍量设高、中、低三个剂量组给药。基于霍山石斛多糖的提取率为13.14%,动物实验中霍山石斛多糖高、中、低三个剂量分别为65.7mg/kg、131.4mg/kg、262.8mg/kg。多糖和5-氟尿嘧啶用生理盐水溶解后灌胃给药,正常组与模型对照组均灌胃同等体积的生理盐水。(3)小鼠体内抗肿瘤活性监测指标一般情况观察:小鼠反应,活动情况,精神状况,毛发变化等;每隔三天称取小鼠体重,并对小鼠摄食摄水情况进行观察记录;实验结束,co2窒息处死小鼠,收集小鼠各器官,称重,计算脏器指数;瘤组织解剖,称重,测量肿瘤长短径,根据v=1/2ab2计算肿瘤体积,拍照;对解剖后肿瘤称重,计算抑瘤率:抑制率%=(1-给药组平均瘤重/模型对照组平均瘤重)·100%。(4)实验结果表2霍山石斛多糖对mfc胃癌荷瘤小鼠肿瘤生长的抑制(n=8)注:1.表中数据为平均值±标准差(n=8);2.同列不同小写字母表示不同处理之间在0.05水平存在显著差异。接种3d后,荷瘤小鼠外观无明显变化,饮食、活动正常,体重有所增加;接种6d后,除正常组外,其余小鼠右前肢腋下开始出现小瘤块,其中模型组小鼠瘤块最大,体积约50mm3;随灌胃天数不断增加,除正常组外,其余小鼠出现不同程度行动减缓,毛发蓬松无光泽的现象,但霍山石斛多糖给药组明显优于模型组小鼠,小鼠生长状况较好,且饮食饮水正常;至灌胃30d,模型对照组荷瘤小鼠右前肢腋下有明显肿瘤块,肿瘤部位褪毛后,可见肿瘤块为不规则球体,包裹小鼠右前肢,因瘤块过大妨碍小鼠行动,并挤压小鼠胸腔和脊椎,对小鼠生理状况产生严重不良影响,而多糖给药组肿瘤较模型对照组小,且呈浓度依赖性下降趋势;阳性对照5-fu组小鼠肿瘤较小,但体重严重下降,活力明显减退,生理状况最差。经计算,霍山石斛多糖高剂量组的抑瘤率最高。实施例5参见附图9,一种具有抗消化系统癌症作用的霍山石斛多糖的抗结直肠癌作用分析如下:(1)动物喂养及小鼠结直肠癌荷瘤模型建立balb/c雄性小鼠72只,6周龄,于spf级动物房中在温度23±2℃、相对湿度50%-60%、12h光照和12h黑暗条件下适应性喂养,期间小鼠可以自由摄取水和食物;一周后,取12只小鼠作为正常组,剩余小鼠均于右腋下接种小鼠ct26.wt结直肠癌细胞(购于中国医学科学院基础医学研究所),每只接种0.2ml(细胞密度为2.5×107个/ml),且压迫注射点,并于spf动物房中继续饲养。(2)动物分组及给药干预接种ct26.wt结直肠癌细胞1d后,荷瘤小鼠随机分为5组,每组12只,分别为模型组、5-氟尿嘧啶组(5-fu,20mg/kg·d)、以及霍山石斛多糖高、中、低剂量组,随后灌胃给药,连续30d。依据《中华人民共和国药典》推荐成人石斛使用低剂量6g/60kg·d的标准,按5倍、10倍及20倍量设高、中、低三个剂量组给药。基于霍山石斛多糖的提取率为13.14%,动物实验中霍山石斛多糖高、中、低三个剂量分别为65.7mg/kg、131.4mg/kg、262.8mg/kg。多糖和5-氟尿嘧啶用生理盐水溶解后灌胃给药,正常组与模型对照组均灌胃同等体积的生理盐水。(3)小鼠体内抗肿瘤活性监测指标一般情况观察:小鼠反应,活动情况,精神状况,毛发变化等;每隔三天称取小鼠体重,并对小鼠摄食摄水情况进行观察记录;实验结束,co2窒息处死小鼠,收集小鼠各器官,称重,计算脏器指数;瘤组织解剖,称重,测量肿瘤长短径,根据v=1/2ab2计算肿瘤体积,拍照;对解剖后肿瘤称重,计算抑瘤率:抑制率%=(1-给药组平均瘤重/模型对照组平均瘤重)·100%。(4)实验结果表3霍山石斛多糖对ct26.wt结直肠癌荷瘤小鼠肿瘤生长的抑制(n=8)组别剂量(mg/kg)体重(g/只)瘤重(g)肿瘤体积(mm3)抑瘤率(%)正常对照组-22.93±0.54d---模型对照组-27.66±0.68a4.38±0.70a4191.69±1215.68a-多糖低剂量组65.727.68±1.85a4.09±1.69a3645.71±951.86a30.52±3.07d多糖中剂量组131.426.26±2.15b3.33±1.18b3036.63±376.04b47.97±3.13c多糖高剂量组262.823.98±1.60c2.02±1.08c1917.91±502.93c63.88±4.57a5-氟尿嘧啶组20.023.58±0.63c2.37±0.68c2001.11±428.27c55.89±2.90b注:1.表中数据为平均值±标准差(n=8);2.同列不同小写字母表示不同处理之间在0.05水平存在显著差异。实验结果表明,霍山石斛多糖对ct26.wt结直肠癌荷瘤小鼠的肿瘤增殖都具有一定抑制作用,其中霍山石斛多糖高剂量组抑制肿瘤生长的效果最好,且具有剂量依赖性;相比5-氟尿嘧啶组小鼠,霍山石斛多糖给药组小鼠生长活性较好,其毛发较柔顺,饮食正常。因此,霍山石斛多糖具有良好的体内抗ct26.wt结直肠癌的效应,且其毒副作用远小于传统抗肿瘤药物5-fu,对小鼠生理状态的影响小。实施例6参见附图10,一种具有抗消化系统癌症作用的霍山石斛多糖的抗肝癌作用分析如下:(1)动物喂养及小鼠肝癌荷瘤模型建立balb/c雄性小鼠72只,6周龄,于spf级动物房中在温度23±2℃、相对湿度50%-60%、12h光照和12h黑暗条件下适应性喂养,期间小鼠可以自由摄取水和食物;一周后,取12只小鼠作为正常组,剩余小鼠均于右腋下接种小鼠hepa1-6肝癌细胞(购于中国医学科学院基础医学研究所),每只接种0.2ml(细胞密度为2.5×107个/ml),且压迫注射点,并于spf动物房中继续饲养。(2)动物分组及给药干预接种hepa1-6肝癌细胞1d后,荷瘤小鼠随机分为5组,每组12只,分别为模型组、5-氟尿嘧啶组(5-fu,20mg/kg·d)、以及霍山石斛多糖高、中、低剂量组,随后灌胃给药,连续30d。依据《中华人民共和国药典》推荐成人石斛使用低剂量6g/60kg·d的标准,按5倍、10倍及20倍量设高、中、低三个剂量组给药。基于霍山石斛多糖的提取率为13.14%,动物实验中霍山石斛多糖高、中、低三个剂量分别为65.7mg/kg、131.4mg/kg、262.8mg/kg。多糖和5-氟尿嘧啶用生理盐水溶解后灌胃给药,正常组与模型对照组均灌胃同等体积的生理盐水。(3)小鼠体内抗肿瘤活性监测指标一般情况观察:小鼠反应,活动情况,精神状况,毛发变化等;每隔三天称取小鼠体重,并对小鼠摄食摄水情况进行观察记录;实验结束,co2窒息处死小鼠,收集小鼠各器官,称重,计算脏器指数;瘤组织解剖,称重,测量肿瘤长短径,根据v=1/2ab2计算肿瘤体积,拍照;对解剖后肿瘤称重,计算抑瘤率:抑制率%=(1-给药组平均瘤重/模型对照组平均瘤重)·100%。(4)实验结果表4霍山石斛多糖对hepa1-6肝癌荷瘤小鼠肿瘤生长的抑制(n=8)组别剂量(mg/kg)体重(g/只)瘤重(g)肿瘤体积(mm3)抑瘤率(%)正常对照组-24.7±0.39b---模型对照组-23.4±0.50c1.55±0.10a1323.37±210.16a-多糖低剂量组65.724.3±0.72b1.30±0.10a525.78±55.98b24.83±4.40c多糖中剂量组131.424.8±0.91b1.25±0.07b467.14±62.86c30.53±3.13b多糖高剂量组262.825.4±0.44a0.96±0.10c327.69±88.32d47.97±3.07a5-氟尿嘧啶组20.022.7±0.52d0.71±0.12c205.78±44.00d51.07±2.28a注:1.表中数据为平均值±标准差(n=8);2.同列不同小写字母表示不同处理之间在0.05水平存在显著差异。通过霍山石斛多糖的抗hepa1-6肝癌荷瘤小鼠体内实验表明,模型对照组小鼠右侧腋下瘤块随时间增加不断扩大,而霍山石斛多糖给药组可显著抑制荷瘤小鼠肿瘤生长,其肿瘤抑制作用呈浓度依赖效应;5-氟尿嘧啶组小鼠虽具有较高的抑制肿瘤生长活性,但对小鼠有明显的副作用,导致小鼠体重减轻,生命活力下降。对不同组的抑瘤率进行统计分析表明,霍山石斛多糖高剂量组的效果与5-氟尿嘧啶组相比无显著性差异,霍山石斛多糖高剂量组对hepa1-6细胞荷瘤小鼠肿瘤具有很好的抑制作用,且长期使用无不良反应。尽管以上已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1