一种两亲性聚三亚甲基碳酸酯及其制备方法和应用与流程
本发明涉及高分子材料技术领域,特别涉及一种两亲性聚三亚甲基碳酸酯,还涉及此两亲性聚三亚甲基碳酸酯的制备方法和应用。
背景技术:
生物可降解材料如聚已内酯(pcl)、聚乙交酯(pga)、聚丙交酯(pla)及聚碳酸酯(pc)等脂肪族聚酯具有良好的生物降解性、优异的生物相容性和物理机械性能,是一类重要的生物降解医用高分子材料。其中,聚三亚甲基碳酸酯(ptmc)具有良好的生物降解性能及生物相容性,是一种重要的生物降解医用高分子材料,在生物医用领域具有较大的应用前景。但是这类材料结晶度高,疏水性较强,缺乏功能化修饰位点等不足,限制了它们生物医学领域的进一步应用。
聚碳酸酯主要有两种制备方法,一是通过二氧化碳和环氧化合物的共聚,但是该方法反应过程中产生大量的五元环碳酸酯和醚键的副产物,且还涉及空气敏感的配位化合物,因而限制了其在实际生产中的应用。另外一种利用环状碳酸酯单体的开环聚合,目前该方法已成为应用最为广泛的一种方法,该方法反应条件温和,易于提纯,聚合物分子量及分散度可控性较好。当利用亲水性引发剂时,可制备两亲性的聚合物,该聚合物在水溶液中可自组装成聚合物胶束,因而在药物控释领域具有很大的应用前景。
对于三亚甲基碳酸酯而言,其5位上的取代基产生的空间位阻效应直接影响开环聚合的难易程度,大量研究报道表明,5位上的取代基团一般为甲基、苄氧羰基以及苄氧基等;当5位上为双取代基时,开环聚合难度较大。
技术实现要素:
为了解决以上现有技术中三亚甲基碳酸酯5位上为双取代基时,开环聚合难度较大的问题,本申请公开了一种5位上为双取代基的两亲性聚三亚甲基碳酸酯。
本发明还提供了5位上为双取代基的两亲性聚三亚甲基碳酸酯的制备方法。
本发明的另一个目的是提供5位上为双取代基的两亲性聚三亚甲基碳酸酯的应用。
本发明设计得到一系列5位上含两个易脱除取代基的环碳酸酯单体,利用亲水性引发剂引发开环聚合制备两亲性聚合物,再通过水解反应去除5位上的保护基团,得到双羧基取代的两亲性聚合物。最后以两亲性聚合物组装构筑胶束、囊泡以及胶囊等纳米聚集体为载体制备纳米药物。
本发明是通过以下步骤得到的:
本发明提供了一种两亲性聚三亚甲基碳酸酯,具体结构式如下:
式中,r1为聚乙二醇基或其衍生物;
r2为甲基、乙基、乙氧基、苄氧基、乙氧羰基、叔丁氧羰基或苄氧羰基;
r3为甲基、乙基、乙氧基、苄氧基、乙氧羰基、叔丁氧羰基或苄氧羰基;
是由三亚甲基碳酸酯发生开环聚合制备得到的,三亚甲基碳酸酯结构式如下:
进一步的,所述三亚甲基碳酸酯为5,5-二乙氧羰基三亚甲基碳酸酯、5,5-二叔丁氧羰基三亚甲基碳酸酯或5,5-二苄氧羰基三亚甲基碳酸酯。
本发明所使用的三亚甲基碳酸酯是通过以下步骤得到的:
(1)将甲醛、丙二酸二乙酯或丙二酸二叔丁酯或丙二酸二苄酯、碳酸钾反应得到双羟甲基丙二酸二乙酯或双羟甲基丙二酸二叔丁酯或双羟甲基丙二酸二苄酯;
(2)将双羟甲基丙二酸二乙酯或双羟甲基丙二酸二叔丁酯或双羟甲基丙二酸二苄酯与吡啶溶于二氯甲烷中,冰浴,滴加三光气的二氯甲烷溶液,反应即得。
进一步的,所述r1为
进一步的,所述三亚甲基碳酸酯发生开环聚合中使用的引发剂为聚乙二醇或其衍生物,其与三亚甲基碳酸酯摩尔比为1:5~60;三亚甲基碳酸酯发生开环聚合中使用的催化剂为配位型催化剂辛酸亚锡。
本发明还提供了一种双羧基取代聚三亚甲基碳酸酯,具体结构式如下:
式中,r1为聚乙二醇基或其衍生物。
上述双羧基取代聚三亚甲基碳酸酯结构式中,r1为
上述双羧基取代聚三亚甲基碳酸酯是由本发明提供的两亲性聚三亚甲基碳酸酯水解得到的。
进一步的,所述两亲性聚三亚甲基碳酸酯水解中使用的催化剂为三氟乙酸-氢溴酸、氢氧化钠、盐酸、钯碳加氢、氯代甲酸乙酯或双(双三甲基硅基)胺锌。
本发明还提供了一种两亲性聚三亚甲基碳酸酯或由两亲性聚三亚甲基碳酸酯水解产物双羧基取代聚三亚甲基碳酸酯在组装构筑胶束为载体的纳米药物中的应用。
本发明的有益效果:
(1)本发明涉及的聚三亚甲基碳酸酯所涉原材料廉价易得,制备方法简单易行,应用前景广阔;
(2)本发明提供的聚三亚甲基碳酸酯(peg-ptmc1)和双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2),具有优异的两亲性能,在水中容易组装而成胶束,可用作为纳米药物的载体使用;
(3)本发明制备的聚三亚甲基碳酸酯(peg-ptmc1)和双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)生物相容性好且具有良好的生物降解性;
(4)本发明提供的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2),还可以利用其功能羧酸基团对组装构筑的纳米药物进行再修饰和改造,如利用羧基来实现交联可以进一步提高纳米药物的稳定性等。因此,该聚三亚甲基碳酸酯(peg-ptmc1和peg-ptmc2)在生物医药领域具有良好的应用前景。
附图说明
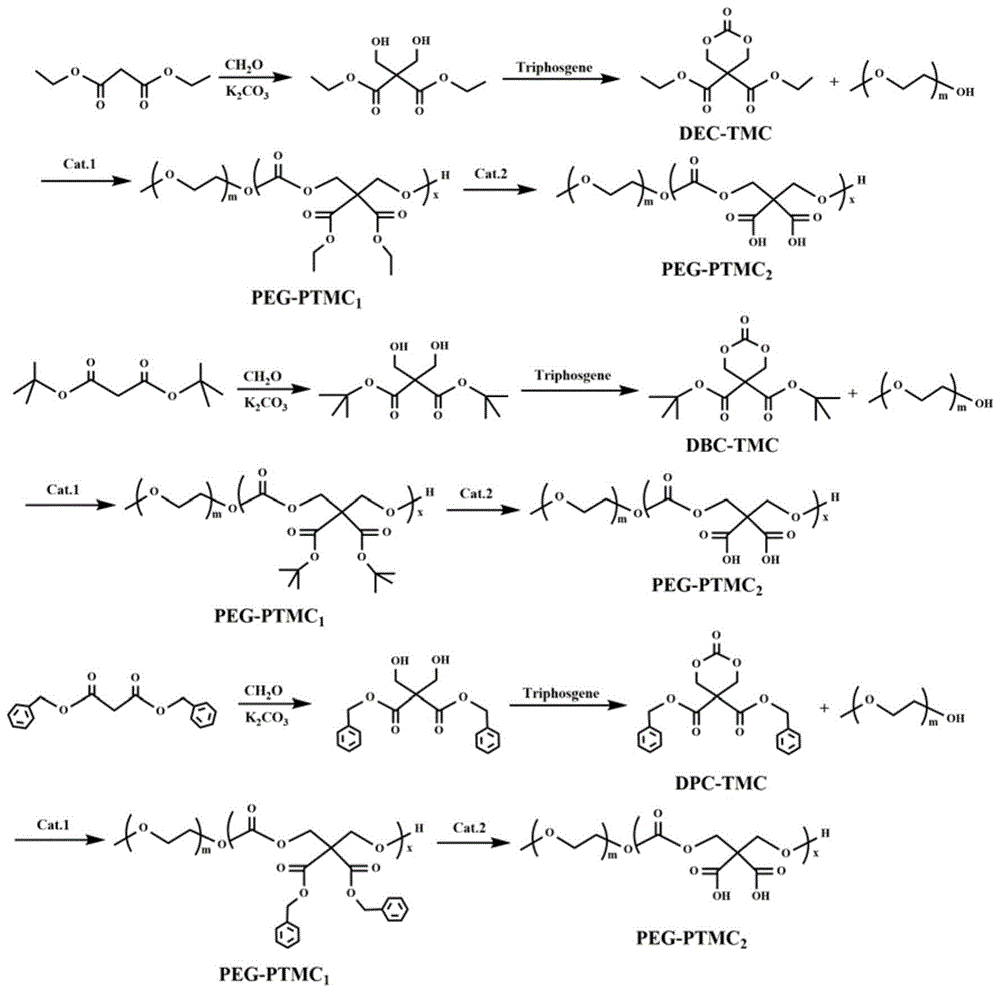
图1三亚甲基碳酸酯(dec-tmc、dbc-tmc或dpc-tmc)及聚三亚甲基碳酸酯(peg-ptmc1和peg-ptmc2)的合成路线图;
图2实施例4、7和9制备的聚三亚甲基碳酸酯(peg-ptmc1)的分子量分布图;
图3丙二酸二乙酯(dm)、双羟甲基丙二酸二乙酯(dbhm)、5,5-二乙氧羰基三亚甲基碳酸酯(dec-tmc)及聚三亚甲基碳酸酯(peg-ptmc1)的核磁谱图;
图4实施例4、5、7和15制备的聚三亚甲基碳酸酯(peg-ptmc1)组装构筑胶束的粒径及分布图;
图5分别以实施例4、5、7和15制备的聚三亚甲基碳酸酯(peg-ptmc1)构筑胶束包载紫杉醇纳米药物(实施例21、22、23和24)的粒径及分布图;
图6pbs(a)和taxol(b)对照组与实施例21(c)和实施例22(d)对荷4t1乳腺癌小鼠抑瘤试验的肿瘤图;
图7实施例21和实施例22对荷4t1乳腺癌小鼠抑瘤试验的肿瘤生长-时间曲线图;
图8实施例21和实施例22对荷4t1乳腺癌小鼠抑瘤试验的鼠重-时间曲线图。
具体实施方式
下面结合具体实施例对本发明进行进一步说明:
实施例1
(1)甲醛(0.32g)和丙二酸二乙酯(0.16g)和碳酸钾(0.0276g)溶于10ml水中,30℃反应6h,结束反应,用饱和氯化钠溶液稀释、乙醚萃取、干燥、浓缩,4℃放置过夜,析出白色固体,过滤,干燥,即得到双羟甲基丙二酸二乙酯。
(2)将双羟甲基丙二酸二乙酯(0.22g)、吡啶(0.48g)溶于100ml二氯甲烷中,冷却至-10℃,滴加三光气(0.3g)反应1h,再室温反应2h,反应结束用饱和氯化铵溶液猝灭反应、酸洗、碱洗和水洗,无水硫酸钠干燥,旋干,用乙酸乙酯重结晶,干燥,即得5,5-二乙氧羰基三亚甲基碳酸酯(dec-tmc)。
实施例2
(1)甲醛(0.32g)和丙二酸二叔丁酯(0.22g)和碳酸钾(0.0276g)溶于10ml水中,30℃反应6h,结束反应,用饱和氯化钠溶液稀释、乙醚萃取、干燥、浓缩,4℃放置过夜,析出白色固体,过滤,干燥,即得到双羟甲基丙二酸二叔丁酯。
(2)将双羟甲基丙二酸二叔丁酯(0.28g)、吡啶(0.48g)溶于100ml二氯甲烷中,冷却至-10℃,滴加三光气(0.3g)反应1h,再室温反应2h,反应结束用饱和氯化铵溶液猝灭反应、酸洗、碱洗和水洗,无水硫酸钠干燥,旋干,用乙酸乙酯重结晶,干燥,即得5,5-二叔丁氧羰基三亚甲基碳酸酯(dec-tmc)。
实施例3
(1)甲醛(0.32g)和丙二酸二苄酯(0.28g)和碳酸钾(0.0276g)溶于10ml水中,30℃反应6h,结束反应,用饱和氯化钠溶液稀释、乙醚萃取、干燥、浓缩,4℃放置过夜,析出白色固体,过滤,干燥,即得到双羟甲基丙二酸二苄酯。
(2)将双羟甲基丙二酸二苄酯(0.35g)、吡啶(0.48g)溶于100ml二氯甲烷中,冷却至-10℃,滴加三光气(0.3g)反应1h,再室温反应2h,反应结束用饱和氯化铵溶液猝灭反应、酸洗、碱洗和水洗,无水硫酸钠干燥,旋干,用乙酸乙酯重结晶,干燥,即得5,5-二苄氧羰基三亚甲基碳酸酯(dpc-tmc)。
实施例4
(1)将mpeg5000(5.0g)、5,5-二乙氧羰基三亚甲基碳酸酯(4.75g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例5
(1)将mpeg5000(5.0g)、5,5-二乙氧羰基三亚甲基碳酸酯(9.5g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例6
(1)将mpeg5000(5.0g)、5,5-二乙氧羰基三亚甲基碳酸酯(19g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例7
(1)将mpeg5000(5.0g)、5,5-二叔丁氧羰基三亚甲基碳酸酯(6.0g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例8
(1)将mpeg5000(5.0g)、5,5-二叔丁氧羰基三亚甲基碳酸酯(15g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例9
(1)将mpeg5000(5.0g)、5,5-二苄氧羰基三亚甲基碳酸酯(7.5g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)
实施例10
(1)将mpeg5000(5.0g)、5,5-二苄氧羰基三亚甲基碳酸酯(19g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)
实施例11
(1)将mpeg1000(1.0g)、5,5-二乙氧羰基三亚甲基碳酸酯(4.75g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-pc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例12
(1)将mpeg2000(2.0g)、5,5-二乙氧羰基三亚甲基碳酸酯(9.5g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-pc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例13
(1)将mpeg1000(1.0g)、5,5-二叔丁氧羰基三亚甲基碳酸酯(6.0g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-pc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例14
(1)将mpeg2000(2.0g)、5,5-二叔丁氧羰基三亚甲基碳酸酯(15g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)。
(2)将聚三亚甲基碳酸酯(peg-pc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例15
(1)将mpeg1000(1.0g)、5,5-二苄氧羰基三亚甲基碳酸酯(7.5g)反应瓶中,100℃下使其熔融,通氮气、抽真空30min,加入溶于微量甲苯的辛酸亚锡(0.041g)、130℃反应24h,冷冻剧停反应,氯仿溶解,正己烷沉淀、干燥,即得聚三亚甲基碳酸酯(peg-ptmc1)
(2)将聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将所得产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)
实施例16
将实施例4制备的聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入三氟乙酸-氢溴酸,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例17
将实施例5制备的聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入氯代甲酸乙酯,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例18
将实施例7制备的聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入双(双三甲基硅基)胺锌,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例19
将实施例7制备的聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)。
实施例20
将实施例9制备的聚三亚甲基碳酸酯(peg-ptmc1,5.0g)溶于30ml甲醇中,加入钯碳催化剂并通氢气,反应12h,结束反应。将产物溶于适量n,n-二甲基甲酰胺中,正己烷沉淀、洗涤、干燥,即得双羧基取代的三亚甲基碳酸酯(peg-ptmc2)。
实施例21
称取实施例4制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc1)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5-1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例22
称取实施例5制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc1)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例23
称取实施例7制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc1)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例24
称取实施例15制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc1)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例25
称取实施例17制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc1)和紫杉醇溶于n,n-二甲基甲酰胺中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例26
称取实施例4制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例27
称取实施例5制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例28
称取实施例7制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例29
称取实施例15制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例30
称取实施例17制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)和紫杉醇溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的ptx,即得聚合物胶束纳米药物。
实施例31
称取实施例5制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc1)和喜树碱溶于四氢呋喃中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,搅拌0.5~1h,透析24h去除有机溶剂和未包载的喜树碱,即得聚合物胶束纳米药物。
实施例32
称取实施例4制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,透析24h去除有机溶剂,再加入顺铂,避光搅拌反应48h,再透析24h去除未络合的顺铂,即得聚合物胶束纳米药物。
实施例33
称取实施例7制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,透析24h去除有机溶剂,再加入顺铂,避光搅拌反应48h,再透析24h去除未络合的顺铂,即得聚合物胶束纳米药物。
实施例34
称取实施例15制备的双羧基取代的聚三亚甲基碳酸酯(peg-ptmc2)溶于二甲基亚砜中,超声使其充分溶解,接着室温下匀速滴加到适量双蒸水中,透析24h去除有机溶剂,再加入顺铂,避光搅拌反应48h,再透析24h去除未络合的顺铂,即得聚合物胶束纳米药物。
实施例35
称取实施例26制备的聚合物胶束纳米药物溶液和顺铂,避光搅拌48h,再透析24h去除未络合的顺铂,即得顺铂配位络合的聚合物胶束纳米药物。
效果实施例
本发明中,三亚甲基碳酸酯(dec-tmc、dbc-tmc或dpc-tmc)及聚三亚甲基碳酸酯(peg-ptmc1和peg-ptmc2)的合成路线图具体如图1所示。本发明制备的基于5,5-二乙氧羰基三亚甲基碳酸酯中间体及聚三亚甲基碳酸酯(peg-ptmc1)的核磁谱图如图3所示。聚三亚甲基碳酸酯(peg-ptmc1)的分子量分布如图2所示。由图2可知,对于三亚甲基环碳酸酯单体而言,当5位取代基为双苄氧羰基时,所得聚三亚甲基碳酸酯(peg-ptmc1)在gpc谱图上明显存在双峰,这是由于苄氧羰基团大的空间位阻效应降低5,5-二苄氧羰基三亚甲基碳酸酯的反应活性,因而得到的聚三亚甲基碳酸酯(peg-ptmc1)的聚合度较低,因而分子量也较小且分子量分布不均匀;而对于5位取代基为双乙氧羰基和双叔丁氧羰基时,聚三亚甲基碳酸酯(peg-ptmc1)gpc谱图为单峰,这是因为5位取代基团的空间位阻作用较小,因而得到分子量较高且分子量分布均匀的聚三亚甲基碳酸酯(peg-ptmc1)。
鉴于上述结果,分别选取实施例4和实施例5由聚乙二醇单甲醚(mpeg5000)引发不同添加量5,5-二乙氧羰基三亚甲基碳酸酯聚合制备的聚三亚甲基碳酸酯(peg-ptmc1)、实施例7由聚乙二醇单甲醚(mpeg5000)引发5,5-二叔丁氧羰基三亚甲基碳酸酯聚合制备的聚三亚甲基碳酸酯(peg-ptmc1)和实施例15由聚乙二醇单甲醚(mpeg1000)引发5,5-二苄氧羰基三亚甲基碳酸酯聚合制备的聚三亚甲基碳酸酯(peg-ptmc1)为研究对象,进行胶束组装构筑和包载紫杉醇(ptx)纳米药物的制备。
本发明制备的聚三亚甲基碳酸酯(peg-ptmc1和(peg-ptmc2)组装构筑的胶束及以其为载体纳米药物的粒径及分布(dls和pdi)用马尔文激光粒度仪测定。抑瘤试验采用balb/c小鼠建立4t1肿瘤细胞模型进行评价。
由实施例4、5、7和15制备的聚三亚甲基碳酸酯(peg-ptmc1)的粒径分布如图4所示。其中,对于施例4和实施例5由聚乙二醇单甲醚(mpeg5000)引发不同添加量5,5-二乙氧羰基三亚甲基碳酸酯聚合制备的聚三亚甲基碳酸酯(peg-ptmc1)来说,随着5,5-二乙氧羰基三亚甲基碳酸酯含量的增加,peg-ptmc1分子量增加,聚合物中疏水链段(ptmc)比例增加,进而由其组装构筑的胶束的疏水核层和胶束的粒径增大。对实施例7由聚乙二醇单甲醚(mpeg5000)引发5,5-二叔丁氧羰基三亚甲基碳酸酯聚合制备的聚三亚甲基碳酸酯(peg-ptmc1)来说,叔丁氧羰基也是具有一定的空间位阻作用,进行开环聚合的活性和能力降低,因而需要增加投料比例来提高相应的聚三亚甲基碳酸酯(peg-ptmc1)的分子量,因而由其组装构筑的胶束及包载ptx的纳米药物其粒径反而有所降低。对于实施例15由聚乙二醇单甲醚(mpeg1000)引发5,5-二苄氧羰基三亚甲基碳酸酯聚合制备的聚三亚甲基碳酸酯(peg-ptmc1)来说,苄氧羰基导致空间位阻效应最大,发生开环聚合的活性大大降低,为了得到相应的聚三亚甲基碳酸酯(peg-ptmc1),而选用分子量低的聚乙二醇单甲醚(mpeg1000)作为开环聚合的引发剂,这样能够得到分子量分布较均一的聚三亚甲基碳酸酯(peg-ptmc1),然而由于该peg-ptmc1分子量较小,因而由其组装构筑的胶束及包载ptx的纳米药物的粒径明显变小。
以实施例4、5、7和15制备的聚三亚甲基碳酸酯(peg-ptmc1)构筑的胶束为载体包载紫杉醇,该纳米药物(实施例21、22、23和24)的粒径及分布如图5所示。结果表明,与空白胶束相比,由实施例4、5、7和15制备的胶束包载紫杉醇制备的纳米药物的粒径有所增大,但是粒径基本都小于100nm且粒径分布较窄,说明非常适于利用肿瘤病灶的epr效应,实现纳米药物在肿瘤病灶的蓄积,进而杀死肿瘤细胞而提高抑瘤效能。
以pbs(a)和市售紫杉醇药物taxol(b)为对照组,将实施例21(c)和实施例22(d)对荷4t1乳腺癌细胞瘤小鼠进行抑瘤试验,其中实施例21和实施例22分别为基于实施例4和实施例5胶束为载体包载紫杉醇的纳米药物,抑瘤试验结果如图6、7和8所示。结果表明,除taxol对照组的小鼠体重下降明显之外,整个试验过程中实施例21和实施例22组小鼠的生长状态良好,鼠重没有明显下降,说明ptx通过胶束包载得到的纳米药物显著降低了化疗药物的毒性。更重要的是,通过小鼠瘤重-时间生长曲线可知,纳米药物(实施例21和实施例22)都具有良好的抑瘤效果。其中与pbs和taxol为对照组相比,由实施例22制备的纳米药物具有更加优异的抑瘤效能,这是由于实施例22涉及的聚三亚甲基碳酸酯具有更多的三亚甲基碳酸酯重复单元,聚合物中疏水链段比例增加,进而由其组装构筑的胶束具有更大的疏水空腔,能够包载更多的ptx,当该纳米药物借助epr效应在肿瘤病灶蓄积后释放出更多的ptx来杀死肿瘤细胞,进而表现出更加优异的抑瘤效能。
总之,本发明设计的基于该两亲性聚三亚甲基碳酸酯构筑的聚合物胶束纳米药物不仅能够显著降低小分子抗肿瘤药物的毒性,还表现出具有良好的抑瘤效能,因而具有良好的应用前景。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备聚乙烯醇-聚己内酯-聚三亚甲基碳酸酯双接枝共聚物的方法
- 一种聚乙烯醇-聚三亚甲基碳酸酯-聚肽双接枝共聚物的制备方法
- 一种用聚三亚甲基碳酸酯与聚己内酯对聚乙烯醇膜耐水性及柔顺性进行改进的方法
- 一种制备聚乙烯醇-聚三亚甲基碳酸酯-聚对二氧环己酮双接枝共聚物胶束的方法
- 一种聚乙烯醇-聚三亚甲基碳酸酯-聚对二氧环己酮双接枝共聚物胶束的制备方法
- 一种聚乙烯醇-聚肽-聚三亚甲基碳酸酯-聚乳酸乙醇酸三接枝共聚物的制备方法
- 一种聚乙烯醇-聚己内酯-聚乳酸乙醇酸-聚三亚甲基碳酸酯三接枝共聚物的制备方法
- 一种制备聚乙烯醇-聚三亚甲基碳酸酯-聚肽双接枝共聚物的方法
- 一种聚乙烯醇-聚三亚甲基碳酸酯-聚乳酸乙醇酸双接枝共聚物的制备方法
- 一种用聚三亚甲基碳酸酯与p(cpp-sa)-聚乙二醇改进聚乙烯醇膜耐水性及柔顺性的方法
- 一种制备聚乙烯醇-聚三亚甲基碳酸酯-聚对二氧环己酮双接枝共聚物胶束的方法
- 一种聚乙烯醇-聚三亚甲基碳酸酯-聚对二氧环己酮双接枝共聚物胶束的制备方法
- 一种聚乙烯醇-聚肽-聚三亚甲基碳酸酯-聚乳酸乙醇酸三接枝共聚物的制备方法
- 一种聚乙烯醇-聚己内酯-聚乳酸乙醇酸-聚三亚甲基碳酸酯三接枝共聚物的制备方法
- 一种制备聚乙烯醇-聚三亚甲基碳酸酯-聚肽双接枝共聚物的方法
- 一种聚乙烯醇-聚三亚甲基碳酸酯-聚乳酸乙醇酸双接枝共聚物的制备方法
- 一种用聚三亚甲基碳酸酯与p(cpp-sa)-聚乙二醇改进聚乙烯醇膜耐水性及柔顺性的方法
- 聚三亚甲基碳酸酯与聚酸酐-聚乙烯吡咯烷酮改进聚乙烯醇膜耐水性及柔顺性的方法
- 一种聚乙烯醇-聚肽-聚己内酯-聚三亚甲基碳酸酯三接枝共聚物的制备方法
- 一种制备聚乙烯醇-聚三亚甲基碳酸酯-聚对二氧环己酮双接枝共聚物的方法