一种高效生产L-乳酸的方法与流程
本发明涉及生物发酵技术领域,尤其涉及一种高效生产l-乳酸的方法。
背景技术:
乳酸是一种天然存在的有机酸,其广泛应用于食品、医药、化工、化妆品等行业特别是随着全球环境保护的日益加强和石油资源的日益枯竭,环境友好的聚乳酸材料越来越受到人们的关注。但是,相比于传统塑料的价格,聚乳酸产品的成本始终是制约其全面代替化石原料产品的主要因素。因此,如何降低聚乳酸单体—乳酸的生产成本,实现发酵过程的高效生产已经成为当下研究的热点。
因此,亟需提供一种高效生产l-乳酸的方法,以解决上述问题。
技术实现要素:
本发明的目的在于提升l-乳酸(l-lacticacid)的生产效率,提供一种偶联细胞生长和细胞非生长高效生产l-乳酸的方法,能够有效增加细胞对底物的转化,提高底物葡萄糖(glucose)转化率,进而提升反应罐的体积产率和发酵过程整体生产l-乳酸的效率,实现了发酵过程的高效生产。
为了实现上述目的,本发明提供了一种高效生产l-乳酸的方法,偶联细胞生长和细胞非生长生产l-乳酸,包括如下步骤:
第一阶段发酵:包括利用干酪乳杆菌生长代谢葡萄糖生成l-乳酸的步骤;
第二阶段发酵:包括利用静息细胞发酵代谢葡萄糖快速生成l-乳酸的步骤;
所述静息细胞为所述第一阶段发酵步骤后离心收集得到的稳定期的干酪乳杆菌细胞。
进一步,所述静息细胞保持着非常高的细胞代谢活性。
进一步,所述第二阶段发酵的步骤包括:将静息细胞液接种于发酵培养基中,细胞浓度为2.35~18.55g/l,添加葡萄糖发酵培养,得到发酵液;培养体系中的初始葡萄糖的浓度为60~140g/l,培养过程中加入ph调节剂维持体系ph值为5.8~6.2。
进一步,所述第二阶段发酵中的初始葡萄糖的浓度为80~120g/l。进一步,所述第二阶段发酵中的初始葡萄糖的浓度为100g/l。
进一步,所述ph调节剂为8~12g/l碳酸钙或20~30%(w/w)氨水溶液。进一步,所述ph调节剂为10g/l碳酸钙或25%(w/w)氨水溶液。
进一步,所述静息细胞液的获取步骤为:所述第一阶段发酵步骤中的干酪乳杆菌细胞于发酵罐中培养后得到发酵培养液,将得到的所述发酵培养液进行离心,将分离得到的菌体用葡萄糖溶液重悬,得到静息细胞液。
进一步,所述静息细胞液的获取步骤为:所述第一阶段发酵步骤中的干酪乳杆菌细胞于发酵罐中培养12~20h后得到发酵培养液,将得到的所述发酵培养液置于0℃温度下以8000~12000r/min转速离心2~5min,将分离得到的菌体用葡萄糖溶液重悬,得到静息细胞液。
进一步,所述发酵罐中培养至稳定期的时间为12~16h。进一步,所述离心为:在0℃温度下以10000r/min转速离心2~5min。
进一步,所述第一阶段发酵的步骤包括:
种子培养:用无菌水将茄子瓶斜面中的菌体悬浮,取适量悬浮液接种于种子培养基中,接种量为17~18%,在35~39℃、100~120r/min培养箱中培养10~14h,得到种子培养液;
摇瓶发酵培养:将种子培养液接种于发酵培养基中,接种量为18~22%,于35~39℃、100~120r/min培养箱中摇瓶发酵培养22~26h,得到预发酵培养液;
罐发酵培养:将预发酵培养液接种于发酵培养基中,接种量为18~22%,在温度为35~39℃、转速为130~170rpm条件下于发酵罐中培养,通气量为0.11~0.14vvm,得到发酵培养液。
进一步,发酵过程中罐工作体积为4/5(v/v)。
进一步,所述第一阶段发酵的步骤中,在所述摇瓶发酵培养和所述罐发酵培养过程中,调节ph在5.8~6.2范围。
进一步,所述第一阶段发酵的步骤中,在所述摇瓶发酵培养和所述罐发酵培养过程中,调节ph为6.0。
进一步,所述第一阶段发酵的步骤包括:
种子培养:用无菌水将茄子瓶斜面中的菌体悬浮,取悬浮液接种于种子培养基中,接种量为17~18%,在37℃、110r/min培养箱中培养12h,得到种子培养液;
摇瓶发酵培养:将种子培养液接种于发酵培养基中,接种量为20%,于37℃、110r/min培养箱中摇瓶发酵培养24h,得到预发酵培养液;发酵初始加入一定量的碳酸钙调节过程ph;
罐发酵培养:将预发酵培养液接种于发酵培养基中,接种量为20%,在温度为37℃、转速为150rpm条件下于发酵罐中培养,通气量为0.125vvm,得到发酵培养液;采用25%(w/w)氨水溶液维持过程ph为6.0。
进一步,所述种子培养基包括:葡萄糖、蛋白胨、牛肉提取物、酵母提取物、柠檬酸氢二铵、磷酸氢二钠、无水乙酸钠、硫酸镁、硫酸锰、氯化钠、硫酸铁、碳酸钙和吐温-80。其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。
进一步,所述种子培养基包括:35~45g/l的葡萄糖、8~12g/l蛋白胨、8~12g/l牛肉提取物、9~11g/l酵母提取物、1.8~2.2g/l柠檬酸氢二铵、1.8~2.2g/l磷酸氢二钠、3.6~4.3g/l无水乙酸钠、0.18~0.22g/l硫酸镁、0.18~0.22g/l硫酸锰、0.02~0.04g/l氯化钠、0.008~0.012g/l硫酸铁、22~28g/l碳酸钙,以及0.8~1.5ml/l吐温-80。
进一步,所述种子培养基的初始ph值为5.8~6.2。进一步,所述种子培养基的初始ph值为6.0;采用氢氧化钠调节ph值。
进一步,所述种子培养基包括:40g/l的葡萄糖、10g/l蛋白胨、10g/l牛肉提取物、10g/l酵母提取物、2g/l柠檬酸氢二铵、2g/l磷酸氢二钠、4g/l无水乙酸钠、0.2g/l硫酸镁、0.2g/l硫酸锰、0.03g/l氯化钠、0.01g/l硫酸铁、25g/l碳酸钙,以及1ml/l吐温-80。
进一步,所述发酵培养基包括:葡萄糖、蛋白胨、酵母提取物、无水乙酸钠、硫酸镁、硫酸锰、氯化钠、硫酸铁。其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。
进一步,所述发酵培养基包括:100~140g/l葡萄糖、12~14g/l蛋白胨、12~14g/l酵母提取物、0.6~0.7g/l无水乙酸钠、0.012~0.015g/l硫酸镁、0.013~0.014g/l硫酸锰、0.012~0.015g/l氯化钠、0.013~0.014g/l硫酸铁。
进一步,所述种子培养基和所述发酵培养基于115℃灭菌20min。
进一步,所述发酵培养基包括:140g/l葡萄糖、13.33g/l蛋白胨、13.33g/l酵母提取物、0.67g/l无水乙酸钠、0.0133g/l硫酸镁、0.0133g/l硫酸锰、0.0133g/l氯化钠、0.0133g/l硫酸铁。
进一步,所述种子培养基和所述发酵培养基中的葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。
进一步,所述葡萄糖溶液经115℃灭菌20min。
本发明实施例中,所述干酪乳杆菌(lactobacillusparacaseincbio-01)为国家生化工程技术研究中心(上海)保藏菌株。
本发明中的材料及仪器为市售产品。
本发明实施例中,所述细胞浓度采用紫外-可见分光光度方法进行测定:用稀盐酸稀释所述发酵液至一定浓度,在紫外可见分光光度计下测定620nm波长时的吸光值,使得测定的光密度值(od)处于0.2~0.8之间。细胞生物量可通过细胞干重(dcw)来表示,两者关系为:1od相当于0.41g/ldcw。
本发明具体实施方式中,发酵液中l-乳酸和葡萄糖测定:取一定量实施例中的发酵液,在5000r/min条件下离心10min,弃去菌体,稀释上清液使得葡萄糖和l-乳酸浓度分别处于1g/l和0.5g/l以下。
本发明具体实施方式中,l-乳酸浓度和葡萄糖浓度通过sba-40c生物传感分析仪进行测定。
本发明的有益效果在于:
本发明的方法通过偶联干酪乳杆菌的细胞生长和细胞非生长来生产l-乳酸,能够有效增加细胞对底物的转化,同时在消耗少量营养物质的情况下,提高底物转化率。细胞在生长期能够快速生长并代谢葡萄糖生成l-乳酸。本发明偶联细胞非生长共同生产乳酸,能够减少发酵罐清洗、种子制备、细胞生长等一系列辅助时间,进而提升反应罐的体积产率和整个发酵过程l-乳酸的生产效率。
本发明利用干酪乳杆菌快速生长并代谢葡萄糖生成l-乳酸,同时在发酵结束后,利用其稳定期静息细胞能够在一定时间范围内仍保持非常高的细胞代谢活性,继续代谢葡萄糖生产l-乳酸。本发明能够使得干酪乳杆菌细胞在常规发酵结束后继续高密度高效生产l-乳酸,其生产速率是常规发酵阶段的2.4倍左右,而且l-乳酸转化率也表现出明显的提升,可达到0.985g/g,非常接近理论值(1.0g/g)。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例3~6中的第二阶段发酵的葡萄糖消耗速率和l-乳酸生产速率的数据图。
图2为本发明实施例7~14中的第二阶段发酵的l-乳酸比生产速率。
图3为本发明试验例3中的偶联细胞生长和细胞非生长生产l-乳酸的生产数据图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实施例提供一种高效生产l-乳酸的方法,偶联细胞生长和细胞非生长生产l-乳酸,包括如下步骤:
第一阶段发酵:包括利用干酪乳杆菌生长代谢葡萄糖生成l-乳酸的步骤;
第二阶段发酵:包括利用静息细胞发酵代谢葡萄糖快速生成l-乳酸的步骤;所述静息细胞为所述第一阶段发酵步骤后离心收集得到的稳定期的干酪乳杆菌细胞。
所述第一阶段发酵的步骤包括:
种子培养:用无菌水将茄子瓶斜面中的菌体悬浮,取适量悬浮液接种于种子培养基中,接种量为17~18%,在35~39℃、100~120r/min培养箱中培养,得到种子培养液;
摇瓶发酵培养:将种子培养液接种于发酵培养基中,接种量为18~22%,于37℃、110r/min培养箱中摇瓶发酵培养,得到预发酵培养液;
罐发酵培养:将预发酵培养液接种于发酵培养基中,接种量为18~22%,在温度为35~39℃、转速为130~170rpm条件下于发酵罐中培养,通气量为0.11~0.14vvm,发酵罐中培养,得到发酵培养液。
所述第一阶段发酵的步骤中,在所述摇瓶发酵培养和所述罐发酵培养过程中,调节ph在5.8~6.2范围。
所述第二阶段发酵的步骤包括:
将静息细胞液接种于发酵培养基中,细胞浓度为2.35~18.55g/l,添加葡萄糖发酵培养,得到发酵液;培养体系中的初始葡萄糖的浓度为60~140g/l,培养过程中加入ph调节剂维持体系ph值为5.8~6.2。
所述ph调节剂为8~12g/l碳酸钙或20~30%(w/w)氨水溶液。
所述静息细胞液的获取步骤为:所述第一阶段发酵步骤中的干酪乳杆菌细胞于发酵罐中培养12~20h后得到发酵培养液,将得到的所述发酵培养液置于0℃温度下以8000~12000r/min转速离心2~5min,将得到的菌体用葡萄糖溶液重悬,即可得到静息细胞液。
所述种子培养基包括:35~45g/l的葡萄糖、8~12g/l蛋白胨、8~12g/l牛肉提取物、9~11g/l酵母提取物、1.8~2.2g/l柠檬酸氢二铵、1.8~2.2g/l磷酸氢二钠、3.6~4.3g/l无水乙酸钠、0.18~0.22g/l硫酸镁、0.18~0.22g/l硫酸锰、0.02~0.04g/l氯化钠、0.01g/l硫酸铁、22~28g/l碳酸钙,以及0.8~1.5ml/l吐温-80。所述种子培养基的初始ph值为5.8~6.2。
所述发酵培养基包括:100~140g/l葡萄糖、12~14g/l蛋白胨、12~14g/l酵母提取物、0.6~0.7g/l无水乙酸钠、0.012~0.015g/l硫酸镁、0.013~0.014g/l硫酸锰、0.012~0.015g/l氯化钠、0.013~0.014g/l硫酸铁。
所述种子培养基和所述发酵培养基中的葡萄糖与其他成分分开配制。
实施例2
本实施例提供一种高效生产l-乳酸的方法,偶联细胞生长和细胞非生长生产l-乳酸,包括如下步骤:
第一阶段发酵:包括利用干酪乳杆菌生长代谢葡萄糖生成l-乳酸的步骤;
第二阶段发酵:包括利用静息细胞发酵代谢葡萄糖快速生成l-乳酸的步骤;所述静息细胞为所述第一阶段发酵步骤后离心收集得到的稳定期的干酪乳杆菌细胞。所述静息细胞保持着非常高的细胞代谢活性。
所述第一阶段发酵的步骤包括:
种子培养:用无菌水将茄子瓶斜面中的菌体悬浮,取适量悬浮液接种于种子培养基中,接种量为18%,在35℃、120r/min培养箱中培养10h,得到种子培养液;
摇瓶发酵培养:将种子培养液接种于发酵培养基中,接种量为22%,于35℃、120r/min培养箱中摇瓶发酵培养22h,得到预发酵培养液;
罐发酵培养:将预发酵培养液接种于发酵培养基中,接种量为22%,在温度为35℃、转速为170rpm条件下于5l发酵罐中培养,通气量为0.11vvm,得到发酵培养液。发酵过程中罐工作体积为4l。
所述第一阶段发酵的步骤中,在所述摇瓶发酵培养和所述罐发酵培养过程中,调节ph在5.8~6.2范围。
所述第二阶段发酵的步骤包括:将静息细胞液接种于发酵培养基中,细胞浓度为16.47g/l,添加葡萄糖发酵培养,得到发酵液;培养体系中的初始葡萄糖的浓度为60g/l,培养过程中加入ph调节剂维持体系ph值为5.8~6.2。所述ph调节剂为25%(w/w)氨水溶液。
所述静息细胞液的获取步骤为:所述第一阶段发酵步骤中的干酪乳杆菌细胞于发酵罐中培养12h后得到发酵培养液,将得到的所述发酵培养液置于0℃温度下以12000r/min转速离心2min,接着将得到的菌体用葡萄糖溶液重悬,得到静息细胞液。
所述种子培养基包括:45g/l的葡萄糖、8g/l蛋白胨、12g/l牛肉提取物、9g/l酵母提取物、2.2g/l柠檬酸氢二铵、1.8g/l磷酸氢二钠、4.3g/l无水乙酸钠、0.18g/l硫酸镁、0.22g/l硫酸锰、0.02g/l氯化钠、0.012g/l硫酸铁、22g/l碳酸钙,以及1.5ml/l吐温-80;其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。所述种子培养基的初始ph值为5.8~6.2。
所述发酵培养基包括:140g/l葡萄糖、12g/l蛋白胨、14g/l酵母提取物、0.6g/l无水乙酸钠、0.015g/l硫酸镁、0.013g/l硫酸锰、0.015g/l氯化钠、0.013g/l硫酸铁;其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。
实施例3
本实施例提供一种高效生产l-乳酸的方法,偶联细胞生长和细胞非生长生产l-乳酸,包括如下步骤:
第一阶段发酵:包括利用干酪乳杆菌生长代谢葡萄糖生成l-乳酸的步骤;
第二阶段发酵:包括利用静息细胞发酵代谢葡萄糖快速生成l-乳酸的步骤;
所述静息细胞为所述第一阶段发酵步骤后离心收集得到的稳定期的干酪乳杆菌细胞。所述静息细胞保持着非常高的细胞代谢活性。
所述第一阶段发酵的步骤包括:
种子培养:用50ml无菌水将茄子瓶斜面中的菌体悬浮,取15ml悬浮液接种于85ml种子培养基中,在37℃、110r/min培养箱中培养12h,得到种子培养液;
摇瓶发酵培养:将20ml种子培养液接种于80ml发酵培养基中,接种量为20%,于37℃、110r/min培养箱中摇瓶发酵培养24h,得到预发酵培养液;发酵初始加入适量的碳酸钙以调节过程ph在5.8~6.2范围;
罐发酵培养:将预发酵培养液接种于发酵培养基中,接种量为20%,在温度为37℃、转速为150rpm条件下于5l发酵罐中培养,通气量为0.125vvm,得到发酵培养液;发酵过程中罐工作体积为4l;采用25%(w/w)氨水溶液维持过程ph为6.0。
所述第二阶段发酵的步骤包括:将静息细胞液接种于发酵培养基中,细胞浓度为18.55g/l,添加葡萄糖发酵培养,得到发酵液;培养体系中的初始葡萄糖的浓度为100g/l,培养过程中加入ph调节剂维持体系ph值为6.0。所述ph调节剂为25%(w/w)氨水溶液。
所述静息细胞液的获取步骤为:所述第一阶段发酵步骤中的干酪乳杆菌细胞于发酵罐中培养14h后得到发酵培养液,将得到的所述发酵培养液置于0℃温度下以10000r/min转速离心4min,接着将得到的菌体用葡萄糖溶液重悬,得到静息细胞液。
所述种子培养基包括:40g/l的葡萄糖、10g/l蛋白胨、10g/l牛肉提取物、10g/l酵母提取物、2g/l柠檬酸氢二铵、2g/l磷酸氢二钠、4g/l无水乙酸钠、0.2g/l硫酸镁、0.2g/l硫酸锰、0.03g/l氯化钠、0.01g/l硫酸铁、25g/l碳酸钙,以及1ml/l吐温-80;其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。所述种子培养基的初始ph值为5.8~6.2。
所述发酵培养基包括:140g/l葡萄糖、13.33g/l蛋白胨、13.33g/l酵母提取物、0.67g/l无水乙酸钠、0.0133g/l硫酸镁、0.0133g/l硫酸锰、0.0133g/l氯化钠、0.0133g/l硫酸铁;其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。
实施例4~6
实施例4~6同实施例3相比,区别仅在于:实施例4~6中所述第二阶段发酵步骤的初始葡萄糖的浓度分别为80g/l、120g/l和140g/l,其他条件与实施例3完全相同。
实施例7
本实施例提供一种高效生产l-乳酸的方法,偶联细胞生长和细胞非生长生产l-乳酸,包括如下步骤:
第一阶段发酵:包括利用干酪乳杆菌生长代谢葡萄糖生成l-乳酸的步骤;
第二阶段发酵:包括利用静息细胞发酵代谢葡萄糖快速生成l-乳酸的步骤;所述静息细胞为所述第一阶段发酵步骤后离心收集得到的稳定期的干酪乳杆菌细胞。所述静息细胞保持着非常高的细胞代谢活性。
所述第一阶段发酵的步骤包括:
种子培养:用无菌水将茄子瓶斜面中的菌体悬浮,取适量悬浮液接种于种子培养基中,接种量为17%,在39℃、100r/min培养箱中培养14h,得到种子培养液;
摇瓶发酵培养:将种子培养液接种于发酵培养基中,接种量为18%,于39℃、100r/min培养箱中摇瓶发酵培养26h,得到预发酵培养液;
罐发酵培养:将预发酵培养液接种于发酵培养基中,接种量为18%,在温度为39℃、转速为130rpm条件下于5l发酵罐中培养,通气量为0.14vvm,得到发酵培养液。发酵过程中罐工作体积为4l。
所述第一阶段发酵的步骤中,在所述摇瓶发酵培养和所述罐发酵培养过程中,调节ph在5.8~6.2范围。
所述第二阶段发酵的步骤包括:将静息细胞液接种于发酵培养基中,细胞浓度为2.35g/l,添加葡萄糖发酵培养,得到发酵液;培养体系中的初始葡萄糖的浓度为140g/l,培养过程中加入ph调节剂维持体系ph值为5.8~6.2。所述ph调节剂为10g/l碳酸钙。
所述静息细胞液的获取步骤为:所述第一阶段发酵步骤中的干酪乳杆菌细胞于发酵罐中培养20h后得到发酵培养液,将得到的所述发酵培养液置于0℃温度下以8000r/min转速离心5min,接着将得到的菌体用葡萄糖溶液重悬,得到静息细胞液。
所述种子培养基包括:35g/l的葡萄糖、12g/l蛋白胨、8g/l牛肉提取物、11g/l酵母提取物、1.8g/l柠檬酸氢二铵、2.2g/l磷酸氢二钠、3.6g/l无水乙酸钠、0.22g/l硫酸镁、0.18g/l硫酸锰、0.04g/l氯化钠、0.008g/l硫酸铁、28g/l碳酸钙,以及0.8ml/l吐温-80;其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。所述种子培养基的初始ph值为5.8~6.2。
所述发酵培养基包括:100g/l葡萄糖、14g/l蛋白胨、12g/l酵母提取物、0.7g/l无水乙酸钠、0.012g/l硫酸镁、0.014g/l硫酸锰、0.012g/l氯化钠、0.014g/l硫酸铁;其中,所述葡萄糖与其他成分分开配制,单独配制葡萄糖溶液。
实施例8~14
实施例8~14与实施例7相比,区别仅在于:实施例8~14中所述第二阶段发酵步骤的静息细胞浓度分别为4.69g/l、7.43g/l、9.36g/l、11.94g/l、14.12g/l、16.47g/l和18.55g/l,其他条件与实施例7完全相同。
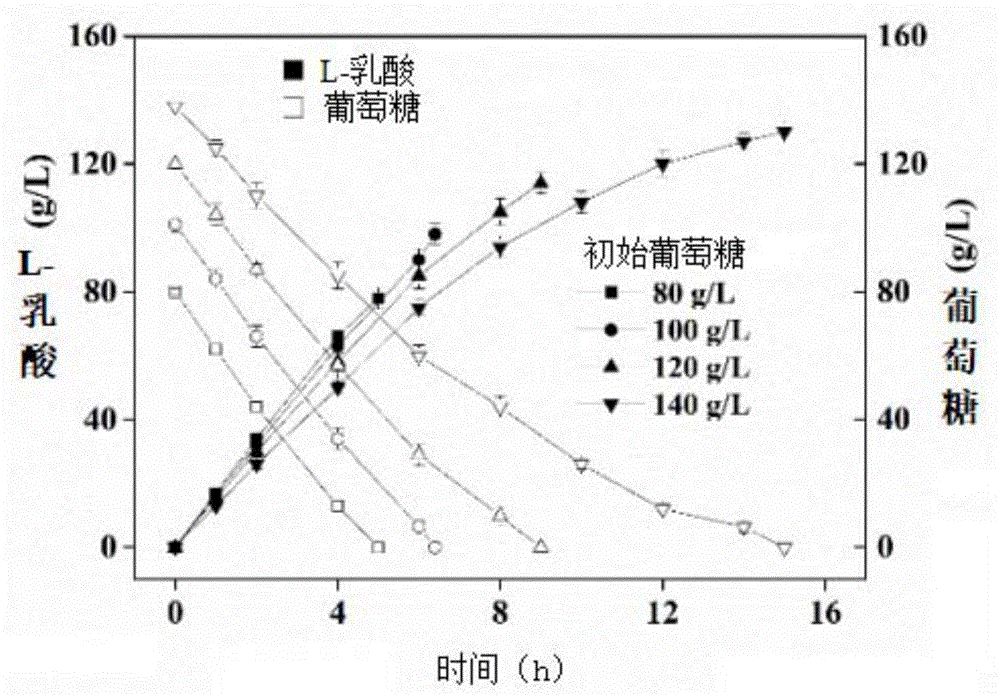
试验例1
本试验分别对本发明实施例3~6进行葡萄糖消耗速率和l-乳酸生产速率的检测,以检测静息细胞在不同初始葡萄糖浓度下的代谢能力,实验结果见图1所示。
根据图1可知,实验结果表明稳定期静息细胞能够在6h左右内仍维持很高的代谢活性,静息细胞能够完全耗尽所有葡萄糖。其中,当初始葡萄糖浓度为80和100g/l时,菌体能够非常快速的消耗完所有的葡萄糖(消耗时间分别为5h和6.4h),并生成l-乳酸,其葡萄糖消耗速率分别为16.0g/l/h、15.8g/l/h,l-乳酸生成速率分别为15.6g/l/h、15.3g/l/h。可见本发明能够完全耗尽100g/l的初始葡萄糖,生成98g/l的l-乳酸。可见,本发明的方法能够增加细胞对底物葡萄糖的转化,实现完全消耗葡萄糖,且提高葡萄糖的转化率,进而提升反应罐的体积产率和发酵过程整体生产l-乳酸的效率,最终实现了生产效率的提升。
试验例2
本试验分别对本发明实施例7~14进行比生产速率的检测,以观察不同静息细胞浓度的比生产速率,检测结果见图2所示。
根据图2可知,在起始的2h内,l-乳酸产量与细胞浓度呈线性关系,这也说明此阶段内菌体比生产速率基本维持不变;随着时间的增加,较低细胞浓度仍能维持与初始阶段一致的比生产速率,而较高细胞浓度的比生产速率则明显下降,然而通过分析上述试验例1可知,这可能是由于较高细胞浓度在前期会产生高浓度的乳酸,高浓度乳酸会显著抑制菌体的代谢,由此可知,较高细胞浓度时的静息细胞仍保持着高的代谢活性,而不是随着时间的增加降低细胞代谢活性。
试验例3
对本发明实施例3中高效生产l-乳酸的方法制得的产物进行检测,以观察生产的l-乳酸的整体情况,进行两批平行试验,试验结果见图3所示。
根据图3可知,在第一阶段,两批平行发酵能够很快地耗尽140g/l左右初始葡萄糖,产生近126g/l的l-乳酸,其葡萄糖消耗速率和l-乳酸生产速率分别为6.3g/l/h和5.9g/l/h,l-乳酸转化率为0.940g/g。
当第一阶段结束后,将两批平行发酵罐菌体通过离心合并继续进行静息细胞发酵,此时初始葡萄糖浓度为102g/l。由于此时细胞浓度为第一阶段单个发酵罐生物量的1.7倍左右,菌体能够在7h内耗尽所有的葡萄糖,生成98g/l的l-乳酸,其葡萄糖消耗速率、l-乳酸生产速率和l-乳酸转化率分别达到了14.6g/l/h、14.4g/l/h和0.985g/g。
由此可知,虽然处理稳定期静息细胞的时间可能需要1h左右,但是在第二阶段的生产速率要远远大于第一阶段,而且需要指出的是,第二阶段由于不存在细胞生长的原因,其l-乳酸转化率也要明显高于第一阶段,从而能够进一步提高生产效率。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!