重组载体及其制备方法、以及提高蔬菜作物芜菁花叶病毒抗性和/或产量的方法与流程
本发明总地涉及生物技术领域,具体涉及重组载体及其制备方法、以及提高蔬菜作物芜菁花叶病毒抗性和/或产量的方法。
背景技术:
微rnamicrorna(mirna)可调控靶标基因的mrna表达水平和翻译,因此在植物生长发育以及抗胁迫过程中发挥着重要的作用。在抗病过程中,mirna通过靶向抗病过程中的重要基因来影响植物与病原微生物的相互作用。
发明人早期研究发现,从油菜中克隆的mirnabra-mir1885a能够特异地被芜菁花叶病毒turnipmosaicvirus(tumv)诱导表达。tumv属于马铃薯y病毒科(potyviridae)成员,是世界五大对蔬菜作物造成最严重损坏的植物病原病毒之一。同时发现mir1885a能够靶向一系列的r基因,而植物r基因能够通过下游的水杨酸(sa)途径发挥抗病作用。但由于早期油菜基因组的参考序列并不完整,因而无法深入研究mir1885a在油菜与tumv互作中的作用。
技术实现要素:
本发明的目的在于提供能够捕获蔬菜作物mirnabra-mirna1885a的质粒载体,通过与mir1885a结合介导mir1885a的降解或是抑制其对靶标的调控。并提供了该载体的制备方法,以及一种提高蔬菜作物芜菁花叶病毒抗性和/或蔬菜作物产量的方法。
本发明提供了一种重组载体,其中,所述重组载体包括:如seqidno.8所示rna序列互补的结合位点。
优选地,根据前述的重组载体,其中,所述结合位点为完全互补或不完全互补。
更优选地,根据前述的重组载体,其中,所述不完全互补为所述结合位点包括不与seqidno.8所示rna序列互补的3-4个连续碱基,最优选地,所述结合位点序列为ggaatcataccctatttcattgatg(seqidno.11)。
优选地,根据前述的重组载体,其中,所述重组载体包括dna序列如seqidno.5所示。
或更优选地,根据前述的重组载体,其中,原始载体为植物双元表达载体。优选为pcambia-1300或pbi121。
本发明还提供了前述重组载体的制备方法,其中,所述方法包括:
(1)扩增dna片段,所述dna片段包括如seqidno.8所示rna序列互补的结合位点;
(2)通过重组反应将所述dna片段插入所述原始载体。
优选地,根据前述的制备方法,其中,所述方法包括:
(a)扩增包括如seqidno.5所示的dna片段;
(b)通过重组反应将所述dna片段插入所述原始载体。
本发明还提供了一种提高蔬菜作物芜菁花叶病毒抗性和/或蔬菜作物产量的方法,其中,所述方法包括抑制所述蔬菜作物中mir1885a的功能。
优选地,根据前述的方法,其中,所述抑制mir1885a的功能为降解mir1885a和/或抑制mir1885a对靶标的调控。
更优选地,根据前述的方法,其中,所述方法包括将前述的重组载体转化至所述蔬菜作物。
再优选地,根据前述的方法,其中,所述蔬菜作物为油菜、白菜或花椰菜。
本发明提供的载体的转录产物通过与mir1885a结合介导mir1885a的降解或是抑制其对靶标的调控。将该载体转化至蔬菜作物可获得阳性转基因蔬菜作物,该阳性转基因蔬菜作物不仅具有对病毒tumv更强的抗性;且出现叶片面积增大、果荚变大变长的表型。同时说明本发明提供的载体是与抗病、产量相关的质粒载体,可用于调控目的植物的抗病性以及产量。
附图说明
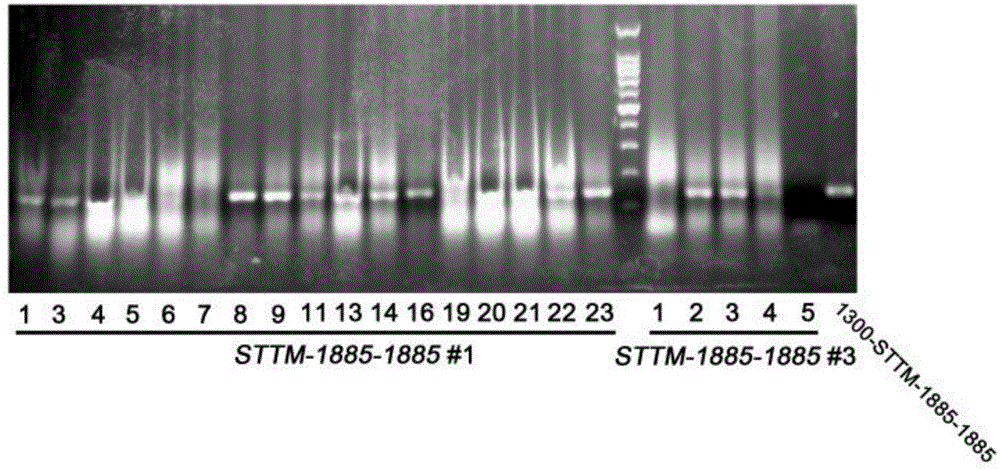
图1为t1代转基因植株dnapcr序列sttm-1885-1885的电泳图;
图2为t1代转基因阳性植株rnart-pcr检测sttm-1885-1885的rna片段表达;
图3为t1代转基因阳性植株叶片表型,其中,b.napus(westar)为野生型,sttm-1885-1885为t1代转基因阳性植株;
图4为t1代转基因阳性植株果荚表型,其中,b.napus(westar)为野生型,sttm-1885-18851为1号t1代转基因阳性株系,sttm-1885-18853为3号t1代转基因阳性株系;
图5为t2代转基因阳性植株tumv病毒摩擦接种实验,其中,a为tumv侵染sttm-1885-1885转基因b.napus的整株植物症状(7天和14天),b为tumv侵染sttm-1885-1885转基因b.napus的接种叶症状(7天和14天),c为tumv侵染sttm-1885-1885转基因b.napus的系统叶症状(7天和14天),b.napus为野生型,sttm-1885-18851-3为1号株系中的3号t2代转基因阳性植株,sttm-1885-18853-2为3号株系中的2号阳性植株,7dai为侵染后7天,14dai为侵染后14天。
图6为t2代转基因阳性植株tumv病毒摩擦接种northernblotting结果,其中,b.napus为野生型,sttm-1885-1885#1和sttm-1885-1885#3均为t2代转基因阳性植株。
具体实施方式
以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。
2011年白菜型油菜基因组序列发布,为进一步研究mir1885a的功能提供了可能性。通过发明人研究发现,bra-mir1885a(mirbaseaccessionmi0008302)基因能够加工产生两个mirna,即bra-mir1885a(mirbaseaccessionmimat0009213)和bra-mir1885b(mirbaseaccessionmimat0023015)。这两个mir1885能够靶向一系列的tir-nbs-lrr靶基因,并且其靶向区域位于tir结构域编码序列内。22nt的bra-mir1885a能够剪切bra027889(ncbiaccessiongbeq01027272)并产生21ntphasedsmall-interferingrnas(phasirnas),21ntphasirnas又能够靶向其他r基因。而植物r基因能够通过下游的sa途径发挥抗病作用。
基于上述研究发现,本发明提供了一种重组载体,该重组载体能够抑制蔬菜作物中mir1885a的功能。该重组载体启动子下游设计一个或多个mir1885a的结合位点,其转录产物通过与mir1885a结合介导mir1885a的降解或是抑制其对靶标的调控。将该重组载体转化到蔬菜作物中可得到阳性转基因植物。该阳性转基因植物对tumv具有更强的抗性,且出现叶片面积增大、果荚变大变长的表型。
该结合位点的转录产物与mir1885a完全互补或不完全互补。不完全互补是指该结合位点序列包括不与mir1885a互补的3-4个连续碱基,优选为3个连续碱基。该结合位点的转录产物与mir1885a结合时,前述连续碱基会形成凸起(bulged),提高该结合位点序列对mir1885a的结合和抑制效果。最优选地,所述结合位点序列为ggaatcataccctatttcattgatg。
该重组载体的原始载体为质粒载体。将完成构建的重组载体转化至蔬菜作物,通过将目的基因整合至该蔬菜作物的基因组中再进行转录。原始载体具体可为pcambia-1300、pbi121等植物双元表达载体。
在一种实施方案中,本发明具体提供了一种mir1885a的mimicry质粒载体sttm-1885-1885。sttm-1885-1885载体能够通过与mir1885a结合介导mir1885a的降解或是抑制其对靶标的调控。
基于上述研究发现,本发明还提供了一种提高蔬菜作物芜菁花叶病毒抗性和/或蔬菜作物产量的方法。该方法包括抑制所述蔬菜作物中mir1885a的功能,可通过降解mir1885a和/或抑制mir1885a对靶标的调控。具体方式为将本发明提供的重组载体转化至蔬菜作物,以使该蔬菜作物转录捕获mir1885a的rna片段。
本发明所述的蔬菜作物是指可以做菜、烹饪成为食品的,除了谷物以外的其他植物。具体可为油菜、白菜、花椰菜等。
以下通过实施例进一步说明本发明的内容。如未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段和市售的常用仪器、试剂,可参见《分子克隆实验指南(第3版)》(科学出版社)、《微生物学实验(第4版)》(高等教育出版社)以及相应仪器和试剂的厂商说明书等参考。
下述实施例中的根癌农杆菌eha105(elizabethe.hood.newagrobacteriumhelperplasmidsforgenetransfertoplants.transgenicresearch,july1993,volume2,issue4,pp208-218)公众可从中国科学院微生物研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的pot2-poly-cis载体(silencingofstress-regulatedmirnasinplantsbyshorttandemtargetmimic(sttm)approach(teotiaandtang,2017)为guiliangtang教授惠赠。
pot2-poly-cis载体也可通过参考文献constructionofshorttandemtargetmimic(sttm)toblockthefunctionsofplantandanimalmicrornas(guiliangtangetc.2012)中公开的制备方法进行制备。
实施例1sttm-1885-1885载体的构建
(1)利用pot2-poly-cis载体为模板,利用以下引物在longamptaq酶(购自neb公司)的催化下进行pcr扩增;
上游引物(5’→3’):gccatttaaatatggtctaaagaagaagaatggaatcataccctatttcattgatggaattcggtacgctgaaatcaccag(下划线为bra-mir1885a的反向互补序列)(seqidno.1)
下游引物(5’→3’):gccatttaaattagaccataacaacaacaaccatcaatgaaatagggtatgattccaagcttgggctgtcctctccaaatg(下划线为bra-mir1885a的序列)(seqidno.2)。
pcr扩增程序:
94℃,2分钟;
[94℃,30秒;58℃,30秒;68℃,4分钟]30个循环;
68℃,10分钟;
4℃,1分钟。
pcr产物回收后,进行swai单酶切。利用dna纯化柱纯化回收酶切片段后,线性酶切产物在dna连接酶的催化下自连接成环状载体。
利用下述引物扩增鉴定环状载体并测序:
上游引物(5’→3’):catttggagaggacagcccaag,(seqidno.3)
下游引物(5’→3’):ctggtgatttcagcgtaccgaa,(seqidno.4)。
将测序结果表明含有seqidno.5所示的dna分子的载体命名为pot2-sttm-1885-1885。
(2)以pot2-sttm-1885-1885载体为模板,以下引物扩增去除pot载体上的扩增起始位点:
上游引物(5’→3):tcccttaattaagtttgcaagcagcagattacgcg(seqidno.6),
下游引物(5’→3):tcccttaattaagaaaggcggacaggtatccggtaag(seqidno.7)。
pcr产物经dna纯化柱纯化回收,paci单酶切后纯化获得酶切片段。与经过paci单酶切后回收的pcambia-1300的线性化质粒(guiliangtang教授惠赠,也可从北京鼎国昌盛生物技术有限责任公司等各公司购买商用载体)连接,转化,经pcr及酶切和测序鉴定重组载体,将pcambia-1300的paci位点间的片段替换为包含基因sttm-1885-1885(即序列seqidno.5)和氯霉素筛选基因的dna分子,并保持pcambia-1300的其它核苷酸不变得到的重组载体命名为sttm-1885-1885。
实施例2甘蓝型油菜/sttm-1885-1885的获得
以westar生态型甘蓝型油菜(b.napuscv.westar)为受体植物,将重组载体sttm-1885-1885转入westar生态型甘蓝型油菜中,得到表达sttm-1885-1885片段的甘蓝型油菜/sttm-1885-1885。
具体方法如下:
(一)甘蓝型油菜的转化
1.1培养基制备
murashige&skoog(ms)培养基粉末(购自duchefu公司)
medium0培养基:1/2ms(ms2.2g),蔗糖30g,加双蒸水到950ml左右调ph5.8-6.0,再加双蒸水定容到1000ml,加植物琼脂phytagel(购自sigma公司)3.5g,113℃高温蒸汽灭菌20min。
稀释培养基:ms4.4g,蔗糖30g,加双蒸水到1000ml调ph5.8,113℃高温蒸汽灭菌20min。待此液态培养基冷却后在超净台中加1ml100mm乙酰丁香酮(as)后混匀备用。
medium2培养基:ms4.4g,蔗糖30g,甘露醇(manitol)18g,激动素(kinetin)0.3mg,phytagel3.5g,加双蒸水到1000ml调ph5.8,113℃高温蒸汽灭菌20min。待培养基冷却到50℃时加入1ml1mg/ml2,4-d,1ml500mg/ml羧苄青霉素(carbenicillin),200μl50mg/ml潮霉素b(hygromycinb)后混匀倒入培养皿中。
medium3培养基:ms4.4g,葡萄糖10g,木糖(xylose)0.25g,2-(n-吗啉)乙磺酸一水合物(mes)0.6g,phytagel3.5g,加双蒸水到1000ml调ph5.8,113℃高温蒸汽灭菌20min。待培养基冷却到50℃时加入1ml2mg/ml玉米素(zeatin),100μl1mg/ml吲哚乙酸(iaa),1ml500mg/mlcarbenicillin,200μl50mg/mlhygromycinb后混匀倒入培养皿中。
medium4培养基:ms4.4g,蔗糖10g,phytagel3.2g,加双蒸水到1000ml,调ph5.8,113℃高温蒸汽灭菌20min。待培养基冷却50℃时可直接倒板;也可加100μl1mg/mliaa后再倒板。
1.2甘蓝型油菜的转化
(a)甘蓝型油菜种子在30%84消毒液中消毒10-15min,无菌水冲洗3遍后,将种子置于medium0培养基(高瓶)上,24℃或27℃黑暗中生长6天左右(随生长速度而定,大部分油菜小苗下胚轴与高瓶高度平齐)。
(b)将质粒sttm-1885-1885转入根癌农杆菌株eha105,挑取单菌落在含卡那霉素的5mllb培养基中28℃250rpm震荡培养过夜。离心后用约2ml的稀释培养基悬浮菌体。
(c)滴3-5滴(依悬浮菌液的浓度调整,若过量,后期将无法抑制农杆菌的生长)步骤(b)中的农杆菌悬浮菌液于20-30ml稀释培养基中。
(d)将(a)中培养了6天的油菜下胚轴切成约1cm长的小段,浸泡在步骤(c)中的稀释培养基中30min。将浸泡过的下胚轴放置于灭过菌的滤纸上,24℃或27℃,黑暗培养3天。
(e)将步骤(d)中的下胚轴转到medium2培养基上,25-28℃,光照,培养16~21天(一般18天,注意防止褐化)。
(f)然后将经步骤(e)处理的下胚轴转到medium3培养基上,每两周换一次medium3培养基,25-28℃,光照培养。
(j)将长出芽的愈伤组织转到medium4培养基上25-28℃,光照,培养,直到生根。
(二)甘蓝型油菜/sttm-1885-1885的筛选及鉴定
转化后得到的当代植株即为t0代转基因植株。本实验中一共得到3株转基因植株。将t0代植株转移至进口土和蛭石1:1的土壤中,放于22℃16hr光照/8hr培养收取种子。得到的转基因种子为t1代转基因种子。
将t1代转基因种子铺于进口土和蛭石1:1的土壤中,放于22℃16hr光照/8hr黑暗的环境下培养7到9天后,挑选出能够正常萌发生长的植株转移到单独的装有1:1进口土和蛭石的盆中进行培养。待移苗成功后取少量的子叶材料,利用ctab法粗提取dna。以dna为模板,以下述引物扩增并鉴定转基因植株:
上游引物(5’→3’):catttggagaggacagcccaag(seqidno.3),
下游引物(5’→3’):ctggtgatttcagcgtaccgaa(seqidno.4)。
目的序列为148bp,扩增出目的大小条带的样品即为含有转基因片段的样品,相应的植株为t1转基因植株,命名为甘蓝型油菜/sttm-1885-1885植株。
在此过程中,t0代1号株系移苗23株,存活17株,阳性苗12株;2号株t1代种子稀少且萌发数量极少,舍弃;3号株萌发和移苗5株,存活5株,阳性苗2株(如图1)。
继续培养转基因阳性植株,丢弃转基因阴性植株。培养21天时分别收集叶片,利用trizol试剂提取叶片总rna后进行半定量的rt-pcr检测sttm-1885-1885的rna片段的表达(如图2)。
在这些sttm-1885-1885转基因阳性株中,sttm-1885-1885rna片段都有不同程度的表达,而在以水为阴性对照的样品中未检测到转基因片段的表达。这些结果进一步说明了,sttm-1885-1885转基因油菜阳性株确实能够表达相应的rna片段。
(三)甘蓝型油菜/sttm-1885-1885的表型观察
如图3和图4所示,t1代甘蓝型油菜/sttm-1885-1885植株中,1号和3号转基因株的14株阳性株都出现有叶片面积增大、果荚变大变长的表型:叶片长度增长率为20.82%±3.38%,叶片宽度增长率为16.80%±4.40%,果荚长度增长率为3.31%±1.87%,果荚直径增长率为21.79%±1.87%。
增长率计算为分别测量野生型植株(wt)和t1代甘蓝型油菜/sttm-1885-1885植株(1885)叶片长度和宽度,果荚长度和直径。wt和t1代植株各测量10株植株,每植株选择测量相同位置叶片各5片进行比较,果荚每植株测量5个果荚。
(四)甘蓝型油菜/sttm-1885-1885的tumv病毒接种
收取t1代转基因阳性植株的种子,并种植t1代种子,得到t2代油菜小苗,对其进行tumv病毒接种处理。观察t2代转基因植株对tumv的抗性反应;分别收集侵染后9天和14天的叶片,利用热酚法提取总rna进行northernbloting检测rna中的tumv病毒积累量以及bra-mir1885a的表达量。
挑选苗龄20天的t2代sttm-1885-1885转基因阳性油菜植株进行tumv病毒摩擦接种。
具体步骤如下:
(1)将研钵放在冰上预冷,然后取一定量包含有tumv病毒颗粒的拟南芥叶片在预冷的研钵中,并加入少量5mm的磷酸氢钠缓冲液(ph7.2)进行研磨。
(2)用装有金刚砂的喷壶喷植物叶片数次,直到适量的金刚砂喷于叶片之上。
(3)用研磨好的汁液轻轻摩擦叶片数下,注意要从叶尖向叶基部的方向摩擦。
(4)摩擦完后,5~10min后用清水轻轻淋洗叶片。
(5)将摩擦后的植物置于湿度大、黑暗环境中培养24hr后正常培养。
tumv侵染14天后观察tumv侵染症状(病斑大小以及数量),并统计症状情况。通过观察发现,sttm-1885-1885转基因油菜植株的tumv症状与对照野生型油菜相比有了明显地减轻(如图5)。相同的实验重复两次。第一次实验中,9株t2代转基因sttm-1885-1885植株1号株症状减轻,表现为病斑相对于野生型b.napus小并且少;5株t2代转基因sttm-1885-1885植株2号株症状减轻。第二次实验中,7株t2代转基因sttm-1885-1885植株1号株症状减轻;8株t2代转基因sttm-1885-1885植株2号株症状减轻.因此,sttm-1885-1885转基因油菜植株至少在症状上减轻了对tumv的抗性。
(五)northernblotting检测rna中的tumv病毒量
接下来收取了tumv侵染14天后的植株叶片,热酚法提取了rna,并利用northernblotting检测rna中的tumv病毒量。
5.1.热酚法提取植物组织rna,方法如下:
5.1.1所需试剂
提取缓冲液(0.1mlicl,100mmtris8.0,10mmedta,1%sds),酚混合液(水饱和酚:氯仿:异戊醇25:24:1),氯仿,异丙醇,3mnaac(ph5.6),75%乙醇,50%去离子甲酰胺,rnase-freeh2o。
5.1.2提取步骤
(a)将100~200mg用液氮泡过的植物材料在预冷的研钵中用液氮研磨成粉末,将粉末加入到65℃预热的700μl提取缓冲液加700μl酚混合液的液体中,振荡混匀。
(b)65℃放置5min后,室温放置5min。
(c)4℃,13000rpm,离心15min,将上清转移至新管中,加入等体积的酚混合液,振荡混匀。
(d)4℃,13000rpm,离心10min,将上清转移至新管中,加入等体积的氯仿,振荡混匀。
(e)4℃,13000rpm,离心10min,将上清转移至新管中,加入等体积的异丙醇(保存于-20℃),颠倒混匀后,室温放置10min。
(f)4℃,13000rpm,离心15min,弃上清,保留沉淀。
(g)沉淀为大分子量rna,用1ml75%乙醇漂洗沉淀。
(h)4℃,13000rpm,离心5min,弃乙醇。4℃,13000rpm,离心1min,去除残留液体。
(i)沉淀溶解于30~50μl50%去离子甲酰胺中。
提取rna后,以28s核糖体rna为内参,利用northernblotting来检测rna中的tumv病毒量。方法如下:
5.2制备探针
利用以下引物通过反转录pcr(rtpcr)扩增tumv病毒dna探针,模板为从包含有tumv病毒颗粒的拟南芥叶片中提取的rna:
上游引物(5’→3):gcgacaaggaagtaaatgctg,(seqidno.9)
下游引物(5’→3):tcggttaaattgcgctgaaga。(seqidno.10)
得到的pcr产物回收纯化后利用amersham公司随机引物标记试剂盒(rediprimetmiirandomprimerlabellingsystem)标记探针,步骤如下:
(a)取待标记的dna25ng,加无菌水,使体积扩增至45μl。
(b)98℃,保温5min,变性dna。
(c)离心,使dna聚集在离心管管底,放在冰上。
(d)将变性的dna加到标记混合物中,轻轻混匀,直到pellet完全融解(不能用枪吹打)。
(e)加1μlklenow酶(防止标记混合物中的klenow失活),离心。
(f)加3μlα-32p-dctp,用枪轻轻吹打均匀,离心。
(g)37℃,反应30~60min;98℃,5min,变性已标记好的dna探针,离心,放在冰上。
(h)取适量探针用于杂交,剩余的探针保存在4℃冰箱中。
5.3总rna电泳
所需试剂
20×ssc溶液的配制:175.3gnaci,88.2g柠檬酸三钠,用hcl调节ph至7.0,定容至1l,高压灭菌。
10×mops缓冲液的配制:41.8gmops,6.56gnaac,20ml0.5medta,用naoh调节ph至7.0,定容至1l,装在棕色瓶中,高压灭菌或过滤除菌。
亚甲基蓝染色液的配制(500ml):0.15克亚甲基蓝(终浓度为0.03%)完全溶解于500ml0.3mnaac(ph5.2)。
37%甲醛(formaldehyde),去离子甲酰胺(formamidedeionized)
rna电泳
1.2%琼脂糖甲醛变性胶的配制:
将琼脂糖与水加入500ml烧杯中,加热直至琼脂糖完全融化。将烧瓶冷却到60℃时加入10×mops以及37%甲醛溶液,混匀后导入至rna电泳胶槽,冷却备用。
rna样品(溶解在50%去离子甲酰胺中,上样15~30μg)的准备:
将samplebuffermix与rna样品等体积混匀,65℃,变性5min,置于冰上5min,加入rna加样缓冲液,混匀,上样。
rna电泳:电泳缓冲液:1×mops
电压=110v,大概3hr
5.4转膜(上行毛细管转移法)
(a)用长和宽均大于凝胶的板胶作为平台,放在塑料盘中,倒入20×ssc,剪一条与平台等宽,长度大于平台的滤纸,先将滤纸一端浸湿在塑料盘中,慢慢放在平台上,直到另一端也浸湿在20×ssc中,赶出滤纸和平台间的气泡。
(b)剪一张长和宽均略大于凝胶的尼龙膜,剪去左上角,完全浸湿在无菌水中,取出膜,再浸入20×ssc中,至少5min。
(c)电泳结束后,切掉凝胶的无用部分,并在左上角切去一角,以作为方位标记。将凝胶放在20×ssc中漂洗片刻。
(d)将凝胶倒放在平台上滤纸的中央,赶出胶和滤纸间的气泡,用parafilm围绕凝胶周围,不要碰到凝胶上的样品。
(e)用20×ssc浸湿凝胶,将湿润的尼龙膜放在凝胶上面,使二者切角重合,赶出尼龙膜和凝胶间的气泡。
(f)用20×ssc浸湿5张与尼龙膜同样大小的滤纸,放在尼龙膜上面,赶出滤纸和尼龙膜间的气泡。
(g)剪一叠15cm厚,略小于滤纸的纸巾,放在滤纸上面,纸巾上放一块玻璃板,再压上500g的重物,转移过夜。
(h)揭去凝胶上方的纸巾、滤纸和parafilm,翻转凝胶和尼龙膜,以凝胶一面在上放在一个塑料盘中,用铅笔在尼龙膜上标记凝胶加样孔的位置。
(i)取出尼龙膜,放在湿润的滤纸上,紫外交联固定rna。
(j)用亚甲基蓝染色液染色,直到看见清晰的核糖体rna条带,蒸馏水冲洗脱色,用保鲜膜包好,放在4℃保存待用。
5.5杂交
(a)预杂交:将杂交缓冲液加热至完全溶解。倒入杂交管中,放入交联固定的膜,65℃预杂1~2hr。
(b)杂交:向杂交管中加入45μl标记好的探针,65℃杂交过夜。
(c)洗膜:用洗膜缓冲液2×ssc/2%sds,在65℃/20min条件下洗膜两次;用0.2×ssc/0.2%sds,在65℃/20min条件下洗膜一次。
(d)压片:将洗好的膜从杂交管中拿出,转移至两层塑膜中,检测杂交信号强弱,将膜放入暗夹中常温过夜压片。
(e)扫描杂交结果:将膜放入磷屏(gehealthcare)中压过夜后,用磷屏成像系统(gehealthcare)检测磷屏信号强度。
northernblotting结果如图6所示,westar生态型油菜(受体植物)中有较强的tumv病毒杂交信号。而sttm-1885-1885#1和#2这两个t2代甘蓝型油菜/sttm-1885-1885株系中,无论是接种叶(localleaves)还是系统叶(systemicleaves),tumv病毒杂交信号明显减弱。
可见转入sttm-1885-1885rna片段的转基因油菜叶片中积累比野生油菜更少的病毒,此sttm-1885-1885转基因油菜具有对tumv更强的抗性。这些结果说明sttm-1885-1885rna是与抗病相关的rna,可用于调控目的植物的产量以及抗病性。
最后应说明的是:显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。
序列表
<110>中国科学院微生物研究所
<120>重组载体及其制备方法、以及提高蔬菜作物芜菁花叶病毒抗性和/或产量的方法
<130>180299ci
<160>11
<170>siposequencelisting1.0
<210>1
<211>81
<212>dna
<213>人工序列(artificialsequence)
<400>1
gccatttaaatatggtctaaagaagaagaatggaatcataccctatttcattgatggaat60
tcggtacgctgaaatcaccag81
<210>2
<211>81
<212>dna
<213>人工序列(artificialsequence)
<400>2
gccatttaaattagaccataacaacaacaaccatcaatgaaatagggtatgattccaagc60
ttgggctgtcctctccaaatg81
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
catttggagaggacagcccaag22
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
ctggtgatttcagcgtaccgaa22
<210>5
<211>148
<212>dna
<213>人工序列(artificialsequence)
<400>5
catttggagaggacagcccaagcttggaatcataccctatttcattgatggttgttgttg60
ttatggtctaatttaaatatggtctaaagaagaagaatggaatcataccctatttcattg120
atggaattcggtacgctgaaatcaccag148
<210>6
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>6
tcccttaattaagtttgcaagcagcagattacgcg35
<210>7
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>7
tcccttaattaagaaaggcggacaggtatccggtaag37
<210>8
<211>22
<212>rna
<213>甘蓝型油菜(brassicanapus)
<400>8
caucaaugaaagguaugauucc22
<210>9
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>9
gcgacaaggaagtaaatgctg21
<210>10
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>10
tcggttaaattgcgctgaaga21
<210>11
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>11
ggaatcataccctatttcattgatg25
- 还没有人留言评论。精彩留言会获得点赞!