用于寡核苷酸治疗剂的大规模平行发现方法与流程
[0001]
本发明涉及治疗性寡核苷酸分析和发现领域,并提供了用于对修饰的寡核苷酸进行基于引物的平行测序的方法,所述方法提供可用于寡核苷酸治疗性发现、制造、质量保证、治疗性开发和患者监测的基于序列的质量信息。
背景技术:
[0002]
ep 1 914 317 a1公开了一种用于定性和定量检测长度为约8至50个核苷酸的短核酸序列的方法。该方法采用重叠捕获探针和聚合酶延伸的杂交。ep'317的实例使用dna硫代磷酸酯寡核苷酸g3139。
[0003]
wo 01/34845 a1公开了一种用于从体液或提取物中定量硫代磷酸酯寡核苷酸的方法。该方法采用与寡核苷酸部分杂交的捕获探针,然后对捕获探针/寡核苷酸杂交体进行酶标记,然后检测标记。wo'845的实例使用dna硫代磷酸酯寡核苷酸isis 2302。
[0004]
caifu等人,nar 33(2005)e179公开了使用基于捕获探针/pcr的扩增系统检测和定量未修饰的短寡核苷酸,诸如microrna。
[0005]
froim等人,var(1995)4219-4223公开了用于通过具有uv检测的毛细管电泳进行硫代磷酸酯反义dna测序的方法。
[0006]
tremblay等人,bioanalysis(2011)3(5)公开了一种基于双连接的杂交测定,用于特异性测定寡核苷酸治疗药物,并用于特异性测定实施定量pcr的复杂混合物中的单个代谢物。
[0007]
wo2007/025281公开了一种用于使用捕获探针杂交、连接和扩增来检测短寡核苷酸的方法。
[0008]
cheng等人,molecular therapey nucleic acids(2013)e67公开了用于鉴定脑穿透适体的体内指数富集的配基系统进化技术(selex)。适体是2'氟修饰的磷酸二酯寡核苷酸,使用onestep rt-pcr试剂盒(qiagen)或superscript iii逆转录酶进行第一链合成,通过sanger测序或illumina测序进行测序。
[0009]
crouzier等人,plos one(2012)e359900涉及使用superscript iii有效逆转录锁定的核酸核苷酸,以产生抗核酸酶的rna适体。crouzier等人使用基于sanger的测序对从lna适体寡核苷酸的第一链合成获得的pcr扩增产物进行测序。值得注意的是,lna适体在另外的rna磷酸二酯核苷背景中具有单个lna核苷。
[0010]
本发明人已经提供了3'捕获探针连接和基于聚合酶对修饰的寡核苷酸(诸如2'-o-moe和lna修饰的寡核苷酸)的检测,其能够对此类修饰的寡核苷酸进行大规模平行测序。先前,如pct/ep2017/078695中所述,发明人已经开发了一种方法,用于检测、定量、扩增、测序或克隆核苷修饰的寡核苷酸(诸如lna修饰的寡核苷酸),该方法基于使用捕获探针对修饰的寡核苷酸进行3'捕获,然后对核苷修饰的寡核苷酸进行链延伸以及检测、定量、扩增、测序或克隆。pct/ep2017/078695公开了volcano2g聚合酶作为合适的酶用于链延伸的用途。
[0011]
本发明人所开发方法的效率高,不仅使修饰的寡核苷酸的捕获和基于pcr的检测成为可能,而且首次实现了对修饰的寡核苷酸样本的大规模平行测序,这是一项革命性的技术,为寡核苷酸治疗剂发现、制造、质量保证、治疗性开发和患者监测提供了关键的新工具。
[0012]
发明概述
[0013]
本发明提供用于对修饰的寡核苷酸(诸如2'糖修饰的寡核苷酸,诸如lna寡核苷酸或2-o-甲氧基乙基寡核苷酸)进行测序的方法,所述方法包括以下顺序步骤:
[0014]
(i)对包含修饰的寡核苷酸的寡核苷酸模板进行聚合酶介导的第一链合成,以产生包含修饰的寡核苷酸的互补序列的核酸序列;
[0015]
(ii)对步骤(i)的第一链合成产物进行基于引物的测序。
[0016]
本发明提供对修饰的寡核苷酸群体(诸如2'糖修饰的寡核苷酸,诸如lna寡核苷酸群体或2-o-甲氧基乙基寡核苷酸群体)进行平行测序的方法,所述方法包括以下步骤:
[0017]
(i)对寡核苷酸模板的群体进行聚合酶介导的第一链合成,其中群体的每个成员是或包含修饰的寡核苷酸,以产生核酸序列的文库,每个核酸序列包含存在于寡核苷酸群体中的修饰的寡核苷酸的互补序列;
[0018]
(ii)对步骤(i)的第一链合成产物的群体进行基于引物的测序。
[0019]
在步骤(i)之后和步骤(ii)之前,可以执行pcr扩增步骤:在一些实施方案中,基于引物的测序步骤可包括在步骤(ii)之前或作为步骤(ii)一部分的第一链合成产物的克隆扩增。在一些实施方案中,克隆扩增采用固相扩增或乳液相扩增。
[0020]
本发明提供了一种用于对修饰的寡核苷酸的核碱基序列进行测序的方法,所述方法包括以下步骤:
[0021]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸的3'末端;
[0022]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含所述修饰的寡核苷酸的互补序列的核酸序列;
[0023]
c.对步骤b)中获得的第一链合成产物进行基于引物的测序。
[0024]
本发明提供了一种用于对修饰的寡核苷酸群体的碱基序列进行平行测序的方法,所述方法包括以下步骤:
[0025]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的3'末端;
[0026]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0027]
c.对步骤b)中获得的第一链合成产物的群体进行基于引物的平行测序。
[0028]
本发明提供一种对修饰的寡核苷酸(诸如2'糖修饰的硫代磷酸酯寡核苷酸)的核碱基序列进行测序的方法,所述方法包括以下步骤:
[0029]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸的3'末端;
[0030]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含所述修饰的寡核苷酸的互补序列的核酸序列;
[0031]
c.将衔接子探针连接至步骤b中获得的所述第一链合成产物的3'端;以及随后
[0032]-对步骤c)中获得的所述连接产物进行基于引物的测序;或者
[0033]-对步骤c)中获得的所述连接产物进行pcr扩增并且对pcr扩增产物进行基于引物的测序。
[0034]
本发明提供一种方法,用于对修饰的寡核苷酸群体(诸如2'糖修饰的硫代磷酸酯寡核苷酸群体)的核碱基序列进行平行测序,所述方法包括以下步骤:
[0035]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的3'末端;
[0036]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0037]
c.将衔接子探针连接至步骤b中获得的所述第一链合成产物的3'端;以及随后
[0038]-对步骤c)中获得的所述连接产物进行基于引物的平行测序;或者
[0039]-对步骤c)中获得的所述连接产物进行pcr扩增并且对所述pcr扩增产物进行基于引物的平行测序。
[0040]
本发明提供了一种用于对修饰的寡核苷酸的核碱基序列进行测序的方法,所述方法包括以下步骤:
[0041]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸的3'末端;
[0042]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含所述修饰的寡核苷酸的互补序列的核酸序列;
[0043]
c.对步骤b)中获得的第一链合成产物进行基于引物的测序;其中基于引物的测序步骤包括使用克隆扩增引物对第一链合成步骤(b)进行克隆扩增,其中一个克隆扩增引物对3'捕获探针是特异的,而第二个克隆扩增引物对修饰的寡核苷酸(诸如修饰的寡核苷酸的5'区域)是特异的。
[0044]
本发明提供了一种用于对修饰的寡核苷酸群体的碱基序列进行平行测序的方法,所述方法包括以下步骤:
[0045]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的3'末端;
[0046]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0047]
c.对步骤b)中获得的第一链合成产物的群体进行基于引物的平行测序,其中基于引物的平行测序步骤包括使用克隆扩增引物对第一链合成步骤(b)进行克隆扩增,其中一个克隆扩增引物对3'捕获探针是特异的,而第二个克隆扩增引物对修饰的寡核苷酸(诸如修饰的寡核苷酸的5'区域)是特异的。
[0048]
本发明提供了一种用于对修饰的寡核苷酸的核碱基序列进行测序的方法,所述方法包括以下步骤:
[0049]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸的3'末端;
[0050]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含所述修饰的寡核苷酸的互补序列的核酸序列;
[0051]
c.对步骤b)中获得的第一链合成产物进行pcr扩增;使用引物,其中一个pcr引物对3'捕获探针是特异的,而第二个pcr引物对修饰的寡核苷酸(诸如修饰的寡核苷酸的5'区域)是特异的。
[0052]
d.对步骤c)的pcr扩增产物进行基于引物的测序
[0053]
本发明提供了一种用于对修饰的寡核苷酸群体的碱基序列进行平行测序的方法,所述方法包括以下步骤:
[0054]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的3'末端;
[0055]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0056]
c.对步骤b)中获得的第一链合成产物进行pcr扩增;使用引物,其中一个pcr引物对3'捕获探针是特异的,而第二个pcr引物对修饰的寡核苷酸(诸如修饰的寡核苷酸的5'区域)是特异的。
[0057]
d.对步骤c)的pcr扩增产物进行基于引物的平行测序
[0058]
本发明提供了一种用于对修饰的寡核苷酸的核碱基序列进行测序的方法,所述方法包括以下步骤:
[0059]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸的3'末端;
[0060]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含所述修饰的寡核苷酸的互补序列的核酸序列;
[0061]
c.将第一链合成产物(例如聚腺苷酸)的3'末端聚核苷酸。
[0062]
d.使用包含与聚核苷酸3'末端互补的序列的引物(例如带有polyt序列的第二链合成引物)进行第二链合成,
[0063]
e.对步骤d)中获得的第二链合成产物进行基于引物的测序。
[0064]
本发明提供了一种用于对修饰的寡核苷酸群体的碱基序列进行平行测序的方法,所述方法包括以下步骤:
[0065]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的3'末端;
[0066]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0067]
c.将第一链合成产物(例如聚腺苷酸)的3'末端聚核苷酸。
[0068]
d.使用包含与聚核苷酸3'末端互补的序列的引物(例如带有polyt序列的第二链合成引物)进行第二链合成,
[0069]
e.对步骤d)中获得的第二链合成产物进行基于引物的平行测序。
[0070]
本发明提供了一种用于对修饰的寡核苷酸的核碱基序列进行测序的方法,所述方法包括以下步骤:
[0071]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸的3'末端;
[0072]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含所述修饰的
寡核苷酸的互补序列的核酸序列;
[0073]
c.将第一链合成产物(例如聚腺苷酸)的3'末端聚核苷酸。
[0074]
d.使用包含与聚核苷酸3'末端互补的序列的引物(例如带有polyt序列的第二链合成引物)进行第二链合成,
[0075]
e.对第二链合成产物进行pcr扩增
[0076]
f.对步骤e)中获得的pcr产物进行基于引物的测序。
[0077]
本发明提供了一种用于对修饰的寡核苷酸群体的碱基序列进行平行测序的方法,所述方法包括以下步骤:
[0078]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的3'末端;
[0079]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0080]
c.将第一链合成产物(例如聚腺苷酸)的3'末端聚核苷酸。
[0081]
d.使用包含与聚核苷酸3'末端互补的序列的引物(例如带有polyt序列的第二链合成引物)进行第二链合成,
[0082]
e.对第二链合成产物进行pcr扩增
[0083]
f.对步骤e)中获得的pcr产物进行基于引物的测序。
[0084]
适当地,pcr引物可以是对3'捕获探针特异的第一pcr引物和对第二链合成引物(是第二链合成引物)特异的第二pcr引物。
[0085]
本发明提供了一种用于确定来自共同的寡核苷酸合成轮次或一组独立的寡核苷酸合成轮次的修饰的寡核苷酸群体中序列异质性的方法,所述方法包括以下步骤:
[0086]
(i)获得或合成修饰的寡核苷酸,
[0087]
(ii)执行根据本发明的用于对修饰的寡核苷酸进行平行测序的方法,
[0088]
(iii)分析在步骤(ii)中获得的序列数据,以鉴定修饰的寡核苷酸群体的序列异质性。
[0089]
本发明提供了一种用于验证修饰的寡核苷酸的序列的方法,所述方法包括以下步骤:
[0090]
(i)获得或合成修饰的寡核苷酸
[0091]
(ii)执行根据本发明的用于对修饰的寡核苷酸进行平行测序的方法,
[0092]
(iii)分析获得的序列数据,以验证修饰的寡核苷酸的序列
[0093]
本发明提供了一种用于确定修饰的寡核苷酸的纯度的方法
[0094]
(i)获得或合成修饰的寡核苷酸
[0095]
(ii)执行根据本发明的用于对修饰的寡核苷酸进行平行测序的方法,
[0096]
(iii)分析获得的序列数据,以确定修饰的寡核苷酸的纯度。
[0097]
本发明提供了平行测序的用途,诸如大规模平行测序用于对修饰的寡核苷酸群体的核碱基序列进行测序的用途。
[0098]
本发明提供了边合成边测序测序用于对修饰的寡核苷酸的核碱基序列进行测序的用途。
[0099]
本发明提供了边合成边测序测序用于对平行修饰的寡核苷酸群体的核碱基序列进行测序的用途。
[0100]
本发明提供了边合成边测序测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的质量的用途。
[0101]
本发明提供了边合成边测序测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的序列的异质性和每个独特序列的出现的用途。
[0102]
本发明提供了边合成边测序测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的质量的用途。
[0103]
本发明提供了边合成边测序测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的异质性的用途。
[0104]
本发明提供了基于引物的测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的质量的用途。
[0105]
本发明提供了基于引物的测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的序列的异质性和每个独特序列的出现的用途。
[0106]
本发明提供了诸如大规模平行测序的平行测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的质量的用途。
[0107]
本发明提供了诸如大规模平行测序的平行测序用于确定修饰的寡核苷酸诸如治疗性寡核苷酸的合成或制造轮次的产物的质量的用途。
[0108]
本发明提供了taq聚合酶,诸如seq id no 1或与seq id no 1具有至少70%同一性的dna聚合酶诸如volcano2g聚合酶,用于从包含lna修饰的硫代磷酸酯寡核苷酸或2'-o-甲氧基乙基修饰的硫代磷酸酯寡核苷酸的模板进行第一链合成的用途。
[0109]
本发明提供用于鉴定在细胞中具有增强的细胞摄取的修饰的寡核苷酸或修饰的寡核苷酸序列的方法,所述方法包括:
[0110]
i.施用修饰的寡核苷酸群体,其中修饰的寡核苷酸群体的每个成员包含对细胞独特的核碱基序列;
[0111]
ii.一段时间后,从细胞内分离修饰的寡核苷酸,
[0112]
iii.对步骤(ii)中获得的修饰的寡核苷酸进行本发明的平行测序方法;以
[0113]
iv.鉴定在细胞或细胞的群体中富集的一种或多种修饰的寡核苷酸序列。
[0114]
本发明提供一种鉴定在哺乳动物的靶组织或细胞中富集的修饰的寡核苷酸(序列)的方法,所述方法包括:
[0115]
i.向哺乳动物施用修饰的寡核苷酸的混合物,其中修饰的寡核苷酸的混合物的每个成员包含独特的核碱基序列,
[0116]
ii.允许修饰的寡核苷酸分布在哺乳动物体内,例如至少6个小时;
[0117]
iii.从哺乳动物的包含目的靶组织或目的靶细胞的一个或多个组织或细胞中分离出修饰的寡核苷酸群体,
[0118]
iv.对步骤iii中获得的修饰的寡核苷酸群体进行本发明的平行测序方法,以
[0119]
v.鉴定在哺乳动物的目的靶组织或细胞中富集的修饰的寡核苷酸序列。
[0120]
本发明提供用于鉴定具有增强的细胞摄取的修饰的寡核苷酸或修饰的寡核苷酸序列的方法,所述方法包括:
[0121]
在一些实施方案中,修饰的寡核苷酸是lna修饰的寡核苷酸,诸如lna硫代磷酸酯寡核苷酸。在一些实施方案中,修饰的寡核苷酸是lna修饰的寡核苷酸,诸如lna硫代磷酸酯寡核苷酸,其进一步包含缀合物基团,诸如n-乙酰半乳糖胺(galnac)部分,诸如三价galnac部分。
[0122]
在一些实施方案中,修饰的寡核苷酸是2'-糖修饰的寡核苷酸,诸如2'-o-甲氧基乙基硫代磷酸酯寡核苷酸,诸如2'-o-甲氧基乙基硫代磷酸酯寡核苷酸,其可任选地进一步包含缀合物基团,诸如n-乙酰半乳糖胺(galnac)部分,诸如三价galnac部分。
[0123]
本发明提供包含一个或多个2'修饰的核苷的寡核苷酸的缀合物,诸如反义寡核苷酸的缀合物,诸如硫代磷酸酯反义寡核苷酸的缀合物,或lna寡核苷酸的缀合物(诸如lna缺口聚体或混聚体),其中缀合物包含所述寡核苷酸和选自图中所示的基团b至t的缀合物部分,任选地具有接头基团(诸如位于寡核苷酸和缀合物部分之间的烷基接头)。适当地,缀合物部分可定位于寡核苷酸的5'末端或3'末端。
[0124]
附图简述
[0125]
图1小图a显示生成以用于测试不同的聚合酶读取lna寡核苷酸的能力的两个单链测试模板分子的示意图。ltt1包含具有lna寡核苷酸的片段(浅灰色),其包含8个lna碱基和11个硫代磷酸酯主链修饰。dtt1是对照模板,其包含与ltt1相同的碱基序列但仅使用具有磷酸二酯主链的dna碱基。(b)示出sybr金染色的15%tbe尿素凝胶,其中dcp1与实施例1的寡核苷酸lna o1(泳道b)和dna o1(泳道c)之间的连接反应。在泳道a中,连接反应中不存在寡核苷酸。
[0126]
图2小图a示出实施例2中6种不同的eva green ddpcr反应中微滴的荧光强度的一维图。用于每个反应的模板分子显示在每个读出泳道上方。粉色线表示手动设置的阈值线,用于分隔阳性微滴和阴性微滴。
[0127]
图3显示实施例3中执行的不同eva green ddpcr反应中微滴的荧光强度。用于在42℃下在ltt1上产生第一链拷贝1小时的酶显示在图上方(左侧6个泳道)。右侧6个泳道是对照反应,在模板上直接运行ddpcr,没有第一链合成。所用模板显示在图上方。
[0128]
图4显示来自实施例4的存在不同浓度的不同添加剂的情况下ltt1模板上的evagreen ddpcr中微滴的荧光强度。添加剂及其浓度显示在图上。添加剂的浓度显示在图上方。小图e显示在小图a-d中所示的反应中检测到的ltt1的定量。小图g显示存在9%peg和含量增加的1,2-丙二醇的情况下,ltt1模板上的evagreen ddpcr中微滴的荧光强度。小图h显示小图g中阳性微滴的数量定量,示出进一步添加1,2-丙二醇不会增加阳性微滴的数量。
[0129]
图5显示来自实施例5的ltt1上第一链合成的ddpcr反应结果。图5小图a显示在没有pcr添加剂的情况下第一链taq聚合酶合成上的ddpcr反应。pcr循环次数显示在每个反应的图的下方。图5小图b显示第一链合成反应期间存在10%peg和0.31m时ddpcr反应的结果pcr循环次数显示在每个反应的图的下方。图5小图c显示没有taq聚合酶存在的情况下相同的反应。pcr循环次数显示在每个反应的图的下方。图5小图e和f显示在有和没有10%peg和0.31m 1.3-丙二醇添加剂的情况下,在hf缓冲液中使用phusion dna聚合酶进行第一链合成反应的ddpcr。图5小图d显示在7个测试条件(a、b、c、d、e、f)下检测到的ltt1拷贝数的定量。
[0130]
图6小图a显示sybr金染色的15%tbe尿素凝胶分离了实施例6中所述的单个捕获
探针和寡核苷酸之间的连接反应。白色正方形表示从包含连接产物的凝胶切下的面积。小图b-e显示进行实施例6中所述的数据处理后四个捕获探针中每一个的前10个最频繁的18个碱基对读长。输入lna寡核苷酸的序列显示在每个表格上方。
[0131]
图7.4种示例性捕获探针(i)-(iv)的关键设计特征,用于捕获例如修饰的糖,例如lna寡核苷酸或立体定向寡核苷酸:
[0132]
区域a:5'端被磷酸化以实现连接。区域a与区域g形成第一双链体(形成非线性捕获探针)。区域g和a碱基配对形成细胞内环,稳定靶标修饰的寡核苷酸向5'磷酸的定位,从而增强连接。
[0133]
区域b包含反应条形码,并且是任选的,尽管对于平行测序非常有利。区域c可以包含简并核苷酸或通用碱基的区域,并且可以任选地使用,例如作为分子条形码。区域b和区域c可以采用任何顺序。
[0134]
区域d对于使用例如固相引物的下一代测序应用有利,并且用于将连接产物或pcr扩增产物杂交到测序平台上(例如流通池结合引物)。备选地,如果包括pcr扩增步骤,可使用包含用于测序平台的结合位点的pcr引物。区域d也可用作第一引物结合位点。
[0135]
区域e是一个任选的第一引物结合位点,可与区域d重叠。
[0136]
区域h是3'核苷酸的区域,其与修饰的寡核苷酸的3'端杂交,从而将修饰的寡核苷酸连接至捕获探针的5'端。区域h可以是简并序列或者可以是本文所述的预定序列。捕获探针的3'端被封闭以便连接,从而避免自我连接。本文举例说明了3'氨基修饰,但也可以使用其他3'阻断基团。
[0137]
区域f'示出的实施方案中,捕获探针借助位于区域d下游(或可能与区域d重叠)的双链体区域内的可裂解键合自引发。
[0138]
细线代表连接所示区域的任选核苷,并且如本文所述,这些可以被非核苷接头取代。
[0139]
图8小图a显示sybr金染色的15%tbe尿素凝胶,分离了实施例7中所述的单个捕获探针和寡核苷酸之间的连接反应。白色正方形表示从包含连接产物的凝胶切下的面积。小图b-e显示进行实施例7中所述的数据处理后四个捕获探针中每一个的前10个最频繁的18个碱基对读长。输入lna寡核苷酸的序列显示在每个表格上方。
[0140]
图9显示实施例8中所述反应的前10个最频繁的15个碱基对读长。
[0141]
图10小图a显示在1x 45min第一链合成反应上进行的evagreen ddpcr反应中微滴的荧光强度。检测到的拷贝数定量示于图10小图b中,以每ul反应的拷贝数为单位显示浓度。图10小图c显示在使用1、3或5轮第一链合成进行的反应上执行的evagreen ddpcr反应中微滴的荧光强度。在每个反应中检测到的拷贝数定量示于图10的小图d中,以每微升反应的拷贝数为单位显示浓度。
[0142]
图11.皮下注射后4h相对于未缀合的寡核苷酸(seq id 35)的肝脏富集倍数。与未缀合的寡核苷酸(seq id 35)相比,galnac缀合的寡核苷酸(seq id 22)以及seq id 26显示出3.5倍的肝脏富集。
[0143]
图12.皮下注射后4h相对于未缀合的寡核苷酸化合物seq id 35的血浆富集倍数。与裸寡核苷酸seq id 35相比,具有c16脂肪酸缀合的寡核苷酸(seq id 46)显示出12.5倍的血浆丰度。galnac缀合的寡核苷酸(seq id 22)显示从血浆耗减。
[0144]
定义
[0145]
寡核苷酸
[0146]
如本文所用,术语“寡核苷酸”定义为如技术人员通常理解的包含两个或以上共价连接的核苷的分子。这样的共价结合的核苷也可以称为核酸分子或寡聚物。寡核苷酸通常在实验室中通过固相化学合成然后纯化的方式制备。当提及寡核苷酸的序列时,提及的是共价连接的核苷酸或核苷的核碱基部分或其修饰的序列或顺序。在本发明的背景中,寡核苷酸是人造的,并且是化学合成的,并且可被纯化或分离。
[0147]
修饰的寡核苷酸
[0148]
术语修饰的寡核苷酸描述了一种寡核苷酸,其包含一个或多个糖修饰的核苷和/或修饰的核苷间键合和/或缀合物部分的存在。
[0149]
在一些实施方案中,修饰的寡核苷酸是治疗性寡核苷酸。
[0150]
在一些实施方案中,修饰的寡核苷酸包含至少两个连续的2'糖修饰的核苷。在一些实施方案中,修饰的寡核苷酸包含至少两个连续的2'糖修饰的核苷,其独立地选自由lna核苷和2'-o-甲氧基乙基核苷组成的组。在一些实施方案中,修饰的寡核苷酸包含至少两个连续的lna核苷。在一些实施方案中,修饰的寡核苷酸包含至少两个连续的2'-o-甲氧基乙基核苷。在一些实施方案中,修饰的寡核苷酸包含至少三个连续的2'糖修饰的核苷,其独立地选自由lna核苷和2'-o-甲氧基乙基核苷组成的组。
[0151]
在一些实施方案中,修饰的寡核苷酸包含至少三个连续的lna核苷。在一些实施方案中,修饰的寡核苷酸包含至少三个连续的2'-o-甲氧基乙基核苷。在一些实施方案中,修饰的寡核苷酸包含至少四个连续的2'糖修饰的核苷,其独立地选自由lna核苷和2'-o-甲氧基乙基核苷组成的组。在一些实施方案中,修饰的寡核苷酸包含至少四个连续的lna核苷。在一些实施方案中,修饰的寡核苷酸包含至少四个连续的2'-o-甲氧基乙基核苷。在一些实施方案中,修饰的寡核苷酸包含至少五个连续的2'糖修饰的核苷,其独立地选自由lna核苷和2'-o-甲氧基乙基核苷组成的组。
[0152]
在一些实施方案中,修饰的寡核苷酸在修饰的寡核苷酸的3'端包含至少两个连续的2'糖修饰的核苷。在一些实施方案中,修饰的寡核苷酸在修饰的寡核苷酸的3'端包含至少三个连续的2'糖修饰的核苷。在一些实施方案中,修饰的寡核苷酸在修饰的寡核苷酸的3'端包含至少四个连续的2'糖修饰的核苷。在一些实施方案中,修饰的寡核苷酸在修饰的寡核苷酸的3'端包含至少五个连续的2'糖修饰的核苷。
[0153]
在一些实施方案中,修饰的寡核苷酸在3'端包含至少两个连续的2'糖修饰的核苷,其独立地选自由lna核苷和2'-o-甲氧基乙基核苷组成的组。在一些实施方案中,修饰的寡核苷酸在3'端包含至少两个连续的lna核苷。在一些实施方案中,修饰的寡核苷酸在3'端包含至少两个连续的2'-o-甲氧基乙基核苷。
[0154]
在一些实施方案中,修饰的寡核苷酸在3'端包含至少三个连续的2'糖修饰的核苷,其独立地选自由lna核苷和2'-o-甲氧基乙基核苷组成的组。在一些实施方案中,修饰的寡核苷酸在3'端包含至少三个连续的lna核苷。在一些实施方案中,修饰的寡核苷酸在3'端包含至少三个连续的2'-o-甲氧基乙基核苷。在一些实施方案中,修饰的寡核苷酸在3'端包含至少四个连续的2'糖修饰的核苷,其独立地选自由lna核苷和2'-o-甲氧基乙基核苷组成的组。
[0155]
在一些实施方案中,修饰的寡核苷酸包含至少一个或多个糖修饰的核苷,诸如一个或多个lna核苷,并且还包含修饰的核苷间键合,诸如硫代磷酸酯核苷间键合。在一些实施方案中,修饰的寡核苷酸包含至少一个或多个2'取代的核苷,例如2'-o-甲氧基乙基核苷,并且还包含修饰的核苷间键合,例如硫代磷酸酯核苷间键合。
[0156]
在一些实施方案中,修饰的寡核苷酸在3'最末端位置包含lna核苷,或在3'最末端位置包含2'取代的核苷,诸如2'-甲氧基乙基或2-o-甲基;并且可以进一步包含硫代磷酸酯核苷间键合。优选地,修饰的寡核苷酸可以是,例如,长度为7至50个连续核苷酸,诸如长度为7-30个连续核苷酸,诸如长度为10-24个连续核苷酸,诸如长度为12-20个连续核苷酸。
[0157]
主链修饰的寡核苷酸
[0158]
主链修饰的寡核苷酸是一种寡核苷酸,其包含至少一个除磷酸二酯以外的核苷间键合。修饰的寡核苷酸有利地是主链修饰的寡核苷酸,诸如硫代磷酸酯寡核苷酸。在一些实施方案中,修饰的寡核苷酸是硫代磷酸酯寡核苷酸,其中修饰的寡核苷酸的核苷之间至少70%的核苷间键合是硫代磷酸酯核苷间键合,诸如至少80%,诸如至少90%,诸如所有核苷间键合是硫代磷酸酯核苷间键合。
[0159]
糖修饰的寡核苷酸
[0160]
糖修饰的寡核苷酸是包含至少一个核苷的寡核苷酸,其中核糖被除脱氧核糖(dna核苷)或核糖(rna核苷)以外的部分取代。糖修饰的寡核苷酸包括2'碳被除氢或羟基以外的取代基取代的核苷,以及双环核苷(lna)。在一些实施方案中,糖修饰是除2'氟rna以外的。
[0161]
2'糖修饰的核苷
[0162]
2'糖修饰的核苷是一种核苷,其在2'位置具有除h或-oh以外的取代基(2'取代的核苷)或包含能够在2'碳与核糖环中的第二个碳原子之间形成桥的2'连接双基,诸如lna(2'-4'双基桥连)核苷。
[0163]
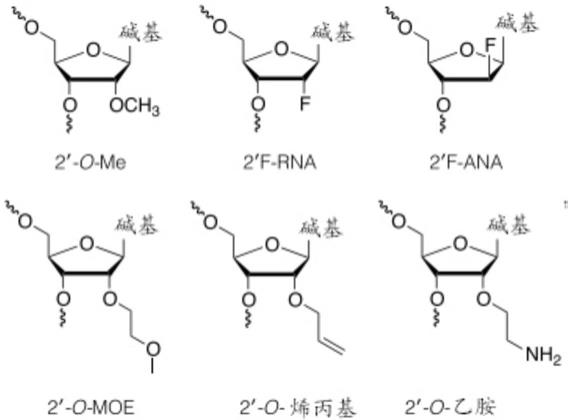
事实上,人们已花费很多精力开发2'糖取代的核苷,并且发现许多2'取代的核苷掺入寡核苷酸后具有有益的特性。例如,2'修饰的糖可以提供增强的结合亲和力和/或增加的对寡核苷酸的核酸酶抗性。2'取代的修饰的核苷的实例是2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna、2'-氟rna、未锁核酸(una)和2'-f-ana核苷。有关进一步的实例,请参见例如freier与altmann;nucl.acid res.,1997,25,4429-4443和uhlmann;curr.opinion in drug development,2000,3(2),293-213和deleavey和damha,chemistry and biology 2012,19,937。下面是一些2'取代的修饰的核苷的示意图。
[0164][0165]
关于本发明,2'取代的糖修饰的核苷不包括像lna那样的2'桥连的核苷。
[0166]
在一些实施方案中,修饰的寡核苷酸不包含2'氟修饰的核苷酸。在一些实施方案中,修饰的寡核苷酸包含至少2个连续的修饰的核苷,其独立地选自2'-o-烷基-rna、2'-o-2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna和lna核苷组成的组-这些是在2'位置包含一个大体积侧基修饰的核苷。
[0167]
锁核酸(lna)
[0168]“lna核苷”是一种2'-修饰的核苷,其包含链接所述核苷的核糖环的c2'和c4'的双基(也称为“2'-4'桥”),其限制或锁定核糖环的构象。这些核苷在文献中也称为桥连核酸或双环核酸(bna)。将lna掺入互补rna或dna分子的寡核苷酸中时,核糖构象的锁定与杂交的增强亲和力(双链体稳定化)有关。这可以常规地通过测量寡核苷酸/互补双链体的解链温度确定。
[0169]
非限制性的示例性lna核苷公开于wo 99/014226、wo 00/66604、wo 98/039352、wo 2004/046160、wo 00/047599、wo 2007/134181、wo 2010/077578、wo 2010/036698、wo 2007/090071、wo 2009/006478、wo 2011/156202、wo 2008/154401、wo 2009/067647,wo 2008/150729、morita等人,bioorganic&med.chem.lett.12,73-76、seth等人j.org.chem.2010,vol 75(5)pp.1569-81和mitsuoka等人,nucleic acids research 2009,37(4),1225-1238和wan和seth,j.medical chemistry 2016,59,9645-9667中。
[0170]
其他非限制性的示例性lna核苷公开于方案1中。
[0171]
方案1:
[0172][0173]
特定的lna核苷是β-d-氧-lna、6'-甲基-β-d-氧lna诸如(s)-6'-甲基-β-d-氧-lna(scet)和ena。
[0174]
一种特别有利的lna是β-d-氧基-lna。
[0175]
2'取代的寡核苷酸
[0176]
在一些实施方案中,核苷修饰的寡核苷酸包含至少一个2'取代的核苷,例如至少一个3'末端2'取代的核苷。在一些实施方案中,2'取代的寡核苷酸是缺口聚体寡核苷酸、混聚体寡核苷酸或总聚体(totalmer)寡核苷酸。在一些实施方案中,2'取代选自由2'甲氧基乙基(2'-o-moe)或2'-o-甲基组成的组。在一些实施方案中,核苷修饰的寡核苷酸的3'核苷酸是2'取代的核苷,诸如2'-o-moe或2'-o-甲基。在一些实施方案中,寡核苷酸不包含多于四个的连续核苷修饰的核苷。在一些实施方案中,寡核苷酸不包含多于三个的连续核苷修饰的核苷。在一些实施方案中,寡核苷酸在3'末端包含2个2'-o-moe修饰的核苷酸。在一些实施方案中,核苷修饰的寡核苷酸包含硫代磷酸酯核苷间键合,并且在一些实施方案中,存在于寡核苷酸中的至少75%的核苷间键合是硫代磷酸酯核苷间键合。在一些实施方案中,修饰的核苷寡核苷酸的所有核苷间键合都是硫代磷酸酯核苷间键合。硫代磷酸酯连接的寡核苷酸广泛用于哺乳动物的体内应用,包括其作为治疗药物的用途。
[0177]
在一些实施方案中,糖修饰的寡核苷酸的长度为7-30个核苷酸,诸如8-25个核苷酸。在一些实施方案中,糖修饰的寡核苷酸的长度为10-20个核苷酸,诸如12-18个核苷酸。
[0178]
核苷寡核苷酸可任选地被缀合,例如与galnac缀合物。如果它们被缀合,那么缀合物基团优选位于除寡核苷酸的3'位置以外,例如,缀合可以在5'末端。
[0179]
lna寡核苷酸
[0180]
在一些实施方案中,核苷修饰的寡核苷酸包含至少一个lna核苷,例如至少一个3'末端lna核苷。在一些实施方案中,lna寡核苷酸是缺口聚体寡核苷酸、混聚体寡核苷酸或总聚体寡核苷酸。在一些实施方案中,lna寡核苷酸不包含多于四个的连续lna核苷。在一些实施方案中,lna寡核苷酸不包含多于三个的连续lna核苷。在一些实施方案中,lna寡核苷酸在3'末端包含2个lna核苷酸。
[0181]
缺口聚体(gapmer)
[0182]
在一些实施方案中,核苷修饰的寡核苷酸可以是缺口聚体寡核苷酸。
[0183]
如本文所用,术语缺口聚体是指反义寡核苷酸,其包含rnase h募集寡核苷酸的区域(缺口
-‘
g’),其在5'侧翼和3'侧翼由侧翼区域(
‘
f’)侧接,该侧翼区域包含一个或多个核苷修饰的核苷酸,例如亲和力增强的修饰的核苷(在侧翼或翼中)。缺口聚体的长度通常为12-26个核苷酸,在一些实施方案中,其可包含6-14个dna核苷的中央区域(g),其两侧侧接侧翼区域f,该侧翼区域f包含至少一个核苷修饰的核苷酸,例如1-6个核苷修饰的核苷(f
1-6
g
6-14
f
1-6
)。位于与缺口区域(例如dna核苷区域)相邻的每个侧翼中的核苷是核苷修饰的核苷酸,例如lna核苷或2'-o-moe核苷。在一些实施方案中,侧翼区域中的所有核苷都是核苷修饰的核苷,例如lna核苷和/或2'-o-moe核苷,然而,除了核苷修饰的核苷(其在一些实施方案中不是末端核苷)之外,侧翼还可包含dna核苷。
[0184]
在一些实施方案中,侧翼区域中的所有核苷都是2'-o-甲氧基乙基核苷(moe缺口聚体)。
[0185]
lna缺口聚体
[0186]
术语lna缺口聚体是缺口聚体寡核苷酸,其中侧翼中的至少一种亲和力增强的修饰的核苷是lna核苷。在一些实施方案中,核苷修饰的寡核苷酸是lna缺口聚体,其中寡核苷酸的3'末端核苷是lna核苷。在一些实施方案中,寡核苷酸的2个3'末端核苷是lna核苷。在一些实施方案中,lna缺口聚体的5'侧翼和3'侧翼均包含lna核苷,并且在一些实施方案中,核苷修饰的寡核苷酸是lna寡核苷酸,例如缺口聚体寡核苷酸,其中寡核苷酸的所有核苷是lna核苷或dna核苷。
[0187]
混合翼缺口聚体
[0188]
术语混合翼缺口聚体或混合侧翼缺口聚体是指其中至少一个侧翼区域包含至少一个lna核苷和至少一个非lna修饰的核苷,诸如至少一个2'取代的修饰的核苷,诸如,例如2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna、2'-氟-rna和2'-f-ana核苷。在一些实施方案中,混合翼缺口聚体具有一个仅包含lna核苷(例如5'或3')的侧翼,而另一个侧翼(分别为3'或5')包含2'取代的修饰的核苷并且任选地包含lna核苷。在一些实施方案中,混合翼缺口聚体在侧翼中包含lna核苷和2'-o-moe核苷。
[0189]
混聚体(mixmers)
[0190]
混聚体是一种既包含核苷修饰的核苷又包含dna核苷的寡核苷酸,其中该寡核苷酸不包含超过4个连续的dna核苷。混聚体寡核苷酸通常用于核酸靶标非rna聚合酶(rnaseh)介导的调控,例如用于微rna(microrna)的抑制或用于mrna前体(pre-mrna)的剪接转换调控。
[0191]
总聚体(totalmer)
[0192]
总聚体是一种核苷修饰的寡核苷酸,其中存在于寡核苷酸中的所有核苷均是核苷修饰的。总聚体可以仅包含一种类型的核苷修饰,例如可以是完整的2
’-
o-moe或完整的2
’-
o-甲基修饰的寡核苷酸,或完整的lna修饰的寡核苷酸,或可以包含不同核苷修饰的混合物,例如lna核苷和2
’-
o-moe核苷的混合物。在一些实施方案中,总聚体可包含一个或两个3’末端lna核苷。
[0193]
微小寡核苷酸(tinys)
[0194]
微小寡核苷酸是长度为7-10个核苷酸的寡核苷酸,其中寡核苷酸中的每个核苷均为lna核苷。微小寡核苷酸已知是靶向microrna的特别有效的设计。
[0195]
立体定向寡核苷酸(stereodefined oligonucleotide)
[0196]
在一些实施方案中,修饰的寡核苷酸是立体定向寡核苷酸。立体定向寡核苷酸是一种寡核苷酸,其中至少一个核苷间键合是立体定向核苷间键合。
[0197]
立体定向硫代磷酸酯寡核苷酸是一种寡核苷酸,其中至少一个核苷间键合是立体定向硫代磷酸酯核苷间键合。
[0198]
rna干扰(rnai)和小干扰rna(sirna)
[0199]
在一些实施方案中,修饰的寡核苷酸可以是rnai分子,例如sirna或sirna有义和/或反义链。在本文中,术语“rna干扰(rnai)分子”是指通过rna减少沉默复合物(risc)抑制rna表达或翻译的任何分子。小干扰rna(sirna)通常是包含有义和反义寡核苷酸的双链rna复合物,当将其施用于细胞时,会导致反义链掺入risc复合物(sirisc)中,从而导致细胞中互补rna靶核酸的翻译或降解的risc相关抑制。有义链也称为过客链,反义链也称为前导链。小发夹rna(shrna)是单个核酸分子,其形成能够通过risc降解mrna的发夹结构。rnai核酸分子可以化学合成(对于sirna复合体而言是典型的)或通过体外转录合成,或从载体表达。
[0200]
通常,sirna的反义链(或shrna的反义区域)的长度为17-25个核苷酸,诸如19-23个核苷酸。在sirna复合物中,反义链和有义链形成双链体,其可包含例如1-3个核苷酸的3'末端突出端,或者可以是平末端(双链体的一个或两个末端均无突出端)。
[0201]
应当认识到的是,rnai可以由较长的双链核糖核酸(dsrna)底物介导,该dsrna底物在细胞内被加工成sirna(该过程被认为涉及dsrna内切核酸酶dicer)。dicer底物的有效扩展形式已在us 8,349,809和us 8,513,207中进行了描述,在此通过引用并入。
[0202]
rnai试剂可使用修饰的核苷酸间键合和高亲和力的核苷进行化学修饰,例如2'-4'双环核糖修饰的核苷,包括lna和cet。参见例如公开了2'-o-甲基修饰的sirna的wo 2002/044321,公开了在称为silna的sirna复合物中使用lna核苷的wo2004083430,以及公开了在诸如silna复合物的sirna中使用不连续过客链的wo2007107162。wo03006477公开了rnai的sirna和shrna(也称为strna)寡核苷酸介质。harborth等人,antisense nucleic acid drug dev.2003年4月;13(2):83-105涉及小干扰rna和短发夹rna的序列、化学和结构
变异,以及对哺乳动物基因沉默的影响。
[0203]
应当认识到的是,本发明的方法能够同时对sirna复合物的两条链进行测序。
[0204]
反义寡核苷酸
[0205]
在一些实施方案中,修饰的寡核苷酸是反义寡核苷酸。
[0206]
如本文所用,术语“反义寡核苷酸”定义为能够通过与靶核酸特别是与靶核酸上的连续序列杂交来调节靶标基因的表达的寡核苷酸。反义寡核苷酸基本上不是双链的,因此不是sirna或shrna。反义寡核苷酸是单链的。应当理解的是,单链寡核苷酸可以形成发夹或分子间双链体结构(同一寡核苷酸的两个分子之间的双链体),只要其内部或相互间的自身互补程度小于寡核苷酸全长的50%。
[0207]
在一些实施方案中,反义寡核苷酸是糖修饰的寡核苷酸。
[0208]
核苷酸
[0209]
核苷酸是寡核苷酸和多核苷酸的组成部分,并且出于本发明的目的,包括天然存在的和非天然存在的核苷酸。实际上,核苷酸诸如dna核苷酸和rna核苷酸包括核糖部分、核碱基部分和一个或多个磷酸基团(在核苷中不存在)。核苷和核苷酸也可以可互换地称为“单元”或“单体”。
[0210]
修饰的核苷
[0211]
如本文所用,术语“修饰的核苷”或“核苷修饰”是指与同等的dna或rna核苷相比,通过引入糖部分或(核)碱基部分的一种或多种修饰而被修饰的核苷。在一个优选的实施方案中,修饰的核苷包含修饰的糖部分。术语修饰的核苷在本文中还可与术语“核苷类似物”或修饰的“单元”或修饰的“单体”互换使用。具有未修饰的dna糖部分的核苷或rna糖部分的核苷在本文中称为dna或rna核苷。如果允许watson crick碱基配对,则dna核碱基区域或rna核碱基区域中修饰的核苷通常仍称为dna或rna。
[0212]
修饰的核苷间键合
[0213]
如技术人员通常所理解的,术语“修饰的核苷间键合”定义为除磷酸二酯(po)键合以外的键合,其将两个核苷共价偶联在一起。因此,本发明的寡核苷酸可包含修饰的核苷间键合。在一些实施方案中,与磷酸二酯键合相比,修饰的核苷间键合增加了寡核苷酸的核酸酶抗性。对于天然存在的寡核苷酸,核苷间键合包括在相邻核苷之间产生磷酸二酯键的磷酸基团。修饰的核苷间键合可用于稳定体内使用的寡核苷酸,并可用于防止本发明的寡核苷酸中dna核苷区域或rna核苷区域的核酸酶裂解,例如在缺口聚体寡核苷酸的缺口区域内以及在修饰的核苷区域中,例如区域f和f'。
[0214]
在一个实施方案中,寡核苷酸包含一个或多个由天然磷酸二酯修饰的核苷间键合,例如一个或多个修饰的核苷间键合,其例如对核酸酶的攻击更具抗性。核酸酶抗性可以通过在血清中孵育寡核苷酸或通过使用核酸酶抗性测定(例如蛇毒磷酸二酯酶(svpd))来确定,都是本领域中众所周知的。能够增强寡核苷酸的核酸酶抗性的核苷间键合称为抗核酸酶核苷间键合。在一些实施方案中,寡核苷酸或其连续核苷酸序列中至少50%的核苷间键合被修饰,诸如至少60%,诸如至少70%,诸如至少80%,诸如至少90%的寡核苷酸或其连续核苷酸序列中的核苷间键合是抗核酸酶核苷间键合。在一些实施方案中,寡核苷酸的所有核苷间键合或其连续核苷酸序列是抗核酸酶核苷间键合。应当认识到的是,在一些实施方案中,将本发明的寡核苷酸与非核苷酸官能团诸如缀合物连接的核苷可以是磷酸二
酯。
[0215]
优选的修饰的核苷间键合是硫代磷酸酯。
[0216]
硫代磷酸酯核苷间键合由于核酸酶抗性、有益的药代动力学和易于制造而特别有益。在一些实施方案中,寡核苷酸或其连续核苷酸序列中至少50%的核苷间键合是硫代磷酸酯,诸如至少60%,诸如至少70%,诸如至少80%,诸如至少90%的寡核苷酸或其连续核苷酸序列中的核苷间键合是硫代磷酸酯。在一些实施方案中,寡核苷酸的所有核苷间键合或其连续核苷酸序列是硫代磷酸酯。
[0217]
抗核酸酶键合,例如硫代磷酸酯键合,在与靶核酸形成双链体时能够募集核酸酶的寡核苷酸区域中特别有用,诸如缺口聚体的区域g。然而,硫代磷酸酯键合也可用于非核酸酶募集区域和/或亲和力增强区域,如缺口聚体的区域f和f'。在一些实施方案中,缺口聚体寡核苷酸可在区域f或f'或同时在区域f和f'中包含一个或多个磷酸二酯键合,其中区域g中的核苷间键合可以完全是硫代磷酸酯。
[0218]
有利地,寡核苷酸的连续核苷酸序列中的所有核苷间键合都是硫代磷酸酯键合。
[0219]
应当认识到的是,如ep2 742 135中所公开的,反义寡核苷酸可包含其他核苷间键合(除磷酸二酯和硫代磷酸酯以外),例如烷基膦酸酯/甲基膦酸酯间核苷,其根据ep2 742 135可以例如以其他方式被dna硫代磷酸酯的缺口区域中所耐受。
[0220]
核碱基
[0221]
术语核碱基包括存在于核苷和核苷酸中的嘌呤(例如腺嘌呤和鸟嘌呤)和嘧啶(例如尿嘧啶、胸腺嘧啶和胞嘧啶)部分,其在核酸杂交中形成氢键。在本发明的背景中,术语核碱基也涵盖修饰的核碱基,其可以不同于天然存在的核碱基,但是在核酸杂交期间起作用。在此背景中,“核碱基”是指天然存在的核碱基,例如腺嘌呤、鸟嘌呤、胞嘧啶、胸苷、尿嘧啶、黄嘌呤和次黄嘌呤,以及非天然存在的变体。此类变体例如描述于hirao等人(2012)accounts of chemical research第45卷第2055页和bergstrom(2009)current protocols in nucleic acid chemistry suppl.37 1.4.1中。
[0222]
在一些实施方案中,核碱基部分被修饰,其方式是将嘌呤或嘧啶改变为修饰的嘌呤或嘧啶,诸如取代的嘌呤或取代的嘧啶,诸如选自异胞嘧啶、假异胞嘧啶、5-甲基胞嘧啶、5-巯基胞嘧啶、5-丙炔基胞嘧啶、5-丙炔基尿嘧啶、5-溴尿嘧啶、5-噻唑尿嘧啶、2-硫代尿嘧啶、2'硫代胸腺嘧啶、肌苷、二氨基嘌呤、6-氨基嘌呤、2-氨基嘌呤、2,6-二氨基嘌呤和2-氯-6-氨基嘌呤的核碱基。
[0223]
核碱基部分可以由每个相应核碱基的字母代码来表示,例如a、t、g、c或u,其中每个字母可以任选地包括具有同等功能的修饰的核碱基。例如,在示例性的寡核苷酸中,核碱基部分选自a、t、g、c和5-甲基胞嘧啶。任选地,对于lna缺口聚体,可以使用5-甲基胞嘧啶lna核苷。
[0224]
核碱基序列
[0225]
核碱基序列是指存在于寡核苷酸或多核苷酸中的核碱基的序列。寡核苷酸的核碱基序列通常是指a、t、c和g核碱基的序列。因此,在通过测序方法鉴定的核碱基序列中可将寡核苷酸中5-甲基胞嘧啶碱基的存在鉴定为的胞嘧啶残基。同样,在测序方法中可将尿嘧啶核碱基可鉴定为酪氨酸碱基。
[0226]
核酸序列
[0227]
术语“核酸序列”是指一种核酸分子,其包含核苷酸的连续序列,并且可以包含存在于修饰的寡核苷酸或其反向互补序列中的核苷酸序列。
[0228]
互补性
[0229]
术语“互补性”描述了核苷/核苷酸的watson-crick碱基配对的能力。watson-crick碱基对是鸟嘌呤(g)-胞嘧啶(c)和腺嘌呤(a)-胸腺嘧啶(t)/尿嘧啶(u)。应当理解的是,寡核苷酸可包含具有修饰的核碱基的核苷,例如,经常使用5-甲基胞嘧啶代替胞嘧啶,因此,术语互补性涵盖未修饰的和修饰的核碱基之间的watson crick碱基配对(参见例如hirao等人(2012)accounts of chemical research第45卷第2055页和bergstrom(2009)current protocols in nucleic acid chemistry suppl.37 1.4.1)。
[0230]
同一性(核苷酸序列)
[0231]
如本文所用,术语“同一性”是指核酸分子(例如寡核苷酸)中连续核苷酸序列的核苷酸比例(以百分比表示),该核酸分子跨连续核苷酸序列与参考序列(例如序列基序)相同。因此,通过计算两个序列(在本发明的化合物的连续核苷酸序列中和在参考序列中)相同的比对碱基(匹配)数,将该数除以寡核苷酸的核苷酸总数再乘以100来计算同一性百分比。因此,同一性百分比=(匹配数x 100)/比对区域的长度(例如,连续核苷酸序列)。在计算连续核苷酸序列的同一性百分比时,不允许插入和删除。应当理解的是,在确定同一性时,只要保留了形成watson crick碱基配对的核碱基的功能能力,就不考虑核碱基的化学修饰(例如,在计算同一性百分比时,认为5-甲基胞嘧啶与胞嘧啶相同)。
[0232]
杂交
[0233]
如本文所用,术语“杂交”应当理解为在相对链上的碱基对之间形成氢键从而形成双链体的两条核酸链(例如寡核苷酸和靶核酸)。
[0234]
如本文所用,术语“杂交”应当理解为在相对链上的碱基对之间形成氢键从而形成双链体的两条核酸链(例如寡核苷酸和靶核酸)。两条核酸链之间结合的亲和力是杂交的强度。通常用解链温度(tm)来描述,解链温度(tm)定义为一半寡核苷酸与靶核酸形成双链体的温度。
[0235]
同一性(氨基酸序列)
[0236]
同一性:两个氨基酸之间的相关性由参数“同一性”描述。出于本发明的目的,使用needleman-wunsch算法(needleman和wunsch,1970,j.mo/.biol.5 48:443-453)确定两个氨基酸序列之间的同一性程度,该算法在emboss软件包(emboss:the european molecular biology open software suite,rice等人,2000,trends in genetics 16:276-277;http://emboss.org)的needle程序中实现,优选3.0.0或更高版本。使用的任选参数是缺口打开罚分10、缺口延伸罚分0.5和eblosum62(emboss的blosum62版本)替换矩阵。使用needle标有“最长同一性”的输出(使用10-nobrief选项获得)作为同一性百分比,其计算方式如下:(相同残基x 100)/(比对长度-比对缺口总数)。
[0237]
适体(aptamer)
[0238]
适体是寡核苷酸,通常长度为20-60个核苷酸,它们通过非核酸杂交机制与特定的靶分子结合。本发明的修饰的寡核苷酸可以是适体,或者可以包含起适体作用的核酸序列的区域。在一些实施方案中,修饰的寡核苷酸包含至少两个(诸如至少三个)连续的2'糖修饰的核苷,其独立地选自由lna和2'-o-甲氧基乙基核苷组成的组。在一些实施方案中,修饰
的寡核苷酸包含位于修饰的寡核苷酸的3'端的至少两个(诸如至少三个)连续的2'糖修饰的核苷,诸如独立地选自由lna和2'-o-甲氧基乙基核苷组成的组的2'糖修饰的核苷酸。在一些实施方案中,修饰的寡核苷酸包含位于修饰的寡核苷酸的3'端的至少两个(诸如至少三个)连续的lna核苷。
[0239]
连接
[0240]
连接是指两个核酸片段(诸如寡核苷酸)的共价链接。连接通常涉及一个核酸片段上的3'-oh基团与另一核酸片段上的5'磷酸基团之间形成磷酸键,并且可由连接酶诸如t4 dna连接酶催化。
[0241]
捕获探针寡核苷酸
[0242]
如本文所述,3'捕获探针寡核苷酸也称为捕获探针寡核苷酸,是包含第一引物结合位点的寡核苷酸,并且在本发明的方法中,其被连接至修饰的寡核苷酸的3'末端,从而能够使用修饰的寡核苷酸作为模板实现基于聚合酶的链延伸。第一引物结合位点也可用作测序引物诸如固相结合的引物的结合位点。
[0243]
捕获探针可包含与修饰的寡核苷酸的3'区域互补的3'区域,(或为简并区域),从而捕获寡核苷酸的3'区域,促进捕获探针与修饰的寡核苷酸的连接。备选地,可进行夹板连接。
[0244]
在一些实施方案中,对于基于引物的测序,3'捕获探针寡核苷酸可进一步包含测序引物结合位点,诸如固相结合引物。因此,捕获探针可以包含用于与大规模平行测序中使用的固体支持物结合的结合位点,例如流通池结合位点,其对于第一引物侧可以是共同的区域,或者可以是与第一引物结合位点分离或重叠的独立区域。应当理解,当测序引物结合位点与第一引物结合位点不同时,测序引物结合位点在上游(即第一引物结合位点的5'),从而保证在从捕获探针的第一链合成中掺入测序引物结合位点。
[0245]
在一些实施方案中,本发明的捕获探针包含可裂解的连接基团,例如用于自引发捕获探针寡核苷酸。由于捕获探针内两个区域之间的两个自身互补区域形成了双链体(在本文中可称为第二双链体区域),自引发捕获探针可用于启动5'-3'链延伸(第一链合成)而无需添加第一引物,其中自引发捕获探针包含可裂解的连接,其在裂解时为5'-3'聚合酶介导的链延伸提供底物(例如,包含3'端-oh基团的双链体区域)。可裂解键合可位于自身互补区域的3'末端区域附近。可裂解键合可以是任何可裂解基团,例如可以是uv可裂解基团或酶促裂解基团。一个优选的裂解基团是包含错配的rna核苷的区域,其可以使用rnaseh2酶裂解。为了有效地裂解rnaseh2,错配的rna核苷可以侧接3或4个3'(和任选的5')核苷,其在两个远端区域之间形成捕获探针双链体的一部分。
[0246]
在一个优选实施方案中,捕获探针是包含至少一个5'dna核苷的寡核苷酸,其用于通过连接(例如,使用t4 dna连接酶,也可以使用其他连接方法)“捕获”核苷修饰的寡核苷酸。捕获可通过捕获探针的5'端连接至修饰的核苷寡核苷酸的3'核苷酸来进行。在一些实施方案中,可能有利的是,捕获探针进一步包含与靶标修饰的寡核苷酸序列上的区域互补的区域,该区域用于在连接步骤之前通过核酸杂交(watson-crick碱基配对)捕获靶核酸序列。在捕获探针的区域和修饰的寡核苷酸上的互补区域之间使用杂交有效地富集了局部底物浓度,从而增强了连接步骤的功效。pct/ep2017/078695公开了可以在本发明的方法中使用的捕获探针。捕获探针可以进一步包含pcr引物结合位点,以用于扩增步骤(pct步骤),其
包括在本发明的方法中。
[0247]
本发明提供或使用捕获探针寡核苷酸,以用于对糖修饰的寡核苷酸进行平行测序,该寡核苷酸包含5'-3':
[0248]
a.5'区域,其包含至少3个预定序列的连续核苷酸,其中5'末端核苷酸是具有末端5'磷酸基团的核苷酸。
[0249]
b.任选地,平行测序反应条形码区域包括预定核苷酸序列的区域,
[0250]
c.任选地,简并或预定核苷酸的区域,位于区域b的3'或区域b的5'
[0251]
d.固相测序引物结合位点
[0252]
e.任选地,第一引物结合位点
[0253]
f.任选地,接头区域(可以是核苷酸序列)
[0254]
g.与第一区段的预定序列a(第一双链体区域)互补的核苷酸的连续序列
[0255]
h.至少2个核苷酸的区域,其中3'最末端核苷酸是带有封闭3'末端基团的末端核苷酸。
[0256]
示意图参见图7。在捕获探针不包含第一引物结合位点的实施方案中,可将第一引物设计成与区域d杂交(即,区域d可以既是测序引物结合位点又用作第一引物结合位点)。
[0257]
本发明提供或使用捕获探针寡核苷酸,以用于对糖修饰的寡核苷酸进行平行测序,该寡核苷酸包含5'-3':
[0258]
a.5'区域,其包含至少3个预定序列的连续核苷酸,其中5'末端核苷酸是具有末端5'磷酸基团的核苷酸。
[0259]
b.任选地,平行测序反应条形码区域包括预定核苷酸序列的区域,
[0260]
c.任选地,简并或预定核苷酸的区域,位于区域b的3'或区域b的5'
[0261]
d.固相测序引物结合位点
[0262]
e.任选地,第一引物结合位点
[0263]
f.任选地,接头区域(可以是核苷酸序列)
[0264]
f'与第一引物结合位点和/或固相测序引物结合位点形成双链体的区域,其中双链体包含可裂解接头,
[0265]
g.与第一区段的预定序列a(第一双链体区域)互补的核苷酸的连续序列
[0266]
h.至少2个核苷酸的区域,其中3'最末端核苷酸是带有封闭3'末端基团的末端核苷酸。
[0267]
区域f'中的可裂解接头的裂解留下了一个3'末端,该末端可用于第一链合成,而无需使用外源添加的第一引物(即形成自引发捕获探针)。
[0268]
参见图7,作为可在本发明的方法中使用的示例性捕获探针的示例:
[0269]
区域a
[0270]
在一些实施方案中,区域a包含预定序列的至少3个连续核苷酸或由其组成,其中5'末端核苷酸是包含5'磷酸基团的dna核苷酸。至少3个连续核苷酸与区域g(第一双链体区域)互补并且可以与其杂交。在一些实施方案中,区域a的至少3个连续核苷酸是dna核苷酸。
[0271]
在一些实施方案中,区域a包含至少3个连续核苷酸或由其组成,诸如3-10个连续核苷酸,诸如3-10个dna核苷酸。
[0272]
区域b
[0273]
区域b可以用作或是平行测序的“反应条形码”区域,其包含预定核苷酸序列的区域,诸如3-20个核苷酸的区域,诸如dna核苷酸。捕获探针包含区域b是有利的,因为其允许在常规平行测序轮次中在测序之前合并来自分离的捕获探针连接的样本。因此,具有不同的区域b序列的不同捕获探针的使用允许从分离的捕获探针连接进行序列数据的测序后分离。
[0274]
区域c
[0275]
区域c是位于区域a的3'的核苷酸的任选序列,其可以包含预定序列或简并序列,或者在一些实施方案中同时包含预定序列部分和简并序列部分。当存在时,区域c的长度可以根据用途进行调节。当使用简并序列时,它可以在随后的测序步骤中允许扩增产物的“分子条形码”,从而确定特定的扩增产物是否独特。这允许比较定量存在于寡核苷酸异质混合物中的不同寡核苷酸。在一些实施方案中,区域c包含3-30个简并的连续核苷酸,例如3-30个简并的连续dna核苷酸。在一些实施方案中,区域c包含通用核苷酸,例如肌苷核苷酸。
[0276]
已知的是,某些序列可能会在pcr期间优先扩增,因此,通过计算源自简并序列的遗传“条形码序列”的出现,您可以确定扩增前的相对量(参见例如kielpinski和vinter,nar(2014)42(8):e70)。
[0277]
在一些实施方案中,区域c引入半简并序列,其允许条形码序列和预定序列二者的益处。额外的益处是条形码序列的质量控制(参见例如kielpinski等人,methods in enzymology(2015)558卷,第153-180页)。半简并序列在每个位置都有一个选定的半简并核碱基(根据需要定义半简并-添加iupac代码,r、y、s、w、k、m、b、d、h和v(参见表3)。
[0278]
在一些实施方案中,区域c同时具有简并序列和预定序列,或者同时具有简并序列和半简并序列,或者同时具有预定序列和半简并序列,或者具有简并序列、预定序列和半简并序列。
[0279]
如果区域c包含预定序列,它可以例如在第一引物位点的上游提供一个替代的或嵌套的引物位点,使用嵌套的引物位点是众所周知的减少pcr扩增期间非特异性结合的工具。在一些实施方案中,区域c包含3-30个预定的连续核苷酸,例如3-30个预定的连续dna核苷酸。
[0280]
在一些实施方案中,捕获探针不包含区域c。
[0281]
应当理解的是,功能上区域c可以位于区域b的5'端或区域b的3'端。
[0282]
在一些实施方案中,当存在时,区域c包含至少3个连续的简并核苷,例如3、4、5、6、7、8、9或10个连续的简并核苷或由其组成。
[0283]
区域d
[0284]
区域d是固相引物结合位点,也称为测序引物结合位点,用于在可选的克隆扩增以及随后的平行测序之前,将衔接子连接产物或可选的由衔接子连接产物制备的pcr产物捕获到附接至固相支持物的寡核苷酸上。区域d也可用作第一引物结合位点以启动第一链合成。
[0285]
在自引发捕获探针中,区域d可以形成双链体(第二双链体)的一部分,该双链体与下游(3')区域(f')杂交,该区域包含可裂解键合,诸如错配的rna核苷酸,只要这不损害区域d与结合到固相支持物上的引物的结合(即在区域f'裂解后保持测序引物结合位点的完整性)。
[0286]
区域e
[0287]
区域e是第一引物结合位点,用于启动第一链合成。将区域d用作第一个引物结合位点时,可能不需要包括区域e。因此,功能上第一引物结合位点区域e可以与固相引物结合位点(d)相同或可以与区域d部分重叠。
[0288]
在本发明的自引发捕获探针中,区域e可以形成双链体(第二双链体)的一部分,该双链体与下游(3')区域(f')杂交,该区域包含可裂解键合,诸如错配的rna核苷酸
[0289]
区域g
[0290]
区域g是与区域a互补的核苷酸区域,其与区域a形成双链体。区域g不包含与区域a互补的rna核苷是有益的,同样有益的是,存在于区域g的与捕获探针的5'末端核苷(区域a的5'末端核苷)互补并杂交的核苷是dna核苷。这会导致区域a和g杂交时dna/dna双链体的形成。在一些实施方案中,区域g的两个或三个3'末端核苷是dna核苷。在一些实施方案中,区域g的所有核苷均为dna核苷。在一些实施方案中,区域g包含与区域a互补并且可以与其杂交的至少3个连续核苷酸。在一些实施方案中,区域g的至少3个连续核苷酸是dna核苷酸。
[0291]
在一些实施方案中,区域g包含3-10个连续核苷酸,例如3-10个dna核苷酸或由其组成。在一些实施方案中,区域a和区域g的核苷酸是dna核苷酸。互补序列a和g的长度和组成(例如g/c与a/t)可用于调节杂交强度,从而允许捕获探针的优化。同样应当认识到的是,在互补序列内引入错配可用于降低杂交强度(参见例如wo2014110272)。在一些实施方案中,区域a和g不形成连续的互补序列,但是由于部分互补,在一些实施方案中,区域a和区域g在与样本混合时形成双链体。区域a和区域g的3'末端碱基对应当是互补碱基对,在某些实施方案中,区域a和区域g的两个或三个末端碱基对是互补碱基对。在一些实施方案中,这些3'碱基对是dna碱基对。
[0292]
区域h
[0293]
区域h的目的是使捕获探针寡核苷酸与要检测、捕获、测序和/或定量的核苷修饰的寡核苷酸杂交。
[0294]
区域h是至少两个或三个核苷酸的区域,当其互补序列的区域a和区域g杂交时,形成3'突出端。区域h的3'末端核苷在3'位置被封闭(即不包含3'-oh基团)。
[0295]
在一些实施方案中,区域h具有至少3个核苷酸的长度。区域h的最佳长度可以至少取决于要捕获的寡核苷酸的长度,并且本发明人发现,区域h可以以2个核苷酸的重叠起作用,例如当使用核糖核酸酶(rnase)处理的样本时,优选是至少3个核苷酸。
[0296]
在一些实施方案中,区域h包含简并序列或半简并序列,其允许在不事先了解寡核苷酸序列的情况下捕获寡核苷酸。在不事先了解其序列的情况下捕获寡核苷酸在从具有所需生物分布的不同寡核苷酸序列的文库中鉴定特定的寡核苷酸,或用于鉴定部分寡核苷酸降解产物特别有用。本发明的探针和方法也可用于捕获和鉴定适体。
[0297]
在一些实施方案中,区域h包含预定序列,从而允许捕获具有已知序列的核苷修饰的寡核苷酸。预定捕获区域h的使用适用于捕获、检测和定量体内治疗性寡核苷酸,例如用于临床前或临床开发或随后用于确定患者来源材料中的局部组织或细胞浓度或暴露情况。患者中化合物浓度的确定对于优化患者中治疗性寡核苷酸的剂量可能很重要。
[0298]
在一些实施方案中,区域h包含高亲和力的修饰的核苷,例如一个或多个lna核苷。在区域h中使用高亲和力的修饰的核苷诸如lna允许使用核苷酸的较短区域,同时允许有效
捕获修饰的寡核苷酸。就lna修饰的寡核苷酸这一方面,lna/lna杂交体特别强固。应当理解,通过在区域h中选择性使用高亲和力的修饰的核苷,可以优化捕获功效。
[0299]
区域h可以是预定核苷酸序列或简并(或部分简并)序列的区域。在已知修饰寡核苷酸的3'区域的情况下,可以使用预定的核苷酸序列。区域h的简并序列可用于连接未知序列的修饰的寡核苷酸,或者在修饰的寡核苷酸群体的3'区域内可能存在异质性。在一些实施方案中,区域h包含或包含至少4个连续的简并核苷,例如4、5、6、7、8、9、10、11或12个连续的简并核苷。
[0300]
在一些实施方案中,当存在区域h时,区域a、b、c、d和e的核苷是dna核苷。
[0301]
接头部分(f)(任选)
[0302]
区域f
[0303]
区域f是一个任选区域,在图7中由连接区域e和g的细线示出。在没有区域e的情况下,它可以将区域d和区域g或区域d或区域e链接到区域f'。在一些实施方案中,捕获探针寡核苷酸不包含非核苷接头。
[0304]
区域f可以用于促进捕获探针区域a和g与第一双链体区域杂交,并且区域f可以是核苷区域或可以包含非核苷酸接头。在一些实施方案中,存在区域f,并且区域f包含至少3或4个核苷酸,诸如至少3或4个dna核苷酸,诸如4-25个核苷酸。
[0305]
区域f的关键功能是允许在区域a和区域g之间形成双链体(第一双链体),在自引发捕获探针的实施方案中,区域f’与区域e之间或区域f’与区域d之间或区域f’与区域d和区域e的重叠区域之间形成第二双链体,因此,区域f可在捕获探针内形成分子内发夹结构。然而,认识到在一些实施方案中,不需要区域f,例如,当区域d(以及任选地区域b和/或区域c)能够形成分子内发夹,从而允许在区域a和区域g之间形成双链体时。在自引发捕获探针实施方案中,设想区域f是有利的。
[0306]
核苷酸区域可以包含或不包含阻止聚合酶通读的修饰(例如,反向核苷酸键合)。
[0307]
防止dna聚合酶从区域d到区域g的通读的优点,例如通过非核苷酸接头或抑制聚合酶的修饰,是它阻止了替代模板分子的形成。这样的替代模板分子导致对捕获探针5'区域上的核苷修饰的寡核苷酸特异的引物错误引发。
[0308]
在本发明的一些实施方案中,接头部分f可以是允许区域a和区域g杂交的核苷酸区域。
[0309]
在一些实施方案中,区域f包含聚合酶阻断接头,诸如c6-32聚乙二醇接头,诸如c18聚乙二醇接头或烷基接头。可以使用的其他非限制性示例性接头基团公开于pct/ep2017/078695中。
[0310]
夹板连接(splint ligation)
[0311]
3'捕获探针在一些实施方案中可以是线性捕获探针。对于线性捕获探针,将夹板连接引物与线性捕获探针结合使用可能是有利的:夹板连接引物与捕获探针的5'区域和修饰的寡核苷酸的3'区域杂交,从而使要连接的末端对齐。
[0312]
阻断dna聚合酶
[0313]
一种修饰或接头部分,其阻断dna聚合酶在接头部分或修饰上的通读,导致链延伸终止。
[0314]
特异性引物
[0315]
特异性引物是包含与引物结合位点互补的序列的引物。应当理解的是,关于引物和引物结合位点的术语“特异性”可能需要考虑到要使用的模板分子,即捕获探针或衔接子中的引物结合位点在一些实施方案中可以经工程化以便将引物结合位点呈现在由包含捕获探针或衔接子的核酸分子制备的互补核酸分子中。
[0316]
第一引物
[0317]
如本文所用,第一引物是指对捕获探针的区域特异的引物,当与捕获探针寡核苷酸/修饰的寡核苷酸连接产物杂交时,该引物用于启动聚合酶介导的链延伸(第一链合成),诸如本文所述的区域d或e。因此,第一引物包含与捕获探针寡核苷酸上的区域互补的序列,并且可以进一步包含其他区域,诸如测序引物结合位点。第一引物可以进一步包含用于结合至大规模平行测序中使用的固体支持物的结合位点,诸如流通池结合位点。第一引物可以进一步包含pcr引物结合位点,以用于扩增步骤(pct步骤),其中包括在本发明的方法中。第一引物可以为例如长度为15-30个核苷酸,并且可以是例如dna寡核苷酸引物。
[0318]
如本文所述,在一些实施方案中,捕获探针是自引发的,不需要外源添加的第一引物来启动第一链合成。
[0319]
聚合酶介导的5'-3'链延伸
[0320]
如本文所用,聚合酶介导的5'-3'链延伸是指当与捕获探针寡核苷酸/修饰的寡核苷酸连接产物杂交时,聚合酶介导的捕获探针寡核苷酸/修饰的寡核苷酸连接产物的互补链从第一引物中延伸,这一过程可以由核酸聚合酶诸如dna聚合酶或逆转录酶介导。如本文所述,实施方案提供了可用于鉴定合适的聚合酶和实验条件的测定,该聚合酶和实验条件能够在修饰的寡核苷酸上通读(即反转录)。因此,聚合酶是能够在修饰的寡核苷酸序列上反转录以提供包含整个修饰的寡核苷酸的互补序列的延伸产物的酶。在一些实施方案中,聚合酶是能够在lna修饰的寡核苷酸序列诸如lna硫代磷酸酯寡核苷酸序列上逆转录的酶。在一些实施方案中,修饰的寡核苷酸包含通过硫代磷酸酯核苷间键合连接的至少两个连续的lna核苷。在一些实施方案中,修饰的寡核苷酸包含通过硫代磷酸酯核苷间键合连接的至少两个连续的糖修饰的核苷。在一些实施方案中,修饰的寡核苷酸包含通过硫代磷酸酯核苷间键合连接的至少两个连续的糖修饰的核苷,其中糖修饰的核苷中的至少一个是lna核苷。在一些实施方案中,修饰的寡核苷酸包含至少两个通过硫代磷酸酯核苷间键合连接的连续的2'-o-甲氧基乙基核苷。在一些实施方案中,修饰的寡核苷酸包含通过硫代磷酸酯核苷间键合连接的至少两个连续的糖修饰的核苷,其中糖修饰的核苷中的至少一个是lna核苷,另一个是2'-o-甲氧基乙基核苷。在一些实施方案中,修饰的寡核苷酸包含dna核苷和lna核苷。
[0321]
如示例中所示,修饰的寡核苷酸诸如硫代磷酸酯和2'糖修饰的寡核苷酸诸如2'-o-moe或lna寡核苷酸对聚合酶构成相当大的障碍。通过筛选许多不同的dna聚合酶(包括逆转录酶),发明人已经确定volcano2g聚合酶在利用修饰的寡核苷酸用于作为dna延伸的模板方面非常有效。发明人还已经确定,在聚乙二醇和/或丙二醇的存在下使用时,taq聚合酶也是有效的。实施方案中使用的小滴pcr方法可用于鉴定其他同样可用于本发明的方法中的合适的聚合酶和酶条件。
[0322]
volcano2g聚合酶可从mypols biotec gmbh(de)获得。
[0323]
在一些实施方案中,本发明方法中使用的聚合酶是基于野生型水生栖热菌(taq)
dna聚合酶的dna聚合酶,其包含关于野生型taq氨基酸序列的突变s515r、i638f和m747k。taq聚合酶的氨基酸序列作为seq id no 1提供。在一些实施方案中,聚合酶选自由以下组成的组:
[0324]
(seq id no:1)或与其具有至少70%同一性,诸如至少80%同一性,诸如至少90%同一性,诸如至少95%同一性,诸如至少98%同一性的有效聚合酶。可以使用实施方案中提供的方法(例如通过小滴pcr)来确定有效的dna聚合酶。
[0325]
>sp|p19821|dpo1_theaq dna聚合酶i,热稳定的os=水生栖热菌(thermus aquaticus)
[0326]
ox=271gn=pola pe=1sv=1
[0327]
mrgmlplfepkgrvllvdghhlayrtfhalkglttsrgepvqavygfaksllkalkedgd
[0328]
avivvfdakapsfrheayggykagraptpedfprqlalikelvdllglarlevpgyeadd
[0329]
vlaslakkaekegyevriltadkdlyqllsdrihvlhpegylitpawlwekyglrpdqwa
[0330]
dyraltgdesdnlpgvkgigektarklleewgsleallknldrlkpairekilahmddlk
[0331]
lswdlakvrtdlplevdfakrrepdrerlraflerlefgsllhefgllespkaleeapwp
[0332]
ppegafvgfvlsrkepmwadllalaaarggrvhrapepykalrdlkeargllakdlsvla
[0333]
lreglglppgddpmllaylldpsnttpegvarryggewteeageraalserlfanlwgrl
[0334]
egeerllwlyreverplsavlahmeatgvrldvaylralslevaeeiarleaevfrlagh
[0335]
pfnlnsrdqlervlfdelglpaigktektgkrstsaavlealreahpivekilqyreltk
[0336]
lkstyidplpdlihprtgrlhtrfnqtatatgrlsssdpnlqnipvrtplgqrirrafia
[0337]
eegwllvaldysqielrvlahlsgdenlirvfqegrdihtetaswmfgvpreavdplmrr
[0338]
aaktinfgvlygmsahrlsqelaipyeeaqafieryfqsfpkvrawiektleegrrrgyv
[0339]
etlfgrrryvpdlearvksvreaaermafnmpvqgtaadlmklamvklfprleemgarml
[0340]
lqvhdelvleapkeraeavarlakevmegvyplavplevevgigedwlsake
[0341]
(seq id no 1)
[0342]
在一些实施方案中,聚合酶是与具有seq id no:1的氨基酸序列或其klenow片段的taq聚合酶具有至少80%、至少90%、至少95%或至少99%的同一性的dna聚合酶,其中dna聚合酶包含在对应于klenow片段的seq id no:1所示taq聚合酶的氨基酸序列的487、508、536、587和/或660位置的一个或多个位置的至少一个氨基酸取代。参见wo2015/082449,在此通过引用并入,包括具体地作为seq id no 3-24公开的聚合酶。在一些实施方案中,dna聚合酶与seq id no 1具有至少80%的互补性,诸如与seq id no 1具有至少90%的互补性,并且包括其中所述一个或多个氨基酸取代选自由seq id no:1的r487h/v、k508w/y、r536k/l、r587k/i和r660t/v组成的组。
[0343]
衔接子探针
[0344]
如本文所用,术语“衔接子探针”是指寡核苷酸探针,其与来自第一引物的聚合酶介导的5'-3'链延伸的延伸产物的3'端连接。衔接子探针提供了引物结合位点,其可直接用于基于引物的测序,和/或可用于其中包括在本发明的方法中的扩增步骤(pct步骤)中。衔接子探针可以进一步包含其他区域,诸如测序引物结合位点。衔接子探针可进一步包含用于结合至大规模平行测序中使用的固体支持物的结合位点,诸如流通池结合位点。衔接子探针可进一步包含pcr引物结合位点,以用于扩增步骤(pcr步骤),其中包括在本发明的方
法中。
[0345]
pcr扩增
[0346]
在一些实施方案中,在衔接子探针连接至延伸产物的3'端之后,执行pcr扩增步骤。pcr扩增使用一对pcr引物,其中一个引物对捕获探针上的区域(可能是第一引物结合序列或捕获探针在第一引物结合序列上游的区域)是特异的,并且其他pcr引物对衔接子探针的区域是特异的。
[0347]
在一些实施方案中,诸如在平行测序实施方案中,pcr扩增是使用附接于固体表面的引物执行的,诸如珠上扩增或固相桥式扩增。在一些实施方案中,固相是流通池(例如,如在固相桥式扩增中所用,例如在illumina测序平台中所用)。固相桥式扩增中使用的固相pcr也称为簇生成:将获自衔接子探针的连接的产物文库捕获在与衔接子探针和/或捕获探针的区域(流动池结合位点)互补的表面结合的寡核苷酸的细布上。然后通过桥式扩增将每个片段扩增成不同的克隆簇。簇生成完成后,模板即可用于边合成边测序。
[0348]
pcr循环数在一些实施方案中可以受到限制,使得每个簇具有约1000个拷贝。在一些实施方案中,pcr步骤利用缩短的循环pcr,即pcr循环数限制在2至约25个循环,诸如约10至约20个pcr循环。
[0349]
条形码(bar coding)
[0350]
条形码是捕获探针或引物内的序列,其用于鉴定在本发明的方法中获得的序列的原始序列,例如关于鉴定源自相同的捕获探针连接事件(分子条形码)或源自共同的捕获探针连接反应(反应条形码)的多个序列。
[0351]
分子条形码(例如可用于捕获探针的区域c)
[0352]
在一些实施方案中,捕获探针寡核苷酸和/或衔接子探针包含随机核苷序列的序列(简并序列)。捕获或衔接子探针中简并序列的使用可用于允许鉴定由于pcr扩增步骤后相同的连接的延伸产物分子重复而产生的测序结果。
[0353]
反应条形码(例如在捕获探针的区域b中使用的条形码)
[0354]
大规模平行测序的功能使测序模板可以合并到单个测序实验中,从而提高每次测序轮次的成本效益。因此,可期望能够分离测序数据以鉴定源自分离测序模板反应的序列。这可以通过使用捕获探针或pcr引物实现,这些捕获探针或pcr引物包含每个模板唯一的共同序列标识。可以修改反应条形码的长度,以反映合并到每个平行测序轮次中的不同测序模板的复杂性,例如可以是2-20个核苷酸(例如dna核苷酸长度),诸如4-5个核苷酸长度。
[0355]
简并核苷酸
[0356]
简并核苷酸是指核酸序列上的一个位置,该核酸序列在界定位置处可以具有多个替代碱基(如核酸的iupac标记所用)。应当认识到的是,对于单个分子,界定位置处将有一个特定的核苷酸,但是在寡核苷酸样本中的分子群体中,界定位置处的核苷酸将是简并的。实际上,简并序列的掺入导致核苷酸序列在寡核苷酸群体的每个成员之间的界定位置处的随机化。已知的是,某些序列可能会在pcr期间优先扩增,因此,通过计算源自简并序列的遗传“条形码序列”的出现,您可以确定扩增前的相对量(参见例如kielpinski和vinter,nar(2014)42(8):e70)。在一些实施方案中,捕获探针包含可用于代替简并核苷酸的基于通用的区域(例如肌苷核苷酸)。
[0357]
测序
[0358]
测序是指确定核酸分子内核碱基的顺序(序列)。在本发明的上下文中,测序是指确定修饰的寡核苷酸内的核碱基的序列。传统的测序方法基于链终止法(称为sanger测序),该方法是利用dna聚合酶在体外dna复制过程中选择掺入链终止的二脱氧核苷酸,然后对链终止的产物进行电泳分离。通过使用四个独立的反应,每个反应具有不同的链终止碱基(a、t、c或g),通过比较4个链终止反应产物在凝胶电泳中的相对运动性来确定序列。
[0359]
sanger测序最初是在掺入放射性标记的核苷酸后进行sds-page电泳的基础上发展的,并在商业上发展为使用荧光染料标记的引物进行自动dna测序的基础,例如可以通过毛细管电泳检测。使用染料终止剂测序可以从单一反应混合物(而不是原始sanger方法的四个反应)进行测序,从而实现自动化。在一些实施方案中,本发明方法的测序步骤是使用自动测序执行的。在一些实施方案中,本发明方法的测序步骤是使用染料终止剂测序诸如自动染料终止剂测序执行的。
[0360]
尽管现在仍在使用基于sanger的测序,但在大规模测序应用中,它已被“下一代”测序技术所取代,参见goodwin等人,nature reviews:genetics vol 17(2016),333-351,在此通过引用并入。
[0361]
基于引物的测序
[0362]
基于引物的测序是指基于聚合酶与核酸模板杂交的引物由5'-3'的链延伸。基于引物的测序可基于链终止方法(例如,sanger测序)或有利地使用边合成边测序。
[0363]
捕获探针/基于衔接子的测序
[0364]
本发明提供了一种用于对修饰的寡核苷酸或修饰的寡核苷酸群体进行测序的方法。在一些实施方案中,该方法包括以下步骤:将捕获探针连接至修饰的寡核苷酸,然后对与捕获探针互补的第一引物进行杂交,随后将其用于基于聚合酶的链延伸以产生延伸产物。然后将衔接子连接至延伸产物的3'端,从而产生核酸分子,该核酸分子包含5'和3'侧接有已知探针序列的修饰的寡核苷酸的互补序列,所述已知探针序列可用作引物结合位点,例如可以直接用于基于引物的测序(单分子模板测序)中,或者可以在测序之前进行扩增,例如通过pcr或缩短循环扩增(克隆扩增测序)。
[0365]
在一些实施方案中,测序步骤是使用“边合成边测序”方法执行的。
[0366]
边合成边测序
[0367]
传统的基于sanger的测序是基于链终止的,而边合成边测序是基于链延伸期间染料标记的核苷酸的添加而不启动链终止。通过实时监视独特的染料信号(a、t、c和g四个碱基中的每个对应一个),可以在链延伸过程中捕获序列。边合成边测序方法的一个显著优势是,它允许对核酸序列的复杂混合物进行大规模平行测序。在一些实施方案中,在本发明的方法中使用的测序方法是循环可逆终止方法或单核苷酸添加方法。
[0368]
边合成边测序方法通常基于循环可逆终止(crt)或单核苷酸加成(sna)方法(metzker,m.l.sequencing technologies—the next generation.nat.rev.genet.11,31
–
46(2010):
[0369]
循环可逆终止(crt)方法,如illumina ngs平台和qiagen intelligent biosystems/genereader平台所用,使用可逆终止分子,其中核糖3'oh基团被封闭,从而防止延伸。首先,dna模板由与衔接子区域互补的序列引发,该序列将引发聚合酶与该双链dna(dsdna)区域的结合。在每个循环中,加入所有四个分别标记的且经3'封闭的脱氧核苷酸
(dntp)的混合物。将单个dntp掺入每条延伸的互补链中后,去除未结合的dntp,并对其表面进行成像,以鉴定每个簇处掺入的dntp。然后可以除去荧光团和阻断基团,并且可以开始新的循环。
[0370]
如本文实施例中所用,illumina系统采用克隆桥式扩增。在一些实施方案中,用于本发明的方法的测序方法是克隆桥式扩增。
[0371]
单核苷酸添加方法,如454焦磷酸测序系统(roche)和ion torrent ngs系统所用,依赖于单个信号来标记dntp向延伸链中的掺入。结果,必须将四个核苷酸中的每一个迭代地添加到测序反应中,以确保仅一个dntp对应该信号。此外,这不需要封闭dntp,因为测序反应中下一个核苷酸不存在的情况会阻止延伸。例外的是添加相同dntp的均聚物区域,序列鉴定依靠的是信号随着多个dntp掺入的按比例增加。值得注意的是,ion torrent系统不使用荧光核苷酸,而是检测掺入每个dntp时释放的h+离子。由此产生的ph值的变化可以通过集成的互补金属氧化物半导体(cmos)和离子敏感场效应晶体管(isfet)检测。
[0372]
平行测序
[0373]
在传统的sanger测序中,每个测序轮次都用于确定单个核酸模板的序列,而采用下一代测序方法可对核酸序列的异质混合物进行平行测序。如本文所述,平行测序可以采用克隆扩增步骤,并且通过在扩增引物中掺入基于序列的标识符,可以鉴定源自每个原始模板分子的重复克隆序列。
[0374]
虽然大规模平行测序的开发主要是为了实现包括整个染色体和基因组的长多核苷酸序列的快速和高效测序,实现单个基因分型解决方案,但本发明人已经发现,这些解决方案也提供了独特的机会以鉴定单个分子种类在修饰的寡核苷酸群体中的存在和比较单个分子种类在修饰的寡核苷酸群体中的丰度。这样的方法可用于多种应用中,诸如寡核苷酸治疗药物发现、制造和质量保证、治疗药物开发以及患者监测。
[0375]
发明详述
[0376]
本发明提供用于对修饰的寡核苷酸(诸如2'糖修饰的寡核苷酸,诸如lna寡核苷酸或2-o-甲氧基乙基寡核苷酸)进行测序的方法。
[0377]
该方法可包括将3'捕获探针连接至修饰的寡核苷酸的步骤,其中3'捕获探针用于启动修饰的寡核苷酸模板的第一链合成(也称为反转录或5'-3'链延伸),得到第一链合成产物,其包含与修饰的寡核苷酸互补的序列和适当地与3'捕获探针的区域(该区域可用作pcr引物/克隆扩增引物结合位点或流动池引物结合位点或测序引物结合位点)互补的区域。
[0378]
在第一链合成之后,可以对第一链合成产物进行pcr扩增,这可以是克隆扩增步骤。pcr可以使用对捕获探针衍生区域特异的第一pcr引物,以及在一些实施方案中可能对修饰的寡核苷酸的区域(适当地为5'区域,从而允许对修饰的寡核苷酸的剩余3'区域进行测序)特异的第二pcr引物。备选地,可以通过在3'端进一步延伸第一链合成产物来对整个修饰的寡核苷酸进行pcr扩增,例如通过连接包含pcr引物结合位点的衔接子探针,或者通过聚核化(将polyn的区域添加到3'末端),诸如,聚腺苷酸化(或polyc和polyu),这是可以使用末端转移酶催化的过程。可以使用包含互补polyn序列的第二链合成引物进行第二链合成。第二引物可以包含第二pcr引物结合位点。然后可以使用第一pcr引物和第二pcr引物执行pcr步骤,所述第一pcr引物对3'捕获探针是特异的,所述第二pcr引物对poly(n)序列
或第二链合成引物pcr结合位点是特异的。应当理解,pcr引物位点可用于克隆扩增,作为本发明的方法的测序步骤的一部分,或直接用于基于引物的测序。使用衔接子探针连接实施方案或聚核化实施方案的优势是,其有助于在寡核苷酸的5'区域未知的情况下对修饰的寡核苷酸进行测序。
[0379]
修饰的寡核苷酸的长度可以例如是至多60个连续核苷酸,诸如至多50个连续核苷酸,诸如至多40个连续核苷酸。在一些实施方案中,修饰的寡核苷酸是或包含长度为7-30个核苷酸的硫代磷酸酯寡核苷酸。在一些实施方案中,修饰的寡核苷酸是或包含长度为7-30个核苷酸的糖修饰的硫代磷酸酯寡核苷酸。在一些实施方案中,修饰的寡核苷酸是长度为7-30个核苷酸的2'糖修饰的硫代磷酸酯寡核苷酸。在一些实施方案中,修饰的寡核苷酸是长度为7-30个核苷酸的lna寡核苷酸。在一些实施方案中,修饰的寡核苷酸是长度为7-30个核苷酸的lna硫代磷酸酯寡核苷酸。在一些实施方案中,修饰的寡核苷酸包含一种或多种lna核苷,或一种或多种2'-o-甲氧基乙基核苷。在一些实施方案中,修饰的寡核苷酸的3'末端核苷是lna核苷。在一些实施方案中,修饰的寡核苷酸的3'末端核苷是2'取代的核苷,诸如2'-o-甲氧基乙基或2'-o-甲基核苷。
[0380]
在一些实施方案中,测序步骤是使用边合成边测序方法执行的。
[0381]
在一些实施方案中,链延伸步骤,也称为聚合酶介导的5'-3'第一链合成,是在聚合酶和聚乙二醇(peg)或丙二醇的存在下进行的。在此类实施方案中,聚合酶可以任选地是taq聚合酶,诸如seq id no 1所示的taq聚合酶或与其具有至少70%同一性,诸如至少80%同一性,诸如至少90%同一性,诸如至少95%同一性,诸如至少98%同一性的有效聚合酶。
[0382]
在一些实施方案中,链延伸步骤,也称为聚合酶介导的5'-3'第一链合成,是在聚合酶和平均分子量为100-20000,诸如约2000至约10000,诸如约4000的聚乙二醇(peg)的存在下执行的。
[0383]
在一些实施方案中,链延伸反应(第一链合成步骤)中的peg浓度为约2%至约15%(w/v-即peg的重量/反应体积),诸如约3%至约15%。高于15%仍可导致有效的延伸,但是在小滴pcr系统中,这会导致微滴不稳定。在一些实施方案中,peg的浓度为约2%至约20%,或约3%至30%(w/v)。
[0384]
在一些实施方案中,链延伸反应混合物(第一链合成步骤)中丙二醇的浓度为至少约0.8m,并且可以例如约0.8m至2m,诸如约1m至约1.6m。
[0385]
如实施方案中所示,与添加丙二醇相比,添加peg可以提供更有效的链延伸/第一链合成。
[0386]
已经发现使用peg和/或丙二醇有利于与多种聚合酶一起使用,例如如本文所公开的taq聚合酶和衍生自taq聚合酶的聚合酶,例如volcano2g聚合酶。应当认为,本文公开的测定法将用于鉴定其他聚合酶,并且作为所需的反应条件,其可在修饰的寡核苷酸的整个长度上提供有效的第一链合成。
[0387]
在一些实施方案中,用于5'-3'链延伸(第一链合成步骤)的聚合酶是taq聚合酶,诸如本文所述的taq聚合酶或volcano2g聚合酶。
[0388]
在一些实施方案中,聚合酶是primescript逆转录酶(可从clontech获得)。
[0389]
dna聚合酶/逆转录酶的选择可以通过评估聚合酶通读修饰的寡核苷酸诸如糖修饰的寡核苷酸的相对效率来执行。对于糖修饰的寡核苷酸,这可能取决于寡核苷酸中连续
的糖修饰的核苷的长度,并且应当认识到对于重度修饰的寡核苷酸,可能需要除taq聚合酶以外的酶。dna聚合酶/逆转录酶的选择还取决于样本的纯度,众所周知的是,某些聚合酶对诸如血液等污染物敏感(参见例如al-soud等人,appl environ microbiol.1998oct;64(10):3748
–
3753)。
[0390]
优选地,dna聚合酶是volcano2g dna聚合酶。
[0391]
在一些实施方案中,使用逆转录酶进行第一链合成(延伸步骤)。在一些实施方案中,逆转录酶可以选自由m-mulv逆转录酶、修饰的m-mulv逆转录酶、superscript
tm iii rt、amv逆转录酶、maxima h负逆转录酶组成的组。在一些实施方案中,dna聚合酶是热稳定的聚合酶,诸如选自由taq聚合酶、hottub聚合酶、pwo聚合酶、rtth聚合酶、tfl聚合酶、ultima聚合酶、volcano2g聚合酶和vent聚合酶组成的组的dna聚合酶。应当理解的是,对于某些酶,为了有效地执行修饰的寡核苷酸的第一链合成,可能有必要优化反应条件,例如经由添加peg和/或丙二醇。
[0392]
优选地,修饰的寡核苷酸是硫代磷酸酯寡核苷酸。在一些实施方案中,修饰的寡核苷酸内至少75%的核苷间键合是硫代磷酸酯核苷间键合,诸如修饰的寡核苷酸内至少90%的核苷间键合是硫代磷酸酯核苷间键合,诸如修饰的寡核苷酸内的所有核苷间键合都是硫代磷酸酯核苷间键合。
[0393]
在一些实施方案中,修饰的寡核苷酸是2'糖修饰的寡核苷酸。在一些实施方案中,修饰的寡核苷酸包含至少2'糖修饰的核苷。在一些实施方案中,修饰的寡核苷酸包含至少1个或至少2个3'末端糖修饰的核苷,诸如至少1个或至少3'末端lna核苷或至少1个或至少2个末端2'-o-moe核苷。在一些实施方案中,修饰的核苷包含至少3个2'糖修饰的核苷,诸如4、5、6、7、8、9、10个或更多个2'糖修饰的核苷。在一些实施方案中,2'糖修饰的核苷独立地选自lna核苷和2'取代的糖修饰的核苷,诸如2'-o-moe核苷。优选地,修饰的寡核苷酸是2'糖修饰的硫代磷酸酯寡核苷酸,诸如lna修饰的硫代磷酸酯寡核苷酸,其中寡核苷酸内至少75%的核苷间键合是硫代磷酸酯核苷间键合,并且修饰的寡核苷酸内的至少一个核苷是lna核苷,诸如修饰的寡核苷酸内的核苷中的2、3、4、5、6、7、8、9、10、11或12个是lna核苷。优选地,修饰的lna寡核苷酸的3'最末端核苷是糖修饰的核苷,诸如lna核苷,或者可以是2'取代的核苷,诸如2'-o-moe核苷。在一些实施方案中,修饰的寡核苷酸包含至少两个连续的lna核苷。
[0394]
在一些实施方案中,修饰的寡核苷酸包含至少一种选自由2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna、2'-氟-rna和2'-f-ana核苷组成的组的修饰的核苷。
[0395]
在一些实施方案中,修饰的寡核苷酸包含至少一个2'-o-甲氧基乙基rna(moe)核苷。在一些实施方案中,修饰的寡核苷酸包含至少一个3'末端2'-o-甲氧基乙基rna(moe)核苷和至少一个另外的2'-o-甲氧基乙基rna(moe)核苷。
[0396]
在一些实施方案中,修饰的寡核苷酸是2'-o-moe修饰的硫代磷酸酯寡核苷酸,诸如2'-o-moe修饰的硫代磷酸酯寡核苷酸,其中寡核苷酸内至少75%的核苷间键合是硫代磷酸酯核苷间键合,并且修饰的寡核苷酸内的至少一个核苷是2'-o-moe核苷,诸如修饰的寡核苷酸内的核苷中的2、3、4、5、6、7、8、9、10、11或12个是2'-o-moe核苷。优选地,修饰的2'-o-moe寡核苷酸中3'最末端核苷是糖修饰的核苷,诸如2'-o-moe。在一些实施方案中,修饰
ion proton)执行的。在一些实施方案中,使用固相模板步移(例如solid wildfire、thermo fisher)执行用于基于引物的测序的模板。
[0416]
大规模平行测序平台(下一代测序)已可商购-例如,如下表所示(如wikipedia中所列):
[0417][0418]
在一些实施方案中,在将3'捕获探针与修饰的寡核苷酸连接后,在第一链合成(链延伸)之前,对连接产物进行纯化,例如经由凝胶纯化,或经由未连接的捕获探针的酶促降解。
[0419]
在一些实施方案中,在衔接子探针与第一链合成产物连接后,在pcr或测序步骤之前,对连接产物进行纯化,例如经由凝胶纯化,或经由未连接的捕获探针的酶促降解。
[0420]
在一些实施方案中,对修饰的寡核苷酸/3'捕获探针连接产物进行纯化,例如经由凝胶纯化,或经由未连接的捕获探针的酶促降解。
[0421]
在一些实施方案中,将第一链合成链/衔接子探针连接产物纯化,例如经由凝胶纯化或经由未连接捕获探针的酶促降解。
[0422]
在一些实施方案中,捕获探针或衔接子探针或两者均包含测序引物结合位点。
[0423]
在一些实施方案中,第一引物或衔接子探针或两者均包含测序引物结合位点。
[0424]
在一些实施方案中,该方法包含pct扩增步骤,在pcr步骤中使用的一种或两种pcr引物包含测序引物结合位点。
[0425]
在一些实施方案中,捕获探针和衔接子探针,或第一引物和衔接子探针,进一步包含流动池结合位点。
[0426]
在一些实施方案中,在pcr步骤中使用的pcr引物进一步包含流动池结合位点。
[0427]
示例性的修饰的寡核苷酸实施方案
[0428]
修饰的寡核苷酸可以是硫代磷酸酯寡核苷酸。修饰的寡核苷酸可以是硫代磷酸酯糖修饰的寡核苷酸,诸如硫代磷酸酯2'糖修饰的寡核苷酸,诸如lna硫代磷酸酯寡核苷酸或
2'-o-甲氧基乙基(moe)硫代磷酸酯寡核苷酸。
[0429]
在一些实施方案中,修饰的寡核苷酸是治疗性寡核苷酸。
[0430]
在一些实施方案中,修饰的寡核苷酸包含缀合物部分,诸如n-乙酰半乳糖胺(galnac)部分,诸如三价galnac部分。
[0431]
在一些实施方案中,修饰的寡核苷酸是lna寡核苷酸,其包含缀合物部分,诸如n-乙酰半乳糖胺(galnac)部分,诸如三价galnac部分。
[0432]
在一些实施方案中,一种或多种修饰的寡核苷酸是缺口聚体寡核苷酸,诸如moe缺口聚体、lna缺口聚体、混合翼缺口聚体或交替侧翼缺口聚体。在一些实施方案中,修饰的寡核苷酸是混聚体寡核苷酸,诸如lna混聚体寡核苷酸。在一些实施方案中,修饰的寡核苷酸是总聚体,诸如moe总聚体,或lna总聚体寡核苷酸。
[0433]
在一些实施方案中,修饰的寡核苷酸是糖修饰的寡核苷酸,诸如包含lna或2'-o-甲氧基乙基修饰的核苷酸,或lna和2'-o-甲氧基乙基同时修饰的核苷酸的寡核苷酸。
[0434]
在一些实施方案中,修饰的寡核苷酸是lna硫代磷酸酯寡核苷酸。
[0435]
在一些实施方案中,修饰的寡核苷酸包含lna核苷和dna核苷这两者,诸如lna缺口聚体或lna混聚体。在一些实施方案中,修饰的寡核苷酸包含至少一个β-d-氧基lna核苷或至少一个(s)cet lna核苷(6'甲基β-d-氧基lna)。在一些实施方案中,存在于lna寡核苷酸中的lna核苷是β-d-氧基lna核苷或至少一个(s)cet lna核苷(6'甲基β-d-氧基lna)。
[0436]
在一些实施方案中,修饰的寡核苷酸包含至少一个糖修饰的t核苷和/或至少一个糖修饰的c残基(包括5个甲基c)。
[0437]
在一些实施方案中,修饰的寡核苷酸包含至少一个lna-t核苷和/或至少一个lna-c(包括5-甲基c)核苷。
[0438]
在一些实施方案中,修饰的寡核苷酸包含至少一个2'-o-甲氧基乙基t核苷和/或至少一个2'-o-甲氧基乙基c残基(包括5个甲基c)。寡核苷酸合成中使用的胞嘧啶和胸腺嘧啶亚磷酸酯单体的合成往往是经由共同的中间体-如实例所示,这可能导致c或t亚磷酰胺之间的污染,这是本发明方法能够检测到的问题。
[0439]
在一些实施方案中,核苷修饰的寡核苷酸包含至少一个(诸如1、2、3、4或5个)3'末端修饰的核苷,诸如至少一个(诸如1、2、3、4或5个)lna或至少一个(诸如1、2、3、4或5个)2'取代的核苷,诸如2'o-moe。在一些实施方案中,核苷修饰的寡核苷酸包含至少一种非末端修饰的核苷,诸如lna或2'取代的核苷,诸如2'-o-moe。
[0440]
在一些实施方案中,修饰的寡核苷酸包含一个或多个lna核苷和一个或多个2'取代的核苷,诸如一个或多个2'-o-甲氧基乙基核苷。
[0441]
在一些实施方案中,修饰的寡核苷酸包含缀合物基团,也称为缀合物部分,诸如galnac缀合物。在一些实施方案中,缀合物部分位于修饰的寡核苷酸中的末端,诸如3'末端或5'末端,并且可以存在将缀合物基团与寡核苷酸共价连接的核苷或非核苷接头部分。
[0442]
缀合物部分
[0443]
在一些实施方案中,缀合物部分选自由以下项组成的组:蛋白质,诸如酶、抗体或抗体片段或肽;亲脂性部分,诸如脂质、磷脂、固醇;聚合物,诸如聚乙二醇或聚丙二醇;受体配体;小分子;报告基因分子;以及非核苷类碳水化合物。
[0444]
在一些实施方案中,缀合物部分包含或是碳水化合物、非核苷糖、碳水化合物复合
物。在一些实施方案中,碳水化合物选自由半乳糖、乳糖、正乙酰半乳糖胺、甘露糖和甘露糖-6-磷酸组成的组。
[0445]
在一些实施方案中,缀合物部分包含或选自由蛋白质、糖蛋白、多肽、肽、抗体、酶和抗体片段组成的组。
[0446]
在一些实施方案中,缀合物部分是亲脂性部分,诸如选自由脂质、磷脂、脂肪酸和固醇组成的组的部分。
[0447]
在一些实施方案中,缀合物部分选自由小分子药物、毒素、报告基因分子和受体配体组成的组。
[0448]
在一些实施方案中,缀合物部分是聚合物,诸如聚乙二醇(peg)、聚丙二醇。
[0449]
在一些实施方案中,缀合物部分是或包含脱唾液酸糖蛋白受体靶向部分,其可以包括例如半乳糖、半乳糖胺、n-甲酰基-半乳糖胺、n-乙酰基半乳糖胺、n-丙酰基-半乳糖胺、n-n-丁酰基-半乳糖胺和n-异丁酰基半乳糖-胺。在一些实施方案中,缀合物部分包含半乳糖簇,诸如n-乙酰基半乳糖胺三聚体。在一些实施方案中,缀合物部分包含galnac(n-乙酰基半乳糖胺),诸如一价、二价、三价或四价galnac。三价galnac缀合物可用于将化合物靶向肝脏(参见例如us 5,994517和hangeland等人,bioconjug chem.1995nov-dec;6(6):695-701、wo2009/126933、wo2012/089352、wo2012/083046、wo2014/118267、wo2014/179620和wo2014/179445)。
[0450]
缀合物接头
[0451]
键合或接头是两个原子之间的连接,其经由一个或多个共价键将一个目标化学基团或区段与另一个目标化学基团或区段链接。缀合物部分可直接或通过链接部分(例如接头或系链)附接至寡核苷酸。接头用于共价连接第三区域,例如寡核苷酸的缀合物部分(例如区域a或c的末端)。
[0452]
在本发明的一些实施方案中,本发明的缀合物或寡核苷酸缀合物可任选地包含位于寡核苷酸和缀合物部分之间的接头区域。在一些实施方案中,缀合物和寡核苷酸之间的接头是可生物裂解的。
[0453]
包含生理上不稳定的键或由其组成的可生物裂解的接头,该键在哺乳动物体内通常遇到的条件下或与之相似的条件下可裂解。生理上不稳定的接头经历化学转化(例如裂解)的条件包括化学条件,诸如ph、温度、氧化或还原条件或试剂,以及在哺乳动物细胞中遇到的盐浓度或与之相似的盐浓度。哺乳动物细胞内条件还包括通常存在于哺乳动物细胞中的酶活性,诸如来自蛋白水解酶或水解酶或核酸酶的酶活性。在一个实施方案中,可生物裂解的接头对s1核酸酶裂解敏感。在一个优选的实施方案中,对核酸酶敏感的接头包含1至10个核苷,诸如1、2、3、4、5、6、7、8、9或10个核苷,更优选地包含2至6个核苷,最优选地包含包含2至4个链接的核苷,该核苷包含至少两个连续的磷酸二酯键合,诸如至少3或4或5个连续的磷酸二酯键合。优选地,核苷是dna或rna。包含磷酸二酯的可生物裂解的接头详细描述于wo 2014/076195(此处通过引用并入)中。
[0454]
缀合物也可以经由不可生物裂解的接头与寡核苷酸链接,或者在一些实施方案中,缀合物可以包含不可裂解的接头,其共价附接至可生物裂解的接头。不一定是可生物裂解的但主要用于将缀合部分共价连接至寡核苷酸或可生物裂解的接头的接头。此类接头可以包含重复结构诸如乙二醇、氨基酸单元或氨基烷基的链结构或寡聚物。在一些实施方案
中,接头(区域y)是氨基烷基,诸如c
2-c
36
氨基烷基,包括例如c6至c
12
氨基烷基。在一些实施方案中,接头(区域y)是c6氨基烷基。缀合物接头基团可经由使用氨基修饰的寡核苷酸和缀合物基团上的活化酯基团,常规地连接至寡核苷酸。
[0455]
质量保证应用
[0456]
本发明提供了一种用于确定来自相同的修饰的寡核苷酸合成轮次中修饰的寡核苷酸群体中序列异质性的方法,所述方法包括以下步骤:
[0457]
获得或合成修饰的寡核苷酸,
[0458]
执行根据本发明的基于引物的测序方法
[0459]
分析获得的序列数据,以鉴定修饰的寡核苷酸群体的序列异质性。
[0460]
序列异质性是指鉴定群体内各个种类的序列,例如形成至少0.01%的种类,例如至少0.05%的种类,例如至少0.1%的种类,例如至少0.5%的种类,并根据每个序列的出现情况,任选地鉴定每个种类形成的总群体的比例(唯一序列)。
[0461]
本发明提供一种用于验证修饰的寡核苷酸的序列的方法,所述方法包括以下步骤:
[0462]
获得或合成修饰的寡核苷酸
[0463]
执行根据本发明的基于引物的测序方法
[0464]
分析获得的序列数据以验证修饰的寡核苷酸的序列。
[0465]
本发明提供了一种用于验证修饰的寡核苷酸群体中的主要序列的方法,所述方法包括以下步骤:
[0466]
获得或合成修饰的寡核苷酸
[0467]
执行根据本发明的基于引物的测序方法
[0468]
分析获得的序列数据以验证修饰的寡核苷酸的序列。
[0469]
修饰的寡核苷酸群体可以例如来自相同的测序轮次(批次)或一组测序轮次(批次)。
[0470]
验证可用于识别进入修饰的寡核苷酸合成步骤的不正确输入错误,例如,这可能是由于印刷错误或合成方法步骤中的错误或使用的污染物引起的。备选地,验证可用于确认修饰的寡核苷酸的身份,例如,修饰的寡核苷酸可从已施用该修饰的寡核苷酸(例如以治疗药物的形式)的患者中获得。序列验证可以鉴定不正确的序列或截短的寡核苷酸或延长的寡核苷酸或异常合成产物。
[0471]
本发明提供了一种用于确定修饰的寡核苷酸的纯度的方法
[0472]
获得或合成修饰的寡核苷酸
[0473]
执行根据本发明的基于引物的测序方法
[0474]
分析获得的序列数据,以确定修饰的寡核苷酸的纯度。
[0475]
本发明提供了大规模平行测序用于对修饰的寡核苷酸群体的核碱基序列进行测序的用途,该修饰的寡核苷酸群体诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如由lna和/或2'-o-甲氧基乙基修饰的核苷组成的硫代磷酸酯寡核苷酸。
[0476]
本发明提供大规模平行测序用于对治疗性寡核苷酸(诸如治疗性修饰的寡核苷酸群体,诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,
诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸)的核碱基序列进行测序的用途。
[0477]
本发明提供了边合成边测序用于对修饰的寡核苷酸群体的核碱基序列进行测序的用途,该修饰的寡核苷酸群体诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸。
[0478]
本发明提供了基于引物的聚合酶测序用于确定修饰的寡核苷酸的合成或制造轮次的产物的质量的用途,该修饰的寡核苷酸诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸。
[0479]
本发明提供了基于引物的聚合酶测序用于确定修饰的寡核苷酸的合成或制造轮次的产物的异质性的用途,该修饰的寡核苷酸诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸。
[0480]
本发明提供了大规模平行测序用于确定修饰的寡核苷酸的合成或制造轮次的产物的质量的用途,该修饰的寡核苷酸诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸。
[0481]
本发明提供了边合成边测序用于确定修饰的寡核苷酸的合成或制造轮次的产物的异质性的用途,该修饰的寡核苷酸诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸。
[0482]
本发明提供了边合成边测序用于确定修饰的寡核苷酸的合成或制造轮次的产物的质量的用途,该修饰的寡核苷酸诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸。
[0483]
本发明提供了边合成边测序用于确定修饰的寡核苷酸的合成或制造轮次的产物的异质性的用途,该修饰的寡核苷酸诸如硫代磷酸酯寡核苷酸或糖修饰的寡核苷酸,诸如糖修饰的硫代磷酸酯寡核苷酸,诸如包含lna和/或2'-o-甲氧基乙基修饰的核苷的硫代磷酸酯寡核苷酸。
[0484]
在一些实施方案中,本发明的方法用于确定修饰的寡核苷酸群体中纯度或异质性的程度,该修饰的寡核苷酸群体为例如单个寡核苷酸合成批次或多个寡核苷酸合成批次的合并池。
[0485]
在一些实施方案中,本发明的方法用于确定修饰的寡核苷酸的序列,或修饰的寡核苷酸群体中存在的主要序列,该修饰的寡核苷酸群体为例如单个寡核苷酸合成批次或多个寡核苷酸合成批次的合并池。
[0486]
体内和药物发现应用
[0487]
尽管多年来寡核苷酸疗法已提供了从靶序列到由watson-crick碱基配对法则设计的药物的希望,但在实践中这很难实现,最近人们发现,寡核苷酸的各个序列可能对寡核
苷酸的药理学分布产生深远影响。因此,很难假设根据其体外的优异效果选择的化合物将在体内具有相同的优异效果,简单地说,其生物分布可能导致在非靶组织中积聚,而在靶组织中药理作用低。本发明提供对lna或2'-o-moe修饰的寡核苷酸进行平行测序的方法,从而允许鉴定导致在所需组织中摄取和/或避免在非靶组织中积聚的隐秘序列。这可以通过制备具有不同序列的寡核苷酸文库(例如简并寡核苷酸文库),并将其用于鉴定在哺乳动物靶组织中富集的核苷修饰的寡核苷酸(序列)的方法来实现。
[0488]
本发明提供一种鉴定在哺乳动物的靶组织中富集的修饰的寡核苷酸(序列)的方法,所述方法包括:
[0489]
a.向哺乳动物施用修饰的寡核苷酸的混合物,其中修饰的寡核苷酸的混合物的每个成员包含独特的核碱基序列,
[0490]
b.允许修饰的寡核苷酸分布在哺乳动物体内,例如至少12小时,诸如12-96小时,诸如24-48小时的时间段;
[0491]
c.从哺乳动物的包含目的靶组织或目的靶细胞的一个或多个组织或细胞中分离出修饰的寡核苷酸群体,
[0492]
d.执行根据本发明的方法,包括对修饰的寡核苷酸群体进行测序的步骤,以
[0493]
e.鉴定在哺乳动物的目的靶组织或细胞中富集的修饰的寡核苷酸序列。
[0494]
修饰的寡核苷酸包含独特的核碱基的区域(独特的核碱基序列)。该区域可以是简并核碱基的区域,例如,用于发现适体或适体序列,也可以是已知序列的区域,例如分子条形码区域(例如用于发现缀合物部分)。
[0495]
替代地或组合地,该方法可用于鉴定在哺乳动物的非靶组织中具有低积累的修饰的寡核苷酸(序列),所述方法包括:
[0496]
a.向哺乳动物施用修饰的寡核苷酸的混合物,其中修饰的寡核苷酸的混合物的每个成员包含独特的核碱基序列,
[0497]
b.允许核苷修饰的寡核苷酸分布在哺乳动物体内,例如至少12小时,诸如12-96小时,诸如24-48小时的时间段;
[0498]
c.从哺乳动物的一个或多个靶组织或细胞(包括非靶组织或非靶细胞)中分离修饰的寡核苷酸群体,以及
[0499]
d.执行根据本发明的方法,包括对修饰的寡核苷酸群体进行测序的步骤,以
[0500]
e.鉴定在哺乳动物的非靶组织或非靶细胞中具有低积累的修饰的寡核苷酸序列。
[0501]
应当理解,上述方法可以组合在单个体内实验中。
[0502]
所述方法可用于鉴定具有所需生物分布或组织摄取特征(自我靶向)的修饰的寡核苷酸,也可用于鉴定可靶向修饰的寡核苷酸的寡核苷酸序列(即,包含“适体”靶向序列的修饰的寡核苷酸)。备选地,如本文所述,所述方法可用于鉴定可用于靶向修饰的寡核苷酸的缀合物部分,从而增强生物分布或组织摄取特征。
[0503]
进一步设想,可以采用组织/细胞摄取的体外测定法代替体内测定法或作为体内测定法的补充。
[0504]
本发明提供用于鉴定具有增强的细胞摄取的修饰的寡核苷酸或修饰的寡核苷酸序列的方法,所述方法包括:
[0505]
a.在一段时间内(例如,1-36小时),将修饰的寡核苷酸的混合物(其中修饰的寡核
苷酸的混合物的每个成员包含独特的核碱基序列)施用于细胞或细胞的群体;
[0506]
b.从细胞或细胞的群体中分离修饰的寡核苷酸群体,
[0507]
c.执行根据本发明的方法,包括对在b中获得的修饰的寡核苷酸群体进行测序的步骤;以
[0508]
d.鉴定在细胞或细胞的群体中富集的一种或多种修饰的寡核苷酸序列。
[0509]
所述细胞可以是哺乳动物细胞,诸如啮齿动物细胞(诸如小鼠或大鼠细胞),或者可以是灵长类动物细胞(诸如猴细胞或人细胞)。还设想所述细胞可以是病原体细胞,诸如细菌细胞或寄生细胞(例如疟疾细胞)。
[0510]
在步骤a.之后和步骤b.之前,可以洗涤细胞以除去存在于细胞培养基中或附着于细胞外表面的任何寡核苷酸。
[0511]
对于体外施用,施用步骤可使用剥裸(gymnosis)(无辅助摄取)进行。
[0512]
通常,从样本(例如,获自细胞/细胞的群体;或者在体内实施方案的情况下,获自从哺乳动物(或患者)获得的组织或细胞)中分离核苷修饰的寡核苷酸的步骤经过核糖核酸酶处理,并且可在用于本发明的寡核苷酸捕获方法之前进一步纯化(例如,通过凝胶或柱纯化)。本发明的体外或体内方法可进一步包含靶细胞的亚细胞分级分离,以鉴定在限定的亚细胞区室中积累的修饰的寡核苷酸。
[0513]
本发明提供鉴定具有所需亚细胞区室化的修饰的寡核苷酸或修饰的寡核苷酸序列的方法,所述方法包括:
[0514]
a.在一段时间内(例如,1-36小时),将修饰的寡核苷酸的混合物(其中修饰的寡核苷酸的混合物的每个成员包含独特的核碱基序列)施用于细胞或细胞的群体;
[0515]
b.对细胞进行亚细胞分级分离;
[0516]
c.从至少一个亚细胞级分或一系列不同的亚细胞级分中分离修饰的寡核苷酸群体;
[0517]
d.执行根据本发明的方法,包括对在c中获得的修饰的寡核苷酸群体进行测序的步骤;以
[0518]
e.鉴定在一种或多种所需亚细胞级分中富集的一种或多种修饰的寡核苷酸序列。
[0519]
本发明的方法可应用于已鉴定的具有适体性质的核酸序列,例如在体内具有所需生物分布的核酸序列。因此,本发明的方法可用于鉴定可将药物分子靶向所需作用位点/组织的适体序列。
[0520]
在一些实施方案中,修饰的寡核苷酸是或包含10-60个简并核苷酸的区域,诸如硫代磷酸酯连接的核苷酸。在一些实施方案中,简并核苷酸区域的核苷酸是dna核苷酸。因此,具有不同核碱基序列的修饰的寡核苷酸的混合物可能包含10-60个简并核苷酸的区域。在一些实施方案中,修饰的寡核苷酸包含限定(已知)序列的5'区域(x)和3'区域(y),其中3'区域(y)是简并序列的区域,例如10-60个简并核苷酸的区域。5'区域可以例如是如本文所述的2'糖修饰的寡核苷酸,并且可以是治疗性寡核苷酸(即,药物载货)。任选地,可以使用包含已知核苷酸的区域的附加3'末端区域(z)。区域z可促进与3'捕获探针的连接。因此,修饰的寡核苷酸可具有式[区域x-区域y-区域z]或[区域x-区域
–
y]或[区域y-区域z],或者在一些实施方案中具有式[区域y]。一旦鉴定出具有所需性质的适体序列,就可以将其共价附接至药物分子,例如治疗性寡核苷酸(诸如sirna或反义寡核苷酸)。在一些实施方案中,修
饰的寡核苷酸包含区域x-y或区域x-y-z,或者由区域x-y或区域x-y-z组成。在一些实施方案中,修饰的寡核苷酸是硫代磷酸酯寡核苷酸。在一些实施方案中,区域y内的核苷间键是硫代磷酸酯核苷间键。在一些实施方案中,区域y中的核苷是dna核苷。
[0521]
在一些实施方案中,修饰的寡核苷酸的适体区域可包含一个或多个立体定义的硫代磷酸酯核苷间键。在这方面,修饰的寡核苷酸可包含通过立体定义的核苷间键(诸如立体定义的硫代磷酸酯核苷间键)连接的核苷的一个或多个区域,并且可进一步包含未立体定义的区域。在一些实施方案中,区域y包含或为通过立体定义的硫代磷酸酯核苷间键连接的核苷的区域。这种鉴定立体定义的适配序列的方法的优点在于,修饰的寡核苷酸可进一步包含分子条形码区域,其允许对具有独特的立体定义的核苷间键基序的分子进行分子鉴定(条形码与特定的立体定义的核苷间键基序相关)。在这方面,修饰的寡核苷酸的混合物可以是修饰的寡核苷酸的文库,所述修饰的寡核苷酸各自包含独特的立体定义的核苷间键基序和分子条形码。因此,认为修饰的寡核苷酸之间的适体序列的多样性可以通过立体定义的核苷间键基序的模式来产生,而不是或加上核苷酸序列的多样性。
[0522]
靶向缀合物的发现:以上发现方法可用于鉴定将药物载货靶向目的靶组织或细胞的缀合物部分。在一些实施方案中,药物载货可以是修饰的寡核苷酸,包括sirna和反义寡核苷酸,诸如硫代磷酸酯寡核苷酸、lna寡核苷酸或2'-o-甲氧基乙基寡核苷酸。该方法可用于鉴定可随后附接至其他药品形式的缀合物。在这方面,修饰的寡核苷酸可以是治疗性寡核苷酸(或潜在的治疗性寡核苷酸),或者可以是用于鉴定缀合物以随后与其他药物载货一起使用的工具性寡核苷酸。
[0523]
该方法涉及将缀合物部分的文库与一系列条形码化的修饰的寡核苷酸(即,修饰的寡核苷酸包含已知序列)缀合的步骤,从而可以通过对每个缀合物部分共价附接至(缀合至)的条形码化的修饰的寡核苷酸进行测序来鉴定每个缀合物部分。然后将条形码化的修饰的寡核苷酸缀合物的文库施用于生物体或细胞,例如哺乳动物或细胞,并在适当的时间段后(例如,参见上述方法),从细胞或选定的细胞或来自生物体的组织中分离编码的修饰的寡核苷酸缀合物的群体,并使用平行测序方法(例如根据本文所述的方法)对修饰的寡核苷酸进行测序。然后,可以将对独特条形码的鉴定以及在一些实施方案中为鉴定出条形码序列的频率,用于鉴定增强了到细胞(诸如选定的细胞或来自生物体的组织)内的摄取的缀合物部分。
[0524]
在一些实施方案中,例如对于缀合物部分的发现应用,群体中的修饰的寡核苷酸包含5'区域(x’)和定位包含分子条形码区域(y’)的3'到5'区域的区域,所述5'区域(x’)是定义的序列-即,是修饰的寡核苷酸群体中的共有序列,其可包含用于pcr和/或克隆扩增的引物结合位点。
[0525]
在一些实施方案中,修饰的寡核苷酸可包含另外的区域(z’),其包含修饰的寡核苷酸群体共有的另外的共有序列,其可包含用于pcr和/或克隆扩增的引物结合位点。包含3'引物结合位点区域后,可直接进行pcr扩增或克隆扩增,以及进行平行测序,而无需3'捕获探针连接。备选地,可以使用3'捕获探针连接。适当地,将不同缀合物部分的文库任选地经由接头和/或可裂解接头缀合至修饰的寡核苷酸的5'区域。对于缀合物的发现,修饰的寡核苷酸可包含3'末端2'糖修饰的核苷酸的区域,例如一个或多个2'-o-moe核苷的区域(例如,包含1、2、3、4或4个2'-o-moe的区域),其保护区域x’和/或区域z’免受核酸外切酶切割。
修饰的寡核苷酸可以是硫代磷酸酯寡核苷酸。修饰的寡核苷酸可以是sirna复合体的一部分,或者可以包含反义寡核苷酸。
[0526]
纳米颗粒靶向发现:本发明的方法可用于鉴定可将药物载货靶向目的靶组织或细胞的纳米颗粒。
[0527]
该方法涉及将一系列独特的条形码化的寡核苷酸配制成一系列纳米颗粒制剂的步骤,以使每种纳米颗粒制剂均包含独特的条形码化的寡核苷酸(即,寡核苷酸包含已知的“条形码”序列,其可用于鉴定纳米颗粒),从而可以通过对每个纳米颗粒包含的条形码化的寡核苷酸进行测序来鉴定每个纳米颗粒。条形码化的寡核苷酸可以在纳米颗粒(例如,载货分子)内,或者可以形成纳米颗粒制剂的一部分(例如,通过整合到涂抹于纳米颗粒的表面上的脂质中的亲脂性缀合物)。
[0528]
配制后,可合并条形码化的寡核苷酸纳米颗粒的群体,以提供条形码化的寡核苷酸纳米颗粒的文库,然后将其施用于细胞、组织或生物体(例如哺乳动物)。
[0529]
然后,本发明的平行测序方法可用于确定纳米颗粒递送到靶细胞或靶组织中的水平。适当地,这是通过以下步骤实现的:从靶细胞或组织中分离寡核苷酸,然后执行本发明的平行测序方法来确定每种独特的条形码化的寡核苷酸的含量,从而确定每种纳米颗粒制剂的递送效率。
[0530]
换言之,在本发明的方法中,将独特的条形码化的修饰的寡核苷酸纳米颗粒的文库(或群体)施用于生物体或细胞(例如哺乳动物或细胞),并在适当的时间段后(例如,参见上述方法),从细胞或选定的细胞或来自生物体的组织中分离编码的修饰的寡核苷酸群体,并使用平行测序方法(例如根据本文所述的方法)对修饰的寡核苷酸进行测序。然后,可以将对独特条形码的鉴定以及在一些实施方案中为鉴定出条形码序列的频率,用于鉴定增强了到细胞(诸如选定的细胞或来自生物体的组织)内的摄取的纳米颗粒。
[0531]
然后可以将成功靶向靶细胞或组织的纳米颗粒用于靶向药物载货。
[0532]
在一些实施方案中,条形码化的寡核苷酸是修饰的寡核苷酸,诸如2'糖修饰的寡核苷酸,诸如lna或2'-o-moe修饰的寡核苷酸。在一些实施方案中,条形码化的寡核苷酸是硫代磷酸酯寡核苷酸。
[0533]
在一些实施方案中,药物载货可以是修饰的寡核苷酸,包括sirna和反义寡核苷酸,诸如硫代磷酸酯寡核苷酸、lna寡核苷酸或2'-o-甲氧基乙基寡核苷酸。该方法可用于鉴定可随后附接至其他药品形式的纳米颗粒。在这方面,修饰的寡核苷酸可以是治疗性寡核苷酸(或潜在的治疗性寡核苷酸),或者可以是用于鉴定纳米颗粒以随后与其他药物载货一起使用的工具性寡核苷酸。
[0534]
在一些实施方案中,例如对于纳米颗粒的发现应用,独特的条形码化的寡核苷酸包含5'区域(x’)和定位包含分子条形码区域(y’)的3'到5'区域的区域,所述5'区域(x’)是定义的序列-即,是修饰的寡核苷酸群体中的共有序列,其可包含用于pcr和/或克隆扩增的引物结合位点。
[0535]
在一些实施方案中,修饰的寡核苷酸可包含另外的区域(z’),其包含修饰的寡核苷酸群体共有的另外的共有序列,其可包含用于pcr和/或克隆扩增的引物结合位点。包含3'引物结合位点区域后,可直接进行pcr扩增或克隆扩增,以及进行平行测序,而无需3'捕获探针连接。备选地,可以使用3'捕获探针连接。适当地,将不同缀合物部分的文库任选地
经由接头和/或可裂解接头缀合至修饰的寡核苷酸的5'区域。对于纳米颗粒的发现,修饰的寡核苷酸可包含3'末端2'糖修饰的核苷酸的区域,例如一个或多个2'-o-moe核苷的区域(例如,包含1、2、3、4或4个2'-o-moe的区域),其保护区域x’和/或区域z’免受核酸外切酶切割。修饰的寡核苷酸可以是硫代磷酸酯寡核苷酸。修饰的寡核苷酸可以是sirna复合体的一部分,或者可以包含反义寡核苷酸。
[0536]
本发明提供用于鉴定包含修饰的寡核苷酸序列的纳米颗粒的方法,所述修饰的寡核苷酸序列在细胞中具有增强的细胞摄取,所述方法包括:
[0537]
i.将纳米颗粒的群体施用于细胞,每个纳米颗粒均包含修饰的寡核苷酸,所述修饰的寡核苷酸包含独特的核碱基序列(条形码);
[0538]
ii.一段时间后,从细胞内分离修饰的寡核苷酸,
[0539]
iii.执行根据本文所述实施方案或权利要求中任一项的方法,以对在步骤(ii)中获得的修饰的寡核苷酸进行平行测序;以
[0540]
iv.鉴定在细胞或细胞的群体中富集的一种或多种纳米颗粒制剂。
[0541]
所述方法可以是体外或体内方法。
[0542]
本发明提供一种鉴定在哺乳动物的靶组织或细胞中富集的一种或多种纳米颗粒制剂的方法,所述方法包括:
[0543]
i.将修饰的寡核苷酸的混合物施用于哺乳动物,其中所述修饰的寡核苷酸的混合物的每个成员包含独特的核碱基序列,其中将所述修饰的寡核苷酸的混合物的每个成员配制成不同的纳米颗粒制剂;
[0544]
ii.允许将纳米颗粒配制的修饰的寡核苷酸分布在哺乳动物体内,例如至少6个小时的时间段;
[0545]
iii.从哺乳动物的包含目的靶组织或目的靶细胞的一个或多个组织或细胞中分离出修饰的寡核苷酸群体,
[0546]
iv.执行根据本文所述的权利要求或实施方案中任一项的方法,包括对修饰的寡核苷酸群体进行平行测序的步骤,以
[0547]
v.鉴定在哺乳动物的目的靶组织或细胞中富集的修饰的寡核苷酸序列,从而鉴定靶向靶组织或细胞的一种或多种纳米颗粒制剂。
[0548]
在一些实施方案中,本发明的方法或用途是鉴定优先被细胞(诸如靶细胞或靶组织)摄取的纳米颗粒。
[0549]
实施方案-下文描述本发明的示例性实施方案,所述实施方案可以与本文中描述或要求保护的其他实施方案组合。
[0550]
1.一种用于对修饰的寡核苷酸的核碱基序列测序的方法,所述方法包括步骤:
[0551]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸的3’末端;
[0552]
b.从捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含修饰的寡核苷酸的互补序列的核酸序列;
[0553]
c.对在步骤b)中获得的第一链合成产物进行基于引物的测序。
[0554]
2.一种用于对修饰的寡核苷酸群体的碱基序列进行平行测序的方法,所述方法包括以下步骤:
[0555]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的
3'末端;
[0556]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0557]
c.对步骤b)中获得的第一链合成产物的群体进行基于引物的平行测序。
[0558]
3.根据实施方案1或2的方法,其中所述捕获探针包含第一引物结合位点,并且在第一链合成之前,将第一引物与所述捕获探针杂交以引发第一链合成。
[0559]
4.根据实施方案1或2的方法,其中所述捕获探针是自引发捕获探针。
[0560]
5.根据实施方案1-4中任一项的方法,其中在步骤b之后且在步骤c之前,将所述第一链合成产物进行pcr扩增。
[0561]
6.根据实施方案1-5中任一项的方法,其中步骤c)包括在进行基于引物的测序之前,对步骤b.的所述第一链合成产物或实施方案5的所述pcr扩增产物进行克隆扩增。
[0562]
7.根据实施方案1-6中任一项的方法,其中在将所述3'捕获探针连接到所述修饰的寡核苷酸之后,并且在第一链合成之前,对所述连接产物进行纯化,例如通过凝胶纯化或通过对所述未连接的3'捕获探针进行酶促降解。
[0563]
8.根据实施方案5-7中任一项的方法,其中使用pcr引物对进行pcr步骤,其中一个pcr引物对3'捕获探针是特异的,而第二pcr引物对修饰的寡核苷酸(诸如修饰的寡核苷酸的5'区域)是特异的。
[0564]
9.根据实施方案1-8中任一项的方法,其中所述基于引物的测序步骤包括使用克隆扩增引物对所述第一链合成步骤(b)进行克隆扩增,其中一个克隆扩增引物对所述3'捕获探针是特异的,而第二克隆扩增引物对所述修饰的寡核苷酸(诸如所述修饰的寡核苷酸的5'区域)是特异的。
[0565]
10.根据实施方案1-7中任一项的方法,其中在所述第一链合成步骤(b)或实施方案7的所述纯化步骤之后,将衔接子探针连接在所述第一链合成产物的3'端。
[0566]
11.根据实施方案10的方法,其中使用一对pcr引物进行pcr步骤,其中一个pcr引物对3'捕获探针是特异的,而另一pcr引物对衔接子探针是特异的。
[0567]
12.根据实施方案10或11的方法,其中所述捕获探针和所述衔接子探针包含克隆扩增引物结合位点,并且所述测序步骤包括对实施方案10的所述第一链合成/衔接子探针连接产物或实施方案11的所述pcr扩增产物进行克隆扩增。
[0568]
13.根据实施方案12的方法,其中所述克隆扩增引物对所述第一和第二pcr引物是特异的;或所述克隆扩增引物对所述3'捕获探针和衔接子探针是特异的;或一个克隆扩增引物对所述pcr引物之一是特异的,而另一个克隆扩增引物则对所述3'捕获探针或所述衔接子探针是特异的。
[0569]
14.根据实施方案1-7中任一项的方法,其中在所述第一链合成步骤(b)之后,将所述第一链合成产物在3'端聚核苷酸(polyn),例如聚腺苷酸化。
[0570]
15.根据实施方案14的方法,其中使用具有互补poly(n)序列的引物(例如,多聚t引物)合成第二链。
[0571]
16.根据实施方案15的方法,其中所述第二链合成引物进一步包含pcr引物结合位点和/或克隆扩增引物结合位点(或流动池引物结合位点)。
[0572]
17.根据实施方案14-16中任一项的方法,其中使用对所述3'捕获探针特异的引物以及所述第二链合成引物或对所述第二链合成引物特异的pcr引物进行所述pcr步骤。
[0573]
18.根据实施方案14-17中任一项的方法,其中所述测序步骤包括克隆扩增,其中一个克隆扩增引物对所述3'捕获探针是特异的,而第二克隆扩增引物对所述第二链合成引物是特异的。
[0574]
19.根据实施方案18的方法,其中所述pcr引物进一步包含克隆扩增引物结合位点(诸如流动池捕获探针结合位点),其中所述测序步骤包括使用克隆扩增引物(诸如流动池结合引物)进行克隆扩增,所述克隆扩增引物与克隆扩增引物结合位点互补。
[0575]
20.根据实施方案1-19中任一项的方法,其中所述基于引物的测序步骤使用边合成边测序方法进行。
[0576]
21.根据实施方案1-20中任一项的方法,其中所述基于引物的测序方法是循环可逆终止方法(crt)。
[0577]
22.根据实施方案1-21中任一项的方法,其中所述测序步骤包括克隆扩增,并且所述克隆扩增引物结合至固相支持物(例如,流通池),或在乳化小滴内区室化。
[0578]
23.根据实施方案22的方法,其中所述基于引物的测序步骤的所述克隆扩增步骤包括
[0579]
a.固相扩增,例如固相桥式扩增,或
[0580]
b.乳液相扩增,例如小滴pcr。
[0581]
24.根据实施方案1-23中任一项的方法,其中所述基于引物的测序使用平行测序例如大规模平行测序来进行。
[0582]
25.根据实施方案1-24中任一项的方法,其中所述第一链合成是在聚合酶和聚乙二醇或丙二醇的存在下进行的。
[0583]
26.根据实施方案1-25中任一项的方法,用于第一链合成的所述聚合酶是taq聚合酶或volcano2g聚合酶或primescript逆转录酶或与taq聚合酶具有至少70%同一性的有效聚合酶。
[0584]
27.根据实施方案1-26中任一项的方法,其中所述修饰的寡核苷酸是2'糖修饰的硫代磷酸酯寡核苷酸,诸如lna硫代磷酸酯或2'-o-moe硫代磷酸酯寡核苷酸。
[0585]
28.根据实施方案1-27中任一项的方法,其中所述修饰的寡核苷酸包含至少两个连续的2'糖修饰的核苷。
[0586]
29.根据实施方案1-28中任一项的方法,其中所述修饰的寡核苷酸包含至少一个2'-o-甲氧基乙基rna(moe)核苷。
[0587]
30.根据实施方案1-29中任一项的方法,其中所述修饰的寡核苷酸包含至少两个连续的2'-o-甲氧基乙基rna(moe)核苷。
[0588]
31.根据实施方案1-30中任一项的方法,其中所述修饰的寡核苷酸包含位于所述修饰的寡核苷酸的3'处的至少一个2'-o-甲氧基乙基rna(moe)核苷,诸如位于所述修饰的寡核苷酸的3'端的至少两个或至少三个连续的2'-o-甲氧基乙基rna(moe)核苷。
[0589]
32.根据实施方案1-31中任一项的方法,其中所述修饰的寡核苷酸包含至少1个lna核苷。
[0590]
33.根据实施方案1-32中任一项的方法,其中所述修饰的寡核苷酸包含至少两个
连续的lna核苷酸或至少三个连续的lna核苷酸。
[0591]
34.根据实施方案1-33的方法,所述修饰的寡核苷酸包含至少一个lna核苷酸,诸如位于所述lna寡核苷酸的3'端的至少两个lna核苷酸。
[0592]
35.根据实施方案1-34中任一项的方法,其中所述修饰的寡核苷酸是lna硫代磷酸酯寡核苷酸。
[0593]
36.根据实施方案1-35中任一项的方法,其中所述修饰的寡核苷酸包含lna核苷和dna核苷这两者,诸如lna缺口聚体或lna混聚体。
[0594]
37.根据实施方案1-36中任一项的方法,其中所述修饰的寡核苷酸包含至少一个2'糖修饰的t核苷,诸如lna-t核苷,或至少一个2'糖修饰的c核苷,诸如lna-c核苷。
[0595]
38.根据实施方案1-37中任一项的方法,其中所述修饰的寡核苷酸包含一个或多个lna核苷和一个或多个2'取代的核苷,诸如一个或多个2'-o-甲氧基乙基核苷。
[0596]
39.根据实施方案1-38中任一项的方法,其中所述修饰的寡核苷酸选自由以下项组成的组:2'-o-甲氧基乙基缺口聚体、混合翼缺口聚体、交替侧翼缺口聚体或lna缺口聚体。
[0597]
40.根据实施方案1-39中任一项的方法,其中所述修饰的寡核苷酸是混聚体或总聚体。
[0598]
41.根据实施方案1-40中任一项的方法,其中所述修饰的寡核苷酸包含缀合物基团,诸如galnac缀合物。
[0599]
42.根据实施方案1-41中任一项的方法,其中所述修饰的寡核苷酸是适体或包含适体序列。
[0600]
43.根据实施方案1-42中任一项的方法,其中所述修饰的寡核苷酸包含修饰的寡核苷酸缀合物的群体,其中所述修饰的寡核苷酸缀合物的群体的每个成员包含不同的缀合物基团。
[0601]
44.一种用于鉴定在细胞中具有增强的细胞摄取的修饰的寡核苷酸或修饰的寡核苷酸序列的方法,所述方法包括:
[0602]
v.施用修饰的寡核苷酸群体,其中修饰的寡核苷酸群体的每个成员包含对细胞独特的核碱基序列;
[0603]
vi.一段时间后,从细胞内分离修饰的寡核苷酸,
[0604]
vii.执行根据实施方案2-43中任一项的方法,以对在步骤(ii)中获得的修饰的寡核苷酸进行平行测序;以
[0605]
viii.鉴定在细胞或细胞的群体中富集的一种或多种修饰的寡核苷酸序列。
[0606]
45.根据实施方案44的方法,其中所述细胞是体外的。
[0607]
46.根据实施方案44的方法,其中所述细胞是体内的。
[0608]
47.一种鉴定在哺乳动物的靶组织或细胞中富集的修饰的寡核苷酸(序列)的方法,所述方法包括:
[0609]
vi.向哺乳动物施用修饰的寡核苷酸的混合物,其中修饰的寡核苷酸的混合物的每个成员包含独特的核碱基序列,
[0610]
vii.允许修饰的寡核苷酸分布在哺乳动物体内,例如至少6个小时;
[0611]
viii.从哺乳动物的包含目的靶组织或目的靶细胞的一个或多个组织或细胞中分
离出修饰的寡核苷酸群体,
[0612]
ix.执行根据实施方案2-38中任一项的方法,包括对修饰的寡核苷酸群体进行平行测序的步骤,以
[0613]
x.鉴定在哺乳动物的目的靶组织或细胞中富集的修饰的寡核苷酸序列。
[0614]
48.根据实施方案44-47中任一项的方法,其中所述修饰的寡核苷酸的所述群体的所述每个成员包含不同的(独特的)分子条形码序列。
[0615]
49.根据实施方案44-48的方法,其中所述修饰的寡核苷酸群体的每个成员包含不同的适体序列。
[0616]
50.根据实施方案44-48的方法,其中所述修饰的寡核苷酸群体的每个成员包含不同的缀合物部分。
[0617]
51.根据实施方案49的方法,其中所述方法是为了鉴定优先被所述细胞(诸如靶细胞或靶组织)摄取的适体或适体序列。
[0618]
52.根据实施方案50的方法,其中所述方法是为了鉴定优先被所述细胞(诸如靶细胞或靶组织)摄取的缀合物部分。
[0619]
进一步的实施方案:
[0620]
本发明还提供了以下实施方案:
[0621]
实施方案1:一种用于对2'糖修饰的硫代磷酸酯修饰的寡核苷酸的核碱基序列进行测序的方法,所述方法包括以下步骤:
[0622]
a.将捕获探针寡核苷酸连接至所述修饰的寡核苷酸的3'末端;
[0623]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生包含所述修饰的寡核苷酸的互补序列的核酸序列;
[0624]
c.将衔接子探针连接至步骤b中获得的所述第一链合成产物的3'端;以及随后
[0625]-对步骤c)中获得的所述连接产物进行基于引物的测序;或者
[0626]-对步骤c)中获得的所述连接产物进行pcr扩增并且对pcr扩增产物进行基于引物的测序。
[0627]
实施方案2:一种用于对2'糖修饰的硫代磷酸酯修饰的寡核苷酸群体的碱基序列进行平行测序的方法,所述方法包括以下步骤:
[0628]
a.将捕获探针寡核苷酸连接至修饰的寡核苷酸群体中存在的修饰的寡核苷酸的3'末端;
[0629]
b.从所述捕获探针进行聚合酶介导的5'-3'第一链合成,以产生核酸序列群体,每个核酸序列都包含所述修饰的寡核苷酸群体中存在的修饰的寡核苷酸的碱基序列的互补序列;
[0630]
c.将衔接子探针连接至步骤b中获得的所述第一链合成产物的3'端;以及随后
[0631]-对步骤c)中获得的所述连接产物进行基于引物的平行测序;或者
[0632]-对步骤c)中获得的连接产物进行pcr扩增,并对pcr扩增产物进行基于引物的平行测序。
[0633]
2.根据实施方案1或2所述的方法,所述捕获探针包含第一引物结合位点,并且在第一链合成之前,将第一引物与所述捕获探针杂交以引发第一链合成。
[0634]
3.根据实施方案1或2所述的方法,所述捕获探针是自引发捕获探针。
[0635]
4.根据实施方案1-4中任一项所述的方法,所述捕获探针和所述衔接子探针包含克隆扩增引物结合位点,并且所述测序步骤包括对步骤c中获得的所述连接产物或对所述pcr扩增产物的克隆扩增。
[0636]
5.根据实施方案1-5中任一项所述的方法,所述pcr扩增步骤使用一对pcr引物进行,所述一对pcr引物中的一条引物对所述捕获探针寡核苷酸具有特异性,另一条引物对所述衔接子探针具有特异性。
[0637]
6.根据实施方案6所述的方法,所述pcr扩增引物包含克隆扩增引物结合位点,并且所述基于引物的测序步骤包括对所述pcr扩增产物的克隆扩增。
[0638]
7.根据实施方案1-5中任一项所述的方法,所述克隆扩增引物对所述第一和第二pcr引物具有特异性;或所述克隆扩增引物对所述3'捕获探针和衔接子探针具有特异性;或分别地所述克隆扩增引物中的一条引物对所述pcr引物中的一条引物具有特异性,而另一克隆扩增引物对所述3'捕获探针或所述衔接子探针具有特异性。
[0639]
8.根据实施方案1-8中任一项所述的方法,所述基于引物的测序步骤使用边合成边测序方法进行。
[0640]
9.根据实施方案1-9中任一项所述的方法,所述基于引物的测序方法是循环可逆终止方法(crt)。
[0641]
10.根据实施方案1-10中任一项所述的方法,所述测序步骤包括克隆扩增,并且所述克隆扩增引物与固体支持物例如流动池结合,或在乳化小滴内区室化。
[0642]
11.根据实施方案1-11中任一项所述的方法,所述基于引物的测序步骤的所述pcr步骤包括:
[0643]
a.固相扩增,例如固相桥式扩增,或
[0644]
b.乳化相扩增,例如小滴pcr。
[0645]
12.根据实施方案1-12中任一项所述的方法,所述基于引物的测序使用平行测序例如大规模平行测序来进行。
[0646]
13.根据实施方案1-13中任一项所述的方法,所述第一链合成是在聚合酶和聚乙二醇或丙二醇的存在下进行的。
[0647]
14.根据实施方案1-14中任一项所述的方法,用于第一链合成的所述聚合酶是taq聚合酶或volcano2g聚合酶或primescript逆转录酶或与taq聚合酶具有至少70%同一性的有效聚合酶。
[0648]
15.根据实施方案1-15中任一项所述的方法,所述修饰的寡核苷酸是2'糖修饰的硫代磷酸酯寡核苷酸,诸如lna硫代磷酸酯或2'-o-moe硫代磷酸酯寡核苷酸。
[0649]
16.根据实施方案1-16中任一项所述的方法,所述修饰的寡核苷酸包含至少两个连续的2'糖修饰的核苷。
[0650]
17.根据实施方案1-17中任一项所述的方法,所述修饰的寡核苷酸包含至少一个2'-o-甲氧基乙基rna(moe)核苷。
[0651]
18.根据实施方案1-18中任一项所述的方法,所述修饰的寡核苷酸包含至少两个连续的2'-o-甲氧基乙基rna(moe)核苷。
[0652]
19.根据实施方案1-19中任一项所述的方法,所述修饰的寡核苷酸包含位于所述修饰的寡核苷酸的3'端的至少一个2'-o-甲氧基乙基rna(moe)核苷,诸如位于所述修饰的
寡核苷酸的3'端的至少两个或至少三个连续的2'-o-甲氧基乙基rna(moe)核苷。
[0653]
20.根据实施方案1-20中任一项所述的方法,所述修饰的寡核苷酸包含至少1个lna核苷。
[0654]
21.根据实施方案1-21中任一项所述的方法,所述修饰的寡核苷酸包含至少两个连续的lna核苷酸或至少三个连续的lna核苷酸。
[0655]
22.根据实施方案1-22所述的方法,所述修饰的寡核苷酸包含至少一个lna核苷酸,诸如位于所述lna寡核苷酸的3'端的至少两个lna核苷酸。
[0656]
23.根据实施方案1-23中任一项所述的方法,所述修饰的寡核苷酸是lna硫代磷酸酯寡核苷酸。
[0657]
24.根据实施方案1-24中任一项所述的方法,所述修饰的寡核苷酸包含lna核苷和dna核苷这两者,诸如lna缺口聚体或lna混聚体。
[0658]
25.根据实施方案1-25中任一项所述的方法,所述修饰的寡核苷酸包含至少一个2'糖修饰的t核苷,诸如lna-t核苷,或至少一个2'糖修饰的c核苷,诸如lna-c核苷。
[0659]
26.根据实施方案1-26中任一项所述的方法,所述修饰的寡核苷酸包含一个或多个lna核苷和一个或多个2'取代的核苷,诸如一个或多个2'-o-甲氧基乙基核苷。
[0660]
27.根据实施方案1-27中任一项所述的方法,所述修饰的寡核苷酸选自由以下项组成的组:2'-o-甲氧基乙基缺口聚体、混合翼缺口聚体、交替侧翼缺口聚体或lna缺口聚体。
[0661]
28.根据实施方案1-27中任一项所述的方法,所述修饰的寡核苷酸是混聚体或总聚体。
[0662]
29.根据实施方案1-29中任一项所述的方法,所述修饰的寡核苷酸包含缀合物基团,诸如galnac缀合物。
[0663]
30.根据实施方案1-30中任一项所述的方法,所述方法用于确定修饰的寡核苷酸群体中纯度或异质性的程度,所述修饰的寡核苷酸群体为例如单个寡核苷酸合成批次或多个寡核苷酸合成批次的合并池。
[0664]
31.根据实施方案1-31中任一项所述的方法,所述方法用于确定所述修饰的寡核苷酸的所述序列,或所述修饰的寡核苷酸群体中存在的主要序列,所述修饰的寡核苷酸群体为例如修饰的寡核苷酸合成批次或多个寡核苷酸合成批次的合并池。
[0665]
32.根据实施方案1-32中任一项所述的方法,所述修饰的寡核苷酸是修饰的寡核苷酸群体,例如来自同一寡核苷酸合成轮次[或批次]或多个寡核苷酸合成轮次[或批次]的修饰的寡核苷酸群体的合并池。
[0666]
33.基于引物的测序用于对2'糖修饰的寡核苷酸群体的核碱基序列进行测序的用途。
[0667]
34.基于引物的测序用于确定2'糖修饰的寡核苷酸的合成或制造轮次的产物的异质性的用途。
[0668]
35.基于引物的测序用于确定2'糖修饰的寡核苷酸的合成或制造轮次的产物的质量的用途。
[0669]
36.平行测序用于对2'糖修饰的寡核苷酸群体的核碱基序列进行测序的用途。
[0670]
37.平行测序用于确定2'糖修饰的寡核苷酸的合成或制造轮次的产物的质量的用
途。
[0671]
38.平行测序用于确定2'糖修饰的寡核苷酸的合成或制造轮次的产物的异质性的用途。
[0672]
39.边合成边测序用于对2'糖修饰的寡核苷酸群体的核碱基序列进行测序的用途。
[0673]
40.边合成边测序用于确定2'糖修饰的寡核苷酸的合成或制造轮次的产物的异质性的用途。
[0674]
41.边合成边测序用于确定2'糖修饰的寡核苷酸的合成或制造轮次中产物的质量的用途。
[0675]
42.根据实施方案34-42中任一项所述的用途,所述2'糖修饰的寡核苷酸如实施方案1-33中任一项所定义。
[0676]
43.taq聚合酶或与seq id no 1具有至少70%同一性的聚合酶用于从包含lna修饰的硫代磷酸酯寡核苷酸或2'-o-甲氧基乙基修饰的硫代磷酸酯寡核苷酸的模板进行第一链合成的用途。
实施例
[0677]
为了能够对核苷修饰的寡核苷酸(例如lna寡核苷酸)进行测序,我们需要一种能够有效读取整个lna寡核苷酸的聚合酶。我们确定只有某些聚合酶才能做到这一点,而对于某些聚合酶,某些添加剂的存在可以增强核苷修饰的寡核苷酸的通读功效。在此我们确定了优选的聚合酶,并已发现使聚合酶能够读取整个测试lna寡核苷酸的用于pcr反应的添加剂。
[0678]
实施例1:生成测试分子以测试lna寡核苷酸的聚合酶读取效率。
[0679]
为了能够测试各种聚合酶读取lna寡核苷酸的能力,我们生成了一个单链测试模板分子,其中一个具有硫代磷酸酯主链(12个碱基对)的lna寡核苷酸在>20bp的常规dna碱基的5'和3'侧上均侧接硫代磷酸酯主链(参见图1a),命名为“lna测试模板1”(ltt1)。该模板分子用于以后的各种实验。我们还与此lna寡核苷酸测试分子平行生成了相同的测试模板,其中12个碱基对由相同序列组成,但所有碱基的dna和主链均为磷酸二酯。该模板称为“dna测试模板1”(dtt1),用作对照寡核苷酸。这些模板用于以后的实验中,引物置于这些分子的5'端和3'部分。为了进行pcr反应,聚合酶必须能够将引物一直延伸跨越模板包含磷酸二酯主链以及5'常规dna的部分。因此,该ltt1分子用于测试聚合酶复制lna寡核苷酸的能力。
[0680]
ltt1和dtt1生成如下:
[0681]
以下寡核苷酸为合成(lna o1)或从idt(dna o1)订购。
[0682]
lna o1:5'-g
o
c
o
g
o
t
o
a
o
a
o
c
o
t
o
a
o
g
o
a
o
c
o
c
o
a
o
t
o
a
o
a
o
g
o
c
o
c
o
g
s
a
s
t
s
a
s
g
s
c
s
t
s
t
s
g
s
a
s
a
sm
c-3'(seq id no 2)
[0683]
dna o1:5'-g
o
c
o
g
o
t
o
a
o
a
o
c
o
t
o
a
o
g
o
a
o
c
o
c
o
a
o
t
o
a
o
a
o
g
o
c
o
c
o
g
o
a
o
t
o
a
o
g
o
c
o
t
o
t
o
g
o
a
o
a
o
c-3'(seq id no 3)
[0684]
其中小写字母是dna核苷,大写字母是β-d-氧基lna核苷,mc=5甲基胞嘧啶β-d-氧基lna核苷,下标o=磷酸二酯核苷间键,下标s=硫代磷酸酯核苷间键。lna o1在图1a中显
示为ltt1,dna o1在图1a中显示为dtt1。
[0685]
将这些寡核苷酸连接至以下dna捕获探针(dcp1)
[0686]
/5phos/cggaccagcaagcttagagatcacggtatccagattcgctcatagtacacaactgcc/isp18/tccggttcaa/3ammo/(seq id no 4)
[0687]
(所有核苷均为磷酸二酯连接的dna核苷;“/5phos/”表示5'磷酸基团;/isp18/表示18原子的六乙二醇间隔基;/3ammo/表示3'氨基修饰)。请注意,在序列表中,本文公开的探针的碱基序列提供时未包含指定的修饰,在某些情况下,rna碱基显示为dna碱基-在不一致的情况下,实施例中的序列和序列的修饰优先于序列表中的公开。
[0688]
连接反应:
[0689]
在pcr管中建立以下连接反应:
[0690]
a:2ul h2o+2ul dcp1(100um)
[0691]
b:2ul lna o1(10um)+2ul dcp1(100um)
[0692]
c:2ul lna o1(10um)+2ul dcp1(100um)
[0693]
将混合物在55℃加热3min,然后冷却至4℃。
[0694]
向每个试管中添加:
[0695]
2ul t4 dna连接酶缓冲液(thermo scientific)
[0696]
6ul peg(50%)
[0697]
6ul h2o
[0698]
2ul t4 dna连接酶(thermo scientific)
[0699]
将混合物涡旋并在以下条件下进行连接3x循环(16℃;20min,25℃;10min,37℃;1min),然后75℃下10min,然后保持在4℃。
[0700]
凝胶电泳:
[0701]
向上述每个反应中,加入等体积的2倍tbe-尿素样本缓冲液(thermo fisher scientific),并将样本在95℃加热变性2min,然后置于冰上。将如此制备的15μl样本上样至15%,15孔tbe-尿素凝胶(thermo fisher scientific),并在180v恒定电压下电泳75min。使用sybr金核酸凝胶染料对dna染色(thermo scientific)10min。凝胶通过chemidoc触摸成像系统(bio rad)在蓝色托盘上可视化(参见图1b)。
[0702]
从凝胶上切下含有dcp1和寡核苷酸之间的连接产物的条带。将凝胶碎片压碎并在500ul te缓冲液中浸泡一整夜,以提取连接的寡核苷酸。浸泡后,使用ultra-0.5ultracel-3滤膜,3kda色谱柱将连接的寡核苷酸洗涤并浓缩。在纳米微滴上测量两个模板寡核苷酸(ltt1和dtt1)的浓度,并归一化为相同的浓度。
[0703]
实施例2:无法在含lna寡核苷酸的模板上进行标准pcr扩增。
[0704]
ltt1、dtt1和捕获探针(dcp1)在使用qx200
tm ddpcr
tm evagreen supermix进行的标准乳化pcr反应中用作模板分子。使用用于evagreen的自动微滴生成油在autodg(biorad)上产生微滴。pcr循环后,在qx200微滴读取器(biorad)上读取微滴。
[0705]
使用dcp1特异性引物(dcp1_引物1:gcagttgtgtactatgagcga,seq id no 5)和结合至ltt1和dtt1的5'端的正向引物(tt1_引物1:gcgtaactagaccataagcc,seq id no 6)建立pcr反应。还进行了第二反应,其中加入额外的标准taq聚合酶(new england biolabs)。
england biolabs的amv逆转录酶10units/ul、来自takara的primescript逆转录酶(primescript rt试剂盒)。
[0713]
10ul第一链合成反应:
[0714]
包含所有反应(1ul ltt1(31pm)、0.5ul dcp1_引物1(10um)和水添加10ul)。使用供应商提供的缓冲液运行不同的酶。
[0715]
a)1ul accuscript、1ul 0.1m dtt、1ul缓冲液、1ul dntp(10mm)
[0716]
b)0.5ul superscript iv、0.5ul 0.1m dtt,2ul第一链缓冲液、1ul dntp(10mm)
[0717]
c)0.2ul vulcano2g、2ul vulcano缓冲液、1ul dntp(10mm)
[0718]
d)0.5ul revertaid、2ul反应缓冲液、1ul dntp(10mm)
[0719]
e)0.5ul amv、0.5ul 0.1m dtt、2ul cdna合成缓冲液、1ul dntp(10mm)
[0720]
f)0.5ul primescript、2ul primescript缓冲液、1ul dntp(10mm)
[0721]
加入除了酶之外的所有组分,将混合物加热至65℃持续5min,然后置于冰上1min,然后最终加入rt酶。每种条件下,在以下温度下进行1小时第一链合成(55℃、54.2℃、52.5℃、50℃、47.1℃、44.6℃,42.9℃、42℃)然后在80℃下10min,冷却并保持在4℃。
[0722]
将所有第一链反应用水稀释200倍,并将2ul样本用作常规qx200
tm ddpcr
tm evagreen supermix pcr反应的输入,如实施例2所述。加入2ul ltt1(15.5fm)、dtt1(15.5fm)或h2o作为阴性和阳性对照。2ul的15.5fm输入等于从第一链合成步骤中添加的ltt1分子的数量。
[0723]
结果:
[0724]
图3显示不同pcr反应中微滴的荧光强度。图中仅显示42℃rt反应的结果。对于每种条件,其他温度的结果相同,只是在52.5℃以上失去非常小的amv活性。我们看到,在普通rt酶中,无法读取整个ltt1模板上或者效率非常低。但是,我们发现vulcano2g在读取模板方面似乎具有相当高的效率。与dtt1模板上具有相等输入分子数量的ddpcr相比,微滴数量的定量显示,vulcano2g酶的读取效率约为10%,这意味着10个llt1分子中的一个被vulcano2g酶完整转录。我们发现amv和prime script酶的效率约为0.1%。
[0725]
实施例4:测试pcr添加剂以允许dna聚合酶通读lna寡核苷酸
[0726]
为了尝试克服使用聚合酶在lna寡核苷酸上转录的困难,我们着手测试pcr反应中的添加剂是否可以帮助聚合酶读取ltt1中的lna寡核苷酸。我们测试了4种已知的pcr添加剂,即四甲基氯化铵(tma)、聚乙二醇(peg)、氯化铵和1,2-丙二醇,以了解它们是否会对读取lna寡核苷酸具有有益的作用。使用含有改良taq聚合酶的accustart ii pcr toughmix(quantibio)在乳化pcr反应中测试添加剂。使用用于evagreen的自动微滴生成油在autodg(biorad)上产生微滴。pcr循环后,在qx200微滴读取器(biorad)上读取微滴。将单独的evagreen染料(biotium目录号31000)添加到pcr反应中。
[0727]
测试了ddpcr反应的以下添加物:tma(1mm、5mm、10mm、20mm、40mm、60mm、80mm、100mm)、peg(0%、0.1%、0.5%、1%、2%、3%、4%、5%)、氯化铵(1mm、5mm、10mm、20mm、40mm、60mm、80mm、100mm)、1,2-丙二醇(0.2m、0.4m、0.6m、0.8m、1m、1.2m、1.6m、2m)。
[0728]
pcr反应混合物(22ul):
[0729]
11ul accustart ii pcr toughmix
[0730]
0.2ul tt1_引物1(10um)
[0731]
0.2ul dcp1_引物1(10um)
[0732]
0.5ul evagreen染料(40x)
[0733]
x ul pcr添加剂
[0734]
2ul ltt1(100fm)
[0735]
h2o ad 22ul
[0736][0737]
结果:
[0738]
图4显示使用添加剂的ddpcr结果。结果显示为一维图,显示所有微滴的荧光强度。结果显示,添加tma氯化物和氯化铵不会导致lna通读有任何改善(图4小图a和c)。但是,我们看到peg浓度增加会导致阳性微滴数量增加。积极作用始于3%peg,4%和5%均有增加(图4小图b)。我们还观察到添加1,2-丙二醇的积极作用,其中我们看到阳性微滴数量从0.8m 1,2-丙二醇开始增加(图4小图d)。尽管将1,2-丙二醇的浓度增加到1.2m以上确实会产生更多阳性微滴,但也会导致阳性微滴的荧光强度降低。综上所述,我们得出的结论是,添加peg或1,2-丙二醇可使taq聚合酶显著提高其读取整个具有磷酸化主链的lna寡核苷酸的能力。图4小图e显示检测到的ltt1分子的浓度,表明peg明显提高ltt1的检测率,并且与同样能够增加一定读取ltt1模板的能力的1,2-丙二醇相比,peg是更好的添加剂。
[0739]
由于我们没有看到peg的积极作用达到饱和,因此我们以相同的设置进行了第二次实验,但在其中我们进一步提高了反应中peg的浓度。(图4小图f)。当peg的浓度增加到9%以上时,我们开始看到微滴开始瓦解,尽管阳性微滴的数量相同。当peg的浓度为15%时,我们看到微滴完全瓦解。最后,我们测试了peg和1,2-丙二醇的组合是否进一步提高了寡核苷酸通读。图4小图g显示使用9%的peg和0m、0.5m、1.0m或1.5m的1,2-丙二醇的相应ddpcr反应,显示通过共添加1,2-丙二醇以进一步增强反应没有明显的益处。通常,当peg的量超过6%时,我们看不到在ddpcr反应中添加额外1,2-丙二醇的益处(数据未显示)。
[0740]
实施例5:peg和/或1,2-丙二醇使某些dna聚合酶能够读取lna寡核苷酸。
[0741]
在实施例4中表明,当我们使用含有未公开的修饰的taq聚合酶的accustart ii pcr toughmix(quantabio)时,添加peg和1,2-丙二醇时对于ltt1模板分子的成功扩增是有益的。为了查看pcr添加剂是否还使lna寡核苷酸能够“通读”其他聚合酶,我们通过执行多轮ltt1模板的第一链合成来测试常规taq聚合酶和高保真聚合酶(phusion聚合酶,thermo scientific)。如实验2、3、4中所示,通过evagreen ddpcr检测可检测所生成完整的第一链
拷贝的数量。设置以下20ul反应,并执行0、1、3、5和10轮第一链扩增。
[0742]
a)0.1ul taq聚合酶、2ul taq缓冲液、0.4ul dcp1_引物1(10um)、0.4ul ltt1(10pm)
[0743]
b)0.1ul taq聚合酶、2ul taq缓冲液、0.4ul dcp1_引物1(10um)、0.4ul ltt1(10pm)、0.5ul 1,2-丙二醇、4ul peg(50%)
[0744]
c)2ul taq缓冲液、0.4ul dcp1_引物1(10um)、0.4ul ltt1(10pm)、0.5ul 1,2-丙二醇、4ul peg(50%)
[0745]
d)0.2ul phusion聚合酶、5倍hf缓冲液、0.4ul dcp1_引物1(10um)、0.4ul ltt1(10pm)
[0746]
e)0.2ul phusion聚合酶、5倍hf缓冲液、0.4ul dcp1_引物1(10um)、0.4ul ltt1(10pm)、0.5ul 1,2-丙二醇、4ul peg(50%)
[0747]
f)0.2ul phusion聚合酶、5倍gf缓冲液、0.4ul dcp1_引物1(10um)、0.4ul ltt1(10pm)
[0748]
g)0.2ul phusion聚合酶、5倍gf缓冲液、0.4ul dcp1_引物1(10um)、0.4ul ltt1(10pm)、0.5ul 1.2-丙二醇、4ul peg(50%)
[0749]
第一链反应。(95℃下5min;52.5℃下3min循环x次,95℃下30sec;然后置于冰上)
[0750]
如实施例2所述,将第一链合成反应稀释50倍,并将2ul用作evagreen ddpcr反应的输入。
[0751]
结果:
[0752]
图5显示第一链合成ddpcr反应的结果。图5小图a显示在没有pcr添加剂的情况下第一链taq聚合酶合成上的ddpcr反应。可以看出,由于第一链合成循环,阳性微滴的数量几乎没有增加,再次表明taq聚合酶在常规条件下无法读取整个含有磷酸酯主链和lna碱基的寡核苷酸。图5小图c显示没有taq聚合酶存在的情况下相同的反应。没有taq聚合物的第一链反应中的阳性微滴数量几乎与没有添加剂的反应中的阳性微滴数量相同。这表明大多数阳性微滴来自发生在evagreen ddpcr反应期间而不是在第一链合成期间lna模板的复制。图5小图b显示第一链合成反应期间存在10%peg和0.31m时ddpcr反应的结果。可以看出,阳性微滴的数量随第一链合成循环次数增加而增加,表明添加剂使标准taq聚合酶能够读取整个ltt1的lna寡核苷酸部分。图5小图e和f显示在有和没有10%peg和0.31m 1.3-丙二醇添加剂的情况下,在hf缓冲液中使用phusion dna聚合酶进行第一链合成反应的ddpcr。这说明无论是否加入peg和1,2-丙二醇以及使用缓冲液hf或gf缓冲液,phusion聚合酶都无法读取整个ltt1的lna寡核苷酸部分。图5小图d显示在7种测试条件下检测到的ltt1拷贝数的定量。仅在使用taq聚合酶和添加剂的反应中可以看到ltt1模板分子的有效第一链复制。我们得出的结论是,这些经过测试的pcr添加剂(peg和1,2-丙烷二醇)的存在可以使某些dna聚合酶读取整个lna寡核苷酸。
[0753]
实施例6:lna寡核苷酸的ngs测序
[0754]
为了说明可以对具有完整硫代磷酸酯主链的lna寡核苷酸进行测序,我们使用以下方法对5个lna寡核苷酸的混合物进行测序。在第一链合成期间使用添加或不添加peg的常规taq dna聚合酶和vulcano2g聚合酶(mypols)进行测序。
[0755]
将以下lna寡核苷酸以1:1的比例混合,并稀释至最终浓度为1um:
[0756]
lna混合物:
[0757][0758][0759]
捕获探针:
[0760][0761]
捕获探针rt引物:ctatcacgcgacatgcgg(seq id no 16)
[0762]
第一连接反应:
[0763]
将2ul lna混合物与2ul捕获探针索引1(10um)混合
[0764]
将2ul lna混合物与2ul捕获探针索引2(10um)混合
[0765]
将2ul lna混合物与2ul捕获探针索引3(10um)混合
[0766]
将2ul lna混合物与2ul捕获探针索引4(10um)混合
[0767]
然后将混合物加热至55℃,然后冷却至4℃。
[0768]
向每个试管中加入16ul连接混合物:
[0769]
每20ul反应:(2ul t4连接缓冲液、6ul peg、6ul h2o、2ul t4连接酶)
[0770]
凝胶电泳:
[0771]
向上述每个反应中,加入等体积的2倍tbe-尿素样本缓冲液(thermo fisher scientific),并将样本在95℃加热变性2min,然后置于冰上。将如此制备的15μl样本上样至15%,15孔tbe-尿素凝胶(thermo fisher scientific),并在180v恒定
电压下电泳75min。使用sybr金核酸凝胶染料对dna染色(thermo scientific)10min。凝胶通过chemidoc触摸成像系统(bio rad)在蓝色托盘上可视化(参见图6a)。
[0772]
从凝胶上切下含有捕获探针和寡核苷酸之间的连接产物的条带。裂解区域在图6a中以红色框表示。将凝胶碎片压碎并在500ul te缓冲液中浸泡一整夜,以提取连接的寡核苷酸。浸泡后,使用amicon ultra 0.5ml离心式mwco 3kda过滤器将连接的寡核苷酸洗涤并浓缩。最后,使用speedvac将样本浓缩至约10ul。
[0773]
第一链合成与纯化:
[0774]
使用4种不同的方案产生连接的lna寡核苷酸的第一链拷贝。
[0775][0776]
使用以下程序在热循环仪上执行第一链合成:
[0777]
95℃;3min;10次(55℃;5min,72℃;1min);然后保持在4℃
[0778]
使用制造商的寡核苷酸清理方案,使用pcr和dna清理试剂盒(new england biolabs)纯化第一链合成反应。将样本在10ul洗脱缓冲液中洗脱。
[0779]
第二连接反应:
[0780][0781]
将8ul第一链合成反应与2ul捕获探针2(1um)混合
[0782]
然后将混合物加热至55℃,然后冷却至4℃。
[0783]
向每个试管中加入16ul连接混合物:
[0784]
每20ul反应:(2ul t4连接缓冲液、6ul peg、6ul h2o、2ul t4连接酶)。连接:2次(4℃;2min,16℃;2小时,22℃5min)75℃;10min,然后保持在4℃。
[0785]
ngs文库的pcr扩增:
[0786][0787]
连接的第一链合成的pcr扩增使用phusion dna聚合酶执行,使用ngs_pcr_引物1和2。这些引物包含5'突出端,与illumina的truseq ngs方案兼容。
[0788]
4ul:5倍hf缓冲液0.4ul:dntp(10um)1ul:ngs_pcr_引物1(10um)1ul:ngs_pcr_引物2(10um)0.2ul:phusion dna聚合酶11.4ul:h2o2ul:来自第二连接反应的样本
[0789]
pcr循环:98℃;30s,15次(98℃;15s,60℃;20s,72℃;20s),72℃下5min然后保持在4℃
[0790]
根据制造商的说明,在qiaquick pcr纯化试剂盒(qiagen)上纯化pcr产物,并在30ul h2o中洗脱。
[0791]
ngs设置:
[0792]
将4个反应归一化至相同浓度,并合并在一起以创建10nm ngs文库。将phix对照混合物加标到该样本中,使最终浓度达到总分子的20%,以便为随后的illumina测序提供序列变异。ngs库是根据illumina用于miniseq系统的变性和稀释文库指南制备的。使用mid输出盒在illumina miniseq系统上对文库测序。设置测序以生成仅使用读长1并在没有索引的情况下执行151个循环的fastq文件。
[0793]
ngs数据分析:
[0794]
将生成的fastq文件导入到clc genomics workbench 10软件(qiagen)中。根据不同捕获探针1中置入的条形码将读长分离,并从读长的5'端修剪掉来自捕获探针1的其余读长。随后,将源自捕获探针2的序列从3'端修剪掉,仅留下插入在捕获探针1和2之间的序列。然后使用awk命令行修剪掉所有小于18的读长,最后通过去除测序读长的3端的碱基,将所有大于18bp或32bp的读长修剪成18或32bp。对独特读长的数量进行定量,前10个最频繁的读长显示于图6小图b。在图6中,对读长进行反向补充,以5'->3'的方式读取原始lna寡核苷酸。
[0795]
实施例7:
[0796]
实施例1:作为质量控制(qc)的lna的ngs测序
[0797]
我们在本文中说明,完全磷酸化的lna寡核苷酸的测序有可能用于qc。
[0798]
以下lna寡核苷酸用于测序。
[0799]
lna混合物:
[0800]
寡核苷酸1:ctacctgagtggcatcct(seq id no 7)寡核苷酸2:cagcttttaaccagagtg(seq id no 21)
寡核苷酸3:cagaaaatacctacctga(seq id no 9)寡核苷酸4:gcttttaaccagagtggc(seq id no 10)
[0801]
捕获探针:
[0802][0803][0804]
捕获探针1rt引物:ctatcacgcgacatgcgg(seq id no 16)
[0805]
第一连接反应:
[0806]
将2ul寡核苷酸1与2ul捕获探针1索引3(10um)混合
[0807]
将2ul寡核苷酸2与2ul捕获探针1索引2(10um)混合
[0808]
将2ul寡核苷酸3与2ul捕获探针1索引4(10um)混合
[0809]
将2ul寡核苷酸4与2ul捕获探针1索引1(10um)混合
[0810]
然后将混合物加热至55℃,然后冷却至4℃。
[0811]
向每个试管中加入16ul连接混合物:
[0812]
每20ul反应:(2ul t4连接缓冲液、6ul peg、6ul h2o、2ul t4连接酶)。连接:2x(4℃;2min,16℃;20min,22℃5min,30℃1min)75℃;10min,然后保持在4℃。
[0813]
凝胶电泳:
[0814]
向上述每个反应中,加入等体积的2倍tbe-尿素样本缓冲液(thermo fisher scientific),并将样本在95℃加热变性2min,然后置于冰上。将制备的15μl样本上样至15%,15孔tbe-尿素凝胶(thermo fisher scientific),并在180v恒定电压下电泳75min。使用sybr金核酸凝胶染料对dna染色(thermo scientific)10min。凝胶通过chemidoc触摸成像系统(bio rad)在蓝色托盘上可视化(参见图8a)。
[0815]
从凝胶上切下含有捕获探针和寡核苷酸之间的连接产物的条带。裂解区域在图1a中以白色框表示。将凝胶碎片压碎并在500ul te缓冲液中浸泡一整夜,以提取连接的寡核苷酸。浸泡后,使用amicon ultra 0.5 ml离心式mwco 3 kda过滤器将连接的寡核苷酸洗涤并浓缩。最后,使用speedvac将样本浓缩至约10 ul。
[0816]
第一链合成与纯化:
[0817]
使用vulcano2g dna聚合酶在20 ul反应中进行第一链合成:
[0818]
4 ul:5倍vulcano2g缓冲液
[0819]
0.4 ul:vulcano2g聚合酶
[0820]
0.5 ul:dntp(10um)
[0821]
0.4 ul:捕获rt引物(10um)
[0822]
4 ul:连接模板
[0823]
h20 ad 20ul
[0824]
在热循环仪上使用以下程序:
[0825]
95℃;3min10次(55℃;5 min,72℃;1 min)然后保持在4℃
[0826]
使用制造商的寡核苷酸清理方案,使用pcr和dna清理试剂盒(new england biolabs)纯化第一链合成反应。将样本在10 ul洗脱缓冲液中洗脱。
[0827]
第二连接反应:
[0828][0829]
将8ul第一链合成反应与2 ul捕获探针2(1 um)混合
[0830]
然后将混合物加热至55℃,然后冷却至4℃。
[0831]
向每个试管中加入16 ul连接混合物:
[0832]
每20 ul反应:(2 ul t4连接缓冲液、6 ul peg、6ul h2o、2 ul t4连接酶)。连接:2次(4℃;2 min,16℃;2小时,22℃5 min)75℃;10min,然后保持在4℃。
[0833]
ngs文库的pcr扩增:
[0834][0835]
连接的第一链合成的pcr扩增使用phusion dna聚合酶执行,使用ngs_pcr_引物1和2。这些引物包含5'突出端,与illumina的truseq ngs方案兼容。
[0836]
4ul:5倍hf缓冲液0.4ul:dntp(10um)1ul:ngs_pcr_引物1(10um)1ul:ngs_pcr_引物2(10um)0.2ul:phusion dna聚合酶11.4ul:h2o2ul:来自第二连接反应的样本
[0837]
pcr循环:98℃;30s,15次(98℃;15s,60℃;20s,72℃;20s),72℃下5min然后保持在4℃
[0838]
根据制造商的说明,在qiaquick pcr纯化试剂盒(qiagen)上纯化pcr产物,并在30ul h2o中洗脱。
[0839]
ngs设置:
[0840]
将4个反应归一化至相同浓度,并合并在一起以创建10nm ngs文库。将phix对照混合物加标到该样本中,使最终浓度达到总分子的20%,以便为随后的illumina测序提供序列变异。ngs库是根据illumina用于miniseq系统的变性和稀释文库指南制备的。使用mid输出盒在illumina miniseq系统上对文库测序。设置测序以生成仅使用读长1并在没有索引的情况下执行151个循环的fastq文件。
[0841]
ngs数据分析:
[0842]
将生成的fastq文件导入到clc genomics workbench 10软件(qiagen)中。根据四个捕获探针1'中置入的条形码将读长分离,并从读长的5'端修剪掉来自捕获探针1的其余读长。随后,将源自捕获探针2的序列从3'端修剪掉,仅留下插入在捕获探针1和2之间的序列。然后使用awk命令行修剪掉所有小于18的读长,最后通过去除测序读长的3端的碱基,将所有大于18bp的读长修剪成18bp。对独特读长的数量进行定量,前10个最频繁的读长显示于图8小图b-e。在图8中,对读长进行反向补充,以5'->3'的方式读取原始lna寡核苷酸。
[0843]
实施例8:用于qc的galnac-lna的ngs测序
[0844]
我们在本文中说明,在5'端与galnac缀合的完全磷酸化的lna寡核苷酸的测序有可能用于qc。
[0845]
以下lna寡核苷酸用于测序。
[0846]
lna混合物:
[0847][0848]
捕获探针:
[0849][0850]
捕获探针1rt引物:ctatcacgcgacatgcgg(seq id no 16)
[0851]
第一连接反应:
[0852]
将2ul寡核苷酸1与2ul捕获探针1索引3(10um)混合
[0853]
然后将混合物加热至55℃,然后冷却至4℃。
[0854]
向试管中加入16ul连接混合物:
[0855]
每20ul反应:(2ul t4连接缓冲液、6ul peg、6ul h2o、2ul t4连接酶)。连接:2x(4℃;2min,16℃;20min,22℃5min,30℃1min)75℃;10min,然后保持在4℃。
[0856]
凝胶电泳:
[0857]
向上述反应中,加入等体积的2倍tbe-尿素样本缓冲液(thermo fisher scientific),并将样本在95℃加热变性2min,然后置于冰上。将制备的15μl样本上样至15%,15孔tbe-尿素凝胶(thermo fisher scientific),并在180v恒定电压下电泳75min。使用sybr金核酸凝胶染料对dna染色(thermo scientific)10min。凝胶通过chemidoc触摸成像系统(bio rad)在蓝色托盘上可视化
[0858]
从凝胶上切下含有捕获探针和寡核苷酸之间的连接产物的条带。将凝胶碎片压碎并在500ul te缓冲液中浸泡一整夜,以提取连接的寡核苷酸。浸泡后,使用amicon ultra 0.5ml离心式mwco 3kda过滤器将连接的寡核苷酸洗涤并浓缩。最后,使用speedvac将样本浓缩至约10ul。
[0859]
第一链合成与纯化:
[0860]
使用vulcano2g dna聚合酶在20ul反应中进行第一链合成:
[0861]
4ul:5倍vulcano2g缓冲液
[0862]
0.4ul:vulcano2g聚合酶
[0863]
0.5ul:dntp(10um)
[0864]
0.4ul:捕获rt引物(10um)
[0865]
4ul:连接模板
[0866]
h20 ad 20ul
[0867]
在热循环仪上使用以下程序:
[0868]
95℃;3min;10次(55℃;5min,72℃;1min);然后保持在4℃
[0869]
使用制造商的寡核苷酸清理方案,使用pcr和dna清理试剂盒(new england biolabs)纯化第一链合成反应。将样本在10ul洗脱缓冲液中洗脱。
[0870]
第二连接反应:
[0871][0872]
将8ul第一链合成反应与2ul捕获探针2(1um)混合
[0873]
然后将混合物加热至55℃,然后冷却至4℃。
[0874]
向每个试管中加入16ul连接混合物:
[0875]
每20ul反应:(2ul t4连接缓冲液、6ul peg、6ul h2o、2ul t4连接酶)。连接:2次(4℃;2min,16℃;2小时,22℃5min)75℃;10min,然后保持在4℃。
[0876]
ngs文库的pcr扩增:
[0877][0878]
连接的第一链合成的pcr扩增使用phusion dna聚合酶执行,使用ngs_pcr_引物1和2。这些引物包含5'突出端,与illumina的truseq ngs方案兼容。
[0879]
[0880][0881]
pcr循环:98℃;30s,15次(98℃;15s,60℃;20s,72℃;20s),72℃下5min然后保持在4℃
[0882]
根据制造商的说明,在qiaquick pcr纯化试剂盒(qiagen)上纯化pcr产物,并在30ul h2o中洗脱。
[0883]
ngs设置:
[0884]
将反应归一化为10nm,并与另一个包含不同条形码系统的ngs文库合并,以创建10nm ngs文库。该单一反应约占总ngs文库的10%。ngs库是根据illumina用于miniseq系统的变性和稀释文库指南制备的。使用mid输出盒在illumina miniseq系统上对文库测序。设置测序以生成仅使用读长1并在没有索引的情况下执行151个循环的fastq文件。
[0885]
ngs数据分析:
[0886]
将生成的fastq文件导入到clc genomics workbench 10软件(qiagen)中。分离源自捕获探针1索引1的读长,并从读长的5'末端修剪掉来自捕获探针1的其余读长。随后,将源自捕获探针2的序列从3'端修剪掉,仅留下插入在捕获探针1和2之间的序列。然后使用awk命令行修剪掉所有小于15的读长,最后通过去除测序读长的3端的碱基,将所有大于15bp的读长修剪成15bp。对独特读长的数量进行定量,前5个最频繁的读长显示于图9。在图9中,对读长进行反向补充,以5'->3'方式读取原始lna寡核苷酸。
[0887]
实施例9:比较superscript iii逆转录酶与vulcano2g ltt1第一链合成
[0888]
crouzier等人描述了superscript iii逆转录酶(rt)(thermos scientific)具有在逆转录rna链时通读lna核苷酸(lna-t和lna-a)的能力。作者表明,superscript iii rt在读取rna模板时可以掺入非连续的lna-t和lna-a。作者还表明,superscript iii rt仅使用常规的dntp即可逆转录包含2个lna a和2个lna t(不连续)的rna模板(crouzier等人,2012年,图3小图c泳道2)。
[0889]
由于已证明superscript iii rt能够逆转录rna磷酸二酯链接链中包含非连续lna的链(crouzier等人,2012),因此我们想了解它是否还能够在同样含有硫代磷酸酯主链的dna链中读取整个连续lna。因此,我们执行ltt1模板的第一链合成,然后使用evagreen ddpcr进行第一链检测,如实施例2中所述。我们比较了superscript iii rt创建ltt1拷贝的能力与vulcano2g聚合酶的能力。第一链superscript iii rt反应的反应条件与crouzier等人2012中所述的相同。
[0890]
10ul第一链合成反应:
[0891]
所有反应包含1ul ltt1(31pm)、0.5ul dcp1_引物1(1um)和水(添加至10ul)。使用供应商提供的缓冲液运行酶。
[0892]
a)2ul 5倍第一链缓冲液、1ul mgcl2(50mm)、0.75ul dtt(100mm)、0.75ul dntp(10mm)
[0893]
b)2ul 5倍第一链缓冲液、1ul mgcl2(50mm)、0.75ul dtt(100mm)、0.75ul dntp(10mm)、0.5superscript iii rt酶
[0894]
c)2ul 5倍vulcano2g缓冲液、1ul dntp(10mm)
[0895]
d)2ul 5倍vulcano2g缓冲液、1ul dntp(10mm)、0.2ul vulcano2g
[0896]
加入除了酶之外的所有组分,将混合物加热至65℃持续5min,然后置于冰上1min,然后最终加入rt酶。在4个条件下完成第一链合成。
[0897]
a)45min 50℃,5min 80℃,保持4℃
[0898]
b)5min 50℃,保持4℃
[0899]
c)3次循环(5min 50℃,30sec 98℃)然后保持4℃
[0900]
d)5次循环(5min 50℃,30sec 98℃)然后保持4℃
[0901]
由于vulcano2g酶是热稳定的,因此添加了条件c和d中的循环条件,所以可使用此酶进行多轮第一链合成以提高敏感性,这不同于因使双链变性所需的温度更高而失活的superscript iii rt。
[0902]
将所有第一链反应用水稀释100倍,并将2ul样本用作常规qx200
tm ddpcr
tm evagreen supermix pcr反应的输入,如实施例2所述。
[0903]
结果:
[0904]
图10小图a显示在1次45min第一链合成反应中执行的evagreen ddpcr反应中微滴的荧光强度。我们没有看到superscript iii rt能够产生ltt1的第一链拷贝的迹象,因为在没有酶的反应中也看到了相同数量的阳性微滴。检测到的拷贝的定量显示在图10小图b中,显示vulcano2g产生ltt1模板的第一链拷贝的能力远为优越。图10小图c显示用1、3或5轮第一链合成进行的evagreen ddpcr反应中微滴的荧光强度。检测到的拷贝的定量显示在图10小图d中,显示由于vulcano2g的热稳定性,它可以执行数轮第一链合成反应,可用于增加对含有lna的分子的检测。同样地,我们没有看到superscript iii rt可以逆转录ltt1模板的迹象。
[0905]
参考:
[0906]
crouzier等人(2012)efficient reverse transcription using locked nucleic acid nucleotides towards the evolution of nuclease resistant rna aptamers.plos one 2012年4月,第7卷,第4期,e35990
[0907]
实施例10:体内缀合物发现
[0908]
数据显示了原则性的证明,即可以使用测序研究与包含dna/ps寡核苷酸的条形码缀合的各种化学部分的文库以了解其在单个动物中的肝脏富集。数据显示了原则性的证明,即与裸寡核苷酸(seq id 35)相比,皮下注射后4h,galnac缀合的寡核苷酸(seq id 22)在肝脏中富集。数据还确定,与裸寡核苷酸seq id 37相比,皮下注射4h后seq id 26在肝脏中富集。将每种寡核苷酸的5μm溶液(下表)以每只小鼠0.25ml的剂量皮下注射到c57bl/6j小鼠(n=3)体内,注射后4h收获肝脏。
[0909]
表.具有缀合的条形码寡核苷酸文库。用于识别的条形码以粗体显示。
[0910]
缀合以化学结构或文字形式显示。在化学结构中,波浪线表示与寡核苷酸的共价键,通过接头,例如c6烷基接头基团以适合5'末端。
[0911]
表13
[0912][0913]
[0914]
[0915][0916]
体内注射后4h,使用tissue lyzer(qiagen)在含有0.1m cacl2、0.1m tris ph 8.0和1%np-40的400μl缓冲液中匀浆肝组织样本(100mg)。平行地,将10μl含有5μm每个寡核苷酸的溶液加标入如上所述匀浆的离体肝脏样本(100mg,n=3)中。加入25μl蛋白酶k(sigma)后,将样本在50℃孵育过夜。然后加入1μl rnaseif(new england biolabs)和1μl dnase i(qiagen),将样本在37℃孵育1h,通过在99℃孵育15min来灭活核酸酶。将样本以10000g离心10分钟,然后使用amicon ultra 0.5ml离心式mwco 3kda过滤器将上清液洗涤三次,洗涤通过在每个洗涤步骤中添加约400μl蒸馏水来执行。在第一连接反应中使用2μl剩余的上清液(约50μl),其中包含1μl捕获探针1(10μm)、2μl t4连接酶缓冲液、6μl peg、1μl t4连接酶(thermofisher scientific)和8μl蒸馏水。将每个样本与是特异的索引序列的特异性捕获探针连接,以便以后鉴定来自每个单独样本的序列(参见下表)。
[0917]
表14.捕获探针1的文库。识别索引以粗体显示
[0918]
[0919][0920]
在16℃孵育1h并在75℃灭活15min后,向该第一连接产物反应中加入等体积的2倍tbe-尿素样本缓冲液(thermo fisher scientific),并将样本在95℃加热变性2min,然后置于冰上。将制备的15μl样本上样至15%,15孔tbe-尿素凝胶(thermo fisher scientific),并在180v恒定电压下电泳75min。使用sybr金核酸凝胶染料对dna染色(thermo scientific)10min。凝胶通过chemidoc触摸成像系统(bio rad)在蓝色托盘上可视化。从凝胶上切下含有与寡核苷酸连接的捕获探针的连接产物的条带。然后将凝胶碎片压碎并浸泡在500μl蒸馏水中,并在4℃下放置过夜以提取连接的寡核苷酸。然后,通过在每个洗涤步骤中使用amicon ultra 0.5ml离心式mwco 3kda过滤器添加约400μl蒸馏水,将所提取的连接寡核苷酸洗涤3次。在最终洗涤之后,浓缩的寡核苷酸被随后用于第一链合成反应中。第一链合成使用4μl匀浆的连接凝胶输入、4μl 5倍volcano2g缓冲液(mypols)、0.4μl第一链引物1μm、0.5μl 10mm dntp、0.4μl volcano2g聚合酶(mypols)和10.7μl蒸馏水执行。pcr条件为95℃持续3min,然后进行15次循环,内容是95℃持续30s,55℃持续5min和72℃持续1min。
[0921][0922]
根据制造商的说明,使用monarch pcr和dna清理试剂盒(new england biolabs)纯化第一链pcr产物,并在10μl洗脱缓冲液中洗脱。然后将8μl洗脱的第一链产物与2μl捕获探针2(100nm)连接,并加热至60℃持续5min,接着缓慢(0.1℃/s)降至4℃。然后加入10μl,包括2μl t4连接酶缓冲液、6μl peg、1μl t4连接酶(thermofisher scientific)和1μl蒸馏水。
[0923][0924]
在16℃孵育1h并在75℃灭活15min后,将2μl的连接反应物应用于含有4μl 5倍hf缓冲液(new england biolabs)、0.4μl 10mm dntp、1μl 10μm正向测序引物(pe1)和1μl 10μm反向测序引物(pe2v2)、0.2μl phusion dna聚合酶(new england biolabs)和11.4μl蒸馏水的pcr反应。pcr条件为98℃持续30s,然后进行20个循环,内容是98℃持续15s、60℃持续20s和72℃持续20s,最后是72℃持续5min。按照制造商的说明,使用qiaquick pcr纯化试剂盒(qiagen)纯化pcr产物,并在30μl蒸馏水中洗脱。
[0925]
[0926][0927]
根据来自illumina miniseq system(illumina)的方案对pcr产物进行测序。通过使用clc genomics workbench软件,识别不同条形码的11.0.1(qiagen)读长数量,并计算条形码的相对丰度。最后,计算体内肝脏相对丰度与离体加标肝脏样本相对丰度的比率。
[0928]
表15.4h肝脏样本读长数量,以及每个样本的相对丰度(n=3)。
[0929][0930]
图11示出皮下注射后4h相对于未缀合的寡核苷酸(seq id 35)的肝脏富集倍数。与未缀合的寡核苷酸(seq id 35)相比,galnac缀合的寡核苷酸(seq id 22)以及seq id 26显示出3.5倍的肝脏富集。
[0931]
实施例11
[0932]
数据显示了原则性的证明,即可以使用测序研究与包含dna/ps寡核苷酸的条形码缀合的各种化学部分的文库以了解其在单个动物中的血浆滞留率。数据显示了原则性的证明,即皮下注射后4h,与寡核苷酸缀合的白蛋白结合c16棕榈酸酯在血浆中富集。数据还确定与裸寡核苷酸相比,galnac缀合的寡核苷酸从循环中去除。
[0933]
将每种寡核苷酸在pbs中的5μm溶液(参见下表)以每只小鼠0.25ml的剂量皮下注射到c57bl/6j小鼠8(n=3)体内,注射后4h取血浆样本。
[0934]
表.具有缀合的条形码寡核苷酸文库。用于识别的条形码以粗体显示。
[0935]
所用化合物在上表13中显示为缀合物,并进一步包括化合物seq id no 46:
[0936][0937]
注射后4h,使用tissue lyzer(qiagen)在240μl ripa缓冲液(qiagen)中匀浆10μl血浆样本。平行地,将10μl含有5μm每种寡核苷酸的溶液加标到10μl离体血浆样本中,然后如上所述在240μl ripa缓冲液中匀浆样本。然后在第一连接反应中使用2μl均质血浆ripa溶液,其中包含1μl捕获探针1(1nm)、2μl t4连接酶缓冲液、6μl peg、1μl t4连接酶
(thermofisher scientific)和8μl蒸馏水。将每个样本与是特异的索引序列的特异性捕获探针1连接,以便以后鉴定每个单独样本。
[0938]
表16:捕获探针1的文库。识别索引以粗体显示
[0939][0940][0941]
在16℃孵育1h并在75℃灭活15min后,将2μl的连接反应物用于第一链合成,其中包含2μl的连接反应物、4μl 5倍volcano缓冲液(mypols),0.4μl第一链引物1μm、0.5μl 10mm dntp、0.4μl volcano pg(mypols)和12.7μl蒸馏水。pcr条件为95℃持续3min,然后进行15次循环,内容是95℃持续30s,55℃持续30min和72℃持续1min。
[0942][0943]
收集所有第一链pcr产物,并按照制造商的说明使用monarch pcr和dna清理试剂盒(new england biolabs)纯化50μl合并的第一链pcr产物,并在10μl洗脱缓冲液中洗脱。然后将8μl洗脱的第一链产物与2μl捕获探针2(100nm)连接,并加热至60℃持续5min,接着缓慢(0.1℃/s)降至4℃。然后加入10μl,包括2μl t4连接酶缓冲液、6μl peg、1μl t4连接酶(thermofisher scientific)和1μl蒸馏水。
[0944][0945]
在16℃孵育1h并在75℃灭活15min后,将2μl的连接反应物添加至含有4μl 5倍hf缓冲液、0.4μl 10mm dntp、1μl 10μm正向测序引物(pe1)、1μl 10μm反向测序引物(pe2v2)、0.2μl phusion dna聚合酶(new england biolabs)和11.4μl蒸馏水中进行pcr反应。pcr条件为98℃持续30s,然后进行20次循环,内容是98℃持续15s,60℃持续20s和72℃持续20s,最后72℃持续5min。
[0946][0947][0948]
根据制造商的说明,使用qiaquick pcr纯化试剂盒(qiagen)纯化pcr产物,并在30μl蒸馏水中洗脱。根据来自illumina miniseq system(illumina)的方案对pcr产物进行测序。通过使用clc genomics workbench软件,识别不同条形码的11.0.1读长数量,并计算条形码的相对数量。最后,计算体内血浆相对丰度与离体加标血浆样本的比率。
[0949]
表17. 4h血浆样本读长数量,以及每个样本的相对丰度(n=3)。
[0950][0951][0952]
表18. 4h血浆样本读长的相对丰度(平均值和标准差)以及体内与加标血浆的比率。
[0953][0954][0955]
图12示出皮下注射后4h相对于未缀合的寡核苷酸化合物seq id 35的血浆富集。与裸寡核苷酸seq id 35相比,具有c16脂肪酸缀合的寡核苷酸(seq id 46)显示出12.5倍的血浆丰度。galnac缀合的寡核苷酸(seq id 22)显示从血浆耗减。
[0956]
实施例12
[0957]
数据显示了原则性的证明,即可以使用测序研究与包含含有lna/dna/ps寡核苷酸的条形码缀合的各种化学部分的文库以了解单个动物中多个组织中的组织递送特性。数据还表明,静脉注射3天后,胆固醇缀合的(seq id 49和50)和生育酚缀合的寡核苷酸(seq id 60和61)在肝脏中富集并且在肾脏中减少。数据还表明胆汁胺缀合的(seq id 51和52)增加了胰腺中寡核苷酸的含量。
[0958]
将15个条形码寡核苷酸组成的文库(下表)以10mg/kg的剂量(所有寡核苷酸)静脉注射到c57bl/6j小鼠(n=2)体内。3天后收集并分析以下器官:脂肪组织、皮层、眼球、股骨、心脏、髂骨、肾脏、肝脏、肺脏、淋巴结、胰腺、血清、脊髓、脾脏和胃。
[0959]
表19.具有缀合的条形码寡核苷酸文库。用于识别的条形码以粗体显示。
[0960]
缀合以文字形式显示。lna核苷酸显示为大写字母。
[0961][0962][0963]
注射后3天,使用tissue lyzer(qiagen)在ripa缓冲液(pierce)中匀浆组织样本。根据其重量以10mg组织/450μl ripa缓冲液的比例将组织在一定体积的ripa缓冲液中匀浆。然后将匀浆的肝脏、肾脏和肺脏组织在蒸馏水中稀释100倍,而其他组织在蒸馏水中稀释10倍。通过将样本在75℃孵育40min,然后在4℃孵育15min来完成dnase灭活。平行地,两个用于参比标准化的样本由10μl的溶液组成,该溶液包含5μm(每种)寡核苷酸文库和490μl ripa缓冲液(每种寡核苷酸最终100nm)。
[0964]
在第一连接反应中使用4μl ripa溶液,其中包含2μl捕获探针1(1nm)、2μl t4连接酶缓冲液、6μl peg、0.25μl t4连接酶(thermofisher scientific)和5.75μl蒸馏水。将每个组织样本与具有特定索引序列的特定捕获探针1连接,以便以后鉴定每个单独样本,参见下表。
[0965]
表20 32个捕获探针1的文库。识别索引以粗体显示
[0966]
[0967]
[0968]
[0969][0970]
在16℃孵育1h并在75℃灭活15min后,将2μl的连接反应物在反应中用于第一链合成,该反应包含2μl的连接反应物、4μl 5倍volcano缓冲液(mypols),0.5μl第一链引物100nm、0.5μl 10mm dntp、0.4μl volcano pg(mypols)和12.6μl蒸馏水。pcr条件为95℃持续2min,然后进行15次循环,依次是95℃持续30s和60℃持续30min,最后72℃持续5min。
[0971][0972]
收集所有第一链pcr产物,并按照制造商的说明使用monarch pcr和dna清理试剂盒(new england biolabs)纯化50μl合并的第一链pcr产物,并在10μl洗脱缓冲液中洗脱。然后将4μl洗脱的第一链产物与4μl捕获探针2(100nm)混合,并加热至60℃持续5min,接着缓慢(0.1℃/s)降至4℃。然后加入12μl,包括2μl t4连接酶缓冲液、6μl peg、0.5μl t4连接酶(thermofisher scientific)和3.5μl蒸馏水。
[0973][0974]
在4℃孵育1h并在75℃灭活15min后,将2μl的连接反应物应用于含有4μl 5倍hf缓
冲液、0.4μl 10mm dntp、1μl 10μm正向测序引物(pe1)和1μl 10μm反向测序引物(pe2v3)、0.2μl phusion dna聚合酶(new england biolabs)和11.4μl蒸馏水的pcr反应。pcr条件为98℃持续30s,然后进行20次循环,内容是98℃持续15s,60℃持续20s和72℃持续20s,最后72℃持续5min。
[0975][0976]
根据制造商的说明,使用qiaquick pcr纯化试剂盒(qiagen)纯化pcr产物,并在30μl蒸馏水中洗脱。根据来自illumina miniseq system(illumina)的方案对pcr产物进行测序。通过使用软件clc genomics workbench,11.0.1。确定不同条形码的读长数量,并计算每个捕获索引(每个组织样本)的条形码的相对数量。将每个条形码的相对数量归一化(%)为索引参考文库1中来自试管反应的条形码的相对数量。
[0977]
表21.两只c57bl/6j小鼠静脉注射后3天的组织样本读长数量。
[0978]
[0979][0980]
[0981][0982]
[0983]
[0984][0985]
表22.每个组织样本中条形码寡核苷酸的读长的相对丰度,相对于参考文库1的读长的相对丰度进行归一化(%)。读长的相对丰度显示,与裸寡核苷酸seq id 55、56和57以及其他缀合相比,生育酚缀合(化合物seq id 58和seq id 59)和胆固醇缀合(seq id 47和seq id 48)具有增加的肝脏分布和减少的肾脏分布。胆汁胺缀合(seq id 49和seq id 50)显示胰腺中含量增加。
[0986][0987]
[0988]
[0989]
[0990][0991]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1