用于调节RTEL1表达的寡核苷酸的制作方法
本发明涉及rtel1抑制剂,例如与rtel1互补的寡核苷酸(寡聚物),其可导致对rtel1表达的调节或对rtel1活性的调节。本发明特别地涉及rtel1靶核酸分子用于在乙型肝炎病毒(hbv)感染,特别是慢性hbv感染的治疗和/或预防中的用途。本发明特别地涉及用rtel1抑制剂使cccdna,例如hbvcccdna不稳定。本发明还包括一种药物组合物及其在hbv感染的治疗和/或预防中的用途。
背景技术:
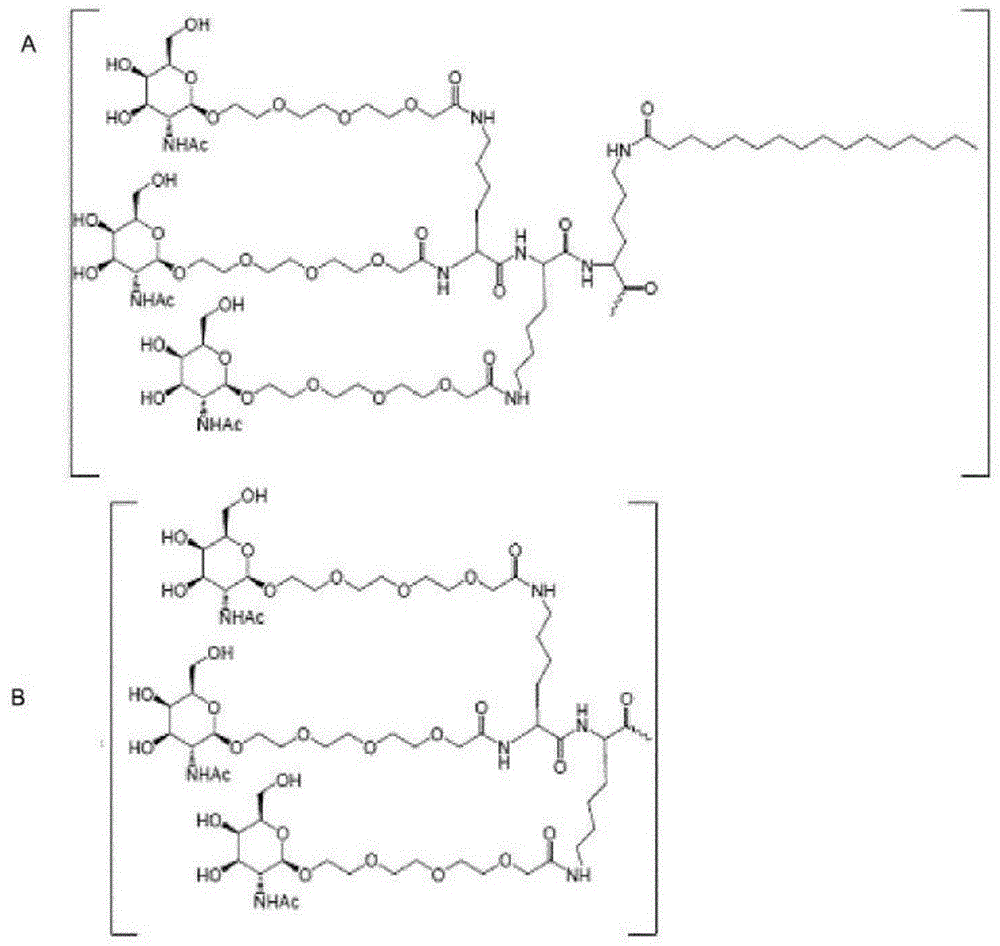
:乙型肝炎是一种由乙型肝炎病毒(hbv)引起的传染病,乙型肝炎病毒是一种小型的嗜肝病毒,其可通过逆转录复制。慢性hbv感染是导致严重肝病(例如肝硬化和肝细胞癌)的关键因素。目前对慢性hbv感染的治疗是基于施用聚乙二醇化的1型干扰素或核苷(核苷酸)类似物的,例如拉米夫定、阿德福韦、恩替卡韦、替诺福韦二吡呋酯和替诺福韦艾拉酚胺,它们可靶向病毒聚合酶(一种多功能逆转录酶)。治疗是否成功通常以乙型肝炎表面抗原(hbsag)的损失量来衡量。然而,由于感染后乙型肝炎病毒dna仍然存在于体内,因此很难完全清除hbsag。hbv持续性是由附加体形式的hbv基因组介导的,该基因组稳定地存在于细胞核中。这种附加体形式被称为“共价闭合环状dna”(cccdna)。cccdna可作为所有hbv转录本的模板,包括前基因组rna(pgrna,一种病毒复制中间体)。少量cccdna拷贝的存在可能足以再次引发全面的hbv感染。目前对hbv的治疗并不针对cccdna。然而,治愈慢性hbv感染需要清除cccdna(由nassal综述,gut.2015dec;64(12):1972-84.doi:10.1136/gutjnl-2015-309809)。调控端粒延伸解旋酶1(rtel1)编码一种dna解旋酶,该dna解旋酶在端粒的稳定性、保护和延伸中发挥作用,并与已知在dna复制过程中保护端粒的保卫蛋白复合物(shelterin)中的蛋白质相互作用。该基因的突变与先天性角化不全和霍耶尔-赫里达斯(hoyerall-hreidarsson)综合征有关(参见例如vannier等人的综述,2014trendscellbiol.vol24p.416)。rtel1位于细胞核中,作为一种atp依赖性dna解旋酶,参与端粒长度调节、dna修复和基因组稳定性维持。rtel1用作一种抗重组酶,可抵抗毒性重组并限制减数分裂过程中的交叉,以及通过物理解离链侵入事件来调节减数分裂重组和交叉稳态,从而通过减数分裂合成依赖性链退火(sdsa)和分解d环重组中间体来促进非交叉修复。另外,rtel1可解构t环并通过抵消端粒g4-dna结构来预防端粒脆性,这些共同确保端粒的动态性和稳定性。rtel1已在sirna筛选中被识别为hpv附加体的稳定剂:(edwards等人,2013plosonevol8,e75406)。靶向rtel1的sirna同样已被用于在霍耶尔-赫里达斯综合征中识别与rtel1的相互作用物(schertzer等人,2015nucleicacidresvol43p.1834)。此外,从必需宿主蛋白的sirna筛选中将rtel1识别为hiv宿主依赖性因子,以提供用于抑制hiv感染的靶标(wo2007/094818)。据我们所知,在cccdna的稳定性和维持性方面,从未将rtel1识别为cccdna依赖性因子,也没有有人提出将抑制rtel1的分子用作cccdna去稳定剂用于治疗hbv感染。发明目的本发明表明在hbv感染的细胞中rtel1的抑制与cccdna的减少之间存在相关性,这与hbv感染者的治疗有关。本发明的目的是识别减少hbv感染的细胞中cccdna的rtel1抑制剂。此类rtel1抑制剂可用于治疗hbv感染。本发明进一步识别了新型核酸分子,其能够在体外和体内抑制rtel1的表达。技术实现要素:本发明涉及靶向核酸的寡核苷酸,所述寡核苷酸能够调节rtel1的表达并治疗或预防与rtel1功能有关的疾病。因此,一方面,本发明提供了一种rtel1抑制剂,其用于在乙型肝炎病毒(hbv)感染的治疗和/或预防中的用途。特别地,一种能够减少cccdna和/或前基因组rna(pgrna)的rtel1抑制剂是有用的。这种抑制剂优选地选自长度为12个至60个核苷酸的核酸分子,其能够减少rtel1mrna,例如与哺乳动物rtel1互补的单链反义寡核苷酸,sirna或shrna。另一方面,本发明涉及12-60个核苷酸(例如12-30个核苷酸)的寡核苷酸,其包含与哺乳动物rtel1互补的至少10个核苷酸(特别是16-20个核苷酸)的连续核苷酸序列。此类寡核苷酸能够抑制rtel1的表达。寡核苷酸可以是单链反义寡核苷酸或shrna核酸分子。反义寡核苷酸可具有缺口聚体设计。优选地,反义寡核苷酸能够通过切割靶核酸来抑制rtel1的表达。切割优选地通过核酸酶募集来实现。另一方面,本发明提供了药物组合物,其包含本发明的反义寡核苷酸和药学上的赋形剂。另一方面,本发明提供了用于调节正在表达rtel1的靶细胞中rtel1表达的体内或体外方法,该方法通过向所述细胞施用有效量的本发明的反义寡核苷酸或组合物来实施。另一方面,本发明提供了用于治疗或预防与rtel1的体内活性有关的疾病、病患或功能障碍的方法,该方法包括向患有或易患所述疾病、病症或功能障碍的受试者施用治疗或预防有效量的本发明的反义寡核苷酸。本发明的其他方面是本发明的核酸分子与药物组合物的缀合物,该缀合物包含本发明的分子。特别关注靶向肝脏的缀合物,例如galnac簇。附图说明图1说明了示例性的反义寡核苷酸缀合物,其中寡核苷酸以波浪线(a-d)或“寡核苷酸”(e-h)或t2(i)表示,并且靶向缀合物部分的脱唾液酸糖蛋白受体是三价n-乙酰半乳糖胺部分。化合物a至d包含二赖氨酸支链分子,peg3间隔物和三个末端galnac碳水化合物部分。在化合物a和b中,寡核苷酸直接附接至靶向缀合物部分的脱唾液酸糖蛋白受体,无需接头。在化合物c和d中,寡核苷酸通过c6接头附接于靶向缀合物部分的脱唾液酸糖蛋白受体。化合物e-i包含可商业获得的三倍体支链分子和不同长度和结构的间隔物以及三个末端galnac碳水化合物部分。定义hbv感染术语“乙型肝炎病毒感染”或“hbv感染”在本领域中是公知的,是指由乙型肝炎病毒(hbv)引起并影响肝脏的传染病。hbv感染可以是急性或慢性感染。慢性乙型肝炎病毒(chb)感染是一种全球性疾病难题,影响着全球2.48亿人。每年约有686,000例死亡归因于hbv相关的晚期肝病和肝细胞癌(hcc)(gbd2013;schweitzer等人,2015)。who预测,如果不加大干预措施,未来40至50年内,chb感染者的人数将保持在目前的高水平,2015年至2030年之间累计死亡人数将达到2000万(who2016)。chb感染不是具有单一临床表现的同质性疾病。感染者在其一生中经历了与chb相关的肝病的几个阶段,这些疾病阶段也是采用标准护理(soc)治疗的基础。目前的指南建议根据三个标准(血清alt水平、hbvdna水平和肝病严重程度),仅对选定的chb感染者进行治疗(easl,2017)。该建议归因于soc(即核苷(核苷酸)类似物(nas)和聚乙二醇化干扰素-α(peg-ifn))无法治愈,必须长期施用从而增加其安全风险的事实。nas可以有效抑制hbvdna复制;然而,它们对其他病毒标记物的作用非常有限/没有影响。hbv感染的两个标志,即乙型肝炎表面抗原(hbsag)和共价闭合环状dna(cccdna),是针对治愈hbv的新药的主要目标。在chb个体的血浆中,hbsag亚病毒(空)颗粒数超过hbv病毒粒子103到105倍(ganem&prince,2014);据信,其过量可能导致该疾病的免疫发病机制,包括个体无法产生中和性抗hbs抗体,这是在急性hbv感染消退后观察到的血清学标记物。cccdna(共价闭合环状dna)cccdna是位于感染的肝细胞细胞核中的病毒基因模板,其中它会产生增值性感染所需的所有hbvrna转录本,并在慢性hbv感染的自然过程中对病毒的持续性起主要作用(locarnini&zoulim,2010antivirther.15suppl3:3-14.doi:10.3851/imp1619)。cccdna用作病毒库,是停止治疗后病毒反弹的来源,因此需要长期(通常是终生)治疗。由于各种副作用,因此peg-ifn仅可施用于一小部分chb。因此,大多数chb患者迫切需要新的治疗方法,即通过降解或清除hbvcccdna来实现完全治愈。化合物在本文中,术语“化合物”是指能够抑制rtel1表达或活性的任何分子。本发明的特别化合物是核酸分子,例如根据本发明的rnai分子或反义寡核苷酸或包含这种核酸分子的任何缀合物。例如,本文中化合物可以是靶向rtel1的核酸分子,特别是反义寡核苷酸或sirna。寡核苷酸如本文所用,术语“寡核苷酸”定义为如技术人员通常理解的包含两个或以上共价联接的核苷的分子。这样共价结合的核苷也可以称为核酸分子或寡聚物。说明书和权利要求书中提及的寡核苷酸通常是长度小于70个核苷酸的治疗性寡核苷酸。寡核苷酸可以是或者可以包含单链反义寡核苷酸,或者可以是另一种寡聚核酸分子,例如crisprrna、sirna、shrna、适体或核酶。治疗性寡核苷酸分子通常在实验室中通过固相化学合成然后纯化和分离来制备。然而,shrna通常使用慢病毒载体传递至细胞中,然后从慢病毒载体中转录以产生单链rna,该单链rna将形成茎环(发夹)rna结构,该结构能够与rna干扰机制(包括rna诱导沉默复合物(risc))相互作用。在本发明的实施例中,shrna是通过化学方法产生的shrna分子(不依赖于来自质粒或病毒的基于细胞的表达)。当提及寡核苷酸的序列时,提及的是共价联接的核苷酸或核苷的核碱基部分或其修饰的序列或顺序。通常,本发明的寡核苷酸是人造的,并且是化学合成的,并且通常是纯化或分离的。尽管在一些实施例中,本发明的寡核苷酸是在进入靶细胞时从载体转录的shrna。本发明的寡核苷酸可包含一个或多个修饰的核苷或核苷酸。在一些实施例中,本发明的寡核苷酸包含或由长度为10个至70个核苷酸组成,例如长度为12个至60个、例如13个至50个、例如14个至40个、例如15个至30个、例如12-25个、例如16个至22个、例如16个至20个连续核苷酸。因此,在一些实施例中,本发明的寡核苷酸长度可为12-25个核苷酸。或者,在一些实施例中,本发明的寡核苷酸长度可为15-22个核苷酸。在一些实施例中,寡核苷酸或其连续核苷酸序列包含或由24个或更少的核苷酸组成,例如22个、例如20个或更少、例如18个或更少、例如14个、15个、16个或17个核苷酸。应当理解的是,本文中给出的任何范围均包括范围的端点。因此,如果说核酸分子包含12个至25个核苷酸,则12个和25个核苷酸均包含在内。在一些实施例中,连续核苷酸序列包含或由长度为12个、13个、14个、15个、16个、17个、18个、19个、20个、21个或22个连续核苷酸组成寡核苷酸用于调节哺乳动物中靶核酸的表达。在一些实施例中,核酸分子,例如sirna、shrna和反义寡核苷酸的核酸分子通常用于抑制靶核酸的表达。在本发明的一实施例中,寡核苷酸选自rnai剂,例如sirna或shrna。在另一个实施例中,寡核苷酸是单链反义寡核苷酸,例如与rna酶h相互作用的高亲和力修饰的反义寡核苷酸。在一些实施例中,本发明的寡核苷酸可包含一个或多个修饰的核苷或核苷酸,例如2'糖修饰的核苷。在一些实施例中,寡核苷酸包含硫代磷酸酯核苷间键。在一些实施例中,寡核苷酸可以缀合至非核苷部分(缀合物部分)。寡核苷酸文库应理解为变异寡核苷酸的集合。寡核苷酸文库的目的可以变化。在一些实施例中,寡核苷酸文库由具有重叠核碱基序列的寡核苷酸组成,该序列靶向一个或多个哺乳动物rtel1靶核酸,目的是识别寡核苷酸文库中最有效的序列。在一些实施例中,寡核苷酸文库是亲代或祖代寡核苷酸的寡核苷酸设计变体(子核酸分子)文库,其中寡核苷酸设计变体保留了亲代核酸分子的核心核碱基序列。反义寡核苷酸如本文所用,术语“反义寡核苷酸”定义为能够通过与靶核酸特别是与靶核酸上的邻接序列杂交来调节靶基因表达的寡核苷酸。反义寡核苷酸在本文中基本上不是双链的,因此不是sirna或shrna。优选地,本发明的反义寡核苷酸是单链的。应当理解的是,本发明的单链寡核苷酸可以形成发夹或分子间双链体结构(同一寡核苷酸的两个分子之间的双链体),只要其内部或相互间的自身互补程度小于寡核苷酸全长的50%。优选地,本发明的单链反义寡核苷酸不包含rna核苷,因为这将降低核酸酶抗性。优选地,本发明的寡核苷酸包含一个或多个修饰的核苷或核苷酸,例如2'糖修饰的核苷。此外,优选的是未修饰的核苷是dna核苷。rnai分子在本文中,术语“rna干扰(rnai)分子”是指能够通过细胞质中rna诱导沉默复合物(risc)来诱导rna依赖性基因沉默的基于短双链rna的寡核苷酸,其中它们与催化risc组分ago(argonaute)相互作用。rnai分子调节。例如,抑制靶核酸在细胞中的表达。例如受试者体内的细胞。例如哺乳动物。rnai分子的一种类型是小干扰rna(sirna),它是由两个互补寡核苷酸组成的双链rna分子,其中转录后一条链与互补mrna的结合导致其降解和翻译损失。小发夹rna(shrna)是基于单链rna的寡核苷酸,可形成茎环(发夹)结构,该结构能够通过dicer和rna减少沉默复合物(risc)减少mrna。可以基于目的基因(靶核酸)的序列设计rnai分子。然后可以化学合成或通过体外转录合成相应的rnai,或从载体或pcr产物表达。sirna术语sirna是指小干扰核糖核酸rnai分子。它是一类双链rna分子,在本领域中也称为短干扰rna或沉默rna。sirna通常包含正义链(也称为过客链)和反义链(也称为前导链),其中每条链的长度为17–30个核苷酸,通常为19–25个核苷,其中反义链与靶核酸互补(例如至少95%互补,例如完全互补)(合适地是成熟的mrna序列),并且正义链与反义链互补,使得正义链和反义链形成双链体或双链体区域。sirna链可形成平末端双链体,或者优选地,正义和反义链的3'端可形成3'突出端,例如1个、2个或3个核苷,类似于dicer生产的产物,可在体内形成risc底物。dicer底物的有效扩展形式已在us8,349,809和us8,513,207中进行了描述,在此通过引用并入。在一些实施例中,正义链和反义链均具有2nt3'突出端。因此,双链体区域的长度可以是例如17-25个核苷酸,例如长度为21-23个核苷酸。一旦进入细胞内,反义链就被掺入到risc复合物中,该risc复合物介导靶核酸的靶降解或靶抑制。sirna除了rna核苷外,通常还包含修饰的核苷。在一个实施例中,sirna分子可以使用修饰的核苷酸间键和2'糖修饰的核苷进行化学修饰,例如2'-4'双环核糖修饰的核苷(包括lna和cet)或2'取代的修饰,例如2'-o-烷基-rna、2'-o-甲基-rna,2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna、2'-氟-dna、阿拉伯糖核酸(ana)、2'-氟-ana。特别地,可以将2′氟、2′-o-甲基或2′-o-甲氧基乙基掺入sirna。在一些实施例中,可以用2′糖修饰的核苷例如lna修饰sirna正义(过客)链的所有核苷酸(例如,参见wo2004/083430、wo2007/085485)。在一些实施例中,sirna的过客链可以是不连续的(例如,参见wo2007/107162)。已经报道了在sirna的反义链的种子区域中出现的热不稳定核苷酸的掺入可用于减少sirna的脱靶活性(例如,参见wo2018/098328)。合适地,sirna在反义链的5'端包含5'磷酸基团或5'-磷酸模拟物。在一些实施例中,反义链的5'端是rna核苷。在一个实施例中,sirna分子进一步包含至少一个硫代磷酸酯或甲基膦酸酯核苷间键。硫代磷酸酯或甲基膦酸酯的核苷间键可以在一条或两条链(例如,反义链;或正义链)的3'-末端上;或者硫代磷酸酯或甲基膦酸酯的核苷间键可以在一条或两条链(例如,反义链;或正义链)的5'末端上;或者硫代磷酸酯或甲基膦酸酯的核苷间键可以在一条或两条链(例如反义链;或正义链)的5'-和3'-末端上。在一些实施例中,剩余的核苷间键是磷酸二酯键。在一些实施例中,sirna分子包含一个或多个硫代磷酸酯核苷间键。在sirna分子中,硫代磷酸酯核苷间键可能会减少或在rics中进行核酸酶切割,因此优选的是,并非反义链中的所有核苷间键都被修饰。sirna分子可以进一步包含配体。在一些实施例中,配体缀合至正义链的3'端。对于生物学分布,例如,可将sirna缀合至靶向配体和/或配制成脂质纳米颗粒。本发明的其他方面涉及包含这些dsrna的药物组合物,例如适合用于治疗用途的sirna分子,以及通过施用dsrna分子(例如本发明的sirna)来抑制靶基因表达的方法,例如用于治疗如本文所公开的各种疾病。shrna短发夹rna或shrna分子的长度通常介于40个至70个核苷酸之间,例如介于45个至65个核苷酸之间,例如介于50个至60个核苷酸之间,并形成一个茎环(发夹)rna结构,该结构可与称为dicer的核酸内切酶相互作用,据信,dicer将dsrna加工成具有特征性的两个碱基3'突出端的19-23个碱基对的短干扰rna,然后将其掺入rna诱导沉默复合物(risc)中。与适当的靶mrna结合后,risc内的一个或多个核酸内切酶切割靶以诱导沉默。rnai寡核苷酸可以使用修饰的核苷酸间键和2'糖修饰的核苷进行化学修饰,例如2'-4'双环核糖修饰的核苷(包括lna和cet)或2'取代的修饰,例如2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna、2'-氟-dna、阿拉伯糖核酸(ana)、2'-氟-ana。在一些实施例中,shrna核酸分子包含一个或多个硫代磷酸酯核苷间键。在rnai分子中,硫代磷酸酯核苷间键可减少或在rics中进行核酸酶切割,因此优选的是,并非shrna分子茎环中的所有核苷间键都被修饰。硫代磷酸酯核苷间键可以优选地位于shrna分子茎环的3'和/或5'端,特别是在与靶核酸不互补的分子的一部分(例如sirna分子中的正义链或过客链)。然而,shrna分子的与靶核酸互补的区域也可以在预计通过dicer切割后会成为3'和/或5'末端部分的前2个至3个核苷间键中被修饰。连续核苷酸序列术语“连续核苷酸序列”是指与靶核酸互补的寡核苷酸区域。该术语在本文中与术语“邻接核碱基序列”和术语“寡核苷酸基序序列”互换使用。在一些实施例中,寡核苷酸的所有核苷酸构成连续核苷酸序列。在一些实施例中,连续核苷酸序列包括在sirna分子的前导链中。在一些实施例中,连续核苷酸序列是shrna分子的部分,其与靶核酸100%互补。在一些实施例中,寡核苷酸包含连续核苷酸序列,例如f-g-f’缺口聚体区域,并且可以任选地包含其他核苷酸,例如可以用于将官能团(例如用于靶向的缀合物基团)附接至连续核苷酸序列的核苷酸接头区域。核苷酸接头区域可以与靶核酸互补或可以不互补。在一些实施例中,反义寡核苷酸的核碱基序列是连续核苷酸序列。在一些实施例中,连续核苷酸序列与靶核酸100%互补。核苷酸和核苷核苷酸和核苷是寡核苷酸和多核苷酸的组成部分,并且出于本发明的目的,包括天然存在的和非天然存在的核苷酸和核苷。实际上,核苷酸诸如dna和rna核苷酸包括核糖部分、核碱基部分和一个或多个磷酸基团(核苷中不存在)。核苷和核苷酸也可以可互换地称为“单元”或“单体”。修饰的核苷如本文所用,术语“修饰的核苷”或“核苷修饰”是指与同等的dna或rna核苷相比,通过引入糖部分或(核)碱基部分的一种或多种修饰而被修饰的核苷。在一个优选的实施例中,修饰的核苷包含修饰的糖部分。术语修饰的核苷在本文中还可与术语“核苷类似物”或修饰的“单元”或修饰的“单体”互换使用。具有未修饰的dna或rna糖部分的核苷在本文中称为dna或rna核苷。如果允许watsoncrick碱基配对,则dna或rna核苷的碱基区域中修饰的核苷通常仍称为dna或rna。修饰的核苷间键如技术人员通常所理解的,术语“修饰的核苷间键”定义为除磷酸二酯(po)键以外的键,其将两个核苷共价偶联在一起。因此,本发明的寡核苷酸可包含一个或多个修饰的核苷间键,诸如一个或多个硫代磷酸酯核苷间键,或一个或多个二硫代磷酸酯核苷间键。在一些实施例中,与磷酸二酯键相比,修饰的核苷间键增加了寡核苷酸的核酸酶抗性。对于天然存在的寡核苷酸,核苷间键包括在相邻核苷之间产生磷酸二酯键的磷酸基团。修饰的核苷间键可用于稳定体内使用的寡核苷酸,并可用于防止本发明的寡核苷酸中dna核苷区域或rna核苷区域的核酸酶裂解,例如在缺口聚体寡核苷酸的缺口区域g内以及在修饰的核苷区域中,例如区域f和f'。在一个实施例中,寡核苷酸包含一个或多个从天然磷酸二酯修饰的核苷间键,诸如一个或多个修饰的核苷间键,其例如对核酸酶的攻击更具抗性。核酸酶抗性可以通过在血清中孵育寡核苷酸或通过使用核酸酶抗性测定(例如蛇毒磷酸二酯酶(svpd))来确定,都是本领域中众所周知的。能够增强寡核苷酸的核酸酶抗性的核苷间键称为抗核酸酶核苷间键。在一些实施例中,寡核苷酸或其连续核苷酸序列中至少50%的核苷间键是经修饰的,诸如至少60%、诸如至少70%、诸如至少75%、诸如至少80%或诸如至少90%的寡核苷酸或其连续核苷酸序列中的核苷间键是经修饰的。在一些实施例中,寡核苷酸或其连续核苷酸序列的所有核苷间键是经修饰的。应当认识到的是,在一些实施例中,将本发明的寡核苷酸与非核苷酸官能团诸如缀合物联接的核苷可以是磷酸二酯。在一些实施例中,寡核苷酸的所有核苷间键或其连续核苷酸序列是抗核酸酶核苷间键。对于本发明的寡核苷酸,使用硫代磷酸酯核苷间键是优选的。硫代磷酸酯核苷间键由于核酸酶抗性、有益的药代动力学和易于制造而特别有用。在一些实施例中,寡核苷酸或其连续核苷酸序列中至少50%的核苷间键是硫代磷酸酯,诸如至少60%、诸如至少70%、诸如至少75%、诸如至少80%或诸如至少90%的寡核苷酸或其连续核苷酸序列中的核苷间键是硫代磷酸酯。在一些实施例中,寡核苷酸的所有核苷间键或其连续核苷酸序列是硫代磷酸酯。核酸酶抗性键,诸如硫代磷酸酯键,在与靶核酸形成双链体时能够募集核酸酶的寡核苷酸区域中特别有用,诸如缺口聚体的区域g。然而,硫代磷酸酯键也可用于非核酸酶募集区域和/或亲和力增强区域,诸如缺口聚体的区域f和f'。在一些实施例中,缺口聚体寡核苷酸可在区域f或f',或者同时在区域f和f'中包含一个或多个磷酸二酯键,其中区域g中的所有核苷间键均可以是硫代磷酸酯。优选地,寡核苷酸的连续核苷酸序列的所有核苷间键都是硫代磷酸酯,或寡核苷酸的所有核苷间键都是硫代磷酸酯键。应当认识到的是,如ep2742135中所公开的,反义寡核苷酸可包含其他核苷间键(除磷酸二酯和硫代磷酸酯以外),例如烷基膦酸酯/甲基膦酸酯核苷间键,其根据ep2742135可以例如以其他方式被dna硫代磷酸酯的缺口区域所耐受。核碱基术语核碱基包括存在于核苷和核苷酸中的嘌呤(例如腺嘌呤和鸟嘌呤)和嘧啶(例如尿嘧啶、胸腺嘧啶和胞嘧啶)部分,其在核酸杂交中形成氢键。在本发明的背景中,术语“核碱基”也涵盖修饰的核碱基,其可以不同于天然存在的核碱基,但是在核酸杂交期间起作用。在此背景中,“核碱基”是指天然存在的核碱基,例如腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶、黄嘌呤和次黄嘌呤,以及非天然存在的变体。此类变体例如描述于hirao等人(2012)accountsofchemicalresearch第45卷第2055页和bergstrom(2009)currentprotocolsinnucleicacidchemistrysuppl.371.4.1中。在一些实施例中,核碱基部分被修饰,其方式是将嘌呤或嘧啶改变为修饰的嘌呤或嘧啶,诸如取代的嘌呤或取代的嘧啶,诸如选自异胞嘧啶、假异胞嘧啶、5-甲基胞嘧啶、5-巯基胞嘧啶、5-丙炔基胞嘧啶、5-丙炔基尿嘧啶、5-溴尿嘧啶、5-噻唑尿嘧啶、2-硫代尿嘧啶、2'硫代胸腺嘧啶、肌苷、二氨基嘌呤、6-氨基嘌呤、2-氨基嘌呤、2,6-二氨基嘌呤和2-氯-6-氨基嘌呤的核碱基。核碱基部分可以由每一个相应核碱基的字母代码来表示,例如a、t、g、c或u,其中每一个字母可以任选地包括具有同等功能的修饰的核碱基。例如,在示例性的寡核苷酸中,核碱基部分选自a、t、g、c和5-甲基胞嘧啶。任选地,对于lna缺口聚体,可以使用5-甲基胞嘧啶lna核苷。修饰的寡核苷酸术语“修饰的寡核苷酸”描述了一种寡核苷酸,其包含一个或多个糖修饰的核苷和/或修饰的核苷间键。术语“嵌合”寡核苷酸是已经在文献中用来描述具有修饰的核苷和dna核苷的寡核苷酸的术语。本发明的反义寡核苷酸优选地是嵌合寡核苷酸。互补性术语“互补性”描述了核苷/核苷酸的watson-crick碱基配对的能力。watson-crick碱基对是鸟嘌呤(g)-胞嘧啶(c)和腺嘌呤(a)-胸腺嘧啶(t)/尿嘧啶(u)。应当理解的是,寡核苷酸可包含具有修饰的核碱基的核苷,例如,经常使用5-甲基胞嘧啶代替胞嘧啶,因此,术语互补性涵盖未修饰的和修饰的核碱基之间的watsoncrick碱基配对(参见例如hirao等人(2012)accountsofchemicalresearch第45卷第2055页和bergstrom(2009)currentprotocolsinnucleicacidchemistrysuppl.371.4.1)。如本文所用,术语“互补性百分比”是指核酸分子(例如寡核苷酸)中连续核苷酸序列的与参考序列(例如靶序列或序列基序)互补的核苷酸比例(以百分比表示),该核酸分子跨连续核苷酸序列。因此,通过计数两个序列之间(当与靶序列5'-3’和3'-5’的寡核苷酸序列比对时)互补(形成watsoncrick碱基对)的对准的核碱基数,将其除以寡核苷酸中核苷酸的总数,然后乘以100,来计算互补性的百分比。在这种比较中,未对准(形成碱基对)的核碱基/核苷酸被称为错配。在计算连续核苷酸序列的互补性百分比时,不允许插入和删除。应当理解的是,在确定互补性时,只要保留了形成watsoncrick碱基配对的核碱基的功能能力,就不考虑核碱基的化学修饰(例如,在计算互补性百分比时,认为5’-甲基胞嘧啶与胞嘧啶相同)。术语“完全互补”是指100%互补。以下是与靶核酸(seqidno:11)完全互补的寡核苷酸基序(seqidno:33)的实例5’-ctttgaccagagtatgtaaaattctc-3’(seqidno:11)3’-aaactggtctcatacatttt-5’(seqidno:33)同一性如本文所用,术语“同一性”是指核酸分子(例如寡核苷酸)中连续核苷酸序列的与参考序列(例如序列基序)相同的核苷酸比例(以百分比表示),该核酸分子跨连续核苷酸序列。因此,通过计数两个序列(在本发明的化合物的连续核苷酸序列中和在参考序列中)相同(匹配)的对准核碱基数,将该数除以寡核苷酸的核苷酸总数再乘以100,来计算同一性百分比。因此,同一性百分比=(匹配数x100)/比对区域的长度(例如,连续核苷酸序列)。在计算连续核苷酸序列的同一性百分比时,不允许插入和删除。应当理解的是,在确定同一性时,只要保留了形成watsoncrick碱基配对的核碱基的功能能力,就不考虑核碱基的化学修饰(例如,在计算同一性百分比时,认为5-甲基胞嘧啶与胞嘧啶相同)。杂交如本文所用,术语“杂交”应当理解为在相对链上的碱基对之间形成氢键从而形成双链体的两条核酸链(例如寡核苷酸和靶核酸)。两条核酸链之间结合的亲和力是杂交的强度。通常用解链温度(tm)来描述,其定义为一半寡核苷酸与靶核酸形成双链体的温度。在生理条件下,tm与亲和力并不严格成比例(mergnyandlacroix,2003,oligonucleotides13:515–537)。标准状态的吉布斯自由能δg°更精确地表示结合亲和力,并且通过δg°=-rtln(kd)与反应的解离常数(kd)相关,其中r为气体常数,t为绝对温度。因此,寡核苷酸与靶核酸之间的反应的非常低的δg°反映了寡核苷酸与靶核酸之间的强杂交。δg°是与水浓度为1m、ph为7、温度为37℃的反应相关的能量。寡核苷酸与靶核酸的杂交是自发反应,而自发反应的δg°小于零。δg°可以通过实验来测量,例如,通过使用如hansen等人,1965,chem.comm.36–38和holdgate等人,2005,drugdiscovtoday中所述的等温滴定量热法(itc)方法测量。技术人员将知道商用设备可用于δg°测量。δg°还可以使用santalucia,1998,procnatlacadsciusa.中描述的最近邻模型,95:1460–1465使用sugimotoet等人,1995,biochemistry34:11211–11216和mctigue等人,2004,biochemistry43:5388–5405中描述的适当推导的热力学参数进行数值评估。为了具有通过杂交调节其预期的核酸靶标的可能性,对于长度为10-30个核苷酸的寡核苷酸,本发明的寡核苷酸以低于-10kcal的δg°估值与靶核酸杂交。在一些实施例中,杂交的程度或强度通过标准状态吉布斯自由能δg°测量。对于长度为8-30个核苷酸的寡核苷酸,寡核苷酸可以低于-10kcal,诸如低于-15kcal、诸如低于-20kcal和诸如低于-25kcal的δg°估值与靶核酸杂交。在一些实施例中,寡核苷酸以-10至-60kcal,诸如-12至-40、诸如-15至-30kcal或-16至-27kcal诸如-18至-25kcal的δg°估值与靶核酸杂交。靶核酸根据本发明,靶核酸是编码哺乳动物rtel1的核酸,并且可以例如是基因、rna、mrna和前体mrna、成熟的mrna或cdna序列。该靶标因此可以称为rtel1靶核酸。本发明的寡核苷酸可以例如靶向哺乳动物rtel1的外显子区域(特别是sirna和shrna靶标外显子区域,但也可以是反义寡核苷酸),或者可以例如靶向rtel1前体mrna中的内含子区域(特别是反义寡核苷酸靶标内含子区域)。人rtel1基因编码15个转录本,其中7个是蛋白质编码的,并且因此是潜在的核酸靶标。表1列出了位于seqidno:1的人rtel1前体mrna上的7个转录本的预测外显子和内含子区域。应当理解的是,本发明的寡核苷酸可以靶向表1中列出的一种或多种转录本的成熟的mrna序列。表1.人rtel1前体mrna(seqidno:1)中用于对rtel1mrna转录本进行不同的蛋白质编码的转录区域、外显子区域和内含子区域合适地,靶核酸编码rtel1蛋白,特别是哺乳动物rtel1,例如人rtel1(参见例如表2和表3),其提供人和猴的前体mrna序列rtel1。在一些实施例中,靶核酸选自seqidno:1和/或seqidno:2或其天然存在的变体(例如表1中编码哺乳动物rtel1蛋白的序列)。如果在研究或诊断中采用本发明的寡核苷酸,则靶核酸可以是cdna或衍生自dna或rna的合成核酸。对于体内或体外应用,本发明的寡核苷酸通常能够抑制表达rtel1靶核酸的细胞中rtel1靶核酸的表达。本发明的寡核苷酸的核碱基的邻接序列通常与rtel1靶核酸互补,如在整个寡核苷酸的长度上测量的,任选地,除了一个或两个错配以外,并且任选地排除可以将寡核苷酸与任选的官能团联接的基于核苷酸的接头,诸如缀合物或其他非互补性末端核苷酸(例如区域d’或d”)。在一些实施例中,靶核酸可以是rna或dna,诸如信使rna、诸如成熟的mrna(例如,表1中列出的转录本的外显子区域)或前体mrna。在一些实施例中,靶核酸是编码哺乳动物rtel1蛋白,诸如人rtel1的rna或dna、例如人rtel1mrna序列、诸如作为seqidno1公开的靶核酸。表2和表3提供了有关示例性靶核酸的更多信息。表2.跨物种的rtel1的基因组和装配信息。fwd=正向链。基因组坐标提供了前体mrna序列(基因组序列)。ncbi参考提供了mrna序列(cdna序列)。表3.跨物种的rtel1的序列详细信息。物种rna类型长度(nt)seqidno人前体mrna384441猴前体mrna372142注意,seqidno2包含多个nnnn区域,其中测序无法准确地精炼序列,因此包含简并序列。为了避免疑问,本发明的化合物与实际靶序列互补,因此不是简并化合物。在一些实施例中,靶核酸是seqidno1。在一些实施例中,靶核酸是seqidno2。靶序列如本文所用,术语“靶序列”是指存在于靶核酸中的核苷酸序列,其包含与本发明的寡核苷酸互补的核碱基序列。在一些实施例中,靶序列由靶核酸上具有与本发明寡核苷酸的连续核苷酸序列互补的核碱基序列的区域组成。靶核酸的这一区域可以互换地称为靶标核苷酸序列、靶序列或靶标区域。在一些实施例中,靶序列比单个寡核苷酸的互补序列更长,并且可以例如代表靶核酸的优选区域,其可以被本发明的几种寡核苷酸靶向。在一些实施例中,靶序列是选自由人rtel1mrna外显子组成的组的序列,诸如选自上表1中所列的人rtel1mrna外显子。在一些实施例中,靶序列是选自由人rtel1mrna内含子组成的组的序列,诸如选自上表1中所列的人rtel1mrna内含子。本发明的寡核苷酸包含与靶核酸诸如本文所述的靶序列互补或杂交的连续核苷酸序列。与寡核苷酸互补或杂交的靶序列通常包含至少10个核苷酸的邻接核碱基序列。连续核苷酸序列介于10个至35个核苷酸之间,诸如12个至30个、诸如14个至20个、诸如16个至20个连续核苷酸。在本发明的一个实施例中,靶序列选自由以下项组成的组:seqidno:3至seqidno:21,如表4所示。表4:人rtel1前体mrna上的靶序列(seqidno:1)在一些实施例中,靶序列选自表5a或表5b所示的区域。靶细胞如本文所用,术语“靶细胞”是指表达靶核酸的细胞。对于本发明的治疗用途,如果靶细胞被hbv感染则是优选的。在一些实施例中,靶细胞可以是体内或体外的。在一些实施例中,靶细胞是哺乳动物细胞诸如啮齿动物细胞,诸如小鼠细胞或大鼠细胞或土拨鼠细胞,或者灵长类细胞,诸如猴细胞(例如食蟹猴细胞)或人类细胞。在优选的实施例中,靶细胞表达rtel1mrna,诸如rtel1前体mrna或rtel1成熟的mrna。对于反义寡核苷酸靶向作用,通常不考虑rtel1mrna的聚腺苷(polya)尾部。此外,靶细胞可以是肝细胞。在一个实施例中,靶细胞是hbv感染的原代人肝细胞,其衍生自hbv感染者或具有人源化肝脏的hbv感染的小鼠(phoenixbio,pxb-小鼠)。根据本发明,靶细胞可以被hbv感染。此外,靶细胞可包含hbvcccdna。因此,靶细胞优选地包含rtel1mrna,诸如rtel1前体mrna或rtel1成熟的mrna,以及hbvcccdna。天然存在的变体术语“天然存在的变体”是指rtel1基因或转录本的变体,其源自与靶核酸相同的遗传基因座,但是可能例如由于遗传密码的简并性导致编码相同氨基酸的密码子的多样性而不同,或由于前体mrna的可变剪接、或存在多态性诸如单核苷酸多态性(snp)和等位基因变体而不同。基于与寡核苷酸足够互补序列的存在,本发明的寡核苷酸因此可以靶向靶核酸及其天然存在的变体。在一些实施例中,天然存在的变体与哺乳动物rtel1靶核酸具有至少95%,诸如至少98%或至少99%的同源性,所述靶核酸诸如seqidno1和/或seqidno2的靶核酸。在一些实施例中,天然存在的变体与seqidno:1的人rtel1靶核酸具有至少99%的同源性。在一些实施例中,天然存在的变体是已知的多态性。表达的调节如本文所用,术语“表达的调节”应理解为,与施用寡核苷酸之前的rtel1的量相比,寡核苷酸改变rtel1的量的能力的总称。另选地,可以通过参考对照实验来确定表达的调节。通常应当理解的是,对照物是用盐水组合物处理的个体或靶细胞,或者用非靶向寡核苷酸(模拟物)处理的个体或靶细胞。一种调节类型是寡核苷酸抑制、下调、降低、抑制、去除、停止、阻断、阻止、减少、减低、避免或终止rtel1表达的能力,例如通过降解mrna或阻止转录实现。另一种调节类型是寡核苷酸恢复、增加或增强rtel1表达的能力,例如通过修复剪接位点或阻止剪接或去除或阻断抑制机制(诸如微小rna阻遏)实现。糖修饰本发明的寡聚物可包含一种或多种具有修饰的糖部分的核苷,所述修饰的糖部分即与dna和rna中发现的核糖部分相比时糖部分的修饰。已经制备了许多具有核糖部分的修饰的核苷,主要目的是改善寡核苷酸的某些性质,诸如亲和力和/或核酸酶抗性。这样的修饰包括其中核糖环结构被修饰的那些修饰,例如,通过用己糖环(hna)或双环替换核糖环结构来实现,其通常在核糖环(lna)的c2和c4碳原子之间具有双基桥,或通常在c2和c3之间缺乏键的未联接核糖环(例如una)。其他糖修饰的核苷包括,例如,双环己糖核酸(wo2011/017521)或三环核酸(wo2013/154798)。修饰的核苷还包括其中糖部分被替换为非糖部分的核苷,例如在肽核酸(pna)或吗啉代核酸的情况下。糖修饰还包括通过将核糖环上的取代基更改为氢以外的基团或天然存在于dna和rna核苷中的2'-oh基团而进行的修饰。例如,可以在2’、3’、4’或5’位置引入取代基。高亲和力修饰的核苷高亲和力修饰的核苷是修饰的核苷酸,其在掺入到寡核苷酸中时,增强了寡核苷酸对其互补靶标的亲和力,例如通过解链温度(tm)测量。本发明的高亲和力修饰的核苷优选地使每一个修饰的核苷的解链温度增加介于+0.5℃至+12℃之间,更优选地介于+1.5℃至+10℃之间并且最优选地介于+3℃至+8℃之间。许多高亲和力修饰的核苷是本领域已知的,并且包括例如许多2’取代的核苷以及锁定的核酸(lna)(参见例如freier&altmann;nucl.acidres.,1997,25,4429-4443和uhlmann;curr.opinionindrugdevelopment,2000,3(2),293-213)。2'糖修饰的核苷2'糖修饰的核苷是一种核苷,其在2'位置具有除h或-oh以外的取代基(2'取代的核苷)或包含能够在2'碳与核糖环中的第二个碳原子之间形成桥的2'联接双基,诸如lna(2'-4'双基桥连)核苷。事实上,人们已花费很多精力开发2'糖取代的核苷,并且发现许多2'取代的核苷掺入寡核苷酸后具有有益的特性。例如,2'修饰的糖可以提供增强的结合亲和力和/或增加的对寡核苷酸的核酸酶抗性。2'取代的修饰的核苷的实例是2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna(moe)、2'-氨基-dna、2'-氟-rna和2'-f-ana核苷。有关进一步的实例,请参见例如freier&altmann;nucl.acidres.,1997,25,4429-4443和uhlmann;curr.opinionindrugdevelopment,2000,3(2),293-213以及deleavey和damha,chemistryandbiology2012,19,937。下面是一些2'取代的修饰的核苷的示意图。关于本发明,2'取代的糖修饰的核苷不包括像lna那样的2'桥连的核苷。锁定的核酸核苷(lna核苷)“lna核苷”是一种2'-糖修饰的核苷,其包含联接所述核苷的核糖环的c2'和c4'的双基(也称为“2'-4'桥”),其限制或锁定核糖环的构象。这些核苷在文献中也称为桥连核酸或双环核酸(bna)。将lna掺入互补rna或dna分子的寡核苷酸中时,核糖构象的锁定与杂交的增强亲和力(双链体稳定化)有关。这可以常规地通过测量寡核苷酸/互补双链体的解链温度确定。非限制性的示例性lna核苷公开于wo99/014226、wo00/66604、wo98/039352、wo2004/046160、wo00/047599、wo2007/134181、wo2010/077578、wo2010/036698、wo2007/090071、wo2009/006478、wo2011/156202、wo2008/154401、wo2009/067647,wo2008/150729、morita等人,bioorganic&med.chem.lett.12,73-76,seth等人j.org.chem.2010,vol75(5)pp.1569-81,mitsuoka等人,nucleicacidsresearch2009,37(4),1225-1238以及wan和seth,j.medicalchemistry2016,59,9645-9667。本发明的lna核苷的特定实例在方案1中给出(其中b如上所定义)。方案1特定的lna核苷是β-d-氧基-lna、6'-甲基-β-d-氧基lna诸如(s)-6'-甲基-β-d-氧基-lna(scet)和ena。药学上可接受的盐术语“药学上可接受的盐”是指那些保留游离碱或游离酸的生物有效性和特性的盐,其并非在生物学上或其它方面所不希望的。盐是由无机酸诸如盐酸、氢溴酸、硫酸、硝酸、磷酸,特别是盐酸,以及有机酸诸如乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸、n-乙酰半胱氨酸形成的。此外,这些盐可以通过向游离酸添加无机碱或有机碱制备。衍生自无机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐。衍生自有机碱的盐包括但不限于下列的伯胺、仲胺和叔胺的盐,取代胺包括天然出现的取代胺、环状胺和碱性离子交换树脂,诸如异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、赖氨酸、精氨酸、n-乙基哌啶、哌啶、聚胺树脂。式(i)化合物也可以两性离子的形式存在。式(i)化合物的特别地优选的药学上可接受的盐是盐酸、氢溴酸、硫酸、磷酸和甲磺酸的盐。rna酶h的活性和募集反义寡核苷酸的rna酶h活性是指其与互补rna分子形成双链体时募集rna酶h的能力。wo01/23613提供了用于确定rna酶h活性的体外方法,其可以用于确定募集rna酶h的能力。如果寡核苷酸在提供互补靶核酸序列时,使用wo01/23613(通过引用并入本文)实例91至95提供的方法测量的初始速率(以pmol/l/min计)为使用具有与所测试修饰寡核苷酸相同的碱基序列但仅包含在寡核苷酸中所有单体之间均具有硫代磷酸酯键的dna单体的寡核苷酸时所测初始速率的至少5%,诸如至少10%或超过20%时,则通常被认为能够募集rna酶h。为了用于确定rna酶h活性,可从creative(与大肠杆菌中表达的his标签融合的重组人rna酶h1)获得重组人rna酶h1。缺口聚体本发明的反义寡核苷酸或其连续核苷酸序列可以是缺口聚体,也称为缺口聚体寡核苷酸或缺口聚体设计。反义缺口聚体一般用于通过rna酶h介导的降解来抑制靶核酸。缺口聚体寡核苷酸包含至少三个不同的结构区域,分别为“5->3”方向的5’侧翼、缺口和3’侧翼f-g-f'。“缺口”区域(g)包含一段使寡核苷酸能够募集rna酶h的邻接dna核苷酸。该缺口区域的侧翼是包含一个或多个糖修饰的核苷(优选地是高亲和力糖修饰的核苷)的5’侧翼区域(f),以及包含一个或多个糖修饰的核苷(优选地是高亲和力糖修饰的核苷)的3’侧翼区域(f’)。区域f和f’中的一个或多个糖修饰的核苷增强寡核苷酸对靶核酸的亲和力(即,亲和力增强的糖修饰的核苷)。在一些实施例中,区域f和f’中的一个或多个糖修饰的核苷是2’糖修饰的核苷,诸如高亲和力的2’糖修饰、诸如独立地选自lna和2’-moe。在缺口聚体设计中,缺口区域的5’和3’最末端核苷是dna核苷,分别位于5’(f)或3’(f’)区域的糖修饰核苷附近。侧翼可进一步定义为在距缺口区域最远的端,即在5’侧翼的5’端和3’侧翼的3’端,具有至少一个糖修饰的核苷。区域f-g-f’形成连续核苷酸序列。本发明的反义寡核苷酸或其连续核苷酸序列可包含式f-g-f’的缺口聚体区域。缺口聚体设计f-g-f′的总长度可以是例如12个至32个核苷,诸如13个至24个核苷、诸如14个至22个核苷、诸如14个至17个核苷、诸如16个至18个核苷。举例来说,本发明的缺口聚体寡核苷酸可以由下式表示:f1-8-g5-18-f’1-8,诸如f1-8-g5-16-f’1-8,诸如f1-8-g7-16-f’2-8前提条件是缺口聚体区域f-g-f’的总长度至少为12个,诸如至少14个核苷酸。在本发明的一个方面,反义寡核苷酸或其连续核苷酸序列由式5’-f-g-f’-3’的缺口聚体组成或包含该缺口聚体,其中区域f和f’独立地包含1-8个核苷或由其组成,其中1-4个核苷是2’糖修饰的并且限定f和f’区域的5’端和3’端,并且g是能够募集rna酶h的6个至18个,诸如6个至16个核苷之间的区域。在一些实施例中,g区域由dna核苷组成。以下进一步定义了区域f、g和f',并且可以将其掺入到f-g-f’式中。缺口聚体-区域g缺口聚体的区域g(缺口区域)是核苷的区域,其使得寡核苷酸能够募集rna酶h诸如人rna酶h1,通常是dna核苷。rna酶h是一种细胞酶,其识别dna和rna之间的双链体,并酶切裂解rna分子。合适地,缺口聚体可以具有长度为至少5个或6个邻接dna核苷的缺口区域(g),诸如5-18个邻接dna核苷、5-17个邻接dna核苷、诸如5-16个邻接dna核苷、诸如6-15个邻接dna核苷,诸如7-14个邻接dna核苷,诸如8-12个邻接dna核苷酸、诸如8-12个邻接dna核苷酸。在一些实施例中,缺口区域g可以由6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个或18个邻接dna核苷组成。在某些情况下,缺口区域的胞嘧啶(c)dna可被甲基化,此类残基标注为5'-甲基胞嘧啶(mec或用e代替c)。如果在缺口中存在cg二核苷酸以减少潜在的毒性,则缺口中胞嘧啶dna的甲基化是优选的,该修饰对寡核苷酸的功效没有显著影响。据报道有5’取代的dna核苷,诸如5’甲基dna核苷可用于dna缺口区域(ep2742136)。在一些实施例中,缺口区域g可以由6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个或18个邻接硫代磷酸酯联接的dna核苷组成。在一些实施例中,缺口中的所有核苷间键是硫代磷酸酯键。尽管传统的缺口聚体具有dna缺口区域,但是有许多修饰核苷的实例,当所述核苷在缺口区域内使用时,它们可以募集rna酶h。已报道当包含在缺口区域内时能够募集rna酶h的修饰的核苷包括,例如,α-l-lna、c4’烷基化的dna(如pct/ep2009/050349和vester等人,bioorg.med.chem.lett.18(2008)2296-2300,两者均通过引用并入本文)、阿拉伯糖衍生的核苷例如ana和2'f-ana(mangos等人,2003j.am.chem.soc.125,654-661)、una(未锁定的核酸)(如fluiter等人,mol.biosyst.,2009,10,1039中所述,通过引用并入本文)。una是未锁定的核酸,通常是核糖的c2和c3之间的键已被去除,形成未锁定的“糖”残基。用于这种缺口聚体中的修饰的核苷可以是当被引入缺口区域时采用2′内(类dna)结构的核苷,即允许rna酶h募集的修饰)。在一些实施例中,本文所述的dna缺口区域(g)可以任选地包含1个至3个糖修饰的核苷,所述核苷当被引入缺口区域时采用2’内(类dna)结构。缺口聚体-侧翼区域,f和f’区域f紧邻区域g的5’dna核苷。区域f的3’最末端核苷是糖修饰的核苷,诸如高亲和力糖修饰的核苷,例如2’取代的核苷,诸如moe核苷或lna核苷。区域f’紧邻区域g的3’dna核苷。区域f’的5’最末端核苷是糖修饰的核苷,诸如高亲和力糖修饰的核苷,例如2’取代的核苷,诸如moe核苷或lna核苷。区域f的长度为1-8个连续核苷酸,诸如长度为2-6个、诸如3-4个连续核苷酸。优选地,区域f的5’最末端核苷是糖修饰的核苷。在一些实施例中,区域f的两个5’最末端核苷是糖修饰的核苷。在一些实施例中,区域f的5’最末端核苷是lna核苷。在一些实施例中,区域f的两个5'最末端核苷是lna核苷。在一些实施例中,区域f的两个5’最末端核苷是2’取代的核苷,诸如两个3’moe核苷。在一些实施例中,区域f的5’最末端核苷是2'取代的核苷,诸如moe核苷。区域f’的长度为2-8个连续核苷酸,诸如长度为3-6个、诸如4-5个连续核苷酸。优选地的是,在实施例中,区域f’的3’最末端核苷是糖修饰的核苷。在一些实施例中,区域f’的两个3’最末端核苷是糖修饰的核苷。在一些实施例中,区域f’的两个3'最末端核苷是lna核苷。在一些实施例中,区域f’的3’最末端核苷是lna核苷。在一些实施例中,区域f’的两个3’最末端核苷是2’取代的核苷,诸如两个3’moe核苷。在一些实施例中,区域f’的3’最末端核苷是2'取代的核苷,诸如moe核苷。应当注意,当区域f或f′的长度为一时,优选地,它是lna核苷。在一些实施例中,区域f和f′独立地由糖修饰的核苷的邻接序列组成或包含糖修饰的核苷的邻接序列。在一些实施例中,区域f的糖修饰的核苷可独立地选自2'-o-烷基-rna单元、2'-o-甲基-rna、2'-氨基-dna单元、2'-氟-dna单元、2'-烷氧基-rna、moe单元、lna单元、阿拉伯糖核酸(ana)单元和2'-氟-ana单元。在一些实施例中,区域f和f′独立地包含lna和2′取代的修饰核苷两者(混合翼设计)。在一些实施例中,区域f和f′仅由一种类型的糖修饰的核苷组成,诸如仅由moe组成或仅由β-d-氧基lna组成或仅由scet组成。这样的设计也称为均匀侧翼或均匀缺口聚体设计。在一些实施例中,区域f或f′或者f和f′的所有核苷均为lna核苷,诸如独立地选自β-d-氧基lna、ena或scet核苷。在一些实施例中,区域f由1-5个,诸如2-4个、诸如3-4个、诸如1个、2个、3个、4个或5个邻接lna核苷组成。在一些实施例中,区域f和f′的所有核苷都是β-d-氧基lna核苷。在一些实施例中,区域f或f’或者f和f’的所有核苷都是2’取代的核苷,诸如ome或moe核苷。在一些实施例中,区域f由1个、2个、3个、4个、5个、6个、7个或8个邻接ome或moe核苷组成。在一些实施例中,仅一个侧翼区域可以由2′取代的核苷,诸如ome或moe核苷组成。在一些实施例中,5’(f)侧翼区域由2’取代的核苷诸如ome或moe核苷组成,而3’(f’)侧翼区域包含至少一个lna核苷,诸如β-d-氧基lna核苷或cet核苷。在一些实施例中,3’(f’)侧翼区域由2’取代的核苷,诸如ome或moe核苷组成,而5’(f)侧翼区域包含至少一个lna核苷,诸如β-d-氧基lna核苷或cet核苷。在一些实施例中,区域f和f’的所有修饰的核苷都是lna核苷,诸如独立地选自β-d-氧基lna、ena或scet核苷,其中区域f或f’或者f和f’可以任选地包含dna核苷(交替侧翼,有关更多详细信息,请参见这些的定义)。在一些实施例中,区域f和f’的所有修饰核苷均为β-d-氧基lna核苷,其中区域f或f’或者f和f’可以任选地包含dna核苷(交替侧翼,有关更多详细信息,请参见这些的定义)。在一些实施例中,区域f和f’的5’和3’最末端核苷是lna核苷,诸如β-d-氧基lna核苷或scet核苷。在一些实施例中,区域f和区域g之间的核苷间键是硫代磷酸酯核苷间键。在一些实施例中,区域f’和区域g之间的核苷间键是硫代磷酸酯核苷间键。在一些实施例中,区域f或f′、f和f′的核苷之间的核苷间键是硫代磷酸酯核苷间键。lna缺口聚体lna缺口聚体是其中区域f和f’中的一者或两者包含lna核苷或由lna核苷组成的缺口聚体。β-d-氧基缺口聚体是其中区域f和f’中的一者或两者包含β-d-氧基lna核苷或由其组成的缺口聚体。在一些实施例中,lna缺口聚体具有下式:[lna]1-5-[区域g]-[lna]1-5,其中区域g如在缺口聚体区域g定义中的定义。moe缺口聚体moe缺口聚体是其中区域f和f′由moe核苷组成的缺口聚体。在一些实施例中,moe缺口聚体设计为[moe]1-8-[区域g]-[moe]1-8,诸如[moe]2-7-[区域g]5-16-[moe]2-7、诸如[moe]3-6-[区域g]-[moe]3-6,其中区域g如缺口聚体定义中的定义。具有5-10-5设计的moe缺口聚体(moe-dna-moe)已在本领域中广泛使用。寡核苷酸中的区域d’或d”在一些实施例中,本发明的寡核苷酸可以包含以下项或由其组成:与靶核酸互补的寡核苷酸的连续核苷酸序列,诸如缺口聚体f-g-f′,以及另外的5′和/或3′核苷。另外的5’和/或3’核苷可以与靶核酸完全互补或可以不与靶核酸完全互补。这种另外的5’和/或3’核苷在本文中可以称为区域d’和d”。出于将连续核苷酸序列(诸如缺口聚体)与缀合物部分或另一个官能团接合的目的,可以使用区域d’或d’的添加物。当用于将连续核苷酸序列与缀合物部分接合时,其可用作可生物裂解的接头。或者,它可以用于提供核酸外切酶保护或使合成或制造变得容易。可以将区域d’和d'’分别附接于区域f的5’端或区域f’的3’端,以生成下式d’-f-g-f’、f-g-f’-d”或d’-f-g-f’-d”的设计。在这种情况下,f-g-f’是寡核苷酸的缺口聚体部分,而区域d’或d”构成寡核苷酸的单独部分。区域d’或d”可以独立地包含1个、2个、3个、4个或5个另外的核苷酸或由其组成,它们可以与靶核酸互补或不互补。与f或f′区域相邻的核苷酸不是糖修饰的核苷酸,诸如dna或rna或这些的碱基修饰形式。d’或d”区域可以用作核酸酶敏感的可生物裂解的接头(参见接头的定义)。在一些实施例中,另外的5’和/或3’端核苷酸与磷酸二酯键联接,并且是dna或rna。wo2014/076195中公开了适合用作区域d’或d”的基于核苷酸的可生物裂解的接头,其包括例如磷酸二酯联接的dna二核苷酸。wo2015/113922中公开了在聚寡核苷酸构建体中可生物裂解的接头的使用,其中它们被用于在单个寡核苷酸内联接多个反义构建体(例如缺口聚体区域)。在一个实施例中,本发明的寡核苷酸除构成缺口聚体的连续核苷酸序列外还包含区域d’和/或d”。在一些实施例中,本发明的寡核苷酸可以由下式表示:f-g-f’;特别是f1-8-g5-16-f’2-8d’-f-g-f’,特别是d’1-3-f1-8-g5-16-f’2-8f-g-f’-d”,特别是f1-8-g5-16-f’2-8-d”1-3d’-f-g-f’-d”,特别是d’1-3-f1-8-g5-16-f’2-8-d”1-3在一些实施例中,位于区域d’和区域f之间的核苷间键是磷酸二酯键。在一些实施例中,位于区域f’和区域d’之间的核苷间键是磷酸二酯键。缀合物如本文所用,术语“缀合物”是指与非核苷酸部分(缀合物部分或区域c或第三区域)共价联接的寡核苷酸。本发明的寡核苷酸与一个或多个非核苷酸部分的缀合可以改善该寡核苷酸的药理学,例如,通过影响寡核苷酸的活性、细胞分布、细胞吸收或稳定性实现。在一些实施例中,缀合物部分通过改善寡核苷酸的细胞分布、生物利用度、代谢、排泄、渗透性和/或细胞吸收来修饰或增强寡核苷酸的药代动力学性质。特别地,缀合物可将寡核苷酸靶向特定的器官、组织或细胞类型,从而增强寡核苷酸在该器官、组织或细胞类型中的有效性。同时,缀合物可用于降低寡核苷酸在非靶细胞类型、组织或器官中的活性,例如脱靶活性或在非靶细胞类型、组织或器官中的活性。通过引用并入本文的wo93/07883和wo2013/033230提供了合适的缀合物部分。其他合适的缀合物部分是那些能够结合脱唾液酸糖蛋白受体(asgpr)的缀合物部分。特别地,三价n-乙酰半乳糖胺缀合物部分适用于与asgpr结合,参见例如wo2014/076196、wo2014/207232和wo2014/179620(通过引用并入本文)。此类缀合物用于增强肝脏对寡核苷酸的摄取,同时减少寡核苷酸在肾脏中的存在,从而与相同寡核苷酸的非缀合形式相比,增加缀合寡核苷酸的肝脏/肾脏比率。寡核苷酸缀合物及其合成也在manoharan于antisensedrugtechnology,principles,strategies,andapplications,s.t.crooke编辑,第16章,marceldekker,inc.,2001中所作综述和manoharan,antisenseandnucleicaciddrugdevelopment,2002,12,103中报导,上述文献各自通过引用整体并入本文。在一个实施例中,非核苷酸部分(缀合物部分)选自由碳水化合物、细胞表面受体配体、药物、激素、亲脂性物质、聚合物、蛋白质、肽、毒素(例如细菌毒素)、维生素、病毒蛋白(例如衣壳)或其组合组成的组。接头键或接头是两个原子之间的连接,其经由一个或多个共价键将一个目标化学基团或区段与另一个目标化学基团或区段联接。缀合物部分可直接或通过联接部分(例如接头或系链)附接于寡核苷酸。接头用于将第三区域诸如缀合物部分(区域c)与第一区域共价连接,该第一区域例如与靶核酸互补的寡核苷酸或连续核苷酸序列(区域a)。在本发明的一些实施例中,本发明的缀合物或寡核苷酸缀合物可任选地包含位于与靶核酸互补的寡核苷酸或连续核苷酸序列(区域a或第一区域)和缀合物部分(区域c或第三区域)之间的接头区域(第二区域或区域b和/或区域y)。区域b是指包含生理上不稳定的键或由其组成的可生物裂解的接头,该键在哺乳动物体内通常遇到的条件下或与之相似的条件下可裂解。生理上不稳定的接头经历化学转化(例如裂解)的条件包括化学条件,诸如ph、温度、氧化或还原条件或试剂,以及在哺乳动物细胞中遇到的盐浓度或与之相似的盐浓度。哺乳动物细胞内条件还包括通常存在于哺乳动物细胞中的酶活性,诸如来自蛋白水解酶或水解酶或核酸酶的酶活性。在一个实施例中,可生物裂解的接头对s1核酸酶裂解敏感。在一个优选的实施例中,对核酸酶敏感的接头包含介于1个至10个核苷,诸如1个、2个、3个、4个、5个、6个、7个、8个、9个或10个核苷,更优选地包含介于2个至6个核苷,并且最优选地包含介于2个至4个联接的核苷,该核苷包含至少两个连续的磷酸二酯键,诸如至少3个或4个或5个连续的磷酸二酯键。优选地,核苷是dna或rna。包含磷酸二酯的可生物裂解的接头更加详细地描述于wo2014/076195(通过引用并入本文)中。区域y是指不一定是可生物裂解的但主要用于将缀合物部分(区域c或第三区域)与寡核苷酸(区域a或第一区域)共价连接的接头。区域y接头可以包含链结构或重复单元诸如乙二醇、氨基酸单元或氨基烷基基团的寡聚物。本发明的寡核苷酸缀合物可以由以下区域元件构建:a-c、a-b-c、a-b-y-c、a-y-b-c或a-y-c。在一些实施例中,接头(区域y)是氨基烷基,诸如c2-c36氨基烷基基团,其包括例如c6至c12氨基烷基基团。在优选的实施例中,接头(区域y)是c6氨基烷基基团。治疗本文所用的术语“治疗”是指既存疾病(例如本文所指的疾病或病症)的治疗或疾病的阻止即预防。因此将认识到,在一些实施例中,本文所指的治疗可以是预防性的。预防可理解为阻止hbv感染转变为慢性hbv感染或阻止由慢性hbv感染引起的严重肝病,诸如肝硬化和肝细胞癌。预防本文中的术语“阻止”、“预防”或“防止”涉及预防性治疗,即其目的是预防而不是治愈疾病的措施或程序。预防是指获得期望的药理和/或生理效果,该效果在完全或部分地阻止疾病或症状方面具有预防作用。因此,本文中的“阻止hbv感染”包括阻止在受试者体内发生hbv感染,以及阻止hbv感染症状的发生。在本发明中,特别地考虑了预防由hbv感染的母亲对孩子造成的hbv感染。还考虑了阻止由急性hbv感染转变为慢性hbv感染。患者为了本发明的目的,“受试者”(或“患者”)可以是脊椎动物。在本发明的上下文中,术语“受试者”包括人和其他动物,特别是哺乳动物和其他生物。因此,本文提供的手段和方法适用于人类治疗和兽医应用。因此,本文的受试者可以是动物,诸如小鼠、大鼠、仓鼠、兔、豚鼠、雪貂、猫、狗、鸡、绵羊、牛科动物、马、骆驼或灵长类动物。优选地,受试者是哺乳动物。更优选地,受试者是人。具体实施方式感染的肝细胞中的hbvcccdna负责持续的慢性感染和再激活,是所有病毒亚基因组转录本和前基因组rna(pgrna)的模板,以确保新合成的病毒后代和cccdna池通过细胞内核衣壳回收而得到补充。在本发明的上下文中,第一次显示rtel1与cccdna稳定性有关。这种认知为hbv感染受试者体内的cccdna去稳定化提供机会,这反过来又为彻底治愈慢性感染hbv患者创造机会。本发明的一方面是一种rtel1抑制剂,其用于在乙型肝炎病毒(hbv)感染的治疗和/或预防中使用,特别是慢性hbv感染。rtel1抑制剂可以是例如与rtel1蛋白特异性结合的小分子,其中所述抑制剂防止或减少rtel1蛋白与cccdna的结合。本发明的一个实施例是rtel1抑制剂,其能够减少感染的细胞,诸如hbv感染的细胞中的cccdna和/或pgrna。在另一个实施例中,rtel1抑制剂能够在hbv感染者体内降低hbsag和/或hbeag。本发明的寡核苷酸治疗性寡核苷酸可能是出色的rtel1抑制剂,因为它们可以靶向rtel1转录本并通过rna干扰途径或通过rna酶h裂解而促进其降解。或者,寡核苷酸诸如适体也可以充当rtel1蛋白相互作用的抑制剂。本发明的一个方面是一种rtel1靶向寡核苷酸,其用于在乙型肝炎病毒(hbv)感染的治疗和/或预防中的用途。这样的寡核苷酸可以选自由单链反义寡核苷酸;sirna分子;或shrna分子组成的组。本章节描述了适用于在乙型肝炎病毒(hbv)感染的治疗和/或预防中使用的新型寡核苷酸。本发明的寡核苷酸能够在体外和体内抑制rtel1的表达。抑制是通过将寡核苷酸与编码rtel1或参与rtel1调节的靶核酸杂交来实现的。靶核酸可以是哺乳动物rtel1序列,诸如seqidno:1和/或seqidno:2的序列在一些实施例中,本发明的寡核苷酸能够通过抑制或下调靶标表达来调节靶标的表达。优选地,与靶标的正常表达水平相比,这种调节产生至少20%的表达抑制,更优选地与靶标的正常表达水平相比,至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的抑制。在一些实施例中,在pxb-phh细胞中使用10μm的本发明寡核苷酸,可能能够在体外将rtel1mrna的表达水平抑制至少60%或70%。在一些实施例中,在pxb-phh细胞中使用10μm的本发明寡核苷酸,可能能够在体外将rtel1蛋白的表达水平抑制至少50%,就选择与cccdna减少具有良好相关性的核酸分子而言,靶标减少的这一范围是优选的。合适地,实例提供了可用于测量rtel1rna或蛋白质抑制的测定法(例如实例1)。通过寡核苷酸的连续核苷酸序列与靶核酸之间的杂交来触发靶抑制。在一些实施例中,本发明的寡核苷酸包含寡核苷酸与靶核酸之间的错配。尽管错配,与靶核酸的杂交仍可能足以显示出所需的rtel1表达抑制。由错配导致降低的结合亲和力可以优选地通过寡核苷酸中核苷酸数量的增加和/或能够增加与靶标结合亲和力的修饰核苷数量的增加来补偿,所述修饰核苷诸如存在于寡核苷酸序列中的2’糖修饰的核苷,包括lna。本发明的一个方面涉及长度为12个至60个核苷酸的寡核苷酸,其包含长度为至少10个核苷酸,诸如长度为至少12个至30个核苷酸的连续核苷酸序列,且与哺乳动物rtel1靶核酸特别是人rtel1核酸至少95%互补,诸如完全互补。这些寡核苷酸能够抑制rtel1的表达。本发明的一个方面涉及根据本发明的寡核苷酸,其是长度为12个至30个核苷酸的反义寡核苷酸,包含长度为至少10个核苷酸,诸如10个至30个核苷酸的连续核苷酸序列,且与哺乳动物rtel1至少90%互补,诸如完全互补。本发明的另一方面涉及根据本发明的寡核苷酸,其包含长度为12个至20个核苷酸,诸如15个至22个核苷酸的连续核苷酸序列,其与seqidno:1的靶核酸至少90%互补,诸如完全互补。在一些实施例中,寡核苷酸包含长度为10个至30个核苷酸的邻接序列,其与靶核酸的区域或靶序列至少90%互补,诸如至少91%、诸如至少92、诸如至少93%、诸如至少94%、诸如至少95%、诸如至少96%、诸如至少97%、诸如至少98%或100%互补。如果本发明的寡核苷酸或其连续核苷酸序列与靶核酸的区域完全互补(100%互补),或者在一些实施例中可包含寡核苷酸与靶核酸之间的一个或两个错配,则是优选的。在一些实施例中,反义寡核苷酸序列与seqidno:1的相应靶核酸100%互补。在一些实施例中,本发明的寡核苷酸或连续核苷酸序列与seqidno:1和seqidno:2的靶核酸至少95%互补,例如完全(或100%)互补。在一些实施例中,寡核苷酸包含长度为15个至22个核苷酸的连续核苷酸序列,其与seqidno:1中存在的相应靶序列至少90%互补,诸如100%的互补性,其中靶核酸选自由seqidno:3至seqidno:21(表4)或表5a中的区域1a至区域959a组成的组。表5a:可以使用本发明的寡核苷酸靶向的seqidno1区域在一些实施例中,寡核苷酸包含长度为16个至20个,诸如15个至22个核苷酸的连续核苷酸序列,其与seqidno:1中存在的相应靶序列至少90%互补,诸如100%互补,其中靶核酸选自由seqidno:3至seqidno:21(表4)或表5b中的区域b1至区域b28组成的组。表5b:可以使用本发明的寡核苷酸靶向的seqidno1区域在一些实施例中,本发明的寡核苷酸包含长度为12个至60个的核苷酸,诸如长度为13个至50个、诸如14个至35个、诸如15个至30个、诸如16个至20个的连续核苷酸,或由其组成。在优选的实施例中,寡核苷酸包含长度为15个、16个、17个、18个、19个或20个的核苷酸或由其组成。在一些实施例中,与靶核酸互补的寡核苷酸的连续核苷酸序列包含长度为12个至30个,诸如13个至25个、诸如15个至23个、诸如16个至22个的连续核苷酸,或由其组成。在一些实施例中,与靶核酸互补的sirna或shrna的连续核苷酸序列包含长度为18个至28个,诸如19个至26个、诸如20个至24个、诸如21个至23个的连续核苷酸,或由其组成。在一些实施例中,与靶核酸互补的单链反义寡核苷酸的连续核苷酸序列包含长度为12个至22个,诸如14个至20个、诸如16个至20个、诸如15个至21个、诸如15个至18个、诸如16个至18个、诸如16个至17个的连续核苷酸,或由其组成。在一些实施例中,寡核苷酸或连续核苷酸序列包含的序列选自由表6(“材料和方法”章节)中所列序列组成的组,或由其组成。在一些实施例中,寡核苷酸或连续核苷酸序列包含长度为10个至30个的核苷酸或由其组成,与选自由seqidno:22至seqidno:237组成的组的序列(参见表6中所列的基序序列)至少90%的同一性,优选地100%的同一性。在一个特定的实施例中,寡核苷酸或连续核苷酸序列选自seqidno:22、seqidno:23、seqidno:24、seqidno:25、seqidno:26、seqidno:27、seqidno:28、seqidno:29、seqidno:32、seqidno:35、seqidno:36、seqidno:37、seqidno:38、seqidno:39、seqidno:40、seqidno:41、seqidno:42、seqidno:42、seqidno:42、seqidno:43、seqidno:43、seqidno:46、seqidno:49、seqidno:83、seqidno:109、seqidno:130、seqidno:203和seqidno:232。应当理解的是,可以修饰邻接寡核苷酸序列(基序序列)以例如增加核酸酶抗性和/或对靶核酸的结合亲和力。将修饰的核苷(例如高亲和力修饰的核苷)掺入寡核苷酸序列中的模式通常称为寡核苷酸设计。本发明的寡核苷酸可以使用修饰的核苷和rna核苷(特别是用于sirna和shrna分子)或dna核苷(特别是用于单链反义寡核苷酸)设计。优选地,使用高亲和力修饰的核苷。在一个实施例中,寡核苷酸包含至少1个修饰的核苷,诸如至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个或至少16个修饰的核苷。在一个实施例中,寡核苷酸包含1个至10个修饰的核苷,诸如2个至9个修饰的核苷、诸如3个至8个修饰的核苷、诸如4个至7个修饰的核苷、诸如6个或7个修饰的核苷。合适的修饰在“定义”章节的“修饰的核苷”、“高亲和力修饰的核苷”、“糖修饰”、“2′糖修饰”和“锁定的核酸(lna)”下进行了描述。在一个实施例中,寡核苷酸包含一个或多个糖修饰的核苷,例如2’糖修饰的核苷。优选地,本发明的寡核苷酸包含一个或多个2’糖修饰的核苷,其独立地选自2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna、2'-氨基-dna、2'-氟-dna、阿拉伯糖核酸(ana)、2'-氟-ana和lna核苷。如果一个或多个修饰的核苷是锁定的核酸(lna),则是优选的。在另一个实施例中,寡核苷酸包含至少一个修饰的核苷间键。合适的核苷间修饰描述于“定义”章节的“修饰的核苷间键”下。如果在寡核苷酸的5’或3’端的至少2个至3个核苷间键是硫代磷酸酯核苷间键,则是优选的。对于单链反义寡核苷酸,如果连续核苷酸序列内的至少75%(诸如所有)的核苷间键是硫代磷酸酯核苷间键,则是优选的。在一些实施例中,单链反义寡核苷酸的邻接序列中的所有核苷酸间键是硫代磷酸酯键。在一些实施例中,本发明的寡核苷酸包含至少一个lna核苷,诸如1个、2个、3个、4个、5个、6个、7个或8个lna核苷,诸如2个至6个lna核苷,诸如3个至7个lna核苷、4个至8个lna核苷或3个、4个、5个、6个、7个或8个lna核苷。在一些实施例中,寡核苷酸中至少75%的修饰的核苷是lna核苷,诸如80%、诸如85%、诸如90%的修饰的核苷是lna核苷。在另一个实施例中,寡核苷酸中所有修饰的核苷均为lna核苷。在另一个实施例中,寡核苷酸可同时包含β-d-氧基-lna和以下lna核苷中的一个或多个:硫代-lna、氨基-lna、氧基-lna、scet和/或ena,或为β-d构型或为α-l构型或其组合。在另一个实施例中,所有lna胞嘧啶单元均为5-甲基胞嘧啶。对于寡核苷酸或连续核苷酸序列的核酸酶稳定性而言,优选的是在核苷酸序列的5’端具有至少1个lna核苷并且在核苷酸序列的3’端具有至少2个lna核苷。在本发明的一个实施例中,本发明的寡核苷酸能够募集rna酶h。在本发明中,优选的结构设计是如“定义”章节中,例如在“缺口聚体”、“lna缺口聚体”和“moe缺口聚体”下描述的缺口聚体设计。在本发明中,如果本发明的反义寡核苷酸是具有f-g-f’设计的缺口聚体,则是优选的。在一些实施例中,缺口聚体是具有均匀侧翼的lna缺口聚体。在本发明的一些实施例中,lna缺口聚体选自以下均匀的侧翼设计:2-12-3、4-14-2、3-10-3、3-9-3、2-15-2、2-12-4、1-13-2、3-13-2、4-13-2、2-12-2、3-12-2、3-15-2、3-14-2、3-13-3、2-14-4、3-12-3、1-14-3、3-14-3、2-14-3、2-15-3、3-11-3、1-12-3、1-11-4、1-13-2、2-13-2、2-16-2、1-14-2、1-17-3和1-18-2。表6(“材料和方法”章节)列出了每一个基序序列的优选设计。在所有情况下,f-g-f’设计还可包括区域d’和/或d”,如“定义”章节中“寡核苷酸中的区域d’或d””下所述。在一些实施例中,本发明的寡核苷酸在缺口聚体区域的5’或3’端具有1个、2个或3个磷酸二酯联接的核苷单元,例如dna单元。在一些实施例中,本发明的寡核苷酸由两个5’磷酸二酯联接的dna核苷和随后的如“定义”章节中所定义的f-g-f’缺口聚体区域组成。在5’或3’端含有磷酸二酯联接的dna单元的寡核苷酸适用于缀合,并且可以进一步包含本文所述的缀合物部分。对于递送至肝脏,asgpr靶向部分作为缀合物部分是特别优选的。对于本发明的一些实施例,寡核苷酸选自具有cmp-id-no:22_1、cmp-id-no:23_1、cmp-id-no:24_1、cmp-id-no:25_1、cmp-id-no:cmp-id-no:26_1、cmp-id-no:27_1、cmp-id-no:28_1、cmp-id-no:29_1、cmp-id-no:30_1、cmp-id-no:31_1、cmp-id-no:32_1、cmp-id-no:cmp-id-no:33_1、cmp-id-no:34_1、cmp-id-no:35_1、cmp-id-no:36_1、cmp-id-no:37_1、cmp-id-no:38_1、cmp-id-no:39_1、cmp-id-no:40_1、cmp-id-no:41_1、cmp-id-no:42_1、cmp-id-no:42_2、cmp-id-no:42_3、cmp-id-no:43_1、cmp-id-no:43_2、cmp-id-no:44_1、cmp-id-no:45_1、cmp-id-no:46_1、cmp-id-no:47_1、cmp-id-no:48_1、cmp-id-no:49_1、cmp-id-no:130_1、cmp-id-no:109_1、cmp-id-no:83_1、cmp-id-no:203_1和cmp-id-no:232_1的寡核苷酸化合物组成的组(参见表6)。缀合因为hbv感染主要影响肝脏中的肝细胞,所以将rtel1抑制剂缀合至缀合物部分是优选的,与未缀合的抑制剂相比,缀合物部分将增加抑制剂向肝脏的递送。在一个实施例中,肝靶向部分选自能够结合脱唾液酸糖蛋白受体(asgpr)的胆固醇或其他脂质或缀合物部分。在一些实施例中,本发明提供了缀合物,其包含共价附接于缀合物部分的本发明的核酸分子。脱唾液酸糖蛋白受体(asgpr)缀合物部分包含一种或多种能够以等于或大于半乳糖的亲和力结合脱唾液酸糖蛋白受体(asgpr靶向部分)的碳水化合物部分。许多半乳糖衍生物对脱唾液酸糖蛋白受体的亲和力已经进行过研究(例如:jobst,s.t.和drickamer,k.jb.c.1996,271,6686)或使用本领域典型的方法容易地确定。在一个实施例中,缀合物部分包含至少一个选自由半乳糖、半乳糖胺、n-甲酰基-半乳糖胺、n-乙酰半乳糖胺、n-丙酰基-半乳糖胺、n-正丁酰基-半乳糖胺和n-异丁酰基半乳糖胺组成的组的脱唾液酸糖蛋白受体靶向部分。优选地,脱唾液酸糖蛋白受体靶向部分是n-乙酰半乳糖胺(galnac)。为了生成asgpr缀合物部分,可以将aspgr靶向部分(优选地galnac)附接于缀合物支架上。通常,asgpr靶向部分可以在支架的相同端。在一个实施例中,缀合物部分由联接至间隔物的二至四个末端galnac部分组成,所述间隔物将每一个galnac部分联接至可与反义寡核苷酸缀合的支链分子。在另一个实施例中,缀合物部分相对于脱唾液酸糖蛋白受体靶向部分为一价、二价、三价或四价。优选地,脱唾液酸糖蛋白受体靶向部分包含n-乙酰半乳糖胺(galnac)部分。galnac缀合物部分可包括例如那些wo2014/179620和wo2016/055601和pct/ep2017/059080(通过引用并入本文)中所述的缀合物部分,以及附接有galnac部分的小肽,例如tyr-glu-glu-(氨基己基galnac)3(yee(ahgalnac)3;与肝细胞上脱唾液酸糖蛋白受体结合的糖三肽,参见,例如,duff等人,methodsenzymol,2000,313,297);基于赖氨酸的半乳糖簇(例如l3g4;biessen等人,cardovasc.med.,1999,214);和基于胆烷的半乳糖簇(例如,脱唾液酸糖蛋白受体的碳水化合物识别基序)。可以使用本领域已知的方法将asgpr缀合物部分,特别是三价galnac缀合物部分附接于寡核苷酸的3’端或5’端。在一实施例中,asgpr缀合物部分联接至寡核苷酸的5′端。在一个实施例中,缀合物部分是三价n-乙酰半乳糖胺(galnac),例如图1所示,特别是如图1d所示。制造方法在另一方面,本发明提供了用于制造本发明的寡核苷酸的方法,该方法包括使核苷酸单元反应并由此形成包含在寡核苷酸中的共价联接的连续核苷酸单元。优选地,该方法使用亚磷酰胺化学方法(参见例如caruthers等人,1987,methodsinenzymology,第154卷,第287-313页)。在另一个实施例中,该方法进一步包括使连续核苷酸序列与缀合物部分(配体)反应以将缀合物部分共价附接于寡核苷酸。在另一方面,提供了一种用于制造本发明的组合物的方法,该方法包括将本发明的寡核苷酸或缀合寡核苷酸与药学上可接受的稀释剂、溶剂、运载体、盐和/或佐剂混合。药用盐根据本发明的化合物可以其药学上可接受的盐的形式存在。术语“药学上可接受的盐”是指保留本发明化合物的生物有效性和特性并由合适的无毒有机或无机酸或者有机或无机碱形成的常规酸加成盐或碱加成盐。酸加成盐包括例如衍生自无机酸诸如盐酸、氢溴酸、氢碘酸、硫酸、氨基磺酸、磷酸和硝酸以及那些衍生自有机酸诸如对甲苯磺酸、水杨酸、甲磺酸、草酸、琥珀酸、柠檬酸、苹果酸、乳酸、富马酸等的盐。碱加成盐包括那些衍生自铵、钾、钠和季铵氢氧化物诸如氢氧化四甲基铵的盐。为了获得改善的化合物的物理和化学稳定性、吸湿性、流动性和溶解性而将药物化合物化学修饰成盐是药物化学家众所周知的技术。例如,bastin在《有机工艺研究与发展》(organicprocessresearch&development)2000年第4期,第427-435页或ansel在以下文章中对此进行了描述:《药物剂型和药物递送系统(第六版)》(pharmaceuticaldosageformsanddrugdeliverysystems,6thed.(1995))第196和1456-1457页。例如,本文提供的化合物的药学上可接受的盐可以是钠盐。在另一方面,本发明提供了反义寡核苷酸或其缀合物的药学上可接受的盐。在一个优选的实施例中,药学上可接受的盐是钠盐或钾盐。药物组合物在另一方面,本发明提供了药物组合物,其包含任何前述寡核苷酸和/或寡核苷酸缀合物或其盐以及药学上可接受的稀释剂、运载体、盐和/或佐剂。药学上可接受的稀释剂包括磷酸盐缓冲盐水(pbs),而药学上可接受的盐包括但不限于钠盐和钾盐。在一些实施例中,药学上可接受的稀释剂是无菌磷酸盐缓冲盐水。在一些实施例中,寡核苷酸以50-300μm溶液的浓度在药学上可接受的稀释剂中使用。用于本发明的合适的制剂可见于《雷明顿药物科学(第十七版)》(remington'spharmaceuticalsciences,mackpublishingcompany,philadelphia,pa.,17thed.,1985)中。对于药物递送方法的简要综述,参见例如langer(science249:1527-1533,1990)。wo2007/031091(通过引用并入本文)提供了药学上可接受的稀释剂、运载体和佐剂的其他合适的和优选的实例。wo2007/031091中也提供了合适的剂量、制剂、施用途径、组合物、剂型、与其他治疗剂的组合、前药制剂。在一些实施例中,本发明的寡核苷酸或寡核苷酸缀合物或其药学上可接受的盐为固体形式,诸如粉末,诸如冻干粉末。可以将本发明的化合物、寡核苷酸或寡核苷酸缀合物与药学上可接受的活性或惰性物质混合以制备药物组合物或制剂。药物组合物的组成和配制方法取决于许多标准,包括但不限于施用途径、疾病程度或施用剂量。这些组合物可以通过常规的灭菌技术进行灭菌,或者可以进行无菌过滤。所得的水溶液可以包装后直接使用或冻干,在施用前将冻干的制剂与无菌水性运载体混合。制剂的ph通常为介于3至11之间,更优选地介于5和9之间或介于6和8之间,并且最优选地介于7和8之间,诸如7至7.5。可以将固体形式的所得组合物包装在多个单剂量单元中,每一个单元包含固定量的一种或多种上述试剂,诸如在片剂或胶囊的密封包装中。固体形式的组合物也可以灵活的量包装在容器中,诸如在设计用于局部适用的乳膏或软膏的可挤压管中。在一些实施例中,本发明的寡核苷酸或寡核苷酸缀合物是前药。特别地,对于寡核苷酸缀合物,一旦前药被递送至作用位点例如靶细胞,缀合物部分就从寡核苷酸上裂解下来。施用本发明的化合物、寡核苷酸、寡核苷酸缀合物或药物组合物可以局部施用(诸如施用至皮肤、吸入、眼部或耳部)或肠内施用(诸如口服或通过胃肠道施用)或肠胃外施用(诸如静脉内、皮下、肌肉内、脑内、脑室内或鞘内施用)。在优选的实施例中,本发明的寡核苷酸或药物组合物通过肠胃外途径施用,包括静脉内、动脉内、皮下、腹膜内或肌肉内注射或输注,鞘内或颅内,例如脑内或脑室内、玻璃体内施用。在一个实施例中,活性寡核苷酸或寡核苷酸缀合物通过静脉内施用。在另一个实施例中,将活性寡核苷酸或寡核苷酸缀合物通过皮下施用。在一些实施例中,本发明的寡核苷酸、寡核苷酸缀合物或药物组合物以0.1–15mg/kg,诸如0.2–10mg/kg、诸如0.25–5mg/kg的剂量施用。施用可以是每周一次、每二周一次、每三周一次或甚至每月一次。本发明还提供了如所述的本发明的寡核苷酸或寡核苷酸缀合物在制备药物中的用途,其中所述药物处于用于皮下施用的剂型中。联合疗法在一些实施例中,本发明的抑制剂诸如本发明的化合物、寡核苷酸、寡核苷酸缀合物或药物组合物用于与另一种治疗剂的联合治疗。治疗剂可以例如是上述疾病或病症的护理标准。举例来说,本发明的寡聚物或寡聚物缀合物可以与其他活性物质联合使用,诸如基于寡核苷酸的抗病毒药(诸如基于序列特异性寡核苷酸的抗病毒剂),其通过反义(包括其他lna寡聚物)、sirna(诸如arc520)、适体、吗啉代物或任何其他抗病毒毒药,核苷酸序列依赖性作用模式作用。作为进一步的实例,本发明的寡聚物或寡聚物缀合物可以与其他活性物质,诸如免疫刺激性抗病毒化合物,诸如干扰素(例如聚乙二醇化干扰素α)、tlr7激动剂(例如gs-9620)或治疗性疫苗联合使用。作为进一步的实例,本发明的寡聚物或寡聚物缀合物可以与具有抗病毒活性的其他活性物质诸如小分子联合使用。这些其他活性物质可以是例如核苷/核苷酸抑制剂(例如恩替卡韦或富马酸替诺福韦二吡呋酯酯)、衣壳化抑制剂、进入抑制剂(例如myrcludexb)。在某些实施例中,另外的治疗剂可以是hbv剂、丙型肝炎病毒(hcv)剂、化疗剂、抗生素、镇痛剂、非甾体抗炎(nsaid)剂、抗真菌剂、抗寄生虫剂、止吐剂、抗腹泻剂或免疫抑制剂。特别地,相关的实施例中,另外的hbv剂可以是干扰素α-2b、干扰素α-2a和干扰素αcon-1(聚乙二醇化和非聚乙二醇化)、利巴韦林;hbvrna复制抑制剂;第二反义寡聚物;hbv治疗性疫苗;hbv预防性疫苗;拉米夫定(3tc);恩替卡韦(etv);富马酸替诺福韦二吡呋酯酯(tdf);替比夫定(ldt);阿德福韦;或hbv抗体疗法(单克隆或多克隆)。在其他特定的相关实施例中,另外的hcv剂可以是干扰素α-2b、干扰素α-2a和干扰素αcon-1(聚乙二醇化和非聚乙二醇化);利巴韦林;pegasys;hcvrna复制抑制剂(例如viropharma的vp50406系列);hcv反义剂;hcv治疗性疫苗;hcv蛋白酶抑制剂;hcv解旋酶抑制剂;或hcv单克隆或多克隆抗体疗法。应用本发明的寡核苷酸可作为研究试剂使用,例如用于诊断、治疗和预防。在研究中,此类寡核苷酸可用于特异性调节细胞(例如体外细胞培养物)和实验动物中rtel1蛋白的合成,从而有助于靶标的功能分析或对其作为治疗干预靶标的可用性的评估。通常,通过降解或抑制产生蛋白质的mrna从而防止蛋白质形成,或通过降解或抑制产生蛋白质的基因或mrna来实现靶标调节。如果在研究或诊断中采用本发明的寡核苷酸,则靶核酸可以是cdna或衍生自dna或rna的合成核酸。本发明还包括在体内或体外调节表达rtel1的靶细胞中rtel1表达的方法,所述方法包括以有效量向所述细胞施用本发明的寡核苷酸、缀合化合物或药物组合物。在一些实施例中,靶细胞是哺乳动物细胞,特别是人细胞。靶细胞可以是形成哺乳动物组织的一部分的体外细胞培养物或体内细胞。在优选的实施例中,靶细胞存在于肝脏中。靶细胞可以是肝细胞。本发明的一个方面涉及用作药物的本发明的寡核苷酸、缀合化合物或药物组合物。在本发明的一个方面,本发明的寡核苷酸、缀合化合物或药物组合物能够降低感染的细胞中的cccdna水平,并因此抑制hbv感染。特别地,反义寡核苷酸能够影响以下参数中的一个或多个:i)减少cccdna和/或ii)减少pgrna和/或iii)减少hbvdna和/或iv)减少感染的细胞中的hbv病毒抗原。例如,抑制hbv感染的核酸分子可以i)与对照物相比,将感染的细胞中的cccdna水平降低至少40%,诸如降低50%、60%、70%、80%或90%;或ii)与对照物相比,将pgrna的水平降低至少40%,诸如降低50%、60%、70%、80%或90%。对照物可以是未处理的细胞或动物,或用适当的对照物处理的细胞或动物。hbv感染的抑制作用可以在体外使用hbv感染的原代人肝细胞进行测量,或在体内使用人源化肝细胞pxb小鼠模型(可从phoenixbio获得,也参见kakuni等人,2014int.j.mol.sci.15:58-74)进行测量。对hbsag和/或hbeag分泌的抑制可以通过elisa测定,例如使用cliaelisa试剂盒(autobiodiagnostic)根据制造商的说明进行。细胞内cccdna或hbvmrna和pgrna的减少可通过qpcr测定,例如,如“材料和方法”章节所述。评估测试化合物是否抑制hbv感染的其他方法是通过例如wo2015/173208中所述的qpcr测量hbvdna的分泌,或使用northern印迹杂交、原位杂交或免疫荧光测量。由于rtel1水平的降低,本发明的寡核苷酸、缀合化合物或药物组合物可用于抑制hbv感染的发展或治疗hbv感染。特别地,与仅减少hbsag分泌的化合物相比,本发明的寡核苷酸、缀合化合物或药物组合物对cccdna的去稳定化和减少作用更有效地抑制了慢性hbv感染的发展或治疗慢性hbv感染。因此,本发明的一个方面涉及本发明的寡核苷酸、缀合化合物或药物组合物用于减少hbv感染者中的cccdna和/或pgrna的用途。本发明的另一方面涉及本发明的寡核苷酸、缀合化合物或药物组合物在抑制慢性hbv感染的发展或治疗慢性hbv感染中的用途。本发明的另一方面涉及本发明的寡核苷酸、缀合化合物或药物组合物在降低hbv感染的人的传染性中的用途。在本发明的一个特定方面,本发明的寡核苷酸、缀合化合物或药物组合物抑制慢性hbv感染的发展。用本发明的寡核苷酸、缀合化合物或药物组合物治疗(或预防性地接受本发明的反义寡核苷酸、缀合化合物或药物组合物)的受试者优选为人,更优选地为hbsag阳性和/或hbeag阳性的人类患者,甚至更优选地为hbsag阳性和hbeag阳性的人类患者。因此,本发明涉及一种治疗hbv感染的方法,其中该方法包括施用有效量的本发明的寡核苷酸、缀合化合物或药物组合物。本发明还涉及预防由慢性hbv感染引起的肝硬化和肝细胞癌的方法。本发明还提供了本发明的寡核苷酸、缀合化合物或药物组合物在制备药物,特别是用于治疗hbv感染或慢性hbv感染或降低hbv感染之人的传染性的药物中的用途。在优选的实施例中,药物被制成用于皮下施用的剂型。本发明还提供了本发明的寡核苷酸、缀合化合物、药物组合物在制备药物中的用途,其中所述药物为用于静脉内施用的剂型。本发明的寡核苷酸、缀合化合物或药物组合物可以用于联合疗法。例如,可以将本发明的寡核苷酸、缀合物或药物组合物可与其他抗hbv试剂诸如干扰素α-2b、干扰素α-2a和干扰素αcon-1(聚乙二醇化和非聚乙二醇化)、利巴韦林、拉米夫定(3tc)、恩替卡韦、替诺福韦、替比夫定(ldt)、阿德福韦或其他新兴的抗hbv药物诸如hbvrna复制抑制剂、hbsag分泌抑制剂、hbv衣壳抑制剂、反义寡聚物(例如,如wo2012/145697、wo2014/179629和wo2017/216390中所述)、sirna(例如,在wo2005/014806、wo2012/024170、wo2012/2055362、wo2013/003520、wo2013/159109、wo2017/027350和wo2017/015175中所述)、hbv治疗性疫苗、hbv预防性疫苗、hbv抗体治疗(单克隆或多克隆)或tlr2、3、7、8或9激动剂联合来治疗和/或预防hbv。本发明的实施例本发明的以下实施例可以与本文描述的任何其他实施例联合使用。1.一种rtel1抑制剂,用于在乙型肝炎病毒(hbv)感染的治疗和/或预防中的用途。2.用于如实施例1所述用途的rtel1抑制剂,其中rtel1抑制剂以有效量施用。3.用于如实施例1或2所述用途的rtel1抑制剂,其中hbv感染是慢性感染。4.用于如实施例1至3所述用途的rtel1抑制剂,其中rtel1抑制剂能够减少感染细胞中的cccdna和/或pgrna。5.用于如实施例1至4中任一项所述用途的rtel1抑制剂,其中rtel1抑制剂防止或减少rtel1与dna诸如cccdna的结合。6.用于如实施例5所述用途的rtel1抑制剂,其中所述抑制剂是特异性结合至rtel1蛋白的小分子,其中所述抑制剂防止或减少rtel1蛋白与cccdna的结合。7.用于如实施例1至5中任一项所述用途的rtel1抑制剂,其中所述抑制剂是长度为12-60个核苷酸的寡核苷酸,其包含长度为至少10个核苷酸的连续核苷酸序列或由其组成,所述连续核苷酸序列与哺乳动物rtel1靶核酸至少90%互补。8.用于如实施例7所述用途的rtel1抑制剂,其能够降低rtel1靶核酸的水平。9.用于如实施例7或8所述用途的rtel1抑制剂,其中靶核酸是rna。10.用于如实施例9所述用途的rtel1抑制剂,其中rna是前体mrna。11.用于如实施例7至10中任一项所述用途的rtel1抑制剂,其中寡核苷酸选自反义寡核苷酸、sirna或shrna。12.用于如实施例11所述用途的rtel1抑制剂,其中寡核苷酸是单链反义寡核苷酸或双链sirna。13.用于如实施例7至12中任一项所述用途的rtel1抑制剂,其中哺乳动物rtel1靶核酸选自seqidno:1或seqidno:2。14.用于如实施例7至12中任一项所述用途的rtel1抑制剂,其中寡核苷酸的连续核苷酸序列与seqidno:1和seqidno:2的靶核酸至少98%互补。15.用于如实施例1至14中任一项所述用途的rtel1抑制剂,其中与对照物相比,hbv感染的细胞中的cccdna降低了至少50%,诸如60%、诸如70%、诸如80%、诸如90%、诸如95%、诸如100%。16.用于如实施例7至15中任一项所述用途的寡核苷酸,其中与对照物相比,rtel1mrna降低了至少50%,诸如60%、诸如70%、诸如80%、诸如90%、诸如95%、诸如100%。17.一种长度为12个至60个核苷酸的寡核苷酸,其包含长度为12个至30个核苷酸的连续核苷酸序列或由其组成,其中连续核苷酸序列与哺乳动物rtel1靶核酸至少90%,诸如95%、诸如98%、诸如完全互补。18.如实施例17所述的寡核苷酸,其中寡核苷酸是化学产生的。19.如实施例17或18所述的寡核苷酸,其中哺乳动物rtel1靶核酸选自seqidno:1或seqidno:2。20.如实施例17或18所述的寡核苷酸,其中连续核苷酸序列与seqidno:1和seqidno:2的靶核酸至少98%互补。21.如实施例17至20中任一项所述的寡核苷酸,其中寡核苷酸的长度为12个至30个核苷酸。22.如实施例17至21中任一项所述的寡核苷酸,其中寡核苷酸是rnai分子,诸如双链sirna或shrna23.如实施例17至21中任一项所述的寡核苷酸,其中寡核苷酸是单链反义寡核苷酸。24.如实施例17至23中任一项所述的寡核苷酸,其中连续核苷酸序列与选自seqidno:3至seqidno:21的靶序列(表4)互补。25.如实施例17至24所述的寡核苷酸,其能够以低于-15kcal的δg°与seqidno:1和seqidno:2的靶核酸杂交。26.如实施例17至25中任一项所述的寡核苷酸,其中连续核苷酸序列包含至少14个连续核苷酸,特别是15个、16个、17个、18个、19个、20个、21个或22个连续核苷酸或由其组成。27.如实施例17至25中任一项所述的寡核苷酸,其中连续核苷酸序列包含14个至22个核苷酸或由其组成。28.如实施例27所述的寡核苷酸,其中连续核苷酸序列包含16个至20个核苷酸或由其组成。29.如实施例17至28中任一项所述的寡核苷酸,其中寡核苷酸包含长度为14个至25个核苷酸或由其组成。30.如实施例29所述的寡核苷酸,其中寡核苷酸包含长度为16个至22个核苷酸或由其组成。31.如实施例17至30中任一项所述的寡核苷酸,其中寡核苷酸包含选自seqidno:22-seqidno:237的序列。32.如实施例17至31中任一项所述的寡核苷酸,其中较之于与其互补的靶核酸,连续核苷酸序列具有零至三个错配。33.如实施例32所述的寡核苷酸,其中与靶核酸相比,连续核苷酸序列具有一个错配。34.如实施例32所述的寡核苷酸,其中与靶核酸相比,连续核苷酸序列具有两个错配。35.如实施例32所述的寡核苷酸,其中连续核苷酸序列与两个靶核酸序列完全互补。36.如实施例17至35所述的寡核苷酸,其包含一个或多个修饰的核苷。37.如实施例36所述的寡核苷酸,其中一个或多个修饰的核苷是高亲和力修饰的核苷。38.如实施例36或37所述的寡核苷酸,其中一个或多个修饰的核苷是2’糖修饰的核苷。39.如实施例38所述的寡核苷酸,其中一个或多个2’糖修饰的核苷独立地选自由2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna、2'-氨基-dna、2'-氟-dna、2'-氟-ana和lna核苷组成的组。40.如实施例36至39所述的寡核苷酸,其中一个或多个修饰的核苷是lna核苷。41.如实施例40所述的寡核苷酸,其中修饰的lna核苷选自氧基-lna、氨基-lna、硫代-lna、cet和ena。42.如实施例40或41所述的寡核苷酸,其中修饰的lna核苷是具有以下2′-4′桥-o-ch2-的氧基-lna。43.如实施例42所述的寡核苷酸,其中氧基-lna是β-d-氧基-lna。44.如实施例40或41所述的寡核苷酸,其中修饰的lna核苷是具有以下2’-4’桥-o-ch(ch3)-的cet。45.如实施例44所述的寡核苷酸,其中cet是(s)cet,即6’(s)甲基-β-d-氧基-lna。46.如实施例40或41所述的寡核苷酸,其中lna是ena,具有以下2′–4′桥-o-ch2-ch2-。47.如实施例17至46中任一项所述的寡核苷酸,其中寡核苷酸包含至少一个修饰的核苷间键。48.如实施例47所述的寡核苷酸,其中修饰的核苷间键是核酸酶抗性的。49.如实施例47或48所述的寡核苷酸,其中修饰的核苷间键是硫代磷酸酯核苷间键。50.如实施例17至49中任一项所述的寡核苷酸,其中寡核苷酸是能够募集rna酶h的反义寡核苷酸。51.如实施例50所述的反义寡核苷酸,其中反义寡核苷酸或连续核苷酸序列是缺口聚体。52.如实施例51所述的反义寡核苷酸,其中反义寡核苷酸或其连续核苷酸序列包含式5'-f-g-f'-3’的缺口聚体或由其组成,其中区域f和f’独立地包括1-4个2’糖修饰的核苷或由其组成,并且g是介于6个至18个核苷之间的能够募集rna酶h的区域。53.如实施例52所述的反义寡核苷酸,其中2’糖修饰的核苷独立地选自由2'-o-烷基-rna、2'-o-甲基-rna、2'-烷氧基-rna、2'-o-甲氧基乙基-rna、2'-氨基-dna、2'-氟-dna、阿拉伯糖核酸(ana)、2'-氟-ana和lna核苷组成的组。54.如实施例52或53所述的反义寡核苷酸,其中区域f和f′中的2′糖修饰的核苷中的一个或多个是lna核苷55.如实施例54所述的反义寡核苷酸,其中区域f和f′中的所有2′糖修饰的核苷均为lna核苷。56.如实施例53至55所述的寡核苷酸,其中lna核苷选自β-d-氧基-lna、α-l-氧基-lna、β-d-氨基-lna、α-l-氨基-lna、β-d-硫代-lna、α-l-硫代-lna、(s)cet、(r)cetβ-d-ena和α-l-ena。57.如实施例53至56所述的反义寡核苷酸,其中区域f和f′由相同的lna核苷组成。58.如实施例53至57所述的反义寡核苷酸,其中区域f和f′中所有的2′糖修饰的核苷均为氧基-lna核苷。59.如实施例52至58中任一项所述的反义寡核苷酸,其中区域g中的核苷是dna和/或α-l-lna核苷。60.如实施例59所述的反义寡核苷酸,其中区域g由至少75%的dna核苷组成。61.如实施例60所述的反义寡核苷酸,其中区域g中的所有核苷都是dna核苷。62.如实施例17至62中任一项所述的寡核苷酸,其中寡核苷酸选自cmpidno:22_1、cmpidno:23_1、cmpidno:24_1、cmpidno:25_1、cmpidno:26_1、cmpidno:27_1、cmpidno:28_1、cmpidno:29_1、cmpidno:30_1、cmpidno:31_1、cmpidno:32_1、cmpidno:33_1、cmpidno:34_1、cmpidno:35_1、cmpidno:36_1、cmpidno:37_1、cmpidno:38_1、cmpidno:39_1、cmpidno:40_1、cmpidno:41_1、cmpidno:42_1、cmpidno:42_2、cmpidno:42_3、cmpidno:43_1、cmpidno:43_2、cmpidno:44_1、cmpidno:45_1、cmpidno:46_1、cmpidno:49_1、cmpidno:130_1、cmpidno:109_1、cmpidno:83_1、cmpidno:203_1和cmpidno:232_1,或其药学上可接受的盐。63.一种缀合化合物,其包含根据实施例17至50中任一项所述的寡核苷酸或根据实施例51至62中任一项所述的反义寡核苷酸,以及至少一个共价附接于所述反义寡核苷酸的缀合物部分。64.如实施例63所述的缀合化合物,其中寡核苷酸是双链sirna,并且缀合物部分共价附接于sirna的正义链。65.如实施例63或64所述的缀合化合物,其中缀合物部分选自碳水化合物、细胞表面受体配体、药物、激素、亲脂性物质、聚合物、蛋白质、肽、毒素、维生素、病毒蛋白或其组合。66.如实施例63至65中任一项所述的缀合化合物,其中缀合物部分能够与脱唾液酸糖蛋白受体结合。67.如实施例66所述的缀合化合物,其中缀合物部分包含至少一个选自由半乳糖、半乳糖胺、n-甲酰基-半乳糖胺、n-乙酰半乳糖胺、n-丙酰基-半乳糖胺、n-正丁酰基-半乳糖胺和n-异丁酰基半乳糖胺组成的组的脱唾液酸糖蛋白受体靶向部分。68.如实施例67所述的缀合化合物,其中脱唾液酸糖蛋白受体靶向部分是n-乙酰半乳糖胺(galnac)。69.如实施例67或68所述的缀合化合物,其中缀合物部分相对于脱唾液酸糖蛋白受体靶向部分为一价、二价、三价或四价。70.如实施例69所述的缀合化合物,其中缀合物部分由两个至四个末端galnac部分和将每一个galnac部分联接至可与反义化合物缀合的支链分子的间隔物组成。71.如实施例70所述的缀合化合物,其中间隔物是peg间隔物。72.如根据实施例66至71所述的缀合化合物,其中缀合物部分是三价n-乙酰半乳糖胺(galnac)部分。73.如实施例66至72所述的缀合化合物,其中缀合物部分选自图1中的三价galnac部分之一。74.如实施例73所述的缀合化合物,其中缀合物部分是图1d中的三价galnac部分。75.如实施例63至74所述的缀合化合物,其包含位于寡核苷酸或反义寡核苷酸与缀合物部分之间的接头。76.如实施例75所述的缀合化合物,其中接头是生理上不稳定的接头。77.如实施例76所述的缀合化合物,其中生理上不稳定的接头是核酸酶敏感的接头。78.如实施例76或77所述的寡核苷酸缀合物,其中生理上不稳定的接头由2个至5个连续的磷酸二酯键组成。79.如实施例66至78所述的缀合化合物,其显示改善了在肝脏(相比于肾脏)之间的细胞分布,或者与未缀合的寡核苷酸或反义寡核苷酸相比,改善了肝脏对所述缀合化合物的细胞吸收。80.一种药物组合物,其包含根据实施例17至50中任一项所述的寡核苷酸或根据实施例51至61中任一项所述的反义寡核苷酸、如实施例63至79所述的缀合化合物或其可接受的盐,以及药学上可接受的稀释剂、运载体、盐和/或佐剂。81.一种识别预防、改善和/或抑制乙型肝炎病毒(hbv)感染的化合物的方法,包括:a.将测试化合物与i.rtel1多肽或ii.表达rtel1的细胞接触;b.在存在和不存在所述测试化合物的情况下,测量rtel1的表达和/或活性;以及c.识别降低rtel1表达和/或活性并减少cccdna的化合物。82.一种用于调节表达rtel1的靶细胞中rtel1表达的体内或体外方法,所述方法包括向所述细胞施用有效量的如实施例17至50中任一项所述的寡核苷酸或如实施例51至61中任一项所述的反义寡核苷酸、如实施例63至79所述的缀合化合物或如实施例80所述的药物组合物。83.如实施例82所述的方法,其中与未经任何处理或经对照物处理的水平相比,靶细胞中的rtel1表达降低了至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或至少95%。84.如实施例82所述的方法,其中以hbv感染靶细胞,并且与未经任何处理或经对照物处理的hbv感染的靶细胞中的水平相比,hbv感染的靶细胞中的cccdna减少了至少50%、或至少60%、或至少70%、或至少80%、或至少90%、或至少95%。85.一种治疗或预防疾病的方法,其包括向患有或易患该疾病的受试者施用治疗或预防有效量的如实施例17至50中任一项所述的寡核苷酸或如实施例51至61中任一项所述的反义寡核苷酸、如实施例63至79所述的缀合化合物或如实施例80所述的药物组合物。86.如实施例17至50中任一项所述的寡核苷酸或如实施例51至61中任一项所述的反义寡核苷酸,或如实施例63至79中任一项所述的缀合化合物或如实施例80所述的药物组合物,用作治疗或预防受试者疾病的药物。87.如实施例17至50中任一项所述的寡核苷酸或如实施例51至61中任一项所述的反义寡核苷酸,或如实施例63至79中任一项所述的缀合化合物在制备用于治疗或预防受试者疾病的药物中的用途。88.如实施例85至87所述的方法、寡核苷酸、反义寡核苷酸、缀合物或用途,其中受试者是哺乳动物。89.如实施例88所述的方法、寡核苷酸、反义寡核苷酸、缀合物或用途,其中哺乳动物是人。现在将通过以下实例说明本发明,所述实例不具有限制性。实例材料和方法寡核苷酸基序序列和寡核苷酸化合物表6:寡核苷酸基序序列(由seqidno表示)的列表,其设计以及基于基序序列设计的具体寡核苷酸化合物(由cmpidno表示)。基序序列代表寡核苷酸中存在的核碱基的邻接序列。设计参考缺口聚体设计f-g-f',其中每一个数字代表连续修饰的核苷,例如2’修饰的核苷的数目(第一个数字=5’侧翼),然后是dna核苷的数目(第二个数字=缺口区域),然后是修饰的核苷例如2’修饰的核苷的数目(第三个数字=3’侧翼),可选地在dna和lna的其他重复区域之前或之后,这些区域不一定是与靶核酸互补的邻接序列的一部分。寡核苷酸化合物代表基序序列的具体设计。大写字母代表β-d-氧基lna核苷,小写字母代表dna核苷,所有lnac均为5-甲基胞嘧啶,而且5-甲基dna胞嘧啶以“e”表示,并且所有核苷间键均为硫代磷酸酯核苷键。寡核苷酸合成寡核苷酸合成是本领域公知的。以下是可以实施的方案。就设备、载体和所用浓度而言,本发明的寡核苷酸可以通过略有变化的方法来产生。使用亚磷酰胺方法在oligomaker48上以1μmol规模在尿苷通用载体上合成寡核苷酸。合成结束时,使用氨水在60℃下将寡核苷酸从固体载体上裂解5-16小时。通过反相hplc(rp-hplc)或通过固相萃取纯化寡核苷酸,通过uplc进行表征,并通过esi-ms进一步确认分子量。寡核苷酸的延伸:通过使用5'-o-dmt保护的亚酰胺在乙腈中的0.1m溶液和dci(4,5-二氰基咪唑)在乙腈(0.25m)中用作激活剂,进行β-氰基乙基亚磷酰胺的偶联(dna-a(bz)、dna-g(ibu)、dna-c(bz)、dna-t、lna-5-甲基-c(bz)、lna-a(bz)、lna-g(dmf)或lna-t)。对于最后的循环,可以使用具有所需修饰的亚磷酰胺,例如,用于附接缀合物基团或这样的缀合物基团的c6接头。通过使用氢化黄原素(0.01m,在乙腈/吡啶9:1中)进行硫醇化以引入硫代磷酸酯键。可以使用碘在thf/吡啶/水7:2:1中的0.02m溶液引入磷酸二酯键。其余试剂是通常用于寡核苷酸合成的试剂。对于固相合成后的缀合,可以在固相合成的最后一个循环中使用可商购的c6氨基接头亚磷酰胺,并且在脱保护并从固体载体上裂解后,分离出氨基联接的脱保护的寡核苷酸。使用标准合成方法通过官能团的活化来引入缀合物。通过rp-hplc纯化:粗制化合物在phenomenexjupiterc1810μ150x10mm色谱柱上通过制备型rp-hplc纯化。0.1m醋酸铵ph8和乙腈以5ml/min的流速用作缓冲液。将收集的级分冻干以给出纯化的化合物,通常为白色固体。缩写:dci:4,5-二氰基咪唑dcm:二氯甲烷dmf:二甲基甲酰胺dmt:4,4’-二甲氧基三苯甲基thf:四氢呋喃bz:苯甲酰基ibu:异丁酰基rp-hplc:反相高效液相色谱tm测定:将寡核苷酸和rna靶标(磷酸酯联接的,po)双链体在500ml无rnase的水中稀释至3mm,并与500ml2xtm缓冲液(200mmnacl、0.2mmedta、20mm磷酸钠、ph7.0)混合。将溶液加热3分钟到95℃,然后在室温下退火30分钟。使用petemplab软件在配备有peltier温度编程器ptp6的lambda40uv/vis分光光度计(perkinelmer)上测量双链体解链温度(tm)。温度从20℃上升到95℃,然后下降到25℃,记录在260nm处的吸收。使用一阶导数以及解链和退火的局部最大值来评估双链体tm。克隆生长培养基(dhcgm)。dhcgm是dmem培养基,其包含100u/ml青霉素、100μg/ml链霉素、20mmhepes、44mmnahco3、15μg/mll-脯氨酸、0.25μg/ml胰岛素、50nm地塞米松、5ng/mlegf、0.1mmasc-2p、2%dmso和10%fbs(ishida等人,2015)。将细胞在37℃的培养箱中于具有5%co2的潮湿气氛中进行培养。接种后24小时更换培养基,并每2天更换一次直至收获。原代人肝细胞(pxb-phh)从phoenixbioco.,ltd(japan)获得从人源化小鼠(upa/scid小鼠)收获的新鲜原代人肝细胞(pxb-phh),本文称为phh。将细胞以下述细胞密度接种在胶原蛋白i包被的板上:在改良的肝细胞克隆生长培养基(dhcgm)中,35,000细胞/孔(384孔)、70,000细胞/孔(96孔)或400,000细胞/孔(24孔)。dhcgm是dmem培养基,其包含100u/ml青霉素、100μg/ml链霉素、20mmhepes、44mmnahco3、15μg/mll-脯氨酸、0.25μg/ml胰岛素、50nm地塞米松、5ng/mlegf、0.1mmasc-2p、2%dmso和10%fbs(ishida等人,2015)。将细胞在37℃的培养箱中于具有5%co2的潮湿气氛中进行培养。接种后24小时更换培养基,并每2天更换一次直至收获。hbv感染和寡核苷酸处理将phh与hbv(从chb个体纯化)一起以40的感染复数(moi)和4%peg孵育24小时;第二天除去病毒接种物。为了建立cccdna,在hbv感染后第3天开始在phh中处理化合物。每2天(实例1)补充溶解在培养基中的新鲜寡核苷酸,或在第3天、第5天、第7天和第9天补充新鲜寡核苷酸,此后每2天补充培养基(实例2)直到在第19天收获细胞。hbv抗原测量为了评估对hbv抗原表达和分泌的影响,在第19天收集了上清液。根据制造商的方案,使用cliaelisa试剂盒(autobiodiagnostic#cl0310-2,#cl0312-2)测量hbv传播参数,hbsag和hbeag水平。简而言之,将每孔25μl的上清液转移至由各自抗体包被的微量滴定板,并添加25μl的酶缀合试剂。将该板于室温下在摇床上孵育60分钟,然后使用自动洗濯器用洗涤缓冲液将孔洗涤五次。向每一个孔中添加25μl底物a和b。在使用envision发光读数器(perkinelmer)测量发光之前,将板于室温下在摇床上孵育10分钟。cck8细胞毒性测量为了评估细胞毒性对寡核苷酸处理的影响,按照“hbv感染和寡核苷酸处理”中所述的方法处理细胞,并在第18天,将phh在37℃的培养箱中于具有5%co2的潮湿气氛中预培养24小时。将10ul的cck-8溶液添加到96孔板的每一个孔中的100ul中,并孵育1-4小时。使用微板读数器(tecan)测量每一个板在450nm的吸光度,并将值计算为相对于对照物(未处理的细胞)的百分比。细胞内hbvpgrna和rtel1rna的实时pcr使用qiagenbiorobot通用系统和rneasy96孔提取板(rneasy96biorobot8000试剂盒(12)/产品目录号/id:967152),根据制造商的方案从细胞提取mrna。在abiquantstudio12kflex上使用实时pcr分析相对hbv和细胞mrna表达水平。使用taqmanfastadvancedmastermix(lifetechnologies,产品目录号4444558)通过qpcr对β-肌动蛋白(actb)和hbvpgrna进行定量,一式三份。结果相对于人actb内源性对照物进行标准化。使用比较周期阈值2-δδct方法分析mrna表达,该方法针对参考基因actb和未转染的细胞进行了标准化。表7列出了用于actbrna和hbvpgrna定量的引物。表7:actb和hbvpgrnaqpcr引物hbvcccdna定量使用sds裂解缓冲液从hbv感染的原代人肝细胞中提取dna,并使用zymoresearch基因组dna清洁和浓缩试剂盒(zymoresearch,产品目录号d4067)方案纯化。用t5核酸外切酶(newenglandbiolabs,ma,usa)消化,使用10u的t5在37℃下将500ngdna以20ul总体积消化1小时,之后测定cccdna水平。消化后,将样品稀释至50ul,其中4ul用于qpcr反应。使用比较周期阈值2-δδct方法分析mrna表达,该方法针对参考基因线粒体dna和未转染的细胞进行了标准化。实时定量聚合酶链反应测量是在quantstudio12kflexpcr系统(appliedbiosystems)上进行的。用fastsybrtmgreenmastermix(lifetechnologies,产品目录号4385612)进行qpcr。结果在表8中示出。表8:cccdnaqpcr引物。实例1:靶向rtel1的反义寡核苷酸对hbv感染的phh中hbv参数的影响在以下实验中,使用表6中的寡核苷酸化合物测试了rtel1敲低对hbv参数hbsag、hbeag、hbvpgrna和cccdna的影响。如“材料和方法”章节所述培养phh。在hbv感染后第3天,以溶解于dhcgm培养基中的最终寡核苷酸浓度10μm对细胞给药,最终培养体积为100μl/孔。实验一式三份进行,每2天补充一次寡核苷酸,并在hbv感染后第19天收获细胞。根据“材料与方法”,使用cck8测定细胞毒性,收集上清液以测量hbsag和hbeag,并分两个级分收集细胞。如“材料和方法”中所述,一个级分用于使用一种裂解缓冲液测量rtel1mrna和pgrna,另一个级分用于使用另一种裂解缓冲液测量cccdna。所有值在表9中显示为相对于对照物(未处理的细胞)的百分比,即对于rtel1mrna、cccdna和pgrna,该值越低则抑制作用越大。按照“材料和方法”章节所述测量cck8细胞毒性,以确认病毒参数的任何降低是否都不是由细胞死亡引起,该值越接近100%则毒性越低。结果如表9所示。表9:rtel1介导的cccdna降解和下游产物的抑制*rtel1和hbvpgrna已标准化为管家基因。所有测试的靶向rtel1的反义寡核苷酸均在单个测量时间点针对cccdna、pgrna、hbsag和hbeag中的至少一个参数显示靶标敲低和hbv抗病毒功效,而cck8并未观察到细胞毒性。实例2:测试了靶向rtel1的其他寡核苷酸文库对感染的phh中cccdna的影响在以下实验中,生成了靶向rtel1转录本的236个寡核苷酸的附加文库,如表6中cmpidno:50_1至cmpidno:237_1所示。测试了减少rtel1和cccdna的能力。如“材料和方法”章节所述培养phh。在hbv感染后第3天、第5天、第7天和第9天,以溶解于dhcgm培养基中的最终寡核苷酸浓度10μm对细胞给药,最终培养体积为100μl/孔。实验一式三份进行,每2天(直到第19天)补充一次培养基,并在hbv感染后第19天收获细胞。根据“材料和方法”,将细胞分为两个级分收获;一个级分用于使用一种裂解缓冲液测量rtel1mrna,另一个级分用于使用另一种裂解缓冲液测量cccdna,如“材料和方法”中所述。所有值在表10中显示为相对于对照物(未处理的细胞)的百分比,即对于rtel1mrna和cccdna,该值越低则抑制/减少作用越大。表10:寡核苷酸处理后rtel1减少和cccdna降解按照“材料和方法”章节所述测量cck8细胞毒性,以评估病毒参数的降低是否可能由细胞死亡引起,该值越接近100%则毒性越低。结果如表11所示。对于cck8相对于对照物高于80%的值,认为细胞死亡不太可能影响表10所示的rtel1和cccdna的减少。表11:cck8细胞毒性#na表示未针对所示化合物测量cck8。结果表明,文库中的236个寡核苷酸中,只有5%无法至少将rtel1或cccdna减少至相对于对照物的至少80%。由此可见,有可能产生靶向整个rtel1转录本的寡核苷酸,它们能够减少rtel1和/或cccdna,通常rtel1和cccdna的减少不是由于细胞死亡,尽管对于一些化合物可能是这种情况。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1