氟化的有机酸的新铵盐,及其合成方法和应用与流程
本发明涉及部分氟化的有机酸的新铵盐,其合成方法和部分氟化的有机酸的新铵盐的用途,特别是在生物学、生物化学和医学中的应用,以可能延长高等生物的组织或器官的保存期限,作为血液替代品制剂中的稳定剂。
衍生自琥珀酸(丁二酸)的部分氟化的羧酸是本领域已知的。在存在弱碱的情况下,通过琥珀酸酐与合适的醇类反应获得琥珀酸的氟化单酯衍生物,其中所指弱碱为例如叔碱,例如:三乙胺(et3n)或hünigs碱(n,n-二异丙基乙胺)等。
在该领域中,1987年的日本专利公开[jp01193336]公开了与1h,1h,2h,2h-十七氟-正癸醇或1h,1h,2h,2h-十三氟正辛醇反应的琥珀酸的单酯,氟化衍生物的合成与用途。
这些酸中的第一种用作合成树脂组合物中的试剂,该合成树脂组合物用作如抗雾剂-表面活性剂组合物的薄膜,该薄膜应用于玻璃表面和/或其他功能性表面上。1998年的另一个日本专利公开[jp200155935]公开了用于包含磁性数据存储介质的组合物中的相同化合物。
日本专利公开2005[jp2007070289]中公开了相同的酸及其进一步的衍生物,即含有衍生自氟化醇的单个片段和衍生自不含氟的醇的另一个片段的二酯。该文献公开了这类二酯作为表面活性剂的性质及其在组合物中作为胶凝剂的用途。
2012年的另一个日本专利公开[jp2013195630]公开了琥珀酸的不对称二酯在液晶,玻璃的反射层,窗户和汽车挡风玻璃的组合物中的用途,用作ir(红外)辐射的滤光器。
2012年的另一日本专利文献[jp2013241366]公开了一种不对称二酯衍生物,其一方面包含氟化醇基团,另一方面包含无氟醇的甾醇衍生物。这些化合物以发胶的形式用于混合物中,作为化妆品。
有机一元酸的氟化衍生物在本领域中也是已知的。其中一种有机一元酸的氟化衍生物是乙酸的硫代衍生物,其硫原子被氟化部分取代。
日本专利公开[jp2003295407和jp2002196459]公开了氟化乙酸衍生物的(锂,钠,钾的)碱金属盐。这些盐用于获得彩色和/或灰度级照相图像的材料组合物中。
1981年的美国专利公开[us4419298]公开了具有氟化乙酸衍生物的铵(二乙醇铵)盐。
该文献公开了这类化合物在用于生产防水纸和纺织品的组合物中的用途。
1995的专利公开[j.fluorinechemistry,1995,70,19-26]公开了2h,2h-全氟烷基-和2h,2h-全氟烯基羧酸及其酰胺的合成方法。2012年的专利公开[j.fluorinechemistry,2012,135,330-338;公开了由全氟化羧酸及其酯合成乙氧基化氟化表面活性剂的方法。2017年的另一专利公开[chemphyschem2017,18,1-13]公开了全氟烷基二羧酸及其酯的合成方法并研究了其性能。2014年的科学论文[fluorinechemistry2014,161,60-65;doi:10.1016/j.fluchem.2014.02.004]公开了一种新型杂化表面活性剂的合成方法和表面活性。这些表面活性剂包含两个片段,阴离子部分中的氟化片段和阳离子部分中的非氟化片段,作为叔铵盐。
在领域[us4423061]中,已知用于生产乳液的全氟化有机环烷基胺衍生物,其具有优异的性能,能够溶解和储存大量的氧气。超永久性乳液和泡沫的生产方法在[ep1960097b1]领域中也是已知的。
在该领域中,存在已知的离子表面活性剂,其被批准用于药物中(r.c.rowe;p.j.sheskey;s.c.owen“handbookofpharmaceuticalexcipients第六版”,2009年)。这种离子表面活性剂包括:(i)苯扎氯铵,(ii)苄索氯铵,(iii)十六烷基吡啶鎓氯化物,(iv)十六烷基三甲基溴化铵,(v)双(2-乙基己基)磺基琥珀酸钠,(vi)十二烷基硫酸钠,(vii)磷脂衍生物(磷脂酰胆碱、磷脂酰甘油、磷脂酰胺等)和(viii)乳化阴离子蜡(含有鲸蜡硬脂醇衍生物)。没有全氟链的离子表面活性剂会导致纳米乳剂的稳定性降低或形成效率不高。
本领域仍然需要具有以下功能的表面活性剂,该表面活性剂的性质将使其能够用于生物学、生物化学和医学中以用于存储组织和敏感生物材料。
这些化合物所需的研究性质包括足够的表面活性(具有足够乳液稳定性和耐久性的表面活性剂),较高的气体溶解度(主要是氧气的溶解度)和较低的表面活性剂的细胞毒性(化合物在水性介质中的浓度相对较高)。生物医学应用中使用的大多数当前已知的表面活性剂存在的一个重要问题在于它们的细胞毒性高。
令人惊讶的是,我们发现通过彻底优化所获得化合物的结构,可以获得所需表面活性和低细胞毒性的氟化有机酸铵盐,使那些表面活性剂能够形成所需的水包油和/或油包水的乳液。
因此,本发明的主题是包含由通式1表示的部分氟化的有机酸的铵盐的化合物,通式1如下:
其中,
cxf2x–是直链或支链,其中x=1至20;
cyh2y–是直链或支链,其中y=1至10;
czh2z–是直链或支链,其中z=0到10;
g是一个键或一个s,o原子或另一个杂原子或羰基(co),羰氧基(oco),
a是一个键或–oco–czh2z–,其中z=0至10或-oco-ar-,其中ar是苯或环烷烃或–(ch)-cooh)-基团或–(c(h)-coo-)-基团,
n为1或2
阳离子(+)是1,1,3,3-四甲基胍盐阳离子或赖氨酸阳离子或精氨酸阳离子或polylysinium阳离子或polycysteinium阳离子或聚酪氨酸。
或阳离子为:
其中,
r1,r2,r3独立地为氢原子,乙氧基(-ch2ch2o-),聚乙氧基((-ch2ch2o-)n,其中n为1至10的自然数)、c1-c25烷基、c1-c25烷氧基、c3-c12环烷基、c1-c5全氟烷基、c2-c12烯基、c3-c12环烯基、c5-c20芳基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基、c7-c24芳烷基、c5-c24全氟芳基、-n(r’)(r”)胺基,被氢原子或卤素原子取代,或至少被以下一种所取代,c1-c12烷基、c1-c12全氟烷基、c1-c12烷氧基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基、c7-c24芳烷基、c5-c24全氟芳基、-n(r')(r”)胺、-or'烷氧基,其中r,r’和r”是相同或不同的c1-c25烷基、c3-c12环烷基、c1-c25烷氧基、c2-c25烯基、c1-c12全氟烷基、c5-c20芳基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳基氧基,这些基团可以连接在一起,形成取代或未取代的c4-c10环状或c4-c12多环系统,可以被c1-c12烷基、c1-c12全氟烷基、c1-c12烷氧基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基中的至少一种所取代。
铵阳离子的取代基r1和r2或r2和r3或r1和r3或r1,r2和r3优选连接,形成链或环系统。
铵阳离子优选为叔阳离子,或仲阳离子或伯阳离子。
部分氟化羧酸的阴离子优选选自以下列表,包括阴离子2a至2s,
而铵离子选自以下列表,包括3a至3i,
本发明的主题包括式1所示的化合物的用途
其中,
cxf2x–是直链或支链,其中x=1至20;
cyh2y–是直链或支链,其中y=1至10;
czh2z–是直链或支链,其中z=0到10;
g是一个键或一个s,o原子或另一个杂原子或羰基(co),羰氧基(oco),
a是一个键或–oco–czh2z–,其中z=0至10或-oco-ar-,其中ar是苯或环烷烃或–(ch)-cooh)-基团或–(c(h)-coo-)-基团,
n为1或2
阳离子(+)是1,1,3,3-四甲基胍盐阳离子或赖氨酸阳离子或精氨酸阳离子或polylysinium阳离子或polycysteinium阳离子或钾阳离子或钠阳离子。
或阳离子(+)为:
r1,r2,r3独立地为氢原子,乙氧基(-ch2ch2o-),聚乙氧基((-ch2ch2o-)n,其中n为1至10的自然数)、c1-c25烷基、c1-c25烷氧基、c3-c12环烷基、c1-c5全氟烷基、c2-c12烯基、c3-c12环烯基、c5-c20芳基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基、c7-c24芳烷基、c5-c24全氟芳基、-n(r’)(r”)胺基,被氢原子或卤素原子取代,或被以下至少一种所取代,c1-c12烷基、c1-c12全氟烷基、c1-c12烷氧基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基、c7-c24芳烷基、c5-c24全氟芳基、-n(r')(r”)胺、-or'烷氧基,其中r,r’和r”是相同或不同的c1-c25烷基、c3-c12环烷基、c1-c25烷氧基、c2-c25烯基、c1-c12全氟烷基、c5-c20芳基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳基氧基,这些基团可以连接在一起,形成取代或未取代的c4-c10环状或c4-c12多环系统,可以被c1-c12烷基、c1-c12全氟烷基、c1-c12烷氧基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基中的至少一种所取代,作为能够形成油包水和/或水包油乳液的表面活性剂。
铵阳离子的取代基r1和r2或r2和r3或r1和r3或r1,r2和r3优选连接,形成链或环系统。
铵阳离子优选为叔阳离子,或仲阳离子或伯阳离子。
部分氟化羧酸的阴离子优选选自以下列表,包括阴离子2a至2s,
而铵阳离子选自以下列表,列表中包括阳离子3a至3l,
本发明的主题还包括上述发明在生产具有高气体溶解度,特别是氧气和/或空气的溶解度的乳液中的用途。
本发明的主题还包括上述发明在生产乳液粒度小于2μm,优选1.5μm,最优选1μm的乳液中的用途。
本发明的主题还包括上述化合物在器官,组织,生物材料的存储或扩展医疗存储中的用途。
本发明的主题还包括上述化合物作为血液替代制剂中的稳定剂的用途。
本发明的主题还包括上述化合物在中风的治疗中以及在提高癌症的光动力治疗的效率中的用途。
本发明的主题还包括上述化合物作为液体成分的用途,该液体成分能够在人工肺通气期间暂时支持呼吸。
本发明的主题还包括上述化合物作为用于医学诊断,特别是用于usg和mri中的液体成分的用途。
本发明的主题还包括上述化合物作为药物、疫苗和医疗产品的组合物中的表面活性剂的用途。
本发明的主题还包括上述化合物作为化妆品、皮肤病学和护理产品的成分的用途。
本发明的主题还包括上述化合物作为洗涤剂、清洁剂和消毒剂的成分的用途。
本发明的主题还包括上述化合物作为油漆、染料乳液、清漆和塑料的成分的用途。
本发明的主题还包括上述化合物作为农业化学产品的成分的用途。
本发明的主题还包括上述化合物作为高端计算机和服务器中的冷却混合物的组分的用途。
本发明的主题还包括上述化合物作为在生物反应器和其他需氧生物培养物中输送氧气的培养基的成分的用途。
本发明的主题还包括上述化合物作为在生物反应器和其他厌氧生物培养物中输送二氧化碳的培养基的成分的用途。
本发明的主题还包括上述化合物在植物和动物细胞的体外培养物中的用途。
本发明的主题还包括由通式1表示的部分氟化的有机酸的铵盐的合成方法,通式i如下:
其中,
cxf2x–是直链或支链,其中x=1至20;
cyh2y–是直链或支链,其中y=1至10;
czh2z–是直链或支链,其中z=0到10;
g是一个键或一个s,o原子或另一个杂原子或羰基(co),羰氧基(oco),
a是一个键或–oco–czh2z–,其中z=0至10或-oco-ar-,其中ar是苯或环烷烃或–(ch)-cooh)-基团或–(c(h)-coo-)-基团,
n为1或2
阳离子(+)是1,1,3,3-四甲基胍盐阳离子或赖氨酸阳离子或精氨酸阳离子或polylysinium阳离子或polycysteinium阳离子或聚酪氨酸。
或阳离子为:
其中
r1,r2,r3独立地为氢原子,乙氧基(-ch2ch2o-),聚乙氧基((-ch2ch2o-)n,其中n为1至10的自然数)、c1-c25烷基、c1-c25烷氧基、c3-c12环烷基、c1-c5全氟烷基、c2-c12烯基、c3-c12环烯基、c5-c20芳基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基、c7-c24芳烷基、c5-c24全氟芳基、-n(r’)(r”)胺基,被氢原子或卤素原子取代,或被以下的至少一种所取代,c1-c12烷基、c1-c12全氟烷基、c1-c12烷氧基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基、c7-c24芳烷基、c5-c24全氟芳基、-n(r')(r”)胺、-or'烷氧基,其中r,r’和r”是相同或不同的c1-c25烷基、c3-c12环烷基、c1-c25烷氧基、c2-c25烯基、c1-c12全氟烷基、c5-c20芳基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳基氧基,这些基团可以连接在一起,形成取代或未取代的c4-c10环状或c4-c12多环系统,可以被c1-c12烷基、c1-c12全氟烷基、c1-c12烷氧基、c5-c24芳氧基、c2-c20杂环、c4-c20杂芳基、c5-c20杂芳氧基中的至少一种所取代,其特征在于,使得用如下通式4表示的适当的部分氟化的有机酸与适当的胺或氨基酸反应,导致形成部分氟化的有机酸的铵盐,其用通式1表示,其中通式4如下
其中所有变量都具有上面指定的含义。
该反应优选在溶剂,醇,优选在甲醇中或在醇,优选甲醇与水的混合物中进行。
优选向溶解在纯醇或水溶液形式的醇,优选甲醇中的相应酸中加入铵或氨基酸。
相应的酸优选用作酯。
优选将反应混合物加热,优选加热至其沸点。
参照附图,使用优选的实施例详细解释本发明,其中:
图1示出了2a3e的比电导率与表面活性剂浓度之间的依存关系的示例。
图2示出了化合物2l3k的xtt测试结果。
图6(表3)示出了用不同浓度的2l3k溶液处理24小时后的l929和hmec-1细胞系的显微图像。
图3示出了化合物2a3g的xtt测试结果。
图7(表4)示出了用不同浓度的2a3g溶液处理24小时后l929和hmec-1细胞的显微图像。
图4示出了结果-浓度为1%或更低时2j3k的非溶血特性。
图5示出了结果-浓度高于0.05%时2c3f的溶血特性。
图6示出了施用经分析的物质后大鼠肾脏的组织学可视化图。he染色。4倍镜头。
图7示出了施用经分析的物质后大鼠肝脏的组织学可视化图。he染色。4倍镜头。
图8示出了施用经分析的物质后大鼠心脏的组织学可视化图。he染色。4倍镜头。
图9示出了施用经分析的物质后大鼠肺的组织学可视化图。he染色。4倍镜头。
图10示出了血清ph值随所测制剂给药次数而变化的图。
图11示出了血液中二氧化碳分压随所测制剂给药次数而变化的图。
图12示出了血液中的氧分压随所测制剂给药次数而变化的图。
图13示出了血液中肌酐浓度随所测制剂给药次数而变化的图。
图14示出了血液中乳酸浓度随所测制剂给药次数而变化的图。
图15示出了血液中淋巴细胞浓度随所测制剂给药次数而变化的图。
图16示出了血液中红细胞浓度随所测制剂给药次数而变化的图。
图17示出了血液中血红蛋白浓度随所测制剂给药次数而变化的图。
图18示出了血细胞比容随所测制剂给药次数的变化而变化。
图19示出了血液中血小板浓度随所测制剂给药次数而变化的图。
图20示出了血液中碳酸盐浓度随所测制剂给药次数而变化的图。
图21示出了细胞外液中be值随所测制剂给药次数而变化的图。
图22示出了血红蛋白氧饱和度变化的百分比随所测制剂给药次数而变化的图。
图23示出了血液中钠离子浓度随所测制剂给药次数而变化的图。
图24示出了血液中钾离子浓度随所测制剂给药次数而变化的图。
图25示出了血液中钙离子浓度随所测制剂给药次数而变化的图。
图26示出了血液中氯离子浓度随所测制剂给药次数而变化的图。
图27示出了血液中葡萄糖浓度随所测制剂给药次数而变化的图。
图28示出了血液中be值随所测制剂给药次数而变化的图。
图29示出了血液(气体定量测量)中血红蛋白浓度随所测制剂给药次数而变化的图。
图30示出了k+阴离子间隙值随所测制剂给药次数而变化的图。
图31示出了阴离子间隙值随所测制剂给药次数而变化的图。
图32示出了总二氧化碳随所测制剂给药次数而变化的图。
图33示出了在大鼠的尾巴变化上测得的收缩压随所测制剂给药次数而变化的图。
本公开中使用的术语具有以下指定的含义。根据现有技术知识,本公开内容和专利申请说明书的上下文,未定义术语具有本领域技术人员所理解的含义。除非另有说明,否则本公开中所用的化学术语的以下惯例具有以下所示的定义。
术语“卤素原子”或“卤素”表示选自f,cl,br,i的元素。
术语“烷基”是指具有指定碳原子数的饱和,直链或支链的烃取代基。示例性的烷基取代基包括-甲基、-乙基、-正丙基、-正丁基、-正戊基、-正己基、-正庚基、-正辛基、-正壬基和-正癸基。代表性的支链-(c1-c10)烷基包括-异丙基、-仲丁基、-异丁基、-叔丁基、-异戊基、-新戊基、-1-甲基丁基、-2-甲基丁基、-3-甲基丁基、-1,1-二甲基丙基、-1,2-二甲基丙基、-1-甲基戊基、-2-甲基戊基、-3-甲基戊基、-4-甲基戊基、-1-乙基丁基、-2-乙基丁基、-3-乙基丁基、-1,1-二甲基丁基、-1,2-二甲基丁基、-1,3-二甲基丁基、-2,2-二甲基丁基、-2,3-二甲基丁基、-3,3-二甲基丁基、-1-甲基己基、-2-甲基己基、-3-甲基己基、-4-甲基己基、-5-甲基己基、-1,2-二甲基戊基、-1,3-二甲基戊基、-1,2-二甲基己基、-1,3-二甲基己基、-3,3-二甲基己基、-1,2-二甲基庚基、-1,3-二甲基庚基、-3,3-二甲基庚基和类似的取代基。
术语“烷氧基”是指经由氧原子连接的上述烷基取代基。
术语“全氟烷基”是指如上所述的烷基,其中所有氢原子均被相同或不同的卤素原子取代。
术语“环烷基”是指具有指定碳原子数的饱和,单环或多环烃取代基。示例性的环烷基取代基包括-环丙基、-环丁基、-环戊基、-环己基、-环庚基、-环辛基、-环壬基、-环癸基和类似基团。
术语“烯基”是指具有指定碳原子数并且包含至少一个碳-碳双键的不饱和,直链或支链的非环状烃取代基。烯基取代基的实例包括-乙烯基、-烯丙基、-1-丁烯基、-2-丁烯基、-异丁烯基、-1-戊烯基、-2-戊烯基、-3-甲基-1-丁烯基、-2-甲基-2-丁烯基、-2,3-二甲基-2-丁烯基、-1-己烯基、-2-己烯基,-3-己烯基、-1-庚烯基、-2-庚烯基、-3-庚烯基、-1-辛烯基、-2-辛烯基、-3-辛烯基、-1-壬烯基、-2-壬烯基、-3-壬烯基、-1-癸烯基、-2-癸烯基、-3-癸烯基和类似基团。
术语“环烯基”是指具有指定碳原子数并且包含至少一个碳-碳双键的不饱和,单环或多环烃取代基。环烯基取代基的实例包括-环戊烯基、-环戊二烯基、-环己烯基、-环己二烯基、-环庚烯基、-环庚二烯基、-环庚三烯基、-环辛烯基、-环辛二烯基、-环辛三烯基、-环辛烯基、-环壬烯基、-环壬二烯基、-环癸烯基、-环壬二烯基、和类似基团。
术语“炔基”是指具有所示碳原子数并且包含至少一个三碳-碳键的不饱和,直链或支链的非环状烃取代基。炔基取代基的实例包括-乙炔基、-丙炔基、-1-丁炔基、-2-丁炔基、-1-戊炔基、-2-戊炔基、-3-甲基-1-丁炔基、-4-戊炔基、-1-己炔基、-2-己炔基、-5-己炔基和类似基团。
术语“环炔基”是指具有指定碳原子数并且包含至少一个三碳-碳键的不饱和,单环或多环烃取代基。环炔基取代基的实例包括-环己炔基、-环庚炔基、-环辛炔基和类似基团。
术语“芳基”是指具有指定碳原子数的芳族,单环或多环烃取代基。芳基取代基的实例包括-苯基、-甲苯基、-二甲苯基、-萘基、-2,4,6-三甲基苯基、-2-氟苯基、-4-氟苯基、-2,4,6-三氟苯基、-2,6-二氟苯基、-4-硝基苯基和类似的基团。
术语“芳烷基”是指被至少一个如上所定义的芳基取代的如上所定义的烷基取代基。芳烷基取代基的实例包括-苄基、-二苯甲基、-三苯甲基和类似的基团。
术语“杂芳基”是指具有指定碳原子数的芳族,单环或多环烃取代基,其中至少一个碳原子已被选自o,n和s原子的杂原子取代。杂芳基取代基的实例包括-呋喃基、-噻吩基、-咪唑基、-恶唑基、-噻唑基、-异恶唑基、三唑基、-恶二唑基、-噻二唑基、-四唑基、-吡啶基、-嘧啶基、-三嗪基、-吲哚基、-苯并[b]呋喃基、-苯并[b]噻吩基、-吲唑基、-苯并咪唑基、-氮杂吲哚基、-喹啉基、-异喹啉基、-咔唑基和类似基团。
术语“杂环”是指具有指定碳原子数的饱和或部分不饱和的单环或多环烃取代基,其中至少一个碳原子已被选自o,n和s原子的杂原子取代。杂环取代基的实例包括呋喃基、噻吩基、吡咯基、恶唑基、咪唑基、噻唑基、异恶唑基、吡唑基、异噻唑基、三嗪基、pyrolidinonyl、吡咯烷基、乙内酰脲、环氧乙烷基、氧杂环丁基、四氢呋喃基、四氢噻吩基、喹啉基、异喹啉基、chromonyl苯甲酰基、cumarinyl、吲哚基、中氮茚基、苯并[b]呋喃基、苯并[b]噻吩基、吲唑基、嘌呤基、4h-喹啉基、异喹啉基、喹啉基、邻苯二甲酰基、萘啶基、咔唑基、β-咔啉基和类似基团。
术语“杂原子”是指选自氧原子,硫原子,氮原子,磷原子和其他原子的原子。
术语“氯化溶剂”是指这样的一种溶剂,该溶剂结构中包含诸如氟,氯,溴和碘原子中的至少一种原子,优选不止一种原子。此类溶剂的实例包括二氯甲烷、氯仿、四氯甲烷(四氯化碳)、1,2-二氯乙烷、氯苯、全氟苯、全氟甲苯、氟利昂等。
术语“非极性有机溶剂”是指特征在于零或非常小的偶极矩的溶剂。此类溶剂的实例包括:戊烷、己烷、辛烷、壬烷、癸烷、苯、甲苯、二甲苯等。
术语“极性有机溶剂”是指特征在于偶极矩明显高于零的溶剂。这种溶剂的实例包括二甲基甲酰胺(dmf),四氢呋喃(thf)及其衍生物,乙醚,二氯甲烷,乙酸乙酯,氯仿,醇(meoh,etoh或i-proh)等。
术语“gc”是指气相色谱法。
术语“gcms”是指气相色谱结合使用质谱法的分析。
术语“hplc”是指高效液相色谱法,标记为“hplc”溶剂的溶剂是纯度足以用于hplc分析的溶剂。
术语“nmr”是指核磁共振。
术语“tmg”是指四甲基胍。
术语“dmap”是指4-二甲基氨基吡啶。
本发明的实施例
给出以下实施例仅是对本发明的举例说明,并且仅是对其各个方面的解释,而不是限制,并且不应与所附权利要求书中所限定的本发明的整个范围相一致。除非另有说明,否则以下实施例使用本领域中使用的标准材料和方法,或者使用特定试剂和方法的制造商的建议。
实施例i
获得有机酸
表1-所获酸的列表
实施例1-制备酸2a
在氩气气氛下,在室温下向0.48g(1.00mmol)的1h,1h,2h,2h-全氟癸硫醇的丙酮(10ml)溶液中加入0.236g(2.05mmol)的tmg。然后滴加0.095g(1.00mmol)氯乙酸的丙酮(5ml)溶液。将反应混合物加热至50℃并搅拌2小时。之后,将混合物冷却至室温,将白色沉淀物滤出并用10ml丙酮洗涤。将滤液浓缩。然后加入10ml水,混合物用1m盐酸溶液酸化至ph=5-6,并用乙酸乙酯(3×20ml)萃取。合并的有机相用水洗涤两次,并用mgso4干燥。在蒸发器上浓缩至干后,使用乙酸乙酯-己烷混合物(0至100%乙酸乙酯)通过柱色谱法将粗产物纯化,得到3,3,4,4,5,5,6,6,7,7,8,8,8,9,10,10,10,10-十七氟-1-十硫代乙酸2a(0.377g,产率=70%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=10.94(s,1h),3.27(s,2h),2.83(dd,j=9.3,6.7hz,2h),2.50(ddd,j=26.5,18.5,8.1hz,2h)。
19fnmr(470mhz,丙酮-d6):δ=-81.72(dd,j=22.1,11.6hz,3f),-113.91–-114.14(m,2f),-114.58–-114.82(m,2f),-122.25(s,2f),-122.46(s,2f),-123.35(d,j=61.9hz,2f),-123.97(d,j=55.9hz,2f),-126.62–-126.96(m,2f)。
13cnmr(126mhz,丙酮-d6):δ=170.61,32.77,31.33,22.79。
13cdec19fnmr(126mhz,丙酮-d6:δ=118.12,117.02,111.19,111.02,110.83,110.76,110.23,108.40。
实施例2-制备酸2b
在氩气气氛下,在室温下向0.38g(1.00mmol)的1h,1h,2h,2h-全氟辛硫醇的丙酮(10ml)溶液中加入0.236g(2.05mmol)的tmg。然后滴加0.095g(1.00mmol)氯乙酸的丙酮(5ml)溶液。按照方法2a进行反应,得到3,3,4,4,5,5,6,6,7,7,8,8,8-全氟己烷磺酸钾-1-辛烷硫代乙酸2b(0.402g,产率=92%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.35–3.24(m,1h),2.89(dd,j=9.3,6.8hz,1h),2.54(ddd,j=26.2,18.4,8.1hz,1h);
19fnmr(470mhz,cd3od):δ=-82.40–-82.51(m,3f),-115.22–-115.59(m,2f),-122.96(s,2f),-123.93(s,2f),-124.31–-124.70(m,2f),-127.26–-127.45(m,2f);
13cnmr(126mhz,cd3od):δ=172.41,32.90,31.22,22.74;
13cdec19fnmr(126mhz,cd3od):δ=119.25,118.56,112.47,112.35,111.68,109.89.
实施例3-制备酸2c
在氩气气氛下,在室温下向0.48g(1.00mmol)的1h,1h,2h,2h-全氟癸硫醇的丙酮(10ml)溶液中加入0.236g(2.05mmol)的tmg。然后滴加0.243g(1.00mmol)的6-溴己酸的丙酮(5ml)溶液。按照方法2a进行反应,得到3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10,10-十七氟-1-癸烷-6-硫代己酸2c(0.534g,产率=90%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=2.74(dd,j=9.3,6.8hz,2h),2.59(t,j=7.3hz,2h),2.45(ddd,j=26.3,18.3,8.3hz,2h),2.29(t,j=7.4hz,2h),1.69-1.57(m,4h),1.49-1.41(m,2h)。
19fnmr(470mhz,cd3od):δ=-82.42(m,3f),-115.07–-115.66(m,2f),-122.72(m,2f),-122.82–-123.09(m,4f),-123.60–-123.97(m,2f),-124.16–-124.68(m,2f),-127.17–-127.65(m,2f)。
13cnmr(126mhz,cd3od):δ=176.03,33.32,31.68,31.30,28.71,27.82,24.19,21.86。
13cdec19fnmr(126mhz,cd3od):δ=119.28,118.48,112.58,112.40,112.21,112.16,111.63,109.81。
实施例4–制备酸2d
在氩气气氛下,在室温下向0.38g(1.00mmol)的1h,1h,2h,2h-全氟辛硫醇的丙酮(10ml)溶液中加入0.236g(2.05mmol)的tmg。然后滴加0.164g(1.00mmol)的8-氯辛烷-1-醇的丙酮(5ml)溶液。根据方法2a进行反应,得到3,3,4,4,5,5,6,6,7,7,8,8,8-十三氟-1-辛-6-硫代己酸2d(0.412g,产率=83%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=2.75(dd,j=9.2,6.8hz,2h),2.59(t,j=7.3hz,2h),2.46(ddd,j=26.1,18.2,8.0hz,2h),2.30(t,j=7.4hz,2h),1.68–1.57(m,4h),1.51–1.41(m,2h)。
19fnmr(470mhz,cd3od):δ=–82.46(ddd,j=10.7,6.1,2.3hz,3f),-115.26–-115.60(m,2f),-122.91(d,j=56.0hz,2f),-123.88(d,j=56.1hz,2f),-124.43(d,j=14.2hz,2f),-127.26–-127.63(m,2f)。
13cnmr(126mhz,cd3od):δ=176.04,33.32,31.67,31.29,28.71,27.82,24.19,21.86。
13cdec19fnmr(126mhz,cd3od):δ=119.27,118.56,112.49,112.37,111.68,109.89。
实施例5–制备酸2e
实施例5–第一步
在氩气气氛下,在室温下,向0.48g(1.00mmol)的1h,1h,2h,2h全氟癸硫醇的丙酮(10ml)溶液中加入0.236g(2.05mmol)的tmg。然后滴加0.164g(1.00mmol)的8-氯辛烷-1-醇的丙酮(5ml)溶液。将反应混合物加热至50℃并搅拌2小时。之后,将混合物冷却至室温,将白色沉淀物滤出并用10ml丙酮洗涤。将滤液浓缩。然后加入10ml水,混合物用1m盐酸溶液酸化至ph=5-6,并用乙酸乙酯(3×20ml)萃取。合并的有机相用水洗涤两次,并用mgso4干燥。在蒸发器上浓缩至干后,使用乙酸乙酯-己烷混合物(0至100%乙酸乙酯)通过柱色谱法将粗产物纯化,得到8-(1h,1h,2h,2h-全氟癸烷)-硫辛烷-1-醇(0.520g,产率=86%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=3.64(t,j=6.6hz,2h),3.53(t,j=6.8hz,2h),2.75–2.53(m,2h),1.80–1.73(m,2h),1.63–1.52(m,4h),1.44(dt,j=14.0,7.2hz,2h),1.39–1.29(m,6h)。
19fnmr(470mhz,cdcl3):δ=-80.81(t,j=9.9hz,3f),-114.37(m,2f),-121.74(s,2f),-121.94(s,4f),-122.74(s,2f),-123.41(s,2f),-126.07–-126.30(m,2f)。
13cnmr(126mhz,cdcl3):δ=62.95,45.09,32.66,32.57,32.23,29.29,29.22,29.20,29.09,28.80,28.67,26.77,25.63,25.60。
13cdec19fnmr(126mhz,cdcl3):δ=117.23,116.81,110.79,110.64,110.46,110.41,109.90,108.07。
实施例5–第二步
向0.608g(1.00mmol)的8-(1h,1h,2h,2h-全氟癸烷)-硫辛烷-1-醇的thf(3ml)溶液中加入琥珀酸酐0.220g(2.2mmol)和dmap0.030g(0.25mmol)。将混合物在100℃下搅拌2小时。之后,将混合物冷却至10℃,并加入100ml的水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物风干,得到8-(1h,1h,2h,2h-全氟癸烷)-硫代-1-辛基琥珀酸单酯2e(0.640g,90%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.98(t,j=6.6hz,2h),2.70–2.60(m,2h),2.54–2.44(m,6h),2.36(ddd,j=26.2,18.1,8.0hz,2h),1.58–1.45(m,4h),1.41–1.11(m,8h)。
19fnmr(470mhz,cd3od):δ=-81.30–-83.94(m,3f),-115.36(m,2f),-122.70(m,2f),-122.80–-123.16(m,4f),-123.91(m,2f),-124.39(m,2f),-127.00–-127.58(m,2f)。
13cnmr(126mhz,cd3od):δ=174.53,172.89,64.35,31.70,31.47,29.00,28.77,28.70,28.66,28.34,28.24,28.23,25.47,21.88。
13cdec19fnmr(126mhz,cd3od):δ=119.28,118.48,112.58,112.40,112.21,112.16,111.63,109.81。
实施例6–制备酸2f
实施例6–第二步
向0.608g(1.00mmol)的8-(1h,1h,2h,2h-全氟癸烷)-硫辛烷-1-醇的thf(3ml)溶液中加入邻苯二甲酸酐0.170g(1.15mmol)和dmap0.030g(0.25mmol)。将混合物在100℃下搅拌2小时。之后,将混合物冷却至10℃,并加入100ml的水。
滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物溶解在乙酸乙酯中,并加入饱和nahco3溶液。分离水相,并将hcl加入水中至ph为6。将水层用乙酸乙酯萃取3次。合并有机部分,用盐水洗涤,用mgso4干燥并浓缩,得到8-(1h,1h,2h,2h-全氟癸烷)-硫代-1-辛基邻苯二甲酸单酯2f(0.750g,产率=70%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=7.83(ddd,j=9.3,5.8,3.4hz,1h),7.68(td,j=6.0,2.9hz,1h),7.66–7.58(m,2h),4.26(t,j=6.6hz,2h),2.79(dd,j=9.3,6,7hz,2h),2.63(t,j=7.4hz,2h),2.53(dt,j=26.4,9.1hz,2h),1.82–1.67(m,2h),1.67–1.54(m,2h),1.49–1.29(m,8h)。
19fnmr(470mhz,丙酮-d6):δ=-79.30–-82.22(m,3f),-112.94–-114.18(m,2f),-120.66–-121.04(m,2f),-121.06–-121.41(m,4f),-121.74–-122.33(m,2f),-122.46–-122.93(m,2f),-125.19–-125.90(m,2f).
13cnmr(126mhz,丙酮-d6):δ=167.02,133.43,131.89,131.22,130.67,129.04,128.39,65.19,32.47,31.96,31.78,31.61,31.50,28.25,26.56,25.72,25.69,22.01,13.31。
13cdec19fnmr(126mhz,丙酮-d6):δ=120.76,119.74,113.88,113.71,113.51,113.44,112.91,111.08。
实施例7–制备酸2g
实施例7–第二步
向0.608g(1.00mmol)的8-(1h,1h,2h,2h-全氟癸烷)-硫辛烷-1-醇的thf(3ml)的溶液中加入戊二酸酐0.125g(1.10mmol)和dmap0.030g(0,25mmol)。将混合物在100℃下搅拌2小时。之后,将混合物冷却至10℃,并加入100ml的水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物溶解在乙酸乙酯中,并加入饱和nahco3溶液。分离水相,并将hcl加入水中至ph为6。将水层用乙酸乙酯萃取3次。合并有机部分,用盐水洗涤,用mgso4干燥并浓缩,得到8-1h,1h,2h,2h-全氟癸烷)-硫-1-辛基戊二酸单酯2g(0.700g,产率=67%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=10.55(s,1h),4.05(t,j=6.7hz,2h),2.83–2.76(m,2h),2.63(t,j=7.4hz,2h),2.54(ddd,j=26.4,18.2,8.1hz,2h),2.37(q,j=7.4hz,4h),1.94–1.82(m,2h),1.60(dd,j=14.0,6.7hz,4h),1.48–1.30(m,8h)。
19fnmr(470mhz,丙酮-d6):δ=-80.00–-81.11(m,3f),-111.84–-114.62(m,2f),-120.98(s,2f),-121.06–-121.50(m,4f),-122.01(s,2f),-122.63(s,2f),-125.27–-125.86(m,2f)。
13cnmr(126mhz,丙酮-d6):δ=173.19,172.35,63.79,32.78,32.47,32.23,31.97,31.79,31.62,31.48,26.53,25.66,25.63,21.99,20.10。
13cdec19fnmr(126mhz,丙酮-d6):δ=120.76,119.75,113.88,113.71,113.51,113.44,112.91,111.08。
实施例8–制备酸2h
实施例8–第一步
在氩气气氛下,在室温下向0.38g(1.00mmol)的1h,1h,2h,2h-全氟辛硫醇的丙酮(10ml)溶液中加入0.236g(2.05mmol)的tmg。然后滴加0.164g(1.00mmol)的8-氯辛烷-1-醇的丙酮(5ml)溶液。将反应混合物加热至50℃并搅拌2小时。之后,将混合物冷却至室温,将白色沉淀物滤出并用10ml丙酮洗涤。将滤液浓缩。然后加入10ml水,并将混合物用1m盐酸溶液酸化至ph=5-6,并用乙酸乙酯(3×20ml)萃取。合并的有机相用水洗涤两次,并用mgso4干燥。在蒸发器上浓缩至干后,通过使用乙酸乙酯-己烷混合物(0至100%乙酸乙酯)通过柱色谱法将粗产物纯化,得到8-(1h,1h,2h,2h-全氟辛烷)-硫辛烷-1-醇(0.365g,产率=72%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=3.64(t,j=6.6hz,2h),3.53(t,j=6.7hz,1h),2.78–2.68(m,1h),2.60–2.50(m,1h),2.45–2.30(m,1h),1.85–1.72(m,1h),1.58(tt,j=13.3,6.8hz,3h),1.48–1.28(m,8h)。
19fnmr(470mhz,cdcl3):δ=-78.73–-82.35(m,3f),-113.65–-115.19(m,2f),-120.22–-122.43(m,2f),-122.55–-123.17(m,2f),-123.26–-123.75(m,2f),-125.81–-126.55(m,2f)。
13cnmr(126mhz,cdcl3):δ=118.91,118.58,112.41,112.32,111.63,109.84。
13cdec19fnmr(126mhz,cdcl3):δ=118.91,118.58,112.41,112.32,111.63,109.84。
实施例8–第二步
向0.608g(1.00mmol)的8-(1h,1h,2h,2h-全氟辛烷)-硫辛烷-1-醇的thf(3ml)溶液中加入琥珀酸酐0.220g(2.2mmol)和dmap0.030(0.25mmol)。将混合物在100℃下搅拌2小时。之后,将混合物冷却至10℃,并加入100ml的水。滤出奶油色沉淀物,并用20ml冷水洗涤。将沉淀物风干,得到8(1h,1h,2h,2h-全氟辛基)-硫代-1-辛基琥珀酸单酯2h(0.590g,产率=97%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=4.07(t,j=6.6hz,4h),3.54(t,j=6.7hz,2h),2.79–2.69(m,2h),2.45(ddd,j=26.6,18.3,8.1hz,2h),1.81–1.70(m,2h),1.61(dt,j=15.0,7.3hz,4h),1.50–1.29(m,8h)。
19fnmr(470mhz,cd3od):δ=-82.35–-82.54(m,3f),-115.19–-115.53(m,2f),-122.94(s,2f),-123.91(s,2f),-124.42(s,2f),-127.24–-127.50(m,2f)。
13cnmr(126mhz,cd3od):δ=174.53,172.89,64.34,44.29,32.36,31.70,31.47,29.01,28.75,28.67,28.42,28.35,28.24,26.41,25.48,21.88。
13cdec19fnmr(126mhz,cd3od):δ=117.85,117.13,111.06,110.94,110.25,108.46.
实施例9–制备酸2i
向1h,1h,2h,2h--全氟-1-辛醇(10g,27.46mmol)的thf(3ml)溶液中加入琥珀酸酐(3.02g,30.21mmol)和dmap(0.67g,5.49mmol)。将混合物在100℃下搅拌2小时。之后,将混合物冷却至10℃,并加入100ml水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物风干,得到1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i(12.33g,产率=97%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=4.41(t,j=6.5hz,2h),2.73–2.61(m,4h),2.47(tt,j=18.3,6.5hz,2h)。
19fnmr(470mhz,cdcl3):δ=-80.87(t,j=10.0hz,3f),-113.42–-113.83(m,2f),-121.74–-122.11(m,2f),-122.78–-123.05(m,2f),-123.55–-123.84(m,2f),-126.02–-126.45(m,2f)。
13cnmr(126mhz,cdcl3):δ=177.80,171.63,56.62,30.43,28.65,28.61。
13cdec19fnmr(126mhz,cdcl3):δ=117.39,117.14,110.95,110.72,110.18,108.41。
实施例10–制备酸2j
向1h,1h,2h,2h-全氟-1-癸醇(15g,32.32mmol)的thf(15ml)溶液中加入琥珀酸酐(3.43g,34.26mmol)和dmap(0.39g,3.23mmol)。将混合物在100℃下搅拌2小时。之后,将混合物冷却至10℃,并添加100ml的水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物风干,得到1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j(17.81g,产率=98%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=4.43(t,j=6.0hz,2h),2.74–2.56(m,6h)。
19fnmr(470mhz,丙酮-d6):δ=-81.35–-81.92(m,3f),-113.96–-114.32(m,2f),-122.23(d,j=9.3hz,2f),-122.34–-122.59(m,4f),-123.29(s,2f),-124.15(s,2f),-126.68–-126.82(m,2f)。
13cnmr(126mhz,丙酮-d6):δ=172.59,171.69,56.04,30.02,28.60,28.09。
13cdec19fnmr(126mhz,cdcl3):δ=118.06,117.02,111.15,110.87,110.78,110.72,110.19,108.36。
实施例11–制备酸2k
向1h,1h,2h,2h-全氟-1-辛醇(5.18g,14.23mmol)的thf(6ml)溶液中加入戊二酸酐(1.78g,15.65mmol)和dmap(0.35g,2.85mmol)。将混合物在100℃下搅拌4小时。之后,将混合物冷却至10℃,并添加100ml的水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物溶解在乙酸乙酯中,并加入饱和nahco3溶液。分离水相,并将hcl加入水中至ph为6。将水层用乙酸乙酯萃取3次。合并有机部分,用盐水洗涤,用mgso4干燥并浓缩,得到1h,1h,2h,2h-全氟-1-辛基戊二酸单酯2k(5.78g,产率=85%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=4.43(t,j=6.2hz,2h),2.74–2.61(m,2h),2.43(t,j=7.4hz,2h),2.38(t,j=7.3hz,2h),1.95–1.85(m,2h)。
19fnmr(470mhz,丙酮-d6):δ=-80.75–-83.66(m,3f),-114.02–-114.22(m,2f),-122.35–-122.63(m,2f),-123.44–-123.60(m,2f),-124.14–-124.35(m,2f),-126.79–-126.98(m,2f)。
13cnmr(126mhz,丙酮-d6):δ=173.25,172.11,55.87,32.58,32.44,30.02,19.87。
13cdec19fnmr(126mhz,丙酮-d6):δ=118.13,117.15,111.10,110.89,110.28,108.49。
实施例12–制备酸2l
向1h,1h,2h,2h-全氟-1-癸醇(3.70g,7.97mmol)的thf(5ml)溶液中加入戊二酸酐(1.00g,8.77mmol)和dmap(0.19g,1.59mmol)。将混合物在100℃下搅拌4小时。之后,将混合物冷却至10℃,并添加70ml的水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物风干以获得1h,1h,2h,2h-全氟-1-癸基戊二酸单酯2l(3.82g,产率=83%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=4.43(t,j=6.2hz,2h),2.73–2.62(m,2h),2.43(t,j=7.4hz,2h),2.38(t,j=7.3hz,2h),1.90(dp,j=22.1,7.4hz,2h)。
19fnmr(470mhz,丙酮-d6):δ=-81.47–-82.04(m),-113.86–-114.23(m),-122.26(s,j=56,9hz),-122.47(s),-122.49(s),-123.30(s),-124.16(s),-126.66–-126.85(m)。
13cnmr(126mhz,丙酮-d6):δ=173.18,172.11,55.88,32.59,32.13,30.03,19.89。
实施例13–制备酸2m
向1h,1h,2h,2h-全氟-1-辛醇(7.41g,20.35mmol)的thf(8ml)溶液中加入邻苯二甲酸酐(3.01g,20.35mmol)和dmap(0.5g,4.07mmol)。将混合物在100℃下搅拌3小时。之后,将混合物冷却至10℃,并添加100ml的水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物溶解在乙酸乙酯中,并加入饱和nahco3溶液。分离水相,并将hcl加入水中至ph为6。将水层用乙酸乙酯萃取3次。合并有机部分,用盐水洗涤,用mgso4干燥并浓缩,得到1h,1h,2h,2h-全氟-1-辛基邻苯二甲酸单酯2k(6.57g,产率=63%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=8.18(s,1h),7.92(d,j=7.9hz,1h),7.67(d,j=7.5hz,1h),7.61(td,j=7.5,1.1hz,1h),7.58(td,j=7.5,1.3hz,1h),4.62(t,j=6.6hz,2h),2.60(tt,j=18.2,6.5hz,2h)。
19fnmr(470mhz,cdcl3):δ=-80.90(t,j=9.9hz,3f),-113.34–-114.16(m,2f),-121.95(s,2f),-122.95(s,2f),-123.61(s,2f),-126.13–-126.31(m,2f)。
13cnmr(126mhz,cdcl3):δ=171.81,167.70,132.72,132.19,131.01,130.09,129.89,128.58,57.49,30.19。
13cdec19fnmr(126mhz,cdcl3):δ=117.47,117.13,110.95,110.73,110.17,108.39。
实施例14–制备酸2n
向1h,1h,2h,2h-全氟-1-癸醇(4.58g,10mmol)的thf(5ml)溶液中加入邻苯二甲酸酐(1.46g,10mmol)和dmap(0.22g,2mmol)。将混合物在100℃下搅拌3小时。之后,将混合物冷却至10℃,并添加50ml的水。滤出白色沉淀物,并用10ml冷水洗涤。将沉淀物溶解在乙酸乙酯中,并加入饱和nahco3溶液。分离各层,将hcl加到水溶液中至ph为6。将水层用乙酸乙酯萃取3次。合并有机部分,用盐水洗涤,用mgso4干燥并浓缩,得到1h,1h,2h,2h-全氟-1-癸基邻苯二甲酸单酯2n(5g,产率=82%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=7.93(d,j=7.5hz,1h),7.67(d,j=7.4hz,1h),7.64–7.60(m,1h),7.60–7.55(m,1h),4.62(t,j=6.5hz,2h),2.67–2.52(m,2h)。
19fnmr(470mhz,cdcl3):δ=-80.86(s,3f),-113.72(s,2f),-121.73(s,2f),-122.00(s,4f),-122.80(s,2f),-123.56(s,2f),-126.19(s,2f)。
13cnmr(126mhz,cdcl3):δ=171.73,167.67,132.78,132.28,131.01,129.93,129.85,128.61,57.51,30.20。
13cdec19fnmr(126mhz,cdcl3):δ=117.48,117.51,117.09,111.05,110.73,110.67,110.16,108.35。
实施例15–制备酸2o
向1h,1h,2h,2h-全氟-1-十二烷醇(2g,3.54mmol)的thf(3ml)溶液中加入邻苯二甲酸酐(0.68g,4.61mmol)和dmap(0.043g,0.35mmol)。将混合物在100℃下搅拌2小时。之后,将混合物冷却至10℃,并添加100ml的水。滤出黄色沉淀物,并用20ml冷水洗涤。将沉淀物风干,得到1h,1h,2h,2h-全氟-1-十二烷基邻苯二甲酸单酯2o(2.33g,产率=92%)。
光谱分析:
1hnmr(500mhz,丙酮-d6)δ=7.80–7.73(m,1h),7.59–7.49(m,3h),4.51(t,j=6.4hz,2h),2.66(tt,j=19.3,6.3hz,2h).
19fnmr(470mhz,丙酮-d6)δ=-81.69(t,j=10.0hz,3f),-113.87–-114.25(m,2f),-122.03–-122.60(m,10f),-123.25(s,2f),-124.08(s,2f),-126.75(s,2f)。
13cnmr(126mhz,丙酮-d6)δ=167.36,167.02,133.06,131.55,131.40,130.91,129.32,128.27,57.00,29.81。
实施例16–制备酸2p
向1h,1h,2h,2h-全氟-1-辛醇(3.56g,3.78mmol)的丙酮(5ml)溶液中滴加jones试剂。当溶液变成固体黄色并同时沉淀出绿色铬盐时,终止反应。然后滴加2-丙醇以减少过量的氧化剂。倾析出蓝色固体,将50ml水加入到残余物中。用乙醚(4×50ml)萃取产物。合并有机层并用水(50ml)洗涤,用mgso4干燥并在减压下浓缩。通过从chcl3中重结晶来纯化产物,得到白色晶体2h,2h-全氟辛酸2p(3.10g,产率=84%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=3.41(t,j=18.5hz,2h).
19fnmr(470mhz,丙酮-d6):δ=-81.73–-81.85(m,3f),-112.36–-122.74(m,2f),-122.34–-122.62(m,2f),-123.36–-123.80(m,4f),-126.73–-126.99(m,2f).
13cnmr(126mhz,丙酮-d6):δ=164.36(s),35.90(t,j=22.0hz).
实施例17–制备酸2r
向2-(1h,1h,2h,2h-全氟癸基)丙二酸二乙酯(9.66g,15.9mmol)的乙醇(32ml)溶液中加入koh(2.68g,47.7mmol)的水(4ml)溶液并在回流(110℃)下搅拌过夜。用水(50ml)稀释悬浮液,并用乙醚(3×50ml)洗涤。将水相冷却至0℃,并用浓hcl(37%)酸化至ph<2。然后将水相用乙醚(3×70ml)萃取。合并有机层,用mgso4干燥并在减压下浓缩。通过柱色谱法从10%乙酸乙酯和90%己烷开始纯化产物,然后使用浓度梯度从10%-100%乙酸乙酯洗脱的洗脱液,得到2-(1h,1h,2h,2h-全氟癸基)丙二酸2r(5.94g,产率=68%)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=3.61(t,j=7.1hz,1h),2.42(tt,j=18.7,8.1hz,2h),2.22–2.14(m,2h)。
19fnmr(470mhz,丙酮-d6):δ=-81.73(t,j=10.1hz,3f),-115.08(tq,j=32.8,18.5hz,2f),-122.27(dd,j=22.2,10.6hz,2f),-122.48(qt,j=18.9,10.0,9.5hz,4f),-123.17–-123.45(m,2f),-124.08(q,j=17.0,16.2hz,2f),-126.78(qd,j=11.7,9.8,4.6hz,2f)。
13cnmr(126mhz,丙酮-d6):δ=170.31,50.71,29.19,20.67。
实施例ii
制备部分氟化的羧酸铵盐。
实施例1-制备盐2a3a
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.115g(1.00mmol)的tmg。回流2小时后,将混合物冷却并浓缩至干,得到产物0.653g(产率=100%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.17(s,2h),2.98(s,8h),2.87–2.76(m,2h),2.53(ddd,j=26.5,18.5,8.2hz,2h)。
19fnmr(470mhz,cd3od):δ=-81.57–-83.84(m,3f),-113.41–-117.50(m,2f),-122.26–-122.80(m,2f),-122.82–-123.28(m,4f),-123.51–-124.12(m,2f),-124.16–-124.83(m,2f),-126.80–-127.76(m,2f)。
13cnmr(126mhz,cd3od):δ=227.82,226.21,215.96,177.36,163.28,39.90,38.17,32.98,32.84,32.60,24.01。
实施例2-制备盐2a3b
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.101g(1.00mmol)的三乙胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.630g(产率=98%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.30(dt,j=3.2,1.6hz,1h),3.23(s,2h),3.20(q,j=7,3hz,6h),2.86(dd,j=9.4,6.8hz,2h),2.61–2.46(m,2h),1.30(t,j=7.3hz,9h)。
19fnmr(470mhz,cd3od):δ=-79.75–-84.68(m,4f),-114.93–-115.58(m,2f),-122.46–-122.81(m,2f),-122.85–-123.15(m,4f),-123.76(s,2f),-124.13-124.76(m,2f),-126.98–-127.67(m,2f)。
13cnmr(126mhz,cd3od):δ=175.94,47.78,36.63,33.12,24.38,19.37。
实施例3-制备盐2a3c
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.149g(1.00mmol)的三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.685g(产率=99%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.82(t,j=10.6hz,6h),3.27–3.22t,j=10.6hz,6h),3.21(s,2h),2.84(dd,j=9.4,6.8hz,2h),2.53(ddd,j=26.5,18.4,8.2hz,2h)。
19fnmr(470mhz,cd3od):δ=-82.40(t,j=10.2hz,3f),-114.90–-115.91(m,2f),-122.58–-122.82(m,j=8.7hz,2f),-122.83–-123.06(m,4f),-123.65–-123.91(m,2f),-124.25–-124.53(m,2f),-127.20–-127.46(m,2f)。
13cnmr(126mhz,cd3od):δ=175.30,56.21,55.82,35.90,31.35,22.62。
实施例4-制备盐2a3d
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.129g(1.00mmol)的二异丙基乙胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.660g(产率=98%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.72(dp,j=13.3,6.6hz,2h),3.30(s,1h),3.22(q,j=7.4hz,2h),3.11(ddd,j=13.5,10.4,5.4hz,2h),2.82–2.56(m,2h),1.37(d,j=6.3hz,6h),1.35–1.26(m,3h)。
19fnmr(470mhz,cd3od):δ=-80.02–-83.37(m,3f),-114.55(dd,j=59.0,43.3hz,2f),-122,49–-122.76(m,2f),-122.77–-123.10(m,4f),-123.58–-123.94(m,2f),-124.31(d,j=103.2hz,2f),-127.07–-127.50(m,2f)。
13cnmr(126mhz,cd3od):δ=168.16,54.19,42.69,41.93,23.71,17.43,15.84,11.09。
实施例5-制备盐2a3e
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.146g(1.00mmol)l-赖氨酸的水(0.5ml)溶液。向反应混合物中加入5ml水,并将混合物回流2小时,接着冷却并浓缩至干,得到产物0.684g(产率=100%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.90(t,j=6.1hz,1h),3.48(s,2h),3.19(t,j=7.5hz,2h),3.03–2.95(m,2h),2.65(td,j=18.9,8.9hz,2h),2.24(dt,j=4.9,2.5hz,1h),2.17–1.99(m,2h),1.96–1.84(m,2h),1.75–1.57(m,2h),1.38(dd,j=46.7,19.6hz,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.29–-83.80(m,3f),-114.11–-115.71(m,2f),-122.64(s,2f),-122.90(s,4f),-123.05(s,2f),-123.78(d,j=206.9hz,2f),-127.65(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=176.45,174.49,54.59,39.14,37.33,31.03,30.04,26.48,22.68,21.57。
实施例6-制备盐2a3f
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.148g(1.00mmol)的2.2′-(亚乙二氧基)-双(乙胺)。回流2小时后,将混合物冷却并浓缩至干,得到产物0.680g(产率=98%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.66(d,j=9.4hz,4h),3.65–3.57(m,4h),3.18(s,2h),2.97(dd,j=14.8,9.4hz,4h),2.82(dd,j=9.4,6.8hz,2h),2.53(ddd,j=26.5,18.3,8.2hz,2h),1.91(d,j=24.4hz,4h)。
19fnmr(470mhz,cd3od):δ=-82.39(t,j=10.1hz,3f),-114.82–-116.17(m,2f),-122.58–-122.81(m,2f),-122.90(s,j=7.4hz,4f),-123.75(s,2f),-124.37(s,j=80.6hz,2f),-126.87–-128.01(m,2f)。
13cnmr(126mhz,cd3od):δ=176.03,69.89,69.19,39.85,36.71,31.38,22.57。
实施例7-制备盐2a3g
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.220g(1.00mmol)的4,7,10-三氧代-1,13-十三烷二胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.735g(产率=99%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.66(d,j=9.4hz,4h),3.65–3.57(m,4h),3.18(s,2h),2.97(dd,j=14.8,9.4hz,4h),2.82(dd,j=9.4,6.8hz,2h),2.53(ddd,j=26.5,18.3,8.2hz,2h),1.91(d,j=24.4hz,4h)。
19fnmr(470mhz,cd3od):δ=-80.47–-83.64(m,3f),-114.25–-115.96(m,2f),-122.70(s,2f),-122.78–-123.25(m,4f),-123.75(s,2f),-124.38(s,2f),-126.89–-127.50(m,2f)。
13cnmr(126mhz,cd3od):δ=176.00,69.89,69.66,68.83,38.42,36.72,31.39,29.22,22.57。
实施例8:制备盐2a3l
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.174g(1.00mmol)的l-精氨酸水(1ml)溶液。回流2小时后,将混合物冷却并浓缩至干,得到产物0.696g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.82–3.67(m,1h),3.65–3.55(m,2h),3.20(t,j=6.6hz,2h),2.81–2.65(m,2h),2.58(t,j=7.2hz,2h),2.34(s,2h),2.23–2.10(m,2h),2.04(dt,j=4.9,2.5hz,2h),1.98–1.76(m,4h),1.75–1.48(m,4h),1.46–1.30(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-83.21(s,3f),-113.12–-114.68(m,2f),-115.40(s,2f),-122.83(s,2f),-123.07(s,2f),-123.20(s,2f),-124.16(s,2f),-127.89(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=176.56,174.41,156.92,54.36,40.63,37.38,31.05,27.77,24.11,22.68。
实施例9-制备盐2ak
将0.538g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-十七氟-1-癸硫代乙酸2a溶解在20ml的甲醇中,并加入0.056g(1.00mmol)的氢氧化钾。回流2小时后,将混合物冷却并浓缩至干,得到产物0.480g(产率=91%)。
光谱分析:
1hnmr(500mhz,d2o):δ=3.28(s,2h),2.78(dd,j=22.0,13.9hz,2h),2.44(ddd,j=26.5,18.2,8.1hz,2h)。
19fnmr(470mhz,d2o):δ=-80.45–-84.64(m,3f),-113.52–-116.82(m,2f),-122.55(d,2f),-123.00(s,4f),-123.16(s,2f),-124.10(s,2f),-127.36–-128.25(m,2f)。
13cnmr(126mhz,d2o):δ=176.61,37.41,30.97,22.64。
实施例10-制备盐2a3c
将0.438g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-辛烷硫代乙酸2b溶解在20ml的甲醇中,并加入0.149g(加入1.00mmol)的三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.570g(产率=97%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.95–3.88(m,3h),3.39(dd,j=14.4,9.4hz,3h),3.22(s,1h),2.83–2.76(m,1h),2.48(ddd,j=26.2,18.0,7.8hz,1h)。
19fnmr(470mhz,cd3od):δ=-82.19(t,j=10.1hz,3f),-114.70–-115.53(m,2f),-122.85(s,2f),-123.83(s,2f),-124.25(s,2f),-127.21(dd,j=14.4,8.3hz,2f)。
13cnmr(126mhz,cd3od):δ=177.67,56.55,56.49,37.91,32.17,23.74。
实施例11-制备盐2b3e
将0.438g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-辛烷硫代乙酸2b溶解在20ml的甲醇中,并加入0.146g(1.00mmol)l-赖氨酸的水(0.5ml)溶液。向反应混合物中加入5ml水,并将混合物回流2小时,然后将混合物冷却并浓缩至干,得到产物0.575g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.71(t,j=6.1hz,1h),3.27(s,2h),2.99(t,j=7.5hz,2h),2.84–2.75(m,2h),2.47(td,j=18.7,9.5hz,2h),1.94–1.82(m,2h),1.74–1.64(m,2h),1.55–1.36(m,2h),1.18(s,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.47–-83.36(m,3f),-113.76–-116.07(m,2f),-122.73(s,2f),-123.78(s,2f),-124.04(s,2f),-127.26(d,j=15.6hz,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=176.51,174.37,54.53,39.09,36.91,30.98,29.92,26.42,22.67,21.49。
实施例12-制备盐2b3f
将0.438g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-辛烷硫代乙酸2b溶解在20ml的甲醇中,并加入0.148g(加入1.00mmol)的2.2′-(亚乙二氧基)-双(乙胺)。回流2小时后,将混合物冷却并浓缩至干,得到产物0.580g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.70(s,4h),3.69–3.66(m,4h),3.28(s,2h),3.06–3.00(m,4h),2.84–2.77(m,2h),2.46(ddd,j=26.5,18.3,7.9hz,2h),2.05(dt,j=5.0,2.5hz,1h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.43–-83.90(m,3f),-114.48–-115.28(m,2f),-122.83(s,2f),-123.75(d,j=130.9hz,2f),-124.09(s,2f),-127.47(dd,j=27.4,12.4hz,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=176.54,69.59,68.78,39.45,37.34,31.01,22.68。
实施例13-制备盐2b3g
将0.438g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-辛烷硫代乙酸2b溶解在20ml的甲醇中,并加入0.220g(1.00mmol)的4,7,10-三氧代-1,13-十三烷二胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.650g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.57(s,4h),3.54(t,j=6.1hz,4h),3.21(s,2h),2.94–2.88(m,4h),2.77–2.68(m,2h),2.36(s,2h),1.87–1.77(m,4h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.43–-84.90(m,2f),-115.13(s,2f),-120.96–-123.64(m,4f),-124.18(s,2f),-127.76(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=176.36,69.52,69.32,68.51,37.68,37.36,29.66,28.03,22.62。
实施例14-制备盐2b3l
将0.438g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-辛烷硫代乙酸2b溶解在20ml的甲醇中,并加入0.174g(1.00mmol)的l-精氨酸水(0.1ml)溶液。回流2小时后,将混合物冷却并浓缩至干,得到产物0.600g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3od):δ=3.72–3.64(m,1h),3.26–3.19(m,4h),2.83–2.76(m,2h),2.48(ddd,j=26.4,18.3,8.0hz,2h),1.98–1.82(m,3h),1.80–1.60(m,3h)。
19fnmr(470mhz,d2o/cd3od):δ=-82.16(t,j=10.0hz,3f),-114.67–-115.50(m,2f),-122.84(s,2f),-123.81(s,2f),-124.24(s,2f),-127.19(dd,j=14.3,8.2hz,2f)。
13cnmr(126mhz,d2o/cd3od):δ=176.69,173.76,156.92,54.28,40.54,36.91,31.07,27.78,24.13,22.63。
实施例15-制备盐2c3a
将0.594g(将1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.115g(1.00mmol)tmg。回流2小时后,将混合物冷却并浓缩至干,得到产物0.708g(产率=100%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=4.85(s,2h),2.98(s,12h),2.74(dd,j=9.3,6.8hz,2h),2.59(t,j=7.4hz,2h),2.45(ddd,j=26.8,18.2,8.3hz,2h),2.19(dd,j=16.4,9.0hz,2h),1.69–1.55(m,4h),1.50–1.39(m,2h)。
19fnmr(470mhz,cd3od):δ=-82.33–-82.46(m,3f),-115.38(dd,j=31.1,15.8hz,2f),-122.78(d,j=56.7hz,2f),-122.91(s,4f),-123.75(s,2f),-124.30(d,j=73.4hz,2f),-126.98–-127.90(m,2f)。
13cnmr(126mhz,cd3od):δ=180.03,161.86,38.46,36.75,31.69,31.41,28.92,28.34,25.52,21.86。
实施例16-制备盐2c3c
将0.594g(将1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.149g(1.00mmol)三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.680g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/丙酮-d6)):δ=3.97(t,j=15.2,9.8hz,6h),3.34(t,j=5.3hz,5h),2.89–2.76(m,2h),2.75–2.63(m,2h),2.55–2.37(m,2h),2.39–2.28(m,2h),2.30–2.24(m,2h),1.77–1.60(m,4h),1.51(d,j=4.9hz,2h)。
19fnmr(470mhz,d2o/丙酮-d6)):δ=-81.57–-84.52(m,4f),-115.42(s,2f),-122.83(s,2f),-123.09(s,4f),-123.24(s,2f),-124.24(s,2f),-127.88(s,2f)。
13cnmr(126mhz,d2o/丙酮-d6)):δ=176.94,56.41,55.57,36.15,31.85,29.74,28.41,25.24,22.12,20.12。
实施例17-制备盐2c3e
将0.594g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.146g(1.00mmol)l-赖氨酸水(0.5ml)溶液。向反应混合物中加入5ml水,并将混合物加热至回流2小时,然后将混合物冷却并浓缩至干,得到产物0.740g(产率=100%)。
光谱分析:
1hnmr(500mhz,d2o):δ=3.65(s,1h),2.99(t,j=7.4hz,2h),2.75–2.63(m,2h),2.57(t,j=7.2hz,2h),2.43–2.24(m,2h),2.18(t,j=7.2hz,2h),1.95–1,79(m,2h),1.71(dt,j=14.9,7.5hz,2h),1.65–1.53(m,4h),1.53–1.29(m,4h)。
19fnmr(470mhz,d2o):δ=-81.95–-84.81(m,3f),-114.61(s,2f),-115.81(s,2f),-123.06(s,2f),-123.37(d,j=66.7hz,2f),-124.32(s,2f),-124.56(s,2f),-128.05(s,2f)。
13cnmr(126mhz,d2o):δ=181.68,174.57,54.38,38.88,37.24,31.59,30.20,28.72,28.34,26.47,25.57,21.94,21.48。
实施例18-制备盐2c3l
将0.594g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.174g(1.00mmol)l-精氨酸水(1ml)溶液。回流2小时后,将混合物冷却并浓缩至干,得到产物0.750g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.82–3.67(m,1h),3.65–3.55(m,2h),3.20(t,j=6.6hz,2h),2.81–2.65(m,2h),2.58(t,j=7.2hz,2h),2.34(s,2h),2.23–2.10(m,2h),2.04(dt,j=4.9,2.5hz,2h),1.98–1.76(m,4h),1.75–1.48(m,4h),1.46–1.30(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-83.21(s,3f),-113.12–-114.68(m,2f),-115.40(s,2f),-122.83(s,2f),-123.07(s,2f),-123.20(s,2f),-124.16(s,2f),-127.89(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.81,174.36,155.71,56.27,40.71,32.24,31.13,30.63,30.46,28.83,28.12,25.69,25.64,24.21。
实施例19-制备盐2c3f
将0.594g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.148g(1.00mmol)2.2′-(乙二氧基)-双(乙胺)。回流2小时后,将混合物冷却并浓缩至干,得到产物0.736g(产率=98%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.67(s,4h),3.62(dd,j=11.7,6.4hz,4h),2.96(dd,j=11,4,6.1hz,4h),2.74(dd,j=9.3,6.8hz,2h),2.63–2.56(m,2h),2.45(ddd,j=26.0,18.1,8.0hz,2h),2.16(t,j=7.5hz,2h),1.66–1.57(m,4h),1.49–1.39(m,2h),1.28(s,1h)。
19fnmr(470mhz,cd3od):δ=-82.33–-82.64(m,3f),-115.17–-115.56(m,2f),-122.72(s2f),-122.90(s,4f),-123.75(s,2f),-124.37(s,2f),-127.13–-127.48(m,2f)。
13cnmr(126mhz,cd3od):δ=181.26,69.89,69.30,39.87,37.56,31.69,31.43,28.96,28.45,25.84,21.86。
实施例20-制备盐2c3g
将0.594g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.220g(1.00mmol)的4,7,10-三氧代-1,13-十三烷二胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.810g(产率=98%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=3.66–3.62(m,4h),3.59(h,j=4.2hz,4h),2.89(dt,j=10.7,6.0hz,4h),2.74(dd,j=9.3,6.8hz,2h),2.62–2.55(m,2h),2.52–2.37(m,2h),2.16(dd,j=14.7,7.3hz,2h),1.87–1.77(m,4h),1.69–1.57(m,4h),1.49–1.39(m,2h)。
19fnmr(470mhz,cd3od):δ=-82.31–-82.51(m,3f),-115.37(dd,j=30.9,15.7hz,2f),-122,77(d,j=52.9hz,2f),-122.91(s,j=90.2hz,4f),-123.86(d,j=104.1hz,2f),-124.37(s,2f),-127.12--127.48(m,2f)。
13cnmr(126mhz,cd3od):δ=181.26,69.90,69.66,68.83,38.40,37.65,31.44,29.19,28.97,28.47,25.88,21.86。
实施例21-制备盐2c3k
将0.594g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.121g(1.00mmol)trizma-base(三(羟甲基)氨基甲烷)水(0.5ml)溶液。回流2小时后,将混合物冷却并浓缩至干,得到产物0.710g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.97(s,9h),3.10–3.04(m,2h),2.93(dd,j=17.7,10.4hz,2h),2.80–2.63(m,2h),2.52(t,j=7.5hz,2h),1.98–1.88(m,4h),1.74(dd,j=14.8,7.9hz,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.71(dt,j=50.0,10.2hz,3f),-115.09(dd,j=73.3,58.4hz,2f),-122.54(s,2f),-122.82(d,j=50.8hz,4f),-123.77(s,2f),-123.95(s,2f)),-127.43(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.61,60.95,60.01,39.24,37.27,31.98,29.15,28.73,25.80,22.29.
实施例22-制备盐2cna
将0.594g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,9,9,9,10,10,10-七氟-1-癸烷-6-硫己酸2c溶解在20ml的甲醇中,并加入0.040g(1.00mmol)氢氧化钠在水/甲醇(比例分别为0.1ml/1ml)中的溶液。回流2小时后,将混合物冷却并浓缩至干,得到产物0.610g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o):δ=2.89–2.79(m,2h),2.70(t,j=7.2hz,2h),2.55–2.40(m,2h),2.28(dd,j=15.0,7.5hz,2h),1.77–1.62(m,4h),1.55–1.41(m,2h)。
19fnmr(470mhz,d2o):δ=-83.18(s,3f),-114.81(d,j=559.6hz,2f),-122.84(s,2f),-123.16(d,j=74.2hz,4f),-124.19(d,j=57.4hz,2f),-127.88(s,2f)。
13cnmr(126mhz,d2o):δ=182.74,37.64,31.81,28.88,28.53,25.76,25.08,22.11。
实施例23-制备盐2d3c
将0.494g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-八-硫代己酸2d溶解在20ml甲醇中,并加入0.149g(1.00mmol)的三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.635g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.87(t,j=5.5hz,6h),3.24(t,j=5.5hz,6h),2.73(dd,j=18.8,10.5hz,2h),2.65–2.55(m,2h),2.39(dq,j=17.6,10.3hz,2h),2.22(t,j=7.6hz,2h),1.61(tt,j=15.3,7.6hz,4h),1.42(dt,j=15.0,7.6hz,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.12–-84.89(m,3f),-114.60–-115.67(m,2f),-122.94(s,2f),-123.99(s,2f),-124.25(s,2f),-127.55(d,j=15.5hz,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=180.98,56.37,55.54,36.57,31.75,31.56,28.89,28.43,25.40,22.13。
实施例24-制备盐2d3e
将0.494g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-八-硫代己酸2d溶解在20ml甲醇中,并加入0.146g(1.00mmol)l-赖氨酸水(0.5ml)溶液。然后加入5ml水,并将混合物回流2小时,然后冷却并浓缩至干,得到0.690g产物(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.77(d,j=5.9hz,2h),3.08(t,j=7.4hz,2h),2.87–2.77(m,2h),2.67(t,j=7.1hz,2h),2.46(d,j=8.2hz,2h),2.26(t,j=7,4hz,2h),2.13(s,1h),1.95(s,2h),1.86–1.74(m,4h),1.75–1.61(m,4h),1.59–1.37(m,6h)。
19fnmr(470mhz,d2o/cd3cn):δ=-83.04(d,j=154.1hz,3f),-115.31(s,2f),-122.99(s,2f),-124.04(s,2f),-124.31(s,2f),-127.63(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=182.15,175.26,54.57,39.05,37.18,31.66,31.45,30.25,28.76,28.37,26.45,25.54,22.06,21.50。
实施例25-制备盐2d3l
将0.494g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-八-硫代己酸2d溶解在20ml甲醇中加入0.174g(1.00mmol)l-精氨酸的水(0.5ml)溶液。然后加入5ml水,并将混合物回流2小时,然后冷却并浓缩至干,得到产物0.690g(产率99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.63(t,j=6.2hz,1h),3.22(t,j=7.0hz,2h),2.75–2.67(m,2h),2.56(dd,j=16.8,9.5hz,2h),2.36(ddd,j=36.0,22.3,7.3hz,2h),2.16(t,j=7.5hz,2h),1.94–1.82(m,2h),1.76–1.50(m,6h),1.39(dt,j=14.7,7.3hz,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.98–-83.09(m,3f),-115.32(s,2f),-122.96(s,2f),-123.96(s,2f),-124.38(s,2f),-127.42(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=182.23,174.64,156.95,54.39,40.59,37.54,31.56,28.78,28.36,28.18,25.71,24.21,21.96。
实施例26-制备盐2d3f
将0.494g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-八-硫代己酸2d溶解在20ml甲醇中,并加入0.148g(1.00mmol)的2.2′-(亚乙二氧基)-双(乙胺)。回流2小时后,将混合物冷却并浓缩至干,得到产物0.628g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.85–3.75(m,8h),3.18(dd,j=14.5,9.4hz,4h),2.80(s,2h),2.67(d,j=6.5hz,2h),2.44(s,2h),2.25(s,2h),1.68(d,j=22.7hz,4h),1.49(s,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.15–-85.38(m,3f),-115.40(s,2f),-122.68(d,j=346.8hz,2f),-124.32(s,2f),-127.83(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.11,69.60,67.91,39.22,37.64,31.87,31.46,28.96,28.60,25.82,22.18。
实施例27-制备盐2d3g
将0.494g(1.00mmol)的3,3,4,4,5,5,6,6,7,7,8,8,8-三氟甲苯氟-1-八-硫代己酸2d溶解在20ml甲醇中,并加入0.220g(1.00mmol)的4,7,10-三氧代-1,13-十三烷二胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.710g(99%产率)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=3.92–3.80(m,12h),3.21(dd,j=13.1,6.0hz,4h),2.96–2.89(m,2h),2.80(t,j=7.4hz,2h),2.66–2.50(m,2h),2.38–2.31(m,2h),2.17–2.04(m,4h),1.79(qd,j=15.2,7.6hz,4h),1.59(dt,j=15.1,7.5hz,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-81.78–-83.50(m,3f),-115.15(d,j=15.6hz,2f),-122.90(s,2f),-123.96(s,2f),-124.19(s,2f),-127.52(d,j=14.1hz,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=182.27,69.71,69.55,68.62,37.83,37.80,31.88,29.05,28.68,27.75,25.93,22.18。
实施例28-制备盐2e3c
将0.708g(1.00mmol)的8-(1h,1h,2h,2h--全氟癸烷)-硫-1-辛基琥珀酸单酯2e溶解在20ml甲醇中,并加入0.149g(1.00mmol)三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.635g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.33(t,j=6.5hz,2h),4.14(t,j=5.1hz,6h),3.55(s,6h),2.95(d,j=7.6hz,2h),2.82(dd,j=12.7,6.3hz,4h),2.73(dd,j=17.0,7.0hz,2h),2.67–2.53(m,2h),1.99–1.80(m,4h),1.69–1.53(m,10h)。
19fnmr(470mhz,d2o/cd3cn):δ=-83.01(s,3f),-115.37(s,2f),-122.71(s,2f),-122.98(d,j=31.7hz,4f),-123.06(s,2f),-124.06(s,2f),-127.72(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=177.88,173.91,64.11,55.34,54.79,31.40,31.12,30.04,29.44,28.50,27.97,27.67,25.57,25.00,24.57,21.43。
实施例29-制备盐2e3e
将0.708g(1.00mmol)的8-(1h,1h,2h,2h--全氟癸烷)-硫-1-辛基琥珀酸单酯2e溶解在20ml甲醇中,并加入0.146g(1.00mmol)l-赖氨酸水(1ml)溶液。向反应混合物中加入5ml水,并将混合物回流2小时,然后冷却并浓缩至干,得到产物0.840g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.25(t,j=6.8hz,2h),3.89(t,j=6.1hz,1h),3.22–3.16(m,2h),2.93–2.84(m,2h),2.80–2.71(m,4h),2.67–2.59(m,2h),2.54(d,j=25.9hz,2h),2.12–2.01(m,2h),1.90(dt,j=15.1,7.7hz,2h),1.80(dt,j=14.2,10.9hz,4h),1.66-1.45(m,8h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.86(d,j=239.0hz,3f),-115.47(s,2f),-122.46(d,j=276,3hz,2f),-123.07(d,j=49.4hz,4f),-123.16(s,2f),-124.15(s,2f),-127.81(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=176.00,175.56,174.75,64.92,54.62,45.97,39.15,32.20,31.78,30.41,30.15,29.30,28.47,28.12,27.97,26.51,25.23,21.59。
实施例30-制备盐2e3l
将0.708g(1.00mmol)的8-(1h,1h,2h,2h--全氟癸烷)-硫-1-辛基琥珀酸单酯2e溶解在20ml甲醇中,并加入0.174g(1.00mmol)l-精氨酸的水(0.1ml)溶液。然后加入5ml水,并将混合物回流2小时,然后冷却并浓缩至干,得到0.840g产物(收率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3od):δ=4.34(t,j=6.7hz,2h),3.95(t,j=6.1hz,2h),3.88(t,j=6.6hz,1h),3.44(t,j=6.9hz,2h),2.84–2.74(m,4h),2.73–2.62(m,2h),2.19–2.07(m,2h),2.01(dd,j=14.5,7.0hz,2h),1.97–1.76(m,4h),1,71–1.48(m,10h)。
19fnmr(470mhz,d2o/cd3od):δ=-83.27(s,3f),-115.11(s,2f),-123.06(s,24f),-124.11(s,4f),-128.02(s,4f)。
13cnmr(126mhz,d2o/cd3od):δ=231.89,180.25,175.90,174.36,156.97,65.38,54.39,45.94,40.69,32.21,32.16,30.85,29.44,28.58,28.22,28.06,27.80,26.33,26.02,25.33,24.17。
实施例31-制备盐2e3f
将0.708g(1.00mmol)的8-(1h,1h,2h,2h--全氟癸烷)-硫-1-辛基琥珀酸单酯2e溶解在20ml甲醇中,并加入0.148g(1.00mmol)2,2'-(乙炔二氧)双(乙胺)。回流2小时后,将混合物冷却并浓缩至干,得到产物0.838g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3od):δ=4.03–3.94(m,8h),3.93–3.88(m,2h),3.42–3.33(m,4h),2.88–2.77(m,4h),2.75–2.64(m,4h),2.32(dt,j=5.0,2.5hz,2h),1.89(dd,j=22.3,15.6hz,4h),1.75–1.46(m,8h)。
19fnmr(470mhz,d2o/cd3od):δ=-83.08(d,j=9.8hz,3f),-115.38(s,2f),-123.04(s,4f),-124.05(s,4f),-127.78(s,4f)。
13cnmr(126mhz,d2o/cd3od):δ=180.03,174.89,70.05,67.81,64.87,39.41,32.26,32.09,30.92,30.69,29.42,28.70,28.33,25.96。
实施例32-制备盐2f3c
将0.264g(0.35mmol)的8-(1h,1h,2h,2h--全氟癸烷)-硫代-1-辛基邻苯二甲酸单酯2f溶解在10ml甲醇中,并加入0.052g(0.35mmol)三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.340g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3od):δ=7.58(dd,j=12.5,6.8hz,2h),7.46(dd,j=14.9,7.4hz,1h),7.36(t,j=7.5hz,1h),4.20(t,j=6.4hz,2h),3.95–3.86(m,6h),3.43–3,37(m,6h),2.67(s,2h),2.48(t,j=7.1hz,2h),2.33(s,3h),1.74(dt,j=9,1,6.5hz,1h),1.64(d,j=6.5hz,2h),1.51(d,j=6.4hz,2h),1.39–1.17(m,8h)。
19fnmr(470mhz,d2o/cd3od):δ=-82.27–-83.58(m,3f),-115.52(s,2f),-122.75(s,2f),-123.13(s,4f),-124.03(s,2f),-124.28(s,2f),-127.73(s,2f)。
13cnmr(126mhz,d2o/cd3od):δ=173.34,168.75,141.12,137.99,131.41,131.12,130.55,127.96,65.62,65.47,61.70,55.80,44.90,31.83,29.05,28.54,28.25,25.79,22.15,13.08。
实施例33-制备盐2g3c
将0.289g(0.40mmol)8-(1h,1h,2h,2h--全氟癸烷)-硫代-1-辛基戊二酸单酯2g溶解在10ml甲醇中,并加入0.06g(0.40mmol)三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.340g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3od):δ=4.10(t,j=6.6hz,2h),3.85(t,j=5.2hz,6h),3.61(t,j=6.6hz,2h),3.40(s,2h),3.22(s,6h),2.38(t,j=7.6hz,2h),2.19(t,j=7.6hz,2h),2.11–2.02(m,2h),1.85(dt,j=15.2,7.7hz,2h),1.80–1.71(m,2h),1.64(dd,j=13.7,6.8hz,4h),1.43(dd,j=13.7,7.0hz,4h),1.31(d,j=41.8hz,6h)。
19fnmr(470mhz,d2o/cd3od):δ=-81.42(m,3f),-115.01(s,2f),-122.94(s,2f),-122.38(s,2f),-123.13(s,2f),-123.72–-123.91(m,2f),-124.15(s,2f),-126.21(s,2f)。
13cnmr(126mhz,d2o/cd3od):δ=180.99,175.61,64.90,56.35,55.63,45.29,36.66,33.66,32.10,28.51,28.48,28.16,28.02,26.22,25.30,25.13,21.52。
实施例34-制备盐2g3e
将0.289g(0.40mmol)8-(1h,1h,2h,2h--全氟癸烷)-硫代-1-辛基戊二酸单酯2g溶解在10ml甲醇中,并加入0.058g(0.40mmol)l-赖氨酸的水(0.2ml)溶液。回流2小时后,将混合物冷却并浓缩至干,得到产物0.345g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3od):δ=4.08(td,j=6.6,3.4hz,2h),3.62(q,j=6.5hz,2h),2,97(t,j=7.4hz,2h),2.82–2.74(m,1h),2.60(t,j=7.3hz,2h),2.56–2.42(m,2h),2.36(t,j=7.6hz,2h),2.17(t,j=7.6hz,2h),2.04(dt,j=4.9,2.5hz,2h),1.94–1.80(m,4h),1.74–1.53(m,6h),1.53–1.19(m,8h)。
19fnmr(470mhz,d2o/cd3od):δ=-81.55(t,j=9.2hz,3f),-114.59(s,2f),-122.25(s,2f),-122.41(s,2f),-123.22(s,2f),-123.53–-123.72(m,2f),-123.91(s,2f),-126.64(s,2f)。
13cnmr(126mhz,d2o/cd3od):δ=180.20,173.85,172.57,64.68,54.54,45.33,39.06,36.75,33.68,32.21,31.41,30.17,28.92,28.70,28.60,28.29,28.18,26.52,26.34,25.44,21.58。
实施例35-制备盐2h3c
将0.323g(0.53mmol)的8-(1h,1h,2h,2h--全氟辛烷)-硫代1-辛基琥珀酸单酯2h溶解在10ml甲醇中,并加入0.079g(0.53mmol)三乙醇胺。回流2小时后,将混合物冷却并浓缩至干,得到产物0.400g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.43(t,j=6.7hz,3h),4.38(t,j=6.8hz,2h),4.27–4.19(m,6h),3.97(t,j=6.6hz,2h),3.77–3.70(m,6h),2.87(ddd,j=18.0,12.5,7.0hz,2h),2.38(dt,j=4.5,2.2hz,2h),2.11(dd,j=14.4,7.0hz,2h),2.01–1.83(m,4h),1.81–1.51(m,8h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.43(t,j=10.0hz,3f),-114.26–-115.82(m,2f),-122.73(s,2f),-123.77(s,2f),-124.10(s,2f),-127.26(d,j=14.3hz,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=179.66,174.44,65.30,55.57,45.89,31.89,30.77,30.01,29.26,28.81,28.44,26.52,25.52,22.24。
实施例36-制备盐2h3e
将0.323g(0.53mmol)的8-(1h,1h,2h,2h--全氟辛烷)-硫代1-辛基琥珀酸单酯2h溶解在10ml甲醇中,并加入0.077g(0.53mmol)l-赖氨酸的水(0.2ml)溶液。回流2小时后,将混合物冷却并浓缩至干,得到产物0.395g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.32(t,j=6.6hz,2h),3.93(t,j=6.0hz,1h),3.86(t,j=6.6hz,2h),3.22(t,j=7.5hz,2h),2.79(t,j=7.1hz,4h),2.66(t,j=7.0hz,2h),2.10(qd,j=13.9,8.2hz,2h),2.05–1.96(m,2h),1.99–1.79(m,6h),1.74–1.48(m,12h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.77(s,3f),-115.34(s,2f),-122.91(s,2f),-124.10(d,j=115.6hz,2f),-124.25(s,2f),-127.54(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=180.03,175.79,174.30,65.36,54.60,45.89,39.17,32.17,32.04,30.75,29.99,28.59,28.23,28.06,26.48,26.34,25.33,21.57。
实施例37-制备盐2i3c
将1.8g(3.88mmol)的1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i溶解在5ml甲醇中,并加入0.58g(3.88mmol)三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物2.33g(产率=98%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=6.24(s,3h),4.36(t,j=6.7hz,2h),3.87–3.74(m,6h),3.08–3.00(m,6h),2.61–2.39(m,6h)。
19fnmr(470mhz,cdcl3):δ=-80.91(t,j=10.0hz,3f),-112.84–-114.39(m,2f),-121.69–-122.15(m,2f),-122.75–-123.16(m,2f),-123.50–-124.09(m,2f),-126.02–-126.56(m,2f)。
13cnmr(126mhz,cdcl3):δ=177.88,172.95,57.55,57.43,56.32,30.62,30.40,29.76。
实施例38-制备盐2i3e
将0.600g(1.29mmol)的1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i溶解在2ml甲醇中,将加入0.188g(1.29mmol)的l-赖氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.756g(产率=96%)。
光谱分析:
1hnmr(500mhz,d2o):δ=4.23(t,j=6.3hz,2h),3.62(t,j=6.1hz,1h),2.96–2.83(m,2h),2.49–2.25(m,6h),1.87–1.70(m,2h),1.59(dt,j=15.0,7.7hz,2h),1.44–1.25(m,2h)。
19fnmr(470mhz,d2o):δ=-82.93(s,3f),-114.80(s,2f),-123.01(s,2f),-124.10(s,2f),-124.73(s,2f),-127.68(s,2f)。
13cnmr(126mhz,d2o):δ=179.79,174.75,174.63,56.62,54.40,38.95,31.28,29.88,29.80,29.60,26.33,21.38。
实施例39-制备盐2ik
将0.50g(1.08mmol)的1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i溶解在2ml甲醇中,并加入0.149g(1.08mmol)的k2co3的水(1ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.524g(产率=97%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=4.41–4.35(m,1h),2.60–2.54(m,2h),2.51–2.44(m,2h)。
19fnmr(470mhz,cd3od):δ=-82.42–-82.52(m,3f),-114.58–-114.80(m,2f),-122.94(s,2f),-123.94(s,2f),-124.67(s,2f),-127.14–-127.72(m,2f)。
13cnmr(126mhz,cd3od):δ=178.20,173.24,55.93,33.40,31.35,30.00。
实施例40-制备盐2i2i3i
将0.500g(1.08mmol)的1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i溶解在2ml甲醇中,并加入0.118g(0.538mmol)的4,7,10-三氧代-1,13-十三烷二胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.610g(99%产率)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=5.70(s,3h),4.36(t,j=6.5hz,2h),3.62(d,j=21.5hz,6h),3.08–3.00(m,j=5.8hz,2h),2.59–2.51(m,2h),2.51–2.34(m,4h),1.97–1.87(m,2h)。
19fnmr(470mhz,cdcl3):δ=-80.64–-81.16(m,3f),-113.68–-114.00(m,2f),-122.02(s,2f),-122.99(s,2f),-123.70(s,2f),-126.13–-126.34(m,2f)。
13cnmr(126mhz,cdcl3):δ=178.47,173.53,70.06,69.74,69.21,56.08,38.19,32.11,30.59,30.41,27.01。
实施例41-制备盐2i2i3h
将0.500g(1.08mmol)的1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i溶解在2ml甲醇中,并加入0.080g(0.538mmol)的2.2'-(乙二氧基)-双(乙胺)。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.568g(收率=98%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=5.91(s,3h),4.36(t,j=6.4hz,2h),3.73–3.55(m,4h),3.07(s,2h),2.56(t,j=6.6hz,2h),2.50–2.41(m,4h)。
19fnmr(470mhz,cdcl3):δ=-80.67–-81.44(m,3f),-113.62–-114.18(m,2f),-122.04(s,2f),-123.02(s,2f),-123.74(s,2f),-126.07–-126.56(m,2f)。
13cnmr(126mhz,cdcl3):δ=178.90,173.52,69.33,66.62,56.12,39.15,33.84,32.03,30.41。
实施例42-制备盐2i3k
将0.400g(0.86mmol)的1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i溶解在2ml甲醇中,然后加入0.104g(0.86mmol)的trizma-base(三(羟甲基)氨基甲烷)。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.492g(产率=98%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=4.38(t,j=6.4hz,2h),3.65(s,6h),2.63–2.53(m,4h),2.52–2.44(m,2h)。
19fnmr(470mhz,cd3od):δ=-82.45(t,j=10.2hz,3f),-114.60–-114.83(m,2f),-122.93(s,2f),-123.93(s,2f),-124.66(s,2f),-127.19–-127.60(m,2f)。
13cnmr(126mhz,cd3od):δ=179.99,174.61,62.15,61.49,57.33,32.98,31.49,31.30。
实施例43-制备盐2i3l
将0.350g(3.88mmol)的1h,1h,2h,2h-全氟-1-辛基琥珀酸单酯2i溶解在2ml甲醇中,并加入0.131g(0.75mmol)的l-精氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.476g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o):δ=4.23(t,j=6.3hz,2h),3.61(t,j=6.1hz,1h),3.10(t,j=6.9hz,2h),2.44-2.28(m,6h),1.83-1.71(m,2h),1.64-1.47(m,2h)。
19fnmr(470mhz,d2o):δ=-82.78(s,3f),-114.74(s,2f),-122.94(s,2f),-124.03(s,2f),-124.65(s,2f),-127.56(s,2f)。
13cnmr(126mhz,d2o):δ=182.68,177.45,177.33,159.43,59.17,56.92,43.07,34.11,32.56,32.28,30.35,26.58。
实施例44-制备盐2j3a
将0.500g(0.89mmol)的1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j溶解在2ml甲醇中,并加入0.102g(0.89mmol)tmg。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.598g(产率=99%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=3.93(t,j=6.7hz,2h),2.96(s,12h),2.58(t,j=7.1hz,2h),2.47(t,j=7.0hz,2h),2.37(ddd,j=19.1,12.9,6.7hz,2h)。
19fnmr(470mhz,cdcl3):δ=-80.89(s,3f),-113.54(s,2f),-121.80(s,2f),-122.02(s,4f),-122.82(s,2f),-123.77(s,2f),-126.21(s,2f)。
13cnmr(126mhz,cdcl3):δ=178.08,174.64,162.66,54.33,51.26,39.56,33.92,32.78,31.03。
实施例45-制备盐2j3c
将0.500g(0.89mmol)的1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j溶解在2ml甲醇中,并加入0.132g(0.89mmol)三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.628g(99%产率)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=5.15(s,3h),4.43(t,j=6.3hz,2h),3.72–3.62(m,6h),2.95–2.86(m,6h),2.68(tt,j=19.0,6.2hz,2h),2.62–2.51(m,4h)。
19fnmr(470mhz,丙酮-d6):δ=-81.71(t,j=10.1hz,3f),-114.05(s,2f),-122.22(s,2f),-122.45(s,2f),-122.46(s,2f),-123.28(s,2f),-124.13(s,2f),-126.76(s,2f)。
13cnmr(126mhz,丙酮-d6):δ=174.47,172.05,58.63,57.33,55.93,30.03,29.26,29.14。
实施例46-制备盐2j3e
将0.500g(0.89mmol)的1h,1h,2h,2h--全氟-1-癸基琥珀酸单酯2j溶解在2ml甲醇中,并加入0.129g(0.89mmol)l-赖氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.625g(收率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.41(t,j=6.4hz,2h),3.77(t,j=6.1hz,1h),3.06(t,j=7.5hz,2h),2.67–2.50(m,6h),2.00–1.87(m,2h),1.83–1.71(m,2h),1.59–1.46(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-83.04(t,j=10.2hz,3f),-114.60–-114.83(m,2f),-122.72(s,2f),-122.99(s,2f),-123.10(s,2f),-124.02(s,2f),-124.40(s,2f),-127.74(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=178.58,174.29,174.11,56.48,54.58,39.14,30.97,30.01,29.82,29.78,26.50,21.59。
实施例47-制备盐2jna
将0.100g(0.18mmol)的1h,1h,2h,2h--全氟-1-癸基琥珀酸单酯2j溶解在1ml甲醇中,然后加入0.015g(0.18mmol)nahco3的水(1ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.103g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.44(t,j=6.5hz,2h),2.68–2.50(m,6h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.98(s,3f),-114.58(s,2f),-122.67(s,2f),-122.94(s,2f),-123.04(s,2f),-123.97(s,2f),-124.33(s,2f),-127.69(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=178.96,174.34,56.52,31.21,29.98,29.80。
实施例48-制备盐2jk
将0.100g(0.18mmol)的1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j溶解在1ml甲醇中,然后加入0.012mg(0.09mmol)的k2co3的水(1ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.105g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.44–4.28(m,2h),2.63–2.38(m,6h)。
19fnmr(470mhz,d2o/cd3cn):δ=-83.13(s,3f),-114.70(s,2f),-122.77(s,2f),-123.06(s,4f),-124.08(s,2f),-124.44(s,2f),-127.82(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=178.65,174.24,56.46,48.96,30.92,29.73。
实施例49-制备盐2j2j3i
将0.400g(0.71mmol)的1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j溶解在2ml甲醇中,并加入0.078g(0.35mmol)4,7,10-三氧代-1,13-十三烷二胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.472g(产率=99%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=5.49(s,3h),4.36(t,j=6.7hz,2h),3.68–3.57(m,6h),3.04(t,j=6.1hz,2h),2.56(t,j=6.9hz,2h),2.50–2.41(m,4h),1.97–1.91(m,2h)。
19fnmr(470mhz,cdcl3):δ=-80.82–-80.94(m,3f),-113.66–-113.83(m,2f),-121.78(s,2f),-122.02(s,4f),-122.81(s,2f),-123.63(s,2f),-126.14–-126.42(m,2f)。
13cnmr(126mhz,cdcl3):δ=178.39,173.52,70.09,69.73,69.41,56.07,38.34,32.14,30.65,30.44,27.05。
实施例50-制备盐2j2j3h
将0.400g1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j溶解在2ml甲醇中,0.052g(0.35mmol)的2.2′-(亚乙二氧基)-双(乙胺)。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.447g(产率=99%)。
光谱分析:
1hnmr(500mhz,cdcl3):δ=5.83(s,3h),4.36(t,j=6.6hz,2h),3.68–3.61(m,4h),3.08–3.02(m,2h),2.59–2.53(m,2h),2.49–2.41(m,4h).
19fnmr(470mhz,cdcl3):δ=-80.91(s,3f),-113.78(s,2f),-121.80(s,2f),-122.04(s,4f),-122.83(s,2f),-123.66(s,2f),-126.23(s,2f)。
13cnmr(126mhz,cdcl3):δ=178.87,173.50,69.28,66.74,56.10,39.17,32.11,30.48,30.41。
实施例51-制备盐2j3k
将0.400g(0.71mmol)的1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j溶解在2ml甲醇中,并加入0.086g(0.71mmol)的trizma-base(三(羟甲基)氨基甲烷)。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.480g(产率=99%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=4.37(t,j=6.5hz,2h),3.64(s,6h),2.66–2.53(m,4h),2.47(t,j=7.2hz,2h).19fnmr(470mhz,cd3od):δ=-82.40(s,3f),-114.69(s,2f),-122.69(s,2f),-122.92(s,4f),-123.76(s,2f),-124.61(s,2f),-127.30(s,2f)。
13cnmr(126mhz,cd3od):δ=179.91,174.60,61.53,57.33,32.94,31.48,31.31。
实施例52-制备盐2j3l
将0.350g(0.62mmol)的1h,1h,2h,2h-全氟-1-癸基琥珀酸单酯2j溶解在2ml甲醇中,并加入0.108g(0.62mmol)的l-精氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.454g(产率=99%)。
光谱分析:1hnmr(500mhz,d2o):δ=4.38(t,j=6.4hz,2h),3.75(t,j=6.2hz,1h),3.24(t,j=7.0hz,2h),2.59–2.43(m,6h),1.96–1.87(m,2h),1.78–1.63(m,2h)。
19fnmr(470mhz,d2o):δ=-82.95–-83.18(m,3f),-114.69(s,2f),-122.74(s,2f),-123.01(s,2f),-123.12(s,2f),-124.04(s,2f),-124.40(s,2f),-127.76(s,2f)。
13cnmr(126mhz,d2o):δ=179.65,174.51,174.41,156.90,56.46,54.38,40.62,31.64,30.13,29.75,27.77,24.08。
实施例53-制备盐2l3c
将0.350g(0.60mmol)的1h,1h,2h,2h-全氟-1-癸基戊二酸单酯2l溶解在2ml甲醇中,并加入0.090g(0.60mmol)三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.429g(产率=98%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.57(t,j=6.4hz,2h),4.07(t,j=5.4hz,6h),3.49(t,j=5.4hz,6h),2.81–2.68(m,2h),2.58(t,j=7.6hz,2h),2.41(t,j=7,7hz,2h),2.09–1.99(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.46(s,3f),-114.33(s,2f),-122.45(s,2f),-122.79(s,4f),-123.68(s,2f),-124.17(s,2f),-127.34(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.12,175.19,57.10,56.78,56.32,36.88,34.01,30.59,21.85。
实施例54-制备盐2l3e
将0.350g(0.60mmol)的1h,1h,2h,2h-全氟-1-癸基戊二酸单酯2l溶解在2ml甲醇中,并加入0.088g(0.60mmol)的l-赖氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.431g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.37(t,j=6.3hz,2h),3.67(t,j=6.2hz,1h),3.01(t,j=7.5hz,2h),2.57–2.48(m,2h),2.38(t,j=7.5hz,2h),2.19(t,j=7,7hz,2h),1.90–1.80(m,4h),1.75–1.66(m,2h),1.55–1.39(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-83.02(s,3f),-114.65(s,2f),-122.74(s,2f),-123.00(s,2f),-123.10(s,2f),-124.02(s,2f),-124.43(s,2f),-127.74(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.33,175.51,174.71,56.39,54.71,39.15,36.64,33.25,30.49,29.76,26.55,21.60,21.25。
实施例55-制备盐2l3k
将0.350g(0.60mmol)的1h,1h,2h,2h-全氟-1-癸基戊二酸单酯2l溶解在2ml甲醇中,并加入0.073g(0.60mmol)的trizma-base(三(羟甲基)氨基甲烷)。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.416g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.61(t,j=6.5hz,2h),3.92(s,6h),2.78(tt,j=18.8,6.1hz,2h),2.61(t,j=7.6hz,2h),2.44(t,j=7.6hz,2h),2.10–2.02(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.44(s,3f),-114.29(s,2f),-122.38(s,2f),-122.70(s,4f),-123.61(s,2f),-124.10(s,2f),-127.25(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=180.75,174.64,61.23,60.15,56.54,36.39,33.45,30.03,21.31。
实施例56-制备盐2l3l
将0.350g(0.60mmol)的1h,1h,2h,2h-全氟-1-癸基戊二酸单酯2l溶解在2ml甲醇中,并加入0.105g(0.60mmol)l-精氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.448g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.49(t,j=6.5hz,2h),3.83(t,j=6.1hz,1h),3.35(t,j=7.0hz,2h),2.71–2.58(m,2h),2.50(t,j=7.6hz,2h),2.31(t,j=7.7hz,2h),2.07–1.91(m,4h),1.89–1.74(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.85(t,j=10.1hz,3f),-114.08–-114.88(m,2f),-122.59(s,2f),-122.86(s,2f),-122.96(s,2f),-123.87(s,2f),-124.28(s,2f),-127.57(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.92,175.29,175.26,157.68,57.08,55.15,41.41,37.42,34.03,30.55,28.65,24.88,22.03。
实施例57-制备盐2k3c
将0.350g(0.73mmol)的1h,1h,2h,2h-全氟-1-辛基戊二酸单酯2k溶解在2ml甲醇中,并加入0.109g(0.73mmol)三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.455g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.35(t,j=6.4hz,2h),3.81(t,j=5.6hz,6h),3.13(t,j=5.1hz,6h),2.55–2.45(m,2h),2.35(t,j=7.6hz,2h),2.17(t,j=7.7hz,2h),1.85–1.77(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.67(s,3f),-114.59(s,2f),-122.87(s,2f),-123.94(s,2f),-124.49(s,2f),-127.47(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.05,174.80,56.71,55.53,36.31,33.20,32.10,29.74,21.08。
实施例58-制备盐2k3e
将0.350g(0.73mmol)的1h,1h,2h,2h-全氟-1-辛基戊二酸单酯2k溶解在2ml甲醇中,并加入0.107g(0.73mmol)l-赖氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.453g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o):δ=4.20(t,j=6.4hz,2h),3.55(t,j=6.1hz,1h),2.91–2.84(m,2h),2.39–2.25(m,2h),2.19(dd,j=17.8,10.3hz,2h),2.04(dd,j=10.0,5.3hz,2h),1.80–1.72(m,2h),1.68–1.55(m,4h),1.41–1.24(m,2h)。
19fnmr(470mhz,d2o):δ=-83.02(s,3f),-114.98(s,2f),-123.09(s,2f),-124.19(s,2f),-124.83(s,2f),-127.78(s,2f)。
13cnmr(126mhz,d2o):δ=184.05,178.38,177.40,59.09,57.20,41.64,39.02,35.64,33.00,32.26,29.08,24.10,23.65。
实施例59-制备盐2k3k
将0.350g(0.73mmol)的1h,1h,2h,2h-全氟-1-辛基戊二酸单酯2k溶解在2ml甲醇中,并加入0.088g(0.73mmol)的trizma-base(三(羟甲基)氨基甲烷)。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.434g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.48(t,j=6.4hz,2h),3.78(s,6h),2.70–2.55(m,2h),2.49(t,j=7.6hz,2h),2.34-2.28(m,2h),1.98-1.91(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.85(t,j=10.1hz,3f),-114.70(s,2f),-122.95(s,2f),-124.04(s,2f),-124.56(s,2f),-127.60(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.30,174.78,60.77,60.04,56.43,36.41,33.19,29.73,21.11。
实施例60-制备盐2k3l
将0.350g(0.73mmol)的1h,1h,2h,2h-全氟-1-辛基戊二酸单酯2k溶解在2ml甲醇中,并加入0.127g(0.73mmol)l-精氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.473g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=4.31(t,j=6.4hz,2h),3.57(t,j=6.2hz,1h),3.18(t,j=6.9hz,2h),2.51–2.40(m,2h),2.32(t,j=7.5hz,2h),2.18–2.10(m,2h),1.85–1.74(m,4h),1.69–1.55(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.96(t,j=10.1hz,3f),-114.80(s,2f),-123.02(s,2f),-124.11(s,2f),-124.63(s,2f),-127.70(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=181.47,176.48,174.71,156.81,56.37,54.64,40.68,36.65,33.18,29.70,28.68,24.14,21.19。
实施例61-制备盐2m3c
将0.600g(1.17mmol)的1h,1h,2h,2h-全氟-1-辛基邻苯二甲酸单酯2m溶解在2ml甲醇中,并加入0.175g(1.17mmol)三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.766g(产率=99%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=7.66(d,j=7.7hz,1h),7.59(d,j=7.6hz,1h),7.51(td,j=7.5,0.9hz,1h),7.40(td,j=7.6,1.0hz,1h),4.57(t,j=6.7hz,2h),3.82–3.76(m,6h),3.17(t,j=5.2hz,6h),2.74(tt,j=18.9,6.6hz,2h)。
19fnmr(470mhz,cd3od):δ=-82.40–-82.47(m,3f),-114.39–-114.83(m,2f),-122.90(s,2f),-123.91(s,2f),-124.54(s,2f),-127.22–-127.60(m,2f)。
13cnmr(126mhz,cd3od):δ=174.84,168.10,140.95,131.03,129.31,128.09,127.87,127.43,56.75,56.58,55.93,29.76。
实施例62–制备盐2m3e
将0.600g(1.17mmol)的1h,1h,2h,2h-全氟-1-辛基邻苯二甲酸单酯2m溶解在2ml甲醇中,并加入0.171g(1.17mmol)l-赖氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.763g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=7.62–7.57(m,j=6.3hz,2h),7.54(t,j=7.6hz,1h),7.35(t,j=7.5hz,1h),4.57(t,j=5.6hz,2h),3.74(t,j=6.1hz,1h),3.04(t,j=7.5hz,2h),2.67–2.52(m,2h),1.97–1.83(m,2h),1.78–1.70(m,2h)),1.59–1.39(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.52(t,j=10.1hz,3f),-114.21(d,j=15.7hz,2f),-122,68(s,2f),-123.77(s,2f),-124.20(s,2f),-127.32(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=177.90,177.57,171.43,143.28,134.64,131.66,130.93,130.60,130.51,60.10,57.34,41.84,32.92,32.36,29.18,24.27。
实施例63-制备盐2m3l
将0.600g(1.17mmol)的1h,1h,2h,2h-全氟-1-辛基邻苯二甲酸单酯2m溶解在2ml甲醇中,并加入0.204g(1.17mmol)的l-精氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.796g(产率=99%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=7.69(d,j=7.8hz,1h),7.56–7.49(m,2h),7.39(td,j=7.6,1.4hz,1h),4.57(t,j=6.6hz,2h),3.54–3.46(m,1h),3.23–3.16(m,2h),2.82–2.66(m,2h),1.93–1.78(m,2h),1.75–1.63(m,2h)。
19fnmr(470mhz,cd3od):δ=-82.39–-82.46(m,3f),-114.27–-114.72(m,2f),-122.88(s,2f),-123.89(s,2f),-124.52(s,2f),-127.08–-127.64(m,2f)。
13cnmr(126mhz,cd3od):δ=178.14,177.75,170.66,160.06,144.41,133.94,131.36,130.90,130.32,129.81,59.46,56.98,43.20,32.43,31.52,27.16。
实施例64-制备盐2n3c
将0.600g(0.98mmol)的1h,1h,2h,2h-全氟-1-癸基邻苯二甲酸单酯2n溶解在2ml甲醇中,并加入0.146g(0.98mmol)三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.739g(产率=99%)。
光谱分析:
1hnmr(500mhz,cd3od):δ=7.64(d,j=7.7hz,1h),7.56(d,j=7.6hz,1h),7.48(td,j=7.5,0.9hz,1h),7.38(td,j=7.6,0.9hz,1h),4.54(t,j=6.7hz,2h),3.85–3.78(m,6h),3.30–3.24(m,7h),2.76–2.65(m,2h).
19fnmr(470mhz,cd3od):δ=-82.40(s,3f),-114.56(s,2f),-122.66(s,2f),-122.91(s,4f),-123.75(s,2f),-124.50(s,2f),-127.30(s,2f).
13cnmr(126mhz,cd3od):δ=175.77,169.46,141.86,132.48,130.87,129.56,129.48,128.91,58.21,57.38,57.17,31.20.
实施例65-制备盐2n3e
将0.600g(0.98mmol)的1h,1h,2h,2h-全氟-1-癸基邻苯二甲酸单酯2n溶解在2ml甲醇中,并加入0.143g(0.98mmol)l-赖氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.736g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/丙酮-d6):δ=7.58(d,j=7.6hz,1h),7.44–7.36(m,2h),7.27(t,j=7.5hz,1h),4.46(与水信号一致,2h),3.65(t,j=6.0hz,1h),2.96(t,j=7.4hz,2h),2.56(t,j=18.9hz,2h),1.87–1.78(m,2h),1.70–1.58(m,2h),1.50–1.35(m,2h)。
19fnmr(470mhz,d2o/丙酮-d6):δ=-82.81(t,j=10.2hz,3f),-114.34–-114.61(m,2f),-122,70(s,2f),-122.98(s,2f),-123.10(s,2f),-123.98(s,2f),-124.29(s,2f),-127,64(s,2f).
13cnmr(126mhz,d2o/丙酮-d6):δ=173.77,172.87,168.86,138.50,131.27,130.49,128.75,128.42,127.42,57.16,54.45,39.05,29.89.29.59,26.40,21.47。
实施例66-制备盐2n3l
将0.600g(0.98mmol)的1h,1h,2h,2h-全氟-1-癸基邻苯二甲酸单酯2n溶解在2ml甲醇中,并加入0.170g(0.98mmol)l-精氨酸的水(0.5ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.736g(产率=99%)。
光谱分析:
1hnmr(500mhz,d2o/cd3cn):δ=7.62(d,j=7.3hz,1h),7.58(d,j=7.7hz,1h),7.52(t,j=7.4hz,1h),7.32(t,j=7.5hz,1h),4.57–4.45(m,2h),3.82(t,j=5,9hz,1h),3.26(t,j=6.9hz,2h),2.53(t,j=18.3hz,2h),2.03–1.92(m,2h),1.88–1.67(m,2h)。
19fnmr(470mhz,d2o/cd3cn):δ=-82.94(t,j=10.1hz,3f),-114.40(s,2f),-122.56(s,2f),-122.86(s,2f),-122.98(s,2f),-123.90(s,2f),-124.20(s,2f),-127.64(s,2f)。
13cnmr(126mhz,d2o/cd3cn):δ=177.80,176.99,171.23,159.63,143.39,134.59,131.69,130.82,130.59,130.54,59.99,57.10,43.34,32.32,30.48,26.86。
实施例67-制备盐2o3c
将(0.350g,0.49mmol)的1h,1h,2h,2h-全氟-1-十二烷基邻苯二甲酸单酯2o溶解在5ml甲醇中,并加入0.073g(0.49mmol)的三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.418g(产率=99%)。
光谱分析:
1hnmr(500mhz,dmso/丙酮-d6)δ=7.81–7.71(m,1h),7.59–7.47(m,3h),4.50(t,j=6,2hz,2h),3.49(t,j=5.9hz,6h),2.79–2.60(m,8h)。
19fnmr(470mhz,dmso/丙酮-d6)δ=-81.08(t,j=9.9hz,3f),-113.35(d,j=15.9hz,2f),-121.79-122.33(m,10f),-123.00(s,2f),-123.55(s,2f),-126.40(s,2f)。
13cnmr(126mhz,dmso/丙酮-d6)δ=168.56,168.20,133.86,132.84,131.03,130.99,129.35,127.94,58.86,57.27,57.19,29.70。
实施例68-制备盐2o3k
将(0.350g,0.49mmol)的1h,1h,2h,2h-全氟-1-十二烷基邻苯二甲酸单酯2o溶解在5ml甲醇中,并加入0.059g(0.49mmol)的trizma-base(三(羟甲基)氨基甲烷)。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.404g(产率=99%)。
光谱分析:
1hnmr(500mhz,dmso/丙酮-d6)δ=7.74(dd,j=7.5,0.9hz,1h),7.40(td,j=7.5,1.4hz,1h),7.36(td,j=7.4,1.3hz,1h),7.29(dd,j=7.4,1.0hz,1h),4.43(t,j=6.4hz,2h),3.47(s,6h),2.67(tt,j=19.5,6.3hz,2h)。
19fnmr(470mhz,dmso/丙酮-d6)δ=-81.10(t,j=9.9hz,3f),-113.30(s,2f),-121.58–-122.58(m,10f),-123.03(s,2f),-123.51(s,2f),-126.41(s,2f)。
13cnmr(126mhz,dmso/丙酮-d6)δ=170.26,169.87,138.40,133.74,129.86,129.30,129.06,126.74,60.92,60.36,56.72,29.66。
实施例69–制备盐2p3c
将2h,2h-全氟辛酸(0.330g,0.87mmol)溶解在5ml甲醇中,并加入0.130g(0.87mmol)三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.454g(99%产率)。
光谱分析:
1hnmr(500mhz,丙酮-d6)δ=3.95–3.87(m,6h),3.46–3.37(m,6h),3.13(t,j=19.5hz,2h)。
19fnmr(470mhz,丙酮-d6)δ=-81.73(td,j=10.0,2.3hz,3f),-112.71(dt,j=19.3,14.7hz,2f),-118.56(q,j=13.5hz,2f),-123.25–-123.59(m,2f),-123.69(s,2f),-126.69–-127.05(m,2f)。
13cnmr(126mhz,丙酮-d6)δ=165.12,57.08,56.40,37.58。
实施例70-制备盐2p3e
将2h,2h-全氟辛酸(0.324g,0.86mmol)溶解在5ml甲醇中,并加入0.125g(0.86mmol)l-赖氨酸的水(2ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.446g(99%产率)。
光谱分析:
1hnmr(500mhz,丙酮-d6):δ=3.64(t,j=6.0hz,1h),2.98–2.85(m,4h),1.87–1.77(m,2h),1.65(dt,j=15.0,7.6hz,2h),1.50–1.33(m,2h)。
19fnmr(470mhz,丙酮-d6):δ=-81.59(t,j=9.9hz,3f),-112.59–-113.12(m,2f),-122.36(s,2f),-123.43(s,2f),-123.67(s,j=13.3hz,2f),-126.75(td,j=14.9,6.7hz,2f)。
13cnmr(126mhz,丙酮-d6):δ=173.82,169.27,54.45,39.04,38.34,29.49,26.38,21.44。
实施例71–制备盐2r3c3c
将2-(1h,1h,2h,2h-全氟癸基)丙二酸(0.300g,0.54mmol)溶解在5ml甲醇中,并加入0.162g(1.08mmol)的三乙醇胺。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.453g(99%产率)。
光谱分析:
1hnmr(500mhz,d2o/丙酮-d6)δ=4.03–3.93(m,12h),3.51–3.34(m,13h),2.31–2.18(m,2h),2.16–2.02(m,2h).
19fnmr(470mhz,d2o/丙酮-d6):δ=-85.16(t,j=10.3hz,3f),-117.69(p,j=18.3,17.5hz,2f),-124.98–-125.74(m,4f),-126.43(s,2f),-126.50(d,j=19.9hz,4f),-130.05(dq,j=15.2,7.2hz,2f).
13cnmr(126mhz,d2o/丙酮-d6):δ=177.34,56.03,55.79,49.77,29.02,21.06。
实施例72–制备盐2r3e3e
将2-(1h,1h,2h,2h-全氟癸基)丙二酸(0.300g,0.54mmol)溶解在5ml甲醇中,并加入0.159g(1.08mmol)的l-赖氨酸的水(2ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.450g(99%产率)。
光谱分析:
1hnmr(500mhz,d2o/丙酮-d6)δ=3.79(t,j=6.1hz,2h),3.13(t,j=7.5hz,1h),3.09(t,j=7.4hz,4h),2.26–2.14(m,2h),2.04(dt,j=11.4,5.8hz,2h),2.00–1.88(m,4h),1.84–1.74(m,4h),1.63–1.44(m,4h)。
19fnmr(470mhz,d2o/丙酮-d6):δ=-84.52–-86.56(m,3f),-116.68–-118.72(m,2f),-124.87–-125.34(m,2f),-125.48(d,j=21.0hz,4f),-125.67(s,2f),-126.20–-127.49(m,2f),-129.92–-130.78(m,2f)。
13cnmr(126mhz,d2o/丙酮-d6):δ=178.09,174.93,57.69,54.83,39.41,30.37,29.14,26.79,21.85,21.19。
实施例73–制备盐2s3e
将2-(1h,1h,2h,2h-全氟癸基)丙二酸(0.300g,0.54mmol)溶解在5ml甲醇中,并加入0.79g(0.54mmol)的l-赖氨酸的水(1ml)溶液。加热至完全溶解后,将混合物冷却并浓缩至干,得到产物0.372g(99%产率)。
光谱分析:
1hnmr(500mhz,d2o/丙酮-d6):δ=3.97–3.91(m,1h),3.33–3.32(m,1h),3.29(t,j=11.5hz,2h),2.47–2.39(m,2h),2.29–2.21(m,2h),2.20–2.07(m,2h),2.04–1.91(m,2h),1.83–1.65(m,2h)。
19fnmr(470mhz,d2o/丙酮-d6):δ=-81.38(t,j=10.0hz,3f),-114.59(s,2f),-122.17(s,2f),-122.39(s,4f),-123.22(s,2f),-123.52(s,2f),-126.60(s,2f)。
13cnmr(126mhz,d2o/丙酮-d6):δ=178.09,174.75,57.64,54.95,49.19,39.52,30.56,26.88,21.92,21.39。
实施例74-制备盐2r3k3k
将2-(1h,1h,2h,2h-全氟癸基)丙二酸(0.300g,0.54mmol)溶解在5ml甲醇中,并加入0.132g(1.08mmol)的trizma-base(三(羟甲基)氨基甲烷)。加热混合物直至完全溶解,然后将混合物冷却并浓缩至干,得到产物0.427g(99%产率)。
光谱分析:
1hnmr(500mhz,d2o/丙酮-d6):δ=3.61(s,13h),2.30–2.16(m,2h),2.10–2.01(m,2h)。
19fnmr(470mhz,d2o/丙酮-d6):δ=-80.56–-83.70(m,3f),-114.97(dt,j=40.3,22.6hz,2f),-121.92–-122.61(m,2f),-122.81(d,j=74.1hz,4f),-123.79(s,2f),-127.16–-127.66(m,4f)。
13cnmr(126mhz,d2o/丙酮-d6):δ=177.70,60.60,59.98,56.67,28.72,20.77。
实施例75–制备盐2r3l3l
将2-(1h,1h,2h,2h-全氟癸基)丙二酸(0.30g,0.54mmol)溶解在5ml甲醇中,并加入0.19g(1.08mmol)的l-精氨酸的水(0.2ml)溶液。加热混合物直至完全溶解,然后将混合物冷却并浓缩至干,得到产物0.488g(99%产率)。
光谱分析:
1hnmr(500mhz,d2o/丙酮-d6):δ=3.72(t,j=6.1hz,2h),3.29(t,j=6.9hz,4h),3.15(t,j=7.5hz,1h),2.30–2.15(m,2h),2.12–2.00(m,2h),2.01–1.85(m,4h),1.84–1.66(m,4h)。
19fnmr(470mhz,d2o/丙酮-d6):δ=δ-81.96–-83.79(m,3f),-115.04(s,2f),-122.56(s,2f),-122.73–-123.05(m,4f),-123.67–-124.07(m,4f),-127.43(s,2f)。
13cnmr(126mhz,d2o/丙酮-d6):δ=178.38,176.30,157.19,58.05,54.87,49.20,40.98,28.84,24.48,21.42。
实施例iii
用新合成的表面活性剂生产o/w乳液
将180mg的表面活性剂溶解在9ml的超纯水(milliq)中,然后将1ml的全氟萘烷添加到溶液中。使用up400sthielscher超声均化器超声处理混合物。设备的运行参数:a=90%(幅度),连续运行模式,声极类型-h14。超声均质化过程持续约2分钟,同时使用冰浴对反应容器进行冷却。获得相对于水相具有10%v/v的全氟化相的10ml的o/w乳液。
a)测定获得的o/w乳液的粒度分布
使用accusizer780光学粒度仪pssnicomp设备确定乳液的粒度分布。用超纯水(milliq)一式三份制备一系列所分析的乳液的稀释液:10倍,100倍和1000倍。检查了1000倍稀释乳液的粒度分布,至少进行了3次测量,在每次测量中制备约30ml的稀释乳液。结果由以下几个值表示:平均直径(以μm为单位)以及不同范围(例如,直径范围0.5-2μm,2-5μm,5-10μm,>10μm)内的颗粒百分比。将来自三个测量的值取平均值,并计算标准偏差。
还使用malvernzetasizernanozs(malverninstruments.ltd.worcestershire,英国)设备通过动态光散射(dls)来测量乳液的粒度分布。为每个样品准备了一系列稀释液:用超纯水(milliq)稀释5倍和50倍。在25℃的温度和173°的散射角下进行测量。使用两个参数表示结果:平均粒度和多分散指数(pdi)。平均粒度(以纳米为单位的平均直径)是由装置根据制造商提供的iso标准(iso13321:1996e和22412)根据颗粒强度信号计算出的值。多分散指数是无量纲值,表示乳液粒度分布的宽度,即所分析样品的均一性,其根据iso13321:1996e和22412计算得到。所有测量均一式三份进行。给出这些值作为三次测量的平均值,并计算标准偏差。
b)测定获得的o/w乳液颗粒的zeta电位
使用zetasizernanozsmalvern设备和zeta电位测量单元dts1070进行zeta电位测量。用超纯水(milliq)将获得的o/w乳液稀释10倍。在25℃的温度下至少进行3次测量,每次约取2ml稀释乳液。根据设备给出的测量质量,对稀释或未稀释的乳液进行测试。将每个样品的结果取平均值,计算标准偏差,以mv单位给出zeta电位值。
c)测定临界胶束浓度
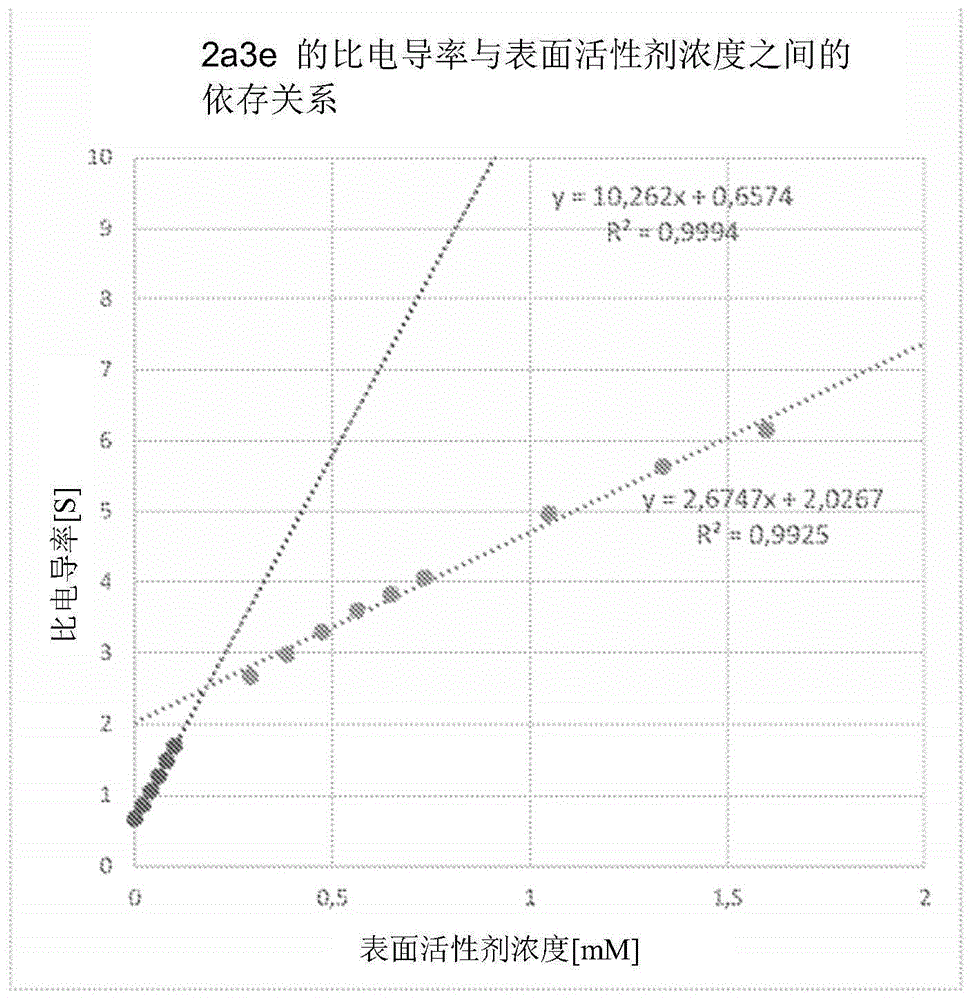
临界胶束浓度(cmc)是给定表面活性剂的特征参数,它定义为表面活性剂的浓度,在该浓度以上会自发形成胶束。各种实验技术可用于确定cmc,包括电导率或比电导率(sc)的测量。电导法允许根据胶束形成前后溶液的电导率变化的差异来确定cmc。在25℃的温度下,通过将一定体积的浓缩表面活性剂溶液添加到已测量电导率的水中,在0.01-40mm的浓度范围内对被测表面活性剂进行电导率测试,其中使用磁力搅拌器将溶液充分混合(高速约20秒)和测量电导率进行测试。在电导率与表面活性剂浓度的关系图中,cmc点作为折射可见。参见图1。
如以下图所示,通过在图形崩溃前后指定两条趋势线的交点并排除弯曲出的点来确定精确的cmc值。在cmc点在一条直线上之后,进行测量以获得至少3个测量值。沿着不同测量点(在cmc点之前和之后)的直线可能会略有不同,从而产生图形崩溃的假象,因此假设要确定实际cmc值,需要使用两条直线的方程式:y=a1*x+b1和y=a2*x+b2,它们必须满足条件a1/a2>2。
表2.结果汇总:使用获得的表面活性剂制得的乳液的平均直径,多分散指数,zeta电位和纯化合物的临界胶束浓度(cmc)
a–10倍稀释乳液的zeta电位值
b-水不溶性化合物
c-使用accusizer780光学粒度仪pssnicomp设备进行测量
实施例四
通过xtt法进行体外细胞毒性研究
根据基于iso10993-5:2009(e)标准“医疗器械的生物学评估-第5部分:体外细胞毒性测试”开发的程序,测试化合物的体外细胞毒性。
实验中使用了两种细胞系:l929-小鼠成纤维细胞和hmec-1-人血管内皮细胞。在杜式改良eagle培养基(dmem,1g/l葡萄糖)中培养成纤维细胞,在mcdb131(1g/l葡萄糖)中培养内皮细胞。两种培养基均补充了胎牛血清(10%fbs),抗生素(1%pen/strep)和l-谷氨酰胺(2mmdmem,10mmmcdb131),mcdb131以及氢化可的松(1μg/ml)和表皮生长因子(egf,1ng/ml)。将细胞在培养箱中于标准条件(37℃,5%co2)下培养。
将测试的化合物称重到两个玻璃容器中,并溶解在两种补充的培养基中。当所测化合物为水不溶性化合物,将其在37℃下提取22-24小时,离心,收集上清液,通过过滤(通过无菌0.22μm针筒式过滤器)进行灭菌,然后制备稀释液。
将两种细胞系以每孔5×103个细胞接种到96孔板中,并孵育22-24小时(37℃,5%co2)。每块板包含(1)阴性对照(nc,培养基中的细胞),(2)阳性对照(pc,用2%tritonx-100溶液处理过的细胞),(3)测试样品(pr%,用先前制备的溶液/提取物处理过的细胞)和(4)空白对照(bl,每种溶液均不含细胞)。接种后的第二天,将100μl溶液加到细胞上,然后将板孵育20-24小时(37℃,5%co2)。在实验的最后一天,使用倒置显微镜监测细胞的形态,拍摄代表照片并进行xtt分析。
在细胞培养基中制备xtt试剂溶液。在即将使用前,将其用pms溶液(吩嗪硫酸甲酯=n-甲基二苯并吡嗪甲基硫酸盐)活化。将活性xtt溶液添加到孔中(nc,pc,pr%,bl),将板孵育2小时(37℃,5%co2),并在两个波长λ1=450nm和λ2=630处进行分光光度测量。使用等式a=a450test-a450blank-a630test计算pr,nc,pc样品的比吸收率(a)。将nc结果取平均值
计算算术平均值和标准偏差(sd),数据以细胞存活率(%)与所测化合物的浓度之间的关系的形式呈现在图表中。根据结果,确定了该化合物的最高非细胞毒性浓度,其中细胞毒性标准是与阴性对照(100%)相比,细胞存活率降低到70%以下。
本文献后面将会呈现两种化合物的示例性结果集
具有低细胞毒性的化合物-2l3k。有关图形,请参见图2和表3
具有高细胞毒性的化合物-2a3g。有关图形,请参见图3和表4
实施例五
新型表面活性剂的溶血特性研究。
通过采用astm国际标准e2524-08:分析纳米颗粒溶血特性的测试方法中所述的方法来进行溶血特性的研究。该方法被列为实践f748和iso10993-4中的一项测试,用于评估与血液接触的医用材料的生物相容性。
该测定基于血液暴露于测试溶液后释放到上清液中的血红蛋白的定量。
在该方法中,血红蛋白及其衍生物在碱性ph下被铁氰化物氧化为高铁血红蛋白。通过添加含氰化物的drabkin溶液(也称为cmh试剂)可将高铁血红蛋白转化为氰化高铁血红蛋白(cmh)。cmh是最稳定的血红蛋白形式,可以通过分光光度法在540nm波长处进行检测。向血液中添加cmh试剂可估算总血红蛋白(tbh),向血浆中添加cmh试剂可估算释放至血浆中的血红蛋白量(pfh)。
校准物:用于校准曲线图的校准物是由冻干的人血红蛋白的从0.8mg/ml到0.025mg/ml的一系列的稀释液制备的。
对照:以10mg/ml的tritonx-100作为阳性对照,40%聚乙二醇溶液为阴性对照。
实验/测定/测试程序:
1.血液样品合格后,用不含ca2+/mg2+离子的磷酸盐缓冲液(pbs)稀释血液,以将总血红蛋白调节至10±2mg/ml(tbh10mg/ml)。
2.将试管分为“管架1”(与血液一起孵育的样品)和“管架2”(与pbs一起孵育的样品)(作为对照)。
3.针对每个测试样品/浓度准备六个试管(管架1和管架2中的三个试管)。
4.准备两个管用于阳性(pc)和阴性(nc)对照。
5.将试管置于振动板上,于37℃下孵育3小时。
6.孵育后,将试管离心,收集上清液,然后在λ=540nm处测量吸光度。
7.溶血率按以下公式进行计算:
tbhd-总血红蛋白(通过将400μltbh(10mg/ml)与5mlcmh试剂混合制备)
溶血特性测试结果示例:
2j3k化合物;结果-在1%和更低的浓度下,该化合物没有溶血特性-参见图4。
表6.化合物的细胞毒性和溶血研究结果
*最高浓度为0.50%时,化合物在培养基中结晶/形成沉淀
**最高浓度为0.25%时,化合物在培养基中结晶/形成沉淀
***最高浓度为0.10%时,化合物在培养基中结晶/形成沉淀
<浓度低于测试浓度的无毒化合物
>给定浓度或高于测试浓度的无毒化合物
实施例六
根据文献数据描述可能的应用
表面活性剂在特定的组成中可能具有以下功能:
-清洁和洗涤物质,
-产生泡沫的物质,
-乳化剂
-分散物质,
-润湿剂,
-破泡剂,
-破乳剂,
-增溶剂。
由于其优异的乳化性能(低cmc),该专利中公开的化合物可成功用于与清洁,洗涤,消毒剂,农用化学品,油漆,清漆,金属加工制剂和塑料生产相关的各种行业,还可用于与生产技术先进的产品相关的行业。
氟化有机酸的铵盐的功能性质也可用于化妆品行业。inci清单(化妆品成分的国际命名法)包括许多用作表面活性剂的全氟化化合物(即c9-10全氟烷基磺酸铵,c9-15氟代醇磷酸酯等)或化妆品成分(即全氟萘烷、全氟环己烷、全氟环戊烷等)。
“药物辅料手册第六版”(r.c.rowe;p.j.sheskey;s.c.owen“药物辅料手册第六版”,2009年)描述了批准用于制药行业的一小部分表面活性剂。人们对具有良好乳化性能的无毒表面活性剂的需求很大。该专利中公开的氟化有机酸的铵盐可以用作药物和医疗产品的均质成分和防腐剂。无毒的表面活性剂还可以替代诊断为婴儿呼吸窘迫综合征(irds)的早产婴儿所使用的外源性动物源性表面活性剂。
使用所公开的氟化有机酸的铵盐,可以获得稳定的全氟化碳乳剂,其发现了在文献中广泛描述的许多生物医学用途。此类用途的第一个用途包括分子成像过程,例如敏感的动脉粥样硬化斑块区域的血栓块的分子成像过程。该实验是在基于全氟烃纳米颗粒(颗粒的标称粒径为250nm的乳液)构建的独特造影剂存在下进行的,从而显著提高了磁共振检测的灵敏度(s.flacke,s.fischer,m.j.scott,r.j.fuhrhop,j.s.allen,m.mclean,p.winter,g.a.sicard,p.j.gaffney,s.a.wickline,g.m.lanza“novelmricontrastagentformolecularimagingoffibrin:implicationsfordetectingvulnerableplaques”,circulation.2001;104:1280-1285)。另一种靶向超声造影剂是由全氟烃纳米颗粒制成的微乳液,该纳米颗粒乳涂有改性脂质层(g.m.lanza,k.d.wallace,m.j.scott,w.p.cacheris,d.r.40abendschein,d.h.christy,a.m.sharkey,j.g.miller,p.j.gaffney,s.a.wickline,,anovelsite-targetedultrasoniccontrastagentwithbroadbiomedicalapplication”,circulation.1996,94,3334–3340)。它显示出低的自然回声性,并能够非侵入性地识别组织中的病理灶。
díaz-lópez(r.díaz-lópez,n.tsapis,e.fattal“liquidperfluorocarbonsascontrastagentsforultrasonographyand19f-mri”pharmaceuticalresearch,27,2010,1-16)中描述了全氟烃纳米乳液和纳米颗粒的多种应用以及氟19f磁共振。他证明检测19f信号可确保高细胞特异性,并能在磁共振图像中进行定量测定。他描述到平均粒径约为400nm的pfc纳米乳液具有非常好的结果,在特定检查的成像过程中提供了优异的对比度。
静脉内施用oxycyte乳剂(含全氟叔丁基环己烷,其载氧量是血红蛋白的五倍)后,首次在体内证明了gold(格拉斯哥血氧依赖水平)代谢成像放大,以识别缺血性半影(g.a.deuchar,d.brennan,w.mholmes,m.shaw,i.m.macrae,c.santosh,,,perfluorocarbonenhancedglasgowoxygenleveldependent(gold)magneticresonancemetabolicimagingidentifiesthepenumbrafollowingacuteischemicstroke”theranostics,2018,8,1706–1722)。
由于出色的氧溶解特性,pfc用于光动力疗法。向缺血性癌细胞施用富氧乳液可使其选择性破坏(a.scheer,m.kirsch,k.ferenz,,perfluorocarbonsinphotodynamicandphotothermaltherapy”j.nanosci.nanomed.2017,1,21-27)。
已经描述了许多基于全氟化碳乳剂的纳米系统,这些纳米系统甚至可以穿透细小的毛细血管(y.liu,h.miyoshi,m.nakamurac,,encapsulatedultrasoundmicrobubbles:therapeuticapplicationindrug/genedelivery”,journalofcontrolledrelease,114,2006,89-99)。这使得能够在超声场的影响下进行药物递送和释放。
文献描述了许多包含氟化表面活性剂(氟化脂质)的乳液的例子。它们主要用作释放受到控制的递送药物的系统(m.p.krafft,,fluorocarbonsandfluorinatedamphiphilesindrugdeliveryandbiomedicalresearch”advanceddrugdeliveryreviews,47,2001,209–228)。
全氟化碳纳米乳液的其他应用源于其有效气体输送的功能。例如,含pfc的含氧饱和乳液可支持人工呼吸过程(在人工肺通气过程中)。该解决方案的主要优点是消除了气液相界面,从而降低了肺泡的表面张力。这可以提高向急性呼吸衰竭患者的毛细血管输送氧气的肺效率(kraff,,fluorocarbonsandfluorinatedamphiphilesindrugdeliveryandbiomedicalresearch”,advanceddrugdeliveryreviews,47,2001,209–228)。另外,全氟化合物可在人工通气期间递送药物或气体,即,扩张血管的药物或抗生素。全氟化合物与表面活性剂的混合物的使用可能会增强气体交换。因此,甚至以低效率为特征的肺部区域也可以提供氧气。这种情况适用于早产婴儿,由于肺表面活性剂(细支气管和肺泡壁的内壁)不足而导致呼吸困难(j.s.greenspan,m.r.wolfson,t.h.shaffer,,airwayresponsivenesstolowinspiredgastemperatureinpretermneonates”,clinicalandlaboratoryobservations,pediatr.97,449-455)。
使用全氟化碳及其乳剂的其他生物技术应用与氧气或其他气体的输送速率有关。因此,发现全氟化碳乳剂可用于弥散性需氧和厌氧培养物中(m.pilarek,k.w.szewczyk,,zastosowania
实施例七
红细胞替代体内测试,包括在全身麻醉下向大鼠施用物质2j3c,2j3e,2l3e
材料和方法:
动物与保养
该研究方案已获得波兰华沙生命科学大学地方伦理委员会(no.waw2/057/2018)的批准。该研究由华沙生命科学大学动物医学学院诊所的大型动物疾病部门展开。该研究涉及从波兰科学院mossakowski医学研究中心(波兰华沙)获得的雄性spraguedawley大鼠(n=19;体重,400±20g;年龄,8至12周),这些大鼠分为4个不相等的组(下表)。根据国家动物福利准则对动物进行饲养。在适应期或整个实验过程中,动物均没有要出现疾病的症状。
将动物分配到研究组中。
实验方案
实验前12小时,将饲料从动物笼子中取出,但是对用水没有限制。根据leeandblaufox(1985)对动物进行称重以计算循环血量,并通过肌肉注射ceptor-0.1ml(scanvet),butomidor-0.1ml(richterpharmaag)和bioketan-0.1ml(vetoquinol)的混合物进行麻醉。注射后2分钟内,将动物置于背侧位置,置于温控外科手术台(美国braintreescientific)上,并植入用于收集血液的导管。
将硅胶导管(美国scientificcommoditiesinc)插入左颈总静脉,朝向心脏,并用扎带(不可吸收的绞线,4-0)固定,以实现最佳的液体输送和血液采样。在抽血之间,导管保持充满林格氏液。在不使用抗凝剂的情况下保持了导管的开放性。皮肤未缝合,将蘸有盐溶液的药签涂在伤口上。
然后将大鼠转移至gn1/1电热板(温度37±1℃,波兰bartscher),将袖带套在大鼠的尾巴上以测量无血尾巴血压(mlt125r,adi,澳大利亚),其连接到系统nibp(无创血压,adi,澳大利亚)和八通道powerlab(adi,澳大利亚)和个人计算机。在整个实验过程中,脉搏和血压均记录在chart程序(澳大利亚adi)中。在整个实验过程中,两次采血之间的收缩压和平均动脉血读数达到血压收缩压阈值读数40mmhg。
如上表所示,使用先前实验中所述的有补偿的渐进性出血方法(循环血液的5%)进行了总共4个实验变体。在随后的实验中使用了补偿:voluven液(浓度0.5%w/v)施用了voluven液(羟乙基淀粉(hes130/0.4),右旋糖酐130kda,freseniuskabi)和制剂2j3c、2j3e和2l3e(nanosanguis)。在麻醉下对每只动物进行实验,直到心脏停止和心律停止,因此研究的持续时间和采集的样本数可能是用来推断被测物质作用的重要因素之一。
在静脉血样本中,进行血气测定(siemensepoc气量计):ph,pco2(co2压力,mmhg),po2(氧气压力,mmhg),chco3-(碳酸氢根离子浓度,mmol/l),be(ecf)(血液缓冲碱缺乏,mmol/l),血细胞比容(hct,%,精确度低于形态分析仪),葡萄糖(mg/dl),乳酸(lac,mmol/l),肌酸酐(crea,mg/dl),然后进行形态学(mindray分析仪):血细胞比容(hct,%),血红蛋白(g/l),红细胞计数(rbc,1012/l),白细胞计数(wbc,x109/l)和血小板计数(plt,x109/l)。middleton等人(2006年)显示静脉和动脉血的胃压测量结果(ph,碳酸氢根浓度,缓冲碱(be)缺乏,乳酸浓度)一致,从而可以评估体内酸碱平衡。结果在随附的excel电子表格中给出。将用于其他生化分析的血液离心并冷冻(-20℃)。
48小时后,将收集的器官(肝、肾、肺和心脏)样品固定在福尔马林缓冲液中。转移至70%乙醇中,并保存用于组织学检查。在对苏木精和曙红切片进行常规染色后进行组织学检查。
大鼠血压参考值和参数
https://www.ncbi.nlm.nih.gov/pmc/articles/pmc4071721/https://www.ahajournals.org/doi/full/10.1161/jaha.116.005204;
buribe-escamillaetal.2011):wistar大鼠340g,全身麻醉(氯胺酮+甲苯噻嗪),中值(最小-最大);)
clillieetal.(1996):sprague-dawley大鼠,全身麻醉(吸入-氟烷),腹主动脉穿刺,平均值(sd);
dbaldisseraetal.(2015),wistar200g大鼠,全身麻醉(吸入-异氟醚),左心室穿刺,中值(最小-最大)。
结果
实验结束后的切片进行宏观分析,结果显示所检查的器官没有病理变化。没有观察到先天性变化或由于施用制剂而可能引起的变化。一般情况下,宏观观察到的器官的苍白与实验的持续时间成正比。器官的代表性显微图像如图6-9所示。内脏实质的结构得以保留,没有明显的炎症迹象,红细胞明显减少或不存在。
voluven
5分钟间隔为9、18、21和21(即45、90、105和105分钟)。除一只动物外,血液ph值保持更长的时间不变,即直到间隔8、9、15和15为止,类似地,直到间隔8、9、15和17时,收缩压均>40mmhg。碱缓冲液平衡(be)最多维持约16个间隔(长达约80分钟)。在动物仍然存活的最后间隔中,血细胞比容和其他血液形态学参数逐渐降低至最小值。在间隔13-15中逐渐增加葡萄糖。乳酸浓度的增加对应于be的减少。
物质2l3e+voluven
5分钟间隔:10、13、21、28和31(即60、75、105、140和155分钟)。在间隔18-22,收缩压>40mmhg。在气体参数方面(尤其是在po2,pco2和缓冲碱浓度方面)观察到了显著差异。在第二系列中用该制剂治疗的大鼠在几到几个间隔后在血液中显示出胃部和形态变化。直到20-21间隔,观察到ph值维持在7.3。缓冲碱的崩溃和乳酸浓度的增加对应于ph的降低。形态参数的减少对应于失血。
物质2j3c+voluven
5分钟间隔:24、23、18、18和11(即120、115、90、90和55分钟)。在20,20间隔,收缩压>40mmhg。直到13和17间隔,ph均保持在7.3,并且类似地,缓冲液平衡(be(ecf))也受到干扰。在实验结束时,血细胞比容和形态元素的数量从生理值逐渐降低至约9%(hct),2x1012/l(rbc),1x109/l(wbc)。乳酸浓度的增加明显高于生理值(极限值8.5mmol/l,baldisseraetal.2015),这一现象发生的时间间隔为15和19。
物质2j3e+voluven
5分钟间隔:15、17、21、25和29,即75、85、105、125和145分钟)。收缩压在14到28个间隔内保持>40mmhg,唯一不同的是,无论大鼠的生存时间长短如何,所有5只大鼠的收缩压下降(在10个初始间隔处快速下降)动态变化类似。在间隔13和20之前观察到维持ph值为7.3,间隔14-19发生缓冲液平衡不足(be(ecf))。血细胞比容从生理值逐渐降低至约5%。在其他血液形态学参数中也观察到了类似的下降。尽管在2只大鼠中未观察到乳酸浓度的变化,但乳酸浓度以13-19的间隔超过了生理临界点(8.5mmol/l)。
总结(每次测量的平均值图表)
获得的结果如图10-33所示。
底线:与接受voluven的对照组相比,施用测试制剂(2j3c,2j3e,2l3e)后,大鼠的存活期高出7-10个间隔:
1.2l3e高了10个间隔,
2.2j3e高了8个间隔,
3.2j3c高了7个间隔。
在大约15个间隔时,所有测试的制剂都会使尾动脉的收缩压降低至40mmhg的极限,但是对于制剂2j3e而言,维持压力高于极限值的时间要长于其它测试组。与对照组相比,测试的制剂引起的降低速度较慢:
-ph降低(最优选2l3e),
-pco2的增加(优选2l3e),
-缓冲液碱基缺乏减少(最优选2l3e),
-乳酸和肌酸酐增加(最优选2l3e)。
在各个测试制剂之间,在血液计数上没有发现差异。
血液电解质的总结结果
电解质的测量在用被测制剂进行血液补偿期间未显示浓度变化。在实验结束时,钠、钾和氯的浓度逐渐超过上限。
- 还没有人留言评论。精彩留言会获得点赞!