一种微环境敏感型荧光探针的制备方法及其对HSA/BSA检测的应用与流程
本发明属于蛋白检测的荧光探针技术领域,具体涉及一种微环境敏感型荧光探针及其制备方法和对hsa/bsa检测的应用。
背景技术:
人血清蛋白(hsa)与牛血清蛋白(bsa)是同源蛋白,在结构与氨基酸序列上有着很高的相似性,都含有半胱氨酸残基。hsa作为人体血浆中含量最丰富的一种蛋白质,可以参与酶催化活动、维持血浆渗透压、参与免疫调节、以及运输药物分子。其含量的异常,可以作为肾功能损害和相关肾脏疾病的早期预警。bsa,作为酶的稳定剂,可以防止酶的分解和非特异性吸附,减轻有些不利环境因素如加热,表面张力及化学因素引起的变性。在当前疫苗生产中普遍采用牛血清作为细胞培养的主要成分,这导致疫苗中不同程度地残留bsa,bsa于机体来说是一种异源蛋白,如果残留过多,注射疫苗后就可能引起过敏性休克等不良反应。因此,发展高效、准确、快速检测hsa和bsa的方法是非常重要的。
近年来,荧光探针因具有响应速度快、灵敏度高、操作简单,实时监测等优点受到了极大关注,可用于蛋白质检测。
技术实现要素:
本发明旨在提供一种微环境敏感型荧光探针及其制备方法和对hsa/bsa检测的应用,该荧光探针为新型有机小分子荧光探针,对hsa/bsa的响应具有高选择性、高灵敏度和响应快等特性,并能用于细胞中hsa/bsa的检测。本发明利用蛋白质结构的微环境,结合巯基反应位点,设计合成能用于细胞中检测hsa/bsa的荧光探针。
本发明由如下技术方案实现的:一种微环境敏感型荧光探针,该荧光探针的分子式为c31h23no2,结构式如下:
制备所述的微环境敏感性荧光探针的方法,具体步骤如下:
(1)在h2o/thf的混合溶剂中,加入水杨醛,2-环戊烯-1-酮和咪唑,将混合物在室温下氮气保护搅拌12~14h;所得反应液用二氯甲烷萃取三次,饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,并通过柱色谱法纯化产物,得到黄色固体化合物1,其结构式为:
(2)化合物1、对二苯氨基苯甲醛和哌啶溶于乙醇中,回流24~26h,反应后混合溶液中加入水,用二氯甲烷萃取,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,硅胶柱二氯甲烷/甲醇=500/1,v/v分离纯化,真空干燥得到红色固体化合物2即为微环境敏感性has/bsa荧光探针分子。
步骤(1)中混合反应溶剂中h2o和thf的体积比为1:1,每1mmol水杨醛使用溶剂1ml;每1ml的反应混合液加1ml的水,水杨醛:2-环戊烯-1-酮:咪唑的摩尔比为1:1~1.2:1~1.2。
步骤(2)中化合物1、对二苯氨基苯甲醛、哌啶的摩尔比为1:0.8~1:0.2。
所述的微环境敏感型hsa/bsa荧光探针的应用,该荧光探针应用于pbs:dmf=8:2的体系和细胞组织环境中hsa和bsa的检测。
在pbs:dmf=8:2的体系中,将荧光探针与hsa/bsa进行反应,用荧光强度变化来检测hsa/bsa的浓度:在未加入hsa/bsa前,探针的荧光信号弱,发射波长在610nm,加入hsa/bsa后,探针荧光信号增强,发射波长蓝移至580nm。
在细胞组织环境中:检测人血清蛋白的线性范围为100-2850mg/l,检出限为13.65mg/l,所述检测牛血清蛋白的线性范围为0-900mg/l,检出限为3.82mg/l。
本发明所制备的微环境敏感型hsa/bsa荧光特性,在甘油和水的混合体系中:随着甘油比例的增加,荧光发射波长蓝移,荧光强度增强;在1,4-二氧六环和水的混合体系中,随着水比例的增加,荧光发射波长红移,从576nm红移到602nm。
在pbs:dmf=8:2的体系和hela细胞中检测hsa和bsa。在pbs:dmf=8:2的体系将荧光探针与hsa/bsa进行反应,利用荧光强度变化来检测hsa/bsa的浓度;在未加入hsa/bsa前,探针的荧光信号比较弱,发射波长在610nm,当加入hsa/bsa后,探针的荧光信号增强,发射波长蓝移至580nm。所述荧光探针检测hsa的线性范围为100-2850mg/l,检出限为13.65mg/l,检测bsa的线性范围为0-900mg/l,检出限为3.82mg/l。
本发明制备的荧光探针具有n,n-二苯基给电子基团和羰基吸电子基团,有明显的分子内电荷转移特性,发射波长较长,并且具有较大的托斯拉克位移。它对hsa/bsa的识别机制包括两方面:1.探针分子结构中具有α,β-不饱和羰基结构,能和蛋白中的游离巯基发生加成反应;2.利用蛋白质的微环境,使荧光强度增强并蓝移。因此探针能对hsa/bsa进行检测,并在hela细胞中实现hsa和bsa成像。
本发明荧光探针的荧光发射波长和强度随溶剂极性和粘度的变化敏感。本发明荧光探针分子检测has/bsa的机理新颖。本发明荧光探针分子实现了hela细胞中hsa/bsa成像。
附图说明
图1为实施例七中探针分子的荧光光谱随极性和粘度变化示意图;其中:(a)为探针分子的荧光光谱随极性变化示意图;(b)为探针分子的荧光光谱随粘度变化示意图;
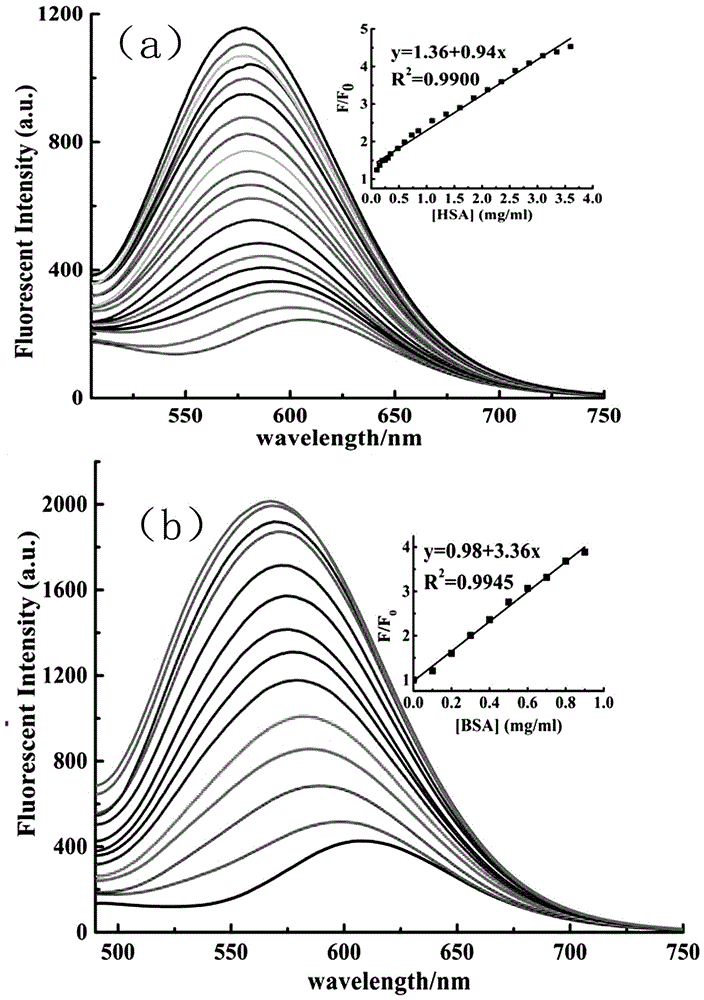
图2为实施例八中探针分子的荧光光谱随hsa/bsa浓度变化示意图;其中:(a)为探针分子的荧光光谱随hsa浓度变化示意图;(b)为探针分子的荧光光谱随bsa浓度变化示意图;
图3为实施例九中探针分子与hsa/bsa反应荧光强度随时间变化示意图;
图4为实施例十中探针分子与不同干扰分析物反应前后的荧光强度变化示意图;
图5为实施例十一中探针分子对hsa/bsa在hela细胞中的成像研究;其中:(a)为探针分子对hsa细胞成像;(b)为探针分子对bsa细胞成像;
图6为本发明所述探针合成路线图。
具体实施方式
下面通过实施例来进一步说明本发明,但不局限于以下实施例。
本发明所述微环境敏感型hsa/bsa荧光探针的合成路线如图6所示。具体实例如下:
实施例一:化合物1的合成:在装有磁力搅拌器的25ml三口瓶中,先分别加入水杨醛(10mmol,1.065ml),2-环戊烯-1-酮(11mmol,0.918ml)和咪唑(11mmol,0.750g),再加入10mlh2o/thf(v/v=1:1),将混合物在室温下经氮气保护搅拌12小时。将反应液用二氯甲烷萃取三次,饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,并通过柱色谱法(二氯甲烷/石油醚,5/1,v/v)进一步纯化产物,得到黄色固体化合物1(0.210g,11.29%)。
1hnmr(600mhz,dmso)δ7.42(d,j=7.4hz,1h),7.30(dd,j=21.6,13.9hz,2h),7.00(t,j=7.4hz,1h),6.93(d,j=8.1hz,1h),5.30(t,j=8.1hz,1h),2.61(dd,j=19.6,8.2hz,1h),2.48–2.34(m,2h),2.09–1.97(m,1h).13cnmr(151mhz,dmso)δ201.54,155.19,132.78,132.71,131.06,126.72,122.68,122.33,116.65,75.76,37.12,28.09。
实施例二:化合物1的合成:在装有磁力搅拌器的25ml三口瓶中,先分别加入水杨醛(10mmol,1.065ml),2-环戊烯-1-酮(10mmol,0.835ml)和咪唑(10mmol,0.682g),再加入10mlh2o/thf(v/v=1:1),将混合物在室温下经氮气保护搅拌13小时。将反应液用二氯甲烷萃取三次,饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,并通过柱色谱法(二氯甲烷/石油醚,5/1,v/v)进一步纯化产物,得到黄色固体化合物1(0.182g,9.78%)。
1hnmr(600mhz,dmso)δ7.42(d,j=7.4hz,1h),7.30(dd,j=21.6,13.9hz,2h),7.00(t,j=7.4hz,1h),6.93(d,j=8.1hz,1h),5.30(t,j=8.1hz,1h),2.61(dd,j=19.6,8.2hz,1h),2.48–2.34(m,2h),2.09–1.97(m,1h).13cnmr(151mhz,dmso)δ201.54,155.19,132.78,132.71,131.06,126.72,122.68,122.33,116.65,75.76,37.12,28.09。
实施例三:化合物1的合成:在装有磁力搅拌器的25ml三口瓶中,先分别加入水杨醛(10mmol,1.065ml),2-环戊烯-1-酮(11mmol,0.918ml)和咪唑(11mmol,0.750g),再加入10mlh2o/thf(v/v=1:1),将混合物在室温下经氮气保护搅拌14h。将反应液用二氯甲烷萃取三次,饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,并通过柱色谱法(二氯甲烷/石油醚,5/1,v/v)进一步纯化产物,得到黄色固体化合物1(0.198g,10.64%)。
1hnmr(600mhz,dmso)δ7.42(d,j=7.4hz,1h),7.30(dd,j=21.6,13.9hz,2h),7.00(t,j=7.4hz,1h),6.93(d,j=8.1hz,1h),5.30(t,j=8.1hz,1h),2.61(dd,j=19.6,8.2hz,1h),2.48–2.34(m,2h),2.09–1.97(m,1h).13cnmr(151mhz,dmso)δ201.54,155.19,132.78,132.71,131.06,126.72,122.68,122.33,116.65,75.76,37.12,28.09。
实施例四:探针分子的合成:在装有磁力搅拌器的25ml三口瓶中,将化合物1(0.5mmol,0.093g),4-二苯氨基苯甲醛(0.45mmol,0.123g)和哌啶溶液(0.1mmol,0.010ml)溶于12ml乙醇中并回流24h。在反应后的混合溶液中加入12ml水,用二氯甲烷萃取,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,通过柱色谱法(二氯甲烷/甲醇,500/1,v/v)进一步纯化,真空干燥得到红色固体化合物2(0.040g,20.16%)。
1hnmr(600mhz,cdcl3)δ7.57(d,j=9.2hz,2h),7.46(d,j=7.7hz,2h),7.41–7.36(m,6h),7.35–7.31(m,1h),7.17(t,j=7.8hz,2h),7.13(d,j=8.7hz,4h),7.03(t,j=7.6hz,1h),6.98(d,j=8.4hz,1h),6.93(d,j=9.1hz,2h),5.34(s,1h),3.65(dd,j=18.0,9.0hz,1h).13cnmr(151mhz,dmso)δ189.94,155.29,149.44,146.58,134.40,134.18,133.97,132.94,132.72,130.94,130.36,127.85,127.41,126.02,125.10,122.98,122.87,120.77,116.79,73.99,34.72。
实施例五:探针分子的合成:在装有磁力搅拌器的25ml三口瓶中,将化合物1(0.5mmol,0.093g),4-二苯氨基苯甲醛(0.5mmol,0.123g)和哌啶溶液(0.1mmol,0.010ml)溶于12ml乙醇中并回流25h。在反应后的混合溶液中加入12ml水,用二氯甲烷萃取,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,通过柱色谱法(二氯甲烷/甲醇,500/1,v/v)进一步纯化,真空干燥得到红色固体化合物2(0.036g,18.14%)。
1hnmr(600mhz,cdcl3)δ7.57(d,j=9.2hz,2h),7.46(d,j=7.7hz,2h),7.41–7.36(m,6h),7.35–7.31(m,1h),7.17(t,j=7.8hz,2h),7.13(d,j=8.7hz,4h),7.03(t,j=7.6hz,1h),6.98(d,j=8.4hz,1h),6.93(d,j=9.1hz,2h),5.34(s,1h),3.65(dd,j=18.0,9.0hz,1h).13cnmr(151mhz,dmso)δ189.94,155.29,149.44,146.58,134.40,134.18,133.97,132.94,132.72,130.94,130.36,127.85,127.41,126.02,125.10,122.98,122.87,120.77,116.79,73.99,34.72。
实施例六:探针分子的合成:在装有磁力搅拌器的25ml三口瓶中,将化合物1(0.5mmol,0.093g),4-二苯氨基苯甲醛(0.4mmol,0.123g)和哌啶溶液(0.1mmol,0.010ml)溶于12ml乙醇中并回流26小时。在反应后的混合溶液中加入12ml水,用二氯甲烷萃取,有机相用饱和食盐水洗涤两次,无水na2so4干燥,减压除去溶剂,通过柱色谱法(二氯甲烷/甲醇,500/1,v/v)进一步纯化,真空干燥得到红色固体化合物2(0.033g,16.63%)。
1hnmr(600mhz,cdcl3)δ7.57(d,j=9.2hz,2h),7.46(d,j=7.7hz,2h),7.41–7.36(m,6h),7.35–7.31(m,1h),7.17(t,j=7.8hz,2h),7.13(d,j=8.7hz,4h),7.03(t,j=7.6hz,1h),6.98(d,j=8.4hz,1h),6.93(d,j=9.1hz,2h),5.34(s,1h),3.65(dd,j=18.0,9.0hz,1h).13cnmr(151mhz,dmso)δ189.94,155.29,149.44,146.58,134.40,134.18,133.97,132.94,132.72,130.94,130.36,127.85,127.41,126.02,125.10,122.98,122.87,120.77,116.79,73.99,34.72。
实施例七;探针分子对微环境敏感性的研究:为测试探针分子对微环境的敏感性,对不同极性、粘度体系中探针的光谱性质进行了研究。在甘油和水的混合体系中,随着粘度的增加(甘油比例的增加),荧光最大发射波长轻微蓝移并荧光强度逐渐增强,如图1(a);在1,4-二氧六环和水的混合体系中,随着极性增加(水比例的增加),荧光最大发射波长从576nm变化到602nm,发生红移,如图1(b)。
实施例八:探针分子对不同浓度hsa和bsa条件下荧光强度变化的研究:为测试探针分子对hsa和bsa浓度响应情况,对不同浓度hsa(0,0.05,0.15,0.20,0.35,0.40,0.53,0.78,0.90,1.15,1.40,1.65,1.90,2.15,2.40,2.65,2.90,3.15,3.40,3.65mg/ml)和bsa(0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,1.0,1.4,1.8,2.2,2.5mg/ml)条件下探针分子的荧光强度变化进行了研究(如图2)。由图2(a)可知,检测hsa的线性范围为100-2850mg/l,检出限为13.65mg/l,由图2(b)可知,检测bsa的线性范围为0-900mg/l,检出限为3.82mg/l,说明本发明荧光探针分子对不同浓度的hsa和bsa表现出了较高的灵敏度。
实施例九:探针分子对hsa和bsa的时间响应研究:为测试探针分子对hsa和bsa的时间响应,分别对探针分子与hsa和bsa反应的荧光强度随时间(0~30分钟)的变化进行了研究。由图3可知,探针分子对hsa和bsa的响应速度快。
实施例十:探针分子对hsa和bsa的选择性研究:为测试探针分子对hsa和bsa的选择性,对探针分子与不同的金属离子(cd2+,co2+,cr3+,ba2+,mn2+,ni2+,zn2+,fe3+,al3+,ca2+,k+,mg2+),阴离子(hso3-,so42-,co32-,so32-,scn-,hco3-,c2o42-,cl-,i-,ch3coo-,clo4-),氨基酸(histidine,glutamate,asparagine,lysine,phenylalanine,tyrosine,alanine,serine,leucine,arginine,cysteine,homocysteine,glutathione)反应前后的荧光强度的变化进行了实验研究,hsa和bsa的浓度为10µm,其余干扰物的浓度均为100µm。由图4可知,探针分子对hsa和bsa的检测不受其他分析物的干扰,具有高度的选择性。
实施例十一:探针分子对hsa和bsa在hela细胞中的成像研究:为测试探针分子对hsa和bsa在hela细胞中的成像,分别对探针分子与hsa(20μm)和bsa(20μm)反应后的变化进行了细胞成像研究,如图5(a)和(b)。由图5可知,探针分子可以对hsa和bsa进行细胞成像。
- 还没有人留言评论。精彩留言会获得点赞!