基于miRNA的山羊中β2-受体激动剂检测引物及检测方法与流程
本发明涉及一种基于mirna的山羊中β2-受体激动剂检测引物及检测方法。
背景技术:
近几年来,病害畜产品、药物残留及人为添加违禁物品等问题,已对人体健康造成了较大的危害,畜产品质量安全与否已成为消费者关心的敏感问题,也成为国际、国内社会关注的热点和焦点。
β2-受体激动剂是一类人工合成药物,包括:西马特罗,喷布特罗,妥布特罗,西布特罗,溴不特罗,马布特罗,特布他林,氯丙那林,莱克多巴胺,克伦特罗,沙丁胺醇,班布特罗,利托君,克伦普罗,齐帕特罗,马贲特罗等。β2-受体激动剂主要用于防治人、兽支气管哮喘和支气管痉挛等病症,但当使用量超过治疗剂量时,它能促进动物体内蛋白质的合成和脂肪的分解,所以常被当作动物饲料添加剂使用来达到提高饲养动物瘦肉率的目的,但β2-受体激动剂的使用会在畜产品中造成残留,给人类的健康带来威胁。
现行我国标准及相关法律法规虽已明令禁止在动物饲料和饮水中添加β2受体激动剂,但仍屡禁不止,而目前主流的药物残留分析方法如仪器分析、免疫分析、传感器及芯片分析等均是基于已知药物的检测,这就导致只有在发现新的β2-受体激动剂后才能建立对应的检测方法,应对效率极低,难以应对当前的严峻形势。因此,寻找合适的β2-受体激动剂检测标志物及建立检测方法,在发现畜产品中已知的药物种类的同时也能够挖掘该家族中的新型药物,对于提高监管效率,早发现早治理至关重要。
技术实现要素:
本发明的目的是提供一种基于mirna的山羊β2-受体激动剂检测引物及检测方法。
第一方面,本发明首先保护引物组合,包括引物a、引物b、引物c、引物d、引物e、引物f、引物g、引物h、引物i和引物j;
所述引物a为序列表的序列1所示的单链dna分子;
所述引物b为序列表的序列2所示的单链dna分子;
所述引物c为序列表的序列3所示的单链dna分子;
所述引物d为序列表的序列4所示的单链dna分子;
所述引物e为序列表的序列5所示的单链dna分子;
所述引物f为序列表的序列6所示的单链dna分子;
所述引物g为序列表的序列7所示的单链dna分子;
所述引物h为序列表的序列8所示的单链dna分子;
所述引物i为序列表的序列9所示的单链dna分子;
所述引物j为序列表的序列10所示的单链dna分子。
所述引物组合还可包括引物对甲;
所述引物对甲由引物f和引物r组成;
所述引物f为序列表的序列11所示的单链dna分子;
所述引物r为序列表的序列12所示的单链dna分子。
所述引物组合的用途为如下(a1)-(a4)中的任一种:
(a1)检测β2-受体激动剂;
(a2)制备用于检测β2-受体激动剂的产品;
(a3)鉴定或辅助鉴定待测样本中是否含有β2-受体激动剂;
(a4)制备用于鉴定或辅助鉴定待测样本中是否含有β2-受体激动剂的产品。
第二方面,本发明还保护所述引物组合的应用,为如下(a1)-(a4)中的任一种:
(a1)检测β2-受体激动剂;
(a2)制备用于检测β2-受体激动剂的产品;
(a3)鉴定或辅助鉴定待测样本中是否含有β2-受体激动剂;
(a4)制备用于鉴定或辅助鉴定待测样本中是否含有β2-受体激动剂的产品。
第三方面,本发明还保护含有所述引物组合的产品,所述产品的用途为如下(b1)或(b2):
(b1)检测β2-受体激动剂;
(b2)鉴定或辅助鉴定待测样本中是否含有β2-受体激动剂。
所述产品还包括mirnacdna第一链合成试剂盒和mirna荧光定量检测试剂盒。所述mirnacdna第一链合成试剂盒和mirna荧光定量检测试剂盒为配套使用的产品,可搭配所述引物组合使用实现mirnacdna第一链的合成和荧光定量检测。所述mirnacdna第一链合成试剂盒具体可为mircute增强型mirnacdna第一链合成试剂盒(tiangen,北京,中国)。所述mirna荧光定量检测试剂盒具体可为mircute增强型mirna荧光定量检测试剂盒(tiangen,北京,中国)。
第四方面,本发明还保护鉴定或辅助鉴定待测样本中是否含有β2-受体激动剂的方法,包括如下步骤:
(1)提取待测样本的mirna,采用mirnacdna第一链合成试剂盒完成mirnacdna第一链的合成;
(2)以步骤(1)得到的mirnacdna第一链为模板,分别使用所述10条引物(引物a至引物j)和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测,获得10个反应体系的△ct值,依次记为x1、x2、x3、x4、x5、x6、x7、x8、x9和x10;
所述x1为采用引物a和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x2为采用引物b和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x3为采用引物c和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x4为采用引物d和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x5为采用引物e和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x6为采用引物f和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x7为采用引物g和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x8为采用引物h和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x9为采用引物i和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述x10为采用引物j和mirna荧光定量检测试剂盒对模板进行荧光实时定量pcr检测得到的ct值与对照反应体系的ct值的差值;
所述对照反应体系的ct值为采用所述引物对甲对模板进行荧光实时定量pcr检测得到的ct值;
(3)将步骤(2)得到的x1-x10代入下述公式1和公式2,
公式1:
y1=23.629x1-196.449x2-104.946x3+60.133x4+369.088x5+19.466x6+12.09x7+54.674x8+133.242x9+8.04x10-3428.62;
公式2:
y2=23.181x1-215.131x2-108.599x3+65.817x4+390.8x5+20.088x6+20.98x7+59.853x8+142.476x9+11.898x10-3992.44;
如果若y1≥y2,则样品不含有β2-受体激动剂;若y1<y2,则样品含有β2-受体激动剂。
以上任一所述β2-受体激动剂具体可为莱克多巴胺和/或盐酸克伦特罗。
以上任一所述待测样本可为动物组织。
所述动物组织可为动物肌肉组织。
所述动物具体可为山羊。所述山羊具体可为绒山羊。
本发明建立了山羊中β2-受体激动剂的有效监测方法。本发明在检测山羊中β2-受体激动剂中的应用中有广阔的前景。
附图说明
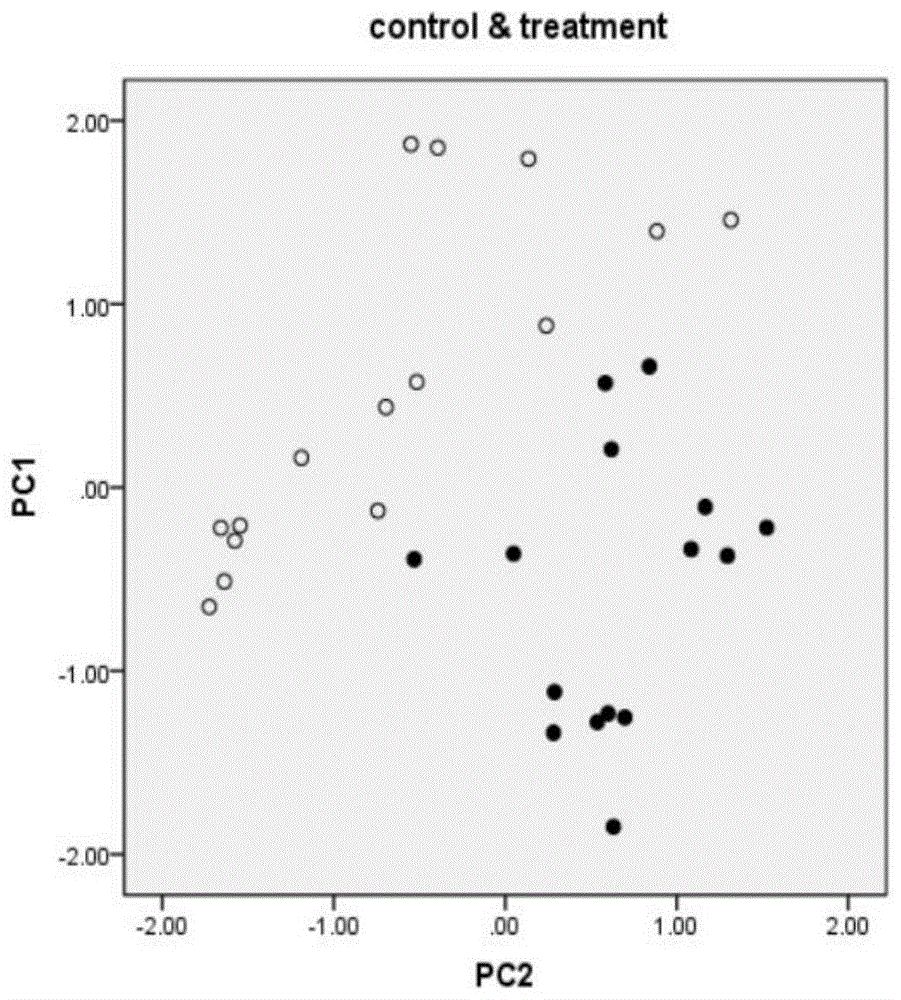
图1为细胞实验主成分分析结果。
图2为动物实验主成分分析结果。
图3为药物浓度为80μg/kg时测序结果(相对表达倍数)和荧光定量pcr检测结果(相对表达倍数)的比较。
图4为药物浓度为20μg/kg时测序结果(相对表达倍数)和荧光定量pcr检测结果(相对表达倍数)的比较。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
健康绒山羊:商购,巴彦淖尔。
实施例1、用于检测山羊中β2-受体激动剂标志物筛选及引物制备
1、将健康绒山羊(30kg)注射麻药处死,采用75%酒精表面消毒后放入无菌室解剖,取出肺组织。
2、完成步骤1后,将肺组织立即放入含双抗的pbs缓冲液中洗涤,去除血液和包膜组织,洗涤3次。
3、完成步骤2后,将组织剪碎成1mm3大小,然后加入0.1%胰酶和0.1%i型胶原酶(gibco,纽约,美国)37℃震荡消化约40min,然后用含10%胎牛血清(gibco,纽约,美国)和1%双抗的dmem/f12(gibco,纽约,美国)完全培养基终止消化,滴管吹打,经过200目不锈钢筛网过滤,收集滤液,将滤液1600rpm离心5min,收集沉淀。
4、完成步骤3后,将沉淀用5ml完全培养基重悬,接种于细胞培养皿中,显微镜下观察后放入37℃,5%co2细胞培养箱中培养。24h后细胞已完全贴壁,部分细胞呈长梭形。48h后,细胞长至培养皿面积的85%-95%。
5、完成步骤4后,收集细胞,以5×106个/孔接种于六孔板中,待细胞贴壁后,换用无血清培养基继续培养,待细胞汇合度达到90%时,弃去培养基,每孔加入含莱克多巴胺(sigma,旧金山,美国)和盐酸克伦特罗(sigma,旧金山,美国)的完全培养基1ml(莱克多巴胺和盐酸克伦特罗终浓度分别为80、40、20、10、5ng/ml,每个孔中同时加入两种药物)培养12h,每个浓度设三个平行孔,对照组各孔加入1ml的完全培养基。
7、完成步骤6后,吸去培养基,收集细胞,取部分细胞进行免疫荧光鉴定。免疫荧光鉴定按照常规方法操作,其中所用一抗和二抗分别是anti-alphasmoothmuscleactin抗体(abcam,剑桥,英国)和兔抗小鼠iggh&l抗体(abcam,剑桥,英国)。免疫荧光鉴定结果表明,细胞边缘荧光明显,细胞形态正常,细胞纯度能够达到后续实验要求。
8、取步骤7中收集的实验组和对照组细胞,提取总rna并分离mirna,建立实验组和对照组mirna库,经过mirna库测序分析和结果比对,筛选表达显著差异的10个mirna,作为用于鉴别山羊中是否含有β2-受体激动剂的标志物,针对10个mirna设计若干检测引物,最终得到用于检测10个mirna的10条引物,具体信息如下:
检测目标mirna-1的引物1:5'-gcgcgtgaggtagtaggttgtatagtt-3'(序列表的序列1);
检测目标mirna-2的引物2:5'-gcgctgaggtagtaggttgtatggtt-3'(序列表的序列2);
检测目标mirna-3的引物3:5'-gcgctgaggtaggaggttgtatagtt-3'(序列表的序列3);
检测目标mirna-4的引物4:5'-cgcgcgtgaggtagtagattgtatagtt-3'(序列表的序列4);
检测目标mirna-5的引物5:5'-gcgtagcagcacataatggtttgtgg-3'(序列表的序列5);
检测目标mirna-6的引物6:5'-cgctttcagtcggatgtttgcag-3'(序列表的序列6);
检测目标mirna-7的引物7:5'-cgcgcgtgaggtagtaagttgtattgtt-3'(序列表的序列7);
检测目标mirna-8的引物8:5'-ccgtagaaccgaccttgcg-3'(序列表的序列8);
检测目标mirna-9的引物9:5'-gcgtagcagcacagaaatgttgg-3'(序列表的序列9);
检测目标mirna-10的引物10:5'-ccgccttggcacctagtaagt-3'(序列表的序列10)。
实施例2、山羊体内外β2-受体激动剂检测方法的建立及验证
一、细胞实验
1、取实施例1的步骤7中制备的实验组和对照组细胞,使用mircutemirna提取分离试剂盒(tiangen,北京,中国)提取mirna(方法参照试剂盒说明书)。
2、取步骤1得到的mirna,使用mircute增强型mirnacdna第一链合成试剂盒(tiangen,北京,中国)进行mirna的反转录,制备mirnacdna第一链。
3、完成步骤2后,以mirnacdna第一链为模板,分别采用实施例1中的10个引物对进行荧光实时定量pcr反应。
荧光实时定量pcr反应按照mircute增强型mirna荧光定量检测试剂盒(tiangen,北京,中国)说明书进行。
反应体系:2×mircuteplusmirnapremix10μl,下游引物(试剂盒自带)0.4μl,上游引物(实施例1中设计的引物)0.4μl,mirna第一链cdna2μl,用ddh2o补足至20μl。下游引物和上游引物均是引物溶液的形式加至反应体系中,所述引物溶液中,上游引物和下游引物的浓度均为10μm。
反应程序如下:95℃,15min,进行起始模板变性;94℃,20sec,进行pcr循环中模板变性,60℃,34sec,进行退火和延伸,共45个循环,最后加上仪器自带的熔解曲线步骤。
采用18srna作为内参,检测引物f:5’-gtggtgttgaggaaagcagaca-3’(序列表的序列11);r:5’-tgatcacacgttccacctcatc-3’(序列表的序列12)。
阈值循环数(ct值)和熔融曲线均由7500实时定量pcr仪自带的sds软件(ab)获得。采用相对定量法对原始数据进行校正,公式如下:
△ct=ct(目标mirna)-ct(内参)。
△△ct=△ct(实验组)-平均△ct(对照组)。
使用wps(kingsoft,北京,中国)软件进行差异mirna相对表达倍数计算,对照组的x-fold值设为1,表示基因的表达量没有变化,2-△△ct代表实验组相对于对照组的基因表达倍数,即相对表达量。使用统计软件spss22.0(ibm,加利福尼亚,美国)进行数据显著性分析,在student-t检验结果中,p≤0.05为显著,p≤0.01为极显著。
结果如图3和图4所示。图3为药物浓度为80μg/kg时测序结果(相对表达倍数)和荧光定量pcr检测结果(相对表达倍数)的比较。图4为药物浓度为20μg/kg时测序结果(相对表达倍数)和荧光定量pcr检测结果(相对表达倍数)的比较。
结果表明,荧光实时定量pcr检测的mirna的上下调趋势与mirna测序结果一致,说明基于测序所选的差异mirna及设计的引物有效。
为进一步测试mirna实验组和对照组样品的区分度,对两组中所有样品数据的△ct值进行主成分分析,结果如图1所示(黑点代表对照组,白点代表实验组)。结果表明,实验组样品可以与对照组样品区分开来,进一步表明了所选差异mirna的有效性。
二、动物实验
1、将健康雄性绒山羊(体重30±2.5kg)54只分为实验组和对照组(每组27只),实验前饲喂空白饲料观察一周。
2、完成步骤1后,分组进行如下实验:
实验组:每日早晨喂食前空腹按剂量口灌给药莱克多巴胺(sigma,旧金山,美国),给药剂量为1mg/kg体重,连续给药28天后停药饲喂21天直至实验结束。
对照组:不进行给药处理。
分别于给药第7天、14天、21天,停药0天、1天、3天、7天、14天、21天各处死实验组和对照组3只给药动物,取背长肌后迅速置于液氮中,而后放置于-80℃直至分析。
3、取步骤2收集的山羊肌肉组织,使用mircutemirna提取分离试剂盒(tiangen,北京,中国)提取mirna(方法参照试剂盒说明书)。
4、取步骤2得到的mirna,使用mircute增强型mirnacdna第一链合成试剂盒(tiangen,北京,中国)进行mirna的反转录,制备mirnacdna第一链。
5、完成步骤4后,荧光实时定量pcr反应按照mircute增强型mirna荧光定量检测试剂盒(tiangen,北京,中国)说明书进行。
反应体系:2×mircuteplusmirnapremix10μl,下游引物(试剂盒自带)0.4μl,上游引物(实施例1中设计的引物)0.4μl,mirna第一链cdna2μl,用ddh2o补足至20μl。
反应程序如下:95℃,15min,进行起始模板变性;94℃,20sec,进行pcr循环中模板变性,60℃,34sec,进行退火和延伸,共45个循环,最后加上仪器自带的熔解曲线步骤。
采用18srna作为内参,检测引物f:5’-gtggtgttgaggaaagcagaca-3’(序列表的序列11);r:5’-tgatcacacgttccacctcatc-3’(序列表的序列12)。
阈值循环数(ct值)和熔融曲线均由7500实时定量pcr仪自带的sds软件(ab)获得。采用相对定量法对原始数据进行校正,公式如下:
△ct=ct(目标mirna)-ct(内参)。
△△ct=△ct(实验组)-平均△ct(对照组)。
对两组中所有样品数据的△ct值进行主成分分析,主成分分析结果如图2所示(黑点代表对照组,白点代表实验组)。结果显示,实验组样品可以与对照组样品区分开来,进一步表明了所选差异mirna和设计的引物的有效性。
三、交叉验证
1、根据动物实验中,实验组和对照组所用样品基于10个mirna得到的△ct值,用spss进行判别,得到判别公式,基于公式1和公式2可确定未知山羊样品中是否含β2受体激动剂。
公式1:
y1=23.629x1-196.449x2-104.946x3+60.133x4+369.088x5+19.466x6+12.09x7+54.674x8+133.242x9+8.04x10-3428.62。
公式2:
y2=23.181x1-215.131x2-108.599x3+65.817x4+390.8x5+20.088x6+20.98x7+59.853x8+142.476x9+11.898x10-3992.44。
公式中,x1-x10依次为采用引物1-引物10对模板进行荧光实时定量pcr检测后得到的△ct值。
根据公式计算的结果进行如下判断:
若y1≥y2,则样品不含有β2-受体激动剂;若y1<y2,则样品含有β2-受体激动剂。
采用spss统计的分类结果如表1所示。
表1分类结果b,c
a.仅对分析中的案例进行交叉验证。在交叉验证中,每个案例都是按照从该案例以外的所有其他案例派生的函数来分类的。
b.已对初始分组案例中的100.0%个进行了正确分类。
c.已对交叉验证分组案例中的100.0%个进行了正确分类。
序列表
<110>中国农业科学院农业质量标准与检测技术研究所
<120>基于mirna的山羊中β2-受体激动剂检测引物及检测方法
<160>12
<170>siposequencelisting1.0
<210>1
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>1
gcgcgtgaggtagtaggttgtatagtt27
<210>2
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>2
gcgctgaggtagtaggttgtatggtt26
<210>3
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>3
gcgctgaggtaggaggttgtatagtt26
<210>4
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>4
cgcgcgtgaggtagtagattgtatagtt28
<210>5
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>5
gcgtagcagcacataatggtttgtgg26
<210>6
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>6
cgctttcagtcggatgtttgcag23
<210>7
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>7
cgcgcgtgaggtagtaagttgtattgtt28
<210>8
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>8
ccgtagaaccgaccttgcg19
<210>9
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>9
gcgtagcagcacagaaatgttgg23
<210>10
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>10
ccgccttggcacctagtaagt21
<210>11
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>11
gtggtgttgaggaaagcagaca22
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
tgatcacacgttccacctcatc22
- 还没有人留言评论。精彩留言会获得点赞!