一种靶向四环素抗性基因tetA的sgRNA及其敲除载体、载体构建方法和应用与流程
本发明涉及生物技术领域,具体涉及特异性靶向抗生素抗性基因teta的sgrna、含有该sgrna的crispr/cas9基因敲除载体及其构建方法和应用。
背景技术:
近年来,随着抗生素在畜禽养殖和临床治疗中的大量使用,环境中抗生素抗性细菌以及抗生素抗性基因的丰度正在不断增加。抗生素抗性基因会使细菌产生抗生素耐药性,目前已被当做一种新型的环境污染物。四环素类抗生素是由放线菌产生的或半合成的一类广谱抗生素,由于价格低廉,不仅被作为药物用于治疗人类或动物的细菌感染,同时也被作为常用的饲料添加剂,用于提高饲料利用率,促进养殖动物的生长。四环素的滥用导致了四环素抗性基因在细菌间广泛传播,这使得四环素的治疗效果不断被削弱,对人和动物有着潜在的健康风险。teta基因是四环素抗性基因中的重要一种,目前在土壤,地表水,大气,污水处理厂、沉积物等环境中都被广泛检出。
目前,抗生素抗性基因的削减主要是通过微生物群落结构的改变,例如,通过过滤的方式减少微生物的生物量。但这些方式都没有从根本上破坏抗性基因,系统中残余的抗性基因仍能通过整合、转座以及接合转移等途径进行迁移转化。crispr/cas9系统是近年来新兴的基因编辑技术,cas9蛋白能在特定guide-rna的引导下靶向切割特定序列。一些研究者利用crispr/cas9系统对大肠杆菌等多种微生物的功能基因进行了敲除,但目前利用该系统对四环素抗性基因敲除的研究还较为缺乏。
技术实现要素:
本发明的目的在于提供特异性靶向四环素抗性基因teta的sgrna、含有该sgrna的crispr/cas9基因敲除载体及其构建方法。
第一方面,本发明所涉及的sgrna序列靶向teta基因的第251位至第270位序列,cas9蛋白在该sgrna的引导下对该位点有良好的切割效果,该sgrna的特异性核苷酸序列如sgrna-1(为seqidno.1)所示。
sgrna-1:5’-catgatggcgtagtcgacag-3’。
第二方面,本发明提供了包含上述特异性靶向teta基因第251至第270位核苷酸序列的sgrna的crispr/cas9基因敲除载体,优选的,crispr/cas9基因敲除载体图谱如附图3所示。
上述crispr/cas9基因敲除载体为单质粒系统,即运用同一个质粒载体表达基因敲除所需要的cas9蛋白和sgrna。
第三方面,本发明提供上述crispr/cas9基因敲除载体的构建方法,其为:将cas9蛋白基因,上述sgrna基因,接合转移位点,复制子,筛选标记基因通过无缝克隆的方法得到上述的crispr/cas9基因敲除载体。
上述crispr/cas9基因敲除载体的构建包含以下步骤:
(1)合成含有上述sgrna序列的表达元件sgrna(teta),该表达元件包含原核生物j23119(spei)启动子、上述sgrna序列、grnascaffold序列和终止子序列,其序列如seqidno.2所示(序列如下):ctgcagcacgtacagcactgatgcatcgctgatgcggtattttctccttacgcatctgtgcggtatttcacaccgcatatgctggatccttgacagctagctcagtcctaggtataatactagtcatgatggcgtagtcgacaggttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttttgaattctctagagtcgacctgcagaagcttagatctattaccctgttatccctgcag
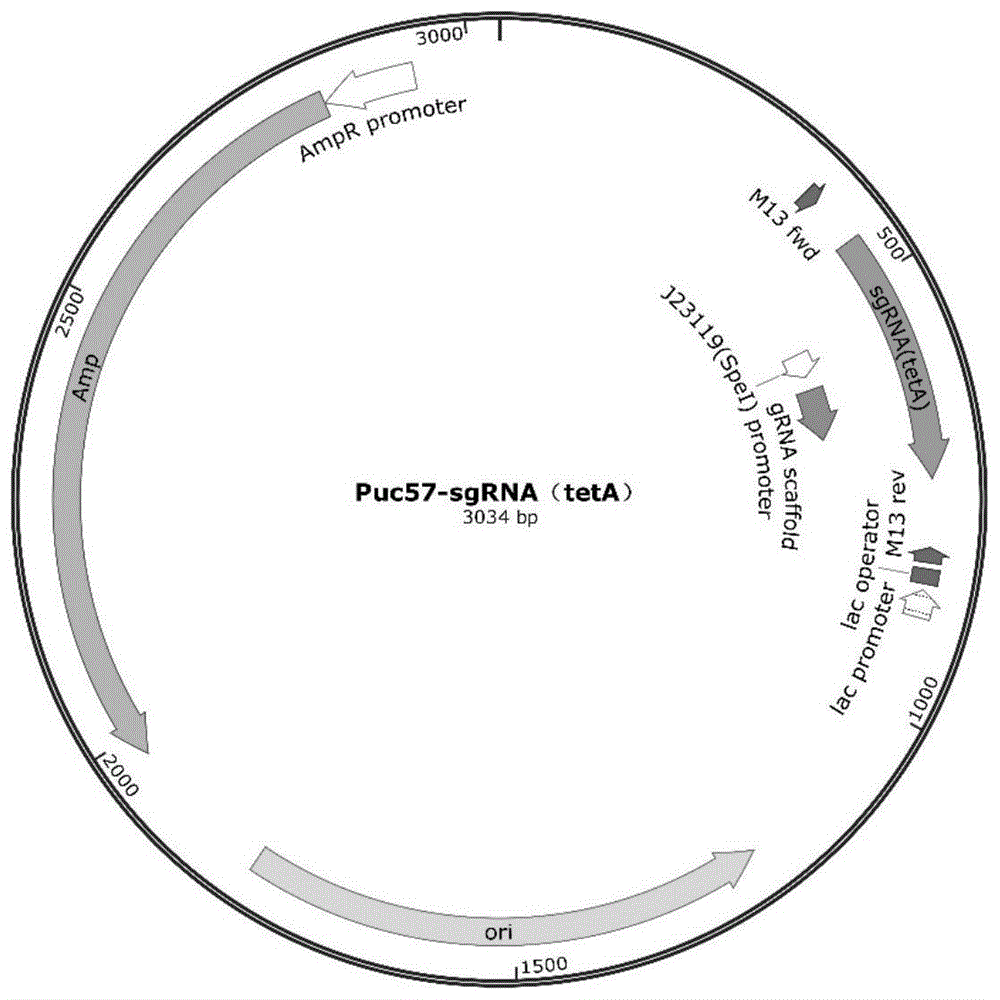
(2)将步骤(1)合成的sgrna(teta)插入到puc57载体中,得到载体puc57-sgrna(teta),其图谱如图1所示。
(3)以pk18mobsacb质粒为模板,利用引物对1pcr扩增rp4-orit序列,其中rp4-orit序列中包含接合转移位点,将扩增产物凝胶纯化。
(4)以步骤(2)中puc57-sgrna(teta)为模板,利用引物对2pcr扩增oriv-sgrna(teta)序列,将扩增产物凝胶纯化。
(5)步骤(3)、(4)所涉及的引物对1、2含有同源片段,利用无缝克隆将步骤(3)、(4)纯化所得的扩增产物连接,得到puc57-orit-sgrna(teta)质粒,其图谱如图2所示。
(6)以pcas质粒为模板,利用引物对3pcr扩增cas9-kan序列,将扩增产物凝胶纯化。
(7)以步骤(5)所得的puc57-orit-sgrna(teta)为模板,利用引物对4pcr扩增oriv-orit-sgrna(teta)序列,将扩增产物凝胶纯化。
(8)步骤(6)、(7)所涉及的引物对3、4含有同源片段,利用无缝克隆将步骤(6)、(7)纯化所得的扩增产物连接,得到puc57-orit-cas9-sgrna(teta)质粒,其图谱如图3所示,该质粒即为靶向teta基因第251位至第270位序列的crispr/cas9基因敲除载体。
引物对1:
orit-s:ctggaggatcatccagccctg
orit-f:gccgagcttcctgctgaacatc
引物对2
puc19-f:gatgttcagcaggaagctcggccttccgcttcctcgctcactg
puc19-s:atcagggctggatgatcctccagtcattaatgcagctggcacgac
引物对3:
fragment-f:atctcagcgatccaggtcattcagactggctaatgc
fragment-s:gatgatcctccaggatgtagccgtcaagttgtcat
引物对4:
vector-f:gacggctacatcctggaggatcatccacgtacagcactgatgcatcg
vector-s:tctgaatgacctggatcgctgagataggtgcctc
同样地,本发明利用pcr扩增,无缝克隆的方法获得puc57-orit-cas9-△sgrna质粒,其图谱如图4所示,该质粒与puc57-orit-cas9-sgrna(teta)相比缺少含有上述sgrna的sgrna(teta)序列,无法行使基因敲除的功能,而puc57-orit-cas9-sgrna(teta)可以行使敲除功能。
上述所涉及的pcr反应采用50ul体系,反应体系如下:primestarmaxpremix25ul,上下游引物各1ul,模板1ul,ddh2o22ul。
上述所涉及的pcr反应程序如下:98℃变性10s,55℃退火10s,延伸温度为72℃,速度为5s/kb,循环数为30。
上述所涉及的无缝克隆反应体系如下:novorecplus重组酶1ul,5×缓冲液4ul,长片段0.05pmol,短片段为0.025pmol,用ddh2o将反应体系补充至20ul,50℃反应15分钟。
第四方面,本发明提供一种微生物,该微生物含有上述的puc57-orit-cas9-sgrna(teta)质粒。其中,所述微生物为大肠杆菌,该微生物由感受态大肠杆菌转化入puc57-orit-cas9-sgrna(teta)质粒得到。
本发明的有益效果包括:
(1)本发明通过对四环素类抗性基因teta的序列分析,筛选出靶向切割teta基因的上述sgrna序列。经实验验证,本发明提供的crispr/cas9敲除载体能够高效靶向切割teta基因第251位至第270位序列。
(2)本发明提供的crispr/cas9敲除载体能够通过转化或接合转移的方式进入受体细胞,对受体细胞中的目的序列进行靶向切割(高效靶向切割teta基因第251位至第270位序列)。
(3)本发明提供的crispr/cas9敲除载体及其构建方法具有很强的实用性,为teta基因及其他抗性基因的敲除及其研究提供了有效方法和基础。
附图说明
图1为本发明实施例2中puc57-sgrna(teta)质粒的图谱。图中标出了复制子(ori),氨苄抗性基因(amp),sgrna-1的表达元件sgrna(teta)。
图2为本发明实施例2中puc57-orit-sgrna(teta)质粒的图谱。该质粒在puc57-sgrna(teta)质粒的基础上增加了接合转移位点(orit)。
图3为本发明实施例2中puc57-orit-cas9-sgrna(teta)敲除载体的质粒图谱。图中标出了复制子(ori),卡那抗性基因(kan),sgrna-1的表达元件sgrna(teta),cas9蛋白基因(cas9)以及接合转移位点(orit)。
图4为本发明实施例2中puc57-orit-cas9-△sgrna对照载体的质粒图谱。该质粒与puc57-orit-cas9-sgrna(teta)质粒相比缺少了sgrna-1的表达元件sgrna(teta)。
图5为本发明实施例3中接合转移实验的结果。实验组和对照组的细菌菌落数有显著差异(p<0.01)。
具体实施方式
下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。此外,在阅读了本发明的内容之后,本领域技术人员可以对本发明做各种改动或修改,这些等价形式同样落于本申请权利要求书所限定的范围。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1特异性靶向teta基因的sgrna序列的获得
(1)从http://www.ncbi.nlm.nih.gov网址中下载四环素抗性基因teta(genbank:ng_048148.1)的基因序列。
(2)将(1)得到的序列导入https://zlab.bio/guide-design-resources中获得符合条件的sgrna,从中筛选出效率和特异性得分都较高的sgrna-1,sgrna-1序列如下:
sgrna-1:5’-catgatggcgtagtcgacag-3’。
实施例2构建含有sgrna-1的crispr/cas9基因敲除载体
含有sgrna-1的crispr/cas9基因敲除载体构建的构建方法包括如下步骤:
(1)利用软件snapgene设计含有sgrna-1的表达元件序列sgrna(teta),并在杭州擎科梓熙生物技术公司合成该序列,表达元件包含原核生物j23119(spei)启动子、上述sgrna-1、grnascaffold序列和终止子序列,其序列如序列1所示。
(2)将步骤(1)合成的sgrna(teta)插入到puc57载体中,得到载体puc57-sgrna(teta),并将该载体转化入大肠杆菌感受态细胞中,质粒载体图谱如图1所示。
(3)以pk18mobsacb质粒为模板,利用引物对1pcr扩增rp4-orit序列,其中rp4-orit序列中包含接合转移位点,将扩增产物用tiangen凝胶纯化试剂盒纯化。
(4)将步骤(2)所得大肠杆菌阳性克隆扩增,用tiangen质粒小提试剂盒提取5ml菌液中步骤(2)涉及的puc57-sgrna(teta)质粒,以该质粒为模板,利用引物对2pcr扩增oriv-sgrna(teta)序列,将扩增用tiangen凝胶纯化试剂盒纯化。
(5)步骤(3)、(4)所涉及的引物对1、2含有同源片段,利用novorecplus无缝克隆试剂盒将步骤(3)、(4)纯化所得的扩增产物连接,得到puc57-orit-sgrna(teta)质粒,并将该载体转化入大肠杆菌感受态细胞中,质粒载体图谱如图2所示。
(6)以pcas质粒为模板,利用引物对3pcr扩增cas9-kan序列,将扩增产物用tiangen凝胶纯化试剂盒纯化。
(7)将步骤(5)所得大肠杆菌阳性克隆扩增,用tiangen质粒小提试剂盒提取5ml菌液中步骤(5)涉及的puc57-orit-sgrna(teta)质粒,以该质粒为模板,利用引物对4pcr扩增oriv-orit-sgrna(teta)序列,将扩增产物用tiangen凝胶纯化试剂盒纯化。
(8)步骤(6)、(7)所涉及的引物对3、4含有同源片段,利用novorecplus无缝克隆试剂盒将步骤(6)、(7)纯化所得的扩增产物连接,得到puc57-orit-cas9-sgrna(teta)质粒,其载体图谱如图3所示,该质粒即为靶向teta基因第251位至第270位序列的crispr/cas9基因敲除载体。
类似地,本发明利用pcr扩增,无缝克隆的方法获得puc57-orit-cas9-△sgrna对照质粒,质粒载体图谱如图4所示,该质粒与puc57-orit-cas9-sgrna(teta)相比缺少含有sgrna-1的sgrna(teta)序列,无法行使基因敲除的功能,而puc57-orit-cas9-sgrna(teta)可以行使敲除功能。
实施例2中涉及的pcr反应采用takara公司的primestarmax高保真聚合酶,反应体系如下:primestarmaxpremix25ul,上下游引物各1ul,模板1ul,ddh2o22ul。pcr反应程序如下:98℃变性10s,55℃退火10s,延伸温度为72℃,速度为5s/kb,循环数为30。
实施例2中涉及的无缝克隆采用novorecplusonesteppcrcloning试剂盒,反应体系如下:novorecplus重组酶1ul,5×缓冲液4ul,长片段0.05pmol,短片段为0.025pmol,用ddh2o将反应体系补充至20ul,50℃反应15分钟
实施例2中涉及的转化步骤如下:取100ul感受态细胞置于冰上解冻,加入无缝克隆连接产物,在冰上放置30分钟;将感受态细胞42℃水浴60秒,快速转移到冰浴中,冷却3分钟;向感受态细胞中加入500ullb液体培养基,混匀后置于37℃200rpm摇床中复苏60分钟;吸取复苏后的感受态细胞100ul涂布于相应抗性的培养基,置于恒温培养箱中培养16小时。
实施例3实施例2构建的crispr/cas9敲除载体的敲除效果验证
对于大肠杆菌而言,在puc57-orit-cas9-sgrna(teta)敲除载体的作用下,若发生质粒dna的断裂,质粒会逐渐丢失,失去四环素抗性,若发生染色体dna的断裂,细菌将难以存活。
1、利用接合转移验证该质粒载体对含有teta基因大肠杆菌的削减作用
(1)细菌培养
将含有rp4质粒的大肠杆菌划线活化后接种于四环素抗性的lb液体培养基中,置于恒温震荡培养箱中37℃震荡培养16小时,速度为200rmp。其中rp4质粒是incpα系列,能够在多种细菌间接合转移的泛宿主型质粒,其大小为60099bp,该质粒携带多种抗生素抗性基因,其中就包含四环素抗性基因teta。
将含有puc57-orit-cas9-sgrna(teta)敲除载体和含有puc57-orit-cas9-△sgrna对照载体的大肠杆菌划线活化后分别接种于卡那抗性的lb液体培养基中,置于恒温震荡培养箱中37℃震荡培养16小时,速度为200rmp。
(2)洗菌
将步骤(1)扩大培养后的摇菌管以转速5000rmp离心5分钟。离心后倒弃上清液,向摇菌管中加入适量pbs缓冲液使沉积的菌液重悬并再次离心,再次弃去上清液,共重复3次。最后,再次用pbs缓冲液将菌液od600值均调节至0.7(±0.03)。
(3)细菌接合
实验组:在10ml离心管中加入2.5mlpbs重悬的含有rp4质粒的大肠杆菌与2.5mlpbs重悬的含有puc57-orit-cas9-sgrna(teta)敲除载体的大肠杆菌。
对照组:在10ml离心管中加入2.5mlpbs重悬的含有rp4质粒的大肠杆菌与2.5mlpbs重悬的含有puc57-orit-cas9-△sgrna对照载体的大肠杆菌。
将实验组和对照组的离心管37℃震荡培养1h后放入37℃恒温培养箱静置培养12h。
(4)平板计数
取步骤(3)中实验组和对照组的菌液分别稀释到适宜浓度,各取100ul菌液涂布于四环素抗性的lb固体培养基上,平行重复3次。平板置于37℃恒温培养箱中培养15h,对菌落进行计数,并计算单位体积实验组和对照组菌液中四环素抗性菌的菌落数(cfu/ml)。
(5)作图结果
根据步骤(4)的平板计数结果,本实验利用r语言绘制了实验组和对照组中四环素抗性菌菌落数的箱线图,如图5所示,其中纵坐标代表单位体积取对数后的菌落数(lg(cfu)/ml)。结果显示与对照组相比,实验组当中携带四环素抗性的菌落数显著减少(p<0.01),这说明puc57-orit-cas9-sgrna(teta)敲除载体能够有效去除rp4质粒上的teta基因。
2、该质粒载体对大肠杆菌s17-1菌株中teta基因同源片段的敲除
大肠杆菌s17-1菌株的染色体上整合了rp4-2质粒,其中就包括teta基因的同源片段,因此,本实验将puc57-orit-cas9-sgrna(teta)敲除载体转化入s17-1菌株中,若该敲除载体能靶向切割teta基因第251位至第270位序列,那么含有该质粒的转化子将无法生长,具体验证方法如下:
(1)转化
取100ul大肠杆菌s17-1感受态细胞置于冰上解冻至冰水混合物状态,将该100ul感受态平均分为2份,每份50ul,分别置于2个离心管中。
实验组:在50ul感受态细胞中加入100ngpuc57-orit-cas9-sgrna(teta)敲除载体,在冰上放置30分钟。
对照组:在50ul感受态细胞中加入100ngpuc57-orit-cas9-△sgrna对照载体,在冰上放置30分钟。
将对照组和实验组42℃水浴60秒,速转移到冰浴中,冷却3分钟。分别向对照组与实验组感受态细胞中加入500ullb液体培养基,混匀后置于37℃200rpm摇床中复苏60分钟,稀释到合适浓度后,吸取稀释后的感受态细胞100ul涂布于相应抗性的培养基上,平行重复3次,将培养基置于恒温培养箱中培养16小时。
(2)平板计数与结果
经过抗性平板的培养,对照组转化子的平均菌落数为62000cfu/ml,而实验组转化子的平均菌落数为0cfu/ml,转化实验表明puc57-orit-cas9-sgrna(teta)敲除载体能有效靶向切割teta基因的第251位至第270位序列。
综上所述,本发明提供的特异性靶向teta基因的sgrna序列以及含有该sgrna的crispr/cas9敲除载体能够高效靶向切割teta基因第251位至第270位序列,实现抗性基因teta基因的敲除。同时,用本发明提供的crispr/cas9敲除载体制备方法较易得到靶向相应抗生素抗性基因的crispr/cas9敲除载体,为teta及其他抗性基因的敲除及其研究提供了有效方法和基础。
序列表
<110>浙江大学
<120>一种靶向四环素抗性基因teta的sgrna及其敲除载体、载体构建方法和应用
<130>20-212069-00016124
<160>10
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
catgatggcgtagtcgacag20
<210>2
<211>284
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctgcagcacgtacagcactgatgcatcgctgatgcggtattttctccttacgcatctgtg60
cggtatttcacaccgcatatgctggatccttgacagctagctcagtcctaggtataatac120
tagtcatgatggcgtagtcgacaggttttagagctagaaatagcaagttaaaataaggct180
agtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttttgaattctctagag240
tcgacctgcagaagcttagatctattaccctgttatccctgcag284
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctggaggatcatccagccctg21
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
gccgagcttcctgctgaacatc22
<210>5
<211>43
<212>dna
<213>人工序列(artificialsequence)
<400>5
gatgttcagcaggaagctcggccttccgcttcctcgctcactg43
<210>6
<211>45
<212>dna
<213>人工序列(artificialsequence)
<400>6
atcagggctggatgatcctccagtcattaatgcagctggcacgac45
<210>7
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>7
atctcagcgatccaggtcattcagactggctaatgc36
<210>8
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>8
gatgatcctccaggatgtagccgtcaagttgtcat35
<210>9
<211>47
<212>dna
<213>人工序列(artificialsequence)
<400>9
gacggctacatcctggaggatcatccacgtacagcactgatgcatcg47
<210>10
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>10
tctgaatgacctggatcgctgagataggtgcctc34
- 还没有人留言评论。精彩留言会获得点赞!