一种巯基化胆固醇修饰的mPEG接枝壳聚糖及其制备方法和应用与流程
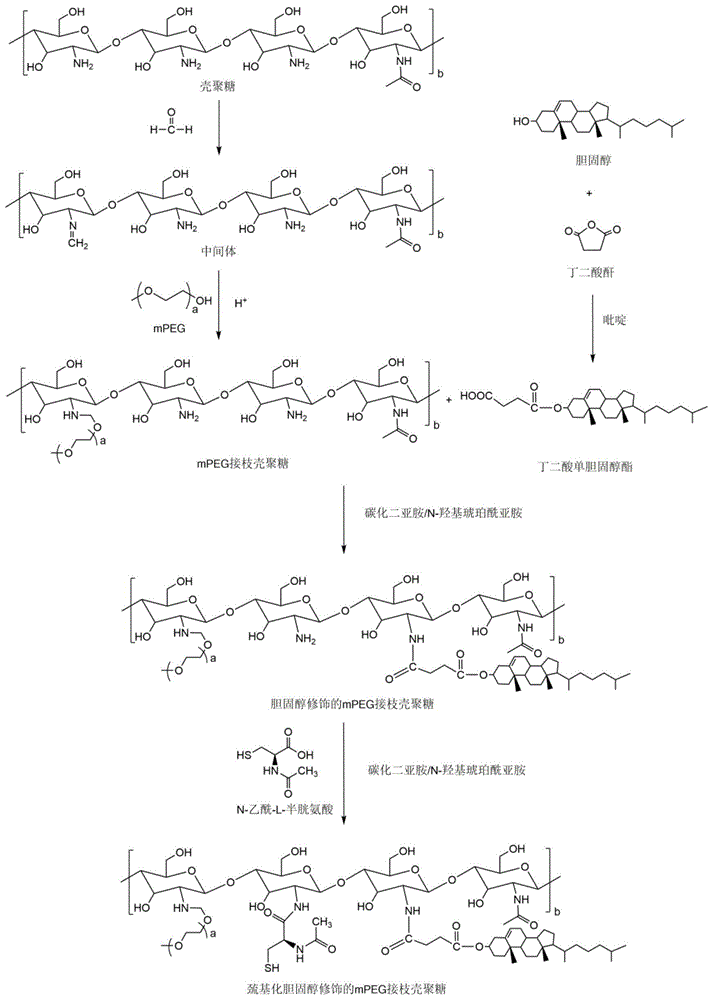
本发明属于天然高分子聚合物领域,尤其是一种巯基化胆固醇修饰的mpeg接枝壳聚糖及其制备方法和应用。
背景技术:
:止血在医疗救治中起着至关重要的作用,无论是日常生活中的小创伤,还是手术中的大切口,都需要进行快速、有效的处理。近年来,越来越多科研工作者致力于止血材料的开发,常见的止血材料有纤维蛋白胶,粉末状胶原蛋白,明胶海绵,但这些材料都因自身存在的缺点而被限制应用。比如,纤维蛋白胶来源于人或者哺乳动物的血浆中,可能会传染人或者动物的血源性疾病,在使用中存在着极大的隐患。相对来说,具有无毒、无抗原性、抗菌性和生物相容性且可在体内降解、吸收等特性的壳聚糖在开发快速止血材料方面有着更大的优势,使得壳聚糖止血材料是目前止血材料研究的热点。但是,壳聚糖止血材料还存在吸水能力不足、伤口愈合慢以及与组织的粘附力不足等问题。技术实现要素:为了解决现有技术中存在的上述问题,本发明在第一方面提供了一种巯基化胆固醇修饰的mpeg接枝壳聚糖,所述壳聚糖具有至少三个葡萄糖重复单元,并且所述接枝壳聚糖包括:(1)作为母体骨架的壳聚糖(cs);(2)接枝在壳聚糖的第一葡萄糖重复单元的氨基上的甲氧基聚乙二醇(mpeg)单元;(3)接枝在壳聚糖的第二葡萄糖重复单元的氨基上的胆固醇(cho);(4)接枝在壳聚糖的第三葡萄糖重复单元的氨基上的含巯基(sh)基团。本发明在第二方面提供了一种制备本发明第一方面所述的接枝壳聚糖的方法,所述方法包括如下步骤:(1)利用胆固醇和丁二酸酐合成丁二酸单胆固醇酯;(2)利用壳聚糖、mpeg、冰醋酸和甲醛合成mpeg接枝壳聚糖;(3)利用所述丁二酸单胆固醇酯和所述mpeg接枝壳聚糖合成胆固醇修饰的mpeg接枝壳聚糖;(4)利用巯基化试剂和所述胆固醇修饰的mpeg接枝壳聚糖合成巯基化胆固醇修饰的mpeg接枝壳聚糖。本发明在第三方面提供了一种止血海绵,所述止血海绵由本发明第一方面所述的接枝壳聚糖或本发明第二方面所述的方法制得的接枝壳聚糖制成。本发明第四方面提供了本发明第一方面所述的接枝壳聚糖或由本发明第二方面所述的方法制得的接枝壳聚糖在制备止血海绵中的应用。本发明具有如下优势或技术效果:(1)本发明以天然大分子壳聚糖为基本原料,属于可再生资源,安全无毒,具有其他合成大分子无法比拟的优点。其良好的生物相容性和生物降解性而被用于医疗领域。同时壳聚糖自身具有良好的止血、抗菌等功效,可以作为一种良好的止血材料。(2)mpeg的改性修饰可使止血材料具有更强的吸水性能。(3)胆固醇修饰后的止血材料会因胆固醇的存在而加速破损细胞的修复和再生,加速伤口愈合。(4)巯基化的止血材料利用巯基-二硫键交换反应,与内在蛋白质(例如粘液糖蛋白,角蛋白或膜相关蛋白质)上的巯基交联形成二硫键从而具有极好的粘膜粘附性。附图说明图1为巯基化胆固醇修饰的mpeg接枝壳聚糖(mpeg-cs(sh)-cho)的合成路线图。具体实施方式下面结合具体的实施方式来对本发明的技术方案做进一步的限定,但要求保护的范围不仅局限于所作的描述。本发明在第一方面提供了一种巯基化胆固醇修饰的mpeg接枝壳聚糖,所述壳聚糖具有至少三个葡萄糖重复单元,并且所述接枝壳聚糖包括:(1)作为母体骨架的壳聚糖;(2)接枝在壳聚糖的第一葡萄糖重复单元的氨基上的甲氧基聚乙二醇单元;(3)接枝在壳聚糖的第二葡萄糖重复单元的氨基上的胆固醇;(4)接枝在壳聚糖的第三葡萄糖重复单元的氨基上的含巯基基团。壳聚糖(chitosan,cs)又称脱乙酰甲壳素,是由自然界广泛存在的几丁质(chitin)经过脱乙酰作用得到的物质。壳聚糖具有诸多良好的生物性能,如良好的生物相容性和生物可降解性,而且还具有止血、抑菌和抗菌的作用,能够促进伤口愈合和修复的作用以及吸水透氧性。本发明利用壳聚糖分子内存在游离的氨基和羟基,通过酰化反应、醚化反应、席夫碱反应、交联反应、接枝共聚反应等化学手段对其进行改性,制得巯基化胆固醇修饰的mpeg接枝壳聚糖。将所述接枝壳聚糖制成止血海绵,获得了非常优异的技术效果,其原因推测有如下几点:(1)壳聚糖本身可以从以下几个途径发挥止血功效:(a)对血小板的刺激作用血小板是血液凝固中的主要成分,可被多种异物材料活化,活化后的血小板释放特征性蛋白β—血小板球蛋白,同时释放大量的5-羟色胺和血栓素a2,使血小板止血栓迅速形成,达到初步止血的目的。(b)对红细胞的聚集作用红细胞是血液中主要的有效成分,在止血过程中,它能促使全血浓度增加,加强血小板向血管壁输送的速度。红细胞表面存在的各种蛋白质类物质及糖脂类物质使膜表面带净负电荷,在生理状态下,由于静电斥力的存在,阻止了红细胞之间的聚集。壳聚糖能使红细胞发生聚集,壳聚糖表面的正电荷与红细胞表面的负电荷发生电荷反应,使红细胞大量聚集黏附在伤口处,从而快速形成血凝块进行止血。(c)激活补体系统壳聚糖能够通过激活旁路途径来引起补体反应,在这个过程中其分子链上大量的羟基和氨基基团发挥了重要的作用。补体系统发挥作用的具体机制主要是由血液中补体c3等先通过水解与b因子、d因子发生一系列生化反应后转化为活化型的c3a和c3b,c3b再通过酯键和酰胺键与壳聚糖中的大量的氨基和羟基基团结合固定从而促凝。另外,补体激活途径中产生的衍生物,如c3a和c5a在凝血过程中也起到重要的作用,这些衍生物不仅能调节血管的紧张性,还能调节血小板的活性,同时促使粒细胞/单核细胞促凝物质的释放。所以壳聚糖可通过激活补体系统达到促进凝血的目的。(d)对血液中其他成分的作用壳聚糖能促使白细胞释放各种细胞因子和细胞粘附因子,同时壳聚糖还具有抑制体内溶解纤维蛋白活性、降低巨噬细胞分泌溶纤酶原激活剂的能力,减少血纤维蛋白的溶解,从而提高止血效果。(2)接枝的mpeg发挥的作用:mpeg(methoxypoly(ethyleneglycol)),即聚乙二醇单甲醚或甲氧基聚乙二醇,其具有较高的水合度、非离子性、长链的高度柔韧性、流动性和较大的排阻体积。此外,mpeg具有羟基活性末端,易于功能化改性而连接到高分子材料表面,增加材料的亲水性,使材料具有较强的吸水性。(3)胆固醇发挥的作用胆固醇是哺乳动物细胞膜的重要组成成分,占质膜脂类的20%以上,胆固醇的存在可以加速破损细胞的修复和再生,加速伤口愈合。(4)巯基化带来的作用巯基化所形成的游离巯基可以通过巯基——二硫键交换反应,与内在蛋白质(例如粘液糖蛋白,角蛋白或膜相关蛋白质)上的巯基交联形成二硫键,因此含有游离巯基的化合物显示出极好的粘膜粘附性。第一葡萄糖重复单元、第二葡萄糖重复单元和第三葡萄糖重复单元仅仅用于区分其上的氨基所接枝的基团的不同,并没有限制顺序的意思。实际上,本发明对第一葡萄糖重复单元、第二葡萄糖重复单元和第三葡萄糖重复单元在母体骨架上的顺序没有特别的限制,可以是彼此相邻的,也可以是彼此相间的;可以是无序的,也可以是有序的;可以是连续的,也可以是间隔的。例如,其中的一个葡萄糖重复单元与其他的一个或者两个相邻或相间。又例如,可以如下结构式所示那样mpeg、含巯基取代基和胆固醇依次接枝在壳聚糖骨架上。在一些优选的实施方式中,所述聚合物具有如下所示的分子结构:其中,a为31至186(例如为40、60、80、100、120、140、160或180),b为113至681(例如200、400或600)。在另一些优选的实施方式中,b取值使得作为母体骨架的壳聚糖的平均分子量为5000~30000da,例如为10000、15000、20000或25000da。在另一些优选的实施方式中,a取值使得mpeg的分子量为350~20000da,例如为500、1000、2000、5000、10000或15000da。在另一些优选的实施方式中,所述接枝壳聚糖采用壳聚糖、胆固醇、巯基化试剂和mpeg作为反应原料制备而成。优选的是,所述壳聚糖的脱乙酰基程度(dd值)为90%至97%(例如91、92、93、94、95或96%)。另外优选的是,mpeg的取代度为5%至30%(例如10、15、20或25%)。另外优选的是,胆固醇的取代度为3%至25%(例如10、15或20%)。另外优选的是,含巯基基团的取代度为2%至30%(例如5、10、15、20或25%)。本发明在第二方面提供了一种制备本发明第一方面所述的接枝壳聚糖的方法,所述方法包括如下步骤:(1)利用胆固醇和丁二酸酐合成丁二酸单胆固醇酯;(2)利用壳聚糖、mpeg、冰醋酸和甲醛合成mpeg接枝壳聚糖;(3)利用所述丁二酸单胆固醇酯和所述mpeg接枝壳聚糖合成胆固醇修饰的mpeg接枝壳聚糖;(4)利用巯基化试剂和所述胆固醇修饰的mpeg接枝壳聚糖合成巯基化胆固醇修饰的mpeg接枝壳聚糖。在本发明方法中,步骤(1)和步骤(2)的顺序没有限定,可以按照顺序依次进行也可以同时进行,也可以先进行步骤(2)然后再进行步骤(1)。但是步骤(4)需要最后进行,否则巯基会因后续反应过程过多且未经氮气保护而氧化成二硫键,从而不具备粘膜粘附性。在另一些优选的实施方式中,在步骤(1)中,将胆固醇和丁二酸酐溶于第一反应溶剂中,以吡啶为催化剂,在25~65℃(例如30、40或50℃)条件下搅拌24~96h(例如48或72h)进行反应,制得丁二酸单胆固醇酯。在本发明中,优选以吡啶为第一反应溶剂,因为吡啶不仅可以作为溶剂,同时还可以作为催化剂催化本次步骤反应的进行。当然,第一反应溶剂可以采用吡啶之外的溶剂同时以吡啶为催化剂,那么可将反应物溶于其他溶剂中再以吡啶为催化剂催化该反应。在另一些优选的实施方式中,在步骤(2)中,将含壳聚糖、mpeg和冰醋酸溶于第二反应溶剂中,在10~50℃(例如20、30或40℃)条件下搅拌10~120min(例如20、40、60、80或100min)后,再加入甲醛水溶液,在10~50℃(例如20、30或40℃)条件下搅拌1~5h(例如2、3或4h)进行反应,制得mpeg接枝壳聚糖。在另一些优选的实施方式中,在步骤(3)中,将所述丁二酸单胆固醇酯溶于第三反应溶剂中,以edc和nhs为活化剂,在20~60℃(例如30、40或50℃)条件下活化1~24h(例如3、6、9、12、15、18或21h),再加入所述mpeg接枝壳聚糖,在20~60℃(例如30、40或50℃)条件下搅拌24~96h(例如48或72h)进行反应,收集反应产物,然后对所述反应产物依次进行透析纯化和冷冻干燥,制得胆固醇修饰的mpeg接枝壳聚糖。在另一些优选的实施方式中,在步骤(4)中,将巯基化试剂溶于第四反应溶剂中,以edc和nhs为活化剂,在20~60℃(例如30、40或50℃)、氮气保护的条件下活化1~24h(例如3、6、9、12、15、18或21h),再加入所述胆固醇修饰的mpeg接枝壳聚糖,在20~60℃(例如30、40或50℃)、氮气保护的条件下搅拌24~96h(例如48或72h)进行反应,收集反应产物,然后对反应产物依次进行透析纯化和冷冻干燥,制得巯基化胆固醇修饰的mpeg接枝壳聚糖。在另一些优选的实施方式中,在步骤(1)中,还包括对收集反应产物然后依次进行重结晶和干燥处理从而得到丁二酸单胆固醇酯的步骤。在另一些优选的实施方式中,在步骤(2)、(3)和/或(4)中,还包括收集反应产物然后依次进行透析纯化和冷冻干燥从而得到相应产物的步骤。在另一些优选的实施方式中,所述巯基化试剂选自由n-乙酰-l-半胱氨酸、半胱氨酸和巯基乙酸组成的组。在另一些优选的实施方式中,在步骤(1)中,所述胆固醇的羟基与所述丁二酸酐的摩尔用量比为(1:10)~(1:1),例如1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2或1:1。在另一些优选的实施方式中,在步骤(2)中,壳聚糖上的氨基与mpeg的羟基的摩尔比为(1:20)~(20:1),例如1:19、1:18、1:17、1:16、1:15、1:14、1:13、1:12或1:11、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、19:1:18:1、17:1、16:1、15:1、14:1、13:1、12:1、11:1、10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1或2:1。在另一些优选的实施方式中,在步骤(3)中,mpeg接枝壳聚糖上的氨基与丁二酸单胆固醇酯的羧基的摩尔比为(1:20)~(20:1)(例如1:19、1:18、1:17、1:16、1:15、1:14、1:13、1:12或1:11、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、19:1:18:1、17:1、16:1、15:1、14:1、13:1、12:1、11:1、10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1或2:1),丁二酸单胆固醇酯的用量与edc和nhs之和的用量的摩尔比为(1:10)~(10:1),edc与nhs的用量摩尔比为(1:10)~(10:1)。在另一些优选的实施方式中,在步骤(4)中,胆固醇修饰的mpeg接枝壳聚糖上的氨基与巯基化试剂的羧基的摩尔比为(1:20)~(20:1),巯基化试剂的用量与edc和nhs之和的用量摩尔比为(1:10)~(10:1)(例如1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1或9:1)。edc与nhs的用量摩尔比可以为(1:10)~(10:1)(例如1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1或9:1)。在一些优选的实施方式中,步骤(1)中的第一反应溶剂选自由吡啶、二甲基甲酰胺(dmf)和二甲基亚砜(dmso)组成的组中的一种或多种。在另外一些优选的实施方式中,步骤(2)中的第二反应溶剂和步骤(3)中的第三反应溶剂独立地选自由水、二甲基甲酰胺和二甲基亚砜组成的组中的一种或多种。在另外一些优选的实施方式中,步骤(4)中的第四反应溶剂选自由二甲基甲酰胺和二甲基亚砜组成的组中的一种或多种。在一些更具体的实施方式中,所述方法包括如下步骤:(1)丁二酸单胆固醇酯的合成:胆固醇和丁二酸酐溶于反应溶剂中,以吡啶为催化剂,在25~65℃条件下搅拌24~96h,反应产物经重结晶、干燥处理后,得丁二酸单胆固醇酯;(2)mpeg接枝壳聚糖的合成:将含壳聚糖、mpeg和冰醋酸溶于反应溶剂中,在10~50℃条件下搅拌10~120min后,再加入甲醛水溶液,在10~50℃条件下搅拌1~5h,收集产物,产物经过透析纯化、冷冻干燥,得到mpeg接枝壳聚糖;(3)胆固醇修饰的mpeg接枝壳聚糖的合成:将丁二酸单胆固醇酯溶于反应溶剂中,以edc和nhs为活化剂,在20~60℃条件下活化1~24h;再加入mpeg接枝壳聚糖,在20~60℃条件下搅拌24~96h,收集产物;产物经过透析纯化、冷冻干燥,得到胆固醇修饰的mpeg接枝壳聚糖;(4)巯基化胆固醇修饰的mpeg接枝壳聚糖的合成:将巯基化试剂溶于反应溶剂中,以edc和nhs为活化剂,在20~60℃、氮气保护的条件下活化1~24h;再加入胆固醇修饰的mpeg接枝壳聚糖,在20~60℃、氮气保护的条件下搅拌24~96h,收集产物;产物经过透析纯化、冷冻干燥,得到巯基化胆固醇修饰的mpeg接枝壳聚糖,即得所述的壳聚糖止血海绵材料。本发明在第三方面提供了一种止血海绵,所述止血海绵由本发明第一方面所述的接枝壳聚糖或本发明第二方面所述的方法制得的接枝壳聚糖制成。由接枝壳聚糖制备止血海绵的方法没有特别的限制,可以例如接枝壳聚糖分散在水中制成均匀混悬液,然后加入氯化钙进行交联再进行冷冻干燥。所述止血海绵具有强的吸水性、强的黏膜粘附性和促进伤口愈合和修复等功能特点。本发明第四方面提供了本发明第一方面所述的接枝壳聚糖或由本发明第二方面所述的方法制得的接枝壳聚糖在制备止血海绵中的应用。实施例下文将通过实施例对本发明进行进一步的说明,但是本发明请求保护的范围不限制于这些实施例。实施例1(1)丁二酸单胆固醇酯(cho-cooh)的合成;将0.6g胆固醇(cho)和0.5g丁二酸酐(摩尔比1:3.23)溶于4ml吡啶中,水浴45℃搅拌72h;将反应混合物倒入10ml的冰盐酸中,析出沉淀;将沉淀于8ml乙酸乙酯和无水乙醇的混合溶剂(v/v=1:1)中重结晶;25℃下烘干,得到cho-cooh。(2)mpeg接枝壳聚糖(mpeg–cs)的制备将0.2g水溶性壳聚糖(cs,dd值为95%,分子量为5000da)溶于10ml的去离子水,再加入20ml的dmso稀释至30ml,加入4ml的乙酸于室温下充分搅拌。另外将0.6g的mpeg(分子量为350da)溶于10ml的dmso中(cs的氨基与mpeg的羟基的摩尔比是1:1.45),将两份溶液充分混合,室温下搅拌15min;而后加入30ml的甲醛,反应1h后,将反应液于去离子水中透析(截留分子量30000da)24h;冻干,制得mpeg-cs。(3)胆固醇修饰的mpeg接枝壳聚糖(mpeg-cs-cho)的合成;将30mgcho-cooh、20mgedc和10mgnhs(edc与nhs的用量摩尔比为1.20:1)溶解(丁二酸单胆固醇酯的用量与edc和nhs之和的用量摩尔比为1:3.08)于1ml的dmf(二甲基甲酰胺)中,45℃下搅拌活化2h;另外取150mg的mpeg-cs溶解于21ml的去离子水和dmf的混合溶剂(v/v=2:19)中,再加至经活化的cho-cooh的混合溶液(mpeg接枝壳聚糖的氨基与丁二酸单胆固醇酯的羧基的摩尔比为9.93:1)中,45℃下搅拌反应72h;将所得混合液于蒸馏水中透析24h,冷冻干燥,制得mpeg-cs-cho。(4)巯基化胆固醇修饰的mpeg接枝壳聚糖(mpeg-cs(sh)-cho)的合成;将10mgnac(n-乙酰半胱氨酸)、20mgedc(碳化二亚胺)和10mgnhs(n-羟基琥珀酰亚胺)溶解于1ml的dmf中,45℃、在氮气保护的条件下搅拌活化2h;另外取174mg的mpeg-cs-cho溶解于20ml的dmf中(edc与nhs的用量摩尔比为1.20:1,n-乙酰半胱氨酸的用量与edc和nhs之和的用量摩尔比为1:2.74),再加至经活化的nac的混合溶液(胆固醇修饰的mpeg接枝壳聚糖的氨基与巯基化试剂的羧基的摩尔比为8.28:1)中,45℃、在氮气保护的条件下搅拌反应72h;将所得混合液于蒸馏水中透析24h,冷冻干燥,得mpeg-cs(sh)-cho。实施例2采用与实施例基本相同的方式进行,不同之处在于,步骤(2)中的溶剂由体积比为1:1的去离子水和dmso混合溶剂替换去离子水,并且将步骤(3)和(4)中的溶剂由dmf替换为dmso。实施例3采用与实施例基本相同的方式进行,不同之处在于,步骤(1)的溶剂由吡啶替换为体积比为1:1的二甲基甲酰胺(dmf)和二甲基亚砜(dmso)的混合溶剂,步骤(2)和步骤(3)的溶剂分别由dmso和dmf替换为去离子水。实施例4采用与实施例1基本相同的方式进行,不同之处在于,巯基化试剂替换为半胱氨酸。实施例5采用与实施例1基本相同的方式进行,不同之处在于,巯基化试剂替换为巯基乙酸。实施例6采用与实施例1基本相同的方式进行,不同之处在于,所述cs的平均分子量为30000da,并且所述mpeg的分子量为1900da。实施例7采用与实施例1基本相同的方式进行,不同之处在于,所述cs的平均分子量为15000da,并且所述mpeg的分子量为20000da。实施例8采用与实施例1基本相同的方式进行,不同之处在于,没有进行所述步骤(1)和步骤(3),在步骤(2)中制备mpeg–cs之后,用之代替mpeg-cs-cho制备mpeg-cs(sh)作为最终产物用于制备止血海绵。实施例9采用与实施例1基本相同的方式进行,不同之处在于,不进行步骤(4),直接采用步骤(3)制得的mpeg-cs-cho作为最终产物制备止血含棉。实施例10采用与实施例1基本相同的方式进行,不同之处在于,不进行步骤(2),直接采用壳聚糖与步骤(1)制得的cho-cooh反应得到cs-cho,用之代替mpeg-cs-cho制备cs(sh)-cho作为最终产物用于制备止血海绵。实施例11采用与实施例1基本相同的方式进行,不同之处在于,在制得丁二酸单胆固醇酯和mpeg接枝壳聚糖之后,先利用巯基化试剂对mpeg接枝壳聚糖进行修饰,得到巯基化mpeg接枝壳聚糖,再利用巯基化的mpeg接枝壳聚糖和丁二酸单胆固醇酯合成巯基化胆固醇修饰的mpeg接枝壳聚糖。壳聚糖止血海绵的制备将各实施例中所制得的最终产物混悬于水中,制成500mg/ml的溶液,加入30mg/ml氯化钙交联2h后,冻干即得壳聚糖止血海绵。吸水性测试将所制备壳聚糖止血海绵在生理盐水中浸泡8分钟,立即测定其吸水倍数(吸水量相对于止血海绵的自身重量的倍数)(n=5)。另外,由于所制备壳聚糖止血海绵表面具有peg结构,其亲水性更强;为了检测其快速吸水能力,还测试其在5s时的吸水倍数(吸水量相对于止血海绵的自身重量的倍数)(n=5)。搭接剪切测试将所制备的壳聚糖止血海绵进行搭接剪切测试:采用10×30mm规格的新鲜猪皮作为粘结基体,将壳聚糖止血海绵制成5×15×5mm的规格放置在制备好的猪皮上,将质量浓度为3%的过氧化氢水溶液涂覆在另一块制备好的猪皮上,将两块猪皮重叠在一起。将样品在37℃的恒温箱中温育60min,然后进行搭接剪切测试,测试速度为5mm/min。结果表明,两块猪皮在36h后能很好地粘合在一起,用以表征测试样品的粘结强度的最大搭接剪切强度参见下表(n=5)。家兔耳动脉止血实验将上述制得的壳聚糖止血海绵进行家兔耳动脉止血实验:将壳聚糖止血海绵制成20×20×5mm的规格备用。准备家兔,将其麻醉,剃去兔耳动脉上的毛,取右耳,在距耳尖8cm处割断耳动脉,擦去浮血,用壳聚糖止血海绵轻轻按压并用医用胶带固定,开始计时其止血时间(n=5)。表1.各实施例制得产物做成的止血海绵的吸水量测试结果由表1的结果可以看出,8分钟内,利用实施例1至7产物制得的止血海绵可以吸收接近其自身质量的50倍水量;5s时可以吸收其自身质量的10倍以上水分,显著高于利用实施例10产物制得的止血海绵。表2.各实施例制得产物做成的止血海绵的搭接剪切测试和家兔耳动脉止血实验结果实施例粘附强度(kpa)完全止血所需时间(s)实施例179103实施例278108实施例380106实施例479107实施例581104实施例679105实施例779104实施例877183实施例953136实施例1076126实施例1158131由表2可以看出,利用实施例1至7产物制得的止血海绵的粘附强度显著高于实施例9和11产物制得的止血海绵的粘附强度。利用实施例1至7产物制得的止血海绵的止血时间比实施例8至11产物制得的止血海绵的止血时间缩短近半分钟。在此有必要指出的是,以上实施例和试验例仅限于对本发明的技术方案做进一步的阐述和理解,不能理解为对本发明的技术方案做进一步的限定,本领域技术人员作出的非突出实质性特征和显著进步的发明创造,仍然属于本发明的保护范畴。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1