一株生产虾青素的重组酿酒酵母及其应用的制作方法
1.本发明属于基因工程领域,涉及一株生产虾青素的重组酿酒酵母及其应用。
背景技术:
2.虾青素是类胡萝卜素合成过程中的终级产物,在类胡萝卜素中抗氧化能力最强,被誉为“超级维生素e”。虾青素在藻类和海洋生物中以酯化的形式存在,在细菌和酵母中以游离形式存在。虾青素独特的化学结构,使其可以穿越细胞膜,穿过血脑屏障,因此相对其他类胡萝卜素具有更好的抗脂质氧化能力。由于虾青素能够有效的清除细胞内外的自由基,减少细胞损伤和衰老,因此在对心血管疾病、糖尿病和癌症等疾病方面具有较好的预防和治疗作用。
3.目前,虾青素的来源主要有化学合成和生物合成。化学合成虾青素过程复杂,过程中残留较多中间体,缺乏安全性,且合成的虾青素为三种构型的混合物,(3r,3’r)、(3s,3’s)、(3r,3’s)为1:1:2,抗氧化能力差,因此化学合成的虾青素目前只被批准用于水产养殖。生物合成虾青素的天然微生物包括雨生红球藻和红发夫酵母。红发夫酵母生产(3r,3’r)构型的虾青素,其抗氧化能力相对较低,目前主要用于饲料行业,用于改善动物的肉质和颜色,提高动物的免疫力。目前唯一被批准人类食用的是雨生红球藻生产的虾青素,其虾青素含量达到15-30mg/g dcw,在总类胡萝卜素中占99%以上,且雨生红球藻中的虾青素以(3s,3’s)形式存在,生物学活性很高。但是雨生红球藻的培养需要适宜的气候、长时间的光照以及大量的水资源,培养周期较长,导致生产成本较高。因此研究人员将目光转向了遗传背景清楚、基因操作工具丰富的大肠杆菌和酿酒酵母等微生物。虽然采用了大量的代谢工程手段和诱变技术,但是虾青素的产量仍然较低,离工业化生产仍然有不小的距离。因此,平衡虾青素在异源宿主内代谢路径的代谢通量和优化培养条件对提高虾青素生产尤为重要。
技术实现要素:
4.本发明所要解决的技术问题是提高酿酒酵母中虾青素的产量和纯度。
5.为解决上述技术问题,本发明提供一株重组酿酒酵母,其组成型表达β-胡萝卜素酮化酶基因crtw,诱导型表达β-胡萝卜素羟化酶基因crtz,将中间产物β-胡萝卜素合成为虾青素,所述β-胡萝卜素酮化酶基因crtw和β-胡萝卜素羟化酶基因crtz的拷贝数之比为3:1-3:2;
6.该重组酿酒酵母为生产虾青素的工程菌株,为平衡酿酒酵母中虾青素路径碳源的流动,提高虾青素产量和纯度,得到工程菌株;所述平衡酿酒酵母中虾青素路径碳源的流动,提高虾青素产量和纯度,为通过调整β-胡萝卜素酮化酶基因crtw和β-胡萝卜素羟化酶基因crtz的相对拷贝数,然后在不同类型启动子调控下,发酵过程中优选加入诱导剂来诱导crtz基因表达的时间和发酵的温度而实现的。
7.在一些实施方案中,上述重组酿酒酵母中,所述β-胡萝卜素酮化酶基因crtw和β-胡萝卜素羟化酶基因crtz的拷贝数之比为3:2。
crtw-tef2t-gal1-crtz-adh1t-gal10-crtz-tpi1t中的一种或多种,优选为prs426-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-gal10-crtz-tpi1t。
21.为解决上述技术问题,本发明还提供一种构建上述任一所述的重组酿酒酵母的方法,包括将上述任一所述的重组表达载体转入出发酿酒酵母中获得重组酿酒酵母的步骤;
22.所述出发酿酒酵母为能合成β-胡萝卜素的酿酒酵母,优选为scy10026酿酒酵母。
23.为解决上述技术问题,本发明还提供一种生产虾青素的方法,包括将上述任一所述的重组酿酒酵母进行发酵培养,使得β-胡萝卜素酮化酶基因crtw组成型表达并且在发酵培养过程中添加d-(+)-半乳糖诱导β-胡萝卜素羟化酶基因crtz表达以合成虾青素的步骤。
24.在一些实施方案中,上述生产虾青素的方法中,所述发酵培养包括将上述任一所述的重组酿酒酵母在发酵培养基中进行发酵培养,在发酵的第30-54小时加入终浓度2%的d-(+)-半乳糖,优选为在发酵的第36小时加入终浓度2%的d-(+)-半乳糖;
25.发酵培养基为4%葡萄糖的ypd培养基(组成为10g/l酵母膏,20g/l蛋白胨,40g/l葡萄糖,余量为水);
26.发酵温度为20℃-30℃,优选20℃;
27.初始od
600
可以为0.1,转速可以为250rpm。
28.在一些实施方案中,上述生产虾青素的方法中,在发酵培养之前,还具有将上述任一所述的重组酿酒酵母进行一级种子培养和二级种子培养的步骤;
29.所述一级种子培养包括将上述任一所述的重组酿酒酵母接入装有sc-ura液体培养基的摇瓶中,在例如30℃、250rpm的条件下培养过夜;
30.所述二级种子培养包括将一级种子培养得到的一级种子转接至装有sc-ura液体培养基的摇瓶中,在例如30℃、250rpm的条件下培养至od
600
=5-6的步骤。
31.所述一级种子的接种量为1%-2%。
32.为解决上述技术问题,本发明还提供上述任一所述的重组酿酒酵母和/或上述任一所述的重组表达载体在生产虾青素中的应用。
33.一种生产高纯度虾青素酿酒酵母工程菌株的构建:
34.本发明的有益效果是:虾青素代谢路径涉及众多基因的调控(如图1所示),特别是其中的crtw和crtz,本发明通过调整crtw和crtz之间的相对拷贝数来平衡酿酒酵母中虾青素路径的碳源流动,并且将crtw和crtz基因置于不同类型启动子的调控下,使得crtw基因组成型表达,crtz基因诱导型表达,构建了重组酿酒酵母,同时进一步优化了重组酿酒酵母的发酵条件。本发明提高了虾青素的产量和纯度,摇瓶水平的虾青素生产可高达14.70mg/g dcw,虾青素纯度达到了96.69%,具有良好的工业应用前景。
附图说明
35.图1为酿酒酵母中虾青素合成路径示意图。
36.图2为实施例1构建的不同拷贝crtw和crtz组合片段示意图。
具体实施方式
37.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
38.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
39.以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
40.酿酒酵母s228c(saccharomyces cerevisiae s228c)在文献“fisk et al.saccharomyces cerevisiae s288c genome annotation:a working hypothesis.yeast.2006;23(12):857
–
865”中公开过,公众可从万华化学集团股份有限公司获得。
41.prs426为武汉淼灵生物科技有限公司产品,货号为p0459。
42.d-(+)-半乳糖为阿拉丁产品,货号为g100367。
43.实施例中的crtz基因为橙黄农杆菌(agrobacterium aurantiacum)来源的crtz,crtw基因为泡囊短波单胞菌(brevundimonas vesicularis dc263)来源的crtw。
44.实施例1:以产β-胡萝卜素酿酒酵母为底盘菌株构建产高纯度虾青素的工程菌株
45.一、构建crtw和crtz的基因表达片段
46.(一)以启动子tdh3p(seq id no:1)、基因crtw(seq id no:2)、终止子tdh2t(seq id no:3)为模板,采用oe-pcr的方法构建tdh3p-crtw-tdh2t片段,tdh3p-crtw-tdh2t片段的序列如seq id no:10所示。
47.oe-pcr体系(50μl反应体系)如下:
48.启动子tdh3p、基因crtw和终止子tdh2t模板各1μl、上游引物各1μl、下游引物各1μl、10
×
buffer 5μl、dntp 4μl,pfu dna polymerase 1μl,加入ddh2o补足体积至50μl。
49.所用引物如下:
50.primer 1-f:5
’-
cagttcgagtttatcattatcaatactgcca-3’(seq id no:4);
51.primer 1-r:5
’-
tcattggagtaacagcggacattttgtttgtttatgtgtgtttattcg-3’(seq id no:5);
52.primer 2-f:5
’-
cgaataaacacacataaacaaacaaaatgtccgctgttactccaatg-3’(seq id no:6);
53.primer 2-r:5
’-
aagtaacttaaggagttaaatttatgaaaataaagaccaccaagg-3’(seq id no:7);
54.primer 3-f:5
’-
tggtggtctttattttcataaatttaactccttaagttactttaatg-3’(seq id no:8);
55.primer 3-r:5
’-
gcgaaaagccaattagtgtgatac-3’(seq id no:9)。
56.(二)以启动子fba1p(seq id no:11)、基因crtw、终止子tef2t(seq id no:12)为模板,采用oe-pcr的方法构建fba1p-crtw-tef2t片段,fba1p-crtw-tef2t片段的序列如seq id no:19所示。
57.oe-pcr体系(50μl反应体系)如下:
58.启动子fba1p、基因crtw和终止子tef2t模板各1μl、上游引物各1μl、下游引物各1μl、10
×
buffer 5μl、dntp 4μl,pfu dna polymerase 1μl,加入ddh2o补足体积至50μl。
59.所用引物如下:
60.primer 4-f:5
’-
tccaactggcaccgctggcttgaacaaca-3’(seq id no:13);
61.primer 4-r:5
’-
tggagtaacagcggacattttgaatatgtattacttggtt-3’(seq id no:
14);
62.primer 5-f:5
’-
aaccaagtaatacatattcaaaatgtccgctgttact-3’(seq id no:15);
63.primer 5-r:5
’-
ggaagcaataattattactctttatgaaaataaagacc-3’(seq id no:16);
64.primer 6-f:5
’-
ctttattttcataaagagtaataattattgcttccatataa-3’(seq id no:17);
65.primer 6-r:5
’-
acgctgacatggtttctttaggtt-3’(seq id no:18)。
66.(三)以启动子hxt7p(seq id no:20)、基因crtw、终止子cyc1t(seq id no:21)为模板,采用oe-pcr的方法构建hxt7p-crtw-cyc1t片段,hxt7p-crtw-cyc1t片段的序列如seq id no:28所示。
67.oe-pcr体系(50μl反应体系)如下:
68.启动子hxt7p、基因crtw和终止子cyc1t模板各1μl、上游引物各1μl、下游引物各1μl、10
×
buffer 5μl、dntp 4μl,pfu dna polymerase 1μl,加入ddh2o补足体积至50μl。
69.所用引物如下:
70.primer 7-f:5
’-
tctagtttctgccttaaacaaagccgc-3’(seq id no:22);
71.primer 7-r:5
’-
tggagtaacagcggacatttttttgattaaaattaaaaaaa-3’(seq id no:23);
72.primer 8-f:5
’-
tttttaattttaatcaaaaaaatgtccgctgttactccaatgagtaga-3’(seq id no:24);
73.primer 8-r:5
’-
aaggaaaaggggcctgttttatgaaaataaagacca-3’(seq id no:25);
74.primer 9-f:5
’-
gtggtctttattttcataaaacaggccccttttcc-3’(seq id no:26);
75.primer 9-r:5
’-
agagtgtaaactgcgaagcttgcaaattaa-3’(seq id no:27)。
76.(四)以启动子gal1(seq id no:29)、基因crtz(seq id no:30)、终止子adh1t(seq id no:31)为模板,采用oe-pcr的方法构建gal1-crtz-adh1t片段,gal1-crtz-adh1t片段的序列如seq id no:38所示。
77.oe-pcr体系(50μl反应体系)如下:
78.启动子gal1、基因crtz和终止子adh1t模板各1μl、上游引物各1μl、下游引物各1μl、10
×
buffer 5μl、dntp 4μl,pfu dna polymerase 1μl,加入ddh2o补足体积至50μl。
79.所用引物如下:
80.primer 10-f:5
’-
tatagttttttctccttgacgttaaagtatagaggtatattaacaa-3’(seq id no:32);
81.primer 10-r:5
’-
caagaagttagtcatttatattgaattttcaaaaattcttact-3’(seq id no:33);
82.primer 11-f:5
’-
aagaatttttgaaaattcaatataaatgactaacttcttgatcgttg-3’(seq id no:34);
83.primer 11-r:5
’-
cgaagaagtccaaagctttaagttctttcttgag-3’(seq id no:35);
84.primer 12-f:5
’-
caagaaagaacttaaagctttggacttcttcgccagag-3’(seq id no:36);
85.primer 12-r:5
’-
catgccggtagaggtgtggtcaataag-3’(seq id no:37)。
tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-salι,bamhι-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-salι的序列如seq id no:57所示。
108.primer 19-f:5
’-
ggatcccagttcgagtttatcattatc-3’(seq id no:55);
109.primer 19-r:5
’-
gtcgaccatgccggtagag-3’(seq id no:56)。
110.用salι和bamhι双酶切bamhι-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-salι片段,得到基因片段;用salι和bamhι双酶切prs426质粒,得到载体片段;将该基因片段和该载体片段连接,获得prs426-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t重组质粒,序列如seq id no:58所示。
111.(二)以tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t、hxt7p-crtw-cyc1t为模板,采用oe-pcr的方法,组装crtw基因和crtz基因拷贝数之比为3:1的hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t片段,序列如seq id no:63所示。
112.oe-pcr体系(50μl反应体系)如下:
113.tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t、hxt7p-crtw-cyc1t模板各1μl、上游引物各1μl、下游引物各1μl、10
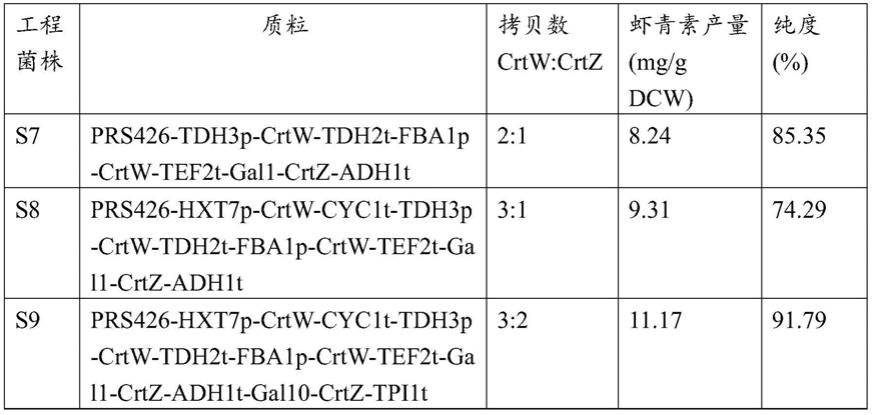
×
buffer 5μl、dntp 4μl,pfu dna polymerase1μl,加入ddh2o补足体积至50μl。
114.所用引物如下:
115.primer 20-f:5
’-
tctagtttctgccttaaacaaagccgcag-3’(seq id no:59);
116.primer 20-r:5
’-
ataatgataaactcgaactgagagtgtaaactgc-3’(seq id no:60);
117.primer 21-f:5
’-
cagtttacactctcagttcgagtttatcattatcaatac-3’(seq id no:61);
118.primer 21-r:5
’-
catgccggtagaggtgtggtcaataagag-3’(seq id no:62)。
119.以hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t片段为模板,以两边带有salι和bamhι酶切位点的primer 22-f和primer 22-r为引物进行pcr扩增,获得bamhι-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-salι,序列如seq id no:66所示。
120.primer 22-f:5
’-
ggatcctctagtttctgccttaaacaaagccgc-3’(seq id no:64);
121.primer 22-r:5
’-
gtcgaccatgccggtagaggtgtggtcaataag-3’(seq id no:65)。
122.salι和bamhι双酶切bamhι-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-salι片段,得到基因片段;salι和bamhι双酶切prs426质粒,得到载体片段;将该基因片段和载体片段连接,获得prs426-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t重组质粒,序列如seq id no:67所示。
123.(三)
124.以hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t、gal10-crtz-tpi1t为模板,经过oe-pcr组装获得crtw基因和crtz基因拷贝数为3:2的bamhι-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-gal10-crtz-tpi1t-salι片段,序列如seq id no:72所示。
125.oe-pcr体系(50μl反应体系)如下:
126.hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t、
gal10-crtz-tpi1t模板各1μl、上游引物各1μl、下游引物各1μl、10
×
buffer 5μl、dntp 4μl,pfu dna polymerase 1μl,加入ddh2o补足体积至50μl。
127.所用引物如下:
128.primer 23-f:5
’-
ggatcctctagtttctgccttaaacaaagcc-3’(seq id no:68);
129.primer 23-r:5
’-
tgaaaattcaatataacatgccggtagaggtgtggtc-3’(seq id no:69);
130.primer 24-f:5
’-
cctctaccggcatgttatattgaattttcaaaaattcttac-3’(seq id no:70);
131.primer 24-r:5
’-
gtcgacttaaatgcttttcttctttttattagaaaaagcgc-3’(seq id no:71)。
132.salι和bamhι双酶切bamhι-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-gal10-crtz-tpi1t-salι,得到基因片段;salι和bamhι双酶切prs426质粒,得到载体片段;将该基因片段和载体片段连接,获得prs426-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-gal10-crtz-tpi1t重组质粒,序列如seq id no:73所示。
133.将以上获得的重组质粒导入大肠杆菌,经转化子筛选和基因测序,确认重组质粒序列正确。
134.不同拷贝crtw和crtz组合片段示意图如图2所示。
135.(四)将重组质粒prs426-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t、prs426-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t、prs426-hxt7p-crtw-cyc1t-tdh3p-crtw-tdh2t-fba1p-crtw-tef2t-gal1-crtz-adh1t-gal10-crtz-tpi1t运用醋酸锂转化法分别转化生产β-胡萝卜素的scy10026酿酒酵母(saccharomyces cerevisiae),获得生产虾青素的酿酒酵母工程菌株s7、s8、s9。
136.上述scy10026酿酒酵母的构建方法如下:将cyc1t-btcrti-hxt7p-tdh3p-pacrtb-adh1t片段(seq id no:74)转入酿酒酵母s288c,同源重组并替换掉gal1、gal7、gal10基因,整合到染色体上;再将cyc1t-pacrty-hxt7p-fba1p-tmcrte-tdh2t片段(seq id no:75)转入其中,同源重组并替换掉ypl062w基因,整合到染色体上,获得生产β-胡萝卜素的酵母scy10026。
137.cyc1t-btcrti-hxt7p-tdh3p-pacrtb-adh1t(seq id no:74)中:
138.第1-40位为gal 7基因下游同源序列,第41-241位为终止子cyc1t序列,第242-1990位为基因btcrti序列,第1991-2691位为启动子hxt7p序列,第2692-3371位为启动子tdh3p序列,第3372-4301位为基因pacrtb序列,第4302-4629位为终止子adh1t序列,第4630-4669位为gal1基因下游同源序列。
139.cyc1t-pacrty-hxt7p-fba1p-tmcrte-tdh2t(seq id no:75)中:
140.第1-40位为ypl062w基因上游同源序列,第41-241位为终止子cyc1t序列,第242-1390位为pacrty基因序列,第1391-2091位为启动子hxt7p序列,第2092-2911位为启动子fba1p序列,第2912-4093位为基因tmcrte序列,第4094-4493位为终止子tdh2t序列,第4494-4533位为ypl062w基因下游同源序列。
141.实施例2:摇瓶发酵生产虾青素
142.将实施例1中构建的生产虾青素的酿酒酵母工程菌株s7、s8、s9分别接种到5ml sc-ura液体培养基中,于30℃、250rpm过夜培养得到一级种子,随后按1-2%(v/v)的接种量将一级种子接种到新鲜的5ml sc-ura液体培养基中,于30℃、250rpm进行二级种子培养至od
600
=5-6,得到二级种子。转接二级种子接种到装有50ml含4%葡萄糖的ypd培养基(10g/l酵母膏、20g/l蛋白胨、40g/l葡萄糖,余量为水)的250ml摇瓶中发酵培养,初始od
600
=0.1,温度30℃,转速250rpm发酵42小时加入终浓度2%(2g/100ml)的d-(+)-半乳糖诱导虾青素生成,发酵84小时结束,得到发酵液。
143.然后,取适量发酵液,并对其中的酵母工程菌株进行破壁处理,再用丙酮提取虾青素,然后上样进行虾青素hplc高效液相色谱检测。
144.虾青素hplc高效液相色谱检测条件如下:
145.采用双波长检测,测定波长设为450/470nm,积分波长470nm;
146.柱温:25℃;
147.流动相:流速为1ml/min,流动相b:乙腈:水=9:1(体积比),流动相c:甲醇:异丙醇=3:2(体积比),洗脱条件为:0-15min,0-90%c;15-30min,90%c;30-35min,90-0%c;35-45min,0%c。外标法计算虾青素浓度。
148.按照下式计算虾青素纯度:
149.w=ca/c*100%
150.w为纯度,ca为虾青素浓度(mg/l),c为类胡萝卜素浓度(mg/l);
151.其中类胡萝卜素浓度同样采用hplc外标法检测得到,hplc检测条件与上述虾青素hplc高效液相色谱检测条件一致。
152.经检测,不同酿酒酵母工程菌株合成虾青素的产量和纯度如表1所示。
153.表1不同酿酒酵母工程菌株合成虾青素的产量和纯度
[0154][0155]
表1显示,经过调整crtw与crtz之间的相对拷贝数,虾青素的产量和纯度均出现了显著变化,当crtw:crtz拷贝数之比为3:2时,虾青素产量达到了11.17mg/g dcw,纯度达到了91.79%。
[0156]
实施例3:摇瓶发酵过程中不同的诱导剂加入时间对虾青素产量和纯度的影响
[0157]
将生产虾青素的工程菌株s9按照实施例2中的种子培养方法培养获得二级种子,然后将其接入五组装有50ml含4%葡萄糖的ypd培养基的250ml摇瓶(每组设置两个平行)
y1、y2、y3、y4、y5中进行发酵培养,初始od
600
=0.1,温度30℃,转速250rpm,分别在发酵的第30h、36h、42h、48h、54h加入终浓度2%的d-(+)-半乳糖诱导虾青素生成,发酵84小时结束,得到发酵液。然后,取适量发酵液,并对其中的酵母工程菌株进行破壁处理,再用丙酮提取虾青素,然后上样进行虾青素hplc高效液相色谱检测(检测条件与实施例2中的相同),各组的虾青素产量和纯度如表2所示。
[0158]
表2发酵过程中不同的诱导剂加入时间下的虾青素产量和纯度
[0159][0160]
表2显示,诱导剂的加入时机能够较大地影响虾青素的产量和纯度,在发酵的第36小时加入终浓度2%的d-(+)-半乳糖,虾青素的产量和纯度均达到最高,分别为12.84mg/g dcw和93.33%。
[0161]
实施例4:不同发酵温度对虾青素产量和纯度的影响
[0162]
将生产虾青素的工程菌株s9按照实施例2中的种子培养方法培养获得二级种子,然后将其接入三组装有50ml含4%葡萄糖的ypd培养基的250ml摇瓶(每组设置两个平行)t1、t2、t3中进行发酵培养,初始od
600
=0.1,转速250rpm,其中t1发酵温度设置为20℃,t2发酵温度设置为25℃,t3发酵温度设置为30℃,三组摇瓶均在发酵的第36小时添加终浓度2%的d-(+)-半乳糖诱导虾青素生成,发酵84小时结束,得到发酵液。同样地,取适量发酵液,并对其中的酵母工程菌株进行破壁处理,再用丙酮提取虾青素,然后上样进行虾青素hplc高效液相色谱检测(检测条件与实施例2中的相同),各组的虾青素产量和纯度如表3所示。
[0163]
表3发酵过程中不同温度下的虾青素产量和纯度
[0164][0165][0166]
表3表明,当发酵温度设置为20℃,最有利于虾青素的生产,虾青素的产量和纯度分别达到14.70mg/g dcw和96.69%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1