一种容受甲基化半乳糖的琼胶酶及其应用的制作方法
本发明涉及生物技术领域,尤其涉及一种容受甲基化半乳糖的琼胶酶及其应用。
背景技术:
琼胶是从海洋红藻细胞壁中提取的多糖,是一种重要的海洋多糖。琼脂糖是琼胶的主要组分,具有优良的凝胶特性,广泛地应用于食品及食品相关工业、化妆品、药品等行业。琼脂糖由(1-3)-o-β-d-吡喃半乳糖残基(g残基)及(1-4)-o-3,6-内醚-α-l-吡喃半乳糖残基(la残基)交替组成。多项研究表明,琼脂糖的结构具有高度异质性,其结构中的g残基往往被甲基化修饰,且修饰程度高达20%。
琼脂糖在室温下不易溶解,生物利用率低。由琼脂糖降解得到的低分子琼脂糖以及寡糖具有水溶性好、粘度低、生物利用率高的特点,并且具有抗菌、保湿皮肤、黑色素瘤细胞增白、抗肥胖、抗糖尿病等多种生物活性,是潜在的功能食品因子,在食品、医药行业中展现出良好的应用前景。
糖苷水解酶能特异性的切割琼脂糖主链中的糖苷键并且不改变其天然结构中的取代基。与常用的酸解相比,采用酶降解琼脂糖不仅反应条件温和,绿色环保,能耗低,并且具有酶的高效性与底物专一性的特点,可有效的克服酸解存在的条件难控制、产物不均一、产物分析和回收难等问题。琼胶酶是一类可特异性降解琼胶中的琼脂糖组分,生成琼脂寡糖的水解酶,根据酶切位点不同,琼胶酶可被分为α-琼胶酶和β-琼胶酶,分别切割α-1,3糖苷键和β-1,4糖苷键。
糖苷水解酶的高度特异性以及多糖结构的异质性,意味着多糖的完全转化需要特异性不同的水解酶。目前已被表征的传统的琼胶酶特异性强,只能降解经典的琼胶结构片段,即(la-g)n,而无法降解含有甲基的多糖片段。因此,这些琼胶酶无法完全降解含甲基的天然琼脂糖。寻找能够容受甲基化半乳糖的琼胶酶对于提高琼脂糖的生物利用率与转化率至关重要。在目前的研究报道中,仅有一个来自pseudomonasatlantica的野生型琼胶酶能水解甲基化的琼脂糖,但野生酶需要在琼脂糖的诱导下才可产生,且其制备成本高、纯化难度大,且产酶总量低、活力低,难以用于工业的大规模生产应用中。分子克隆可以依据基因实现酶的高效表达及大量获取,是解决以上问题的理想策略。实现产酶序列的克隆表达可为酶法降解琼脂糖提供工具,为低分子量琼脂糖及寡糖的大规模生产应用提供前提。
技术实现要素:
本发明要解决的技术问题为野生型容受甲基化半乳糖的琼胶酶产量低、活力低、纯化难度大,产酶菌株需在琼脂糖底物的诱导下才可产酶,致使酶的制备成本高、缺少完全转化琼脂糖的关键工具酶。
为解决上述问题,本发明从wenyingzhuangiafucanilyticacz1127t菌株中发掘得到一条基因,其原始核苷酸编码735个氨基酸,其氨基酸序列如seqidno.1所示,利用expasy软件预测其理论分子量为79.73kda。根据序列比对发现此酶与目前报道的同家族的琼胶酶的相似性最高仅为47%,所以此酶为一种序列新颖的酶。以此为基础提供一种容受甲基化半乳糖的琼胶酶的基因及其应用,从而突破该类酶的高效获取及实际应用、琼脂糖的完全转化、低分子量琼脂糖及寡糖规模化制备的关键瓶颈。
为达到上述目的,本发明提供一种容受甲基化半乳糖的琼胶酶,其氨基酸序列为seqidno.1以及经过取代、缺失或添加一个或多个氨基酸且具有1中酶活性的,由1所衍生的酶。
seqidno.1:
mrvksvykklsvsfilvmlsasqevnsqakvsvnlnvkhvvggisefdrtkyitihanqienewdgdnftsdlrdhflngfdvylgrdtggitwnlnnmqedasrpgfanpsniiskgintrnnyaskthlhvyenrksnhvvaaqlhpfwtgesqiatkgtgwelasptatgeymgryfnefyggngepvpswievinepayealggkknftnslqeiadfhvevadairvqnpnlkiggytaafpdfetgdfqrwinrdklfidvagekmdfwswhlydfpviggkedirsgsnveatfdmhdhysmlklghkkpyviseygaqthdfrnegwssyrdwlfvraqnslmmsfmerpediamaipftivkaewgfntdknlpyparlmrkanepesytgewvytdrvkfydlwknvkgtridtkstdldiqvdayvdgnkgylilnnleseeteitldvfekydssitnilkrhltlssnnvvieeetfsssistvqlgagstmileytfansltidetsteekyyadsylqpivasqpilfavnnvvksatygeavlrlglgrdhgkslkpivkvnntevvvpddwrgydqadkgrffgtieipvsydllttnntvsvefpdssghvssvimqvfnfssdirtlsvndvtasdtktllispnpvkdgmlnmtipaklknpiasiynvsgsllikqsmkhsqtsipvnlfdkgvyllvlqdgskkigeskfviq
该酶与其他已知酶的序列相似度最高仅为47%(与来源于saccharophagusdegradans2-40产aga86c相似度最高),为一种序列新颖的酶。利用mega6将该酶与cazy数据库中的gh86家族已性质研究的序列构建系统发育树,结果如图6所示:可以看出该酶处于gh86家族琼胶酶的系统发育树中。因此,本发明中的琼胶酶是gh86家族的一个新成员。
一种编码上述容受甲基化半乳糖的琼胶酶的基因,其核苷酸序列为seqidno.2及可翻译出seqidno.1的所有基因。
seqidno.2:
atgagggttaaatctgtatataaaaaacttagtgtgagttttattttagtaatgctatctgcttctcaagaggtaaatagtcaagctaaagtttctgttaatttaaatgtaaaacacgttgttggtgggatatctgaatttgatagaacaaagtatatcacaattcatgcaaatcaaattgaaaatgagtgggatggtgataattttacatcagatttaagagatcattttttaaatggctttgatgtatatttaggaagagatacaggagggattacttggaatttaaataatatgcaagaagatgcttctagacctggttttgcaaatccttctaacataatatcaaaaggtataaacactagaaataattatgcttctaaaacgcatttacatgtatatgaaaatagaaaaagcaatcatgtagtcgcagcacaattacatccgttttggacaggtgaaagtcaaatagctactaaaggtacaggttgggaattggcaagtccaactgcaactggagaatatatgggacgttattttaatgaattttatggaggtaatggagagcctgtacctagttggatagaagtaattaatgaaccagcatatgaagctcttggaggaaagaaaaattttacaaactcactacaagagatagcagattttcatgtagaggtagcagatgctattagagtacaaaatccaaatttaaaaataggaggatacacagcagcatttccagattttgaaacgggtgattttcaaagatggataaatagagataaattatttatagatgttgcgggtgaaaaaatggatttttggtcttggcatttgtatgattttcctgtaataggaggaaaagaagatatacgatcggggagtaacgtagaggcaacttttgatatgcatgatcattatagtatgttaaagttgggacataaaaaaccttatgtaatttcagaatatggggctcaaacacacgattttagaaatgaaggttggtcttcttacagagattggttgtttgtaagggctcaaaactcattaatgatgtcttttatggaaagaccagaagatatagctatggcaattccatttacaattgtaaaagcagaatggggttttaatacagataaaaatttaccttatccggctagattaatgcgtaaggctaatgagccagaaagttatacaggagaatgggtgtacacagatagagttaagttttacgatttatggaaaaacgtaaaaggaactagaattgacacaaaatctacggatttagacatacaggtagatgcgtatgttgatggaaacaaaggatatttaattttaaataatttagaatctgaggagactgaaattactttagatgtttttgaaaaatatgatagcagtattacaaatattttaaaaagacatttaacactttctagtaataacgttgtaatagaagaggagactttttcatcttcaatttctacagtccaattaggagctggatctacaatgattttggagtatacctttgcaaattcccttaccattgatgagacttctaccgaagaaaaatattatgcagacagttatttacagcctatagttgcttctcaacctattttgtttgcagttaataatgtagttaaatcggctacatatggagaggctgtgttgaggttaggactaggtagagatcatggtaagtctttaaaaccaattgtaaaagtaaataatacagaagtggttgtaccagatgattggagaggttacgatcaggcagataaagggaggttttttgggactatagaaataccagtctcgtatgatttgttaactacaaacaataccgtttctgttgaattcccagactctagcggacatgtaagtagtgtaattatgcaagtatttaattttagttcagatattagaacattgtctgtgaatgatgttactgcatcagatacaaaaacgctattgatttctccaaacccagtaaaagatggaatgttaaatatgactataccagcaaaattaaaaaatccaatagcttctatttataatgtttcaggtagtttgttaataaaacaatcaatgaaacatagtcaaactagtattcctgtaaacttatttgacaaaggagtttatttattggttctacaagatggaagtaaaaaaataggagaatctaaatttgtaatacaataa
本发明提供了一种上述容受甲基化半乳糖的琼胶酶的制备方法,将酶异源表达在大肠杆菌、枯草芽孢杆菌、毕赤酵母等体系中,通过诱导产酶即可大量制备容受甲基化半乳糖的琼胶酶。上述的容受甲基化半乳糖的琼胶酶成功异源表达在了大肠杆菌、枯草芽孢杆菌、毕赤酵母等体系中可用于大量生产、制备目标酶,且在毕赤酵母表达体系中的表达活力最高,可有效地应用于化学分析、食品工业等领域。
本发明的有益效果在于:
(1)本发明的琼胶酶基因可以通过克隆表达的方式实现容受甲基化半乳糖的琼胶酶的高效制备;
(2)本发明的琼胶酶能够以内切方式降解琼胶,该酶对于甲基化的琼胶结构片段以及经典的琼胶结构片段均具有高效的催化能力;在控制加酶量或反应时间的条件下,短时间内即可迅速降解琼胶生成分子量为6kda-900kda的不同分子量琼胶及寡糖。
附图说明
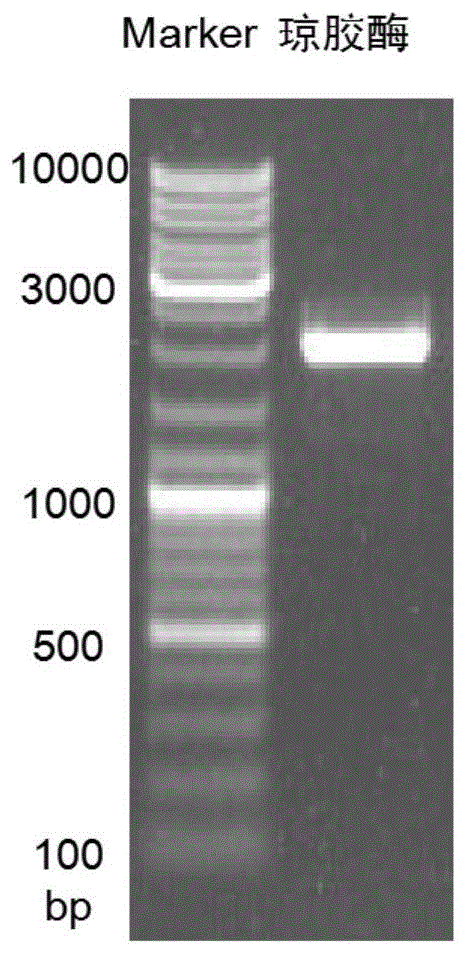
图1:本发明的琼胶酶目的基因pcr扩增后的核酸电泳图谱;
图2:本发明的琼胶酶的最适反应条件示意图;
图3:本发明的琼胶酶的降解终产物提取离子流色谱图;
图4:本发明的琼胶酶在控制加酶量产生不同分子量的琼脂糖示意图;
图5:本发明的琼胶酶在控制反应时间的条件下产生不同分子量的琼脂糖示意图;
图6:本发明的琼胶酶的系统发育分析图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明的实施例,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:琼胶酶在大肠杆菌中的异源表达
在2216e培养基中培养wenyingzhuangiafucanilyticacz1127t直至对数末期并提取全基因组dna,根据目的基因设计上下游引物,以全基因组为模板进行pcr,pcr反应条件为:95℃3min,95℃20s,42℃22s,72℃60s,22个循环,最后72℃持续5min,得到了琼胶酶的基因片段。bamhi和xhoi双酶切目的基因与pet28a(+)载体,连接构成重组质粒。将重组质粒导入bl21(de3)感受态细胞中构成重组菌株。在含卡那霉素的lb培养基中利用异丙基硫代半乳糖苷进行诱导表达,诱导温度为17℃,诱导时间为12h。离心收集菌体,加入一定量的20mm磷酸氢二钠-磷酸二氢钠(na2hpo4-nah2po4)缓冲液悬浮,然后在冰水浴中进行超声破碎(功率400w,工作2s,间隙6s,循环99次),离心收集上清,此即为琼胶酶的粗酶液。
实施例2:琼胶酶在枯草芽孢杆菌中的异源表达
在2216e培养基中培养wenyingzhuangiafucanilyticacz1127t直至对数末期并提取全基因组dna,根据目的基因设计上下游引物,以全基因组为模板如实施例1进行pcr,得到琼胶酶基因片段,bamhi和saci双酶切目的基因与pht01质粒,连接构成重组质粒。将重组质粒转化入枯草芽孢杆菌感受态细胞中,筛选阳性克隆并利用异丙基硫代半乳糖苷在lb培养液中进行诱导表达,诱导温度为37℃,诱导时间为12h。离心收集菌体,加入一定量的20mmna2hpo4-nah2po4缓冲液悬浮,然后在冰水浴中进行超声破碎(功率400w,工作2s,间隙6s,循环99次),离心收集上清,此即为琼胶酶的粗酶液。
实施例3:琼胶酶在毕赤酵母中的异源表达
在2216e培养基中培养wenyingzhuangiafucanilyticacz1127t直至对数末期并提取全基因组dna,根据目的基因设计上下游引物,以全基因组为模板如实施例1进行pcr,得到琼胶酶基因片段,利用ecori和bamhi双酶切目的基因与ppic9k质粒,连接构成重组质粒,经saci酶切后,直接加入到毕赤酵母gs115感受态细胞中构成重组细胞。离心后用10mmph8.0n,n-二羟乙基甘氨酸重新悬浮菌体;将菌液涂布到含有氨苄青霉素的ypd平板,30℃倒置培养3-4天,将在抗性平板上生长的含有重组质粒的阳性克隆子接种于ypd培养基中,30℃培养20h,然后接种于发酵基本培养基中,加入0.3%甲醇诱导,发酵150h后,离心收集上清,此即为琼胶酶的粗酶液。
实施例4:琼胶酶在多种表达体系中的活力比较
将实施例1-实施例3中75μl适当稀释的酶液分别与75μl2mg/ml琼胶溶液(含0.2mnacl)混合30℃反应10min后,100℃灭活5min。同样使用75μl适当稀释的灭活酶液与琼胶溶液混合于相同条件下反应,作为对照。使用还原糖增量法phbh法检测实验组和对照组体系中的还原糖,计算琼胶酶的酶活。1u活力定义为1min内生成1μmol还原糖的活力。利用phbh法检测1ml发酵液在不同表达体系下的活力如下表所示:
从以上结果可以看出,本发明中的琼胶酶可成功表达在大肠杆菌、枯草芽孢杆菌、毕赤酵母等异源体系中,且在毕赤酵母中的表达活力最高。毕赤酵母表达体系可实现重组酶的胞外表达,且外源蛋白含量低,简化了后续重组酶的分离纯化操作,有助于其应用于保健品、食品及药物的开发与生产。
实施例5:琼胶酶的生化性质
使用实施例1中大肠杆菌获得的重组酶液,进行生化性质的探究。
1)温度对酶活的影响
最适反应温度:将适量酶液与琼胶底物溶液混合,混匀后置于15℃-50℃温度下反应10min,于100℃金属浴中放置5min以灭酶,phbh法测定酶活力。
温度稳定性:将纯化后的酶液于4℃、25℃、30℃、40℃分别放置24h,间隔时间取样并检测酶活力,将放置0h的酶的活力定义为100%,分析琼胶酶在不同放置温度下的温度稳定性。结果表明,该酶在30℃展现出最高的酶活力,在4℃~30℃具有较好的稳定性。
2)ph对酶活的影响
缓冲体系:ph4.0-6.5:20mm柠檬酸-磷酸氢二钠缓冲液;ph6.5-9.0:20mmpbs缓冲液;ph9.0-11.0:20mm碳酸钠-碳酸氢钠缓冲液。
最适反应ph:以上述不同ph值的缓冲液配制琼胶底物,使底物浓度为2mg/ml。使用上述不同ph值的缓冲液置换酶液原来的缓冲环境,并将相应的ph的底物与酶液混匀,于30℃反应10min,100℃金属浴5min灭酶,phbh法测定酶活力。
ph稳定性:使用上述不同ph值的缓冲液置换酶液原来的缓冲环境,并将酶液置于4℃下1h。然后将酶液的ph值调至ph6.5,按照酶活测定条件测定酶活。将未经任何处理的酶液酶活定义为100%,分析琼胶酶在不同放置ph条件下的ph稳定性。结果表明,该酶在ph6.5时具有最高的酶活力,在ph4.0-11.0的范围内活力保持稳定。
3)金属离子及有机试剂对酶活的影响
将酶解反应中添加有机试剂和金属离子(1mm),然后计算相对残余酶活,结果详见下表。二价离子如mg2+、cd2+、ca2+都可促进琼胶酶的活力,sds、mn2+、hg2+都会抑制酶的活力,zn2+显著抑制酶活,k+、edta对酶的活力无明显影响。
实施例6:lc-ms分析琼胶酶降解终产物
使用实施例1中大肠杆菌获得的重组酶液,加入至100mg2mg/ml琼胶底物(ph6.5水溶液溶解,含0.1mnacl)中,并添加ph6.5的水溶液将反应体系补足至100ml,于30℃反应24h,100℃金属浴5min以灭酶,得到降解终产物,以0.22μm水系微孔滤膜过滤,待用。利用thermoscientificq-exactiveorbitrap质谱仪进行产物的lc-ms分析。如图3所示,质谱分析结果表明,降解产物主要由典型的新琼寡糖(二糖、四糖、六糖)以及不同甲基化程度的琼脂寡糖(二糖、四糖、六糖)。这表示该酶对于甲基化的琼胶结构片段以及经典的琼胶结构片段均具有高效的催化能力,这对于琼胶的完全转化具有重要意义。
实施例7:通过控制加酶量可制备不同分子量的琼脂糖
将向琼脂糖溶液中加入实施例1大肠杆菌体系所获得的重组酶,按照1g底物(0.5mg/ml)对应于1u、2u、4u、6u、8u、10u重组酶的比例进行反应。30℃反应1h后分别取500μl灭活。利用高效体积排阻色谱-示差折光检测器-多角激光光散射仪联用(hpsec-malls法)监测琼脂糖的分子量,流动相为ph7.4、含10mmpbs的0.15mnacl,流速为0.5ml/min。分子量检测结果如图4所示,随着加酶量的增大,在1h内即可获得6kda-900kda的不同分子量琼脂糖及寡糖。
实施例8:通过控制反应时间可制备不同分子量的琼脂糖
向琼脂糖溶液中加入实施例1大肠杆菌体系所获得的重组酶,按照1g底物(0.5mg/ml)对应于6u重组酶的比例进行反应。30℃反应10min、20min、30min、40min、50min、60min后分别取500μl灭活。利用hpsec-malls法监测琼脂糖的分子量,流动相条件同实施例7。分子量检测结果如图5所示,随着加酶量的增大,在1h内即可获得30kda-900kda的不同分子量琼脂糖及寡糖。
综合实施例7-8,通过控制加酶量、反应时间,可制备出6kda-900kda的不同分子量琼脂糖及寡糖。不同分子量的琼脂糖为琼脂糖构效关系研究奠定了基础。
最后需要说明,以上实施例虽然描述了本发明的具体实施方式,但是并非限制本发明;本领域的技术人员应当理解,这些仅是举例说明,本发明的保护范围是由所附权利要求书所限定的。而一切进行修改或等同替换,其均应包含在本发明的保护范围内。
序列表
<110>中国海洋大学
<120>一种容受甲基化半乳糖的琼胶酶及其应用
<130>中国海洋大学
<140>1
<141>2020-06-16
<160>2
<170>siposequencelisting1.0
<210>1
<211>735
<212>prt
<213>wenyingzhuangiafucanilyticacz1127t
<400>1
metargvallysservaltyrlyslysleuservalserpheileleu
151015
valmetleuseralaserglngluvalasnserglnalalysvalser
202530
valasnleuasnvallyshisvalvalglyglyileserglupheasp
354045
argthrlystyrilethrilehisalaasnglnilegluasnglutrp
505560
aspglyaspasnphethrseraspleuargasphispheleuasngly
65707580
pheaspvaltyrleuglyargaspthrglyglyilethrtrpasnleu
859095
asnasnmetglngluaspalaserargproglyphealaasnproser
100105110
asnileileserlysglyileasnthrargasnasntyralaserlys
115120125
thrhisleuhisvaltyrgluasnarglysserasnhisvalvalala
130135140
alaglnleuhisprophetrpthrglygluserglnilealathrlys
145150155160
glythrglytrpgluleualaserprothralathrglyglutyrmet
165170175
glyargtyrpheasngluphetyrglyglyasnglygluprovalpro
180185190
sertrpilegluvalileasngluproalatyrglualaleuglygly
195200205
lyslysasnphethrasnserleuglngluilealaaspphehisval
210215220
gluvalalaaspalaileargvalglnasnproasnleulysilegly
225230235240
glytyrthralaalapheproaspphegluthrglyasppheglnarg
245250255
trpileasnargasplysleupheileaspvalalaglyglulysmet
260265270
aspphetrpsertrphisleutyrasppheprovalileglyglylys
275280285
gluaspileargserglyserasnvalglualathrpheaspmethis
290295300
asphistyrsermetleulysleuglyhislyslysprotyrvalile
305310315320
serglutyrglyalaglnthrhisasppheargasngluglytrpser
325330335
sertyrargasptrpleuphevalargalaglnasnserleumetmet
340345350
serphemetgluargprogluaspilealametalaileprophethr
355360365
ilevallysalaglutrpglypheasnthrasplysasnleuprotyr
370375380
proalaargleumetarglysalaasngluproglusertyrthrgly
385390395400
glutrpvaltyrthraspargvallysphetyraspleutrplysasn
405410415
vallysglythrargileaspthrlysserthraspleuaspilegln
420425430
valaspalatyrvalaspglyasnlysglytyrleuileleuasnasn
435440445
leugluserglugluthrgluilethrleuaspvalpheglulystyr
450455460
aspserserilethrasnileleulysarghisleuthrleuserser
465470475480
asnasnvalvalilegluglugluthrpheserserserileserthr
485490495
valglnleuglyalaglyserthrmetileleuglutyrthrpheala
500505510
asnserleuthrileaspgluthrserthrgluglulystyrtyrala
515520525
aspsertyrleuglnproilevalalaserglnproileleupheala
530535540
valasnasnvalvallysseralathrtyrglyglualavalleuarg
545550555560
leuglyleuglyargasphisglylysserleulysproilevallys
565570575
valasnasnthrgluvalvalvalproaspasptrpargglytyrasp
580585590
glnalaasplysglyargphepheglythrilegluileprovalser
595600605
tyraspleuleuthrthrasnasnthrvalservalglupheproasp
610615620
serserglyhisvalserservalilemetglnvalpheasnpheser
625630635640
seraspileargthrleuservalasnaspvalthralaseraspthr
645650655
lysthrleuleuileserproasnprovallysaspglymetleuasn
660665670
metthrileproalalysleulysasnproilealaseriletyrasn
675680685
valserglyserleuleuilelysglnsermetlyshisserglnthr
690695700
serileprovalasnleupheasplysglyvaltyrleuleuvalleu
705710715720
glnaspglyserlyslysileglygluserlysphevalilegln
725730735
<210>2
<211>2208
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgagggttaaatctgtatataaaaaacttagtgtgagttttattttagtaatgctatct60
gcttctcaagaggtaaatagtcaagctaaagtttctgttaatttaaatgtaaaacacgtt120
gttggtgggatatctgaatttgatagaacaaagtatatcacaattcatgcaaatcaaatt180
gaaaatgagtgggatggtgataattttacatcagatttaagagatcattttttaaatggc240
tttgatgtatatttaggaagagatacaggagggattacttggaatttaaataatatgcaa300
gaagatgcttctagacctggttttgcaaatccttctaacataatatcaaaaggtataaac360
actagaaataattatgcttctaaaacgcatttacatgtatatgaaaatagaaaaagcaat420
catgtagtcgcagcacaattacatccgttttggacaggtgaaagtcaaatagctactaaa480
ggtacaggttgggaattggcaagtccaactgcaactggagaatatatgggacgttatttt540
aatgaattttatggaggtaatggagagcctgtacctagttggatagaagtaattaatgaa600
ccagcatatgaagctcttggaggaaagaaaaattttacaaactcactacaagagatagca660
gattttcatgtagaggtagcagatgctattagagtacaaaatccaaatttaaaaatagga720
ggatacacagcagcatttccagattttgaaacgggtgattttcaaagatggataaataga780
gataaattatttatagatgttgcgggtgaaaaaatggatttttggtcttggcatttgtat840
gattttcctgtaataggaggaaaagaagatatacgatcggggagtaacgtagaggcaact900
tttgatatgcatgatcattatagtatgttaaagttgggacataaaaaaccttatgtaatt960
tcagaatatggggctcaaacacacgattttagaaatgaaggttggtcttcttacagagat1020
tggttgtttgtaagggctcaaaactcattaatgatgtcttttatggaaagaccagaagat1080
atagctatggcaattccatttacaattgtaaaagcagaatggggttttaatacagataaa1140
aatttaccttatccggctagattaatgcgtaaggctaatgagccagaaagttatacagga1200
gaatgggtgtacacagatagagttaagttttacgatttatggaaaaacgtaaaaggaact1260
agaattgacacaaaatctacggatttagacatacaggtagatgcgtatgttgatggaaac1320
aaaggatatttaattttaaataatttagaatctgaggagactgaaattactttagatgtt1380
tttgaaaaatatgatagcagtattacaaatattttaaaaagacatttaacactttctagt1440
aataacgttgtaatagaagaggagactttttcatcttcaatttctacagtccaattagga1500
gctggatctacaatgattttggagtatacctttgcaaattcccttaccattgatgagact1560
tctaccgaagaaaaatattatgcagacagttatttacagcctatagttgcttctcaacct1620
attttgtttgcagttaataatgtagttaaatcggctacatatggagaggctgtgttgagg1680
ttaggactaggtagagatcatggtaagtctttaaaaccaattgtaaaagtaaataataca1740
gaagtggttgtaccagatgattggagaggttacgatcaggcagataaagggaggtttttt1800
gggactatagaaataccagtctcgtatgatttgttaactacaaacaataccgtttctgtt1860
gaattcccagactctagcggacatgtaagtagtgtaattatgcaagtatttaattttagt1920
tcagatattagaacattgtctgtgaatgatgttactgcatcagatacaaaaacgctattg1980
atttctccaaacccagtaaaagatggaatgttaaatatgactataccagcaaaattaaaa2040
aatccaatagcttctatttataatgtttcaggtagtttgttaataaaacaatcaatgaaa2100
catagtcaaactagtattcctgtaaacttatttgacaaaggagtttatttattggttcta2160
caagatggaagtaaaaaaataggagaatctaaatttgtaatacaataa2208
- 还没有人留言评论。精彩留言会获得点赞!