一种马铃薯黑胫病抗性的鉴定方法与流程
本发明涉及一种马铃薯病原菌抗性的鉴定方法,尤其涉及一种马铃薯黑胫病抗性的鉴定方法。
背景技术:
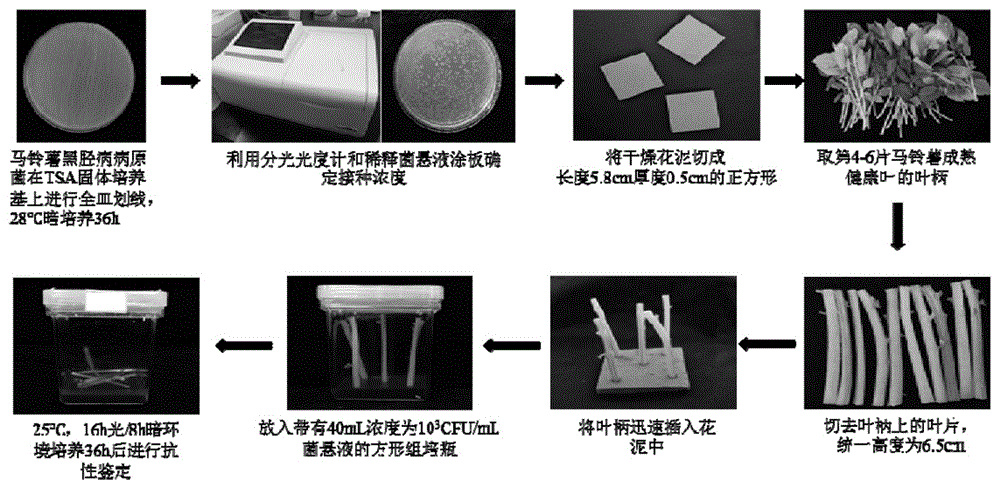
:马铃薯黑胫病由果胶杆菌(pectobacteriumspp.和dickeyaspp.)引起的发生在马铃薯植株茎基部及块茎上的严重病害,该病害主要侵染维管束组织,从种薯发芽到生长后期均可发病,以苗期最盛。黑胫病菌可通过灌溉、雨水传播,也可通过昆虫为害造成的伤口侵染,还可以通过农业操作造成的机械伤口侵染,侵染后植株上产生典型的黑胫病症状。后期病株上的病菌在土壤传染薯快,使薯块带菌。在贮藏期间,病菌通过接触健康数块伤口而传染,并能在发病的块茎里存活。同时病菌在种薯块茎或收获过程中遗留在田间未完全腐烂的病薯上越冬,成为翌年的初侵染来源。所以,马铃薯黑胫病是世界马铃薯种植中的重要病害,近些年在我国发生越来越严重,威胁着马铃薯产业的健康发展。由于马铃薯中对抵抗黑胫病没有主效的抗病基因,只有一些可能的qtl(quantitativetraitlocus)发挥作用,所以,马铃薯田间一旦发黑胫病,很难得到控制,因此目前生产上对该病害的防治以预防为主。如此,马铃薯黑胫病早期的诊断,以及选育和种植马铃薯抗性品种或者材料有着紧迫的需求。而马铃薯抗性品种或者材料的筛选离不开马铃薯黑胫病的鉴定。所以,目前亟需一种能够快速稳定鉴定马铃薯黑胫病抗性的方法,以鉴别马铃薯感染黑胫病的程度,分析马铃薯对黑胫病的抗性,有利于马铃薯黑胫病的防治和马铃薯抗黑胫病的育种。目前进行马铃薯黑胫病抗性筛选最为常见的方式是利用活体植株为材料,对其马铃薯主茎进行病原菌菌悬液的注射。然而,这种方法存在以下问题:一是细菌会使整株实验材料的死亡导致实验成本高,二是试验材料种植占地面积大导致土地资源浪费,三是在抗病鉴定过程中会出现肉眼难以观察的腐烂症状从而出现定性定级分析不准确。为解决以上问题,研究者们相继创造了马铃薯离体组织或器官接种黑胫病的方法,其中就有叶片接种,该方法是通过在马铃薯叶片打孔并滴入病原菌菌悬液。该方法保护马铃薯植株不被破坏,不会造成资源浪费和成本提高。但是该方法有以下缺点:叶片保水能力较差导致叶片过早失水死亡,无法定性判断病害侵入;细菌悬浮液容易从叶片滑落导致接种失败;由于黑胫病在马铃薯维管束组织体现最为准确,此方法有时会与田间试验结果不一致。综上所述,由于目前常用的鉴定马铃薯黑胫病的方法不稳定,可能会导致筛选出的材料抗性结果不一致,因此遗漏了带有一些非主效qtl的育种材料,错过了某些依靠提高植物自身免疫来提供抗性的候选材料;也可能不能为马铃薯黑胫病的防治提供进一步准确的预判。技术实现要素:有鉴于此,本发明确有必要提供一种马铃薯黑胫病抗性的鉴定方法,以解决上述问题。本发明提供的技术方案为:一种马铃薯黑胫病抗性的鉴定方法,包括:准备悬浮液提供一种浓度为103cfu/ml的马铃薯黑胫病病原菌悬浮液;筛选待测叶柄选择有10片完全展开的叶片的马铃薯植株,选取所述马铃薯植株第4-6片成熟健康叶的叶柄作为待测叶柄,该待测叶柄的长度为l0;接种观察将所述马铃薯黑胫病病原菌悬浮液倒入组培瓶中;将待测叶柄插入干燥花泥中,并置于盛有所述马铃薯黑胫病病原菌悬浮液的所述组培瓶中,盖上瓶盖后放入24-26℃、16h光/8h暗的光照培养箱进行培养观察;抗性鉴定利用灯箱和白炽灯观察并记录所述待测叶柄的软化水渍化症状,测量所述待测叶柄的水渍化病变长度,以所述待测叶柄接种培养36h后的病变长度作为叶柄最终病变长度l病,按照分级标准进行病害分级并计算病情指数;依据所述病情指数对马铃薯黑胫病抗性进行评价鉴定:病情指数≤0.2属于抗性,0.2<病情指数≤0.4属于中抗,0.4<病情指数≤0.6属于感病,0.8<病情指数属于易感;其中,病情指数的计算公式如下:所述病害分级标准如下:0≤病变长度l病<0.08l0,病害等级设置为0级;0.08l0≤病变长度l病<0.15l0,病害等级设置为1级;0.15l0≤病变长度l病<0.3l0,病害等级设置为2级;0.3l0≤病变长度l病<0.6l0,病害等级设置为3级;0.6l0≤病变长度l病<l0,病害等级设置为4级。基于上述,所述筛选待测叶柄的步骤包括:选择定植后生长5-6周的马铃薯植株,或者选自采用块茎种植且出芽后生长3-4周的马铃薯植株,所述马铃薯植株有10片完全展开的叶片,取第4-6片成熟健康叶的叶柄,并切去叶柄周围多余的叶片,并将叶柄切至统一长度l0作为所述待测叶柄。基于上述,所述待测叶柄的长度l0为-6.5cm。基于上述,所述接种培养的步骤包括:将所述马铃薯黑胫病病原菌悬浮液置于所述组培瓶中;先将具有相同遗传背景的待测材料的若干株所述待测叶柄插入干燥花泥中,再置于盛有所述马铃薯黑胫病病原菌悬浮液的所述组培瓶中,盖上所述组培瓶的瓶盖;将盖上所述瓶盖的组培瓶放入25℃,16h光/8h暗的光照培养箱进行培养观察。基于上述,置于同一组培瓶中的待测叶柄有3-6株。基于上述,所述抗性鉴定的步骤包括:每间隔相同时间,利用光源照射所述光照培养箱中的组培瓶,用肉眼观察叶柄软化水渍化症状,用尺子测量叶柄水渍化病变长度并拍照记录,以所述待测叶柄接种培养36h的病变长度作为最终病变长度l病,按照所述病害分级标准进行分级并计算所述病情指数,依据所述病情指数对马铃薯黑胫病抗性进行评价鉴定。基于上述,所述待测叶柄的长度l0为6.5cm,所述病害分级标准为:0≤病变长度l病<0.5cm,病害等级设置为0级;0.5cm≤病变长度l病<1cm,病害等级设置为1级;1cm≤病变长度l病<2cm,病害等级设置为2级;2cm≤病变长度l病<4cm,病害等级设置为3级;4cm≤病变长度l病<6.5cm,病害等级设置为4级。基于上述,所述准备悬浮液的步骤包括:将马铃薯黑胫病病原菌在tsa平板培养基上进行全皿划线培养,并稀释获得od600值所对应的浓度为103cfu/ml的所述马铃薯黑胫病病原菌悬浮液。在相同条件下,使用本发明提供的马铃薯黑胫病抗性的鉴定方法,与现有的田间主茎注射的方法相比,使用本发明接病后的发病情况与同样材料田间主茎注射的发病情况基本一致;采用本发明提供的鉴定方法仅需要2天左右,鉴定周期短;本发明提供的鉴定方法采用离体接种培养,而且病情分为5级,可以避免因田间主茎注射材料在抗病鉴定过程中会出现肉眼难以观察的腐烂症状或者发病不稳定的情况从而出现无法定性定级,最终造成分析结果不准确,鉴定材料结果不清晰;另外,本发明采用离体培养,不用在田间试验,避免黑胫病病原菌污染田间土壤,造成环境污染。进一步,经多次试验发现,当采用103cfu/ml的马铃薯黑胫病菌悬浮液接种侵染马铃薯叶柄36h时,叶柄病变长度结果稳定并可重复,浓度过低会导致叶柄病变时间推后且误差值较大,浓度过高会导致叶柄病变时间太快错失一些低抗性的材料。因此,本发明提供的马铃薯黑胫病抗性的鉴定方法具有方法操作简单,试验成本低,分级准确,鉴定周期短,结果可靠,可为马铃薯黑胫病抗性育种和马铃薯黑胫病防治提供技术支持。附图说明图1本发明实施例提供的马铃薯黑胫病抗性的鉴定方法操作流程图。图2是本发明实施例采用的不同稀释倍数菌悬液涂板培养。图3是本发明实施例采用不同稀释倍数的马铃薯黑胫病病原菌悬浮液侵染马铃薯叶柄不同时间的病变叶柄长度的曲线图。图4是本发明实施例采用不同马铃薯叶柄与马铃薯黑胫病病原菌悬浮液侵染时间之间的病变叶柄长度的柱状图。图5是本发明实施例提供的马铃薯叶柄接种36h后的黑胫病抗性评级示意图。具体实施方式下面通过具体实施方式,对本发明的技术方案做进一步的详细描述。请参阅图1,本发明实施例提供一种马铃薯黑胫病抗性的鉴定方法,包括:步骤一、准备悬浮液该步骤主要包括确定马铃薯黑胫病病原菌的浓度和制备马铃薯黑胫病病原菌悬浮液。(1)确定马铃薯黑胫病病原菌(该菌株由河南农业大学植物保护学院提供)的浓度a.将由-80℃超低温冰箱中取出的马铃薯黑胫病病原菌(来源于胡萝卜软腐果胶杆菌马铃薯亚种的病原菌)按1:500接种于1ml灭过菌的30g/ltsb液体培养基中,28℃下振荡培养3.5h;先用移液枪配合灭菌过的枪头吸取50μl菌悬液到灭菌过的tsa培养基平皿上,其中所述tsa培养基由tsb培养基30g/l和琼脂粉17g/l组成,再用一次性无菌涂棒均匀涂布,28℃培养箱暗培养12-16小时后,挑取单菌落在灭菌过的90mmtsa培养基平皿上培养皿划线,28℃培养箱暗培养36h;b.配制用于稀释病原菌的mes缓冲溶液100ml,用koh调ph至5.8,121℃灭菌20min,其中,所述mes缓冲溶液由ms4.3g/l+mes2.13g/l组成;c.请一并参阅图2,用所述mes缓冲溶液对培养36h后的病原菌平板进行梯度稀释,直至将培养36h后的病原菌平板稀释成10-9的菌悬液;并且对浓度较高的10-1、10-2、10-3的菌悬液测定od600值(能准确测出od值的浓度梯度),得出如表1所示的不同od600值所对应的菌液浓度,对浓度较低的最后几个梯度的菌悬液进行涂板后暗培养16h计数菌落数;d.用移液枪配合经高温高压灭菌后的枪头分别从10-7、10-8、10-9的菌液中吸取50μl(加入数量过少会导致稀释倍数较低的涂板结果不准确)菌悬液分别加入1/10所述tsa培养基平皿中,用一次性无菌三角涂布棒将菌悬液均匀涂布于培养皿中,直至干燥,并在皿盖做好相应标注,暗培养12h计数菌落数,每个浓度重复三次;e.根据平皿中过夜培养长出的菌落数来估算菌悬液的浓度如表1所示。表1不同稀释浓度涂板后的平皿菌落数或od600数值稀释浓度菌落数/皿菌浓度/皿od60010-9≈1102cfu/ml-10-8≈6103cfu/ml-10-7≈200104cfu/ml-10-6>1800105cfu/ml-10-5-106cfu/ml-10-4-107cfu/ml≈0.0410-3-108cfu/ml≈0.2310-2-109cfu/ml≈0.8910-1-1010cfu/ml≈2.56其中,将过夜培养后的平皿,取稀释浓度10-7之后的50μl菌悬液进行涂板过夜培养,计数培养皿上的菌落得到菌落数约200个,推算出过夜培养12h后的原始菌浓度为1010cfu/ml;取稀释浓度10-8之后的50μl菌悬液进行涂板过夜培养,计数培养皿上的菌落得到菌落数约6个,也推算出过夜培养的原始菌浓度为1010cfu/ml;同理,取稀释浓度10-9之后的50μl菌悬液进行涂板过夜培养,计数培养皿上的菌落得到菌落数1个,推算出过夜培养的原始菌浓度为1010cfu/ml;综上所述,病原菌平皿28℃过夜培养12h后,当原始菌悬液稀释浓度10-2后测定的od值约为0.89,稀释浓度10-3后测定的od值约为0.89时,原始菌悬液浓度为1010cfu/ml。(2)制备马铃薯黑胫病病原菌悬浮液将马铃薯黑胫病病原菌在tsa固体培养基上进行全皿划线,28℃暗培养36h。移液枪配合经121℃灭菌15min后的枪头吸取mes缓冲溶液9ml滴入马铃薯黑胫病病原菌培养36h后的tsa固体培养基全皿中,用一次性无菌三角涂布棒来回不停滚动直至刮下所有菌体,使用分光光度计测定此时菌液的od600值,得出相对应的浓度,用mes缓冲溶液进行梯度稀释直至达到试验所需浓度。其中,本实施例中,采用上述方法获得od600值分别为10cfu/ml、102cfu/ml、103cfu/ml、104cfu/ml和105cfu/ml的马铃薯黑胫病病原菌悬浮液。步骤二、筛选待测叶柄选择块茎种植且出芽后生长4周的、有10片完全展开的叶片的马铃薯苗,每棵植株取第4-6片成熟健康叶的叶柄作为试验材料,切去叶柄周围多余的叶片,并将叶柄切至统一长度约6.5cm。本实施例中的试验材料来源于表2所示的14个不同马铃薯材料#1-#14,并于2019年2月至2019年5月采用块茎种植法种植在河南农业大学科教园区,按当地主栽方式进行播种和田间管理。步骤三、接种培养在60mm*60mm*90mm的方形组培瓶里倒入40ml所述的马铃薯黑胫病病原菌悬浮液,将预处理好的相同材料(遗传背景相同)的马铃薯材料的5株叶柄迅速插入长度5.8cm厚度0.5cm的正方形干燥花泥中,盖上组培盖,将瓶子放入25℃,16h光/8h暗的光照培养箱进行培养观察,空白对照组的组培瓶中所使用的为40ml的mes溶液。在本发明提供的马铃薯黑胫病抗性鉴定方法中,马铃薯黑胫病病原菌悬浮液的浓度和待测叶柄被侵染时间(即马铃薯黑胫病病原菌悬浮液的接种培养时间)与本发明提供的鉴定方法的可靠性有重要影响。下面进一步说明浓度与接种时间对鉴定方法的影响。(1)马铃薯黑胫病病原菌悬浮液的浓度试验分析浓度的影响主要通过5组比对试验表现。具体地,以从感病材料#1上获得的待测叶柄作为试验材料,分别采用浓度为10cfu/ml、102cfu/ml、103cfu/ml、104cfu/ml和105cfu/ml的马铃薯黑胫病病原菌悬浮液重复“步骤三、接种培养”,其中,每组试验的接种培养时间为72h,每2h测量记录待测叶柄的病变长度。根据测量的待测叶柄的病变长度进行统计分析,绘制如图3所示的不同稀释倍数的马铃薯黑胫病病原菌悬浮液侵染马铃薯叶柄不同时间的病变叶柄长度的曲线图。从图3中可以看出:当马铃薯黑胫病病原菌悬浮液的浓度为103cfu/ml时,同一组培瓶中的5株马铃薯叶柄的病变长度误差较小,具有稳定性和可重新性。当马铃薯黑胫病病原菌悬浮液的浓度比较高,如104cfu/ml和105cfu/ml时,马铃薯叶柄的发病时间比较快,会错失一些低抗性的材料。当当马铃薯黑胫病病原菌悬浮液的浓度比较高,如10cfu/ml、102cfu/ml时,叶柄发病时间推后且误差值较大,叶柄病发长度的稳定性和可重新性较差。因此,采用浓度为103cfu/ml的马铃薯黑胫病病原菌悬浮液侵染马铃薯叶柄的试验数据的一致性和稳定性最好。(2)待测叶柄的侵染时间试验分析浓度的影响主要通过5组比对试验表现。具体地,分别以表2所示马铃薯材料#1-#5上获得的待测叶柄作为试验材料,将该5种来源的待测叶柄分别置于浓度为103cfu/ml的马铃薯黑胫病病原菌悬浮液中接种培养48h。其中,每12h测量记录待测叶柄的病变长度。根据测量的待测叶柄的病变长度进行统计分析,绘制如图4所示的不同材料的马铃薯叶柄与被侵染时间之间的病变叶柄长度的柱状图。从图4中可以看出:来源于马铃薯材料#1-#5的待测叶柄在被侵染24h时,叶柄基本上没有发生病变;当被侵染36h之后,待测叶柄发生病变。与被侵染48h相比,来源于马铃薯材料#1-#5的待测叶柄在被侵染36h时的叶柄病变长度数据的差异性较小,数据相对稳定,可重复性好。因此,本发明选择马铃薯叶柄最佳侵染时间为36h。所以,本发明实施例以“103cfu/ml的马铃薯黑胫病病原菌悬浮液和浸染时间36h”作为步骤三的试验条件,以表2所示的14个不同马铃薯材料#1-#14为来源的待测叶柄作为试验对象进行接种培养,为后续的抗性鉴定步骤试验做准备。步骤四、抗性鉴定每隔12h利用灯箱和白炽灯肉眼观察叶柄软化水渍化症状,用尺子测量叶柄水渍化病变长度并拍照记录,以接种36h的病变长度作为最终病变长度,按照分级标准进行分级并计算病情指数,最后依据计算的病情指数来确定抗感性。其中,分别以感病材料#3作为感病对照、抗病材料#12为抗病对照来确定抗感性。主要根据以下标准确定:(1)0≤病变叶柄长度<0.5cm,病害等级设置为0级;0.5cm≤病变叶柄长度<1cm,病害等级设置为1级;1cm≤病变叶柄长度<2cm,病害等级设置为2级;2cm≤病变叶柄长度<4cm,病害等级设置为3级;4cm≤病变叶柄长度<6.5cm,病害等级设置为4级。(2)根据以下公式计算病情指数:(3)根据以下病情指数来确定马铃薯抗感性水平:高抗病情指数≤0.2;抗病0.2<病情指数≤0.4;中抗0.4<病情指数≤0.6;感病0.6<病情指数≤0.8;易感0.8<病情指数,且抗病、中抗、感病以及易病4个马铃薯材料的黑胫病抗性评价等级如图5所示。依据以上标准,14个马铃薯材料的黑胫病抗性评价结果如表2所示:易感材料有#3(感病对照),#11,#13;感病材料有#1,#6,#10;中抗材料有#2,#5,#7,#8;抗病材料有#4,#12(抗病对照),#14。表214个马铃薯材料利用本发明实施例提供的黑胫病抗性评级试验材料接病植株空白对照病情指数抗性评价#113株5株0.788感病#210株5株0.4中抗#315株5株0.983易感#415株5株0.233抗病#510株5株0.425中抗#613株5株0.634感病#713株5株0.404中抗#87株5株0.429中抗#913株5株0.942易感#1012株5株0.75感病#1113株5株0.846易感#1213株5株0.481抗病#1313株5株0.923易感#1420株5株0.363抗病注:为了保证对比试验的一致性,本次试验结果中展示的采用叶柄接病技术的马铃薯植株与表2中采用主茎注射技术的马铃薯植株为同一批试验材料。经多次试验发现,由于本发明提供的鉴定方法中的叶柄接病技术操作简便,结果稳定,接病植株和空白对照的种植数量可分别减少到5株和3株。采样时,每个试验材料可以选取第4-6片叶的成熟健康的叶柄用于接种鉴定即可。评价结果验证对比试验在其它条件相同的情况下,采用传统的主茎注射技术与本发明提供的鉴定方法进行对比验证试验。具体地,与本发明实施例提供的鉴定方法相比,传统的主茎注射技术的主要区别在于:a.主茎注射接种培养:用一次性无菌注射器针头分别穿刺出芽后4周的#1-#14马铃薯主茎,用移液枪配合灭菌的枪头吸取10μl浓度为1.5×108cfu/ml的病原菌菌悬液,接种于穿刺部位,每棵马铃薯主茎在5个不同的位点接种,间距约为3cm;接种后将接种部位覆盖保鲜膜12h保持湿度以稳定发病率,空白对照组的植株穿刺后接种所使用的为10μl的mes溶液。b.利用传统主茎注射技术评价鉴定:以感病材料#3作为感病对照,抗病材料#12为抗病对照,10-15天后将马铃薯植株连根拔出,将近地面的主茎部位纵剖,观察维管束颜色,超过注射接种数量2/3的植株主茎剖面呈黑色为感病材料,低于注射接种植株数量1/3的主茎剖面黑色为抗病材料,超过注射接种植株数量的1/2但未超过2/3的主茎剖面呈黑色为感病?材料;依据以上标准,如表3所示14个马铃薯材料的黑胫病抗性评价结果发现,#4、#7、#12、#14为抗病材料,#5、#8为感病?材料,#1、#2、#3、#6、#9、#10、#11、#13为感病材料。表314个马铃薯材料利用传统主茎注射的黑胫病抗性评级试验材料接病植株空白对照主茎剖面抗性评价#113株5株10/13黑色感病#210株5株6/10黑色感病#315株5株13/15黑色感病#415株5株3/15黑色抗病#510株5株5/10黑色感病?#613株5株10/13黑色感病#713株5株4/10黑色抗病#87株5株3/7黑色感病?#913株5株13/13黑色感病#1012株5株11/12黑色感病#1113株5株12/13黑色感病#1213株5株2/13黑色抗病#1313株5株11/13黑色感病#1420株5株4/20黑色抗病从表2和表3中可以看出使用本提供的鉴定方法中的叶柄接种的发病情况与同样材料田间主茎注射的发病情况基本一致,但田间主茎注射材料除了鉴定期长的问题外,在抗病鉴定过程中会出现肉眼难以观察的腐烂症状或者发病不稳定的情况从而出现无法定性定级,最终造成分析结果不准确,鉴定材料结果不清晰。另外,本发明提供的鉴定方法采用叶柄离体培养法,可以避免因田间主茎注射法引起土壤污染等问题。最后应当说明的是:以上实施例仅用以说明本发明的技术方案而非对其限制;尽管参照较佳实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解:依然可以对本发明的具体实施方式进行修改或者对部分技术特征进行等同替换;而不脱离本发明技术方案的精神,其均应涵盖在本发明请求保护的技术方案范围当中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1