一种3D生物组织专用培养装置和块状培育肉的制备方法与流程
一种3d生物组织专用培养装置和块状培育肉的制备方法
技术领域
[0001]
本发明涉及培育肉制备技术领域,尤其涉及一种3d生物组织专用培养装置和块状培育肉的制备方法。
背景技术:
[0002]
培育肉又被称作培养肉、清洁肉、体外肉等,是一种基于细胞生产的人造肉,该类肉品因可以绕开动物饲喂而可持续地为人类供应真实动物蛋白,被认为是最有可能解决未来人类肉品生产和消费困境的方案。参见王守伟的“人造肉分类与命名分析及规范建议”(食品科学,2020,41(11):310-316)。
[0003]
目前,培育肉的制备技术尚处于发展阶段,其制备所需的细胞来源、细胞体外培养、细胞体外3d成型等诸多关键性的技术尚需进一步突破或完善。参见董桂灵的“培育肉的研究进展及相关专利申请”(中国发明与专利,2019,16(7):71-75)。其中,细胞体外3d成型和培养方式与培育肉的食用口感密切相关,目前已有的培育肉制备技术只能先制备小尺寸的肌管细胞团或者肌管细胞,然后通过物理方法比如添加辅料(中国专利申请cn110730615a)将其组合成可食用规模的培育肉产品,这导致了培育肉的咀嚼感变差。
技术实现要素:
[0004]
本发明实施例提供一种3d生物组织专用培养装置和块状培育肉的制备方法,通过解决动物骨骼肌卫星细胞的3d培养等技术难题,克服了目前无法一次性制备具有较大尺寸的块状单一培育肉结构单元的缺陷,在培育肉制备过程中可实现对其单一结构单元的3d构型和尺寸的控制。
[0005]
本发明实施例提供一种3d生物组织专用培养装置,包括:
[0006]
3d生物组织培养槽,用于放置3d生物组织,
[0007]
和储液槽,用于盛装培养基;
[0008]
所述3d生物组织培养槽和所述储液槽之间通过管路连接形成循环回路,供培养基循环流动;
[0009]
所述3d生物组织培养槽的敞口处设有密封塞,所述密封塞的内侧设有多个培养基灌注针,使用时所述培养基灌注针穿过3d生物组织。
[0010]
由于普通培养装置在培养箱中处于一种静置的状态,3d生物组织的中间部位会由于没有足够的营养物质渗透导致其中的细胞不能正常生长或坏死。本发明实施例提供的3d生物组织专用培养装置,通过培养灌注针的设置使3d生物组织的中间部位也能很好地渗透营养物质,且培养基一直处于循环流动的状态,比较均一,可有效保证3d生物组织内部细胞的均匀生长和分化。
[0011]
本发明实施例还提供一种块状培育肉的制备方法,包括:
[0012]
先将动物骨骼肌卫星细胞与生物墨水混合进行3d生物打印,然后将打印所得3d动物骨骼肌卫星细胞组织置于上述本发明实施例提供的3d生物组织专用培养装置中进行增
殖培养和分化。
[0013]
使用本发明上述实施例提供的3d生物组织专用培养装置中进行体外培养和分化,可有效保证块状3d生物组织的内部细胞均匀生长和分化,从而得到块状培育肉。
[0014]
根据本发明实施例提供的块状培育肉的制备方法,所述生物墨水为甲基丙烯酸酐化明胶(gelma)和/或纳米纤维素。
[0015]
甲基丙烯酸酐化明胶(gelma)作为生物墨水进行mscs的3d生物打印具有较好的细胞生长和分化状态,再加上其良好的培养基渗透性能,非常适合块状培育肉的制备;另外纳米纤维素具有良好的生物相容性,而且本身是植物来源,生产成本低,可食用,无论是单独作为生物墨水还是与甲基丙烯酸明胶混合作为生物墨水表现出良好的生物相容性。实验发现,甲基丙烯酸酐化明胶(gelma)和纳米纤维素的混合体系比gelma本身更加适合块状培育肉的制备。
[0016]
根据本发明实施例提供的块状培育肉的制备方法,所述动物骨骼肌卫星细胞为猪骨骼肌卫星细胞或鸡骨骼肌卫星细胞。
[0017]
当所述动物骨骼肌卫星细胞为猪骨骼肌卫星细胞时,具体地,先将动物骨骼肌卫星细胞与生物墨水混合进行3d生物打印,然后将打印所得3d动物骨骼肌卫星细胞组织置于本发明实施例提供的3d生物组织专用培养装置中后,再将整体置于36.5~37.5℃、5%co
2
条件下培养,待细胞形态稳定,将增殖培养基更换为分化培养基,直至形成块状培育肉。
[0018]
其中,采用的增殖培养基包含表皮生长因子8~12ng/ml、成纤维细胞生长因子0.5~2ng/ml、胰岛素0.005~0.015mg/l和地塞米松0.3~0.5μg/ml,采用的分化培养基包含胰岛素0.005~0.015mg/l。
[0019]
采用上述培养基,可以在无血清的情况下使细胞正常生长,生长周期与含20%胎牛血清的培养基一致,这有利于降低培育肉的生产成本。
[0020]
当所述动物骨骼肌卫星细胞为鸡骨骼肌卫星细胞时,具体地,先将动物骨骼肌卫星细胞与生物墨水混合进行3d生物打印,然后将打印所得3d动物骨骼肌卫星细胞组织置于本发明实施例提供的3d生物组织专用培养装置中后,再将整体置于40.5~41.5℃、5%co
2
条件下培养,待细胞形态稳定,将增殖培养基更换为分化培养基,直至形成块状培育肉。
[0021]
其中,采用的增殖培养基为含10~20%鸡血清或胎牛血清的mccoy's 5a培养基,采用的分化培养基为含0~5%鸡血清或胎牛血清的mccoy's 5a培养基。
[0022]
本发明通过实验发现,对于鸡骨骼肌卫星细胞,传统的培养温度36.5~37.5℃并不是最适合的,40.5~41.5℃下效果才更好,41℃最优。
[0023]
综上可见,采用本发明实施例提供的专用的骨骼肌卫星细胞增殖培养基、分化培养基和3d生物组织专用培养装置有利于高效率地实现骨骼肌卫星细胞3d生物组织定向分化成多核肌管细胞。而且,针对不同的动物骨骼肌卫星细胞,其专用的骨骼肌卫星细胞增殖培养基和分化培养基还略有差异,可见其专一性。
[0024]
根据本发明实施例提供的块状培育肉的制备方法,所述动物骨骼肌卫星细胞为经提取和体外培养所得,其中,猪骨骼肌卫星细胞为从新生期动物的骨骼肌组织中提取,鸡骨骼肌卫星细胞为从孵化器的胚胎中提取。此时相应的骨骼肌卫星细胞含量最为丰富且增殖活力更高,利于后续培养。
[0025]
进一步地,提取方式为组织块贴壁法。虽然组织块贴壁法、酶解组织块贴壁法和酶
消化过滤法是提取组织细胞常用的方法,但是针对本发明的骨骼肌卫星细胞,发明人发现采用组织块贴壁法可以在较短时间内完成大量骨骼肌卫星细胞的提取操作,提取效率高,方便快捷。
[0026]
所述体外培养采用贴壁培养方式或负载于微载体微球表面以悬浮培养的方式培养。
[0027]
本发明发现除了可以常规地将动物骨骼肌细胞在培养皿或细胞工厂中以贴壁的形式快速生长,还可以负载于微载体微球表面以悬浮培养的形式快速生长,两种方式均可以实现细胞的快速增殖,其中,悬浮培养的方式得到的细胞生长密度更大,有更大的可能进一步低成本降低生产成本,扩大生产规模。具体地,贴壁的方式细胞的密度是:2
×
10
5
个/cm
2
;悬浮培养的方式细胞的密度是:3.5
×
10
7
个/ml(鸡)或2.5
×
10
7
个/ml(猪)。
[0028]
进一步地,进行所述体外培养时,可采用无血清专用培养基或10%~20%胎牛血清添加量的通用培养基,优选的培养基为20%胎牛血清添加量的通用培养基dmem。培养条件为36.5~37.5℃、5%co
2
。
[0029]
作为本发明一个优选实施方式,所述块状培育肉的制备方法包括以下步骤:
[0030]
(1)动物骨骼肌卫星细胞的提取
[0031]
采用组织块贴壁法提取动物骨骼肌卫星细胞;
[0032]
(2)动物骨骼肌卫星细胞的体外培养
[0033]
将提取的动物骨骼肌卫星细胞采用贴壁培养方式或负载于微载体微球表面以悬浮培养的方式进行体外培养,培养基为20%胎牛血清添加量的通用培养基dmem,培养条件为36.5~37.5℃、5%co
2
;
[0034]
(3)动物骨骼肌卫星细胞的3d生物打印
[0035]
将体外培养得到的动物骨骼肌卫星细胞与生物墨水混合进行3d生物打印;所述生物墨水为甲基丙烯酸酐化明胶(gelma)和/或纳米纤维素,所述生物墨水的体积占比为1%~20%;
[0036]
(4)3d动物骨骼肌卫星细胞组织的增殖培养和分化
[0037]
将打印所得3d动物骨骼肌卫星细胞组织置于上述本发明实施例提供的3d生物组织专用培养装置中后,再将整体置于36.5~37.5℃(猪骨骼肌卫星细胞)/40.5~41.5℃(鸡骨骼肌卫星细胞)、5%co
2
条件下培养,1-2天后待细胞形态稳定,将增殖培养基更换为分化培养基,3~5天后,将分化培养基更换为增殖培养基,继续培养直至细胞分化融合形成块状培育肉。
[0038]
上述技术方案中,动物骨骼肌卫星细胞的提取方法可快速提取骨骼肌卫星细胞,降低对骨骼肌卫星细胞的损伤,得到的动物骨骼肌卫星细胞纯度高、形态学均一稳定、干性维持稳定、再生活力高、扩增速率快;
[0039]
动物骨骼肌卫星细胞的体外培养方法利用合适的培养基和有效的规模化扩增手段可以对动物骨骼肌卫星细胞进行稳定规模化高效扩增,扩增过程中细胞生长密度大、试剂用量少、操作简便;
[0040]
动物骨骼肌卫星细胞的3d生物打印方法可以快速实现细胞3d生物组织的快速成型和形状的精准控制,操作简便、扩展潜力大,可用于规模化快速生产培育肉结构单元;
[0041]
3d动物骨骼肌卫星细胞组织的增殖培养和分化方法可以为体外细胞3d生物组织
培养提供足够的营养供给,保证3d生物组织内部的细胞处于良好的生长状态,可实现骨骼肌卫星细胞的3d原位分化,可用于块状培育肉结构单元的快速制备,有利于形成培育肉产品的咀嚼口感。
[0042]
本发明实施例还提供一种块状培育肉,由上述任一所述的块状培育肉的制备方法制得。
[0043]
本发明实施例提供的3d生物组织专用培养装置,可有效保证3d生物组织内部细胞的均匀生长和分化,适用于制备块状培育肉。本发明实施例提供的块状培育肉的制备方法可显著提高动物培育肉的制备规模,制得的培育肉尺寸可达到1
×
1
×
1cm
3
,相较于现有技术中先制得小尺寸的肌管细胞团或肌管细胞再通过物理方法粘合在一起,真正实现了制备高质量的块状培育肉,具有肉产品的咀嚼口感。该制备方法可广泛用于人造肉、细胞工程、再生医学、分子生物学等领域。
附图说明
[0044]
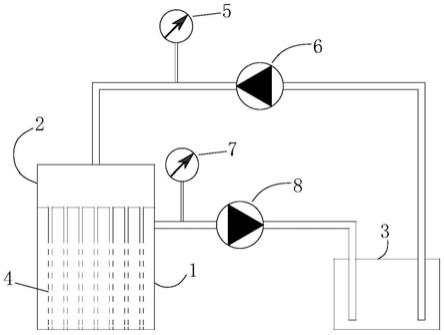
图1为本发明实施例1提供的3d生物组织专用培养装置的结构示意图,其中,1:3d生物组织培养槽;2:密封塞;3:储液槽;4:培养基灌注针;5:第一压差表;6:灌注泵;7:第二压差表;8:吸液泵;
[0045]
图2和图3分别为本发明实施例2步骤(2)中培养48h和培养72h后的猪骨骼肌卫星细胞的形态图;
[0046]
图4和图5分别为本发明实施例3步骤(2)中培养24h和培养48h后的鸡骨骼肌卫星细胞的形态图;
[0047]
图6为本发明实施例4步骤(2)中培养72h后的猪骨骼肌卫星细胞的形态图;
[0048]
图7为本发明实施例5步骤(2)中培养48h后的鸡骨骼肌卫星细胞的形态图;
[0049]
图8为本发明实施例2步骤(2)中培养5d后的猪骨骼肌卫星细胞的形态图;
[0050]
图9和图10分别为本发明实施例2中培养10d和培养15d后的3d猪骨骼肌卫星细胞组织的形态图;
[0051]
图11为本发明实施例3中培养15d后的3d鸡骨骼肌卫星细胞组织的形态图;
[0052]
图12为本发明实施例2中猪肌肉干细胞的成肌图;
[0053]
图13为本发明实施例3中鸡肌肉干细胞的成肌图;
[0054]
图14为本发明对比例1中采用酶解组织块贴壁法进行提取后的猪骨骼肌卫星细胞的形态图;
[0055]
图15为本发明实施例2中采用组织块贴壁法进行提取后的猪骨骼肌卫星细胞的形态图;
[0056]
图16为本发明对比例2中采用静置培养后的猪骨骼肌卫星细胞的形态图。
具体实施方式
[0057]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0058]
实施例1
[0059]
本发明实施例提供一种3d生物组织专用培养装置,其结构示意图如图1所示,包括:
[0060]
3d生物组织培养槽1,用于放置3d生物组织,
[0061]
和储液槽3,用于盛装培养基;
[0062]
3d生物组织培养槽1和储液槽3之间通过管路连接形成循环回路,供培养基循环流动;流入3d生物组织培养槽1的管路上设有第一压差表5和灌注泵6,从3d生物组织培养槽1流出的管路上设有第二压差表7和吸液泵8;
[0063]
3d生物组织培养槽1的敞口处设有密封塞2,密封塞2的内侧设有多个培养基灌注针4,使用时培养基灌注针4穿过3d生物组织。
[0064]
实施例2
[0065]
本发明实施例提供一种块状猪培育肉的制备方法,具体如下:
[0066]
(1)猪骨骼肌卫星细胞的提取
[0067]
先将新生猪用co
2
处死,放入75%酒精溶液中浸泡消毒5min,然后解剖猪获取其大腿部位的骨骼肌组织,撕去其中的筋膜组织后,用眼科剪刀将其剪切成约1mm
3
见方的组织块;再加入磷酸盐缓冲溶液(pbs)移液枪轻轻吹洗组织块,完成后经700rpm离心5min,吸去上清,下层沉淀即为猪骨骼肌组织块;然后用含20%胎牛血清的dmem培养基将上述组织块重悬并平铺于培养皿中于37℃、5%co
2
条件下静置于培养箱中培养。培养3天后,用移液枪吸出培养皿中的猪骨骼肌组织块,更换新鲜的含20%胎牛血清的dmem培养基。
[0068]
(2)猪骨骼肌卫星细胞的贴壁和体外培养
[0069]
待步骤(1)中提取得到的猪骨骼肌卫星细胞覆盖培养皿底部面积达50%以上后,将培养基弃掉,然后用磷酸缓冲液(dpbs)润洗一遍培养皿底部的细胞。完成后,加入1ml0.25%胰酶,37℃条件下消化4.5min,完毕后加入1ml含10%胎牛血清的pbs终止消化,然后用移液枪轻轻地将贴壁细胞完全吹打下来并转移至离心管中,经900rpm离心5min,吸去上清,下层沉淀即为原代猪骨骼肌卫星细胞。然后用1ml含20%胎牛血清的dmem培养基重悬,计数后接种合适的量于细胞工厂中(约3
×
10
6
个/层),然后静置于37℃、5%co
2
培养条件的培养箱中培养,待骨骼肌卫星细胞扩增至覆盖细胞工厂底部面积80%时进行传代,不断扩增骨骼肌卫星细胞的数量。
[0070]
(3)猪骨骼肌卫星细胞的3d生物打印
[0071]
在无菌条件下,将适量步骤(2)中得到的猪骨骼肌卫星细胞与一定体积的生物墨水甲基丙烯酸酐化明胶混合,使生物墨水的体积占比达到1%~20%之间,然后加入生物打印机中进行猪骨骼肌卫星细胞的3d生物打印于无菌培养皿中,打印成块状或网格状。
[0072]
(4)3d猪骨骼肌卫星细胞组织的增殖培养和分化
[0073]
将步骤(3)中打印的动物骨骼肌卫星细胞组织置于本发明实施例1提供的3d生物组织专用培养装置中,然后整体置于37℃、5%co
2
条件下培养,1~2天后待细胞形态稳定,将猪骨骼肌卫星细胞用增殖培养基(具体成分见表1)更换为猪骨骼肌卫星细胞用分化培养基(具体成分见表2),3~5天后,将分化培养基再更换为增殖培养基,继续培养,待3d生物组织内部的骨骼肌卫星细胞分化融合形成统一的整体、组织具有一定的弹性、组织表面具有一定的光泽后即为3d生物组织培养和分化完成,形成单一培育肉结构单元。
[0074]
表1猪骨骼肌卫星细胞用增殖培养基成分
[0075]
[0076][0077]
表2猪骨骼肌卫星细胞用分化培养基成分
[0078][0079]
实施例3
[0080]
本发明实施例提供一种块状鸡培育肉的制备方法,具体如下:
[0081]
(1)鸡骨骼肌卫星细胞的提取
[0082]
选取发育良好、鸡蛋外壳无破损、无明显不可祛除污物的鸡蛋,用75%酒精棉球轻轻擦拭消毒,用医用镊子轻轻敲破气室并掀去壳内附着白膜,用弯头镊子取出鸡胚胎放入75%酒精中浸润3秒。然后将消毒后的鸡胚放入事先倒有pbs溶液的平皿中,用pbs溶液润洗两次;吸去pbs溶液,把鸡胚大腿部位剪下,撕去外层筋膜,一支镊子固定肌肉,一支弯头镊子撕拉肌肉,将鸡胚一只大腿上附着在骨骼处的肌肉撕碎成糜状。在糜状的鸡骨骼肌组织中加入没过肌肉组织的pbs,吹打均匀,经800rpm离心5min,吸去上清,下层沉淀即为目标鸡骨骼肌组织块。然后用含20%胎牛血清的dmem培养基将上述组织块重悬并平铺于培养皿中于37℃、5%co
2
条件下静置于培养箱中培养。培养1天后,用移液枪吸出培养皿中的骨骼肌组织块,更换新鲜的含20%胎牛血清的dmem培养基。
[0083]
(2)鸡骨骼肌卫星细胞的贴壁和体外培养
[0084]
待步骤(1)中提取得到的鸡骨骼肌卫星细胞覆盖培养皿底部面积达50%以上后,将培养基弃掉,然后用磷酸缓冲液(dpbs)润洗一遍培养皿底部的细胞。完成后,加入1ml0.25%胰酶,37℃条件下消化4.5min,完毕后加入1ml含10%胎牛血清的pbs终止消化,然后用移液枪轻轻地将贴壁细胞完全吹打下来并转移至离心管中,经900rpm离心5min,吸去上清,下层沉淀即为原代鸡骨骼肌卫星细胞。然后用1ml含20%胎牛血清的dmem培养基重悬,计数后接种合适的量于细胞工厂中(约3
×
10
6
个/层),然后静置于37℃、5%co
2
培养条件的培养箱中培养,待骨骼肌卫星细胞扩增至覆盖细胞工厂底部面积80%时进行传代,不断扩增骨骼肌卫星细胞的数量。
[0085]
(3)鸡骨骼肌卫星细胞的3d生物打印
[0086]
在无菌条件下,将适量步骤(2)中得到的鸡骨骼肌卫星细胞与一定体积的生物墨水甲基丙烯酸酐化明胶混合,使生物墨水的体积占比达到1%~20%之间,然后加入生物打印机中进行鸡骨骼肌卫星细胞的3d生物打印于无菌培养皿中,打印成块状或网格状。
[0087]
(4)鸡骨骼肌卫星细胞组织的增殖培养和分化
[0088]
将步骤(3)中打印的鸡骨骼肌卫星细胞组织置于本发明实施例1提供的3d生物组织专用培养装置中,然后整体置于41℃、5%co
2
条件下培养,1~2天后待细胞形态稳定,将鸡骨骼肌卫星细胞用增殖培养基(具体成分见表3)更换为鸡骨骼肌卫星细胞用分化培养基(具体成分见表4),3~5天后,将分化培养基再更换为增殖培养基,继续培养,待3d生物组织内部的骨骼肌卫星细胞分化融合形成统一的整体、组织具有一定的弹性、组织表面具有一定的光泽后即为3d生物组织培养和分化完成,形成单一的培育肉结构单元。
[0089]
表3鸡骨骼肌卫星细胞用增殖培养基成分
[0090][0091]
[0092]
表4鸡骨骼肌卫星细胞用分化培养基成分
[0093][0094][0095]
实施例4
[0096]
本实施例提供一种块状猪培育肉的制备方法,其与实施例2的区别仅在于步骤(2)中猪骨骼肌卫星细胞的体外培养时,将贴壁培养方式换为负载于微载体微球上悬浮培养的方式。
[0097]
实施例5
[0098]
本实施例提供一种块状鸡培育肉的制备方法,其与实施例3的区别仅在于步骤(2)中鸡骨骼肌卫星细胞的体外培养时,将贴壁培养方式换为负载于微载体微球上悬浮培养的方式。
[0099]
对比例1
[0100]
本对比例提供一种猪源培育肉的制备方法,其与实施例2的区别仅在于步骤(1)中提取骨骼肌卫星细胞时,将组织块贴壁法换为酶解组织块贴壁法。
[0101]
对比例2
[0102]
本对比例提供一种猪培育肉的制备方法,其与实施例1的区别仅在于步骤(4)中3d猪骨骼肌卫星细胞组织的增殖培养和分化时,不采用实施例1提供的3d生物组织专用培养装置,而在培养箱中静置培养。
[0103]
图2和图3分别为本发明实施例2步骤(2)中培养48h和培养72h后的猪骨骼肌卫星细胞的形态图;从图中可以看出,猪的初代骨骼肌卫星细胞呈现梭型,随着培养时间的延长触手逐渐增多,呈现出卫星放射状的细胞形态,形状一致,增殖速度快。
[0104]
图4和图5分别为本发明实施例3步骤(2)中培养24h和培养48h后的鸡骨骼肌卫星细胞的形态图;从图中可以看出,鸡的初代骨骼肌卫星细胞提取效率高(每克鸡骨骼肌卫星细胞组织可以得到约5
×
10
5
个原代鸡骨骼肌卫星细胞),细胞的生长速度极快,形态稳定。
[0105]
图6为本发明实施例4步骤(2)中培养72h后的猪骨骼肌卫星细胞的形态图;图7为本发明实施例5步骤(2)中培养48h后的鸡骨骼肌卫星细胞的形态图;从图6、图7与图3、图5的比较中可以看出,进行体外培养时,采用贴壁培养方式和负载于微载体微球上悬浮培养的方式都是可行的。但是采用负载于微载体微球上悬浮培养的方式细胞扩增密度更大,经计算,在悬浮培养转瓶中使用微载体微球作为骨骼肌卫星细胞生长的载体进行悬浮培养,每毫升培养体系中可生产3.5
×
10
7
个鸡mscs或2.5
×
10
7
个猪mscs,可提高培养基的使用效率20~50倍,而且转瓶可重复,这可有效降低生产成本。
[0106]
图8为本发明实施例2步骤(2)中培养5d后的猪骨骼肌卫星细胞的形态图;从图中可以看出三维培养状态下的骨骼肌卫星细胞增殖迅速,生长出大量的触须状骨架,并发生相互之间的接触和融合,说明细胞在此种生物墨水基质中生长状态良好。
[0107]
图9和图10分别为本发明实施例2中培养10d和培养15d后的3d猪骨骼肌卫星细胞组织的形态图;可以看出块状培育肉已基本形成。
[0108]
图11为本发明实施例3中培养15d后的3d鸡骨骼肌卫星细胞组织的形态图;可以看出已形成直径为1cm的块状培育肉。
[0109]
图12为本发明实施例2中猪肌肉干细胞的成肌图;图13为本发明实施例3中鸡肌肉干细胞的成肌图;从图中可以看出细胞呈现完全伸展状态,而且可以发生原位分化,生成三维纤维状肌管,3d成型后细胞的增殖和分化活力仍然存在。
[0110]
图14为本发明对比例1中采用酶解组织块贴壁法进行提取后的猪骨骼肌卫星细胞的形态图;图15为本发明实施例2中采用组织块贴壁法进行提取后的猪骨骼肌卫星细胞的
形态图;可以看出,采用组织块贴壁法进行提取可降低对骨骼肌卫星细胞的损伤,得到的动物骨骼肌卫星细胞纯度高、形态学均一稳定、干性维持稳定、再生活力高、扩增速率快。
[0111]
图16为本发明对比例2中采用静置培养后的猪骨骼肌卫星细胞的形态图;从图中可以看出,组织块中间出现大量的细胞死亡,可与图8形成鲜明的对比。
[0112]
结果表明,本发明实施例为块状培育肉的制备提供了一种有效方法。本发明实施例提供的动物骨骼肌卫星细胞的提取方法可为培育肉生产高效率的提供种子细胞;本发明实施例提供的动物骨骼肌卫星细胞体外扩增方式,可以以较低成本和简便操作在较短时间内为培育肉的生产提供大量的动物骨骼肌卫星细胞;本发明实施例提供的动物骨骼肌卫星细胞3d成型方式,可以实现快速、自动化的生产;本发明实施例提供的细胞组织的增殖培养和分化方法,可以实现培育肉的整体培育和分化,有利于增强培育肉的食品属性,提升培育肉的食用口感。
[0113]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1