同时检测DNA病毒和RNA病毒的病毒核酸检测方法与流程
同时检测dna病毒和rna病毒的病毒核酸检测方法
技术领域
[0001]
本发明涉及病毒检测技术领域,尤其是涉及同时检测dna病毒和rna病毒的病毒核酸检测方法。
背景技术:
[0002]
近些年来,由病毒造成的全球事件频繁发生。非洲猪瘟造成了全球生猪大面积死亡,伊波拉病毒的高度感染性使其在世界各地反复出现,而流感病毒则频繁地导致大范围人群及家禽致病。这些病毒传播途径简单、传播速度快,往往容易引起聚集性爆发事件,导致流行性疫病。针对这些病毒,医疗工作人员目前尚无长期有效的疫苗及治疗方法。因此,快速高效的病毒检测就成为了控制病毒传播扩散的有力手段。
[0003]
在进行病原体的检测时,常常需要针对可能产生相似症状的不同种病毒进行检测以更好地区分。例如,发烧、头疼、乏力、嗓子疼等症状在eb病毒(dna病毒)以及流感病毒(rna病毒)造成的感染中都有可能出现,如果不能对其进行准确检测,可能会耽误患者的后续治疗工作。目前实践中最常用的病毒检测方法是聚合酶链式反应(polymerase chain reaction,pcr)以及由此改进得到的其它检测方法。这些方法在进行检测时需要专业的技术人员和大量的血清样本,耗时较长,反应条件也相对苛刻。如果在面临上述情况、需要针对不同的dna病毒和rna病毒进行检测时,往往只能分别进行,其原因在于,不同类型的病毒的核酸的特性、长度和复杂程度都有所不同,如果同时对两类病毒进行检测可能会因假阳性等原因而使得结果的准确性较差。因此,有必要提供一种准确高效的能够同时检测dna病毒和rna病毒的病毒核酸检测方法。
技术实现要素:
[0004]
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种准确高效的能够同时检测dna病毒和rna病毒的病毒核酸检测方法。
[0005]
第一方面,本发明的一个实施例提供了一种同时检测dna病毒和rna病毒的病毒核酸检测方法,该病毒核酸检测方法包括以下步骤:
[0006]
s1:提供cas12a蛋白、cas13a蛋白、第一crrna、第二crrna和待测核酸样品的体系;
[0007]
s2:将体系与dna荧光探针、rna荧光探针混合反应,检测反应前和反应后的荧光信号;
[0008]
其中,第一crrna用于与cas12a蛋白形成第一复合物,第一复合物特异性识别dna病毒;第二crrna用于与cas13a蛋白形成第二复合物,第二复合物特异性识别rna病毒。
[0009]
本发明实施例的病毒核酸检测方法至少具有如下有益效果:
[0010]
crispr/cas系统是一种通过cas蛋白与相应crrna结合后特异性识别并结合靶向dna或rna序列,对其进行剪切或修改的基因编辑技术。本方案采用的cas12a蛋白在与特异性crrna形成复合物后,与dna病毒中靶向的互补dna链结合进一步形成功能复合体cas12a-crrna-dna,该功能复合体的形成会释放出强大的非特异性剪切ssdna的剪切活性,能够对
dna荧光探针进行剪切,改变其荧光发光状态。同样的,cas13a蛋白具有rna介导的rna酶切活性,在与特异性crrna及rna病毒中靶向的互补rna链结合形成功能复合体cas13a-crrna-rna后,产生的非特异剪切ssrna的剪切活性会对rna荧光探针进行剪切从而改变其荧光发光状态。荧光发光状态的改变程度与对应的功能复合体的量呈正相关,因而可以通过这两类cas蛋白的联用,实现对dna病毒及rna病毒的同时检测。而且,根据dna荧光探针和rna荧光探针的发光强度的改变,能够准确地测定样品中dna病毒和rna病毒的含量。cas12a和cas13a蛋白所具有的非特异性剪切功能可无差别剪切其周围的非特异单链dna荧光探针和rna荧光探针,这为检测信号的放大提供了有利条件,提高了信噪比。crrna间隔区序列对靶向dna或rna片段的特异性识别则进一步提高了两类病毒同时检测的准确性。
[0011]
根据本发明的一些实施例的病毒核酸检测方法,体系还包括缓冲液,缓冲液中钠离子的终浓度为40~60mm,镁离子的终浓度为4~8mm。cas12a蛋白和cas13a蛋白的反应体系相对独立,不同的反应条件会导致cas12a蛋白和cas13a蛋白在联用时处于不同的反应活性状态,进而影响病毒核酸的检测效果。而当体系中的钠离子和镁离子处于上述浓度时,两种反应系统同时处于较佳的反应条件,检测体系的效率和准确性更好。
[0012]
根据本发明的一些实施例的病毒核酸检测方法,缓冲液中钠离子的终浓度为42~58mm,镁离子的终浓度为4.4~7.6mm;优选为钠离子的终浓度为44~56mm,镁离子的终浓度为4.8~7.2mm;优选为钠离子的终浓度为46~54mm,镁离子的终浓度为5.2~6.8mm;优选为钠离子的终浓度为48~52mm,镁离子的终浓度为5.6~6.4mm。
[0013]
根据本发明的一些实施例的病毒核酸检测方法,缓冲液以终浓度计,包括如下组分:40~60mm的nacl、15~25mm的tris、4~8mm的mgcl2、50~150μg/ml的bsa,ph为7.3~7.7。tris(三羟甲基氨基甲烷)能够维持核酸稳定性、避免核酸降解、提高核酸纯度,而bsa(牛血清白蛋白)则能够保持酶活。整个体系中缓冲液满足上述条件时可以使两种蛋白同时处于高效激活状态,具有良好的生物反应活性,能够准确检测样品中dna病毒和rna病毒的含量。
[0014]
根据本发明的一些实施例的病毒核酸检测方法,荧光信号通过tirfm(total internal reflection fluorescent microscope,全内反射荧光显微镜)进行检测。传统的全液态crispr/cas检测在无核酸扩增的情况下,灵敏度最高只能达到pm;而如果结合核酸扩增的反应,其中部分信息会出现失真,导致假阳性或假阴性的结果。tirfm的成像面积较小,可以达到微米级别,低背景、高分辨率的特点使其可以进一步提高信噪比,使得信号的微小变化都可以被观测,极少量的病毒核酸激发的探针剪切都可以被检测出来,从而获得更高的灵敏度。
[0015]
根据本发明的一些实施例的病毒核酸检测方法,检测荧光信号的方法包括如下步骤:
[0016]
通过全内反射荧光显微镜获取反应前后的图像;
[0017]
根据图像提取不同波段的荧光强度;
[0018]
根据荧光强度分析待测核酸样品中dna病毒和rna病毒的浓度。
[0019]
根据本发明的一些实施例的病毒核酸检测方法,其中的不同波段是指分别对应dna荧光探针和rna荧光探针的荧光波段。显然,为了获得较好的分析图像,dna荧光探针和rna荧光探针的荧光波段不同。
[0020]
根据本发明的一些实施例的病毒核酸检测方法,采用机器学习技术执行分析。具体采用的机器学习技术可以是分类树、判别分析、k最近邻算法、朴素贝叶斯、支持向量机、深度学习或卷积神经网络等。通过机器学习技术对图像中不同波段的荧光强度进行更准确的分析从而得出相应的病毒浓度结果。
[0021]
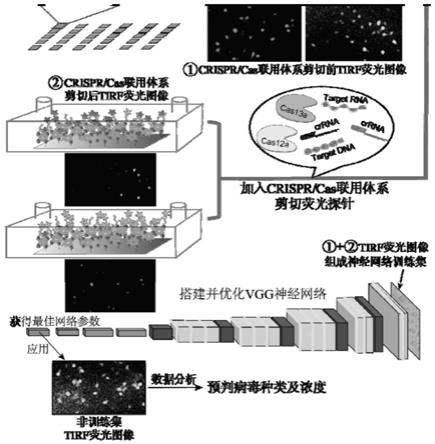
根据本发明的一些实施例的病毒核酸检测方法,机器学习技术为卷积神经网络。利用卷积神经网络计算参数较少、经济成本及运算时间成本较低、速度较快的特点,来搭建适用于本检测方法的神经网络。利用tirfm获取的不同靶向核酸浓度产生的荧光图像组成训练集,来训练并优化搭建的神经网络获得最优参数,从而获得最佳识别效果。并基于优化后的神经网络来读取tirfm获得的荧光图像,根据图像的底层信息来准确判断病毒的种类及病毒核酸的浓度。
[0022]
根据本发明的一些实施例的病毒核酸检测方法,dna荧光探针和rna荧光探针固定于固相载体。因为在检测分析过程中需要观察荧光基团的数量及强度,所以传统crispr/cas系统中所用的带有荧光基团和淬灭基团的游离核酸探针无法很好地适用于本方案,因而本方案中优选将探针固定到固相载体上以更好地观察记录。剪切前,固定在固相载体上的探针发出荧光,功能复合体被激活时所产生的非特异剪切使探针的核酸片段断裂,被剪切的荧光探针数量随靶向核酸片段的浓度升高而增多,导致相应的荧光基团数量及信号的降低。据此利用非特异性剪切的信号放大与tirfm的低背景、超分辨显微相结合,连级降低了信噪比,能够实现无核酸扩增情况下的微量病毒检测。
[0023]
根据本发明的一些实施例的病毒核酸检测方法,dna荧光探针和rna荧光探针通过化学修饰的方法固定于固相载体。
[0024]
根据本发明的一些实施例的病毒核酸检测方法,dna荧光探针和rna荧光探针通过链霉亲和素-生物素固定于固相载体。传统的化学表面修饰技术往往会产生一些化学杂质的残留,进而产生许多非特异性信号。这些非特异性信号在tirfm下有可能影响真实信号的判断,因而通过链霉亲和素-生物素的固定方式将探针固定到固相载体表面,从而减少杂质造成的影响。
附图说明
[0025]
图1是本发明的实施例1的病毒核酸检测方法的流程示意图。
[0026]
图2是本发明的实施例3中反应前的微流控芯片在激发光波长649nm的荧光图像。
[0027]
图3是本发明的实施例3中反应前的微流控芯片在激发光波长494nm的荧光图像。
[0028]
图4是本发明的实施例3中反应后的微流控芯片在激发光波长649nm的荧光图像。
[0029]
图5是本发明的实施例3中反应后的微流控芯片在激发光波长494nm的荧光图像。
[0030]
图6是本发明的实施例3中反应后的微流控芯片非训练集的荧光图像。
具体实施方式
[0031]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0032]
实施例1
[0033]
本实施例提供一种病毒核酸检测方法中所用crrna的组合,通过以下方法获得:
[0034]
1.crrna的设计合成
[0035]
本实施例以eb病毒、新冠病毒分别作为dna病毒和rna病毒的案例。
[0036]
选择新冠病毒(sars-cov-2)的s基因和和eb病毒(epstein-barr virus)的enba-1基因的保守序列,用primer express软件设计引物和crrna。
[0037]
表1.引物对和crdna
[0038]
名称序列crdna1(sars-cov-2)tatcaaacctcttagtaccattggtccc(seq id no.1)crdna2(sars-cov-2)aaccttcaacaccattacaaggtgtgct(seq id no.2)ebv-f1gccatttttccaccctgtag(seq id no.3)ebv-r1attgagggcgtctcctaaca(seq id no.4)crdna3(eb)caacctaaggcgaggaactgccc(seq id no.5)crdna4(eb)cctccctggtttccacctatggt(seq id no.6)
[0039]
利用hiscribe t7快速rna合成试剂盒,以表1提供的crdna为模板,合成对应的crrna,冻干-20℃保存。
[0040]
2.crrna的筛选
[0041]
取eb病毒感染者的血浆样本,按dna抽提试剂盒说明书要求进行病毒dna提取,去离子水溶解即得eb病毒模板。取sars-cov-2感染者的体液样本,用trizol方法提取rna。
[0042]
将两种病毒模板与cas12a蛋白、cas13a蛋白以及表1中合成的对应不同cas蛋白的crrna、以及报告rna和报告dna混合,检测相应的发光情况。报告rna和报告dna为两端分别修饰荧光报告基团和荧光淬灭基团的rna探针和dna探针。
[0043]
将步骤1设计出的多个crrna通过不同的排列组合,采用一种或多种crrna同时加入反应体系。不同的crrna与cas蛋白的结合能力以及触发的非特异性剪切反应可能会出现区别。根据cas蛋白与不同crrna结合出现的荧光信号的强弱,筛选出合适的crrna的组合,从而获得更高的检测灵敏度。
[0044]
结果显示,crrna1和crrna3的组合发出的荧光较强,作为本实施例中最优的crrna组合。
[0045]
实施例2
[0046]
1.微流控芯片的制作
[0047]
(1)利用强酸和强碱对玻片进行彻底清洁,除去其表面的有机物和无机物。通入氮气,高温状态下使玻片表面修饰羟基以获得亲水性。
[0048]
(2)依次通过聚乙二醇-生物素(polyethylene glycol-biotin,peg-biotin)与链霉亲和素使玻片表面形成链霉亲和素修饰层。
[0049]
(3)以该玻片为基板制备得到微流控芯片。
[0050]
(4)将一端标记生物素蛋白、另一端标记荧光基团的dna荧光探针(cy5荧光基团)和rna荧光探针(fam荧光基团)注入芯片孵育,使dna荧光探针和rna荧光探针固定于玻片表面,清洗除去未固定的探针。其中,dna荧光探针和rna荧光探针均为短的单链核酸序列,为避免探针相互配对形成双链聚合体,利用不同长度和非配对碱基分别设计dna荧光探针和
rna荧光探针。同时,dna荧光探针和rna荧光探针上标记的荧光基团的荧光波段不相同,以保证检测过程中更容易识别,准确性更高。
[0051]
2.病毒核酸检测方法
[0052]
(1)将待测核酸样品与cas12a蛋白、cas13a蛋白、crrna1、crrna3及缓冲液混合,孵育,形成体系。
[0053]
(2)将体系通入微流控芯片内部与基板玻片上的探针发生反应。
[0054]
(3)利用tirfm观测记录体系通入前后基板玻片的荧光图像。
[0055]
(4)利用优化好的卷积神经网络模型对荧光图像进行分析,得出待测核酸样品中对应的dna病毒和rna病毒的浓度。
[0056]
其中,缓冲液混合形成体系后各组分的终浓度如下:nacl:50mm,tris:20mm,mgcl2:6mm,bsa:100μg/ml,ph值为7.5。
[0057]
tirfm能够激发固相载体表面100nm左右厚度的薄层内的荧光基团,降低背景色,利用此高信噪比优势,结合非特异性剪切的信号放大功能,该检测方法可在无目的核酸扩增的情况下实现极微量的病毒检测。由于需要观察荧光基团的数量及强度以及tirfm激发荧光基团的范围限制,本实施例将标记有不同荧光基团的dna荧光探针及rna荧光探针固定于超薄玻片上。为避免玻片表面极微小的杂质产生的非特异性荧光影响结果,本实施例对玻片的清洁及表面修饰技术做了相应的调整。
[0058]
参考图1,示出了本实施例的病毒核酸检测方法的流程图。cas蛋白与靶向核酸的种类决定了剪切核酸探针的类型,靶向核酸的浓度与被剪切的荧光探针数量呈线性关系。因此,当加入不同类型及浓度的靶向核酸进入体系,激活不同cas蛋白的非特异性剪切功能,被剪切的荧光探针数量会随着目标核酸浓度的增高而增多,导致相应的荧光基团数量及信号的降低。非特异性剪切功能的信号放大与tirfm的低背景、超分辨显微技术相结合,连级降低了信噪比,进一步优化了无核酸扩增情况下的微量病毒检测。
[0059]
实施例3
[0060]
选择包含eb病毒、新冠病毒两种灭活病毒混合样本的试样,采用实施例2中的方法进行检测。结果如图2~6所示。参考图2,示出了本实施例中反应前的微流控芯片在激发光波长649nm的荧光图像;参考图3,示出了本实施例中反应前的微流控芯片在激发光波长494nm的荧光图像;参考图4,示出了本实施例中反应后的微流控芯片在激发光波长649nm的荧光图像;参考图5,示出了本实施例中反应后的微流控芯片在激发光波长494nm的荧光图像。可以看到,反应后,dna荧光探针和rna荧光探针的荧光信号都有所减弱,表明该方法检测到了试样中的eb病毒和新冠病毒。图6是本实施例中反应后的微流控芯片非训练集的荧光图像。
[0061]
不同浓度的靶向核酸触发cas蛋白剪切探针后,tirfm激发不同数量及信号强度的荧光基团,产生不同的荧光图像,并捕获图像。通过python语言搭建卷积神经网络,并利用梯度浓度的靶向核酸产生的荧光图像作为训练集,用于vgg卷积神经网络的训练及优化。该网络以vgg为基础,通过由tirfm记录的训练集图像最终生成的卷积神经网络,读取随机试样给出的tirfm荧光图像的关于荧光波段、荧光强度等的底层信息,直接判断待测核酸样品中病毒的种类及不同种类病毒核酸的浓度。
[0062]
相较于使用单一cas蛋白对单一病毒进行检测,本实施例通过联用两类cas蛋白可
同时检测两类病毒。各类cas蛋白的活化缓冲条件不同,联用具有一定技术上的困难,本实施例摸索建立cas蛋白联用所需的所有反应条件,最终获得两类cas蛋白的最适反应缓冲环境。
[0063]
本发明上述实施例所提供的同时检测dna病毒和rna病毒的病毒核酸检测方法无需核酸拷贝数的扩增,防止了在扩增过程中病毒核酸信息的失真或丢失;也无需苛刻的实验条件,常温即可发生反应,防止了条件变化过程中一些不可控因素对检测的影响。crispr/cas联用体系的非特异性剪切功能以及tirfm的运用产生的多级降噪和连级信噪比提高,为无扩增条件下病毒核酸的微量检测提供有利条件。针对不同的dna病毒和rna病毒,可以针对性设计对应的crrna来完成。
[0064]
上面结合实施例对本发明作了详细说明,但是本发明不限于上述实施例,在所述技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1