用于自动分离核酸与蛋白的系统、方法和装置与流程
背景技术:
本公开文件通常涉及生物样本处理系统、方法和装置。更具体地说,本公开文件涉及将核酸和/或蛋白从生物和/或环境来源中自动化分离的系统、方法和装置。
相关技术
某些实验室程序在执行当中仍占主导地位,这些程序利用低效的手工方法,要求科学家或实验室技术人员在执行程序时集中注意力。这些程序中,许多将会从自动化中获益。例如,核酸纯化或分离操作指南,例如从细菌培养中进行大规模质粒提取,目前仍是耗时、低效、未实现完全自动化的任务。之前有过类似自动化操作指南的尝试,例如美国专利号8,404,198和9,808,799中披露系统的商业化实施例,及类似产品,均遭受无数缺点的困扰,例如包括未完全自动化和/或大体积样本时无法操作。诸如引进沉淀过滤器等的逐步改善措施,已减少所需的人工操作时间。但是,即使是最先进的核酸纯化试剂盒,仍需要大量的时间投入,例如,maxi、mega或giga规模的无内毒素质粒纯化需要数个小时和单独关注。
这至少有一部分原因在于核酸纯化的高技术性以及该流程期间需执行的不同任务的多样性。例如,许多核酸纯化方案使各种粘度和密度的液体流动并规划路线,在纯化方案期间的不同时间执行。此外,从生物样本中纯化核酸的流程期间,缓冲溶液及试剂需与生物样本和/或滤液均匀混合,这一点很重要,因为这有助于提高靶核酸的纯度和最后浓度。因此,到目前为止已经证明,很难将这些不同液体纳入可以提供延时释放的自动化流程,尤其是采用一种能够混合液体以创造均相溶液的方式。
此外,事实证明,在自动化系统中分别提供各种缓冲溶液及试剂,既问题重重又代价高昂。理想上,容纳各种缓冲溶液及试剂的材料应由一种与所存放溶液在化学上相容的材料(例如不发生化学反应的或惰性的材料),以使溶液在未使用或贮存期间一直保持功效和活性,直至这些溶液为预期目的而应用。
许多核酸纯化实验方案中采用的各种过滤步骤,额外增加了自动化流程中的应用复杂性和难度。例如,核酸纯化实验方案中的不同步骤,要求采用机械和/或离子手段选择性过滤溶液,随后对与过滤器/过滤膜结合的组件进行清洗或纯化。这其中产生的废物数量是生物样本原有数量的数倍,而这些废弃产物的封存或处置对自动化来说是一个复杂的因素。
以传统实际操作方式执行时,一名技术人员或科学家利用各种不同的机器和仪器来执行核酸纯化实验方案。例如,这包括利用离心机和移液器浓缩生物样本,加入特定数量的缓冲液,同时间歇搅拌或涡流,以使溶液内部的每种缓冲液/试剂均质化。在离心或真空情况下采用许多不同的过滤器/过滤膜、柱或磁珠,以进一步开展核酸纯化实验方案,在离心/真空步骤之间,有许多步骤会产生待处置的废弃产物。
随着生物样本体积的增加,上述问题进一步恶化。处理大体积生物样本时,通常需要更多的缓冲液和试剂,更加稳健的过滤器、滤膜和柱。这对各种过滤器/滤膜的结构完整性和过滤能力提出更加苛刻的要求,在任何自动化流程中对这种滤器/滤膜的纳入及监控提出了难题。此外,处理大体积生物样本时采用更多的缓冲液和试剂,会产生更多的废物。对此类废物负责的能力,为任何自动化流程提出了一个额外的独特技术障碍。
此外,由于当前核酸纯化实验方案依赖于实际操作和人员互动,存在固有污染风险,样本制备和处理流程之间缺少一致性,不断需要技术娴熟的人员开展这些流程。重要的是,大规模核酸纯化是一项极其耗时的程序,分散科学家在中央项目或任务的注意力。这些因素等成本高且效率低——无论是在学术或临床实验背景下,还是在商业企业内部。
因此,核酸自动纯化中,能够解决许多不利条件和问题,对于能够实现核酸纯化的系统、方法和装置,特别是那些能够将纯化过程中的所有阶段整合到单个消耗元件中,从而限制或消除用户在纯化过程中的干预的系统、方法和装置来说,有着突出的需求。
同样,自动蛋白纯化也需解决许多类似技术问题。蛋白纯化中,除了从目的蛋白中移除其他细胞碎片和材料外,分离/纯化后蛋白还需要维持生物活性。这通常需要运用不会打乱蛋白三级结构的条件和技术,留住蛋白的任何翻译后修饰(例如磷酸化、糖基化、半胱氨酸二硫键),并不引入非天然蛋白修饰(例如氧化反应、脱酰氨基作用)。而在人工操作过程中很难实现这一点,蛋白纯化自动化的技术难题实质上更多。
对于能够实现蛋白纯化的系统、方法和装置,特别是那些能够将纯化过程中的所有阶段整合到单个消耗元件中,从而限制或消除用户在纯化过程中的干预的系统、方法和装置来说,有着突出的需求。
技术实现要素:
本公开的实施方式解决了本领域中上述关于从生物和/或环境来源中自动分离靶核酸和/或靶蛋白等靶生物分子的一或多个问题或其他问题。
尤其是,一或多次实施可以纳入一台设备,以便自动纯化生物样本中的靶核酸和/或靶蛋白等靶生物分子。所述设备包括,例如(i)用于容纳生物样本的输入储槽;(ii)与输入储槽及裂解缓冲液储槽流体连通的第一生物处理组件;(iii)与第一生物处理组件及第一洗脱缓冲液储槽流体连通的第二生物处理组件;(iv)与第二生物处理组件流体连通的容器。第一生物处理组件可用于产生包含靶生物分子的裂解物。第二生物处理组件可包括一个靶生物分子结合过滤器,用于保留第一生物处理组件中的靶生物分子,容器可用于容纳输出容器,容纳来自第二生物处理组件的经纯化靶生物分子。非限制性示例可包括两个或两个以上生物处理组件。
用于自动纯化靶生物分子(如靶核酸和/或靶蛋白)的设备,可以联合使用任何数目包含试剂和/或缓冲液的储槽,适当使用以从生物样本中把靶生物分子自动分离。例如,该设备拥有一或多个储槽,含有重悬缓冲液、rnasea(或其他酶,例如蛋白酶k、烟草蚀纹病毒(tev)酶或全能核酸酶)、裂解缓冲液、中和缓冲液、内毒素去除缓冲液、高离液盐缓冲液、洗涤缓冲液、洗脱缓冲液、复性缓冲液、异丙醇、70%乙醇和/或te缓冲液。可根据待纯化靶生物分子的类型选择储槽内容(例如是否自动纯化靶核酸或靶蛋白)。
在一些实施例中,本公开所述的设备用于从生物样本中纯化靶生物分子。在一些实施例中,生物样本包括细菌培养物、细胞培养物、原核细胞培养物、真核细胞培养物、环境样本、食品或饮料样本和/或临床样本(例如尿液、血液、血浆、唾液、鼻液、粪便物水溶液、脑脊液或其他体液或渗出物)。靶生物分子可以是基因组dna、质粒dna或rna等靶核酸,也可以是靶蛋白,例如抗体、细胞因子、病毒蛋白或其他重组药物蛋白,链霉亲和素、蛋白a、c反应蛋白(crp)或在功能、结构或蛋白交互分析中使用的任何自然产生或重组蛋白。作为非限制性示例,靶生物分子可以是从细菌培养物、细胞培养物、生物样本等(即生物样本)中分离出来的质粒dna。作为替代性、非限制性示例,靶生物分子可以是从真核培养物(即生物样本)中分离出来的重组或单克隆抗体。在一些非限制性实施例中,生物样本包括大体积细菌培养物、大体积细胞培养物、大体积原核细胞培养物、大体积真核细胞培养物、大体积环境样本、大体积食品或饮料样本或大体积临床样本。在一些进一步非限制性实施例中,生物样本可以是小体积、中体积或大体积样本。
在靶生物分子是靶核酸的一些实施例中,一种用于从生物样本中自动纯化靶核酸的设备实施例包括:用于容纳哦生物样本的输入储槽;与输入储槽流体连通的第一生物处理组件以及裂解缓冲液储槽,所述第一生物处理组件用于生成含靶核酸的裂解物;与第一生物处理组件和第一洗脱缓冲液储槽流体连通的第二生物处理组件,所述第二生物处理组件包括用于保留靶核酸的核酸结合过滤器;与第二生物处理组件流体连通的容器,所述容器用于放置容纳经纯化靶核酸的输出容器。
在靶生物分子是靶核酸的一些实施例,一种用于从生物样本中自动纯化靶核酸的设备的实施例包括:(i)用于容纳生物样本的第一生物处理组件,所述第一生物处理组件由废物分离过滤器和流体连接至所述废物分离过滤器的多个储槽组成;(ii)第二生物处理组件包括阴离子交换膜、与所述阴离子交换膜流体连接的洗涤液储槽,以及与所述阴离子交换膜流体连接的第一洗脱缓冲储槽;(iii)第三生物处理组件,包括沉淀过滤器和与所述沉淀过滤器流体连接的第二洗脱缓冲液储槽。
本公开文件中的设备或装置亦可以包括一个在自动生物分子纯化系统中使用的消耗性纯化柱,例如自动靶核酸纯化系统或自动靶蛋白纯化系统。示例性实施例消耗性纯化柱可以包括用于容纳细菌培养物、细胞培养物或真核细胞培养物的输入储槽,与输入储槽及裂解缓冲液储槽流体连通的第一生物处理组件,与第一生物处理组件及第一洗脱缓冲液储槽流体连通的第二生物处理组件,以及与第二生物处理组件流体连通的输出容器。第一生物处理组件可用于从细菌或真核细胞培养中生成裂解物,其中裂解物包括诸如靶核酸。在这个实施例中,第二生物处理组件可包含一个用于留住靶核酸的硅基过滤器,输出容器可用于容纳来自第二生物处理组件的经纯化靶核酸。消耗性纯化柱可用于连接自动核酸纯化系统,以在无人为交互的情况下自动纯化靶核酸。
本公开文件中的方法包括一种从生物样本中进行靶生物分子自动纯化方法,例如靶核酸和/或靶蛋白。这种示例性方法可包括下列步骤:在输入储槽处接收生物样本且无需进一步的人机交互,在第一生物处理组件中从包含靶生物分子(例如靶核酸和/或靶蛋白)的生物样本生成裂解物,在第二生物处理组件处接收包含所述部分裂解物的靶生物分子(例如包含部分裂解物的靶核酸和/或包含部分裂解物的靶蛋白),在所述第二生物处理组件处将所述靶生物分子保留在生物分子结合过滤器上(例如核酸结合过滤器和/或靶蛋白结合过滤器),并且将所述靶生物分子的纯化形式从生物分子结合过滤器洗脱到输出容器中。
在一些实施例中,所述方法还可包括,在第一生物处理组件的第一膜处捕获生物样本的细胞内容物,并将所述细胞内容物的至少一部分重新投入一或多种重悬缓冲液、脱氧核糖核酸酶溶液或裂解缓冲液中。至少部分细胞内容物的重悬液可包括,例如通过转移重悬液来反洗第一膜,而重悬液可包括重悬缓冲液、核糖核酸酶溶液或裂解缓冲液中的一种或多种,从设置在所述第一膜的第二侧且穿过所述第一膜的流体通道。
所述方法可另外包括靶生物分子特定处理步骤。例如,在一些实施例种,靶生物分子由靶核酸组成,所述方法可另外包括,将裂解物与中和缓冲液混合以形成中和裂解物,并将包含靶核酸的部分与所述中和裂解物的废物部分分离。所述方法亦可选地包括将内毒素去除缓冲液与裂解物中的含靶核酸部分混合。在一些情况下,在第二生物处理组件处将靶核酸保留在核酸结合过滤器上,包括使裂解物的含靶核酸部分通过阴离子交换膜,并从阴离子交换膜上移除裂解物的含靶核酸部分,使靶核酸沉淀以除去靶核酸的盐分和/或浓缩靶核酸。根据公开的一些方法,沉淀后的靶核酸可被沉淀膜进一步捕获。
或者,在第二生物处理组件处将靶核酸保留在核酸结合过滤器上,包括使裂解物的含靶核酸部分通过硅基或高级硅基过滤器。在这些示例性方法中,裂解物的含靶核酸部分通过硅基过滤器之前,裂解物的含靶核酸部分可与高离液盐缓冲液混合。
一些实施例针对可在自动核酸纯化过程中使用的核酸纯化仪器。仪器与内置核酸纯化柱对接,以控制纯化柱内部的流体移动和路径,控制密封件和阀门的致动,同时控制纯化流程步骤的时机等其他功能。
在一个实施例中,纯化仪器包括,设有内部隔室的套管,该内部隔室在尺寸和形状上配置成容纳纯化柱;可选择性关闭的检修门,其通往内部隔室;泵组件,其位于内部隔室中,用于通过蠕动运动提供抽吸作用。在一些实施例中,仪器可以进一步包括夹紧机构,该夹紧机构布置在内部隔室内,并用于在可进入内部隔室的打开位置和夹紧机构压缩插入的纯化柱的关闭位置之间移动。夹紧机构从而可以在其在纯化过程中可能受到的相对高压期间,帮助维持柱的流体密封件的完整性。
仪器可以包括一个或多个传感器,用于确定组件位置、仪器操作状态、过程状态和/或其他指示。例如,一个或多个位置传感器可用于确保在启动自动移动部件之前柱的正确插入、柱的正确状态和/或柱的安全封闭。一个或多个传感器可以通信地耦合至控制器,该控制器可用于自动控制至少部分基于接收自一个或多个传感器的信息的仪器操作。例如,控制器可用于在其确定柱不合适、插入不当、无法有效收集纯化产物、装载有不合适的样本和/或未正确并安全地封闭在仪器内时,防止纯化过程启动和/或向用户提供通知/警报。
仪器还可以包括一个或多个执行机构,用于与插入柱相互作用来例如泵送流体、打开密封件和释放流体、打开排气孔、控制阀门和/或混合流体。在一些实施例中,用于与插入柱的一个或多个流体通道接合的泵组件包括凸轮轴和从凸轮轴横向延伸的多个凸轮构件。凸轮元件尖端与关联流体通道啮合。泵组件用于使得凸轮轴的旋转引起凸轮元件尖端的线性蠕动运动,从而蠕动地压缩流体通道并驱动流体运动通过通道。
在一个实施例中,一种用于从生物样本中自动纯化靶核酸的方法包含以下步骤:提供核酸纯化设备(即仪器)、通过检修门将纯化柱装载到设备的内部隔室中,并使用仪器启动纯化程序。纯化程序的启动使得仪器自动纯化靶核酸,而无需进一步的人为交互。
在一些实施例中,方法进一步包括关闭仪器的检修门,以及仪器驱动夹紧机构,使其移动到关闭位置来压缩插入纯化柱,从而帮助流体地密封所装载的纯化柱。方法还可以包含以下步骤:在启动纯化程序之前确定纯化柱已满载和/或确定检修门已完全关闭,方法是例如使用一个或多个位置传感器来检测柱的位置。方法还可以包含以下步骤:确定输出容器被正确地放置在纯化柱上,并在确定输出容器不存在时,发出警报/通知和/或防止纯化程序启动。
在一些实施例中,方法可以包括以下步骤:确定纯化柱中生物样本的光密度。仪器可以作为“智能”仪器进行操作,该仪器能够响应于接受的输入和/或传感器数据改变一个或多个过程参数。例如,光密度测定可用来调整纯化程序的一个或多个参数,比如纯化程序使用的一种或多种试剂的体积、通过泵组件泵送的持续时间或通过泵组件泵送的速度。
在一些实施例中,在启动纯化程序之前读取初始光密度读数,以确定之前是否使用过纯化柱。例如,在光密度读数基本等于空气空白读数的情况下,可以认为该读数表明生物样本纯化柱的培养物输入储槽仍然完整,因此,所述纯化柱也未被使用过。
本文公开的系统和设备可以另外包括流体释放系统或与流体释放系统相关联,以保持和选择性地释放流体。这种示例性系统可包括柔性垫圈、布置在柔性垫圈第一侧的用于容纳流体的储槽、布置在柔性垫圈和流体储槽之间的易碎密封件,以及布置在柔性垫圈第二侧的执行机构,该执行机构可操作来偏转柔性垫圈并使易碎密封件破裂,从而选择性地释放储槽中的流体。
另外,在一些实施例中,流体释放系统包括柔性排气孔、布置在柔性排气孔第一侧的易碎气体密封件以及布置在柔性排气孔第二侧的排气执行机构。排气执行机构可操作来选择性地朝易碎气体密封件偏转排气孔,从而使易碎气体密封件破裂,将空气排入储槽。
流体释放系统可以与本文公开的任何数量或类型的混合室或储槽相关联,并且可以使流体在适当的时间从这些室/储槽中选择性地释放,从而影响核酸纯化系统和关联柱内的不同过程和流体运动。因此,本公开的实施例另外包括用于选择性释放流体的自动化系统,该系统包括自动化核酸纯化系统,该系统由所公开的流体释放系统的至少一个组件以及与自动化核酸纯化系统一起使用的生物样本纯化柱组成,以及包括所公开的流体释放系统的至少一个其他组件。
用于在自动化过程中选择性地从储槽中释放流体的方法可包括使柔性垫圈与执行机构接触,移动执行机构以使柔性垫圈朝与储槽相关联的易碎密封件偏转,并使柔性垫圈破坏易碎密封件,从而从储槽中释放流体。
用于选择性地从储槽中释放流体的方法可以另外包括让柔性排气孔与排气执行机构接触,移动排气执行机构以使柔性排气孔朝易碎气体密封件偏转,并使柔性排气孔破坏易碎气体密封件。
本公开所述的系统、方法和设备还可以包括用于流体的受控运动的设备。设备可以包括第一外层,该第一外层具有包括一系列通道的第一侧以及第二侧。设备可以另外包括布置成与第一外层的第一侧相对的第二外层,以及布置在第一和第二外层之间的弹性体层。弹性体层可以包括与该一系列通道相对应的密封骨条结构,并且可以用于当弹性体层在第一和第二外层之间压缩时流体地分隔通道。
在一些实施例中,设备可以另外包括在弹性体层和第一外层或第二外层中一者或两者之间的标称间隙,使得当弹性体层在第一和第二外层之间压缩时,密封骨条的压缩部分在标称间隙内移位。另外,或可替代地,设备可包括与一系列通道相关联的阀门,该阀门可选择性地在关闭位置和打开位置之间移动,以分别限制或允许流体流过阀门。
在一些实施例中,设备的孔可提供通向弹性体层的可偏转部分的通路,该可偏转部分包含从弹性体层向第一外层延伸的阀门密封骨条。阀门密封骨条在阀门处于关闭位置时,可与第一外层接触,在阀门处于打开位置时,可与第一外层分离。另外,或可替代地,设备可包括与阀门的可偏转部分接触的柱塞。在这些实施例中,柱塞在尺寸和形状上可用于可通过地进入孔中,以偏转可偏转部分并朝关闭位置移动阀门。
在一个实施例中,设备用于承受施加在密封骨条结构整个长度上的至少500lbf磅力,优选至多15,000lbf磅力。另外,密封骨条结构可被压缩来在泄漏前承受至少30psi,优选至少60psi的流体压力,和/或当弹性体层在第一和第二外层之间压缩时,密封骨条被压缩至少20%,优选至少30%。
本公开的实施例另外包括控制流体运动的方法。一种示例性方法可以包括将本文公开的用于流体受控运动的设备提供给用于自动纯化靶核酸或靶蛋白的系统,使一个或多个柱塞打开设备中的阀门,使得打开的阀门允许流体连通在一系列通道的上游和下游部分之间,并使泵将流体从上游部分移到下游部分。所公开的用于控制流体运动的方法可以另外包括向设备提供包含靶核酸或靶蛋白的生物样本的步骤,并且如整个申请所述,在一些实施例中,生物样本可以是细菌培养物,靶核酸可以是质粒dna(或细胞培养物和靶蛋白可以是任何细胞蛋白)。
因此,公开了用于从生物样本中自动纯化例如核酸或蛋白等靶生物分子的系统、方法和装置。
本公开的实施方式通过从生物、临床和/或环境源中自动分离例如靶核酸或蛋白等靶生物分子来解决本领域的一个或多个上述或其他问题。
尤其是,一个或多个实施方式可以包括用于从生物样本中自动纯化靶蛋白的设备,该设备包含:用于容纳生物样本的输入储槽;与输入储槽和裂解缓冲液储槽流体连通的第一生物处理组件,该第一生物处理组件用于生成包含靶蛋白的裂解物;与第一生物处理组件和第一洗脱缓冲液储槽流体连通的第二生物处理组件,该第二生物处理组件包括用于保留靶蛋白的蛋白结合支持物;与第二生物处理组件流体连通的容器,该容器用于容纳输出容器,该输出容器用于容纳纯化形式的靶蛋白。
在一个实施例中,设备包含用于自动化蛋白纯化系统的消耗性纯化柱。在一些情况下,用于自动化蛋白纯化系统的消耗性纯化柱包括:用于容纳包含靶蛋白或相关蛋白的生物样本的输入储槽;与输入储槽和裂解缓冲液储槽流体连通的第一生物处理组件,该第一生物处理组件用于从生物样本中生成裂解物,该裂解物包含靶蛋白;与第一生物处理组件和洗脱缓冲液储槽流体连通的第二生物处理组件,该第二生物处理组件包含用于保留靶蛋白的支持物或过滤器;与第二生物处理组件流体连通的输出容器,该输出容器用于容纳纯化形式的靶蛋白,其中消耗性纯化柱用于与自动化蛋白纯化系统相关联并自动纯化靶蛋白,而无需人为交互。该消耗性纯化柱可在第二生物处理室或附加生物处理室中另外包含用于柱色谱法、亲和色谱法、凝胶过滤色谱法、离子交换色谱法、快速蛋白液相色谱法或其任意组合的一个或多个组件。在一些情况下,这些组件可位于靶蛋白结合支架的上游。在一些情况下,这些组件中的一种或多种可以包含靶蛋白结合支持物。
在一些实施例中,自动化蛋白纯化系统可另外包括一个或多个控制器,所述控制器包括控制各种流体运动,样本运动,试剂分配和其他过程的计算机化系统。
本公开的蛋白自动纯化设备、系统和消耗性纯化柱可与多种样本兼容使用,例如但不限于包括生物样本、组织、活检、细胞系、细胞培养物、细胞、细胞悬液、尿液、唾液、脑脊液、血液、血清、血浆,粪便物水溶液、其他体液或渗出物的样本,选自啮齿动物、昆虫、灵长类和人类细胞组成的组的真核细胞,或包含原核细胞、细菌细胞、酵母细胞等的原核细胞或细胞悬浮液。
在一些实施例中,第一生物处理组件包括澄清过滤器。在一些情况下,澄清过滤器与输入储槽和裂解缓冲液储槽流体连通,所述澄清过滤器被用于将含有蛋白的靶蛋白部分与生物样本的第一废物部分分离。
在生物样本包含多个细胞的细胞系或组织的情况下,含靶蛋白的部分在细胞系或组织中包含蛋白,且第一废物部分包含裂解的细胞,并可选地包含培养基。
在一些实施例中,第一生物处理组件包括细胞捕获或浓缩过滤器。在一些实施例中,细胞捕获或浓缩过滤器设置在澄清过滤器的上游。在细胞捕获或浓缩过滤器与所述输入储槽和裂解缓冲液储槽流体连通的情况下,所述澄清过滤器用于将含有蛋白的靶蛋白部分与生物样本的第一废物部分分离。
在一些实施例中,所述设备还包括一个或多个额外的含蛋白纯化试剂的生物处理室。在一些情况下,所述设备内的一个或多个过滤器包含中空纤维过滤器。
例如,本公开的示例性自动化蛋白纯化设备,系统和消耗性纯化柱可以包括具有至少一种裂解剂和脱氧核糖核酸酶的裂解缓冲液。在一些实施例中,本文所述的自动化蛋白纯化系统可另外包括切割缓冲液和蛋白水解酶(例如,tev蛋白酶),从靶蛋白去除亲和标签。例如,可以使经dnase处理的裂解物通过结合给定亲和标签的柱子或过滤器,并在洗涤柱体后,使用裂解缓冲液和蛋白水解酶从柱体/过滤器中释放靶蛋白。可以进一步纯化或收集已消化的靶蛋白。
本文公开的蛋白纯化系统和设备可以另外包括流体释放系统或与流体释放系统相关联,以保持和选择性释放流体。这种示例性系统可包括柔性垫圈、布置在柔性垫圈第一侧的用于容纳流体的储槽、布置在柔性垫圈和流体储槽之间的易碎密封件,以及布置在柔性垫圈第二侧的执行机构,该执行机构可操作来偏转柔性垫圈并使易碎密封件破裂,从而选择性地释放储槽中的流体。
此外,在一些实施例中,流体释放系统包括柔性排气孔,设置在柔性排气孔的第一侧上的易碎气体密封件以及设置在柔性排气孔的第二侧上的排气执行机构。排气执行机构可操作来选择性地朝易碎气体密封件偏转排气孔,从而使易碎气体密封件破裂,将空气排入储槽。
流体释放系统可与本文公开的任何数量或类型的混合室或储槽相关联,并可使流体在适当的时间从这些室/储槽中选择性释放,从而影响蛋白纯化系统和相关联的纯化柱内的不同过程和流体运动。因此,本公开的实施例还包括用于选择性释放流体的自动化系统,其中至少一个组件可由自动化蛋白纯化系统操作,以及所公开的流体释放系统的至少一个其他组件包括在用于与自动蛋白纯化系统一起使用的生物样本纯化柱内。
用于在自动化过程中选择性地从储槽释放流体的方法可包括使柔性垫圈与执行机构接触,移动执行机构以使柔性垫圈朝向与储槽相关的易碎密封件偏转,并导致柔性垫圈破坏脆弱密封,从而释放储槽中的液体。
用于选择性地从储槽释放流体的方法可另包括使柔性通风口与排气执行机构接触,移动排气孔执行机构以使柔性通风口朝向易碎气体密封件偏转,并导致柔性通风口破坏脆弱气封。
本公开所述的系统,方法和设备还可包括用于流体的受控运动的设备。设备可以包括第一外层,该第一外层具有包括一系列通道的第一侧以及第二侧。设备可以另外包括布置成与第一外层的第一侧相对的第二外层,以及布置在第一和第二外层之间的弹性体层。弹性体层可以包括与该一系列通道相对应的密封骨条结构,并且可以用于当弹性体层在第一和第二外层之间压缩时流体地分隔通道。
在一些实施例中,所述设备可以另外包括在弹性体层与第一外部层或第二外部层之一或两者之间的标称间隙,使得当弹性体层被压缩在第一外部层和第二外部层之间时,压缩的部分被压缩。密封骨条在额定间隙内移动。另外,或可替代地,设备可包括与一系列通道相关联的阀门,该阀门可选择性地在关闭位置和打开位置之间移动,以分别限制或允许流体流过阀门。
在一些实施例中,所述设备的孔径可提供对所述弹性体层的可偏转部分的接入,所述可偏转部分包括从所述弹性体层向所述第一外层延伸的阀门密封骨条。阀门密封骨条在阀门处于关闭位置时,可与第一外层接触,在阀门处于打开位置时,可与第一外层分离。另外,或可替代地,设备可包括与阀门的可偏转部分接触的柱塞。在这些实施例中,柱塞在尺寸和形状上可用于可通过地进入孔中,以偏转可偏转部分并朝关闭位置移动阀门。
在一个实施例中,所述设备用于承受施加在密封骨条结构整个长度上的至少500lbf的磅力,优选达15,000lbf的磅力。另外,密封骨条结构可被压缩来在泄漏前承受至少30psi,优选至少60psi的流体压力,和/或当弹性体层在第一和第二外层之间压缩时,密封骨条被压缩至少20%,优选至少30%。
本公开的实施例还包括控制流体运动的方法。一种示例性方法可包括将本文公开的用于流体受控运动的设备提供给用于自动纯化靶生物分子(例如靶核酸和/或靶蛋白)的系统,使一个或多个柱塞打开装置内的阀门,使得打开的阀门允许流体连通在一系列通道的上游和下游部分,使泵将流体从上游部分输送到下游部分。本公开所述的用于控制流体运动的方法可另外包括提供包含靶生物分子的生物样本的步骤,并且如在整个申请中所提供的,在一些实施例中,生物样本可以是细胞系中的细胞、细胞培养物、组织、活组织样本、血液、血清、血浆,在真核生物、原核生物或任何其他生物材料中,靶生物分子可以是来自这些细胞的任何靶核酸和/或靶蛋白。
一些实施例描述了包括使用本文所述的设备或系统从细胞裂解物中自动分离或纯化靶蛋白的方法。这种示例性方法可包括在输入储槽处接收生物样本且无需进一步的人类相互作用、在第一生物处理组件中从包含靶蛋白的生物样本生成裂解物的步骤,在第二生物处理组件处接收包含所述裂解物的靶蛋白部分,将所述靶蛋白保留在所述第二生物处理组件处的蛋白结合过滤器或蛋白结合载体上,并且将所述靶蛋白的纯化形式洗脱到输出容器中。
在一些实施例中,所述方法可另外包括在所述第一生物处理组件的第一膜处捕获所述生物样本的细胞内容物并将所述细胞内容物的至少一部分重新投入重悬缓冲液、脱氧核糖核酸酶溶液、或裂解缓冲液中。重悬所述细胞内容物的至少一部分可包括例如通过转移重悬溶液来反洗第一膜,所述重悬溶液可包括重悬缓冲液、核糖核酸酶溶液、脱氧核糖核酸酶溶液或裂解缓冲液中的一种或多种,从设置在所述第一膜的第二侧且穿过所述第一膜的流体通道。
所述方法可另外包括将所述裂解物与中和缓冲剂混合以形成中和裂解物并从中和的裂解物的废物部分中分离出含有靶蛋白的部分。在一些实施例中,所述方法包括将内毒素去除缓冲液与所述裂解物中含蛋白的靶蛋白部分混合。
所述方法可以另外包括一个或多个附加步骤,该步骤使含靶蛋白的裂解物与附加蛋白纯化/分离试剂接触,并将靶蛋白捕获在可以结合靶蛋白的支持物或过滤器滤膜上。分离靶蛋白的方法的其他步骤可包括柱色谱法,亲和色谱法,凝胶过滤色谱法,离子交换色谱法,快速蛋白液相色谱法或其任意组合中的一种或多种。然后可以从支持物或过滤器上洗脱靶蛋白,用于下游进一步的加工或使用。
因此,公开了用于从生物样本中自动纯化靶蛋白的系统、方法和装置。
本摘要旨在以简化的形式介绍一系列概念,这些概念将在下面进一步详细描述。本摘要不用作标识所述权利要求主题的关键特征或必要特征,也用作对所述权利要求的主题的范围的指示。
本公开的附加特征和优点将在下面的描述中进行阐述,从该描述中一定程度上可明显体现,或者可以通过实践予以揭示。本公开的特征和优点可通过所附权利要求中特别指出的仪器和组合来实现。通过以下描述和所附权利要求,本公开所述特征及其他特征将变得更加明显,或者可以通过下文所述的本公开的实践来学习。
附图说明
为获得所述方式以及本公开的其他优点和特征,请参考附图中所示的具体实施例来对上述公开进行更具体的描述。应理解为,这些附图仅描绘了本公开的典型实施例,因此不应被视为对其范围的限制。
附图中,编号可能包括附加的单独字母,例如图3a。本公开将通过附图对附加的特性和细节进行描述和解释,其中:
图1示出了用于从生物样本中自动纯化靶生物分子(例如靶核酸和/或靶蛋白)的通用系统;
图2示出了示例性纯化柱的各种组件,这些组件用于从生物样本中自动纯化靶生物分子的系统中,例如靶核酸和/或靶蛋白;
图3a示出了从生物样本中自动纯化靶核酸的系统内使用的示例性纯化柱的各种组件;
图3b示出了基于图3a所示纯化柱的示例性纯化柱,其在第一和第二生物处理组件中的每个中配有一个过滤器;
图3c示出了基于图3a所示纯化柱的另一个示例性纯化柱,其在第一生物处理组件中配有两个过滤器,在第二生物处理组件中配有一个过滤器;
图3d示出了基于图3a所示纯化柱的另一个示例性纯化柱,其在第一生物处理组件中配有一个过滤器,在第二生物处理组件中配有两个过滤器;
图3e示出了基于图3a所示纯化柱的另一个示例性纯化柱,其在第一和第二生物处理组件中的每个中配有两个过滤器;
图4示出了用于从生物样本中自动纯化靶核酸的纯化柱的示例性布置图,所述纯化柱包括输入储槽、各种生物处理组件和相关膜、过滤器、混合室、缓冲/试剂储槽、泵、阀门、导管,输出容器,用于容纳输入生物样本中经纯化的靶核酸;
图5a至图5k按顺序示出了在相关纯化仪器作用下样本和各种流体通过示例性纯化柱的运动;
图6示出了纯化柱容器的示例性实施例,其用于容纳用于接收经纯化靶核酸的输出容器;
图7a示出了用于从生物样本中自动纯化靶核酸的系统的示例性纯化柱的另一实施例;
图7b示出了用于从生物样本中自动纯化靶核酸的系统的示例性纯化柱的另一实施例;
图7c示出了用于从生物样本中自动纯化靶核酸的系统的示例性纯化柱的另一实施例;
图8a至图8c示出了一种流体释放系统的示例性实施例,其用于保持和选择性地从纯化柱内的储槽或混合室释放流体;
图9a和9b示出了用于选择性地将空气排放到纯化柱的相关联的储槽或混合室的柔性排气孔的示例性实施例;
图10示出了能够自动核酸纯化的纯化仪器的示例性实施例;
图11a和图11b示出了夹紧机构,所述夹紧机构可作为纯化仪器的一部分,用于对插入的纯化柱施加压缩力,使其在纯化过程中保持纯化柱流体密封的完整性;
图12示出了纯化仪器的后视图,示出了用于手动夹具释放机构的切入点。
图13从仪器内部隔室的角度示出了检修门锁定机构。
图14示出了检修门传感器组件的实施例。
图15示出了纯化柱位置传感器组件。
图16示出了输出容器存在传感器组件。
图17示出了光密度传感器的实施例,该光密度传感器可包括在测量插入纯化柱中的生物样本的光密度的仪器中;
图18a和图18b示出了泵送组件,该组件可作为纯化仪器的一部分,用于沿插入的纯化柱的流体路径移动和引导流体。
图19a至19f依次示出了与流体通道啮合的泵组件驱动后流体通过纯化柱流体通道的运动;
图20a示出了控制系统,该系统可包括在仪器中,并用于控制仪器的各种组件、接收用户输入、显示数据以及与其他计算机设备和/或网络通信;
图20b示出了可由图20a的控制系统实现的示例性方法,以至少部分地基于所接收的传感器数据选择一种纯化方案并执行选定纯化方案;
图21示出了示例性核酸纯化柱的平面图,所述纯化柱具有密封骨条结构,用于限定和密封柱的各种流体通道;
图22示出了柱体流体通道的横截面图,显示有弹性体层,密封骨条布置在两个外部层之间;
图23a和23b示出了夹紧纯化柱从而压缩密封骨条结构,并为纯化过程提供足够密封;
图24示出了阀门机构,所述阀门机构利用弹性体层提供气配机构;.
图25示出了对使用本公开示例性系统和核酸纯化柱分离的质粒产物进行的琼脂糖凝胶分析。
具体实施方式
在详细描述本公开的各种实施例之前,需要理解的是,本公开不限于特定举例的系统、方法、设备、产品、工艺和/或组件的参数,当然,所述参数可能会有所不同。因此,虽然将参考特定结构、参数、组件、元件等详细描述本公开的某些实施例,但是这些描述是说明性的,并且不应被解释为限制所要求保护的发明的范围。此外,本文使用的术语是为了描述实施例,并不一定是为了限制发明权利要求的范围。
此外,对于本文描述的任何给定组件或实施例,除非有明确或隐含的理解或另有说明,否则应理解为该组件列出的任何可能的候选或备选方案通常可以单独使用或相互结合使用。此外,除非有明确的理解或另有说明,任何此类候选或备选方案清单均仅为说明,而不具有限制性。
此外,除非另有说明,在专利说明书和权利要求书中使用的表示数量、成分、距离或其他测量值的数字应被理解为经过本文定义的“大约”一词的修饰。因此,除非另有说明,否则专利说明书和所附权利要求书中所列的数值参数均为近似值,该近似值可能随本文提出的标的物所寻求获得的预期特性而有所不同。至少,不应试图将等效原则的应用限制在权利要求的范围内,每个数值参数至少应根据所报告的有效数字的数目和应用普通的四舍五入法进行理解。尽管本文提出的数值范围和参数说明了标的物的广泛范围是近似值,但具体例子中所述的数值却是尽可能精确地报告的。然而,任何数值都必然包含一定程度的误差,这些误差来自于各自测试测量中的标准偏差。
本文所使用的任何标题和副标题仅用于组织目的,并不意味着用于限制说明或权利要求的范围。
示例性靶生物分子纯化系统的概述和优势
正如上文所提供的那样,有一些缺点和问题是可以解决的,比如靶生物分子的自动纯化,包括靶核酸和/或靶蛋白,特别是用于处理大样本量。对于能够自动化靶生物分子纯化过程的系统、方法和装置有这突出的需求,例如纯化靶核酸和/或靶蛋白的各自过程。特别是,对于能够将纯化过程所有阶段整合到单一的可消耗元件中,限制或消除用户在纯化过程中的干预的系统、方法和装置,存在着突出的需求。
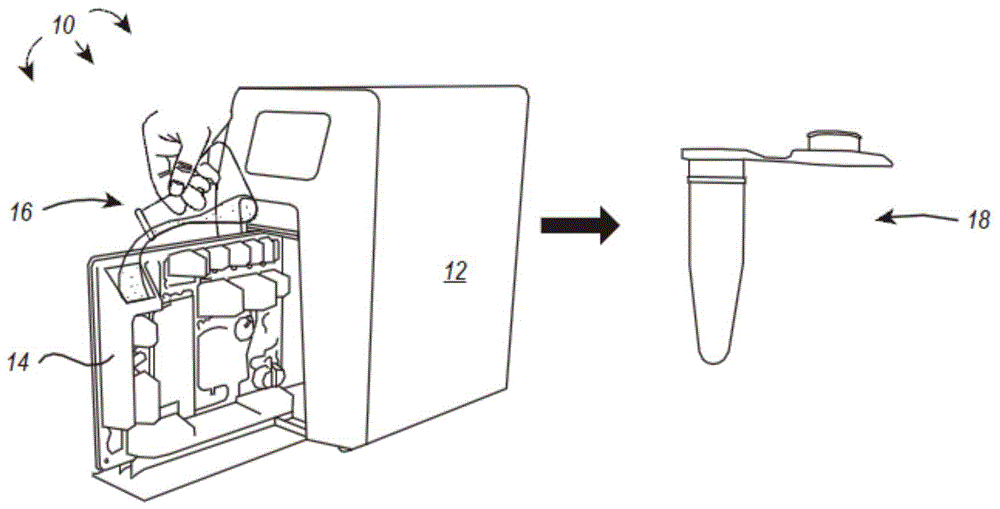
本公开的实施例解决了自动化靶生物分子纯化技术中的一个或多个上述问题。例如,如图1所示,用于自动纯化靶生物分子(如靶核酸和/或靶蛋白)的系统10,可以联合使用纯化仪器12和纯化柱14来从生物样本中把靶生物分子进行分离和纯化,且存在有限的用户交互。在优选实施例中,用户将含有靶生物分子的生物样本16添加到纯化柱14中,并将纯化柱14加载到纯化仪器12中,在此,靶生物分子随后被自动分离、纯化并沉积到与系统10相关联的输出容器18中——所有这些都不需要用户与系统的进一步交互。通过这种方式,本公开的靶生物分子纯化系统(如本文公开的核酸纯化系统和蛋白纯化系统)可以包括一个自给系统。在一些实施例中,与手动方法相比,本公开的靶生物分子纯化设备和系统可以在更短的时间内实现完全自动化的大规模靶生物分子纯化(例如,从100-200ml细菌培养输入的无内毒素最大尺度质粒dna纯化或从500ml真核细胞培养输入的重组药物蛋白纯化)。在一些情况下,所公开的系统可以在不到一个小时的时间内自动分离和纯化靶生物分子(例如,纯化靶核酸的总运行时间约为45分钟,而设置时间只有约2分钟)。
通过实施所公开的系统、方法和装置,可以实现额外的好处。例如,本文所公开的系统可以包括一种便携式台式仪器,该仪器坚固且能够处理不同输入密度的生物样本(例如,细菌培养物、真核细胞培养物、临床样本、食品/饮料样本或环境样本),并且能够实现靶生物分子的高纯度,例如高纯度核酸(在从细菌培养物中纯化的质粒dna情况下为“低内毒素”或“无内毒素”)。在一些实施例中,纯化仪器可以是云端启用的以及“智能”的,具有内置的光学密度传感器和通信硬件和软件,其用于根据光学密度(例如,a600)读出和/或接收的输入样本类型,通知用户输入培养物密度和/或动态触发不同的纯化方案。
所公开的系统、方法和装置的其他优点包括,例如,将所有试剂、过滤器、泵、流体通道、输入储槽、废物储槽和最终输出容器集成到一个纯化柱中的一体式纯化柱设计。这就可以将用户的互动限制在系统的单一组件上,从而减少错误,提高一致性,并且大大减少靶生物分子纯化过程中的动手时间。此外,所公开的系统更容易使用,因此可以减少从生物样本中纯化靶生物分子而所需的技术专长或技术秘密。
这与手动试剂盒形成了强烈的对比。手动试剂盒需要技术专业的使用者获取和操作几种试剂、纯化柱、离心机、移液器、移液器吸头、中间容器和最终输出容器。同样地,手动和半自动系统也需要大量的、由用户操作的消耗元件,以完成对核酸和/或蛋白等生物分子的纯化。与手动过程不同(手动过程需要用户与打开的试剂容器进行交互),所公开的纯化柱允许试剂在设置和纯化的步骤中保持密封。本公开的一些实施例,还可以在纯化过程中的各种适当时间内自动释放试剂,这是对先前手动和半自动过程的改进,这些过程需要用户在执行方案之前和/或执行方案期间,打破试剂密封或直接访问试剂。
在一些实施例中,纯化柱是系统内的消耗性和一次性元件,在一些情况下,这可以导致与先有技术套件和系统相比成本较低的消耗品。例如,在一些实施例中,纯化柱是用热成型塑料制成的,或者结合了热成型塑料。使用热成型塑料而不是成本较高的注塑工艺,可以为生成消耗性纯化柱提供成本较低、体积较大的解决方案。由于制造成本降低,热成型塑料一直被用作传统的包装材料。在本公开的实施例中,其中的纯化柱是用热成型塑料制成的,或包括了热成型塑料,这样的设计标准代表了与典型应用的重大差异,因为产品本身是由热成型塑料制成的,而不是像常规的那样,产品的包装由热成型塑料制成。出乎意料的是,热成型塑料的使用产生了一种合适的、非反应性的纯化柱系统,降低了成本,其实用性也没有出现实质性的损失。
作为另外一个示例,一些实施例组合使用纯化仪器和纯化柱,在纯化柱内形成流体密封。这种形式的密封,可以使得制造方法更加便宜和简单,因为,例如,纯化柱不包含传统的、冗长的流体密封,而流体密封通常由昂贵的、复杂的超声波焊接而形成的。这一点,与成本大大降低的热成型进行分离或者结合,可以大大降低纯化柱的成本和制造时间。
此外,纯化柱的实施例也可以包括夹在两个热成型外层之间的弹性体层。在这种利用两个热成型层之间的弹性体层的实施例中,弹性体层可以用作阀体,允许在制造中可以更简单地组装消耗品,因为阀体只使用一个组件,而不是每个阀体都需要单个组件。这种设计还可以实现非常简单、可靠的单轴执行机构。例如,弹性体的天然弹性和其倾向于回弹至原状的特性,也允许执行机构在不施加相反的力和/或在没有相反的执行机构情况下,通过压住弹性体或从弹性体释放压力来实现变化(例如,阀控或释放纯化柱内的流体),这就简化了系统内的阀门、流体流动控制和执行。
纯化柱
以下公开涉及了一种纯化柱的示例性实施例,该纯化柱可用于从生物样本中进行靶生物分子的自动纯化,如靶核酸和/或靶蛋白。纯化柱可与本文所述的其它组件和/或仪器一起使用。例如,纯化柱可以配置为被纯化仪器所接收并与其对接,诸如图1中所描述和说明的仪器12,或本文所述的任何其他纯化仪器。
纯化柱概述
如上所述,传统的靶生物分子纯化程序,如核酸纯化和/或蛋白纯化程序,都是人工实验室过程,需要相对较高的实验室技术人员的专业知识和时间。虽然训练有素的实验室技术人员可能能够处理该过程中所涉及的各种操作参数,但是,对于能够实现靶生物分子纯化过程自动化(如核酸纯化和/或蛋白纯化)的系统、方法和装置,特别是那些能够将靶生物分子纯化过程中的所有阶段整合到单个消耗元件中,从而限制或消除用户在纯化过程中的干预的系统、方法和装置来说,有着突出的需求。
出于几个原因,设计一种能够有效地实现大部分过程自动化的一次性纯化柱是具有挑战性的。例如,用于执行核酸和/或蛋白纯化过程所有阶段的纯化柱,应该能够贮存和及时分配(或者以其他方式根据需要进行获取和分配)与各自纯化方案相关的各种试剂和缓冲液。纯化柱还应该能够或者用于移动和输送不同粘度和密度的流体,通常与分配适当的试剂和/或缓冲剂一起,将不同的流体混合在一起,并控制流体通过和/或经过适当的过滤器或膜。这样的纯化柱也应该是用户可以进行安全操作的,并且能够在整个生物分子的纯化过程中保持适当的液体分离/密封。
如下文更详细地描述的那样,本文所述的纯化柱能够满足上述挑战中的一个或多个。例如,纯化柱可以配置成与纯化仪器相关联的,从而可以让用户将包含靶生物分子(例如靶核酸和/或靶蛋白)的生物样本加载到纯化柱中,并将纯化柱插入到仪器中,即出现靶生物分子的被分离和纯化,而无需用户的进一步交互,从而提供了可以执行生物分子纯化过程所有阶段的纯化柱。
作为另一个示例,本文所公开的纯化柱可以是自足的溶液,在单独的储槽中整合了生物分子纯化(例如核酸纯化和/或蛋白纯化)所需的各种缓冲液和试剂,并以这样的方式,在生物分子纯化过程中的适当时间中选择性地进行释放。此外,本文所公开的纯化柱可以配置有多个相互连接和合作的导管、阀门和泵,以便在生物分子的纯化过程中,在整个纯化柱中移动和导送不同粘度和密度的流体。纯化柱还可包括装有磁力搅拌棒的混合室,该混合室与纯化柱导管和储槽进流体连通,以便在整个纯化过程中提供均匀的混合物。此外,如下面所提供的那样,本公开的纯化柱可以安全地密封为自给式消耗品,增加了使用者的安全性,降低了试剂/缓冲液的污染风险,并增加了自动生物分子纯化过程中的易用性。
图2示出了用于某一系统内、从生物样本中进行靶生物分子(例如,靶核酸和/或靶蛋白)自动纯化的示例性纯化柱20的一般特征及其组件。如图所示,纯化柱20包括输入储槽22,该输入储槽用于容纳含有靶生物分子的生物样本。在一些实施例中,本文公开的纯化柱,包括图2中所示的纯化柱20,优选用于处理大体积样本。相应地,输入储槽22的大小和形状可以接收约5ml-5l的生物样本。在一些实施例中,输入储槽可以用于容纳至少10ml生物样本、至少50ml生物样本、至少100ml生物样本、至少150ml生物样本、至少200ml生物样本、至少250ml生物样本或至少500ml生物样本。在相同或替代的实施例中,输入储槽可以用于容纳小于50ml、小于100ml的生物样本、小于150ml的生物样本、小于200ml的生物样本、小于250ml的生物样本、小于500ml的生物样本、小于1l的生物样本、小于2l的生物样本,或者小于5l的生物样本。应当认识到,输入储槽的大小和形状可定为接收一定体积的生物样本,所述样本体积处于从上述最小和最大体积中选择的具有下限和上限的体积范围内。还应当认识到,本公开的系统、设备和纯化柱可以按比例缩小,并且可以改变大小和形状,以便处理比上文所公开的样本体积小的样本体积。
在优选实施例中,输入储槽的大小和形状被定为可接收含质粒dna——靶核酸的50ml–250ml细菌培养物。输入储槽22还可用于为接收其他生物样本,如其他细胞培养物、真核细胞培养物、临床样本或环境样本。在一个实施例中,输入储槽22被用于容纳最高达1l、最高达1.5l、最高达2l的临床样本,或以上列举的任意体积范围的临床样本,如尿液,排泄物水溶液,或其他体液或渗出物。输入储槽22还可另外或替代性地用于容纳大体积的环境样本,如水样或类似的样本。
除输入储槽22外,柱20还可另外包括至少两个生物处理组件24、30。第一生物处理组件24可以与输入储槽22流体连通,并且可以用于从包含靶生物分子的生物样本生成裂解物。例如,所述第一生物处理组件24可与裂解缓冲槽进行流体连通,以便输入储槽22中的生物样本可与裂解缓冲液储槽在第一生物处理组件24汇合,以生成包含靶生物分子的裂解物。所述第二生物处理组件30可与所述第一生物处理组件24流体连通,该组件可包括用于保留靶生物分子的生物分子结合过滤器(例如,靶核酸结合过滤器和/或靶蛋白结合过滤器)。
柱20可另外包括多个与第一和/或第二生物处理组件24、30流体连接的试剂和缓冲剂28,以及一系列阀门和泵26,用于在自动纯化过程中协调各种流体在柱20中的移动。应认识到,当使用本发明的泵时,本公开的泵可通过例如连接柱体内生物处理组件的通道推动和/或拉动流体(例如,可施加正压力和/或负压)来协调柱体内各种流体的运动。这可以通过将泵战略性地放置在生物处理组件内部和/或之间来实现,使泵位于待移动的流体的上游和/或下游。例如,放置在流体上游的泵可以推动流体通过柱子,放置在流体下游的泵可以拉动流体通过柱子。应该认识到,在纯化过程中,可以使用单泵在一个步骤中拉动液体,在另一个步骤中推动液体。例如,在纯化过程的第一步,可以在柱内安装一个阀门,使流体通过过滤器/过滤膜,在纯化过程的后一步,阀门的作用是推动流体通过相同或不同的过滤器/过滤膜。
继续参考图2,所述柱20还可包括与所述第二生物处理组件流体连通的容器,所述第二生物处理组件用于容纳收集纯化形式的靶生物分子的输出容器34。
图2所示的纯化柱20显示为可选地包括废物储槽32。在一些实施例中,在纯化过程中产生的废物可以被捕获并贮存在纯化柱中。这将有益地使柱20成为独立的一次性生物样本纯化柱,并且通过收集纯化过程中纯化柱内产生的所有废物,可以有益地减少使用者对这些废物的接触,并隔离各种化学品和溶液以及可转移容器。此外,通过收集废物于纯化柱内,纯化仪器不暴露于也不接触废物,这减少了使用同一仪器的样本之间交叉污染的可能性。
现在参考图3a,该图示出另一示例性纯化柱36的各种组件,其用于靶核酸的自动纯化的系统内。与图2所示的纯化柱20类似,图3a所示的纯化柱36包括输入储槽38、第一生物处理组件40、第二生物处理组件56、各种试剂和缓冲液(例如,裂解缓冲液、中和缓冲液、rnasea、重悬缓冲液、ipa、乙醇、te缓冲液、er冲洗缓冲液、洗涤缓冲液、洗脱缓冲液,高离液盐缓冲液)和输出容器82。尽管没有显示,但图3a所示的纯化柱36可能还包括一系列阀门和泵,用于在自动纯化过程中协调整个纯化柱36的各种流体的运动。如上文关于图2所述,阀门和泵可用于推动和/或拉动流体穿过纯化柱,其中一些实施例可包括一系列在空间上配置在泵和过滤器/过滤膜上游和下游的阀门,使得泵的操作可导致流体通过过滤器/过滤膜纯化过程中的一个步骤,并在纯化过程中的不同步骤中通过膜。
继续参考图3a,所示出的纯化柱36表示本公开范围内设想的各种示例性纯化柱的集合。应该认识到,纯化柱36内所示的组件之间的空间结构和流动,并不是决定本文公开的构造和组织纯化柱的的唯一方法。相反,所公开的结构在性质上是示例性的,并且旨在作为示意图来帮助描述在本公开范围内设想的可能的代表性结构和纯化柱的组件。如图3a所示,虚线框和箭头表示可能在本文公开的示例性纯化柱中使用的组件的添加或选择。图3b-3e中提供了一些示例性选择和结构,用以更具体地说明图3a中所公开的内容。
一般而言,图3a中广泛描述并在图3b-3e中详细说明的各种可能的纯化柱结构遵循类似的处理方案。如图3a所示,第一生物处理组件40流体连接到输入储槽38。通过激活一系列阀门和泵,在输入储槽38内接收到的生物样本可以转移到第一生物处理组件40内并在其中处理。应该认识到,在一些实施例中,输入储槽38是第一生物处理组件40的一个组件,在第一生物处理组件40内执行的一个或多个纯化步骤可以在输入储槽38内或使用该输入储槽38进行。例如,最初的纯化步骤可能包括生物样本的均质化。生物样本可能含有固体或颗粒物质,而在提供的介质和/或应用的水缓冲液/溶剂中,减小固体或颗粒物质的粒度或更均匀地混合对纯化过程有益。
因此,在一些实施例中,生物样本在输入储槽38和/或作为第一生物处理组件40中的预处理步骤进行均质化。这可以通过本领域已知的任何方法来实现,例如包括使用磁性搅拌棒、高功率打珠、振动、涡流或类似方式。例如,可以将粪便或土壤样本添加到输入储槽中(同时或通过随后添加介质和/或水缓冲液/溶剂),生物样本在其中被均质并转移到第一生物处理组件。附加的或替代的均质化步骤可以在第一生物处理组件40内实施,并且可以与生物样本的细胞内容物的溶解相结合。生物样本可与封装在裂解缓冲室42内的裂解缓冲液组合以实现细胞内容物的裂解,并且在一些实施例中,激活均匀化组分,以使裂解的样本均匀化。
在第一生物处理组件40中,通过使用一个或多个过滤器/过滤膜,从细胞内容物和废物介质中部分纯化生物样本中的靶核酸。一般来说,这包括在细胞物质溶解和中和后分离靶核酸。例如,保存在裂解缓冲室42内的裂解缓冲液可与混合室44中的生物样本连接以形成裂解物。来自中和缓冲室46的中和缓冲液,例如可在混合室44中与裂解物组合并通过澄清过滤器52,从而从生物样本的废物部分分离含有生物样本部分54的靶核酸。
如本文所用的术语“过滤器”或“膜”包括任何尺寸选择和/或带电半透性屏障,其可用于从溶液中选择或分离一个或多个组分。这包括选用合适尺寸滤纸或材料的薄膜或柱。它还包括其他方式的过滤方法,如亲和柱、珠子(例如钢、玻璃、氧化锆,或任何合适尺寸的其他合适材料,直径最好在0.1毫米至2毫米之间),或通过该工艺而获知的其他方法。
然后,部分纯化的靶核酸可以转移至流体连接的第二生物处理组件,在那里,部分纯化的靶核酸进一步纯化和浓缩,最终收集在一个输出容器82中以作为纯化的靶核酸。在第一和第二生物处理组件内的纯化步骤可以高效完成,几乎无需用户交互处理。
上述通用纯化过程将在各种典型纯化柱的说明文字部分进行详述,如图3b-3e所示。
如图3b示出了一个用于从生物样本中自动纯化靶核酸系统的纯化柱的一个实施例。纯化柱36a在第一和第二生物处理组件40a、56a中各配有一个单一过滤器。具体而言,所示筒体36a的第一生物处理组件40a包括单个过滤器52a,其用于从细胞组分和介质中过滤生物样本中所含有的靶核酸部分。例如,该过滤器可以是具有适合于分离特定靶核酸的选用合适尺寸和材料的过滤器。上述非限制性示例包括5μm尼龙过滤器。
在图3b的纯化柱36a的实施例实现过程中,生物样本可以通过输入储槽38,并通过第一步生物处理组件40a的过滤器52a从而去除样本中中的介质。经过这个过程,生物样本的细胞部分会被保留在过滤器52a中。与过滤器52a相关的细胞,可以使用纯化柱40a的裂解缓冲室42中的裂解缓冲液进行裂解从而形成裂解物。值得注意的是,裂解缓冲液可以将细胞施加到过滤器52a的细胞捕获侧从而在过滤器52a中洗脱细胞。或者亦可以将裂解缓冲液从过滤器52a的背面推入(例如通过过滤器52相反侧洗脱细胞,然后在混合室44中与生物样本结合形成裂解物。来自中和缓冲室46的中和缓冲液可在混合室44中与裂解物组合并进入过滤器52a,从而在生物样本的废物部分分离出含有生物样本部分54的靶核酸。
如图3b中的进一步说明,含有生物样本部分54的靶核酸可被转移(例如,使用与纯化柱36a的基础设施相关联的泵和阀门)至第二生物处理组件56a,其中第二生物处理组件56a与单个过滤器或膜系统76相耦合。例如,单个过滤器或膜系统76包括一个硅基过滤器78。在该实施例中,裂解物中含有靶核酸的部分54可使用从朝向性盐缓冲室80自动获得的朝向性盐缓冲液进行预处理,以促进靶核酸与硅基过滤器78的结合。一旦与硅基过滤器78结合,靶核酸可通过清洗缓冲室66的冲洗缓冲液进行自动释放和转移,并通过硅基过滤器78进行一系列洗涤。上述洗涤步骤产生的废物可转移至废物储槽72。洗涤后的靶核酸可使用本技术已知的任何适当的低盐洗脱缓冲液在硅基过滤器78中洗脱,并以纯化靶核酸84的形式进入输出容器82。
在一些实施例中,上文所述第一生物处理组件可具有多个过滤器。例如,图3c所示的另一典型的纯化柱36b,其在第一生物处理组件40b中配有过滤器48和过滤器52,该第一生物处理组件40b与图3b所示相同的第二生物处理组件56a(具有单个过滤器)相耦合。
如图3c所示,第一生物处理组件40b还可包含细胞捕获过滤器48。在第一生物处理组件40b处接收到的生物样本可通过细胞捕获过滤器48移除生物样本的非靶核酸部分。例如,在以细菌培养物作为生物样本的实施例中,细胞捕获过滤器48可将细菌细胞保留在细胞捕获过滤器48处,同时允许将培养上清液送至废物储槽50中。来自裂解缓冲室54的裂解缓冲液或重悬缓冲液可进入细胞捕获过滤器48,通过细胞捕获过滤器48移除细胞并将其转移至混合室44中的含有细胞的溶液从而形成裂解物。中和缓冲室46可与混合室44流体连通,并且中和缓冲液继而可转移至混合室44,并在混合室44中对裂解物进行中和。中和裂解物继而可通过澄清过滤器52以从裂解物的废物部分分离出含有裂解物部分54的靶核酸。在细菌培养的运行示例中,上述裂解物的废物部分包括已裂解细菌细胞的细胞组分以及细菌基因组dna。
需要说明的是,虽然以细菌培养物作为生物样本进行举例说明,但使用本例是为了便于说明所公开的纯化柱的结构特征。生物样本亦可是其他样本,如污垢样本、临床或法医样本(如粪便、血液、唾液、尿液等)、水样本,或具有靶核酸的其他样本。
纯化柱36b的第一生物处理组件40b流体连接到第二生物处理组件56a,并且如上所述,包含生物样本的靶核酸内容物部分54可以从第一生物处理组件40b转移到第二生物处理组件56a,在此它作为纯化的靶核酸84与单个过滤器/过滤膜系统76结合、冲洗和洗脱。
图3d显示了另一个示例性纯化柱36c。所示的纯化柱36c在第一生物处理组件40a中配有单个过滤器52a(类似于图3b中所示和讨论的过滤器)和第二生物处理组件58b中的两个过滤器。裂解物靶核酸内容物部分54与第二生物处理组件56b内的靶核酸捕获过滤器58b结合。在与过滤器58b结合之前,根据“低内毒素”或“无内毒素”纯化方案,裂解物靶核酸内容物部分54可以视需要可选地以内毒素去除(er)缓冲液来处理(例如,从er冲洗缓冲液室64处理)。一旦与靶核酸捕获过滤器58b结合,则将靶核酸以纯化靶核酸84的形式冲洗并洗脱到输出容器82中。冲洗结合到捕获过滤器58的靶核酸可以包括,例如,用捕获过滤器58b过滤各种冲洗缓冲液或含有异丙醇或乙醇的水溶液并装入废物储槽72。这些冲洗缓冲液自动从与捕获过滤器58b流体连通的一个或多个冲洗缓冲室66释放。以类似的方式,冲洗过的靶核酸可通过例如蒸馏水的自动释放或从与捕获过滤器58b流体连接的dh2o/洗脱缓冲室74获得的洗脱缓冲液中,从捕获过滤器58b中洗脱。
如图3d所示,捕获过滤器58b可包括一系列过滤器/过滤膜60。在洗脱到输出容器82之前,裂解物的靶核酸内容物部分54可以被结合并沿着一系列过滤器/过滤膜60冲洗。在一些实施例中,裂解物的靶核酸内容物部分54可在结合该系列过滤器/过滤膜60之前用冲洗缓冲液进行预处理。冲洗缓冲液可以从冲洗缓冲室66自动释放到混合室62中,与裂解物的靶核酸内容物部分54混合。然后,预处理的靶核酸可与阴离子交换膜68结合,再通过让冲洗缓冲液(例如,释放自一个或多个不同的冲洗缓冲室66的冲洗缓冲液)自动流经阴离子交换膜68来执行额外的冲洗步骤。然后,可以从阴离子交换膜68中洗脱靶核酸并结合到沉淀过滤器70以进行额外的冲洗和纯化步骤。
在一些实施例中,标靶核酸从阴离子交换膜68中洗脱并转移至混合室,其中标靶核酸与异丙醇混合并从溶液中沉淀。然后将沉淀的标靶核酸转移至沉淀过滤器70。在该过滤器里,在洗脱到输出容器82之前,通过基于乙醇(例如70%的乙醇)的大量洗涤物进行脱盐。
图3e显示另一个示例性纯化柱36d。纯化柱36d在第一和第二生物处理组件40b和36b各配有两个过滤器。例如,第一生物处理组件40b可以包括图3c所示纯化柱36d的相同的第一生物处理组件40b,第二生物处理组件56b可以包括在图3d所示纯化柱36c的相同的第二台生物处理组件56b。
因此,用于从生物样本中自动纯化核酸的纯化柱可包括二或多生物处理组件,每台生物处理组件与至少一个过滤器/过滤膜相连连关。在一些实施例中,第一生物处理组件可以包括澄清过滤器,或者第一生物处理组件可以包括细胞捕获过滤器和澄清过滤器。相似地,第二生物处理组件可以包括硅基过滤器,或者,第二台生物处理组件可以包括位于阴离子交换膜下游的沉淀膜。用另一种方法表示,第二生物处理组件可包括阴离子交换膜,且纯化柱可另外包括第三生物处理组件,该第三生物处理组件包括沉淀过滤器,用于从阴离子交换膜接收洗脱的靶核酸。
通过示例性纯化柱处理样本
图2和图3中所示和描述的纯化柱具体可以作为图4的示例性纯化柱100。具体而言,图4示出与图示纯化柱100相关联的各种生物处理组件、过滤器/过滤膜、缓冲液/试剂储槽、流体导管、阀门(例如阀门154等;在图5a-5k中也显示为标记为“v”的元件)、密封件(例如密封件156和密封件158等;在图5a-5k中也显示为标记为“l”的元件)、废物储槽和输出容器的局部横截面图。图4所示纯化柱100的各种组件的每一种将在图5a-5k中逐步显示的示例性自动核酸纯化过程中进行讨论。应当理解的是,在整个自动核酸纯化过程中密封和排放液体的机制描述时在下面参考图5a–5k予以更加详细的讨论。
在一个示例性实施例中,图5a-5k的纯化柱100可与本文所述的纯化仪器一起使用,从而对生物样本实施“无需人工操作的”自动化生物处理,同时提供的性能至少与类似的人工处理方法同样优秀,即使不能做到更好。如上所述,当科学家或实验室的技术人员在执行生物样本的人工核酸纯化方案时,会产生人为错误并且缺乏重现性。如果作为一套自动化核酸纯化系统的一部分使用时,纯化柱100(以及本文在此公开的其它纯化柱)可消除或减少在人工核酸纯化过程的再现性不足的人为错误。另外,本文提供的纯化柱可增加使用的便利性,节省劳动时间,降低污染,并且提高执行核酸分离和纯化方案的效率与灵活性。
例如,参考图5a,技术人员、科学家或其他用户可以将生物样本(如含有质粒dna的细菌培养物或其他细胞培养物)添加到培养储槽102里。药筒100可插入纯化仪器中,该纯化仪器已经启动一项核酸纯化方案。以下关于图5a–5k讨论的步骤可以在自动化过程中无需更多的人工交互的情况下执行。为了便于说明和描述,图5a-5k中的组件和处理步骤将参考一种细菌培养物作为生物样本,同时质粒dna作为标靶核酸。应当重视,其他生物样本和标靶核酸可以使用本文公开的自动核酸纯化系统、方法、装置进行处理,并且包括在本发明的范围之内。其次,重要的是,在图4和5a–5k的公开实施例中,在示例性核酸纯化方案中讨论和使用的每种缓冲剂和试剂都包含在虑筒100里。类似地,在即将到来的示例性核酸纯化方案中讨论和使用的每种过滤器/过滤膜都包含在纯化柱100里。在纯化柱里流体的排放、密封和移动通常都通过纯化仪器进行控制和/或启动,具体如下详述。
仍然参考图5a,含有质粒dna的细菌培养物存在培养物储槽102内。在一些实施例中,空气可通过培养储槽102泵送,从而分散任何沉淀的细胞和/或者在从培养物储槽102排放之前使培养物匀化。这在些实施例中尤其有利,其中,在从培养储槽102排放以后,在光密度窗口105处测量培养物的光密度(例如a600),因为可以从均质培养物获得更加准确的读数。例如,培养物的光密度可以报告给用户和/或由仪器使用,显示由于输入材料不足(低od)而预期的低产量,或指示由于系统过载(高od)而导致的低产量。
不管是否进行光密度测量,培养储槽102已经打开(例如,刺穿在培养储槽和流体通道之间易碎密封件),并且将培养储槽102的内容物通过纯化柱100内的流体通道泵送(例如使用泵104)至细胞捕获过滤器106。在细胞捕获过滤器106,在生物样本内的培养基通过过滤器106并进入废物储槽108。在生物样本内含有细菌细胞的质粒dna保留在细胞捕获过滤器106。在一些实施例中,细胞捕获过滤器106可以孔梯度在0.65μm–1.2μm之间的选择过滤器(例如7.5mil厚的尼龙细胞捕获过滤器)。另外,在一些实施例中,细胞捕获过滤器最好能够承受大于20psi、大于30psi、大于40psi或大于60psi的压力而不泄漏,因为在过滤器一侧的电池堆积可能导致出现低流量情况并增加过滤器的压力。在一些实施例中,一种柔顺支撑垫圈(例如一种定位在细胞捕获过滤器的弹性体层)可添加在纯化柱外部各层之间与常驻弹性体层相对的过滤器周界周围,以便在纯化柱和仪器之间提供更好的密封界面。
如图5a的细胞捕获过滤器106的简化横截面示意图(支撑垫圈如元件107所示)所示,过滤器106夹在虑筒100的外层115a和115b之间。生物样本可以从培养储槽102中,以及在第一外层115a和过滤器106的第一侧之间提取。泵104的抽吸或泵送动作使得生物样本内的培养基通过过滤器106并进入过滤器106的第二侧和第二外部层115b之间的空间里。然后培养基沿着流体导管引导并通过打开的阀门进入废物储槽108。
如图5b所示,rnasea可通过穿透将重悬缓冲液储槽110与rnasea储槽112和裂解缓冲液储槽114分离的易碎密封件被动地与重悬缓冲液和溶解缓冲液混合。在一些实施例中,裂解缓冲液储槽114可以具有高架的较大体积,以便容纳rnasea和重悬缓冲液的体积、从重悬缓冲液储槽110通过rnasea储槽112进入裂解缓冲液储槽114的重力流可以允许这些缓冲液和试剂在裂解缓冲液中的被动混合储层114用于创建重悬/裂解缓冲液。
如图5b的细胞捕获过滤器106的嵌入横截面示意图所示,组合的重悬/裂解缓冲溶液可在过滤器106上反洗,以便从过滤器106中重新捕获细胞,将其夹带在重悬/裂解缓冲溶液里,并将含有细胞的溶液转移至第一活性混合室116。如图5b所示,可反转泵104,从而允许在过滤器106上进行反洗,并输送至活性混合室116。
如图5c所示,可以在混合室116的活性混合情况下对重悬/裂解缓冲溶液中的细胞进行裂解。与下面讨论的其他活性混合室一样,第一活性混合室116可以包括一根磁性搅拌棒(或在室116内搅拌和/或混合溶液的其他方式),通过纯化仪器操作在混合室116经过充分混合的内容物。在一些实施例中,磁性搅拌棒可使混合物的搅拌速度达到甚至大于1000rpm。
在混合室116内形成细胞裂解物之后,中和缓冲液可自动从中和缓冲溶液槽118排放到混合室116中(例如,通过刺穿与中和缓冲液储槽118相关的易碎密封件,并允许从中和缓冲溶液槽118被动转移至混合室116)。积极地混合中和缓冲液与裂解物,可以使裂解物的ph值恢复正常,从而使蛋白从裂解物中沉淀出来,并使遗传物质再生。介于其环状的性质,质粒dna可以适当地重生并保持可溶性,而基因组dna由于链的随机结合而崩溃。沉淀的细胞碎片和结合的基因组dna在溶液里不溶,因此可以从溶液里分离出来。
现在参考图5d,可以将较小体积的er缓冲液从er缓冲液储槽124预先排放至第二活性混合室122,以改善随后与后续流体的反应。同时或在释放er缓冲液之前或之后的短时间内,中和裂解物可通过一个澄清过滤器118。澄清的裂解物(即包含裂解物的标靶核酸部分)通过澄清过滤器118提取并用泵120泵送至第二活性混合室122。中和裂解物的含废物部分保留在澄清过滤器118。
在一些实施例中,澄清过滤器在流动过程中容易倒塌并封闭其多孔结构,从而阻止过滤器实现其期望的功能。为了防止这种情况,有些实施例可能包括一种薄的半刚性的、多孔背衬结构代替周边支撑垫片,以在澄清过滤器的范围内提供支撑,并防止澄清过滤器在流动过程中倒塌,从而允许过滤器实施其所需的功能。澄清过滤器可以使用在本领域已知或使用过的任何澄清过滤器,并且适合从中和裂解物的含核酸部分分离出发中和裂解物的含废物部分。例如,澄清过滤器可包括孔径大于约1μm和/或小于约5μm且厚度大于30mil的一种基于玻璃纤维的过滤器。例如,在本公开的纯化柱内使用的澄清过滤器可包括具有4.3μm孔径和45mil厚度的玻璃纤维a过滤器或具有1μm孔径且厚度在43mil–53mil之间的一种玻璃纤维过滤器。基于玻璃纤维的澄清过滤器可与任何合适的半刚性澄清支撑组合使用,例如,孔径大于15μm(例如,孔径在15至45μm之间)的1/16”厚聚乙烯澄清支撑物过滤器。
澄清的裂解物通过澄清过滤器118提取并泵入第二活性混合室122以后,与er缓冲液在其中积极混合。澄清的裂解物/er缓冲溶液可使用上文关于第一活性混合室116或类似物而提供的磁性搅拌棒在第二活性混合室122内进行活性混合,以从澄清的裂解物中除去污染物,提高样本的纯度。
现在参考图5e,澄清的裂解物从第二活性混合室122泵送,并用泵128通过一种阴离子交换膜结构126。澄清的裂解物里的质粒dna由于与带电柱的良好离子相互作用而与阴离子交换膜结构126结合,并且澄清裂解物的含废物部分(即非靶核酸包含部分)通过阴离子交换膜结构126并沉积在废物储槽130。
如图5e的插图横截面示意图所示,阴离子交换膜126的结构旨在通过一堆阴离子交换膜产生一种轴向流。如示例性横截面示意图所示,中间层117和入口侧的第一外部层115a形成约9mm高的近垂直壁。由中间层形成的孔径通过筒体的外层和中间层形成流体通道的入口,进入可以容纳一堆阴离子交换膜126的壳体。当流体通过膜堆126提取时,膜可以离子捕获质粒dna,同时允许废物部分通过过滤器组126并进入废物储槽130。需要指出的是,通过阴离子交换膜126的轴向流可以采用不同的方式或通过使用不同高度的叠层膜予以实施。
在一些实施例中,阴离子交换膜是经硅酮处理的玻璃纤维膜。基于玻璃纤维的阴离子交换膜可以配合任何合适的半刚性支撑使用,例如,孔径大于15μm(例如孔径在15到45μm之间)的1/16”厚聚乙烯支撑过滤器。
中和裂解物通过阴离子交换膜126以后,洗涤缓冲储液储槽132的洗涤缓冲液采用泵128通过阴离子交换膜结构126自动排放和提取,如图5f所示。任何通过阴离子交换膜126的洗涤液都收集在废物储槽130里。在优选实施例中,选择洗涤液以不干扰膜结合的质粒dna为目的,并且用以去除与质粒dna和/或过滤器126相关的多余物质。
现在参考图5g,异丙醇自动从异丙醇储槽138排放到第三活性混合室136,从而改善与后续流体的反应。同时或在异丙醇排放之前或之后的短时间内,洗脱缓冲液可使用128从洗脱缓冲液储槽134自动排放并通过阴离子交换膜结构126。与阴离子交换膜相比,洗脱缓冲液能够提供与质粒dna更好的化学交换作用,超过阴离子交换膜,从而使质粒dna从膜上分离并洗入通过的洗脱缓冲液。该洗脱液通过阴离子交换膜结构126并且用泵送入第三活性混合室136。在第三活性混合室136,由洗脱缓冲液和质粒dna组成的洗脱液与异丙醇混合,从洗脱缓冲液溶液中沉淀质粒dna及数种盐类。
在第三个活性混合室136内形成的沉淀混合物随后通过沉淀膜138,如图5h所示。沉淀混合物中的质粒dna在沉淀器膜内结合(例如基于沉淀器膜的孔径),以及更小的可溶组分以及洗脱缓冲液通过沉淀膜并被收集在废物储槽142中。在一些实施例中,使用孔径大于等于1μm并且用玻璃纤维制成或包括玻璃纤维的沉淀膜。例如,沉淀膜可以包括孔径1μm的玻璃纤维过滤器或16mil厚的玻璃纤维d过滤器。
在一些实施例中,沉淀过滤器可能不会经受与细胞捕获过滤器相同或类似的高压,但是为了确保很少或基本上没有流体流入沉淀过滤器的非活动区域,可以将周界密封与除尘器过滤器相关联。例如,o型环(或其他功能相似的垫圈)可位于纯化柱的外层之间,并且沉淀过滤器的对侧,作为纯化柱的中间层。
沉淀器膜138可使用乙醇基溶液洗涤以溶解和除去质粒dna的盐类(即脱盐)。如图5i所示,70%乙醇溶液可从乙醇储槽144中自动排放,并使用140通过沉淀膜138提取。储槽乙醇洗涤液可以和任何可溶性盐类一起通过沉淀膜138并进入废物储槽142。
现在参考图5j,在乙醇洗涤液通过沉淀器过滤器138以后,泵140可以继续运行。这会导致空气流过沉淀过滤器138,干燥质粒dna,并导致多余液体(尤其乙醇类)蒸发。
经洗涤和干燥的质粒dna可以从沉淀膜138中洗脱并转移到输出容器148,如图5k所示。在这最后的过程中,te缓冲液可以自动从te缓冲液储槽146中排放,并通过泵140的持续作用到达沉淀器膜138,在这里质粒dna从沉淀膜138洗脱并进入通过的te缓冲液。通过闭合和开启纯化柱100内的不同阀门,洗脱质粒dna可以从沉淀膜138进入输出容器148,而不是像之前流经沉淀膜138的液体那样进入废物储槽142。
输出容器148可以是适合接收纯化核酸的任何容器。例如,输出容器148中有一个标准微型离心管。为了保证纯化后的核酸被转移到输出容器中,而非与纯化柱持续关联,纯化柱100可设计成独特的形状,以克服纯化柱材料与纯化核酸之间的表面张力。尤其是这种独特的形状(如图6中的箭头152所示)可以防止或减少纯化核酸附着到纯化柱的115a、115b外壁上而不落入输出容器中。
外壁115a和115b的表面能通常大于弹性中间层117的(例如,外壁可由pvc制成或包含pvc,且pvc的表面能远高于大多数弹性中间材料,如硅胶),这就使得核酸优先附着到外层而非弹性中间层。相应地,输出容器148放置于纯化柱100内,以便将外层115b的中间与输出容器148的中心和/或中轴对齐。在一些实施例中,如此对齐的外层可附上促进液滴形成并沉积到输出容器中的小标签。
一旦输出容器148接收纯化核酸,即表明自动核酸纯化方案完成,而且用户可经一个可及性高的容器区域将输出容器148从纯化柱100中移除。
需要注意的是,上面图4以及图5a-5k中所示的纯化柱100的各种组件的特定构造、大小、形状本质上是示例性的,而其他结构、构造、形状和尺寸均包括在本公开的范围内。例如,如图7a所示,还提供了示例性纯化柱160a的另一实施例,和自动纯化生物样本中靶核酸的系统一起使用。如图所示,纯化柱160a包含许多与图4和图5a-5k中所示的纯化柱100相同或类似的试剂、缓冲液、过滤器和滤膜。但纯化柱160a包含一个单独的废物储槽164,而非是图4和图5a-5k中所示纯化柱100的三个独立废物储槽108、130、142。在废物和纯化柱分开处置的情况下,单个废物储槽(如图7a中的废物储槽164)可以有利地允许用户清空单个废物储槽,而不是进入多个独立废物储槽。
为了进一步说明图7a所示的纯化柱160a与图4和图5a-5k所示纯化柱100之间的差异,纯化柱160a包括一个位于裂解缓冲液储槽114上游和细胞捕获过滤器下游的额外泵162。通过在细胞捕获过滤器的两侧设置泵,例如,当生物样本从培养储槽通过细胞捕获过滤器时,以及在细胞捕获过滤器上反洗重悬/裂解缓冲液时,可以提高吸力。
另外还提供了纯化柱160b的另一种实施例,与自动纯化生物样本中靶核酸的系统一起使用,如图7b所示。如图所示,纯化柱160a包含许多与图4和图5a-5k中所示的纯化柱100和160a相同或类似的试剂、缓冲液、过滤器和滤膜。与图7a所示的纯化柱160a类似,图7b所示的纯化柱160b包括一个单独的废物储槽,而非图4和图5a-5k所示的纯化柱100的三个独立废物储槽。
为了进一步说明图7b所示的纯化柱160b与图7a所示的纯化柱之间的区别,纯化柱160b还配备一个压力传感器161,位于细胞捕获过滤器和第一混合室之间。例如,压力传感器161可在细胞捕获和/或细胞/细胞组分从细胞捕获过滤器的洗脱过程中监测纯化柱内的压力。如上所述,当细胞捕获过滤器接收到越来越多的细胞,纯化柱内的压力也会升高。压力传感器161可防止纯化柱内的压力达到纯化柱内过滤器或其他组件失效的断点。此外,压力传感器161还可作为调节系统泵送动作的一种手段。例如,泵的动力可由一个门限开/关滞后系统提供,其中当系统达到预设阈值上限(例如,10psi)时,泵会完全打开,达到预设阈值下限(例如,2psi)时,泵会保持完全关闭,而当压力达到阈值上限时泵会再次开启。需要注意的是,用户可在制造过程中通过配置性设置(例如,访问与系统相关的用户界面)进行系统级别的阈值调整。
另外,压力传感器还可以根据pid(比例/积分/微分)控制回路调节泵,主动控制泵的工作周期(如速度),从而维持持压力设定值。在这种情况下,不是泵在系统达到阈值上限时完全关闭,而是泵的转速随着接近阀值上限而剧烈下降,这样压力就可以保持在阀值上限或接近阀值上限,而泵就可以继续运行。
如图7b所示,te缓冲液储槽可通过两个独立的出口分开。这样用户就能够在使用单个废物储槽的同时进行多个te缓冲清洗循环。例如,第一体积的te缓冲液可以通过第三混合室洗涤混合室中残留的乙醇,并流入废液中。剩余的te缓冲液可在沉淀过滤器上冲洗溶解保留的靶核酸,以便在成品管中进行收集。该中间洗涤步骤可以提高沉淀过滤器获得质粒的效率和/或浓度。
图7c还给出了纯化柱160c的另一种实施例,与自动纯化生物样本中靶核酸的系统一起使用。如图所示,纯化柱160c包含许多与图4、图5a-5k以及图7a、7b中所示的纯化柱100、160a和160b相同或类似的试剂、缓冲液、过滤器和滤膜。如图7c所示,纯化柱160c可从裂解缓冲液和重悬缓冲液的三重堆叠中去除核糖核酸酶a,待细胞从细胞捕获过滤器中重悬后再加入第一混合室。例如,在示例操作中,细胞可能捕获到细胞捕获过滤器上,如上所述。但不是裂解缓冲液、核糖核酸酶a和重悬缓冲液的混合溶液洗涤细胞捕获过滤器删的细胞,而是过滤器重悬细胞,然后通过反冲洗步骤进入第一混合室(类似于上述与图5相关的步骤)。然后,通过细胞捕获过滤器将裂解缓冲液推入第一混合室,从而使细胞裂解。核糖核酸酶a可预装入第一混合室,并随细胞(重悬缓冲液将细胞从过滤器带至混合室)进入第一混合室,或随裂解缓冲液进入第一混合室。应该认识到,在一些实施例中,裂解缓冲液和重悬缓冲液可将细胞从细胞捕获过滤器重悬到第一混合室之前加入。
图7c所示的纯化柱160c还可添加与第三混合室连接的再循环流体通道。例如,在冲洗液流入废物储槽之前,可使用再循环通道使第一te缓冲液再次流过第三混合室,以便te缓冲液(或其他洗脱液)进入沉淀过滤器。这有利于提高从沉淀膜中洗脱靶核酸的效率、纯度和/或浓度。
此外,本公开的纯化柱或可包含一个或多个附加旁路阀或通风口。例如,通风口可与细胞捕获过滤器连接,这样泵压就不会超过阈值压力。这样可以有效防止纯化柱因过滤器堵塞而受到破坏力的影响。旁通阀还可使未过滤的介质流入废液中。在一些情况下,可启动该旁路阀检索加载到要被回收或未被处理的纯化柱中的介质。
此外,还可放置多个窗口到整个纯化柱中,以便确定流体的存在(例如,测量与其中一个窗口重合的通道的光密度)。这有利于样本的动态处理,例如,处理需要较长过滤时间的样本(例如,粪便样本或密集细菌培养与水或尿液样本)。
需要进一步说明的是,本文所公开的纯化柱布局和设计可以适应使用一系列组分储槽的溶液和试剂的定制制备。例如,不是裂解缓冲液和重悬缓冲液都有单独储槽,该纯化柱可能为每种缓冲液或试剂的组分设置独立储槽,并可能生成指定体积的所需缓冲液或试剂(例如,分配和/或直接分配到样本之前在一个混合室内混合)。
相应地,可根据纯化方案中使用的过滤器/滤膜和/或缓冲液/试剂的数量和类型,以及与处理不同生物样本和/或不同纯化方案相关的体积和步骤调整纯化柱内组件的组织、布局和规格,但这需要具有专业技艺的人进行。
流体释放机制
以下公开涉及一种自动化核酸纯化系统的示例性实施例,在此类自动纯化过程中,该自动化核酸纯化系统可选择性地从输入储槽、缓冲液/试剂储槽、混合室或纯化柱的其他区域释放液体。流体释放系统可包括来自公开的纯化仪器和纯化柱的交互组件。例如,流体释放系统的执行机构可与纯化仪器关联并受其控制,并与纯化柱的柔性区域相互作用以释放流体。
流体释放系统综述
核酸纯化程序是手控的,实验室操作需要专业技能,而且可能需要几个小时来完成。由于纯化过程中的特定时间点需要大量不同的流体(至少是部分原因),因此很难实现自动化。以前总是尝试使用机器人技术复制人工过程,但除了人工过程中常用的实验室设备(离心机、真空阀组等)的相关费用外,这些方法还需要对昂贵的机器人设备额外投资。此外,因主要依赖于商业纯化试剂盒中提供的过滤柱和缓冲液,这些方法未能减少耗材的数量和类型。
此外,先前的方法也未能改善核酸纯化过程中流体释放的机制。相反,在以前的方法中通常使用管道(类似于人工操作)输送液体,或者分配大储槽中的等分液体到各种管道或过滤柱中。对于前者而言,除了需要监测和更换这些额外的耗材之外,还需要对移液管尖端进行必要的进样和喷射,这就增加成本和处理时间。对于后者,样本之间的交叉污染风险较高,而且需要特别注意对样本之间的管道或注射口进行清洗和/或消毒。在这两种情况下,提出的解决方案都未能解决需要一个独立流体释放系统的问题,这个系统可以减少核酸纯化过程中与流体释放/转移相关的耗材的数量和/或类型,而且可以降低或消除样本制剂之间的交叉污染风险。
因此,这对设计一个能够在自动核酸纯化程序中选择性释放适当液体(例如,样本、缓冲液、试剂或其组合)的系统提出了数个挑战。如下文更详细地描述的那样,在一侧的流体储槽和另一侧的执行机构之间添加一个柔性垫圈后,本文所述的流体释放系统就能够解决上述一种或多种问题。可操作执行机构使柔性垫圈偏转,并打破保持流体在储槽内的易碎密封件,从而选择性地释放储槽中的流体。
在一些实施例中,柔性垫圈、易碎密封件和储槽均为纯化柱的组件,而所述执行机构是纯化仪器的组件。这有利于控制流体从消耗性纯化柱中释放,而不会交叉污染样本。执行机构与柔性垫片的一侧相连,从一侧压下柔性垫圈,垫圈片会向易碎密封件方向变形,导致垫圈的另一侧的易碎密封件相互作用并破坏密封件。这样一来,执行机构就可以通过中间垫片与流体分离,不会直接接触流体。执行机构可反复穿入流体容器,不需要对样本之间或内部进行清洗或处理,而且几乎不会造成污染。
另外一个好处是,本公开的流体释放系统简化了流体释放过程,使处理时间更短,同时基本不知道释放的流体的体积。也就是说,本公开的流体释放系统可用于释放少量或大量的流体,因为流体释放的组分和过程基本上与储槽的尺寸无关。此外,释放流体的机械装置也很简单,也就是说,该系统不需要随时间推移证明不可靠的复杂机械装置。这可以增加系统的可靠性、可重复性和长期效用,尤其是在使用单轴驱动的实施例中。
流体释放机制
现在参照图8a-8c,图示为保持和选择性释放流体的流体释放系统的示例性实施例。如图所示,该系统包括执行机构166和储槽168。所述储槽168用于保留流体,并至少部分被所述纯化柱的外层(例如,外层115a)和易碎密封件170所限定,完好的易碎密封件170可将流体保持在储槽168内。
本文所用的“易碎密封件”是指一种可穿透材料,其可在机械力的作用下撕裂、断裂或发生灾难性故障,从而不再有密封作用。本公开的易碎密封件可以由面向相关通道或储槽的试剂侧的化学惰性材料组成。在一个实施例中,易碎密封件包括一薄层化学惰性材料,其可在紧密密封流体的同时在发生外部机械力时破裂。在一些情况下,惰性材料为塑料,如聚丙烯、聚氯乙烯、聚苯乙烯或类似材料。此外,易碎密封件还可以包含第二增强层,例如由金属箔组成。第二增强层可与惰性材料熔合并在功能上形成单层,从而使塑料或加固层的破裂在功能上等同于两层的破裂。其他适用于易碎密封的材料可按照本行业所知选择,例如,预制塑料包装的药物填充腔(如泡塑包装)上的易碎密封件,或者在一些消费食品上的其他易碎密封件。例如,水汽损失大约为零的箔层可以与第二增强层(如aclar)熔接和/或联用,以进一步延迟和/或防止水汽损失。
执行机构166的易碎密封件170之间放置一个柔性垫圈172。如图8a所示,柔性垫圈172是纯化柱的一个组成部分。该柔性垫圈可能构成中间层117(外层115a和115b之间)的一部分。例如,柔性垫圈172可以是夹在纯化柱内外热成形层之间的弹性体层的延伸,而该纯化柱类似于本文所述的。在这些实施例中,所述储槽168可至少部分由柔性垫圈172限定在所述纯化柱的两个外层之一中。如本文中更详细的描述,纯化柱的外层115a和115b可由热成形塑料制成或包含热成形塑料。
在一些实施例中,如图8a所示,柔性垫圈172可形成通道或导管174,而流体可通过该通道或导管从流体储槽168中释放。为了有选择地从储槽168中释放液体,执行机构166从第一位置(箭头a所示)移动到第二位置(图8b中的箭头b所示)。在此过程中,执行机构166接触柔性垫圈172的第一侧,并且随着朝向柔性垫圈172的持续轴向运动,致动器166使柔性垫圈172朝易碎密封件170偏转。
如图8b所示,执行机构166可以朝储槽168移动一段距离,致使偏转的柔性垫圈176被刺穿或易碎密封件170被刺穿。这样一来,执行机构166就不会直接接触易碎密封件170或储槽168的内容物。相反的是,挠曲的柔性垫圈176的表面会接触易碎密封件并使其破裂。当储槽168中的一些液体可能会在偏转的挠性垫片176和破裂的密封件178之间流动时,在缩回执行机构166时,如图8c所示,柔性垫圈172返回其原始位置(例如,由于其挠性特性),并提供一个透明的导管174,流体可通过该导管通过由破裂的密封178形成的孔180离开储槽168。
值得注意的是,流体储槽168可以是纯化柱内的任何储槽或腔室,包括例如输入储槽、缓冲试剂储槽、混合室等。因此,储槽168内的流体可以是输入样本、重悬缓冲液、rnasea、蛋白酶k、裂解缓冲液、中和缓冲液、结合缓冲液、内毒素去除缓冲液、洗涤缓冲液、洗脱缓冲液、异丙醇、70%乙醇、te缓冲液、水以及上述物质的组合,或任何其他流体、试剂、缓冲液,核酸纯化过程中使用或形成的酶或混合物。另外,导管174可以提供一条通道,使释放的流体在储槽168和纯化柱内的下一个或最终目的地182之间流动。
图8a-8c所示的系统包括来自核酸纯化柱和相关仪器的组件。图8a-8c所示的系统可以包括蛋白纯化柱和关联仪器的组件。例如,执行机构166可能是纯化仪器的一个组件,而储槽168、相关的易碎密封件170和柔性垫圈172则是纯化柱的组件,本文对此有更详细的描述。这样一来,执行机构166的运动可以由仪器进行控制,如上所述,仪器包括计算机可执行指令或其他可编程元件,其允许由预定义或用户定义的方案根据时间或情况来释放流体。这可以有效地使用各种缓冲液、试剂和处理参数的任意组合来动态实施各种核酸纯化方案,而无需改变仪器的物理组件,例如执行机构。换句话说,公开的流体释放系统能够通过单个硬件配置从而实现多种用途。
值得注意的是,核酸或蛋白纯化仪器内的执行机构位置也可以是动态化的。在一些实施例中,一个纯化仪器可以具有单个执行机构,该执行机构在整个纯化方案中被重新定位,从而使其在不同时间与各种易碎密封件对齐并致其破裂。此外,纯化仪器可具有多个执行机构,这些执行机构与纯化柱上相应的易碎密封件对齐或在它们之间进行移动。
在一些实施例中,易碎密封件170是箔状密封。或者,易碎密封件可以由合适的材料制成,这些材料能够承受与之相关的储槽或腔室中的流体对其施加的压力,但当柔性垫圈通过执行机构在其上施加更大的作用力时,该材料将破裂。在一些实施例中,可调整易碎密封件的厚度,以适应不同的储槽内的压力或执行机构的压力。
在一些实施例中,如图8a-8c所示,执行机构呈叶尖形。这利于执行机构施加的作用力集中在易碎密封件的较小面积区域内,从而缩小易碎密封件中可向外部传播以扩大孔径的故障程度。当然同时也需要注意的是,也可以提供其他形状的执行机构,以达到相同或类似的效果。例如,典型的执行机构可以具有1毫米、2毫米、3毫米、4毫米、5毫米、7毫米、10毫米的叶尖直径,或者具有小于上述任何一种的叶尖直径。叶尖直径也可从上述两种直径范围内选择(例如:1毫米至10毫米、2毫米至5毫米、3毫米至7毫米、2毫米至4毫米)。
挠性排气孔
在一些情况下,通过上述机制释放的流体在逸出时可能导致储槽内产生负压。这可能导致储槽中的液体未完全排净(例如,在封闭系统中),也可能导致从储槽间歇流动或空气流入储槽(例如,在开放系统中)。上述情况中的每一个都会对自动纯化过程的效率和/或输出靶核酸或输出靶蛋白的纯度或浓度产生负面影响。
例如,如果流体与悬浮液、裂解物或洗脱液混合,若未完全排净则会改变其所需的化学性质,并导致不同或不近理想的效果。例如,如果未完全排净的储槽中含有洗涤缓冲液或内毒素清除缓冲液,则输出的靶核酸可能受到污染或与其预期用途不一致。作为上述非限制性实施例,靶核酸可以是拟用于哺乳动物细胞培养分析的质粒,如果该质粒是从革兰氏阴性菌中纯化的并且用所需体积的内毒素去除缓冲液,但未完全处理干净,脂多糖的毒性或炎性浓度可能仍与纯化质粒dna相关,导致其未达到预期使用用途。
间歇性地流动和/或气流进入流体储槽同样会对自动纯化过程的效率和/或输出靶核酸或靶蛋白的纯度或浓度产生负面影响。例如,如果流体中含有表面活性剂,流入储槽的空气会使下表面张紧的流体产生气泡,从而导致流体的未完全排净。很多裂解缓冲液含有表面活性剂,而裂解缓冲液与输入生物样本的不完全结合会减少可纯化的靶核酸的数量。
本公开的流体释放系统可以解决上述一个或多个问题。例如,典型的流体释放系统可用于将空气排放到流体储槽中,以促进从储槽中完全排净流体。在一些实施例中,如图9a和9b所示,流体释放系统包括与流体储槽168相关联的排气系统184。排气系统184可用以操作与流体储槽168相关联的易碎气体密封件190破裂,从而将空气引导到储槽168中。
如图9a和9b所示,排气系统184是纯化柱的一部分。排气系统184包括挠性排气孔188,其类似于上述柔性垫圈,可以作为布置在柱体的两个外部层115a、115b之间的中间层117的一部分。在一些实施例中,挠性排气孔188是弹性体层的延伸,并且可部分限定流体储槽168。
如图所示,挠性排气孔188通过易碎气体密封件190与储槽168的流体连通分开。为有选择地将空气排放到储槽168中,可以移动执行机构(未示出)与挠性排气孔188接触,并向储槽168连续轴向移动(例如,如图9a所示,方向从左至右),执行机构可使挠性排气孔188向易碎气体密封件190偏转,直至偏转的排气孔接触并穿孔或以其他方式使易碎气体密封件190破裂。与上文所述的柔性垫圈相类似,挠性排气孔188可以在执行机构施加的偏转力消除后返回至其非偏转位置。
挠性排气孔188可在储槽168和外部空气之间形成通道或导管192(例如通过挠性排气孔188所形成的破裂易碎气体密封件和排气孔186)。如图所示,从外部空气进入导管192可以从排气孔186开始,沿着储槽168纵向移动至易碎气体密封件190处或其上方。在一些实施例中,易碎气体密封件190可以放置在储槽168的顶部,方向远离重力,并且用于从储槽68释放液体的易碎密封件(未显示)可以位于储液罐底部,朝向重力方向。在该方向上,破坏易碎密封件和易碎气体密封件可导致液体在重力的作用下通过流体力从储槽的底部溢出,此时进入储槽顶部的空气压力和重力相等。这样可以使储槽中液体完全排放,并且还可以防止由于储槽与外部空气之间的压力不相等而导致的堵塞或排放不畅。
在一些实施例中,易碎气体密封件比易碎密封件先出现缺口,使得储槽内的压力可在放出液体之前与外部空气相等。换言之,易碎气体密封件比易碎密封件后出现破损,以在储槽排空时保持压力平衡。对于满载或接近容量的储槽,在易碎密封件之后破坏易碎气体密封件可降低液体通过被破坏的易碎气体密封件溢出的可能性,因为液位可能较低和/或与之相关的储槽顶部空间的可用体积易碎气体密封件可能更大。在一些实施例中,易碎气体密封件可被与上述易碎密封件相同的执行机构破坏。
在一些实施例中,易碎气体密封件和易碎密封件同时或几乎同时破裂。易碎密封件因此可能被不同的执行机构损坏。另外,执行机构相对于易碎气体密封件的运动可以由纯化仪器控制,如上所述,纯化仪器可以包括计算机可执行指令或其他可编程元件,其允许根据预定义或客户自定义的时间或状况来排出空气。这个可以有利于整个核酸纯化过程的液体控制,执行机构不接任何液体也不会污染样本品。
蛋白纯化柱,仪器和系统
本公开内容涉及用于从生物样本中纯化靶生物分子的组件,自动化系统和方法。前述讨论,尤其是与图3a-5k和图7a-c有关的前述讨论说明了用于自动纯化靶核酸的各种示例性组件设计和处理工作流程。以类似的方式,本文公开的实施例可以包括用于自动纯化不同的靶生物分子即靶蛋白的类似组件和处理工作流程。
蛋白纯化对于表征蛋白的功能,结构以及相互作用至关重要。纯化过程中的各个步骤可以包括细胞裂解,从细胞碎片中分离可溶性蛋白组分,以及最终从与产品-和过程相关-的杂质中分离目的蛋白。然而,从液体细胞培养物中提取和纯化蛋白的许多现有方法是费时的,并且主要是人工操作。这些方法要求具备技术专长和专业设备来执行各个步骤。例如,一种典型的方法是通过分离液体细胞培养物来获取细胞,然后将所得细胞沉淀重悬于裂解缓冲液中进一步裂解细胞。然后,通过额外的离心步骤使裂解物澄清,然后将澄清的裂解物倒出进行收集。然后可以将澄清的裂解物通过蛋白纯化柱(或其他过滤器,树脂或蛋白捕获装置),以进一步纯化所需蛋白,以收集在洗脱缓冲液中以用于进一步的下游工作流程。
本文所述的自动化系统和随附的组件可以实现蛋白纯化过程中各个步骤的自动化,并且可以包括在将包含靶蛋白的生物样本添加到相应的蛋白纯化柱中之后进行基本上整个蛋白纯化过程的自动化,以及可操作的自动化系统。例如,本文公开的组件和系统适用于从细菌和/或真核培养物中纯化和/或分离蛋白。在一个实施例中,靶蛋白由真核细胞或与之相关的细胞组成例如酵母(例如,酿酒酵母),或昆虫细胞或啮齿动物细胞(例如,小鼠,大鼠或仓鼠细胞)例如cho细胞或,灵长类/人细胞,如293或cos细胞。在另一个实施例中,靶蛋白由(例如,作为重组蛋白)原核细胞(例如大肠杆菌)或与之有关的原核细胞组成。不管细胞类型如何,自动蛋白纯化系统以及相关的组件和方法都能够从中纯化和收集靶蛋白。
与上述靶核酸纯化系统和组件相似,本公开的自动蛋白纯化柱可以适于通过相关的培养储槽接收包含靶蛋白的生物样本,并通过许多方法处理该生物样本。的相互连接的生物加工组件以产生纯化的靶蛋白。例如,在将含有靶蛋白的生物样本(例如,原核细胞/真核细胞的培养物)添加到靶蛋白纯化组件之后,可以在用于分离样本/培养上清液中细胞部分的第一生物处理组件中处理所述纯化柱。应当重视,在靶蛋白是分泌的蛋白的情况下,上清液可以被进一步处理而不是被忽略而废弃掉。此外,在靶蛋白与细胞相关的情况下,可以将生物样本/培养物的细胞部分可以在细胞捕获膜上获得,上清液将被废弃掉。应当认识到,以上关于核酸纯化生物加工组件和试剂可用于蛋白纯化。
作为非限制性示例,可以将来自悬浮液的细胞添加至靶蛋白纯化柱,并使其通过过滤器,在此处通过过滤在过滤器的第一侧捕获细胞。滤液通过过滤器,并经过过滤器的第二侧面,然后被引入一个废物容器。完成此步骤后,可选地通过空气/气泡传感器或任何其他方法,有选择性地检测每个后续步骤,以检测是否存在本文中披露的和/或本领域技术人员所知的流体流量或阈值流体流速。如上所述,靶蛋白纯化柱可以与配套的自动化纯化系统相关联,该自动化纯化系统利用泵送动作,使生物样本沿着第一流动方向从过滤器中抽吸出来,然后可能会另外进入第二操作状态,以促使液体沿相反的第二流动方向流动。
在一些实施例中,主要基于流速和过滤器容量来选择合适的细胞捕获过滤器系统,以用于靶蛋白纯化柱中。在选择合适的细胞捕获过滤器]系统(例如,为了捕获具有靶蛋白的细胞)时,还会考虑过滤器的其他特性,例如孔径尺寸。作为非限制性示例,可以对大肠埃希菌菌株进行工程学改造,以产生重组靶蛋白。这些大肠埃希菌的培养物可以在含有0.2微米中空纤维过滤器薄膜的自动纯化柱内的膜系统上捕获。作为补充示例,与靶蛋白纯化柱相关的细胞捕获过滤器包含有多个基于醋酸纤维素的多孔中空纤维,这些多孔中空纤维弯曲成一系列的环状结构。这些环状结构能够有效地为过滤器提供较大的表面积,以捕获和/或处理生物样本和/或经过部分纯化的靶蛋白。这些环状结构的开口端被放入聚氨酯或类似的聚合物中,以形成端塞(例如,进行机械加工以确保环状结构的开口端保持在打开状态)。在一个实施例中,中空纤维过滤器可以是可从
此外,本公开的靶蛋白纯化柱内的生物处理组件还包括流体混合室,和/或可能包含用于处理一个或多个样本的固体支持物。固体支持物可以是用于过滤、洗涤、染色、洗脱、收集、处理或进行化学反应或生物处理的任何支持物。在一些实施例中,固体支持物可以选自滤纸匣、滤纸、沉淀膜、沉淀过滤器、固相萃取柱、固相萃取盒、固相萃取盘、树脂、薄膜(例如印迹膜、滤膜、pvdf膜、尼龙膜、带正电的尼龙膜和硝化纤维素膜)、反应珠(例如玻璃珠和磁珠)、包含生物分子阵列(例如蛋白阵列、组织阵列)的刚性平面固体支持物、显微镜载玻片及以上组合中的一种或多种。
在一些实施例中,在一个或多个生物处理室中,固体支持物可包括滤纸、过滤器或滤纸匣。滤纸、过滤器或滤纸匣可包括任何合适类型的过滤装置,这类过滤装置具有适当的化学性质、孔径、形状、三维结构(例如对称或不对称的三维结构,包括“v”字形或漏斗形的孔结构)和/或用于预期用途的表面面积。即可以根据靶蛋白的性质和/或所要求的纯化方案来选择固体支持物。此外,固体支持物还可用于溢流道、横向流、切向流或以上任意组合。应当理解的是,滤纸、过滤器或滤筒可以是由任何合适材料制成的,或包括任何合适材料的单层或多层过滤装置,这些合适材料包括聚醚砜、聚乙烯、超高分子量聚乙烯、聚丙烯、尼龙、纤维素、三乙酸纤维素、聚丙烯腈、聚酰胺、玻璃纤维、二氧化硅、聚砜、pvdf等。在一些实施例中,在一个或多个处理室中,固体支持物是沉淀膜或沉淀过滤器,或者其也可以是印记膜。在一些实施例中,固体支持物可以是固相萃取柱、固相萃取盒或固相萃取盘。在一些实施例中,固体支持物可包括多个珠子,例如涂覆珠子、涂覆玻璃珠、玻璃珠、磁珠或涂覆磁珠。珠子可以装入处理室内的立柱或悬浮液中。
作为非限制性示例,本公开的实施例可能包括用于纯化靶蛋白的纯化柱,该纯化柱具有跟踪细胞捕获子组件的蛋白捕获组件。蛋白捕获组件可用于澄清裂解物,或者也可以用于从澄清的裂解物中接收和捆绑靶蛋白。因此,应当理解的是,用于纯化生物样本中靶蛋白的示例性纯化柱可能包括澄清和/或蛋白捕获组件,这些捕获组件除了以流动的方式与一个或多个缓冲液/洗涤液/试剂相连接以外,还与细胞捕获组件和/或混合室相连接。例如,装有蛋白酶抑制剂、ph差异溶液、洗涤缓冲液、洗脱缓冲液等的储槽可被纳入相应的以流动方式连接的储槽中,这些储槽如本文所述予以密封。可以根据蛋白纯化方案,而非核酸纯化方案,对所设想的纯化柱(例如,如图3a-5k和图7a-c所示)的生物处理组件内部或之间的缓冲液及处理步骤,进行相应的删除和/或增补。
在一个实施例中,自动化蛋白纯化柱包括具有一个或多个亲和力基质/立柱的子组件(例如,代替了图3a-5k和图7a-c中的自动化核酸纯化柱中提供的核酸纯化专用膜/过滤器)。亲和色谱法是一种有效的蛋白纯化技术,这种技术通常只使用一步来纯化蛋白,其纯度足以进行分析表征。亲和色谱法是一种基于分子构象的分离技术,这些分子彼此“匹配”,以“锁与钥匙”的方式有选择性地相互结合(例如,抗体可以识别抗原,并专门与抗原结合)。该技术可以使用专用色谱树脂,该树脂具有附着在树脂表面的配体特异性受体(例如,包含有抗原结合结构域的抗体片段)。最常见的情况是,这些受体会以类似于抗体-抗原相互作用的方式,与靶蛋白相结合。受体与其标靶化合物之间的这种高度特异性匹配使亲和柱色谱也具有高度特异性。抗原与树脂粘结的抗体相结合(通常具有高亲和力),而其他样本组分和杂质并不结合,而是通过亲和柱流向废物容器。然后可以从立柱上洗去并洗脱任何结合的抗原(通常是相关蛋白),这通常会改变ph值,从而破坏分子抗原与抗体之间的相互作用,继而产生代表靶蛋白的单一高纯度的洗脱峰。
因此,本文公开的蛋白纯化柱的实施例可能其中包括这样一种亲和柱,该亲和柱可以专门结合并捕获靶蛋白,并同时允许剩余的蛋白和细胞产物通过立柱并转变为废物。可以对立柱进行清洗,以去除立柱上的任何松散结合的或残留的细胞碎片(例如,打开装有洗涤缓冲液的储槽,并通过该立柱抽吸内容物进行自动清洗)。纯化柱内的储槽可以装载溶液,该溶液可用来改变基质/立柱的ph值,并因此洗脱靶蛋白(例如,进入采集管道)。至于其他洗涤步骤和/或纯化步骤,则可以借助用于此类用途的系统和蛋白纯化柱来自动执行。
作为非限制性示例,thermofisherscientific通过其
在使用纯化柱的自动化蛋白纯化流程中,此类(以及类似)产品可以帮助有效地实现筛选,提升亲和力和稳定性,并可以在纯化流程中实现一系列示例性优势,例如单步纯化、易于使用、纯化成本最小化、有效去除杂质、更高质量的产物、灵活性提升等。
本文公开的自动化蛋白纯化柱的一个或多个子组件中包含有蛋白纯化产品的其他示例,其中包含用于从多种环境中分离免疫球蛋白形式(例如从转基因动物中分离血浆和乳汁,或从哺乳动物细胞培养物中分离上清液)的
在一些实施例中,本文公开的蛋白纯化柱可用于运行选自以下各项的方案和生物处理程序:免疫沉淀、重组蛋白分离、蛋白标记、靶蛋白的分离和隔离、以及基于珠子的自动分离(包括基于磁珠的自动分离)。所公开的蛋白纯化柱可以另行调配,以便与本文所公开的自动化系统一起使用,和/或本文所公开的系统可以予以修改,以便与本文所公开的蛋白纯化柱相兼容。应当理解的是,本文公开的与核酸纯化相关的组合纯化柱和系统的功能,可以通过用于蛋白纯化的相应纯化柱和系统来实现。因此,与本文提供的核酸纯化柱和系统有关的密封机制和流体控制机制可以另行使用,和/或与蛋白纯化柱相关联。
在自动化工作流程的一个实施例中,整个细胞裂解过程—包括过滤至少1l的细胞悬浮液、任何(可选)洗涤步骤、与将缓冲液/溶液装载至适当的储槽或混合室中以进行孵育和/或重新悬浮捕获的细胞和裂解细胞,以及收集澄清的裂解物有关的所有步骤—都可以在2个小时内或更短的时间内完成,最好能在1个小时或更少的时间内完成。在一个实施例中,在从澄清的裂解物中收集纯化的靶蛋白时,其中所涉及的所有步骤(包括通过纯化柱纯化靶蛋白),以及所有的洗涤和洗脱步骤,都可以在大约2个小时内或更短的时间内完成,最好是能在1个小时内完成。因此,在一个实施例中,在单一的自动化流程中,从多达1l的细胞悬液中过滤、裂解、澄清和纯化靶蛋白可能需要约4个小时或更短的时间,最好是大约2小时或更短的时间。
在一些实施例中,处理工作流程可能包括其他处理步骤,这些步骤可能会增加运行时间的总量。例如,经过纯化的蛋白可以通过互补色谱策略进一步予以纯化(例如“抛光”)或更换缓冲液,这些策略可能包括尺寸排阻、离子交换或亲和纯化。作为补充示例或替代示例,举例而言,经过纯化的蛋白可以予以蛋白水解处理,以去除蛋白序列中氨基或羧基末端编码的亲和标签,然后进入最终纯化步骤。应当理解的是,工作流程可以扩展,即根据需要增加或减少各种系统组件的尺寸和/或数量,以适应细胞悬浮液体积大于或小于1l的过滤和/或纯化要求。
自动纯化仪器
以下公开内容介绍了可用于自动纯化靶生物分子(例如靶核酸和/或靶蛋白)的仪器的示例性实施例。该纯化仪器可与本文所述的其他组件一起使用。例如,该仪器可用于容纳上文所述消耗性纯化柱,并配合该消耗性纯化柱使用。尽管在描述该仪器或设备的某些功能时使用核酸纯化作为示例,但应当理解的是,类似仪器(具有本文所述的修改)也可用于蛋白纯化。
仪器概述
如上所述,用于纯化靶生物分子(例如靶核酸和/或靶蛋白)的常规方案是人工实验室流程,其需要相对较高水平的实验室专有技术知识和时间。尽管训练有素的实验室技术人员能够处理流程中所涉及的各种操作参数,然而,出于若干原因,设计一种能够有效地自动执行大部分流程的仪器,仍具有挑战性。例如,用于执行自动化流程的装置应能够有效地移动和输送不同粘度和密度的流体,在特定的规定时间释放试剂,以及与其他流体移动操作相结合,将不同的流体混合在一起,处理体积相对较大的样本,并在整个流程中进行适当的流体分离/密封。这类装置还应具备安全性,以确保用户安全操作,并且具备纯化给定靶生物分子(例如预先选择的靶核酸或预先选择的靶蛋白)的功能。
如下文中详细所述,本文所述的纯化仪器能够应对一个或多个上述挑战。例如,纯化仪器可能包括泵组件,该泵组件用于通过蠕动运动提供抽吸作用,以便流体能有效地通过插入的消耗性纯化柱;也可能包括组件,该组件用于控制插入的纯化柱内的流体的自动化混合;也可能包括用于提供或增强纯化柱上的液密密封性能的组件;也可能包括保护用户免受意外伤害和/或限制过程错误风险的安全机构。在一些实施例中,本公开的仪器可能用于处理体积较大的样本(例如,大约5ml至5l、或10ml至500ml、或大约15ml至250ml)。应该认识到,系统、设备、纯化柱的尺寸也可以减小来纯化较小的体积(例如,小于5ml(如0.5ml-5ml)的体积)。
图10提供了能够自动进行核酸纯化的纯化仪器300(在本文中也可以称为纯化“设备”)的等轴测视图。仪器300包括外壳302,该外壳302围绕在内部隔室304周围,并对内部隔室304进行了限定。内部隔室304的尺寸和形状设计成能容纳样本纯化柱301。在优选实施例中,纯化柱301是消耗性纯化柱,例如本文其他地方中更为详细描述的纯化柱。仪器300包括可选择性关闭的检修门306,该检修门提供通向内部隔室304的通道。在本文公开的范围内,还设想了插入和/或接收纯化柱的其他装置,包括自动将纯化柱送入仪器的装置,或本领域内已知的其他机械等。仪器300还可能包括废物托盘(未显示),该托盘设置在内部隔室304内,作用是收集来自纯化柱和/或仪器附近区域的泄漏物或溢出物,例如生物样本或所用的各种试剂/缓冲液的泄漏物或溢出物。废物托盘可选择性插入或移除,以便清除废物及清洗。
机壳302可采用的形状见图10仪器300非限制性示例所示。在本示例中,仪器300的长度(从检修门306到后侧308)与仪器300的高度大致相同,仪器300的宽度大约为其长度的一半。上述相对尺寸在典型实验室设置中运转良好。但是,应当理解,只要内部隔室304能够接收纯化柱301,则仪器300的组件和特征不需要特定形状的机壳302。在其他实施例中,机壳302可为其他形状,例如具有其他长高比、长宽比和/或宽高比。
此外,所述实施例用于在基本垂直的方向上接收纯化柱,其他实施例可让纯化柱从不同方向插入。例如,一些实施例可用于在基本水平的方向上接收纯化柱。此外,虽然在所述实施例中,可一次可接收一个纯化柱,但其他实施例可包含多个隔室,每个隔室可同时或可独立接收纯化柱。例如,在这些实施例中,可并行处理多个样本。
如图所示,检修门306可配有铰接点310,铰接点310设置在仪器300的底部312附近,以便向上转动检修门306转轴以打开,向下转动检修门306转轴以关闭。这种结构使检修门306在打开时靠在台面上,提供通向内部隔室304的入口。在其他实施例中,可配置不同的检修门306,例如,通过在仪器上侧或左侧或右侧设置铰接点或通过使用滑动式门或面板组件。虽然建议使用检修门306,但在一些实施例中,可省去检修门。
在所述实施例中,当检修门306开启,检修门306的内表面314可用作引导纯化柱301进入内部隔室304的引导件。例如,用户可将纯化柱301放置在内表面314上,然后在合适的高度将纯化柱301导入内部隔室304。内表面314还包含一个或多个凹槽316或其他该类引导结构,这类结构可与纯化柱301衔接,进一步帮助纯化柱301在内部隔室304正确定位。本文设想了用于引导纯化柱进入隔室的其他装置和/或结构,包括,例如当纯化柱部分插入隔室时用于固定纯化柱的夹紧机构,以及随后用于将纯化柱进一步运送至隔室进行进一步处理的转移装置。其他可使用的装置是现有技术中已知的。
在所述实施例中,还包含用于容纳用户输入和/或显示仪器信息的用户界面318。用户界面318通过通信耦合方式连接控制器(详情如下文所述–见图20a),以实现与仪器300各不同组件的通信并对其进行控制。用户界面318用于容纳用户输入和/或显示信息,例如与放置在纯化柱中的生物样本体积、纯化柱识别信息、选定纯化方案、用户定义方案的创建和/或保存、样本识别信息、仪器识别信息、用于可选择性关闭的检修门306或其相关组件的操作指令、待纯化的靶核酸的期望浓度、与初始样本和/或纯化过程中各不同阶段样本相关的一个或多个光密度测量值、和/或包含靶核酸的洗脱剂的最终体积相关的信息。
用户界面318可允许通过触摸屏、控制板、鼠标、麦克风、键盘和/或现有技术中已知的其他计算机输入/输出组件与用户进行交互。在处理过程中,用户界面318可让用户观察纯化柱执行纯化过程的进度,还可发出处理完成或处理过程中可能出现的错误或其他问题的提示警告。
仪器夹紧机构
可作为仪器300部件的夹紧机构320实施例见图11a和图11b所示。在一些应用中,仪器300可与具有低成本结构的消耗性纯化柱对接。也就是说,为了降低制造复杂程度和相关成本,可有意设计具有最小固有密封的消耗性纯化柱。例如,可设计足以在环境压力下维持流体分离所需密封的消耗性纯化柱,但不需要其可承受纯化过程(例如,作为使生物样本、试剂和/或其他流体在不同分离/过滤过程步骤中通过膜、过滤器、树脂和/或微球柱的结果)中的高压。
可将消耗性纯化柱设计为靠仪器300的夹紧机构320提供足够密封力,以使消耗性纯化柱能承受纯化过程中的高压。这种设计方法有利于让仪器抵消消耗性纯化柱的固有成本。将这些成本用在耐用仪器上比用在可消耗的一次性消耗性纯化柱更经济有效。
如图11a和11b所示,已移除机壳302和其他组件,以便更好展示夹紧机构320。夹紧机构320包含用于在打开位置(如图11a所示)和关闭位置(如图11b所示)之间移动的第一板322和第二板324。在关闭位置,板322和324压缩位于其间的消耗性纯化柱,并提供足以让消耗性纯化柱承受纯化过程中相对高压的夹紧力。如图11b所示,板322和324可包含孔326,该孔与消耗性纯化柱组件(如流体储槽或消耗性纯化柱通道组件)对准。因此,板322和324用于对准压缩消耗性纯化柱,并压缩消耗性纯化柱需要压紧的部分以便在纯化过程中维持密封完整性。
如图11a所示,第一板322和第二板324支撑在支架328内。在本实施例中,夹紧机构320用于使板322相对板324横向移动。也就是说,第一板322是移动板,第二板324是固定板。底座330安装在插座332中,且底座330可相对插座332纵向移动。插座332附接至支架328和/或作为构成支架328的一部分,其作用是将底座330维持在内部隔室边缘并防止底座330横向移动。
如图11b所示,已移除支架328和插座332,以便更好展示底座330及其相关机构。如图所示,底座330通过一个或多个连杆334与第一板322连接。最好能提供多个连杆334,让压力更好地分布在第一板322上。连杆334还可包含弹簧,以便更好地分配板的横向压力。连杆334还可包含各种不同的垫片来调解施加压力的大小。
传动螺杆336有效地连接电机338并穿过接收器340。接收器340附接至底座330并带有螺纹,使传动螺杆336的转动带动接收器340在传动螺杆336上纵向移动。这使底座330纵向移动。因为插座332阻止底座330横向移动,并且因为支架328阻止第一板322纵向移动,所以底座330纵向移动带动第一板332相应横向移动。连杆334末端也在凸轮路径中移动,提供相对第一板322的额外机械优势。
在其他实施例中,可使用其他机构提供第一板322线性运动。例如,可将底座330有效地连接至线性执行机构、皮带和滑轮组件、链条和链轮组件、齿轮和齿条组件或其联合体,而不是将传动螺杆连接至上述位置。一些实施例可包含直接推拉第一板322的机构,例如基于活塞的机构或直接应用于第一板322的某些其他线性执行机构。一些实施例可用于让板322和板324相对于彼此移动,而不是让其中一个板静止。
由于某些消耗性纯化柱可能需要承受高达50至100磅/平方英寸的压力,夹紧机构320用于施加至少约500磅力的总密封力,或最好施加至少约1000磅力的总密封力,或甚至更好施加至少约2000磅力的总密封力。
如果在纯化过程中断电,用户可使用手动释放机构松开夹紧机构320并允许移除消耗性纯化柱。部分处理的消耗性纯化柱可能包含生物危害和/或危险化学物质,可能需要在维修、运输或进一步使用仪器300之前将其移除。在所述实施例中,如图12所示,手动释放机构可通过位于仪器300后侧308的接入点350进入,但接入点350可位于其他位置。
手动释放机构用于让通过接入点350插入的常用工具(例如螺丝刀、内六角扳手)接触该机构,并允许通过旋转工具手动转动传动螺杆336。也可抓住手动释放机构。例如,一旦松开夹紧机构,夹紧机构弹力可开始将板推开,并使传动螺杆336快速旋转。之后,与该夹紧机构相关联的单项轴承开始旋转,以防止用于启动手动释放夹紧机构的工具不受控制地旋转。
其他仪器实施例可以省去夹紧机构。例如,并非所有的消耗性纯化柱都需要制造成使用仪器的额外压力的消耗性纯化柱。例如,在消耗性纯化柱有足够固有密封的情况下,在生物样本含有较少细胞或因其他原因(例如,水或尿液样本)粘性较小的情况,和/或在生物样本体积相对于仪器容量较小(例如,约10ml)的情况下,仪器不需要包含或使用夹紧机构。应当理解,虽然某些样本相对于本文所述仪器和处理容量而言可能较“小”,但这些样本相对于传统纯化仪器和处理容量而言还是较大。
在仪器省去夹紧机构或不使用夹紧机构的应用中,相关联的消耗性纯化柱可用于承受所涉及的预期压力。这种消耗性纯化柱不一定能够承受上述高压(例如,约50到150ml的培养物/样本体积可通过一个或多个细胞捕获膜处理的情况),但仍足以承受上述情况中涉及的相对较低压力。这种消耗性纯化柱可用聚合物材料(例如,热成型和/或其他合适的聚合物)制作而成,将两个分开的侧面沿边缘和任何其他所需位置熔接、粘合和/或机械锁定在一起。
仪器安全机制
图13所示为从面向检修门306内表面314的角度所看到的门锁定机构视图。将锁定片342(在图11a中也可以看到)连接至1号板322(即移动板)上。将相应的闭锁糟344设置在检修门306一部分上。当门关闭时,检修门306位于内部隔间内。当检修门306关闭,并且夹紧机构320驱动时,锁定片342与1号板322发生平移,从而进入闭锁糟344中。这样有助于防止夹紧工艺已经启动后,打开检修门306。
所述锁定机构可用作访问屏障,有效防止用户因内部隔间内各种运动部件而受伤。检修门306最好是访问内部隔间的唯一出口。一旦关闭,检修门306和门框302形成屏障,将用户和内部的自动运动部件分隔开。
作为一种额外的或可选的预防措施,仪器300可用于仅在确定检修门306关闭时才为夹紧电机338供电。可采用用于检测检修门306启闭状态的一个或多个传感器,做出决定。在图14所示实施例中,门框302包括位于门框302部分内,界定检修门框架的一对冗余霍尔效应传感器346。将一对相对应的磁铁348设置在检修门306上。当检修门306关闭时,其位置与霍尔效应传感器346对齐。
霍尔效应传感器346和磁铁348位置可以调换,即将磁铁348配置在检修门门框上,而将霍尔效应传感器346配置在检修门306上。虽然本文所示为两对传感器/磁铁,但是一些实施例可能仅包含一对或可能包含两队以上传感器/磁铁。其他实施例可能附加地或可选择地包含其他类型的触点和/或接近传感器,例如电容式或感应式接近传感器、红外接近传感器、光传感器、电涡流传感器、机械开关(例如限位开关)或所有前述仪器的组合。
仪器工艺控制机制
仪器300最好包括旨在确保在纯化工艺开始前对各种组分进行适当准备的一个或多个特征。例如,仪器300可能包含确保在启动夹紧或纯化工艺其他步骤以前对生物分子纯化柱进行准确定位的特征,以及确保不使用所插入的纯化柱的特征,和/或确保为接收纯化产品已经对输出容器进行准确定位的特征。
图15所示为在仪器内部隔间内定位的柱定位机制实施例。可以在内部隔间内将接触开关352(例如限位开关)定位在所插入的柱301跟开关352接触的位置上。在所示实施例中,接触开关352定位在内部隔间后侧。在该位置,当柱301插入时,达到接触开关352前,其前缘305将不断前进。接触开关352与仪器控制器连通。控制器可能用于防止接触开关352已经接触前,启动工艺。
其他实施例可能将接触开关352定位在内部隔间的其他合适位置。其他实施例可能附加地或可选择地包含其他类型的触点和/或接近传感器,例如本文所述跟仪器300其他组分相关的其他类型的传感器(例如光传感器、磁传感器等)。
柱定位机制可能还包括用于连接柱301,以便插入合适位置后将柱固定到位的闭锁装置354。闭锁装置354还可用于向用户提供触觉反馈,提醒用户柱已经准确定位。例如,闭锁装置354可以采用弹簧加载的方式,或者偏向于关闭位置的其他方式,并用于柱插入过程中发生位移以后,将其“弹”回或“切换”回关闭位置。
在所示实施例中,在插入过程中,当柱301开始与闭锁装置354接触时,柱301的接合部件303可以与闭锁装置354的倾斜表面356接触。进一步插入柱301可以导致闭锁装置354离开关闭位置。当接合部件303已经清除了倾斜表面356以后,槽358允许闭锁装置354返回关闭位置。其他实施例可能附加地或可选择地包含其他闭锁装置特征,例如磁性耦合器、门夹、球压张紧弹簧销、门碰球等此项技术中已知的其他锁闭装置。
图16所示为仪器300可能包含的其他工艺控制机制。纯化柱通常包括收集纯化产品的输出容器。通常,将柱插入仪器前,用户可以取走输出容器,以便对输出容器贴标签。但是,如果用户忘记对柱内输出容器重新定位,将柱插入,并启动纯化工艺,则会将宝贵的纯化产品撒到仪器板上。这将浪费宝贵的产品,并有可能会造成混乱,导致重新开始使用仪器前需要进行清理。
在图16所示实施例中,接触开关360安装在一个板材上(本实施例中的2号板324上),并在柱301内部对输出容器307进行准确定位后,将其定位在可以与输出容器307接触的位置上。接触开关360确保纯化方案开始前,对输出容器307进行准确定位。例如,接触开关360可以通信耦合控制器,并且如果接触开关360确定输出容器307缺失的情况下,控制器可以防止方案开始和/或向用户提供状态通知。其他实施例可能附加地或可选择地包含其他类型的触点和/或接近传感器,例如本文所述跟仪器300其他组分相关的其他类型的传感器。
此外,仪器300还包括用于确定已经插入纯化柱中的生物样本(例如细菌培养物或其他细胞培养物)的初始光密度(例如od600或a600)的一个或以上光密度传感器。可以通过使用已知波长(通常为600nm,也可以按照样本类型、检测靶和/或其他特殊使用目的,利用其他波长)照亮样本的方式确定光密度,并测量通过样本并到达样本对面检测器的光的数量。此外,还可以在纯化工艺结束时和/或在工艺中间部分,利用光传感器测量样本中的核酸浓度(例如利用230、260和/或280nm波长)。
仪器300也可能包含监控在210或280nm波长吸光度条件下蛋白纯度或浓度、或在不同波长条件下的吸光度比值、使用细胞色素c、亚铁血红素和其他辅因子或辅基评价脱辅酶/全酶状态的一个或多个其他传感器。在一些实施例中,可以附加地或可选择地包含传感器,监控ph值、传导率、折射率、渗透压、氧化还原电位或蛋白聚集。
可以将光密度传感器获得的光密度(od)信息报告给用户,并可以利用其通知用户生物样本是否位于可以处理的合适范围内。例如,光密度传感器可以通信耦合控制器,并且如果所测量的光密度不在优先范围内,控制器可以通知用户和/或防止方案推进。
详见下文所述,光密度读数也可以确定和/或激活更好优化某个生物样本类型的特定纯化方案。例如,在已确定的样本光密度基础上,用于纯化靶核酸的缓冲剂/试剂可以分散在不同体积中。在另外一个实施例中,按照确定的样本光密度情况,样本混合的时间和/或通过纯化柱的一个或以上微孔滤膜/过滤器的时间也可能会发生变化。测量柱不同部位样本和纯化过程不同阶段样本的光密度传感器可以位于不同位置。例如,可以通过将测量的光密度与预期的空气冲击流进行对比,利用光密度传感器确定柱某个特定部位是否存在流体。
可以附加地或选择性地利用光密度信息确定已插入的纯化柱之前是否使用过。例如,某些方案可以要求将生物样本放入纯化柱输入储槽以前,某些方案可能要求提供光密度读数。将任何样本放入柱内以前,光密度初始读数大致相当于空气冲击流读数。较高读数表明柱输入储槽之前已经被开封/打开,并被注入生物样本。例如,之前样本可能在样本室窗户上留下残留物。在这种情况下,控制器可以向用户发出通知,和/或防止方案推进。
图17示意性列举了光密度传感器362的一个实施例。所示实施例包含用作安装在铝板上的发光二极管(led),波长为595nm的光源364。用作安装在印刷电路板(pcb)上的硅检波器的检测器366应配置在光源364对面。应将注有一部分生物样本309的样本室设置在光源364和检测器366中间。样本室包含可以通过发射光的窗户368。光密度传感器362也可以包含一个或以上其他光组件,例如透镜370、扩散器372、过滤器、开口、和/或其他光组件。
所示实施例仅为一个合适的光密度传感器的实施例。此外,还可以利用此项技术中已知的其他光密度传感器配置。例如,其他实施例可能包含备选光源类型、备选检测器类型、备选透镜、过滤器和/或开口结构、备选光路或备选样本室尺寸。若上所述,还可以在不同波长条件下利用一个或以上光密度传感器,提供不同样本信息。例如,可以使用合适波长(例如230、260和/或280nm)并利用一个或以上传感器测量核酸浓度。
仪器泵总成
将纯化柱插入仪器300并启动纯化工艺以后,仪器300可利用一系列泵总成,通过纯化柱,移动并规定流体路径。可配置泵总成,连接纯化柱(例如,当夹紧装置关闭时),在纯化过程中,可规定流体路径。可配置泵总成,作为纯化柱各个处理部分(例如各个微孔滤膜/过滤器)的上游和/或下游。即,可配置泵总成“推动”样本、试剂或工艺下游的其他流体,或“拉动”样本、试剂或工艺下游的其他流体,或二者兼而有之。本文所述泵组件有益于不同黏度和密度流体的移动和输送。
图18a所示为示例性泵组件374(在部分分解图中)。泵组件374包括有电机376,且该电机通过动力传输组件有效连接至凸轮轴378。如图所示,动力传输组件可包括齿轮379,和/或一个或多个其他动力传输部件,例如,传动带、滑轮、链条、链轮等。
连接到凸轮轴378的是多个凸轮元件380(即“偏心爪”)。如图所示,每一凸轮元件380包括用于连接凸轮轴378的固定端382和从凸轮轴378横向(例如,垂直)延伸的尖顶384。凸轮元件380布置在凸轮轴378上,这样一来,转动凸轮轴378可使得凸轮元件尖顶384产生线性蠕动式运动。凸轮元件380和/或泵组件374的其他部件可布置在壳体386内。
图18b是凸轮元件尖顶384的展开图,该凸轮元件尖顶与纯化柱流体通道311/313接触。这里,偏转前的流体通道显示为311,偏转后的流体通道显示为313。可倾斜尖顶384,以实现其与流体通道311/313的有效啮合,尽管根据特定的应用需求和偏好可以使用其他凸轮元件形状。如图所示,凸轮元件380相对于流体通道311/313的移动可导致流体通道发生偏转,从而使得流体通道311/313内的流体得以置换。
图19a至图19f对泵组件374与纯化柱301流体通道315的啮合进行了解释性说明,并进而对凸轮元件380线性蠕动式运动如何驱动流体在流体通道315中实现流体运动进行了展示。图19a至图19d所示为横截面平面图,且这些平面图均垂直于泵组件374的侧面。
图19a显示了凸轮轴378处于任意90度位置时的泵组件374。当凸轮轴378继续转动到图19b所示的180度位置、图19c所示的270度位置,然后转动到图19d所示的0度(即360度)位置时,凸轮元件380与流体通道315的顺序啮合使得流体317流过流体通道315。如图19e和图19f所示,当凸轮轴378通过增加转动圈数继续转动时,凸轮元件380继续以相应的蠕动方式与流体通道315进行啮合,以进一步引导流体317流过流体通道315。
泵组件示例性实施例表明,凸轮轴每转动一圈,可移动约0.16ml流体(例如,约0.05-0.45ml)。当电机转速为每分钟136转时,其所产生的流速约为22ml/分钟(例如,约10-35ml/分钟)。当然,如果电机转速不同、流体通道尺寸不同、凸轮元件数量或方位不同、或流体黏度不同等,则电机转动所产生的流速也会不同。
由泵图解可知,泵组件有益于不同黏度和密度流体的移动。但是,其它实施例可附加地或可选择地包括有其它流体输送方式。例如,泵组件可利用滚轮机构来压紧流体通道,然后使其沿流体通道直线移动以移动流体。
仪器控制系统
图20a对示例性控制系统388进行了示意性说明,该控制系统可用于实现对仪器300各种组件和操作的控制。控制器390包括有一个存储器392a(即,物理存储介质或硬件存储设备)和一个或多个处理器392b(和/或合适的微控制器)。如上所述,控制器390可以互动性方式连接到用户界面318,以通过用户界面318接收用户输入的信息,并向用户界面318发送显示信息。
控制器390还可以互动性的方式连接至一个或多个传感器399,例如本文所述的位置传感器。此类位置传感器包括检修门传感器346/348(例如,霍尔效应传感器)、纯化柱接触开关352、输出容器接触开关360,以及光密度传感器398(或多个这样的传感器)。如上所述,可基于此类传感器的测定状态来运行控制器390,以发送用户通知和/或暂停或停止纯化过程。
如上所述,以光密度传感器398为例,控制器390可用于接收光密度信息和发送(用以表明光密度信息和/或光密度测定是如何与优选方案范围相关联的)用户通知。在一些实施例中,控制器390可用于基于从光密度传感器398接收到的光密度信息来指示先前是否使用了插入式纯化柱,并且其还可以用于发送通知和/或停止纯化过程。
控制器390还可以互动性的方式连接至纯化柱传感器396,而纯化柱传感器396用于连接与插入式纯化柱,以从纯化柱获取识别信息。例如,纯化柱396可包括有一个条形码读取器和/或其他合适的能够读取纯化柱标识符或代码的传感器。识别信息可包括批号、有效期、库存单位编号、纯化柱类型、纯化柱相关使用次数、纯化柱相关可使用次数等。
仪器不必受限于所示传感器的数量和/或类型。例如,在一些实施例中,可附加地或可选择地包括有一个或多个流速传感器、温度传感器、延时传感器、体积传感器、重量传感器和/或用于测量纯化工艺其他参数的其他类型传感器。
控制器390还可以互动性的方式连接至一个或多个执行机构397。例如,当其连接至夹紧电机338时,可实现对夹紧机构活动的控制;当其连接至泵组件374时,可通过纯化柱实现对泵组件374内流体活动的控制。该系列执行机构397还可包括一个或多个密封执行机构391和/或阀门执行机构393。密封执行机构和阀门执行机构用于有选择性地破坏纯化柱中的流体密封和控制纯化柱中阀门的启闭(关于此点,在本文其他地方有更详细的描述)。该系列执行机构397还可包括有一个或多个混合执行机构395。在优选实施例中,混合执行机构包括可旋转磁体,其安置位置与设置在纯化柱混合室内相应的磁性搅拌元件对齐。
控制器390还可以互动性的方式连接至通信硬件394。通信硬件394可包括一个路由器和/或其它网络硬件。路由器和/或其他网络硬件用于为网络(例如,局域网(lan)、广域网(wan)、云网络)、外部服务器系统、外部计算机装置、分布式计算机系统,以及有线或无线连接网络中的一个或多个提供通信服务。通信硬件394还可包括通过直接连接即可实现数据上传或下载的组件,例如以太网端口、个人计算机存储卡国际协会(pcmcia)插槽或通用串行总线(usb)端口等。
在一些实施例中,作为“智能”纯化系统的一部分,控制器390用于基于接收自一个或多个传感器的输入信息,自动改变纯化方案。例如,输入样本的测定光密度可用以调整纯化程序的一个或多个操作参数。此类可变操作参数可包括,例如,纯化程序过程所用仪器移动的一种或多种试剂的体积、泵送时间和/或通过泵送组件驱动的泵送速度。举例来说,细胞捕获/过滤步骤通常作为纯化程序的初始部分来执行。当输入样本的光密度较高时,该细胞捕获/过滤步骤将在较长的时间内予以优先执行。作为另一实例,当输入样本的光密度较高时,可优先使用用量较大的一种或多种试剂。
此外,控制系统388还可与用户库存数据库建立通信,以实现对用户组织或实验室内消耗性产品(例如缓冲液、试剂、纯化柱)使用情况和可用性的跟踪。控制系统或用户库存数据库可关联于一个或多个规则。当阈值或触发条件达到时,这些规则可向用户发出提示。例如,当可用库存低于阈值水平时,即有规则来提示用户购买额外的消耗品(或促成购买活动)。值得重视的是,与本文所述系统相关联的任何数量或类型的触发条件,均可预先对其进行确定和/或改变,以满足单独用户的需求或偏好。
作为进一步的例子,图20b说明了一种用于执行纯化程序的示例性方法400。方法400可以使用合适的计算机控制系统来实施,例如图20a所示的控制系统388。在所示方法400中,控制系统可用于从一个或多个传感器接收传感器数据,以确定一种或多种工艺状态(步骤402)。上述一个或多个传感器可包括图20a所示传感器399中的任何一个或所有和/或本文中所描述的其他传感器(例如温度传感器、体积传感器、重量传感器、盒式扫描仪(如条形码或二维码扫描仪)等。工艺状态可包括由此类传感器进行的任何测量操作。此外,工艺状态数据还可包括用户输入的和/或从特定纯化柱获得的信息,例如纯化柱类型(如阴离子交换和沉淀或硅基捕获)、样本类型(如细胞培养、环境、临床、食品或法医样本)等。
然后,控制系统可将所确定的工艺状态与存储在方案库中的一系列不同方案进行比较(步骤404)。方案库可存储在控制器390的存储器392a中,和/或可通过控制器390与一个或多个服务器系统、“云”数据库等之间的网络通信来实现对其的访问。方案库包括涉及不同可能工艺状态的不同纯化方案。例如,方案库可包括与“低”初始光密度读数相关联的纯化方案、与“中等”初始光密度读数相关联的不同纯化方案,以及与“高”初始光密度读数相关联的不同纯化方案。当然,不同方案的数值不必局限于低/中/高分类。例如,可以基于任何期望的粒度级别数值范围,来对不同方案的数量进行区分归类。
每一单独的纯化方案都可以对执行纯化工艺所需的工艺步骤和参数进行定义。例如,纯化方案可定义是否使用细胞捕获和/或细胞裂解、细胞捕获和/或细胞裂解的持续时间、所用试剂、所用试剂量、是否和/或何时在一个或多个纯化步骤中执行混合工艺、一个或多个混合步骤的持续时间和/或速度、一个或多个纯化步骤之间的泵送持续时间和/或速度、是否和/或何时打开和关闭纯化柱内的一个或多个阀门、是否和/或何时刺穿纯化柱内的一个或多个密封(以允许相应的液体释放或气体排放)、涉及的核酸捕获类型、核酸捕获持续时间、待捕获蛋白的类型、靶蛋白捕获的持续时间或其组合。
然后,控制系统可基于所确定的工艺状态从方案库中选择一种纯化方案(步骤406)。例如,基于特定的一组确定工艺状态,可选择一种纯化方案作为其最佳匹配;或基于相互排斥的对应工艺状态,可从一系列纯化方案中选择一种纯化方案作为其唯一匹配。
然后控制系统会根据操作者(在步骤408中)的选定纯化方案控制一台或多台仪器的执行机构实施与选定纯化方案相关的操作。此处所提到的一台或多台仪器的执行机构可以包括图20a中所展示的任何或所有的执行机构397。举例来说,根据当前选定纯化方案,如果需要在某个过程步骤中实现特定的搅拌速度和时长,那么控制器390会根据上述要求驱动相应的搅拌操作执行机构395来完成选定纯化方案中指定的那部分任务。在另一个实例中,根据选定纯化方案中的具体要求,如果我们需要在纯化程序的执行过程中使用特定数量的试剂,而且该试剂需要在整个纯化的过程中多次添加,那么控制器390就会根据选定纯化方案的要求控制与该过程相关的封闭式执行机构391、泵机总成374和/或阀门执行机构393沿着特定的管线路径完成试剂添加的操作。在第三个实例中,如果选定纯化方案中要求实现特定的调用捕获时长(如根据初始光密度值进行的预估),那么控制器390就会相应地按要求控制相关的封闭式执行机构391、泵机总成374和/或阀门执行机构393,从而确保调用捕获过程中的时长符合相关要求。
在一些实施方式中,方法400可以实现迭代操作。如箭头410所示,当选定纯化方案正在被执行时,控制器390可以继续接收额外的传感器数据,从而对一个或多个更新后的过程状态进行处理。然后系统可以将更新后的过程状态与方案库中的内容进行比对,同时根据最新获取到的测量结果对执行中的纯化方案进行相应的更新/修改。这有利于系统根据上一个过程步骤的实施结果在每两个步骤的实施过程之间对纯化程序进行重新优化。例如,如果传感器数据显示系统在细胞捕获步骤中搜集到了少量的溶菌产物,而这显然与基于输入样本的初始光密度值所预想的结果不相符,那么系统就可以对最初选定纯化方案进行更新/修改,以便更好地根据所检测到的溶菌产物的数量对后续过程中试剂的用量和/或使用时机、搅拌操作、泵送操作以及其它类似参数进行调整。
本公开中的控制系统388可以含有及使用专用的或通用的,包括计算机硬件在内的各种计算机系统,或与这类计算机系统进行通信。本发明专利范围内的控制系统388还可以包含物理的以及其他形式的计算机可读介质,以便用于承载或存储各类计算机可执行指令和/或数据结构。上述可由计算机进行读取的介质可以是任何现有的存储介质形式,而且这种存储介质应当可以在各类通用的或是专用的计算机系统上进行访问读取。用于存放计算机可执行指令的计算机可读介质应为物理的存储介质(如各类硬件存储装置等)。用于承载计算机可执行指令的计算机可读介质应为可传输介质。因此,本专利的实施例可能包含至少两种完全不同类型的计算机可读介质,举例来说,可以是但不仅限于计算机可读硬件存储介质以及用于数据传输的计算机可读介质。
上述计算机可读硬件存储介质包括随机存储器、只读存储器、电可擦可编程只读存储器、只读光盘驱动器或其他类型的光存储介质(如cd、dvd等)、磁盘存储器或其他的磁性存储装置、或任何其他可以用于存储所需的程序代码的介质,而这些程序代码可以是计算机可执行指令或相关数据结构,而且应该可以利用通用或专用的计算机系统进行访问读取操作。
本公开中的“网络”应由一个或多个数据链路组成,用于在多个计算机系统和/或模块和/或其他的电子装置之间进行电子数据的传输。当通过网络或其他的通讯连接(可以是有线连接、无线连接或有线无线的混合组网)向电脑传输或提供信息时,电脑应将该连接视作一种传输介质。此处的传输介质可能包括用于承载所需程序代码的网络连接和/或数据链路,而这些程序代码可以是计算机可执行指令或相关数据结构,而且应该可以利用通用或专用的计算机系统进行访问读取操作。上述传输介质的混合形式同样属于计算机可读介质的范围。
另外,以计算机可执行指令或数据结构形式存在并被传输到各类计算机系统组件的程序代码可以自动地被本系统从计算机可读传输介质转移到计算机可读硬件存储介质(反之亦然)。例如,当计算机系统通过网络或数据链路接收到计算机可执行指令后,会将其缓存在网络接口模块(如网路界面卡)的随机存储器中,并最终将指令传输到计算机系统的随机存储器中和/或计算机系统中相对更加安全的计算机可读硬件存储介质中。因此,计算机可读硬件存储介质与其他同样(甚至主要)用到传输介质的计算机系统组件属于同一类组件。
计算机可执行指令包括各种指令和数据数据,例如用于在通用计算机(目标计算装置等)、专用计算机(传感器和/或目标计算装置等)或专用处理设备上实现特定功能或功能集合的指令和数据。计算机可执行指令可以是各种不同的形式,如二进制文件、汇编语言等中间格式指令,或者甚至是源代码。
本文所描述的功能可以附加性地或选择性地执行,但至少应在一个或多个硬件逻辑组件上实现部分的功能。例如,可使用的说明性硬件逻辑组件包括但不仅限于现场可编程闸阵列(fpga)、特定程序集成电路(asic)、特定程序标准产品(assp)、单片机系统(soc)、复杂可编程逻辑控制装置(cpld)等。
另外,在本公开中提到的计算机系统之间进行的无线通信可以是基于该技术领域内的所有无线方案,包括如蓝牙、无线个域网、超宽带(uwb)和无线局域网等。相应的,应注意到的是即便在所有公开的实施例中已特别提到过或描述过某特定的无线方案(或相应组件),在确保实现已公开的功能和/或实施类似功能或完成本质上类似任务的基础上,我们仍可将实施例中所提及的具体无线方案替换为该技术领域中的任一种其他的无线方案。
流体密封和阀动装置
以下公开涉及了一种可以用于对所选择的靶生物分子实施自动纯化操作的靶生物分子纯化柱的示例性实施例,如靶核酸纯化柱或靶蛋白纯化柱等。流体密封和阀动装置实施例可以用于本文中所描述的其他组件。例如,可以将密封和阀动组件与上文中提到的易耗(如一次性的)纯化柱进行整合,并用于上文中所提到的靶生物分子纯化仪器(如靶核酸纯化仪器或靶蛋白纯化仪器)等装置,和/或用于上文所述的一个或多个流体释放机制。在优选实施例中,流体密封、阀动装置、流体管路和连接、流体储槽和薄膜/过滤器主要用于减少或去除可能会污染或以共价方式改变纯化后的生物分子,尤其是纯化后的靶蛋白的浸出物。
密封和阀动装置概述
传统的核酸纯化程序或蛋白纯化程序需要手动在实验室完成,因此需要较高的实验室专业技术和较长的时间。之前业内曾有过一些将纯化过程及步骤进行自动化改造的尝试,但最终只是改进了承载样本的纯化柱,发明了刚性聚合物纯化柱。由于需要在特定的时间点对流经特定路径的流体的量进行控制、对流体进行混合操作并通过纯化柱控制流体的通断,进而成功完成纯化程序,这种纯化柱通常比较复杂且成本很高,且当涉及大量样本时,尤其如此。
尤其需要注意的是,在进行混合操作之前,必须对不同种类的流体进行密封,也就是流体相互之间应完全隔离。由于需要使流体以相对复杂的路径移动,且移动的过程应满足各种时间参数要求,因此对这些流体进行密封隔离变得更加困难。比如,如果要以泵送的方式使流体沿着所需的路径流动,那么可能引起相应的压力差,该压力差可能会对旨在将纯化柱的流体通道进行分隔的流体密封装置造成一定压力。为了避免泄露,传统的纯化柱在制造时所使用的密封体本身就可以承受这种压力差,但这也极大地增加了相关部件和/或纯化柱的制造成本。例如,在制造较大长度的流体密封件时通常需要在注塑件之间实施复杂的超声波焊接操作。这些额外的成本及费用使得“易消耗的”、“用完即可丢弃的”、“只使用一次的”或“一次性”的纯化柱变得很不经济,即便这种纯化柱可以直接供应给用户,有使用便利、节省时间等优点。
因此,如何确保设计好的纯化柱能够保证有效的流体密封和阀动性能,我们在这方面面临着众多的挑战。正如下文的很多具体细节中所将要描述的那样,通过采用更为有效的密封和阀动装置,本文中所提到的纯化柱能够很好地应对上文中所提到一个或多个挑战。例如,正如下文的很多具体细节中所将要描述的那样,该纯化柱中包含一个位于两个相对坚硬的外部层之间的弹性体层。该弹性体层中含有很多密封骨条,当该弹性体层受到两边的外部层挤压时,这些密封骨条就会对外部层中形成的流体通道起到流体密封的作用。
这种结构设计使用了较为便宜的材料和更加简单的制造方法。例如,这种纯化柱不需要实现较大的流体密封长度,因此也就不需要实施较长的且复杂的超声波焊接操作。通过将压力转移至外部仪器或部件,我们可以将成本和费用从易消耗的纯化柱(通常使用次数较为有限)转移至较为长时间使用的其他装置上。
这个设计还有一个额外的好处,那就是这里的弹性体层也可以用于实现阀动功能。因此,所有的纯化柱阀体只需由一个组件组成,而传统设计中,每个阀体都需要由各自独立的组件组成。在下文中会对这些优点以及能够带来这些优点的结构组件进行详细的说明。
密封骨条
图21以示意图的形式对纯化柱501进行了说明,可以看到由于有很多聚合物密封骨条522,纯化柱501中形成了一系列的流体通道。密封骨条522将上述纯化柱分隔为不同的部分,从而对各个流体通道起到了限流的作用。根据图片所示,其中一些由于密封骨条的作用而形成的流体通道最终构成了相对狭窄的流体路径504,而其他的流体通道则构成了相对较宽和较大的流体储槽506。根据本文所提到的用途,“储槽”一般指的是用于对流体进行储存、混合、过滤、分离和/或实现流体反应的纯化柱的一部分,而这些储槽之间形成的狭窄通道主要用于在储槽之间输送流体。
图22展示的是一段纯化柱501的剖面图,可以看到该纯化柱由多个不同的层组成,这些层进一部形成各个流体通道。图22中还展示了流体通道524的横截面视图。这里展示的纯化柱横断面为垂直方向,优选实施例中的纯化柱的方向与此相同。但是,需要明白的是本文中此处所描述的特征并不意味着所有应用实例均应是垂直方向。在实际操作中可根据特定的应用需求和/或喜好采用其他的方向布局。
说明中的实施例含有第一外部层508。第一外部层508由第一侧面510(例如内侧面)和第二侧面512(例如外侧面)组成。第二外部层514则被布置与第一外部层508的第一侧面510相对的位置。与此相似的是,第二外部层514也是由第一侧面516(例如内侧面)和第二侧面518(例如外侧面)组成。
如图中所示,第一外部层510可以带有向外突出的凹槽或槽沟,从而形成流体通道524的通道壁526。流体通道的横截面形状可以如实例中展示的那样呈弧状,同时其内部部分通常要比外部部分更宽(如流体通道的底部或“最低点”)。本文中所展示的实施例,其通道壁526呈隆起状,从最低点处移动至与最低点相对的转折点527处。其他实施例可以包括具有不同截面形状的流体通道,包括多边形,例如,矩形截面形状。
位于第一外部层510和第二外部层514之间的是弹性体层520。弹性体层520包括密封骨条结构522。如图所示,一对密封骨条522朝着第一外部层508的第一侧510进行延伸,并与第一外部层508的第一侧510进行接触,从而使得密封骨条522位于流体通道524的两侧。密封骨条522由此限定了流体通道524的宽度,并限制了流体在通道524内的“向上”和“向下”(从图22的角度来看)运动。如图所示,密封骨条522可以进行定向,使得每个条522的顶点(即最内侧的点)和对立拐点527相对应或者超出拐点527(相对于通道最低点来说)。
在图示的实施例中,弹性体层520和第一外部层508和/或第二外部层514之间可以存在公称间隙521。公称间隙521为密封骨条522的弹性体材料留出空间,以便在压缩时偏转。密封骨条522也优先与流体通道壁526间隔稍远的距离,以便在压缩的时候,这些密封骨条不会偏转和过度覆盖流体通道。
弹性体层520可由各种合适的弹性体材料形成,包括热固性弹性体和热塑性弹性体。合适弹性体的非限制性示例包括天然橡胶、异戊二烯橡胶、丁二烯橡胶、氯丁橡胶、丁基橡胶、卤代丁基橡胶如氯丁橡胶和溴丁橡胶、苯乙烯-丁二烯橡胶、丁腈橡胶、乙丙橡胶、乙丙二烯橡胶、环氧氯丙烷橡胶、聚丙烯酸橡胶、硅橡胶、氟硅氧烷、氟橡胶、全氟橡胶、聚醚嵌段酰胺(peba)、氯磺化聚乙烯、乙烯-醋酸乙烯酯、闭孔泡沫及其组合。举例来说,弹性体层可以具有约5至约500mpa、或者约10至约100mpa的杨氏模量。
外部层508和514可以由各种合适的材料形成。外部层508和514优选具有比弹性体层520更大的刚性(例如,更高的杨氏模量)。优选地,外部层508和514由在热成型工艺中易于被制造出来的聚合物材料形成。非限制性示例包括聚乙烯、聚丙烯、聚碳酸酯、聚对苯二甲酸乙二醇酯、聚苯乙烯、聚氯乙烯、其它聚合物及其组合。距离来说,外部层508和514可以具有约500至约4000mpa的杨氏模量。
图22所示的实施例包括形成在第一外部层508中的流体通道524,并且包括朝向第一外部层508进行延伸的密封骨条522。虽然此处并没有显示,但是,纯化柱还可以包括一个或多个形成在第二外部层514中的流体通道,以及从弹性体层520向第二外部层514进行延伸的相关密封骨条。
当弹性体层520被压缩在第一和第二外部层508和514之间时,密封骨条522用于对流体通道524进行密封,从而将其与任何其他流体通道进行流体分离。图23a和23b展示了在第一夹紧板532和第二夹紧板534之间进行夹紧的纯化柱501示例。图23a显示了对纯化柱501压缩之前的夹紧板532和534,图23b显示了纯化柱501完全压缩在夹紧板532和534之间。
配置夹紧板532和534的尺寸和形状,是其位于纯化柱501的两侧,以允许压缩纯化柱501的含密封骨条部分,同时,使诸如储槽506的其他部分不被压缩。例如,夹紧板532和534可以包括孔536,孔536允许储槽506的大部分避免被压缩,而底层密封骨条则被定位成接受压缩。
密封骨条结构用于承受至少约500lbf磅力的压缩,或者优选高达约15,000lbf磅力的压缩,压缩施加在密封骨条结构的整个长度上。当在这些类型的载荷下被压缩时,密封骨条可能会偏转约20%至约30%,或者更多。这样的压缩已被证明能够充分维持每英寸约4.5lbf的密封力,能够在超过50到60psi的压力下维持密封。
压缩可以由纯化仪器的夹持机制提供,如本文其他地方所描述的与纯化仪器有关的机制。然而,其他实施例可以利用其他夹持机制,这些机制的操作不一定需要纯化仪器的驱动。例如,一些实施例可以包括具有可消耗中间部分和两个可重复使用板部的纯化柱,该纯化柱可以位于中间部分,并在使用前拧紧,以压缩中间部分。
阀体
纯化柱501可以包含在不同位置的多个阀门,这些阀门可以在纯化程序中选择性地打开和关闭,以引导流体的流动。例如,一个或多个阀门可以位于纯化柱每个储槽附近,并用于在纯化过程中对流体进入和/或离开储槽进行控制。
图24以横截面的方式展示了示例性阀门机制540。关于阀门机制540的阀部件,通过利用在纯化柱501其他地方所用的相同弹性体层520形成密封骨条522,从而有利地形成该阀门机制的阀部件,减少了必要的部件数量,简化了纯化柱的制造。
如图所示,弹性体层520包括可偏转部分542,该可偏转部分延伸穿过形成在第二外部层514中的孔528。可偏转部分542在此显示为“圆顶”形结构。然而,其他实施例可以提供其他形状的可偏转部分。可偏转部分542偏向于外侧,使得形成于第一外部层508中的流体通道523和流体通道525之间设有开口530。
在开放状态下,流体503能够自由地通过在流体通道523和525之间所形成的护道546。当柱塞505或其他合适的结构与可偏转部分542进行啮合,并使其朝护道546偏转时,该阀门可被驱动并移动到关闭状态。可偏转部分542面向护道546的一侧可以包括密封骨条544,该密封骨条可以在来自柱塞505的压迫下与护道546进行啮合,以帮助关闭开口530,并将流体通道525从流体通道523中密封起来。当柱塞505缩回时,可偏转部分542回弹到其正常几何形状,从而重新打开阀门。
可偏转部分542优选地能够在达到30psi以上的压力下,或甚至在50至60psi以上的压力下保持关闭。这就转化为对可偏转部分542需要约为5lbf的力道,以将其保持在关闭位置。因此,可偏转部分542应优选地用于承受约3至7lbf的磅力,和/或高达约50至60psi的磅力,而不至于失效或“破裂”,导致流体通过。
柱塞505可以是纯化仪器的一部分,在该纯化仪器中能够对纯化柱501进行处理。例如,多个柱塞可以安装到本文所述的纯化仪器的一个或两个夹板上。
密封骨条522和544的横截面形状在前述例子中显示为具有半圆形几何形状(例如,大体上类似于o型环几何形状)。其他实施例可以包括其他截面形状,包括其他曲线形状或者多边形状,如三角形。
应当理解的是,上述关于任何靶生物分子纯化系统和纯化柱所公开的任何处理系统、阀体、密封等,都可以在适当情况下利用和适应于专门为靶核酸或靶蛋白自动纯化而配置的系统和纯化柱。
定义术语缩略表
为了帮助理解本书面说明和所附权利要求的范围和内容,下面直接对一些术语进行了定义。除非另有定义,本文中所使用的所有技术和科学术语与本公开中所涉及的技术领域普通技术人员所通常理解的含义相同。
本文所使用的术语“大约”、“约”和“大致”表示接近具体所述的数量或条件,该量或条件仍然执行所需功能或实现所需结果。例如,术语“大约”、“约”和“大致”可以指与具体所述之数量或条件相差小于10%、或小于5%、或小于1%、或小于0.1%、或小于0.01%的数量或条件。
术语“缓冲液”在上下文中指任何合适的缓冲液、洗涤液、重悬缓冲液、裂解缓冲液液、中和缓冲液、rnase(或其他酶)、结合缓冲液/溶液、洗脱/收集缓冲液或沉淀缓冲液,这些缓冲液可根据正在执行的方案与或不与任何附加合适试剂一起使用。合适的缓冲液及其组成和使用方法在下列美国专利参考文献中公开:u.s.pat.no./u.s.pat.公开日期:2012年1月26日第6,914,137号、第2006/0154247号、第2007/0117972号、第6,242,220号、第5,990,301号、第7,214,508号、第7,109,322号和第6,297,371号文件,所有这些文件均在此以引用方式全部纳入。
根据目前所描述的系统和方法的示例性重悬缓冲液,可以包括任何合适生物可接受的缓冲液,例如,tris、taps、bicine、tricine、hepes、tes、mops、pipes、cacodylate、mes、乙酸酯或类似物,其酸碱度值在约3.5至约9之间、约5至约8之间或约6.5至约7.5之间。此外,重悬缓冲液可包括1mm至100mm、5mm至50mm或10mm至20mm的螯合剂,例如edta、egta、ala、βαρτα、defarasirox、deferiprone、deferoxamine、dtpa、dimercaprol、dmps、dmsa或者类似物。重悬缓冲液可选地包括核糖核酸酶,例如从任何一种或多种核糖核酸酶a核糖核酸酶η、核糖核酸酶i、核糖核酸酶iii、核糖核酸酶l、核糖核酸酶ρ、核糖核酸酶phym、核糖核酸酶tl、核糖核酸酶t2、核糖核酸酶u2、核糖核酸酶vi、核糖核酸酶v、核糖核酸酶、核糖核酸酶pei、核糖核酸酶ii、核糖核酸酶r、核糖核酸酶d、核糖核酸酶t、核糖核酸外切酶i,核糖核酸外切酶ii等等中选择的一种或多种内切核糖核酸酶和/或核糖核酸外切酶。在一些实施例中,重悬缓冲液可选地包含溶菌酶或介于约1mm至约500mm之间、约10mm至约200mm之间、约20mm至约100mm之间、约30mm至约75mm之间的碳水化合物(例如糖)。典型性的糖包括葡萄糖、果糖、半乳糖、甘露糖、麦芽糖、乳糖等。
例如,重悬缓冲液可以为含50毫米三盐酸(ph8.0)和10毫米edta的水溶液。在另一实施例中,重悬缓冲液可以为含有50mmtris-hcl(ph8.0)、2.4mg/mlrnasea和10mmedta的水溶液。在另一非限制性示例中,重悬缓冲液可以为含有50mmtris(ph7.4)、100pg/mlrnaseal、10mmedta和5mm葡萄糖的水溶液。
对于裂解溶液或缓冲液,合适的裂解溶液或缓冲液可在水性载体介质中包括一种或多种变性剂与一种或多种脂质破坏剂的组合。变性剂可以为核酸变性剂,例如碱性盐。合适的碱性盐包括氢氧化钠、氢氧化钾及氢氧化钙等。合适的脂质破坏剂包括离子表面活性剂。典型的离子表面活性剂包括胆酸钠、十二烷基硫酸钠(sds)、脱氧胆酸钠(doc)、n-月桂酰肌氨酸盐、十六烷基三甲基溴化盐(ctab)和双(2-乙基己基)磺酸琥珀酸盐等。
作为非限制性示例,本文中使用的裂解缓冲液可以为含有1%(v/v)十二烷基硫酸钠(sds)和200mm氢氧化钠的水溶液。作为另一非限制性示例,典型的裂解溶液可以为含有约10mm至约500mm、约50mm至约250mm、约100mm至约200mmnaoh与高达约10%(v/v)sds、多达约5%(v/v)sds或多达约1%(v/v)十二烷基硫酸钠(sds)的水溶液。裂解缓冲液中可能存在额外的药剂,熟练技术人员很容易识别这一点。
对于中和溶液,合适的中和溶液是指在适当的水载体介质中,一种或多种能中和溶解溶液中的表面活性剂或碱性溶液的药剂。在一些实施例中,中和溶液含有约0.5m至约5m的乙酸盐,其ph值大于4。典型的中和溶液包括ph值约为5.5的3.1μ乙酸钾水溶液。
在一些实施例中,例如蛋白纯化,可使用不破坏蛋白结构和功能的非离液缓冲液和试剂。
合适的洗涤缓冲液是指在适当的水性载体介质中0.1mm到大约100mm的盐,约0.5mm至约500mm的适当的生物缓冲液,使得洗涤缓冲液的ph值至少约为6.0或更高,以及至少5%(v/v),至少10%(v/v)或至少15%(v/v)的酒精,例如乙醇或异丙醇。在示例性实施例中,洗涤缓冲液可为ph值5.0的水溶液,含有812.5mm氯化钠(nacl)和100mm乙酸钠三水合物。在另一个非限制性示例中,洗涤缓冲液可以为ph值5.0的包括1.5氯化钠,100mm三水乙酸钠的溶液。可选地,洗涤缓冲液含有约0.01%(v/v)至多达约10%(v/v)的非离子清洁剂,例如
在一些实施例中,超纯水或蒸馏水可用于洗脱靶核酸。或者,亦可使用te缓冲液或洗脱缓冲液。te缓冲液包括含有ph值为8.0的10mm三羟甲基氨基甲烷(tris)和0.1mm乙二胺四乙酸(edta)的水性载体介质。洗脱缓冲液包括在合适的水性载体介质中的盐、ph值在5.0-9.0之间的至多约150mm的生物缓冲液和至多约10mm的螯合剂。典型的洗脱缓冲液包括ph值为8.5的100mm盐酸三(羟甲基)氨基甲烷(trishcl)和1250mm氯化钠(nacl)。另一洗脱缓冲液的非限制性示例包括ph值为8.0的10mm盐酸三(羟甲基)氨基甲烷(trishcl)与1mm乙二胺四乙酸(edta)的结合。
在一些实施例中,使用之前可使平衡缓冲液可选地通过在任何第一或第二生物处理组件中使用的膜或过滤器。在这些实施例中,平衡缓冲液包括1μ的盐、500mm的ph值在5.0-9.0之间的生物缓冲液、约10%(v/v)的非离子洗涤剂和约20%(v/v)的乙醇。典型的平衡缓冲液包括,例如750mm氯化钠(nacl)、ph值为7的50mm两性离子缓冲液(mops)、15%(v/v)异丙醇和约0.15%(v/v)
在一些实施例中,沉淀缓冲液可在使用前可选地通过沉淀过滤器。沉淀缓冲液包括多达5μ的乙酸钾、多达500mm的ph值在约5.0-9.0之间的生物缓冲液。典型的沉淀缓冲剂包括ph值5.5的3.1m乙酸钾。
本文所使用的术语“大体积”,包括任何大于约5ml的体积,尤其指任何大于约10ml的体积或介于10ml至5l之间的体积范围。本文所用的术语“大体积”应理解为通常是参照生物样本,包括至多250ml、10-250ml、50-200ml、100-150ml、100ml-2l,或介于两者之间的任何范围或数值。例如,可以使用大体积为150ml的公开的系统、方法和装置从大量细菌培养物中纯化质粒dna。作为附加的非限制性示例,大体积包括多达1l的尿液。需要指出的是,本文所公开的系统、方法和装置可适当调整用以处理不同体积的生物样本,包括比上文所述体积更小的体积。
本文使用的术语“靶生物分子”意在理解为源自生物或环境源的核酸或蛋白(如本文所定义)。
本文所采用的术语“靶核酸”,旨在理解为源于生物学或环境源的核酸序列,并且可以是基因、调节序列、基因组dna、质粒dna、cdna或rna中的一种或多种。如本文所述,靶核酸可以采取任何前述形式和具有任何长度,尽管在优选实施例中,靶核酸构成了从细菌培养物中获得的质粒。
本文所使用的术语“靶蛋白”旨在被理解为来自生物源或环境源的蛋白序列。该序列可以是多肽、寡肽、糖蛋白、脂蛋白、磷蛋白、膜蛋白或任何蛋白形式。如本文所概述,靶蛋白可采取上述任何蛋白形式且可为任何长度,尽管在优选实施例中,靶蛋白仍处于其生物活性状态和结构,这种状态和结构可包括天然翻译后修饰且可以是无污染或无化学修饰的。
本公开的各个方面,包括装置、系统和方法,可以参考一个或多个实施例或实施来说明,这些实施例或实施在性质上是示例性的。如本文所使用的,术语“示例性”意指“用作示例、实例或说明”,并不一定被解释为比所公开的其他实施例更优先或更有利此外,引用本公开或本发明的“实施”包括对其一个或多个实施例的具体引用,反之亦然,并且旨在不限制本发明的范围(根据所附权利要求而不是通过以下描述而定)的前提下提供说明性示例。
如说明书中所用,以单数形式出现的词包括其复数对应词,而以复数形式出现的词也包括其单数对应词,除非另有隐含或明确的理解或说明。因此,应当注意到,如在本说明书和所附权利要求中所使用的,除非上下文另有明确规定,否则单数形式“一个”、“一种”和“该”包括复数指代物。例如,对单数指代(如,“小部件”)的引用包括一个、两个或多个指代,除非另有隐含或明确的理解或说明。类似地,除非内容和/或上下文另有明确指示,否则对多个指代的引用应被解释为包括单个指代和/或多个指代。例如,对复数形式的指代(如,“小部件”)的引用不一定需要多个这样的指代。相反,这会被理解为,不依赖推断的指代数量,除非另有说明,此处的一个或多个指代均为估计的。
如本文所用,方向性术语,如“top(顶部)”、“bottom(底部)”、“left(左)”、“right(右)”、“up(上)”、“down(下)”、“upper(上面的)”、“lower(下面的)”、“proximal(近端)”,“distal(远端)”等在本文中仅用于指示相对方向,而不是为了限制本公开和/或本要求保护的发明的范围。
结论
此处使用的术语和表达被用作描述性术语而非限制性术语,使用此类术语和表达无意排除所示和所描述的特征或部分的任何同等物,但公认在所要求保护的发明范围内可以进行各种修改。因此,应当理解,虽然本发明已经部分明确公开优选实施例、示例性实施例和可选特征,但是本领域技术人员可以采取本文所公开的概念修改和变动,并且这些修改和变动被认为是在所附权利要求所限定的本发明的范围内。本文提供的特定实施例是本发明的有用实施例以及本文所示的发明特征的各种变动和/或修改的示例,并且,本公开所示且遵循的原则(可能发生在相关技术领域的技术人员身上)可另行应用于所示实施例,而无须脱离权利要求所定义的本发明的精神和范围,并且被认为是在本公开的范围内。
还应认识到,根据本公开的某些实施例,系统、设备、产品、套件、方法和/或流程可以包括、包含或以其他方式包含本文公开和/或描述的其他实施例中所述的属性或特征(例如,组件、构件、元件、部件和/或部分)。因此,某些实施例的各种特征可以与本公开的其他实施例兼容、组合,涵盖进和/或并入到其他实施例中。因此,公开与本公开特定实施例相关的某些特征的不应被解释为限制将所述特征应用于或包括到特定实施例中。相反,应当认识到,其他实施例也可以包括所述特征、构件、元件、部件和/或部分,而不一定脱离本公开的范围。
此外,除非一项特征被描述为需要与之结合的另一特征,否则本文中的任何特征可以与本文公开的相同或不同实施例的任何其他特征组合。此外,为了避免混淆示例性实施例的各方面,本文不对说明性系统、方法、设备等的众所周知的方面进行详细描述。然而,本文也考虑了这些方面。
总体看来,本申请书中引用的所有参考文件是合并编辑的,但前提是它们与本申请书中的公开内容不矛盾。对于本领域技术人员来说,显而易见的是,非本文特定描述的方法、装置、装置元件、材料、程序和技术可以应用于本文广泛公开的本发明的实践,而不需要借助于过度的实验。本文中特定描述的方法、装置、装置元件、材料、程序和技术的所有该领域已知的功能性等效物意欲包含在本发明中。
当本文公开一组材料、成分、组分或化合物时,应理解为所有这些单项及其所有次项都是单独公开的。当在本文中使用markush组或其他分组时,组的所有单项以及所有可能的组合和子组合都旨在被单独包括在本公开中。除非另有说明,否则本文所描述或例示的每种组分的配方或组合可用于实施本发明。每当说明书中给出范围时,例如,温度范围、时间范围或成分范围,所有中间范围和子范围以及包含在给定范围中的所有单个值都旨在包括在本发明中。
权利要求中的等效含义和范围内的所有变更均应包含在其范围内。
实施例
提供以下示例是为了说明本文公开的各种实施例的实施,并且旨在成为示例性的,且必定限制本文公开的范围和/或内容。
例1
本文公开的一种仪器和附带的一次性纯化柱被直接从细菌培养物中用于全自动质粒dna纯化方案。
为了用靶核酸(例如质粒dna)培养细菌,需要从严格筛选的新划线平板中挑选一个含有相关质粒的细菌单菌落接种,并接种1mllb培养基的起子培养物(含适当的选择性抗生素,本例中为氨苄西林)。培养物需在37℃和剧烈振荡(300rpm)的环境中培养8小时。接下来,起子培养物在5l的烧瓶中按1:1000比例在含有适当的选择性抗生素的lb培养基中稀释。1l培养物在37℃下培养14小时,剧烈摇晃(300rpm),以促进细菌的生长和扩增。然后检查细菌培养物,以确保其在600nm(a600)下达到约2–6x109个细胞/ml的细胞密度或2.0-6.0的吸光度,然后进行质粒dna纯化处理。
在这个特例中使用的细菌细胞是前10名和dh5α的大肠杆菌,但其他大肠杆菌菌株也被用于产生类似结果的附加研究中。在这个特例中使用的质粒是高拷贝pgl4.50,但是其他具有不同主干和不同大小插入物的质粒,高拷贝和低拷贝,在类似的实验中也得到了类似的结果。
仪器原型和随附的一次性纯化柱原型(例如图7b中的纯化柱160b)用于从150ml(最大刻度)细菌培养物中进行全自动质粒dna纯化。purelinktmexpi无内毒素maxi质粒纯化试剂盒并排使用,严格按照制造商方案作为对照。
图1显示了三次仪器运行和一次使用purelink试剂盒手动制备pgl4.50质粒/前10个细胞的结果,培养物od600=3.0,使用purelink试剂盒对pgl4.50质粒/dh5a细胞进行三次仪器运行和一次手动制备,培养物od600=4.5。下表1记录了质粒dna当量(微克)、输出管中约1ml洗脱量的质粒浓度和用纳米滴(a260/280、a260/230)测量的质粒纯度。质粒产品的琼脂糖凝胶分析如图25所示。
表1
对于pgl4.50质粒/前10细胞,自动纯化的质粒当量为755-803微克,pgl4.50质粒/dh5a细胞–881-982微克,非常类似于用purelink阴离子交换柱为基础的试剂盒所做的手工制备。所有样本的a260/280纯度都很高(例如大于1.9)。所有样本的a260/230纯度都很高(例如大于2.2)。琼脂糖凝胶分析显示纯化的质粒产品纯度高,完整性好。
下表2显示了在两个仪器原型上总共25次质粒纯化的结果。从150ml输入细菌培养物中获得的高拷贝质粒的平均当量为796微克,这与手动maxi-prep相当。质粒纯度如图25所述,符合要求。仪器原型的总运行时间约为50分钟,明显快于手动制备,对于标准阴离子交换膜柱,手动制备至少需要1.5小时或更长时间。
表2:1在纯化柱1和2上就总共25次质粒纯化进行的总结(每个纯化柱的设计如图7b所示;结果根据150ml细菌培养物输入)。
如图所示,仪器原型和附带的纯化柱原型能够实现完全自动化的质粒dna纯化,直接从细菌培养(无需离心),并提供高产量的干净质粒dna,大大快于“经典”的手动纯化工具。
附加实施例说明
以下是示例性的、非限制性的实施例,其包含前述描述的一个或多个特征。
实施例1一种用于从生物样本中自动纯化靶核酸或靶蛋白等生物分子的设备,包括:用于容纳生物样本的输入储槽;与所述输入储槽和裂解缓冲液储槽流体连通的第一生物处理组件,所述第一生物处理组件用于生成含靶核酸或靶蛋白等靶生物分子的裂解物;与所述第一生物处理组件和第一洗脱缓冲液储槽流体连通的第二生物处理组件,所述第二生物处理组件包括用于保留靶生物分子的靶生物分子结合过滤器,例如靶核酸结合过滤器或靶蛋白结合过滤器;与所述第二生物处理组件流体连通的容器,所述容器用于放置接收来自所述第二生物处理组件的靶核酸或靶蛋白等靶生物分子的输出容器。
实施例2。根据实施例1其中所述的设备,其中所述设备包含一个消耗性纯化柱。
实施例3。根据实施例1-2其中中任一实施例所述的设备,其中所述输入储槽用于容纳大容量临床样本、大体积环境样本、食品样本或饮料样本。
实施例4。根据实施例1-3中任一实施例所述的设备,还包括设置在所述输入储槽与所述第一生物处理组件之间的光密度检测器窗口,可通过所述光密度检测器窗口检测所述生物样本的光密度。
实施例5。根据实施例1-4其中中任一实施例所述的设备,其中所述第一生物处理组件包括澄清过滤器。
实施例6。根据实施例5其中所述的设备,其中所述澄清过滤器与所述输入储槽和所述裂解缓冲液储槽流体连通,所述澄清过滤器用于分离所述生物样本的含靶核酸部分与所述生物样本的第一废物部分。
实施例7。根据实施例5或6其中所述的设备,其中所述第一生物处理组件包括细胞捕获过滤器,其中所述细胞捕获过滤器设置在所述澄清过滤器的上游。
实施例8。其中根据实施例7所述的设备,其中所述细胞捕获或浓缩过滤器与所述输入储槽和所述裂解缓冲液储槽流体连通,所述细胞捕获或浓缩过滤器用于分离所述生物样本的含靶核酸部分与所述生物样本的第一废物部分。
实施例9。根据实施例7或8其中所述的设备,其中所述裂解缓冲液储槽与所述细胞捕获过滤器流体连接,使所述细胞捕获过滤器能够进行反冲洗,并使反冲洗液能够进入所述澄清过滤器。
实施例10。根据实施例9所述的设备,还包括设置在所述澄清过滤器与所述细胞捕获过滤器之间的第一混合室,所述第一混合室用于容纳所述反冲洗液。
实施例11.根据实施例10所述的设备,还包括与所述第一混合室流体连通的中和缓冲液储槽,所述第一混合室用于容纳所述反冲洗液和中和缓冲液,并混合所述反冲洗液和所述中和缓冲液以形成中和裂解物。
实施例12。根据实施例11其中所述的设备,其中所述澄清过滤器与所述第一混合室流体连通,所述澄清过滤器用于分离所述生物样本的第二废物部分与含靶核酸部分。
实施例13。根据实施例9-12其中中任一实施例所述的设备,其中所述澄清过滤器包括所述细胞捕获过滤器,所述细胞捕获过滤器用于在第一纯化步骤中浓缩所述生物样本的细胞组分,以及在后续第二纯化步骤中澄清所述中和裂解物。
实施例14。根据实施例1-13其中中任一实施例所述的设备,其中所述第二生物处理组件的靶生物分子结合过滤器包括硅基过滤器或对靶核酸具有亲和力的微球柱。
实施例15。根据实施例14其中所述的设备,其中所述第二生物处理组件还包括与所述靶生物分子结合过滤器(例如所述核酸结合过滤器)流体连通的纯化试剂储槽。
实施例16。根据实施例14或15其中所述的设备,其中所述靶生物分子结合过滤器,例如所述核酸结合过滤器,与所述洗脱缓冲液储槽和所述输出容器流体连通。
实施例17。根据实施例1-16其中中任一实施例所述的设备,其中所述第二生物处理组件包括设置在所述第一生物处理组件与所述靶生物分子结合过滤器之间的第二混合室。
实施例18。根据实施例17其中所述的设备,其中所述第二混合室与内毒素去除缓冲液储槽流体连通。
实施例19。根据实施例1-18其中中任一实施例所述的设备,其中所述靶生物分子结合过滤器采用包含阴离子交换膜的核酸结合过滤器。
实施例20。根据实施例19所述的设备,其中其中所述第二生物处理组件包括设置在所述阴离子交换膜下游的沉淀膜。
实施例21。根据实施例20其中所述的设备,其中所述阴离子交换膜用于分离所述生物样本的第三废物部分与含靶核酸部分。
实施例22。根据实施例20或21所述的设备,还包括第二洗脱缓冲液储槽,所述第一洗脱缓冲液储槽与所述阴离子交换膜流体连接,使所述靶核酸能够通过所述阴离子交换膜洗脱,所述第二洗脱缓冲液储槽与所述沉淀膜流体连接,使所述靶核酸能够通过所述沉淀膜洗脱。
实施例23。根据实施例20-22其中中任一实施例所述的设备,其中所述沉淀膜用于分离所述生物样本的第四废物部分与含靶核酸部分。
实施例24根据实施例20-23其中中任一实施例所述的设备,其中所述沉淀膜与沉淀剂储槽流体连通,所述沉淀剂储槽可选地包含异丙醇。
实施例25根据实施例20-24其中中任一实施例所述的设备,其中所述沉淀膜与洗涤/脱盐溶液储槽流体连通,所述洗涤/脱盐溶液储槽可选地包含约70%乙醇。
实施例26根据实施例20-25其中中任一实施例所述的设备,其中所述第二生物处理组件包括设置在所述阴离子交换膜与所述沉淀膜之间并与其流体连通的第三混合室,其中所述第三混合室与所述沉淀剂储槽和/或所述脱盐溶液储槽流体连接,并设置在所述沉淀膜与所述沉淀剂储槽和/或所述脱盐溶液储槽之间。
实施例27。根据实施例1-26其中中任一实施例所述的设备,其中所述输出容器可选择性地从所述设备上拆卸。
实施例28根据实施例1-27其中中任一实施例所述的设备,其中所述输入储槽的尺寸和形状适合接收至少5ml、优选至少100ml或至多2l的生物样本。
实施例29。一种用于从生物样本中自动纯化核酸的设备的实施例,包括:用于容纳所述生物样本的输入储槽;与输入储槽流体连通的第一生物处理组件以及裂解缓冲液储槽,所述第一生物处理组件用于生成含靶核酸的裂解物;与第一生物处理组件和第一洗脱缓冲液储槽流体连通的第二生物处理组件,所述第二生物处理组件包括用于保留靶核酸的核酸结合过滤器;与第二生物处理组件流体连通的容器,所述容器用于放置容纳经纯化靶核酸的输出容器。一种用于从生物样本中自动纯化靶核酸的设备的另一实施例包括:用于容纳生物样本的第一生物处理组件,所述第一生物处理组件包括废物分离过滤器和流体连接至所述废物分离过滤器的多个储槽;第二生物处理组件包括阴离子交换膜、与所述阴离子交换膜流体连接的洗涤液储槽和与所述阴离子交换膜进行流体耦合的第一洗脱缓冲储槽;第三生物处理组件,包括沉淀过滤器和与所述沉淀过滤器流体连接的第二洗脱缓冲液储槽。
实施例30根据实施例29所述的设备,其中其中所述第一生物处理组件还包括细胞捕获过滤器,其中所述多个储槽中的第一储槽包括重悬缓冲液储槽。
实施例31。根据实施例30所述的设备,其中输入储槽与所述细胞捕获过滤器的第一侧进行流体连接,所述重悬缓冲液储槽与所述细胞捕获过滤器的第二侧进行流体耦合。
实施例32。根据实施例1-31其中中任一实施例的设备,其中所述装置是用作自动核酸纯化系统中的消耗性纯化柱,所述消耗性纯化柱用于与所述自动化核酸纯化系统相关联,以实现所述靶核酸的自动纯化,而无需人的交互作用。
实施例33。一种用于从生物样本中自动纯化靶核酸的方法,包括:采用输入储槽容纳所述生物样本;在没有进一步的人类交互作用的情况下,在第一生物处理组件中从所述生物样本生成裂解物,所述裂解物包含所述靶核酸;在第二生物处理组件处接收包含所述裂解物部分的靶核酸;将所述靶核酸保留在所述第二生物处理组件处的核酸结合过滤器上;从所述核酸结合过滤器中洗脱纯化形式的所述靶核酸到输出容器中。
实施例34。实施例33所述的方法,还包括在所述第一生物处理组件的第一膜处捕获所述生物样本的细胞内容物。
实施例35。实施例33或34所述的方法,还包括在生成所述裂解物之前测量所述生物样本的光密度,可选地,其中在捕获所述第一膜处的所述细胞内容物之前测量所述光密度。
实施例36。根据实施例35所述的方法,其中其中所述生物样本包括细菌培养物,所述生物样本的光密度测量包括自动测量所述细菌培养物在约600nm处的吸光度。
实施例37。所述实施例33-36中任一实施例的方法,还包括在一个或多个重悬缓冲液体、核糖核酸酶溶液或裂解缓冲液中重悬至少一部分细胞内容物,可选地,其中重悬所述至少一部分所述细胞内容物包括反冲洗所述第一膜。
实施例38。根据所述实施例37的方法,其中反冲洗所述第一膜的过程包括从布置在所述第一膜的第二侧的流体通道并通过所述第一膜转移包含一个或多个重悬缓冲液、核糖核酸酶溶液或裂解缓冲液的重悬溶液。
实施例39。实施例33-38中任一实施例之所述方法,还包括所述裂解物与中和缓冲液混合以形成中和裂解物,并将包含靶核酸的部分与所述中和裂解物的废物部分分离。
实施例40。根据实施例33-39中任一实施例所述的方法,还包括将内毒素去除缓冲液与裂解物的含靶核酸部分混合。
实施例41。根据实施例33-40中任一实施例所述的方法,其中在第二生物处理组件处将靶核酸保留在核酸结合过滤器上包括使裂解物的含靶核酸部分通过阴离子交换膜。
实施例42。根据实施例41所述的方法,还包括从阴离子交换膜中去除裂解物的含靶核酸部分,沉淀靶核酸,以对靶核酸进行脱盐和/或浓缩,以及可选地在沉淀膜上捕获沉淀的靶核酸。
实施例43。根据实施例33-42中任一实施例所述的方法,其中在第二生物处理组件处将靶核酸保留在核酸结合过滤器上包括使裂解物的含靶核酸部分通过沉淀膜,从而在沉淀膜处捕获靶核酸。
实施例44。根据实施例33-43中任一实施例所述的方法,其中在第二生物处理组件处将靶核酸保留在核酸结合过滤器上包括使裂解物的含靶核酸部分通过硅基过滤器,并在裂解物的含靶核酸部分通过硅基过滤器之前将裂解物的含靶核酸部分与离液盐缓冲液混合,并可选地用醇基洗涤液洗涤硅基过滤器。
实施例45。根据实施例44所述的方法,其中从核酸结合过滤器洗脱纯化形式的靶核酸包括在低盐条件下使用水或te缓冲液洗脱。
实施例46。根据实施例33-45中任一实施例所述的方法,使用实施例1-32中任一实施例所述的设备实施。
实施例47。一种用于从生物样本中自动纯化靶核酸或靶蛋白的设备,包括:具有内部隔室的外壳,所述内部隔室的尺寸和形状适合放置纯化柱;可选地,可选择性关闭的检修门,所述检修门提供通向内部隔室的通道;泵组件,设置在内部腔室内,用于通过蠕动运动提供泵送作用。
实施例48。根据实施例47所述的设备,还包括设置在内部隔室内的夹紧机构,夹紧机构构造成在打开位置与关闭位置之间移动,处于打开位置时,可进入内部隔室,处于关闭位置时,夹紧机构夹在插入的纯化柱上,使所述生物样本能够进行处理,可选地,其中当处于关闭位置时,夹紧机构操作,对所述生物样本纯化柱进行流体密封。
实施例49。根据实施例48所述的设备,还包括控制器,其中控制器仅在确定检修门关闭时才向夹紧机构供电。
实施例50。根据实施例48或49所述的设备,还包括锁定机构,该锁定机构用于在夹紧机构移动到关闭位置时,将检修门锁定在关闭位置。
实施例51。根据实施例48-50中任一实施例所述的设备,其中夹紧机构由电机提供动力,可选地,其中电机可操作地连接蜗轮或传动螺杆,蜗轮或传动螺杆可旋转以引起所述夹紧机构的运动。
实施例52。根据实施例51所述的设备,还包括手动释放机构,该手动释放机构可操作地连接到夹紧机构,使夹紧机构能够独立于电机手动释放。
实施例53。根据实施例48-52中任一实施例所述的设备,其中外壳包括检修门连接到其上的开口端和与开口端相对的封闭端,开口端和封闭端限定了纵向方向,其中夹紧机构构造成沿横向于纵向方向的方向移动。
实施例54。根据实施例47-53中任一实施例所述的设备,还包括:光密度传感器,用于测量放置在生物样本纯化柱内的生物样本的光密度;光密度传感器,用于测量靶生物分子浓度,例如纯化产物的靶核酸浓度和/或靶蛋白浓度。
实施例55。根据实施例47-54中任一实施例所述的设备,还包括用于显示仪器信息和接收用户输入的用户界面,该用户界面用于容纳与一个或多个生物样本体积、选定纯化方案、可选择性关闭的检修门的操作指令、靶核酸或靶蛋白等靶生物分子的期望浓度、或含靶生物分子的洗脱液的最终体积相关的用户输入。
实施例56。根据实施例47-55中任一实施例所述的设备,其中内部隔室包括用于确定纯化柱已经完全插入所述内部隔室中的位置传感器,限位开关的位置应使其在纯化柱完全插入内部隔室时与纯化柱的前缘接触时被触动。
实施例57。根据实施例47-56中任一实施例所述的设备,还包括一个或多个检修门传感器,其用于确定检修门是处于打开位置还是关闭位置,其中所述一个或多个检修门传感器可选地包括一个或多个霍尔效应传感器以及一个或多个相应的磁体。
实施例58。根据实施例47-57中任一实施例所述的设备,还包括输出容器传感器,该输出容器传感器用于检测在插入的纯化柱处是否存在输出容器。
实施例59。根据实施例47-58中任一实施例所述的设备,还包括一个或多个可旋转磁体,该磁体设置成将电磁场向内引导至内部隔室。
实施例60。根据实施例47-59中任一实施例所述的设备,其中泵组件包括经由动力传输组件联接至电机的凸轮轴,多个凸轮元件附接至凸轮轴,并且在插入时从凸轮轴朝向纯化柱横向延伸,凸轮元件可选地包括斜面尖端,用于在插入时接合所述纯化柱。
实施例61。根据实施例60所述的设备,其中凸轮元件的布置使凸轮轴的旋转引起该凸轮元件顶端的线性蠕动运动。
实施例62。一种系统,包括根据实施例47-62中任一实施例所述的设备和纯化柱,其中纯化柱是根据实施例1-32中任一实施例所述的设备。
实施例63。一种用于从生物样本中自动纯化靶核酸的方法,包括:提供如实施例47-62中任一实施例所述的设备(或系统);通过检修门将纯化柱装载到设备的内部隔室内;启动设备纯化程序,其中纯化程序的启动使得仪器自动纯化靶核酸,而无需要进一步的人为交互。
实施例64。根据实施例63所述的方法,还包括关闭设备检修门,以及将夹紧机构移动到关闭位置,以夹紧所装载的纯化柱并对其进行流体密封。
实施例65。根据实施例64所述的方法,还包括在启动纯化程序之前确定纯化柱已满载和/或确定检修门已完全关闭。
实施例66。根据实施例63-65中任一实施例所述的方法,还包括确定输出容器的位置是否正确,并在确定没有输出容器时提供警告。
实施例67。根据实施例63-66中任一实施例所述的方法,还包括确定纯化柱内的生物样本的光密度,可选地,其中所确定的输入样本的光密度用于调节纯化程序的一个或多个参数,所述一个或多个参数包括纯化程序使用的一种或多种试剂的体积、通过泵组件泵送的持续时间或通过泵组件泵送的速度。
实施例68。根据实施例67所述的方法,其中相对于较低光密度读数,较高光密度读数需满足以下一个或多个参数:需使用的一种或多种试剂体积较大、一个或多个流体运动步骤泵送时间较长、在一个或多个流体运动步骤期间流体流速较大。
实施例69。根据实施例63-68中任一实施例所述的方法,其中在启动纯化程序之前获取初始光密度读数,以确定以前是否使用过纯化柱,其中光密度读数大体上等于空气空白读数,表明生物样本纯化柱的培养输入储槽完好无损。
实施例70。根据实施例63-69中任一实施例所述的方法,还包括将体积约为5ml至5l或10ml至500ml或15ml至250ml的大体积生物样本装载到纯化柱中。
实施例71。根据实施例47-62中任一实施例所述的用于控制自动纯化设备(或系统)的控制系统,包括:一个或多个处理器;其上存储有计算机可执行指令的一个或多个硬件存储设备,该指令可由一个或多个处理器执行,使控制系统至少:从一个或多个传感器接收传感器数据,以确定自动纯化设备的一个或多个过程状态;将所确定的过程状态与存储在方案库中的一组不同方案进行比较;根据所确定的过程状态从方案库中选择纯化方案;通过使自动纯化设备的一个或多个仪器执行机构按照选定纯化方案操作来实施选定纯化方案。
实施例72。根据实施例71所述的控制系统,其中一个或多个传感器包括光密度传感器、检修门传感器、纯化柱接近或接触传感器、输出容器接近或接触传感器、纯化柱扫描仪、计时器、温度传感器、重量传感器、体积传感器或其组合。
实施例73。根据实施例71或72所述的控制系统,其中所确定的过程状态至少包括初始输入样本的确定光密度,可选地,其中选定纯化方案提供基于初始输入样本的确定光密度的细胞捕获持续时间。
实施例74。根据实施例71-73中任一实施例所述的控制系统,其中选定纯化方案确定:是否使用细胞捕获和/或细胞裂解、细胞捕获和/或细胞裂解的持续时间、要使用的试剂、要使用的试剂体积、是否在一个或多个纯化步骤中进行混合和/或何时进行混合、一个或多个混合步骤的持续时间和/或速度、一个或多个纯化步骤之间泵送的持续时间和/或速度、是否打开和关闭纯化柱内的一个或多个阀门和/或何时打开和关闭,是否刺穿纯化柱内的一个或多个密封件以允许相应的流体释放或气体排出和/或何时刺穿、所涉及的靶生物分子捕获的类型、靶生物分子捕获的持续时间或其组合。
实施例75。一种用于保持和选择性释放流体的流体释放系统,包括:柔性垫圈;设置在柔性垫圈第一侧的储槽,该储槽用于保持流体;设置在柔性垫圈和流体储槽之间的易碎密封件;设置在柔性垫圈第二侧的执行机构,其中执行机构可操作以使柔性垫圈偏转,从而导致易碎密封件破裂并选择性地从储槽中释放流体。
实施例76。根据实施例75所述的系统,其中柔性垫圈是弹性体。
实施例77。根据实施例75或76所述的系统,其中柔性垫圈是设置在两个外层之间的中间层的一部分,储槽可选地至少部分由柔性垫圈和两个外层之一限定。
实施例78。根据实施例75-77中任一实施例所述的系统,其中易碎密封件包括化学惰性材料,易碎密封件还可选地包括增强层,其中化学惰性材料结合或熔合到增强层的表面,使得化学惰性材料设置成朝向和/或形成限定储槽的侧壁。
实施例79。根据实施例75-78中任一实施例所述的系统,其中易碎密封件包括可刺穿材料,其构造可在执行机构施加的机械力的作用下发生灾难性失效。
实施例80。根据实施例75-79中任一实施例所述的系统,其中流体包括核酸纯化试剂、蛋白纯化试剂、输入样本、重悬缓冲液、rnasea、dnase、蛋白酶k、裂解缓冲液、中和缓冲液、离液盐缓冲液、非离液盐缓冲液、结合缓冲液、内毒素去除缓冲液、洗涤缓冲液、洗脱缓冲液、异丙醇、乙醇、水或te缓冲液。
实施例81。根据实施例75-80中任一实施例所述的系统,还包括与储槽流体连通的流体通道,该流体通道用于在从储槽释放流体时接收流体。
实施例82。根据实施例75-81中任一实施例所述的系统,还包括柔性排气孔,设置在柔性排气孔第一侧的易碎气体密封件,以及设置在柔性排气孔第二侧的排气执行机构,可选地,其中排气执行机构可操作,以选择性地使柔性排气孔向易碎气体密封件偏转,从而破坏易碎气体密封件以将空气排放到储槽中。
实施例83。一种用于选择性地释放流体的自动系统,包括:根据实施例75-82中任一实施例所述的流体释放系统;与自动靶生物分子纯化系统配合使用的生物样本纯化柱,该生物样本纯化柱包括根据实施例1-32中任一实施例所述的设备,该自动系统还可选地包括根据实施例71-74中任一实施例所述的控制系统,并且可选地包括根据实施例47-62中任一实施例所述的自动纯化设备或系统。
实施例84。一种用于在自动化过程中选择性地从储槽释放流体的方法,包括:使柔性垫圈与执行机构接触;移动执行机构,使柔性垫圈朝向与储槽相关联的易碎密封件偏转;使柔性垫圈破坏易碎密封件,从而从储槽中释放流体。
实施例85。根据实施例84所述的方法,其中流体在执行机构不与流体直接接触的情况下从储槽中释放。
实施例86。根据实施例84或85所述的方法,还包括将执行机构从破裂的易碎密封件缩回,并且在执行机构缩回时,柔性垫圈从破裂的易碎密封件移开。
实施例87。根据实施例84-86中任一实施例所述的方法,还包括:使柔性排气孔与排气执行机构接触;移动排气执行机构,使柔性排气孔朝向易碎气体密封件偏转;使柔性排气孔破坏易碎气体密封件,其中破坏易碎气体密封件使空气排入储槽。
实施例88。根据实施例84-87中任一实施例所述的方法,使用实施例75-83中任一实施例所述的系统实施。
实施例89。一种用于流体受控运动的设备,包括:第一外层,该第一外层包括第一侧和第二侧,第一侧包括一系列通道;第二外层,与第一外层的第一侧相对设置;设置在第一外层与第二外层之间的弹性体层,该弹性体层包括与一系列通道相对应的密封骨条结构,该弹性体层用于其在第一外层与第二外层之间压缩时对通道进行流体分离。
实施例90。根据实施例89所述的设备,其中第一系列通道中的第一通道包括储槽,可选地,其中一个或多个所述第一外层或所述第二外层是热成型聚合物。
实施例91。根据实施例89或90所述的设备,还包括弹性体层与第一外层和/或第二外层之间的标称间隙,使得当弹性体层在第一外层与第二外层之间压缩时,密封骨条的压缩部分在标称间隙内移位。
实施例92。根据实施例89-91中任一实施例所述的设备,还包括与一系列通道相关联的阀门,该阀门可选择性地在关闭位置和打开位置之间移动,以分别限制或允许流体通过阀门。
实施例93。根据实施例89-92中任一实施例所述的设备,其中阀门在第二外层有一个孔。
实施例94。根据实施例93所述的设备,其中该孔提供通向弹性体层可偏转部分的通道,该可偏转部分包括从弹性体层朝第一外层延伸的阀门密封骨条。
实施例95。根据实施例94所述的设备,其中当阀门处于关闭位置时,阀门密封骨条接触第一外层;当阀门处于打开位置时,阀门密封骨条与第一外层分离。
实施例96。根据实施例94或95所述的设备,还包括与阀门的可偏转部分接触的柱塞,该柱塞的尺寸和形状适合穿过所述孔以使可偏转部分偏转并使阀门朝关闭位置移动。
实施例97。根据实施例94-96中任一实施例所述的设备,其中该阀门还包括在第一外层中形成并且朝向所述孔延伸的凸缘,可选地,其中当阀门处于关闭位置时,凸缘接触阀门密封骨条。
实施例98。根据实施例94-98中任一实施例所述的设备,其中当阀门完全移动到打开位置时,可偏转部分延伸并超出所述孔。
实施例99。根据实施例89-98中任一实施例所述的设备,其中第二外层包括设置在第二外层的第一侧的第二系列通道,第二外层的第一侧面向第一外层的第一侧。
实施例100。根据实施例99所述的设备,其中密封骨条结构包括朝向第一外层延伸的第一组密封骨条和朝向第二外层延伸的第二组密封骨条。
实施例101。根据实施例89-100中任一实施例所述的设备,其中密封骨条结构沿一系列通道的轮廓布置。
实施例102。根据实施例101所述的设备,其中每个通道包括最低点,并且形成从最低点上升到位于最低点的相对侧上的拐点的表面,可选地,其中密封骨条包括顶点,密封骨条的布置使顶点设置在通道的拐点处或相对于相应的通道最低点超出拐点。
实施例103。一种控制流体运动的方法,包括:将根据实施例89-102中任一实施例所述的设备提供给自动纯化靶核酸或靶蛋白的系统;使一个或多个柱塞打开该设备内的阀门,打开的阀门使系列通道的上游部分和下游部分之间能进行流体连通;使泵将流体从上游部分移动到下游部分。
实施例104。根据实施例103所述的方法,还包括以下一项或多项要求:压缩密封骨条结构,使其在泄漏之前承受至少30psi,优选至少60psi的流体压力;该设备的构造使其能承受施加在密封骨条结构的整个长度上的至少500lbf,优选高达15,000lbf的力;或者在弹性体层压缩在第一外层与第二外层之间时,密封骨条至少压缩20%,优选至少压缩30%。
实施例105。一种生物样本纯化柱,包括以下至少两项:根据实施例1-32中任一实施例所述的设备;根据实施例47-62中任一实施例所述的设备;根据实施例71-74中任一实施例所述的控制系统;根据实施例75-83中任一实施例所述的系统;根据实施例89-102中任一实施例所述的设备。
实施例106。一种用于从生物样本中自动纯化靶蛋白的设备,包括:用于容纳生物样本的输入储槽;与输入储槽和裂解缓冲液储槽流体连通的第一生物处理组件,该第一生物处理组件用于生成包含靶蛋白的裂解物;与第一生物处理组件和第一洗脱缓冲液储槽流体连通的第二生物处理组件,该第二生物处理组件包括用于保留靶蛋白的蛋白结合支持物;与第二生物处理组件流体连通的容器,该容器用于放置容纳靶蛋白的输出容器。
实施例107。根据实施例106所述的设备,其中所述设备包含消耗性纯化柱。
实施例108。根据实施例106或107所述的设备,第一生物处理组件包含澄清过滤器。
实施例109。根据实施例108所述的设备,澄清过滤器与输入储槽和裂解缓冲液储槽流体连通],配置澄清过滤器从生物样本的第一废物部分分离含靶蛋白的成分。
实施例110。根据实施例106-109中任一实施例所述的设备,其特征在于首个生物处理结构包含细胞捕获或浓缩过滤器,其中可选地,所述细胞捕获或浓缩过滤器位于澄清过滤器的上游。
实施例111。根据实施例110所述的设备,细胞捕获和浓缩过滤器与输入储槽和裂解缓冲液储槽流体连通,配置细胞捕获和浓缩过滤器从生物样本的第一废物部分分离含靶蛋白的成分。
实施例112。实施例106-111之一的设备,包含一个或多个具备蛋白纯化试剂的生物处理室。
实施例113。根据实施例106-112中任一实施例所述的设备,进一步包括一个或多个过滤器,其中所述一个或多个过滤器包含中空纤维过滤器。
实施例114。一种包括使用根据实施例106-113中任一实施例所述的设备从菌体裂解自动分离或纯化靶蛋白的方法。
实施例115。实施例114的方法中,用细胞分裂步骤、柱色谱法、亲和色谱法、凝胶过滤色谱法、离子交换色谱分析法、快速蛋白液相色谱或方法组合分离出靶蛋白。
实施例116。实施例114或115方法中的样本包括生物样本、组织、活组织检查、细胞培养、细胞、细胞悬液、尿、唾液、脑脊髓液、血液、血清、血浆、粪便的水溶液、其他体液或分泌液和从老鼠、昆虫、灵长类动物和人类细胞、原核细胞中选出的真核细胞或由原核细胞组成的细胞悬浮液。
实施例117。根据实施例114-116中任一实施例所述的方法,其中所述生物样本是指包含很多细胞的细胞系或组织,包含靶蛋白的成分包括细胞系或组织中的蛋白和包含裂解细胞及培养基(可选地)的第一废物部分。
实施例118。一种生物样本纯化柱,包括以下至少两项:根据实施例106-117中任一实施例所述的设备;根据实施例47-62中任一实施例所述的设备;根据实施例71-74中任一实施例所述的控制系统;根据实施例75-83中任一实施例所述的系统;根据实施例89-102中任一实施例所述的设备。
- 还没有人留言评论。精彩留言会获得点赞!