一种苯环类化合物及其应用的制作方法
1.本发明涉及药物领域,具体地涉及一种苯环类化合物及其应用。
背景技术:
2.肿瘤是严重危害人类健康的常见病,恶性肿瘤的死亡率也一直呈上升趋势。由于肿瘤的异质性及患者个体差异,如果简单根据其来源或病理特征等采用同一治疗方法或同一药物就容易产生治疗不当的问题,贻误患者宝贵的治疗时间和机会,因此针对患者的不同情况,采用个性化治疗就显得十分必要。随着生物学技术的发展,肿瘤治疗也进入了精准化治疗的时代,并且越来越多与肿瘤相关基因表达的改变被相继发现,相关基因的改变在恶性肿瘤的发展中发挥了重要的作用,这样生物标志物的发现和应用将会为相关药物的应用提供精准指引,使得肿瘤的个体化治疗成为可能,从而实现有针对性地给药,显著提升治疗效果。
3.因此,本领域亟需开发一种能够对肿瘤进行精准化治疗的药物。
技术实现要素:
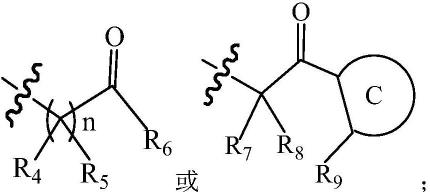
4.本发明的目的就是提供一种安全有效地抑制癌症的化合物及其应用。
5.本发明所另一目的在于提供一种线粒体氧化磷酸化通路、线粒体膜通透性转换孔、nnmt基因和/或nnmt基因区dna cpg位点甲基化水平用于判断肿瘤患者是否适合采用本发明所述化合物进行预防和/或治疗的标志物。本发明所述的化合物对线粒体氧化磷酸化通路上调、线粒体膜通透性转换孔低活性、nnmt基因低表达或未表达、和/或nnmt基因区dna cpg位点甲基化水平高的肿瘤具有更显著优异的治疗效果。
6.本发明第一方面,提供一种式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐,
[0007][0008]
其中,
[0009]
环a为取代或未取代的c6-c16芳环、取代或未取代的c3-c16环烷环、取代或未取代的3-16元杂环烷环、或取代或未取代的3-16元杂芳环;
[0010]
环b为无、取代或未取代的c6-c16芳环、取代或未取代的c3-c16环烷环、取代或未取代的3-16元杂环烷环、或取代或未取代的3-16元杂芳环;
[0011]
r1为
[0012]
r2为氢、
[0013]
r3为无、氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-、f3c-o-、取代或未取代的c1-c10烷基、取代或未取代的c3-c12环烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c16芳基、取代或未取代的5-12元杂芳基、取代或未取代的c6-c16芳基-取代或未取代的c1-c10烷基-、取代或未取代的5-12元杂芳基-取代或未取代的c1-c10烷基;
[0014]
r4和r5各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、取代或未取代的c1-c10烷基、取代或未取代的c3-c12环烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c16芳基、或取代或未取代的5-12元杂芳基;
[0015]
r6为取代或未取代的c6-c16芳基、或取代或未取代的5-12元杂芳基、取代或未取代的3-16元环烷基、取代或未取代的3-16元杂环烷基;
[0016]
n为0、1、2、3、4、5或6;
[0017]
环c为无、取代或未取代的c6-c16芳环、取代或未取代的c3-c16环烷环、取代或未取代的3-16元杂环烷环、或取代或未取代的3-16元杂芳环;
[0018]
r7为氢、卤素、-cn、羟基、巯基、硝基、氨基、取代或未取代的c1-c10烷基、取代或未取代的c3-c12环烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c16芳基、或取代或未取代的5-12元杂芳基;
[0019]
r8和r9连接形成取代或未取代的3-16元环烷环、取代或未取代的3-16元杂环烷环;
[0020]r10
和r
11
各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-o-、f3c-、取代或未取代的c1-c10烷基、取代或未取代的c3-c12环烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c16芳基、或取代或未取代的5-12元杂芳基、取代或未取代的c6-c16芳基-取代或未取代的c1-c10烷基-、或取代或未取代的5-12元杂芳基-取代或未取代的c1-c10烷基-、取代或未取代的c1-c6烷基-c(o)-;或r
10
和r
11
连接形成取代或未取代的3-16元杂环烷环、取代或未取代的3-16元杂芳环;
[0021]r12
和r
13
各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-、f3c-o-、取代或未取代的c1-c10烷基、取代或未取代的c3-c12环烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c16芳基、取代或未取代的5-12元杂芳基、取代或未取代的c6-c16芳基-取代或未取代的c1-c10烷基-、取代或未取代的5-12元杂芳基-取代或未取代的c1-c10烷基-;
[0022]
所述的任一“取代”是指环或基团上的一个或多个(优选为1、2、3、4、5、6、7或8个)
氢原子被选自下组的取代基所取代:c1-c8烷基、c3-c8环烷基、c1-c8卤代烷基、c3-c8卤代环烷基、卤素、硝基、-cn、羟基、巯基、氨基、f3c-o-、f3c-、c1-c4羧基、c2-c4酯基、c2-c4酰胺基、c1-c8烷氧基、c1-c8烷硫基、c1-c8卤代烷氧基、c1-c8卤代烷硫基、c6-c12芳基、5-10元杂芳基、5-10元杂环烷基;
[0023]
所述的杂环烷基、杂芳基、杂环烷环和杂芳环的杂环上各自独立地具有1-4个(优选为1、2、3个或4个)选自n、o和s的杂原子。
[0024]
在另一优选例中,所述的任一“取代”是指环或基团上的一个或多个(优选为1、2、3、4、5、6、7或8个)氢原子被选自下组的取代基所取代:c1-c6烷基、c3-c8环烷基、c1-c6卤代烷基、c3-c8卤代环烷基、卤素、硝基、-cn、羟基、巯基、氨基、f3c-o-、f3c-、c1-c4羧基、c2-c4酯基、c2-c4酰胺基、c1-c6烷氧基、c1-c6烷硫基、c1-c6卤代烷氧基、c1-c6卤代烷硫基、c6-c12芳基、5-10元杂芳基、5-10元杂环烷基。
[0025]
在另一优选例中,所述的任一“取代”是指环或基团上的一个或多个(优选为1、2、3、4、5、6、7或8个)氢原子被选自下组的取代基所取代:c1-c4烷基、c3-c8环烷基、c1-c4卤代烷基、c3-c8卤代环烷基、卤素、硝基、-cn、羟基、巯基、氨基、f3c-o-、f3c-、c1-c4羧基、c2-c4酯基、c2-c4酰胺基、c1-c4烷氧基、c1-c4烷硫基、c1-c4卤代烷氧基、c1-c4卤代烷硫基、c6-c12芳基、5-10元杂芳基、5-10元杂环烷基。
[0026]
在另一优选例中,所述的杂环烷基、杂芳基、杂环烷环和杂芳环的杂环上各自独立地具有1-4个(优选为1、2、3个或4个)选自n、o和s的杂原子。
[0027]
在另一优选例中,所述的卤素为f、cl、br或i。
[0028]
在另一优选例中,所述的环烷环具有1、2或3个c=c环双键。
[0029]
在另一优选例中,所述的杂环烷环具有1、2或3个c=c环双键。在另一优选例中,所述的杂环烷基、杂芳基、杂环烷环和杂芳环的杂环上各自独立地具有1-4个(优选为1、2、3个或4个)选自n、o和s的杂原子。
[0030]
在另一优选例中,环a为取代或未取代的c6-c12芳环、取代或未取代的c3-c12环烷环、取代或未取代的3-12元杂环烷环、或取代或未取代的3-12元杂芳环。
[0031]
在另一优选例中,环a为取代或未取代的c6-c10芳环、取代或未取代的c3-c10环烷环、取代或未取代的3-10元杂环烷环、或取代或未取代的3-10元杂芳环。
[0032]
在另一优选例中,环a为取代或未取代的c6-c8芳环、取代或未取代的c3-c8环烷环、取代或未取代的3-8元杂环烷环、或取代或未取代的5-8元杂芳环。
[0033]
在另一优选例中,环a为无、取代或未取代的5元杂环烷环、取代或未取代的6元杂环烷环、取代或未取代的7元杂环烷环、取代或未取代的8元杂环烷环、取代或未取代的5元杂芳环、取代或未取代的6元杂芳环、取代或未取代的7元杂芳环、取代或未取代的8元杂芳环。
[0034]
在另一优选例中,环a为取代或未取代的5元杂芳环、取代或未取代的6元杂芳环、取代或未取代的7元杂芳环或取代或未取代的8元杂芳环。
[0035]
在另一优选例中,环a为取代或未取代的砒啶环、取代或未取代的嘧啶环、取代或未取代的苯环、取代或未取代的萘环、取代或未取代的噻唑环、取代或未取代的咪唑环、取代或未取代的吡咯环。
[0036]
在另一优选例中,环a为砒啶环、嘧啶环、苯环、萘环、噻唑环、咪唑环。
[0037]
在另一优选例中,r1与环a的环杂原子相连。
[0038]
在另一优选例中,r1与环a的环n、o或s原子相连。
[0039]
在另一优选例中,r1与环a的环n原子相连。
[0040]
在另一优选例中,r2与环a的环碳原子相连。
[0041]
在另一优选例中,环b为无、取代或未取代的c6-c12芳环、取代或未取代的c3-c12环烷环、取代或未取代的3-12元杂环烷环、或取代或未取代的3-12元杂芳环。
[0042]
在另一优选例中,环b为无、取代或未取代的c6-c10芳环、取代或未取代的c3-c10环烷环、取代或未取代的3-10元杂环烷环、或取代或未取代的3-10元杂芳环。
[0043]
在另一优选例中,环b为无、取代或未取代的c6-c8芳环、取代或未取代的c5-c8环烷环、取代或未取代的5-8元杂环烷环、或取代或未取代的5-8元杂芳环。
[0044]
在另一优选例中,环b为无、取代或未取代的5元杂环烷环、取代或未取代的6元杂环烷环、取代或未取代的7元杂环烷环、取代或未取代的8元杂环烷环、取代或未取代的5元杂芳环、取代或未取代的6元杂芳环、取代或未取代的7元杂芳环、取代或未取代的8元杂芳环。
[0045]
在另一优选例中,所述的杂环烷环的环上具有1、2或3个碳碳环双键。
[0046]
在另一优选例中,环b为无、取代或未取代的四氢吡啶环、取代或未取代的吡咯环、取代或未取代的二氢吡咯环、取代或未取代的咪唑环、取代或未取代的吡唑环。
[0047]
在另一优选例中,环b为无、四氢吡啶环、哌啶环、吡咯环、二氢吡咯环、四氢吡咯环、咪唑环、吡唑环、吡啶环、环、环。
[0048]
在另一优选例中,r3与环b的环碳原子相连。
[0049]
在另一优选例中,r3与环b的环杂原子相连。
[0050]
在另一优选例中,r3与环b的环n、o或s原子相连。
[0051]
在另一优选例中,r3与环b的环n原子相连。
[0052]
在另一优选例中,所述的与环a的连接方式为
[0053]
在另一优选例中,所述的与环a的连接方式为
[0054]
在另一优选例中,所述的四氢吡啶环为1,2,3,4-四氢吡啶环。
[0055]
在另一优选例中,所述的吡咯环为1-氢吡咯环。
[0056]
在另一优选例中,所述的二氢吡咯环为2,3-二氢吡咯环。
[0057]
在另一优选例中,环b为无。
[0058]
在本发明应当理解的是,当环b为无时,式i化合物的结构如下i-1结构所示:
[0059][0060]
在另一优选例中,所述的式i化合物为如式i-1化合物:
[0061][0062]
在另一优选例中,环b为无,r2为
[0063]
在另一优选例中,环b为取代或未取代的c6-c16芳环、取代或未取代的c3-c16环烷环、取代或未取代的3-16元杂环烷环、或取代或未取代的3-16元杂芳环,r2为氢。
[0064]
在另一优选例中,r1为
[0065]
在另一优选例中,r1为
[0066]
在另一优选例中,r2为氢、
[0067]
在另一优选例中,r2为氢、
[0068]
在另一优选例中,r3为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-o-、f3c-、取代或未取代的c1-c8烷基、取代或未取代的c3-c10环烷基、取代或未取代的c1-c8烷氧基、取代或
未取代的c1-c8烷硫基、取代或未取代的c6-c12芳基、或取代或未取代的5-10元杂芳基、取代或未取代的c6-c12芳基-取代或未取代的c1-c8烷基-、或取代或未取代的5-10元杂芳基-取代或未取代的c1-c8烷基-。
[0069]
在另一优选例中,r3为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-o-、f3c-、取代或未取代的c1-c6烷基、取代或未取代的c3-c8环烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c1-c6烷硫基、取代或未取代的c6-c10芳基、或取代或未取代的5-10元杂芳基、取代或未取代的c6-c10芳基-取代或未取代的c1-c4烷基-、或取代或未取代的5-10元杂芳基-取代或未取代的c1-c4烷基-。
[0070]
在另一优选例中,r3为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-o-、f3c-、取代或未取代的c1-c4烷基、取代或未取代的c3-c8环烷基、取代或未取代的c1-c4烷氧基、取代或未取代的c1-c4烷硫基、取代或未取代的c6-c8芳基、或取代或未取代的5-8元杂芳基、取代或未取代的c6-c8芳基-取代或未取代的c1-c2烷基-、或取代或未取代的5-8元杂芳基-取代或未取代的c1-c2烷基-。
[0071]
在另一优选例中,r3为氢、取代或未取代的c1-c6烷基、取代或未取代的c3-c6环烷基、取代或未取代的苯基、取代或未取代的苯基-甲基-、取代或未取代的吡啶基、取代或未取代的吡啶基-甲基-、取代或未取代的苯基-乙基-、取代或未取代的吡啶基-乙基-、
[0072]
在另一优选例中,r3为氢、取代或未取代的c1-c4烷基、取代或未取代的c3-c6环烷基、取代或未取代的苯基、取代或未取代的苯基-甲基-、取代或未取代的吡啶基、取代或未取代的吡啶基-甲基-、取代或未取代的苯基-乙基-、取代或未取代的吡啶基-乙基-。
[0073]
在另一优选例中,r3为氢、取代或未取代的甲基、取代或未取代的乙基、取代或未取代的丙基、取代或未取代的环丙基、取代或未取代的苯基、取代或未取代的苯基-甲基-、取代或未取代的吡啶基、取代或未取代的吡啶基-甲基-、取代或未取代的苯基-乙基-、取代或未取代的吡啶基-乙基-。
[0074]
在另一优选例中,在所述的取代或未取代的苯基中,所述的取代或未取代的苯基为单取代或未取代的苯基。
[0075]
在另一优选例中,在所述的取代或未取代的苯基中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代。
[0076]
在另一优选例中,在所述的取代或未取代的苯基中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代,所述的取代基为卤素(如氯)、硝基、氨基、c1-c4烷基(如甲基)、c1-c4烷氧基、c1-c4烷硫基、f3c-、f3c-o-。
[0077]
在另一优选例中,在所述的取代或未取代的苯基-甲基-中,所述的取代或未取代的苯基为单取代或未取代的苯基。
[0078]
在另一优选例中,在所述的取代或未取代的苯基-甲基-中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代。
[0079]
在另一优选例中,在所述的取代或未取代的苯基-甲基-中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代,所述的取代基为卤素(如氯)、硝基、氨基、c1-c4烷基(如甲基)、c1-c4烷氧基、c1-c4烷硫基、f3c-、f3c-o-。
[0080]
在另一优选例中,所述取代的苯基为单取代苯基。
[0081]
在另一优选例中,r4和r5各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、取代
或未取代的c1-c8烷基、取代或未取代的c3-c10环烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c12芳基、或取代或未取代的5-10元杂芳基。
[0082]
在另一优选例中,r4和r5各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、取代或未取代的c1-c6烷基、取代或未取代的c3-c10环烷基、取代或未取代的c1-c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c12芳基、或取代或未取代的5-10元杂芳基。
[0083]
在另一优选例中,r4和r5各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、取代或未取代的c1-c4烷基、取代或未取代的c3-c8环烷基、取代或未取代的c1-c4烷氧基、取代或未取代的c1-c4烷硫基、取代或未取代的c6-c8芳基、或取代或未取代的5-8元杂芳基。
[0084]
在另一优选例中,r4和r5各自独立地为氢、甲基、乙基、丙基或丁基。
[0085]
在另一优选例中,n为0、1、2、3、4、5或6。
[0086]
在本发明中,应当理解的是,当n为0时,“为
[0087]
在另一优选例中,r6为取代或未取代的c6-c12芳基、或取代或未取代的5-12元杂芳基、取代或未取代的3-12元环烷基、取代或未取代的3-12元杂环烷基。
[0088]
在另一优选例中,r6为取代或未取代的c6-c10芳基、或取代或未取代的5-10元杂芳基、取代或未取代的3-8元环烷基、取代或未取代的3-8元杂环烷基;
[0089]
在另一优选例中,r6为取代或未取代的c6-c8芳基、或取代或未取代的5-8元杂芳基、取代或未取代的3-8元环烷基、取代或未取代的3-8元杂环烷基。
[0090]
在另一优选例中,r6为取代或未取代的苯基、取代或未取代的吡啶基、取代或未取代的吡嗪基。
[0091]
在另一优选例中,所述的取代或未取代的苯基为单取代或未取代的苯基。
[0092]
在另一优选例中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代。
[0093]
在另一优选例中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代,所述的取代基为卤素、硝基、氨基、c1-c4烷基、c1-c4烷氧基、c1-c4烷硫基、f3c-、f3c-o-、c6-c12芳基、5-10元杂芳基。
[0094]
在另一优选例中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代,所述的取代基为卤素、硝基、氨基、c1-c4烷基、c1-c4烷氧基、c1-c4烷硫基、f3c-、f3c-o-、苯基。
[0095]
在另一优选例中,所述取代的苯基为单取代苯基。
[0096]
在另一优选例中,r6为间硝基苯基、邻硝基苯基、对硝基苯基、苯基、对甲基苯基、邻甲基苯基、间甲基苯基、间氨基苯基、对氨基苯基、邻氨基苯基、间甲氧基苯基、对甲氧基苯基、邻甲氧基苯基、间三氟甲氧基苯基、对三氟甲氧基苯基、邻三氟甲氧基苯基、对卤代苯基、邻卤代苯基、间卤代苯基、对三氟甲基苯基、邻三氟甲基苯基、间三氟甲基苯基、对苯基
c8烷氧基、取代或未取代的c1-c8烷硫基、取代或未取代的c6-c12芳基、或取代或未取代的5-12元杂芳基、取代或未取代的c6-c12芳基-取代或未取代的c1-c8烷基-、或取代或未取代的5-12元杂芳基-取代或未取代的c1-c8烷基-、取代或未取代的c1-c4烷基-c(o)-;或r
10
和r
11
连接形成取代或未取代的3-12元杂环烷环、或取代或未取代的3-12元杂芳环。
[0115]
在另一优选例中,r
10
和r
11
各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-o-、f3c-、取代或未取代的c1-c6烷基、取代或未取代的c3-c8环烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c1-c6烷硫基、取代或未取代的c6-c8芳基、或取代或未取代的5-10元杂芳基、取代或未取代的c6-c10芳基-取代或未取代的c1-c4烷基-、或取代或未取代的5-10元杂芳基-取代或未取代的c1-c4烷基-、取代或未取代的c1-c4烷基-c(o)-;或r
10
和r
11
连接形成取代或未取代的5-12元杂环烷环、或取代或未取代的5-12元杂芳环。
[0116]
在另一优选例中,r
10
和r
11
各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-o-、f3c-、取代或未取代的c1-c4烷基、取代或未取代的c3-c8环烷基、取代或未取代的c1-c4烷氧基、取代或未取代的c1-c4烷硫基、取代或未取代的c6-c8芳基、或取代或未取代的5-8元杂芳基、取代或未取代的c6-c8芳基-取代或未取代的c1-c2烷基-、或取代或未取代的5-8元杂芳基-取代或未取代的c1-c2烷基-、取代或未取代的c1-c4烷基-c(o)-;或r
10
和r
11
连接形成取代或未取代的5-12元杂环烷环、或取代或未取代的5-12元杂芳环。
[0117]
在另一优选例中,所述的取代或未取代的3-12元杂环烷环为取代或未取代的c6-c8芳环并取代或未取代的单环c5-c8杂环烷环。
[0118]
在另一优选例中,所述的取代或未取代的5-12元杂环烷环为取代或未取代的c6-c8芳环并取代或未取代的单环c5-c8杂环烷环。
[0119]
在另一优选例中,r
10
和r
11
各自独立地为氢、甲基、取代或未取代的苯基、取代或未取代的苯基-c1-c2烷基-、取代或未取代的吡啶基、取代或未取代的吡啶基-c1-c2烷基-、取代或未取代的c1-c3烷基-c(o)-;或r
10
和r
11
连接形成取代或未取代的异喹啉环、取代或未取代的喹啉环、取代或未取代的四氢异喹啉环、取代或未取代的四氢喹啉环、取代或未取代的二氢异喹啉-1酮环。
[0120]
在另一优选例中,所述四氢喹啉环为1,2,3,4-四氢喹啉环。
[0121]
在另一优选例中,所述二氢异喹啉-1酮环为3,4-二氢异喹啉-1酮环。
[0122]
在另一优选例中,取代或未取代的苯基-c1-c2烷基-为取代或未取代的苯基-甲基-或取代或未取代的苯基-乙基-。
[0123]
在另一优选例中,在所述的取代或未取代的苯基-c1-c2烷基-中,所述的取代或未取代的苯基为单取代或未取代的苯基。
[0124]
在另一优选例中,在所述的取代或未取代的苯基-c1-c2烷基-中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代取代。
[0125]
在另一优选例中,在所述的取代或未取代的苯基-c1-c2烷基-中,所述的取代或未取代的苯基为单取代或未取代的苯基,且取代为苯基的邻位、对位或间位取代,所述的取代基为卤素、硝基、氨基、c1-c4烷基、c1-c4烷氧基、c1-c4烷硫基、f3c-、f3c-o-。
[0126]
在另一优选例中,所述取代的苯基为单取代苯基。
[0127]
在另一优选例中,在所述的取代或未取代的苯基-c1-c2烷基-为取代或未取代的苯基-甲基-或取代或未取代的苯基-乙基-。
[0128]
在另一优选例中,r
12
和r
13
各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-、f3c-o-、取代或未取代的c1-c8烷基、取代或未取代的c3-c8环烷基、取代或未取代的c1-c6烷氧基、取代或未取代的c1-c6烷硫基、取代或未取代的c6-c12芳基、或取代或未取代的5-12元杂芳基、取代或未取代的c6-c12芳基-取代或未取代的c1-c6烷基-、或取代或未取代的5-12元杂芳基-取代或未取代的c1-c6烷基-。
[0129]
在另一优选例中,r
12
和r
13
各自独立地为氢、卤素、-cn、羟基、巯基、硝基、氨基、f3c-、f3c-o-、取代或未取代的c1-c4烷基、取代或未取代的c3-c6环烷基、取代或未取代的c1-c4烷氧基、取代或未取代的c1-c4烷硫基、取代或未取代的c6-c8芳基、或取代或未取代的5-10元杂芳基、取代或未取代的c6-c8芳基-取代或未取代的c1-c2烷基-、或取代或未取代的5-8元杂芳基-取代或未取代的c1-c2烷基-。
[0130]
在另一优选例中,r
12
和r
13
各自独立地为氢、卤素、苯基。
[0131]
在另一优选例中,所述的式i化合物的结构如下i-2结构所示:
[0132][0133]
其中,r4、r5、r6和n如上所定义。
[0134]
在另一优选例中,所述的式i化合物的结构如下i-3结构所示:
[0135][0136]
其中,r4、r5、r6和n如上所定义。
[0137]
在另一优选例中,所述的式i化合物的结构如下i-4结构所示:
[0138][0139]
其中,r4、r5、r6、r
10
、r
11
和n如上所定义。
[0140]
在另一优选例中,所述的式i化合物的结构如下i-5结构所示:
[0141][0142]
其中,r4、r5、r6、r
10
、r
11
和n如上所定义。
[0143]
在另一优选例中,所述的式i化合物的结构如下i-6结构所示:
[0144][0145]
其中,r3、r4、r5、r6和n如上所定义。
[0146]
在另一优选例中,所述的式i化合物的结构如下i-7结构所示:
[0147]
[0148]
其中,r3如上所定义;
[0149]r15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0150]
在另一优选例中,所述的式i化合物的结构如下i-8结构所示:
[0151][0152]
其中,r3如上所定义;
[0153]r15
、r
16
和r
17
各自独立地为氢、卤素(如cl)、甲基、硝基、苯基。
[0154]
在另一优选例中,所述的式i化合物的结构如下i-9结构所示:
[0155][0156]
其中,r3、r4、r5、r6和n如上所定义;
[0157]
a为0、1或2;
[0158]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0159]
在另一优选例中,所述的式i化合物的结构如下i-10结构所示:
[0160][0161]
其中,r3、r4、r5、r6和n如上所定义;
[0162]
a为0、1或2;
[0163]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0164]
在另一优选例中,所述的式i化合物的结构如下i-11结构所示:
[0165][0166]
其中,r3、r4、r5、r6和n如上所定义;
[0167]
a为0、1或2;
[0168]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0169]
在另一优选例中,所述的式i化合物的结构如下i-12结构所示:
[0170][0171]
其中,r3、r4、r5、r6和n如上所定义;
[0172]
a为0、1、2或3;
[0173]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0174]
在另一优选例中,所述的式i化合物的结构如下i-13结构所示:
[0175][0176]
其中,r3、r4、r5、r6和n如上所定义;
[0177]
a为0、1、2、3或4;
[0178]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0179]
在另一优选例中,所述的式i化合物的结构如下i-14结构所示:
[0180]
[0181][0182]
其中,r3、r4、r5、r6和n如上所定义;
[0183]
a为0、1、2或3;
[0184]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0185]
在另一优选例中,所述的式i化合物的结构如下i-15结构所示:
[0186][0187]
其中,r3、r4、r5、r6和n如上所定义;
[0188]
a为0、1或2;
[0189]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0190]
在另一优选例中,所述的式i化合物的结构如下i-16结构所示:
[0191][0192]
其中,r3、r4、r5、r6和n如上所定义;
[0193]
a为0、1或2;
[0194]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0195]
在另一优选例中,所述的式i化合物的结构如下i-17结构所示:
[0196][0197]
其中,r3、r4、r5、r6和n如上所定义;
[0198]
a为0、1或2;
[0199]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0200]
在另一优选例中,所述的式i化合物的结构如i-18结构所示:
[0201][0202]
其中,r3、r4、r5、r6和n如上所定义。
[0203]
在另一优选例中,所述的式i化合物的结构如下i-19结构所示:
[0204][0205]
其中,r3如上所定义。
[0206]
在另一优选例中,所述的式i化合物的结构如下i-20结构所示:
[0207][0208]
其中,r3、r4、r5、r6和n如上所定义。
[0209]
a为0、1、2、3、4或5;
[0210]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0211]
在另一优选例中,所述的式i化合物的结构如下i-21结构所示:
[0212][0213]
其中,r3如上所定义;
[0214]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3;
[0215]
a为0、1、2、3、4或5;
[0216]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0217]
在另一优选例中,所述的式i化合物的结构如下i-22结构所示:
[0218][0219]
其中,r3如上所定义;
[0220]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3;
[0221]
a为1、2、3、4或5;
[0222]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0223]
在另一优选例中,所述的式i化合物的结构如下i-23结构所示:
[0224][0225]
其中,r3、r4、r5、r6和n如上所定义;
[0226]
a为1、2、3、4或5;
[0227]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0228]
在另一优选例中,所述的式i化合物的结构如下i-24结构所示:
[0229]
[0230]
其中,r3如上所定义;
[0231]
a为0、1、2、3、4或5;
[0232]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3;
[0233]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0234]
在另一优选例中,所述的式i化合物的结构如下i-25结构所示:
[0235][0236]
其中,r3如上所定义;
[0237]
a为0、1、2、3、4或5;
[0238]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3;
[0239]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0240]
在另一优选例中,所述的式i化合物的结构如下i-26结构所示:
[0241][0242]
其中,r
10
、r
11
和环c如上所定义。
[0243]
在另一优选例中,所述的式i化合物的结构如下i-27结构所示:
[0244][0245]
其中,r
10
、r
11
和环c如上所定义。
[0246]
在另一优选例中,所述的式i化合物的结构如下i-28结构所示:
[0247][0248]
其中,r
10
和r
11
如上所定义;
[0249]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0250]
在另一优选例中,所述的式i化合物的结构如下i-29结构所示:
[0251][0252]
其中,r
10
和r
11
如上所定义;
[0253]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0254]
在另一优选例中,所述的式i化合物的结构如下i-30结构所示:
[0255][0256]
其中,r
10
和r
11
如上所定义;
[0257]r15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0258]
在另一优选例中,所述的式i化合物的结构如下i-31结构所示:
[0259][0260]
其中,r
10
和r
11
如上所定义;
[0261]r15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0262]
在另一优选例中,所述的式i化合物的结构如下i-32结构所示:
[0263][0264]
其中,r3如上所定义;
[0265]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0266]
a为0、1、2或3;
[0267]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8
元杂芳基。
[0268]
在另一优选例中,所述的式i化合物的结构如下i-33结构所示:
[0269][0270]
其中,r3如上所定义;
[0271]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0272]
a为0、1、2或3;
[0273]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0274]
在另一优选例中,所述的式i化合物的结构如下i-34结构所示:
[0275][0276]
其中,r3如上所定义;
[0277]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0278]
a为0、1、2或3;
[0279]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0280]
在另一优选例中,所述的式i化合物的结构如下i-35结构所示:
[0281][0282]
其中,r3如上所定义;
[0283]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0284]
a为0、1、2或3;
[0285]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0286]
在另一优选例中,所述的式i化合物的结构如下i-36结构所示:
[0287][0288]
其中,r3如上所定义;
[0289]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0290]
a为0、1、2或3;
[0291]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0292]
在另一优选例中,所述的式i化合物的结构如下i-37结构所示:
[0293][0294]
其中,r3如上所定义;
[0295]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0296]
a为0、1、2或3;
[0297]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0298]
在另一优选例中,所述的式i化合物的结构如下i-38结构所示:
[0299][0300]
其中,r3、r4、r5、r6和n如上所定义;
[0301]
a为0、1、2或3;
[0302]
各个r
18
独立地为氢、卤素、取代或未取代的c1-c4烷基、取代或未取代的c6-c12芳基、取代或未取代的c3-c8环烷基、取代或未取代的3-8元杂环烷基、或取代或未取代的5-8元杂芳基。
[0303]
在另一优选例中,所述的式i化合物的结构如下i-39结构所示:
[0304][0305]
其中,
[0306]r10
和r
11
如上所定义;
[0307]r14
、r
15
、r
16
和r
17
各自独立地为氢、卤素(如cl、f)、甲基、硝基、苯基、-ocf3、、-cf3。
[0308]
另一优选例中,所述的式i化合物的结构如下i-40结构所示:
[0309][0310]
其中,r4、r5、r6、r
10
、r
11
和n如上所定义;
[0311]r19
为氢、取代或未取代的c1-c6烷基。
[0312]
在另一优选例中,r
19
为氢、取代或未取代的c1-c4烷基(如甲基)。另一优选例中,所述的式i化合物的结构如下i-41结构所示:
[0313][0314]
其中,r4、r5、r6、r
10
、r
11
和n如上所定义;
[0315]r20
为氢、卤素。
[0316]
在另一优选例中,r
19
为氢、取代或未取代的c1-c4烷基(如甲基)。
[0317]
在另一优选例中,所述的式i化合物的结构如下i-42结构所示:
[0318][0319]
其中,r4、r5、r6和n如上所定义。
[0320]
在另一优选例中,所述的式i化合物的结构如下i-43结构所示:
[0321][0322]
其中,r3如上所定义;
[0323]r14
、r
15
、r
16
和r
17
各自独立地为氢、-cf3、卤素(如cl、f)、甲基、硝基、苯基、-ocf3。
[0324]r19
为氢、取代或未取代的c1-c6烷基。
[0325]
在另一优选例中,r
19
为氢、取代或未取代的c1-c4烷基(如甲基)。
[0326]
在另一优选例中,所述的式i化合物的结构如下i-44结构所示:
[0327][0328]
其中,r3如上所定义;
[0329]r14
、r
15
、r
16
和r
17
各自独立地为氢、-cf3、卤素(如cl、f)、甲基、硝基、苯基、-ocf3。
[0330]r19
为氢、取代或未取代的c1-c6烷基。
[0331]
在另一优选例中,r
19
为氢、取代或未取代的c1-c4烷基(如甲基)。
[0332]
在另一优选例中,所述的式i化合物的结构如下i-45结构所示:
[0333]
[0334]
其中,r4、r5、r6、r
10
、r
11
和n如上所定义。
[0335]
在另一优选例中,所述的式i化合物的结构如下i-46结构所示:
[0336][0337]
其中,r4、r5、r6、r
10
、r
11
和n如上所定义。
[0338]
在另一优选例中,所述的式i化合物的药学上可接受的盐为式i化合物与选自下组的酸形成的盐:盐酸、粘酸、d-葡萄糖醛酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸、甲酸、乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、苯甲磺酸、苯磺酸、天冬氨酸、谷氨酸,或其组合。
[0339]
在另一优选例中,所述的式i化合物具有以下结构:
[0340]
[0341]
[0342]
[0343]
[0344]
[0345]
[0346]
[0347]
[0348]
[0349]
[0350]
[0351]
[0352]
[0353]
[0354]
[0355]
[0356]
[0357]
[0358]
[0359]
[0360]
[0361]
[0362]
[0363]
[0364]
[0365]
[0366]
[0367][0368]
本发明第二方面,提供一种药物组合物,所述的药物组合物包括(a)如本发明第一方面所述的式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐;和(b)药物上可接受的载体。
[0369]
本发明第三方面,提供一种如本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐的用途,用于制备组合物或制剂,所述组合物或制剂用于预防和/或治疗癌症。
[0370]
在另一优选例中,所述的癌症选自下组:肺癌、胰腺癌、乳腺癌、淋巴癌、前列腺癌、脑癌、白血病、肝癌、黑色素癌、肠癌、肾癌、结肠癌,或其组合。
[0371]
在另一优选例中,所述的结肠癌包括结肠腺癌。
[0372]
在另一优选例中,所述的癌症细胞中线粒体膜通透性转换孔为低活性。
[0373]
在另一优选例中,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8,较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0374]
在另一优选例中,所述的乳腺癌包括三阴性乳腺癌。
[0375]
在另一优选例中,所述的肝癌为间变性低分化肝癌。
[0376]
在另一优选例中,所述的白血病包括急性髓细胞性白血病。
[0377]
在另一优选例中,所述的白血病包括m4型急性髓细胞性白血病。
[0378]
在另一优选例中,所述的肺癌选自下组:小细胞肺癌、非小细胞肺癌,或其组合。
[0379]
在另一优选例中,所述的淋巴癌包括b细胞淋巴癌。
[0380]
在另一优选例中,所述的肠癌包括结直肠腺癌。
[0381]
在另一优选例中,所述的结直肠腺癌包括dukes'type c,grade iv结直肠腺癌。
[0382]
在另一优选例中,所述的脑癌选自下组:髓母细胞瘤、脑胶质母细胞瘤,或其组合。
[0383]
在另一优选例中,所述的肾癌包括肾透明细胞腺癌。
[0384]
在另一优选例中,所述癌症的癌细胞中线粒体氧化磷酸化通路上调和/或线粒体膜通透性转换孔低活性。
[0385]
在另一优选例中,所述癌症的癌细胞中线粒体氧化磷酸化通路上调。
[0386]
在另一优选例中,所述癌症的癌细胞中线粒体膜通透性转换孔低活性。
[0387]
在另一优选例中,所述线粒体氧化磷酸化通路上调是指某一细胞(如癌细胞)的线粒体氧化磷酸化通路水平或表达e1与正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0388]
在另一优选例中,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0389]
在另一优选例中,所述的癌症的患者通过给予线粒体膜通透性转换孔抑制剂来使得癌细胞中线粒体膜通透性转换孔为低活性。
[0390]
在另一优选例中,通过给予线粒体膜通透性转换孔抑制剂使线粒体膜通透性转换孔为低活性。
[0391]
在另一优选例中,所述的水平为蛋白水平和/或mrna水平。
[0392]
在另一优选例中,所述的表达为蛋白表达和/或mrna表达。
[0393]
在另一优选例中,所述的线粒体膜通透性转换孔抑制剂选自下组:cyclosporin a、cyp-d蛋白抑制剂、过氧化物清除剂,或其组合。
[0394]
在另一优选例中,所述的肿瘤(癌症)包括nnmt基因低表达或未表达的肿瘤。
[0395]
在另一优选例中,所述肿瘤(癌症)包括nnmt基因区dna cpg位点甲基化水平高的肿瘤。
[0396]
在另一优选例中,所述的nnmt基因为人源nnmt基因。
[0397]
在另一优选例中,所述的nnmt基因为人nnmt基因。
[0398]
在另一优选例中,所述nnmt基因低表达或未表达的肿瘤是指从该肿瘤中提取的1ug蛋白中通过nnmt抗体检测不到nnmt蛋白,更佳地是指从该肿瘤中提取的5ug蛋白中通过nnmt抗体检测不到nnmt蛋白,更佳地是指从该肿瘤中提取的10ug蛋白中通过nnmt抗体检测不到nnmt蛋白,更佳地是指从该肿瘤中提取的100ug蛋白中通过nnmt抗体检测不到nnmt蛋白,是指从该肿瘤中提取的1000ug蛋白中通过nnmt抗体检测不到nnmt蛋白。
[0399]
在另一优选例中,所述nnmt基因低表达或未表达是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤0.000001,更佳地≤0.0000001。
[0400]
在另一优选例中,所述的同一细胞是指nnmt基因正常表达的细胞(如癌细胞)。
[0401]
在另一优选例中,所述的正常细胞是指nnmt基因正常表达的正常组织细胞(如癌细胞起源细胞或邻近细胞)。
[0402]
在另一优选例中,e0为nnmt基因正常表达细胞的nnmt基因的表达水平。
[0403]
在另一优选例中,所述的nnmt基因正常表达的细胞包括对式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐不敏感的细胞。
[0404]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平高是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0405]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平高是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥
15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0406]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平高是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平(n%)≥3%且小于等于m%,其中,m为3-100之间的任一正整数。
[0407]
在另一优选例中,m为5、10、15、20、25、30、35、40、45、50、55、60、65、70、80、85、90、95或100。
[0408]
在另一优选例中,所述的cpg位点甲基化水平是指某基因区域甲基化的cpg核苷酸数量占该基因区域所有核苷酸数量的比值。
[0409]
在另一优选例中,所述的nnmt基因区cpg位点甲基化水平是指nnmt基因区的甲基化的cpg核苷酸数量占nnmt基因区所有核苷酸数量的比值。
[0410]
在另一优选例中,所述的cpg位点甲基化水平是指某基因区域甲基化的cpg核苷酸数量占该基因区域所有cpg核苷酸数量的比值。
[0411]
在另一优选例中,所述的nnmt基因区cpg位点甲基化水平是指nnmt基因区的甲基化的cpg核苷酸数量占nnmt基因区所有cpg核苷酸数量的比值。
[0412]
在另一优选例中,所述的dna cpg位点甲基化水平是指某区域dna已甲基化的cpg位点数量占该区域dna的全部cpg位点数量的比值。
[0413]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平是指nnmt基因区dna已甲基化的cpg位点数量占nnmt基因区dna的全部cpg位点数量的比值。
[0414]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平包括nnmt基因启动子区dna cpg位点甲基化水平。
[0415]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平包括nnmt基因转录起始位点前1050bp到转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0416]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平包括nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0417]
在另一优选例中,所述的肿瘤选自下组:肺癌、肾癌、乳腺癌、结肠癌、淋巴癌、白血病、胰腺癌、肝癌、前列腺癌,或其组合。
[0418]
在另一优选例中,所述的表达包括蛋白表达和/或mrna表达。
[0419]
在另一优选例中,所述的组合物为药物组合物。
[0420]
在另一优选例中,所述的组合物或制剂还包括药学上可接受的载体。
[0421]
在另一优选例中,所述的表达为mrna或蛋白表达。
[0422]
在另一优选例中,所述的组合物或制剂的剂型为固体制剂、液体制剂或半固体制剂。
[0423]
在另一优选例中,所述的组合物或制剂的剂型为口服制剂、外用制剂或注射制剂
[0424]
在另一优选例中,所述的组合物或制剂的剂型为片剂、注射剂、输液剂、膏剂、凝胶剂、溶液剂、微球或膜剂。
[0425]
在另一优选例中,所述的组合物为药物组合物。
[0426]
在另一优选例中,所述的组合物或制剂还包括药学上可接受的载体。
[0427]
本发明第四方面,提供一种线粒体膜通透性转换孔抑制剂的用途,用于制备组合物或制剂,所述的组合物或制剂用于增强抗癌症药物的抗癌症效果。
[0428]
在另一优选例中,所述的抗癌症药物如本发明第一方面所述的式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐。
[0429]
在另一优选例中,所述的癌症如本发明第一方面所述。
[0430]
在另一优选例中,所述的线粒体膜通透性转换孔抑制剂选自下组:cyclosporin a、cyp-d蛋白抑制剂、过氧化物清除剂,或其组合。
[0431]
在另一优选例中,所述的cyp-d蛋白抑制剂如sfa、bka和adp(调节ant蛋白活性的小分子)。
[0432]
在另一优选例中,所述的过氧化物清除剂选自下组:propofol、pyruvate、mci-186,或其组合。
[0433]
本发明第五方面,提供一种活性成分组合,所述的活性成分组合包括以下组分:
[0434]
(1)第一活性成分,所述的第一活性成分为抗癌症药物;和
[0435]
(2)第二活性成分,所述的第二活性成分为线粒体膜通透性转换孔抑制剂。
[0436]
在另一优选例中,所述的第一活性成分与所述第二活性成分的摩尔比为0.01-600:1,较佳地0.05-500:1,更佳地0.1-400:1,更佳地0.2-200:1,更佳地0.5-100:1,更佳地0.5-80:1,最佳地1-50:1。
[0437]
在另一优选例中,所述的活性成分组合中,至少有一种活性成分是独立的。
[0438]
在另一优选例中,所述的活性成分组合中,第一活性成分和第二活性成分是相互独立的。
[0439]
本发明第六方面,提供一种组合物,所述的组合物包括:
[0440]
(1)第一活性成分,所述的第一活性成分为抗癌症药物;和
[0441]
(2)第二活性成分,所述的第二活性成分为线粒体膜通透性转换孔抑制剂。
[0442]
在另一优选例中,所述的组合物为药物组合物。
[0443]
在另一优选例中,所述的药物组合物还包括药学上可接受的载体。
[0444]
在另一优选例中,所述的第一活性成分的含量为0.01-99.99wt%,较佳地0.1-99.9wt%,更佳地1-99wt%,更佳地10-99wt%,最佳地20-99wt%,以组合物活性成分的总重量计。
[0445]
在另一优选例中,所述第二活性成分的含量为0.01-99.99wt%,较佳地0.1-99.9wt%,更佳地1-99wt%,更佳地10-99wt%,最佳地20-99wt%,以组合物活性成分的总重量计。
[0446]
本发明第七方面,提供一种药盒,所述药盒包括:
[0447]
(a)含有第一活性成分的第一制剂,所述的第一活性成分为抗癌症药物;和
[0448]
(b)含有第二活性成分的第二制剂,所述的第二活性成分为线粒体膜通透性转换孔抑制剂。
[0449]
在另一优选例中,所述的药盒还包括使用说明书。
[0450]
在另一优选例中,所述的第一制剂和第二制剂是相互独立制剂。
[0451]
在另一优选例中,所述的第一制剂和第二制剂是合并制剂。
[0452]
在另一优选例中,所述的使用说明书中注明将所述第一制剂和第二制进行联用,从而用于增强抗癌症药物的抗肿瘤活性。
[0453]
在另一优选例中,所述的联用的方法为先给予含有线粒体膜通透性转换孔抑制剂
的第二制剂,再给予抗癌症药物。
[0454]
本发明第八方面,提供一种体外非治疗性和非诊断性的抑制癌症细胞的方法,所述的方法包括步骤:将癌细胞与如本发明第一方面所述的式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行接触,从而抑制癌症细胞。
[0455]
在另一优选例中,所述的接触为体外培养接触。
[0456]
本发明第九方面,提供一种预防和/或治疗癌症的方法,所述的方法包括步骤:给需要的对象施用如本发明第一方面所述的式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐,或本发明第五方面所述的活性成分组合,或本发明第六方面所述的组合物,或本发明第七方面所述的药盒,从而预防和/或治疗癌症。
[0457]
在另一优选例中,所述对象为人和非人哺乳动物(啮齿动物、兔、猴、家畜、狗、猫等)。
[0458]
本发明第十方面,提供一种用于判断肿瘤患者是否适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗肿瘤的标志物,所述的标志物包括线粒体氧化磷酸化通路、线粒体膜通透性转换孔、nnmt基因和/或nnmt基因区dna cpg位点甲基化水平。
[0459]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平包括nnmt基因启动子区dna cpg位点甲基化水平。
[0460]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0461]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0462]
在另一优选例中,当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0463]
在另一优选例中,当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0464]
在另一优选例中,当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0465]
在另一优选例中,当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dna cpg位点甲基化水平低,则该肿瘤患者不适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0466]
本发明第十一方面,提供一种检测试剂盒,所述的检测试剂盒包括:
[0467]
(i)用于检测线粒体氧化磷酸化通路水平、线粒体膜通透性转换孔水平、nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平的检测试剂。
[0468]
在另一优选例中,所述的水平包括蛋白水平和/或mrna水平。
[0469]
在另一优选例中,所述检测试剂盒的检测样本包括肿瘤细胞。
[0470]
在另一优选例中,nnmt基因表达是指该基因mrna和该蛋白的表达;
[0471]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平是指nnmt基因启动子区dna cpg位点甲基化水平。
[0472]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0473]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0474]
本发明第十二方面,提供一种如发明第十二方面所述的检测试剂盒的用途,用于制备一伴随诊断试剂盒,所述伴随诊断试剂盒用于判断肿瘤患者是否适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0475]
在另一优选例中,所述的伴随诊断试剂盒还包括说明书或标签。
[0476]
在另一优选例中,所述的说明书或标签记载:
[0477]
当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0478]
在另一优选例中,所述的说明书或标签记载:
[0479]
当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0480]
在另一优选例中,所述的说明书或标签记载:
[0481]
当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0482]
在另一优选例中,所述的说明书或标签记载:
[0483]
当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dna cpg位点甲基化水平低,则该肿瘤患者不适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0484]
在另一优选例中,所述线粒体氧化磷酸化通路上调是指某一细胞(如癌细胞)的线粒体氧化磷酸化通路水平或表达e1与正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0485]
在另一优选例中,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0486]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平包括nnmt基因启动子区dna cpg位点甲基化水平。
[0487]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平包括nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0488]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平包括nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0489]
在另一优选例中,所述的cpg位点甲基化水平高是指相关区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0490]
在另一优选例中,所述的cpg位点甲基化水平低是指相关区域内dna cpg位点甲基化水平≤15%,较佳地≤10%,更佳地≤5%,更佳地≤3%,更佳地≤2%,更佳地≤1%。
[0491]
在另一优选例中,所述nnmt基因高表达或是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0492]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平低是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤0.000001,更佳地≤0.0000001。
[0493]
本发明第十三方面,提供一种药盒,所述的药盒包括:
[0494]
(i)用于检测线粒体氧化磷酸化通路水平、线粒体膜通透性转换孔水平、nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平的检测试剂;和
[0495]
(ii)如本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐。
[0496]
在另一优选例中,所述的药盒还包括说明书或标签。
[0497]
在另一优选例中,所述的说明书或标签记载:
[0498]
当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0499]
在另一优选例中,所述的说明书或标签记载:
[0500]
当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0501]
在另一优选例中,所述的说明书或标签记载:
[0502]
当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0503]
在另一优选例中,当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dnacpg位点甲基化水平低,则该肿瘤患者不适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0504]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平是指nnmt基因启动子区dna cpg位点甲基化水平。
[0505]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0506]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0507]
在另一优选例中,所述的cpg位点甲基化水平高是指相关区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0508]
在另一优选例中,所述的cpg位点甲基化水平低是指相关区域内dna cpg位点甲基化水平≤15%,较佳地≤10%,更佳地≤5%,更佳地≤3%,更佳地≤2%,更佳地≤1%。
[0509]
在另一优选例中,所述nnmt基因高表达或是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0510]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平低是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤0.000001,更佳地≤0.0000001。
[0511]
本发明第十四方面,提供一种预防和/或治疗肿瘤的方法,给所需的对象施用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐。
[0512]
在另一优选例中,所述的肿瘤如本发明第一方面所述。
[0513]
在另一优选例中,所述癌症的癌细胞中线粒体氧化磷酸化通路上调和/或线粒体膜通透性转换孔低活性。
[0514]
在另一优选例中,所述对象的肿瘤包括nnmt基因低表达或未表达的肿瘤。
[0515]
在另一优选例中,所述对象的肿瘤包括nnmt基因区dna cpg位点甲基化水平高的肿瘤。
[0516]
在另一优选例中,所述对象的肿瘤nnmt基因区dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0517]
在另一优选例中,所述对象的肿瘤nnmt基因启动子区dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0518]
在另一优选例中,所述对象的肿瘤nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0519]
在另一优选例中,所述对象的肿瘤nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0520]
在另一优选例中,所述对象为人和非人哺乳动物(啮齿动物、兔、猴、家畜、狗、猫等)。
[0521]
本发明第十五方面,提供一种装置或系统,所述的装置或系统包括:
[0522]
(i)检测模块,所述的检测模块用于检测线粒体氧化磷酸化通路水平、线粒体膜通透性转换孔水平、nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平;
[0523]
(ii)输出模块,所述的输出模块包括输出以下信息:
[0524]
当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗;
[0525]
在另一优选例中,当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗;
[0526]
当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗;和/或
[0527]
当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dna cpg位点甲基化水平低,则该肿瘤患者不适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0528]
在另一优选例中,所述线粒体氧化磷酸化通路上调是指某一细胞(如癌细胞)的线粒体氧化磷酸化通路水平或表达e1与正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0529]
在另一优选例中,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0530]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平为nnmt基因启动子区dna cpg位点甲基化水平。
[0531]
在另一优选例中,所述的nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平包括肿瘤细胞的nnmt基因表达和/或nnmt基因启动子区dna cpg位点甲基化水平。
[0532]
在另一优选例中,所述的nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平包括肿瘤细胞的nnmt基因表达和/或nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0533]
在另一优选例中,所述的nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平包括肿瘤细胞的nnmt基因表达和/或nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0534]
在另一优选例中,所述的cpg位点甲基化水平高是指相关区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0535]
在另一优选例中,所述的cpg位点甲基化水平低是指相关区域内dna cpg位点甲基
化水平≤15%,较佳地≤10%,更佳地≤5%,更佳地≤3%,更佳地≤2%,更佳地≤1%。
[0536]
在另一优选例中,所述nnmt基因高表达或是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0537]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平低是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤0.000001,更佳地≤0.0000001。
[0538]
在另一优选例中,所述的装置包括基因检测仪或蛋白检测仪。
[0539]
在另一优选例中,所述的装置或系统还包括进样模块。
[0540]
在另一优选来了,所述的进样模块用于进肿瘤细胞提取物。
[0541]
在另一优选例中,所述的装置或系统还包括数据处理模块。
[0542]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因区dna cpg位点甲基化水平高低。
[0543]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因启动子区dna cpg位点甲基化水平高低。
[0544]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平高低。
[0545]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平高低。
[0546]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
[0547]
附图
[0548]
图1为敏感及不敏感肿瘤细胞nnmt基因表达情况。
[0549]
图2为敏感及不敏感肿瘤细胞nnmt基因启动子区dna cpg位点甲基化水平。
[0550]
图3为敏感及不敏感肿瘤细胞nnmt基因转录起始位点前1050bp到转录起始位点后500bp之间区域dna cpg位点甲基化水平。
[0551]
图4为敏感及不敏感肿瘤细胞nnmt基因转录起始位点前1050bp到转录起始位点前193bp之间区域dna cpg位点甲基化水平
具体实施方式
[0552]
本发明人经过长期而深入的研究,通过大量筛选,意外地发现一类特定的类化合物(式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐)可有效地抑制肿瘤。此外,意外发现本发明化合物对于线粒体氧化磷酸化通路mptp不活跃的
肿瘤细胞,在较低浓度(ic50)下就可显著抑制肿瘤细胞的活性,这表明本发明化合物对mptp低活性或不活跃的肿瘤细胞具有更强抑制作用,而对mptp高活性的细胞抑制作用相对较弱,通常正常体细胞mptp活性较高,即本发明化合物对正常体细胞影响相对较小,成药安全性好。
[0553]
本发明人还首次意外地发现本发明化合物对nnmt基因低表达(或未表达)和/或nnmt基因区dna cpg位点甲基化水平高的肿瘤细胞具有显著的抑制作用。nnmt基因表达水平和/或nnmt基因启动子区dna cpg位点甲基化水平能够作为判断肿瘤患者是否适合采用本发明化合物进行预防和/或治疗的标志物。在此基础上,发明人完成了本发明。
[0554]
术语
[0555]
如本文所用,术语“包含”、“包括”、“含有”可互换使用,不仅包括封闭式定义,还包括半封闭、和开放式的定义。换言之,所述术语包括了“由
……
构成”、“基本上由
……
构成”。
[0556]
术语“抗癌症药物”与“抗肿瘤药物”可互换使用。
[0557]
术语“癌”、“癌症”、“肿瘤”和“瘤”可互换使用。
[0558]
术语“ic50”为半抑制浓度(50%inhibiting concentration),即达到50%抑制效果时抑制剂的浓度。
[0559]
如本文所用,术语“ic50”与“ic
50”可互换使用,是指半抑制浓度(50%inhibiting concentration),即达到50%抑制效果时抑制剂的浓度。
[0560]
术语“线粒体膜通透性转换孔”简称mptp(mitochondria permeability transition pore)。
[0561]
术语“氧化磷酸化通路”简称为oxphos(oxidative phosphorylation),又称为氧化磷酸化。
[0562]
如本文所用,术语“dna cpg位点甲基化水平高”、“dna cpg位点甲基化高水平”与“dna cpg位点高甲基化”可互换使用。
[0563]
如本文所用,术语“dna cpg位点甲基化低水平”、“dna cpg位点甲基化水平低”与“dna cpg位点低甲基化”可互换使用。
[0564]
如本文所用,术语“dna cpg位点甲基化水平”是指某一dna区域内已甲基化的cpg位点数量占该区域内所有cpg位点数量的比例。
[0565]
如本文所用,术语“cpg位点甲基化”、“cpg核苷酸甲基化”与“cpg甲基化”可互换使用。
[0566]
如本文所用,“肿瘤患者适合采用本发明化合物”包括肿瘤患者的肿瘤对本发明化合物敏感。
[0567]
如本文所用,“肿瘤患者不适合采用本发明化合物”包括肿瘤患者的肿瘤对本发明化合物不敏感。
[0568]
应当理解,本领域的普通技术人员可以选择本发明的化合物上的取代基和取代型式以产生化学上稳定的化合物,所述化合物可以通过本领域己知的技术以及下文所阐述的方法合成。如果被超过一个(多个)取代基团取代,应当理解,这多个基团可以是在同一个碳上或在不同碳上,只要产生稳定的结构即可。
[0569]
如本文所用,术语“取代”或“取代的”是基团上的氢原子被非氢原子基团取代,但需要满足其化合价要求并且由取代生成化学稳定的化合物,即不会自发进行诸如环化、消
除等转变的化合物。
[0570]
如本文所用,“r
1”、“r1”和“r
1”的含义相同,可相互替换,其它类似定义的含义相同。
[0571]
如本文所用,表示基团的连接位点。
[0572]
如本文所用,术语“烷基”指只含碳原子的直链(即,无支链)或支链饱和烃基,或直链和支链组合的基团。当烷基前具有碳原子数限定(如c1-c6烷基)指所述的烷基含有1-6个碳原子,例如,c1-c4烷基指含有1-4个碳原子的烷基,代表性实例包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、或类似基团。
[0573]
如本文所用,术语“c2-c4烯基”指具有1个或多个双键的2-4个碳原子的直链或支链烯烃分子少掉一个和双键连接的氢原子形成的烃基,例如乙烯基(ch2=ch-)、(c(ch3)2=ch-),或类似基团
[0574]
如本文所用,术语“c2-c4炔基”指具有1个或多个三键的2-4个碳原子的直链或支链炔基分子少掉一个和三键连接的氢原子形成的烃基,例如乙炔基(ch≡ch-)、(h3c-c≡ch-),或类似基团。
[0575]
在本发明中,术语“卤素”指f、cl、br或i。
[0576]
在本发明中,术语“卤代”是指被卤素取代。
[0577]
如本文所用,术语“卤代烷基”是指烷基的一个或多个(优选为1、2、3或4个)氢被卤素取代,所述的烷基和卤素如上所定义,当烷基前具有碳原子数限定(如c1-c8卤代烷基)指所述的烷基含有1-8个碳原子,例如,c1-c6卤代烷基指含有1-6个碳原子的卤代烷基,代表性实例包括但不限于-cf3、-chf2、单氟代异丙基、双氟代丁基、或类似基团。
[0578]
如本文所用,术语“环烷环”指具有饱和的或部分饱和的单元环,二环或多环(稠环、桥环或螺环)环系。当某个环烷环前具有碳原子数限定(如c3-c12)时,指所述的环烷环具有3-12个环碳原子。在一些优选实施例中,术语“c3-c8环烷环”指具有3-8个环碳原子的饱和或部分饱和的单环或二环烷环,包括环丙环、环丁环、环戊环、环庚环、或类似环。“螺环烷环”指单环之间共用一个碳原子(称螺原子)的二环或多环,这些可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。“稠环烷环”指系统中的每个环与体系中的其他环共享毗邻的一对碳原子的全碳二环或多环,其中一个或多个环可以含有一个或多个双键,但连接母体的共享毗邻的一对碳原子为具有非共轭的π电子体的全碳二环或多环上的毗邻的一对碳原子。“桥环烷环”指任意两个环共用两个不直接连接的碳原子的全碳多环,这些可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。如下是环烷环的代表性实例,包括但不限于:环丙环、环丁环、环戊环、环庚环,或类似环。
[0579]
如本文所用,术语“环烷基”指具有饱和的或部分饱和的单元环,二环或多环(稠环、桥环或螺环)环系基团。当某个环烷基前具有碳原子数限定(如c3-c12)时,指所述的环烷基具有3-12个环碳原子。在一些优选实施例中,术语“c3-c8环烷基”指具有3-8个环碳原子的饱和或部分饱和的单环或二环烷基,包括环丙基、环丁基、环戊基、环庚基、或类似基团。“螺环烷基”指单环之间共用一个碳原子(称螺原子)的二环或多环基团,这些可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。“稠环烷基”指系统中的每个环与体系中的其他环共享毗邻的一对碳原子的全碳二环或多环基团,其中一个或多个环可以含有一个或多个双键,但连接母体的点必须在具有非共轭的π电子体系的环上的碳原子上。“桥环烷基”指任意两个环共用两个不直接连接的碳原子的全碳多环基团,这些可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。如下是环烷基的代表性实例,包括但不限于:
[0580][0581]
如本文所用,术语“卤代环烷基”是指环烷基的一个或多个(优选为1、2、3或4个)氢被卤素取代,所述的环烷基和卤素如上所定义,当环烷基前具有碳原子数限定(如c3-c8卤代烷基)指所述的环烷基含有3-8个环碳原子,例如,c3-c8卤代烷基指含有3-6碳原子的卤代环烷基,代表性实例包括但不限于单氟代环丙基、单氯代环丁基、单氟代环戊基、双氟代环庚基,或类似基团。
[0582]
术语“烷氧基”指r-o-基团,其中r为烷基,烷基为如上本文所定义,当烷氧基前具有碳原子数限定,如c1-c8烷氧基基指所述的烷氧基中的烷基具有1-8个碳原子。烷氧基的代表性示例包括但不限于:甲氧基、乙氧基、正丙氧基、异丙氧基、叔丁氧基,或类似基团。
[0583]
如本文所用,术语“烷硫基”指r-o-基团,其中r为烷基,烷基为如上本文所定义,当烷硫基前具有碳原子数限定,如c1-c8烷硫基指所述的烷硫基中的烷基具有1-8个碳原子。烷硫基的代表性示例包括但不限于:甲硫基、乙硫基、正丙硫基、异丙硫基、叔丁硫基,或类似基团。
[0584]
如本文所用,术语“卤代烷氧基”是指卤代烷基-o-,所述的卤代烷基如上所定,例如,c1-c6卤代烷氧基指含有1-6个碳原子的卤代烷氧基,代表性实例包括但不限于、单氟代甲氧基、单氟代乙氧基、双氟代丁氧基、或类似基团。
[0585]
如本文所用,术语“卤代烷硫基”是指卤代烷基-s-,所述的卤代烷基如上所定,例如,c1-c6卤代烷硫基指含有1-4个碳原子的卤代烷硫基,代表性实例包括但不限于、单氟代甲硫基、单氟代乙硫基、双氟代丁硫基、或类似基团。
[0586]
术语“杂环烷环”又称为“杂环”,是指完全饱和的或部分不饱和的的环(包含但不限于如3-7元单环,7-11元双环,或8-16元三环系统),其中至少有一个杂原子存在于至少有一个碳原子的环中。当杂环前有元数限定时,指的是杂环的环原子个数,例如3-16元杂环指的是具有3-16个环原子的杂环。每个含有杂原子的杂环上可以带有一个或多个(如1,2,3或4个)杂原子,这些杂原子各自独立地选自氮原子、氧原子或硫原子,其中氮原子或硫原子可以被氧化,氮原子也可以被季铵化。杂环可以连接到环或环系分子的任何杂原子或碳原子的残基上。典型的单环杂环烷环包括但不限于氮杂环丁烷环、氧杂环丁烷、咪唑啉环、咪唑烷环、四氢呋喃环、哌啶环、哌嗪环、2-氧代哌嗪环、2-氧代哌啶环、4-哌啶酮环、四氢吡喃
环、吗啡啉环、硫代吗啡啉环、硫代吗啡啉亚砜环、硫代吗啡啉砜环、1,3-二噁烷环和四氢-1,1-二氧噻吩环等。多环杂环烷环包括螺环、稠环和桥环的杂环环;其中涉及到的螺环、稠环和桥环的杂环任选与其他环通过单键相连接,或者通过环上的任意两个或两个以上的原子与其它环烷环、杂环、芳环或杂芳环进一步并环连接,连接母体的点必须在具有非共轭的π电子体系的环上碳原子或杂原子。
[0587]
术语“杂环烷基”是指完全饱和的或部分不饱和的的环状基团(包含但不限于如3-7元单环,7-11元双环,或8-16元三环系统),其中至少有一个杂原子存在于至少有一个碳原子的环中。当杂环烷基前有元数限定时,指的是杂环烷基的环原子个数,例如3-16元杂环烷基指的是具有3-16个环原子的杂环烷基。每个含有杂原子的杂环上可以带有一个或多个(如1,2,3或4个)杂原子,这些杂原子各自独立地选自氮原子、氧原子或硫原子,其中氮原子或硫原子可以被氧化,氮原子也可以被季铵化。杂环烷基可以连接到环或环系分子的任何杂原子或碳原子的残基上。典型的单环杂环烷基包括但不限于氮杂环丁烷基、氧杂环丁烷基、咪唑啉基、咪唑烷基、四氢呋喃基、哌啶基、哌嗪基、2-氧代哌嗪基、2-氧代哌啶基、4-哌啶酮基、四氢吡喃基、吗啡啉基、硫代吗啡啉基、硫代吗啡啉亚砜基、硫代吗啡啉砜基、1,3-二噁烷基和四氢-1,1-二氧噻吩等。多环杂环烷基包括螺环、稠环和桥环的杂环基;其中涉及到的螺环、稠环和桥环的杂环烷基任选与其他基团通过单键相连接,或者通过环上的任意两个或两个以上的原子与其它环烷环、杂环进一步并环连接,多环杂环烷基可以具有稠和的芳香环但连接母体的点必须在具有非共轭的π电子体系的环上碳原子或杂原子。
[0588]
术语“芳环”指具有共轭的π电子体系的全碳单环或稠合多环(也就是共享毗邻碳原子对的环),是一种芳香环状烃类化合物,当芳环前面具有碳原子数限定,如c6-c12芳环,则指所述的芳环具有6-12个环碳原子,例如苯环和萘环。所述芳环可以稠合于其它碳环(包括饱和或不饱和环),但不能含有杂原子如氮、氧、或硫,同时连接母体的点必须在具有共轭的π电子体系的环上的碳原子上。代表性地芳环为苯环和萘环,或类似环。
[0589]
术语“芳基”指具有共轭的π电子体系的全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,是一种芳香环状烃类化合物基团,当芳基前面具有碳原子数限定,如c6-c12芳基,则指所述的芳基具有6-12个环碳原子,例如苯基和萘基。所述芳基环可以稠合于其它环状基团(包括饱和或不饱和环),但不能含有杂原子如氮、氧、或硫,同时连接母体的点必须在具有共轭的π电子体系的环上的碳原子上。如下是芳基代表性实例,包括但不限于:
[0590][0591]
术语“杂芳环”指具有一个到多个(优选为1、2、3或4个)杂原子的芳族杂环,其可以是单环(单环的)或者稠合在一起或共价地连接的多环(二环的、三环的或多环的),每个含有杂原子的杂环上可以具有一个或多个(如1、2、3、4个)各自独立选自下组的杂原子:氧、硫和氮。当杂芳环前有元数限定时,指的是杂芳环的环原子个数,例如5-12元杂芳环指的是具有5-12个环原子的杂芳环,代表性的例子包括但不限于:吡咯环、吡唑环、咪唑环、噁唑环、异噁唑环、噻唑环、噻二唑环、异噻唑环、呋喃环、吡啶环、吡嗪环、嘧啶环、哒嗪环、三氮嗪环、三氮唑环及四氮唑环等。
[0592]
术语“杂芳基”指具有一个到多个(优选为1、2、3或4个)杂原子的芳族杂环系基团,其可以是单环(单环的)或者稠合在一起或共价地连接的多环(二环的、三环的或多环的),每个含有杂原子的杂环上可以带有一个多个(如1、2、3、4个)各自独立选自下组的杂原子:氧、硫和氮。当杂芳基前有元数限定时,指的是杂芳基的环原子个数,例如5-12元杂芳基指的是具有5-12个环原子的杂芳基,代表性的例子包括但不限于:吡咯基、吡唑基、咪唑基、噁唑基、异噁唑基、噻唑基、噻二唑基、异噻唑基、呋喃基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三氮嗪基、三氮唑基及四氮唑基等。
[0593]
如本文所用,术语“羧基”指具-cooh基团或-烷基-cooh基团,烷基为如上本文所定义,例如“c
2-c4羧基”是指-c
1-c3烷基-cooh结构的基团,羧基的代表性示例包括(但不限于):-cooh、-ch2cooh、-c2h4cooh,或类似基团。
[0594]
如本文所用,术语“酯基”指具r-co-o-基团或-co-o-r基团,其中r为烷基,烷基为如上本文所定义,例如“c
2-c4酯基”是指c
1-c3烷基-co-o-结构的基团或者-co-o-c
1-c3烷基结构的基团,酯基的代表性示例包括但不限于:ch3coo-、c2h5coo-、c3h8coo-、(ch3)2chcoo-、-cooch3、-cooc2h5、-cooc3h8,或类似基团。
[0595]
如本文所用,术语“酰胺基”指具r-co-n-基团或-co-n-r基团,其中r为烷基,烷基为如上本文所定义,例如“c
2-c4酰胺基”是指c
1-c3烷基-co-n-结构的基团或者-co-n-c
1-c3烷基结构的基团,酰胺基的代表性示例包括但不限于:ch3co-n-、c2h5co-n-、c3h8co-n-、(ch3)2chco-n-、-co-n-ch3、-co-n-c2h5、-co-n-c3h8,或类似基团。
[0596]
如本文所用,在单独或作为其他取代基一部分时,术语"氨基"表示-nh2。
[0597]
如本文所用,在单独或作为其他取代基一部分时,术语"硝基"表示-no2。
[0598]
如本文所用,在单独或作为其他取代基一部分时,术语"氰基"表示-cn。
[0599]
如本文所用,在单独或作为其他取代基一部分时,术语"羟基"表示-oh。
[0600]
如本文所用,在单独或作为其他取代基一部分时,术语"巯基"表示-sh。
[0601]
在本说明书中,应解释为所有取代基为未取代的,除非在本文中明确描述为“取代的”。术语“取代”是指特定的基团上的一个或多个氢原子被特定的取代基所取代。特定的取代基为在前文中相应描述的取代基,或各实施例中所出现的取代基,优选地,所述的取代是指环或基团上的一个或多个(优选为1、2、3、4、5、6、7或8个)氢原子被选自下组的取代基所取代:c1-c8烷基、c3-c8环烷基、c1-c8卤代烷基、c3-c8卤代环烷基、卤素、硝基、-cn、羟基、巯基、氨基、c1-c4羧基、c2-c4酯基、c2-c4酰胺基、c1-c8烷氧基、c1-c8烷硫基、c1-c8卤代烷氧基、c1-c8卤代烷硫基、c6-c12芳基、5-10元杂芳基、5-10元杂环烷基。除非特别说明,某个任意取代的基团可以在该基团的任何可取代的位点上具有一个选自特定组的取代基,所述的取代基在各个位置上可以是相同或不同的。
[0602]
在本发明中,术语“预防”表示预防疾病和/或它的附随症状的发作或者保护对象免于获得疾病的方法。本文中使用的"预防"还包括延迟疾病和/或它的附随症状的发作和降低对象的得病的风险。
[0603]
本发明所述的“治疗”包括延缓和终止疾病的进展,或消除疾病,并不需要100%抑制、消灭和逆转。在一些实施方案中,与不存在本发明所述的组合物、药盒、食品盒或保健品盒、活性成分组合时观察到的水平相比,本发明所述组合物或药物组合物通过抑制肿瘤减轻、抑制和/或逆转了例如至少约10%、至少约30%、至少约50%、或至少约80%。
[0604]
在本发明中,术语“预防”表示预防疾病和/或它的附随症状的发作或者保护对象免于获得疾病的方法。
[0605]
本发明所述的“治疗”包括延缓和终止疾病的进展,或消除疾病,并不需要100%抑制、消灭和逆转。在一些实施方案中,与不存在本发明所述的化合物时观察到的水平相比,本发明所述化合物将相关疾病(如肿瘤)及其并发症减轻、抑制和/或逆转了例如至少约10%、至少约30%、至少约50%、或至少约80%。
[0606]
线粒体氧化磷酸化通路和线粒体膜通透性转换孔
[0607]
氧化磷酸化通路(oxidative phosphorylation,oxphos)是线粒体最重要的通路之一,该通路利用三羧酸循环和脂肪氧化等通路来源的nadh和fadh等来合成atp。线粒体氧化磷酸化通路有大于90个蛋白组成,这些蛋白分别组成5个蛋白复合体,复合体i、ii、iii、iv和v。
[0608]
线粒体氧化磷酸化通路受线粒体膜通透性转换孔(mptp,mitochondria permeability transition pore)调节,本发明化合物在mptp不活跃细胞的抑制作用更佳。
[0609]
如本文所用,术语“线粒体氧化磷酸化通路上调”、“线粒体氧化磷酸化通路阳性”可互换使用,是指某一细胞(如癌细胞)的线粒体氧化磷酸化通路水平或表达高于正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达。优选地,术语“线粒体氧化磷酸化通路上调”或“线粒体氧化磷酸化通路阳性”是指某一细胞(如肿瘤细胞)的线粒体氧化磷酸化通路水平或表达e1与正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0610]
在本发明中,“线粒体氧化磷酸化通路上调”、“线粒体氧化磷酸化通路阳性”可用mptp的活性来表征,mptp不活跃表示“线粒体氧化磷酸化通路上调”或“线粒体氧化磷酸化通路阳性”,例如当某一细胞(如癌细胞)的mptp的活性水平或表达水平a1与正常细胞(同种细胞)中mptp的活性水平或表达水平a0的比值(a1/a0))≤0.8较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05,可认为该所述细胞为线粒体氧化磷酸化通路上调或阳性的细胞。
[0611]
在本发明的一个优选例中,所述的水平为蛋白水平和/或mrna水平。
[0612]
在本发明的一个优选例中,所述的表达为蛋白表达和/或mrna表达。
[0613]
在本发明中,所述的氧化磷酸化通路水平或表达、mptp的活性水平或表达水平可以用常规方法进行测定,例如测定mptp的活性,或者在蛋白水平或mrna水平测定mptp的表达量。
[0614]
nnmt基因
[0615]
nnmt基因英文名为nicotinamide n-methyltransferase,不同网站对该基因有不同的识别号:hgnc:7861;entrez gene:4837;ensembl:ensg00000166741;omim:600008;uniprotkb:p40261。
[0616]
优选地,nnmt基因为人源nnmt基因,较佳地为人nnmt基因。
[0617]
在本发明中,所述的nnmt基因启动子区是指nnmt基因转录起始位点之前2000bp至转录起始位点之后500bp之间的区域。
[0618]
nnmt基因区位于人类11号染色体第114,255,831到114,313,285,总长为57455bp的dna序列,包括nnmt基因启动子区、nnmt基因外显子区和nnmt基因内含子区。
[0619]
nnmt基因启动子区:人11号染色体第114,255,831到114,258,331,也就是nnmt基因转录起始位点之前2000bp至转录起始位点之后500bp之间的区域为nnmt基因启动子区。
[0620]
nnmt基因启动子区序列为nnmt基因转录起始位点之前2000bp(黑色加深且无下划线部分)以及之后500bp之间的序列(非黑色加深且有下划线部分),其核苷酸序列如seq id no:1所示:
[0621]
[0622][0623]
dna甲基化(dna methylation)
[0624]
dna甲基化(dna methylation)为dna化学修饰的一种形式,能够在不改变dna序列的前提下,改变遗传表现。所谓dna甲基化是指在dna甲基化转移酶的作用下,在基因组cpg二核苷酸的胞嘧啶5号碳位共价键结合一个甲基基团。大量研究表明,dna甲基化能引起染色质结构、dna构象、dna稳定性及dna与蛋白质相互作用方式的改变,从而调控基因表达。
[0625]
dna甲基化是最早被发现、也是研究最深入的表观遗传调控机制之一。广义上的dna甲基化是指dna序列上特定的碱基在dna甲基转移酶(dna methyltransferase,dnmt)的催化作用下,以s-腺苷甲硫氨酸(s-adenosyl methionine,sam)作为甲基供体,通过共价键结合的方式获得一个甲基基团的化学修饰过程。这种dna甲基化修饰可以发生在胞嘧啶的c-5位、腺嘌呤的n-6位及鸟嘌呤的n-7位等位点。一般研究中所涉及的dna甲基化主要是指发生在cpg二核苷酸中胞嘧啶上第5位碳原子的甲基化过程,其产物称为5—甲基胞嘧啶(5-mc),是植物、动物等真核生物dna甲基化的主要形式。dna甲基化作为一种相对稳定的修饰状态,在dna甲基转移酶的作用下,可随dna的复制过程遗传给新生的子代dna,是一种重要的表观遗传机制。
[0626]
dna甲基化反应分为2种类型。一种是2条链均未甲基化的dna被甲基化,称为从头甲基化(denovo methylation);另一种是双链dna的其中一条链已存在甲基化,另一条未甲
基化的链被甲基化,这种类型称为保留甲基化(maintenance methylation)。
[0627]
典型地,dna甲基化为dna cpg位点甲基化。cpg双核苷酸在人类基因组中的分布很不均一,而在基因组的某些区段,cpg保持或高于正常概率。cpg位点富集区(又称cpg岛)主要位于基因的启动子(promotor)和外显子区域,是富含cpg二核苷酸的一些区域,约有60%以上基因的启动子含有cpg岛。这里cpg是胞嘧啶(c)—磷酸(p)—鸟嘌呤(g)的缩写。
[0628]
细胞内基因表达受多种信号传导通路、转录因子和表观遗传修饰的调控。dna甲基化修饰是表观遗传修饰调控基因表达的重要方式,特定基因区dna甲基化水平往往影响该基因的表达水平。相对于信号传导通路和转录因子等对基因表达的调控,表观遗传修饰中的dna甲基化修饰对基因表达的影响更加稳定,并不易被细胞外环境所影响,dna甲基化修饰容易用现有技术精准检测,因此是较为理想的生物标志物。
[0629]
式i化合物
[0630]
如本文所用,“本发明化合物”、“本发明式i化合物”、或“式i化合物”可互换使用,指具有式i结构的化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐。应理解,该术语还包括上述组分的混合物。
[0631][0632]
具体地,所述的式i化合物如上本发明第一方面所述。
[0633]
代表性地,本发明所述的式i化合物如本发明实施例1-105所制备的具体化合物(包括其成盐形式或去掉盐根的游离形式)。
[0634]
在本发明中,应当理解是,当环b为无时,r3也为无,即当环b为无时,所述的式i化合物具有如下结构:
[0635][0636]
本方面所述的式i化合物可通过本领域公知的的有机合成方法制备。
[0637]
本发明化合物对肿瘤细胞具有优异的抑制作用,对线粒体氧化磷酸化通路上调的或mptp低活性的肿瘤细胞具有更优异的抑制作用,特别是对mptp始终处于关闭状态的肿瘤细胞具有更为优异的抑制作用。同时,因正常体细胞mptp活性较高,本发明化合物对正常体细胞抑制较弱,毒副作用小,故而本发明化合物可开发成为较为安全有效的抗癌药物。
[0638]
术语“药学上可接受的盐”指本发明化合物与酸或碱所形成的适合用作药物的盐。药学上可接受的盐包括无机盐和有机盐。一类优选的盐是本发明化合物与酸形成的盐,适合形成盐的酸包括(但并不限于):盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸等无机酸,甲酸、乙酸、三氟乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬
酸、苦味酸、甲磺酸、苯甲磺酸,苯磺酸等有机酸;以及天冬氨酸、谷氨酸等酸性氨基酸。一类优选的盐是本发明化合物与碱形成的金属盐,适合形成盐的碱包括(但并不限于):氢氧化钠、氢氧化钾、碳酸钠、碳酸氢钠、磷酸钠等无机碱、氨水、三乙胺、二乙胺等有机碱。
[0639]
本发明所述的如式i所示化合物可通过常规方法转化为其药学上可接受的盐,例如,可将相应的酸的溶液加入到上述化合物的溶液中,成盐完全后除去溶剂即得本发明所述化合物的相应的盐。
[0640]
本发明所述的化合物优选为如本发明实施例所制备的。
[0641]
癌症
[0642]
本发明研究表明,本发明化合物对肿瘤细胞具有优异的抑制作用,尤其是对线粒体氧化磷酸化通路上调、mptp低活性、nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高的肿瘤细胞具有更优异的抑制作用。
[0643]
在本发明的一个优选例中,所述的癌症包括但不限于:肺癌、胰腺癌、乳腺癌、淋巴癌、前列腺癌、脑癌、白血病、肝癌、黑色素癌、肠癌、肾癌、结肠癌,或其组合。
[0644]
在另一优选例中,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8,较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0645]
代表性地,所述的乳腺癌包括三阴性乳腺癌。
[0646]
代表性地,所述的肝癌为间变性低分化肝癌。
[0647]
代表性地,所述的白血病包括急性髓细胞性白血病。
[0648]
代表性地,所述的白血病包括m4型急性髓细胞性白血病。
[0649]
代表性地,所述的肺癌选自下组:小细胞肺癌、非小细胞肺癌,或其组合。
[0650]
代表性地,所述的淋巴癌包括b细胞淋巴癌。
[0651]
代表性地,所述的肠癌包括结直肠腺癌。
[0652]
代表性地,所述的结直肠腺癌包括dukes'type c,grade iv结直肠腺癌。
[0653]
代表性地,所述的脑癌选自下组:髓母细胞瘤、脑胶质母细胞瘤,或其组合。
[0654]
代表性地,所述的肾癌包括肾透明细胞腺癌。
[0655]
在本发明的另一优选例中,所述癌症的癌细胞中线粒体氧化磷酸化通路上调和/或线粒体膜通透性转换孔低活性。
[0656]
优选地,所述线粒体氧化磷酸化通路上调是指某一细胞(如癌细胞)的线粒体氧化磷酸化通路水平或表达e1与正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0657]
优选地,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8,较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0658]
在本发明的一个优选例中,所述的癌症包括但不限于:nnmt基因低表达或未表达的癌症。
[0659]
在另一优选例中,所述癌症包括但不限于:nnmt基因区dna cpg位点甲基化水平高
a、cyp-d蛋白抑制剂、过氧化物清除剂,或其组合。
[0679]
代表性地,所述的cyp-d蛋白抑制剂如sfa、bka和adp(调节ant蛋白活性的小分子)。
[0680]
代表性地,所述的过氧化物清除剂包括但不限于:propofol、pyruvate、mci-186,或其组合。
[0681]
标志物
[0682]
本发明还提供一种用于判断肿瘤患者是否适合采用本发明所述化合物进行预防和/或治疗的标志物,所述的标志物包括线粒体氧化磷酸化通路、线粒体膜通透性转换孔、nnmt基因和/或nnmt基因区dna cpg位点甲基化水平。
[0683]
优选地,所述的nnmt基因区dna cpg位点甲基化水平包括nnmt基因启动子区dna cpg位点甲基化水平。
[0684]
在一个实施方式中,当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发所述的化合物进行预防和/或治疗。
[0685]
在一个实施方式中,当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发所述的化合物进行预防和/或治疗。。
[0686]
在一个实施方式中,nnmt基因和/或nnmt基因区dna cpg位点甲基化水平作为判断肿瘤患者是否适合采用本发明所述化合物进行预防和/或治疗的标志物,其方法包括但不限于:
[0687]
当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,则该肿瘤患者适合采用本发明所述化合物进行预防和/或治疗;和/或
[0688]
当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dna cpg位点甲基化水平低,则该肿瘤患者不适合采用本发明所述化合物进行预防和/或治疗。
[0689]
在另一优选例中,所述nnmt基因高表达或是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0690]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平低是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤0.000001,更佳地≤0.0000001。
[0691]
检测试剂盒及其用途
[0692]
本发明提供一种用于检检测试剂盒,所述的所述的检测试剂盒包括:
[0693]
(i)用于检测nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平的检测试剂。
[0694]
本发明还提供一种本发明所述检测试剂盒的用途,用于制备一伴随诊断试剂盒,所述伴随诊断试剂盒用于判断肿瘤患者是否适合采用本发明所述化合物进行预防和/或治疗。
[0695]
在另一优选例中,所述的伴随诊断试剂盒还包括说明书或标签。
[0696]
在另一优选例中,所述的说明书或标签记载:
[0697]
当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0698]
在另一优选例中,所述的说明书或标签记载:
[0699]
当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0700]
在另一优选例中,所述的说明书或标签记载:
[0701]
当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,则该肿瘤患者适合采用本发明所述化合物进行预防和/或治疗;和/或
[0702]
当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dna cpg位点甲基化水平低,则该肿瘤患者不适合采用本发明所述化合物进行预防和/或治疗。
[0703]
在另一优选例中,所述线粒体氧化磷酸化通路上调是指某一细胞(如癌细胞)的线粒体氧化磷酸化通路水平或表达e1与正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0704]
在另一优选例中,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0705]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平包括nnmt基因启动子区dna cpg位点甲基化水平。
[0706]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平包括nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0707]
在另一优选例中,nnmt基因区dna cpg位点甲基化水平包括nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0708]
在另一优选例中,所述的cpg位点甲基化水平高是指相关区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0709]
在另一优选例中,所述的cpg位点甲基化水平低是指相关区域内dna cpg位点甲基化水平≤15%,较佳地≤10%,更佳地≤5%,更佳地≤3%,更佳地≤2%,更佳地≤1%。
[0710]
在另一优选例中,所述nnmt基因高表达或是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0711]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平低是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤
0.000001,更佳地≤0.0000001。
[0712]
药盒
[0713]
本发明还提供一种药盒,所述的药盒包括:
[0714]
(i)用于检测线粒体氧化磷酸化通路水平、线粒体膜通透性转换孔水平、nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平的检测试剂;和
[0715]
(ii)本发明所述式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐。
[0716]
在另一优选例中,所述的药盒还包括说明书或标签。
[0717]
在另一优选例中,所述的说明书或标签记载:
[0718]
当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0719]
在另一优选例中,所述的说明书或标签记载:
[0720]
当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0721]
在另一优选例中,所述的说明书或标签记载:
[0722]
当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,该肿瘤患者适合采用本发明所述化合物进行预防和/或治疗;和/或
[0723]
当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dnacpg位点甲基化水平低,则该肿瘤患者不适合采用本发明所述化合物进行预防和/或治疗。
[0724]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平是指nnmt基因启动子区dna cpg位点甲基化水平。
[0725]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0726]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平是指nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0727]
在另一优选例中,所述的cpg位点甲基化水平高是指相关区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0728]
在另一优选例中,所述的cpg位点甲基化水平低是指相关区域内dna cpg位点甲基化水平≤15%,较佳地≤10%,更佳地≤5%,更佳地≤3%,更佳地≤2%,更佳地≤1%。
[0729]
在另一优选例中,所述nnmt基因高表达或是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0730]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平低是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤
0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤0.000001,更佳地≤0.0000001。
[0731]
本发明化合物用途
[0732]
本发明提供一种式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐用于预防和/或治疗癌症。
[0733]
本发明还提供一种体外非治疗性和非诊断性的抑制癌症细胞的方法,所述的方法包括步骤:将癌细胞与如本发明所述的式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行接触,从而抑制癌症细胞。
[0734]
在本发明中,体外非治疗性和非诊断性的抑制癌症细胞的方法能够用于药物筛选、质控等用途。例如,通过将本发明所述的式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐以及其他待筛选药物等与癌细胞接触,通过比较相关抑制效果获得能够抑制癌细胞的类似药物作为候选药物,进一步通过动物实验、临床试验研究候选药物对癌细胞的治疗效果。
[0735]
本发明还提供一种预防和/或治疗癌症的方法,所述的方法包括步骤:给需要的对象施用如本发明所述的式i化合物,或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐,或如本发明所述的药物组合物,从而预防和/或治疗癌症。
[0736]
在另一优选例中,所述对象为人和非人哺乳动物(啮齿动物、兔、猴、家畜、狗、猫等)。
[0737]
预防和/或治疗肿瘤的方法,
[0738]
本发明还提供一种预防和/或治疗肿瘤的方法,给所需的对象施用本发明所述化合物。
[0739]
在另一优选例中,所述癌症的癌细胞中线粒体氧化磷酸化通路上调和/或线粒体膜通透性转换孔低活性。
[0740]
在另一优选例中,所述对象的肿瘤包括nnmt基因低表达或未表达的肿瘤。
[0741]
在另一优选例中,所述对象的肿瘤包括nnmt基因区dna cpg位点甲基化水平高的肿瘤。
[0742]
在另一优选例中,所述对象为人和非人哺乳动物(啮齿动物、兔、猴、家畜、狗、猫等)。
[0743]
装置或系统
[0744]
本发明还提供一种装置或系统,所述的装置或系统包括:
[0745]
(i)检测模块,所述的检测模块用于检测线粒体氧化磷酸化通路水平、线粒体膜通透性转换孔水平、nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平;
[0746]
(ii)输出模块,所述的输出模块包括输出以下信息:
[0747]
当肿瘤患者的肿瘤细胞中线粒体氧化磷酸化通路上调,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗;
[0748]
在另一优选例中,当肿瘤患者的肿瘤细胞中线粒体膜通透性转换孔低活性,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗;
[0749]
当肿瘤患者的肿瘤细胞中nnmt基因低表达或未表达或nnmt基因区dna cpg位点甲基化水平高,则该肿瘤患者适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗;和/或
[0750]
当肿瘤患者的肿瘤细胞中nnmt基因高表达或nnmt基因区dna cpg位点甲基化水平低,则该肿瘤患者不适合采用本发明第一方面所述的式i化合物、或其光学异构体或其外消旋体、或其溶剂化物、或其药学上可接受的盐进行预防和/或治疗。
[0751]
在另一优选例中,所述线粒体氧化磷酸化通路上调是指某一细胞(如癌细胞)的线粒体氧化磷酸化通路水平或表达e1与正常细胞(同种细胞)中线粒体氧化磷酸化通路水平或表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0752]
在另一优选例中,所述线粒体膜通透性转换孔低活性是指某一细胞(如癌细胞)的线粒体膜通透性转换孔的活性水平或表达水平a1与正常细胞(同种细胞)中线粒体膜通透性转换孔的活性水平或表达水平a0的比值(a1/a0)≤0.8较佳地≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,最佳地≤0.05。
[0753]
在另一优选例中,所述的nnmt基因区dna cpg位点甲基化水平为nnmt基因启动子区dna cpg位点甲基化水平。
[0754]
在另一优选例中,所述的nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平包括肿瘤细胞的nnmt基因表达和/或nnmt基因启动子区dna cpg位点甲基化水平。
[0755]
在另一优选例中,所述的nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平包括肿瘤细胞的nnmt基因表达和/或nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平。
[0756]
在另一优选例中,所述的nnmt基因表达和/或nnmt基因区dna cpg位点甲基化水平包括肿瘤细胞的nnmt基因表达和/或nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平。
[0757]
在另一优选例中,所述的cpg位点甲基化水平高是指相关区域内dna cpg位点甲基化水平≥3%,较佳地≥5%,较佳地≥10%,较佳地≥15%,较佳地≥20%,更佳地≥25%,更佳地≥30%,更佳地≥40%,更佳地≥50%。
[0758]
在另一优选例中,所述的cpg位点甲基化水平低是指相关区域内dna cpg位点甲基化水平≤15%,较佳地≤10%,更佳地≤5%,更佳地≤3%,更佳地≤2%,更佳地≤1%。
[0759]
在另一优选例中,所述nnmt基因高表达或是指某一细胞(如癌细胞)的nnmt基因的表达e1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因的表达e0的比值(e1/e0)≥1.2,较佳地≥1.5,更佳地≥2,更佳地≥3,更佳地≥5。
[0760]
在另一优选例中,所述nnmt基因区dna cpg位点甲基化水平低是指某一细胞(如癌细胞)的nnmt基因区dna cpg位点甲基化水平a1与同一细胞或正常细胞(如癌旁组织细胞)中nnmt基因区dna cpg位点甲基化水平a0的比值(a1/a0)≤0.7,更佳地≤0.6,更佳地≤0.5,更佳地≤0.4,更佳地≤0.3、更佳地≤0.2,更佳地≤0.1,更佳地≤0.05,更佳地≤0.01,更佳地≤0.005,更佳地≤0.001,更佳地≤0.0001,更佳地≤0.00001,更佳地≤0.000001,更佳地≤0.0000001。
[0761]
在另一优选例中,所述的装置包括基因检测仪或蛋白检测仪。
[0762]
在另一优选例中,所述的装置或系统还包括进样模块。
[0763]
在另一优选来了,所述的进样模块用于进肿瘤细胞提取物。
[0764]
在另一优选例中,所述的装置或系统还包括数据处理模块。
[0765]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因区dna cpg位点甲基化水平高低。
[0766]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因启动子区dna cpg位点甲基化水平高低。
[0767]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因转录起始位点前1050bp到基因转录起始位点后500bp区域内dna cpg位点甲基化水平高低。
[0768]
在另一优选例中,所述的数据处理模块处理得到nnmt基因表达高低和/或nnmt基因转录起始位点前1050bp到基因转录起始位点前193bp区域内dna cpg位点甲基化水平高低。
[0769]
组合物或制剂、活性成分的组合和药盒和施用方法
[0770]
本发明还提供一种组合物或制剂、活性成分的组合和药盒,所述的组合物或制剂、活性成分的组合和药盒可用于预防和/或治疗癌症。
[0771]
本发明所述的组合物优选为药物组合物。本发明所述的组合物可以包括药学上可接受的载体。
[0772]
如本文所用“药学上可接受的载体”是指一种或多种相容性固体、半固体、液体或凝胶填料,它们适合于人体或动物使用,而且必须有足够的纯度和足够低的毒性。“相容性”是指药物组合物中的各组分和药物的活性成分以及它们之间相互掺和,而不明显降低药效。
[0773]
应理解,在本发明中,所述的药学上可接受的载体没有特别的限制,可选用本领域常用材料,或用常规方法制得,或从市场购买得到。药学可接受的载体部分例子有纤维素及其衍生物(如甲基纤维素、乙基纤维素、羟丙甲基纤维素、羧甲基纤维素钠等)、明胶、滑石粉、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油、等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如吐温)、润湿剂(如十二烷基硫酸钠)、缓冲剂、螯合剂、增稠剂、ph调节剂、透皮促进剂、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、抑菌剂、无热原水等。
[0774]
在体外研究和体内给药(如瘤内给药),线粒体膜通透性转换孔抑制剂通过降低肿瘤细胞中mptp活跃程度和上调线粒体氧化磷酸化通路,从而增强抗肿瘤药物的治疗效果,因此,抗肿瘤药物和mptp抑制剂能够发挥协同抗肿瘤效果。
[0775]
本发明提供一种含有抗肿瘤药物和mptp抑制剂的活性成分组合、组合物和药盒,用于协同抗肿作用。
[0776]
本发明还提供一种活性成分组合,所述的活性成分组合包括以下组分:
[0777]
(1)第一活性成分,所述的第一活性成分为抗癌症药物;和
[0778]
(2)第二活性成分,所述的第二活性成分为线粒体膜通透性转换孔抑制剂。
[0779]
在另一优选例中,所述的活性成分组合中,至少有一种活性成分是独立的。
[0780]
在另一优选例中,所述的活性成分组合中,第一活性成分和第二活性成分是相互独立的。
[0781]
本发明还提供一种组合物,所述的组合物包括:
[0782]
(1)第一活性成分,所述的第一活性成分为抗癌症药物;和
[0783]
(2)第二活性成分,所述的第二活性成分为线粒体膜通透性转换孔抑制剂。
[0784]
在另一优选例中,所述的药物组合物还包括药学上可接受的载体。
[0785]
在另一优选例中,所述的第一活性成分的含量为0.01-99.99wt%,较佳地0.1-99.9wt%,更佳地1-99wt%,更佳地10-99wt%,最佳地20-99wt%,以组合物活性成分的总重量计。
[0786]
在另一优选例中,所述第二活性成分的含量为0.01-99.99wt%,较佳地0.1-99.9wt%,更佳地1-99wt%,更佳地10-99wt%,最佳地20-99wt%,以组合物活性成分的总重量计。
[0787]
本发明还提供一种药盒,所述药盒包括:
[0788]
(a)含有第一活性成分能的的第一制剂,所述的第一活性成分为抗癌症药物;和
[0789]
(b)含有第二活性成分的第二制剂,所述的第二活性成分为线粒体膜通透性转换孔抑制剂。
[0790]
在另一优选例中,所述的药盒还包括使用说明书。
[0791]
在另一优选例中,所述的第一制剂和第二制剂是相互独立制剂。
[0792]
在另一优选例中,所述的第一制剂和第二制剂是合并制剂。
[0793]
在另一优选例中,所述的使用说明书中注明将所述第一制剂和第二制进行联用,从而用于增强抗癌症药物的抗肿瘤活性。
[0794]
在另一优选例中,所述的联用的方法为先给予含有线粒体膜通透性转换孔抑制剂的第二制剂,再给予抗癌症药物。
[0795]
优选地,在本发明所述的活性成分的组合、组合物和/或药盒中,所述的第一活性成分与所述第二活性成分的摩尔比为0.01-600:1,较佳地0.05-500:1,更佳地0.1-400:1,更佳地0.2-200:1,更佳地0.5-100:1,更佳地0.5-80:1,最佳地1-50:1。
[0796]
在本发明中,组合物和制剂的剂型包括但不限于口服制剂、注射制剂、外用制剂。
[0797]
代表性地,合物和制剂的的剂型包括但不限于:片剂、注射剂、输液剂、膏剂、凝胶剂、溶液剂、微球、膜剂。
[0798]
典型地,所述的注射剂为瘤内注射剂。
[0799]
药物制剂应与给药方式相匹配,优选的给药方式为口服给药、注射给药(如瘤内注射),使用时,是将治疗有效量的药物施用于所需对象(如人或非人哺乳动物)。如本文所用,术语“治疗有效量”,是指对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。本领域的普通技术人员应该理解,所述的“治疗有效量”可随着药物组合物的形式、给药途径、所用药物的辅料、疾病的严重程度以及与其他药物联合用药等情况的不同而有所不同。
[0800]
在一个施用方式中,第一活性成分的安全有效日使用剂量通常至少约0.1mg,而且在大多数情况下不超过约2500mg。较佳地,该剂量是1mg-500mg;第二活性成分的安全有效量通常至少约0.01mg,而且在大多数情况下不超过2500mg。较佳地,该剂量范围是0.1mg至2500mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是在熟练医师技能范围之内的。
[0801]
本发明的主要优点包括:
[0802]
本发明首次开发了新的化合物,其能够高效且安全抑制肿瘤细胞,尤其是对线粒体氧化磷酸化通路上调或mptp低活性的肿瘤细胞具有显著的抑制作用,此外,还尤其对nnmt基因低表达或未表达的肿瘤,和/或nnmt基因区dna cpg位点甲基化水平高的肿瘤具有显著的抑制作用。
[0803]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0804]
实施例1
[0805]
化合物ab24831a的制备
[0806]
步骤1):
[0807][0808]
将化合物1(440mg,2mmol)溶解在干燥的n,n-二甲基甲酰胺(20ml)中,再加入2(428.4mg,4.2mmol),双三苯基膦二氯化钯(42mg,0.06mmol),n,n-二异丙基乙胺(825mg,6.4mmol)和碘化亚铜(19mg,0.1mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物3(130mg)。收率:33%。
[0809]
步骤2):
[0810][0811]
将化合物3(130mg,0.47mmol)溶解在二氧六环(6ml)中,再加入叔丁醇钾(336.6mg,3mmol),然后氮气置换三次,温度升至110℃搅拌16小时。点板检测新点出现,用水(20ml)稀释,然后加入乙酸乙酯(10ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(50mg)。收率:50%。
[0812]
步骤3):
[0813][0814]
将化合物4(100mg,0.67mmol)溶解在乙腈(10ml)中,再加入5(312mg,1.34mmol),然后氮气置换三次,升温至80℃搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过制备纯化得到化合物ab24831a(25.2mg)。收率:8.1%。
[0815]
化合物ab24831a:
[0816]
1h nmr(400mhz,dmso-d6)δ13.53(s,1h),9.06(s,1h),8.24(d,j=7.1hz,1h),8.14(d,j=6.5hz,1h),8.08(d,j=7.4hz,4h),7.74(d,j=7.6hz,2h),7.64
–
7.55(m,3h),7.48(s,1h),6.36(s,2h).
[0817]
ms-esi:理论值[m-cf3coo]
+
347.82,实测值:347.25。
[0818]
实施例2
[0819]
化合物ab24828a的制备
[0820]
步骤1):
[0821][0822]
将化合物1(140mg,0.66mmol)溶解在干燥的n-n-二甲基甲酰胺(10ml)中,再加入2(161.4mg,1.39mmol),双三苯基膦二氯化钯(14mg,0.02mmol),n,n-二异丙基乙胺(272mg,2.11mmol)和碘化亚铜(5.7mg,0.03mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物3(100mg)。收率:75.7%。
[0823]
步骤2):
[0824][0825]
将化合物3(100mg,0.47mmol)溶解在二氧六环(30ml)中,再加入叔丁醇钾(160mg,1.43mmol),然后氮气置换三次,温度升至110℃搅拌1小时。点板检测新点出现,用水(20ml)稀释,然后加入乙酸乙酯(10ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(50mg)。收率:50%。
[0826]
步骤3):
[0827][0828]
将化合物4(50mg,0.67mmol)溶解在乙腈(10ml)中,再加入5(312mg,1.34mmol),然后氮气置换三次,升温至80℃搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通过制备纯化得到化合物ab24828a(34.7mg)。收率:10.9%。
[0829]
化合物ab24828a:
[0830]1h nmr(400mhz,dmso-d6)δ13.15(s,1h),9.02(s,1h),8.21(d,j=6.1hz,1h),8.07(d,j=8.4hz,3h),7.74(d,j=7.0hz,2h),7.31(d,j=29.2hz,5h),6.74(s,1h),6.33(s,2h),4.33(s,2h).
[0831]
ms-esi:理论值[m-cf3coo]
+
361.84,实测值361.25。
[0832]
实施例3
[0833]
化合物ab24861的制备
[0834]
步骤:
[0835][0836]
将化合物1(100mg,0.48mmol)和2(123g,0.577mmol)溶解在乙腈(10ml)中。在室温下搅拌4小时。点板检测产生新点,将反应液直接过滤并用乙腈洗涤滤饼得到化合物ab24861(110.0mg)。收率:67.2%。
[0837]
化合物ab24861:
[0838]1h nmr(400mhz,dmso-d6)δ12.96(s,1h),9.15(s,1h),8.27(s,1h),8.22(s,1h),8.11(s,1h),8.04(d,j=7.4hz,1h),7.56(d,j=7.1hz,1h),7.47(d,j=7.8hz,1h),7.39(d,j=6.5hz,1h),7.29(d,j=12.7hz,4h),7.17(s,1h),6.27(s,2h),4.18(s,2h),2.43(s,3h).
[0839]
ms-esi:理论值[m-br]
+
341.43,实测值341.30。
[0840]
实施例4
[0841]
化合物ab24859的制备
[0842]
步骤1):
[0843][0844]
将化合物1(2.0g,15.5mmol),2(5.6g,46.6mmol),双(二亚芐基丙酮)钯(771.0mg,0.5mmol),四氟硼酸三叔丁基膦(451.0mg,1mmol)和三乙烯二胺(5.24g,30mmol)溶解在n,n-二甲基乙酰胺(50ml)中。然后氮气置换三次,120℃搅拌16小时后,点板检测反应产生新点,然后冷却到室温,加入水和乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=66.6%)得到化合物3(70mg)。收率:2.16%。
[0845]
步骤2):
[0846][0847]
将化合物3(97mg,0.5mmol)和4(244g,1mmol)溶解在乙腈(10ml)中。在室温下搅拌16小时。点板检测产生新点,将反应液直接过滤并用乙腈洗涤滤饼得到化合物ab24859(89mg)。收率:52.1%。
[0848]
化合物ab24859:
[0849]1h nmr(400mhz,dmso-d6)δ12.98(s,1h),9.17(s,1h),8.28
–
8.21(m,2h),8.09(d,j=6.6hz,1h),7.94(d,j=7.7hz,2h),7.43(d,j=7.8hz,2h),7.34
–
7.24(m,4h),7.18(d,j=7.2hz,1h),6.36(s,2h),2.41(s,3h).
[0850]
ms-esi:理论值[m-br]
+
341.43,实测值341.30。
[0851]
实施例5
[0852]
化合物ab24835a的制备
[0853]
步骤1):
[0854][0855]
将化合物1(1.28g,10mmol),2(4.02g,30mmol),双(二亚芐基丙酮)钯(457.5mg,0.5mmol),四氟硼酸三叔丁基膦(290.13mg,1mmol)和三乙烯二胺(3.36g,30mmol)溶解在n,n-二甲基乙酰胺(50ml)中。然后氮气置换三次,120℃搅拌16小时后,点板检测反应产生新点,然后冷却到室温,加入水和乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:
石油醚=66.6%)得到化合物3(1.1g)。收率:52.88%。ms-esi:理论值[m+1]
+
208.26,实测值:209.30。
[0856]
步骤2):
[0857][0858]
将化合物3(208mg,1mmol)和4(233.5mg,1mmol)溶解在乙腈(10ml)中。在80℃下搅拌3小时。点板检测产生新点,然后冷却到室温,将反应液直接过滤并用乙酸乙酯洗涤滤饼得到化合物ab24835a(150mg)。收率:41.55%。
[0859]
化合物ab24835a:
[0860]1h nmr(400mhz,dmso-d6)δ12.98(s,1h),9.14(s,1h),8.30
–
8.19(m,2h),8.08(dd,j=22.2,7.3hz,3h),7.72(d,j=7.9hz,2h),7.29(dt,j=14.9,7.5hz,4h),7.18(d,j=7.0hz,1h),6.35(s,2h),4.18(s,2h).
[0861]
ms-esi:理论值[m-br]
+
361.84,实测值361.30。
[0862]
实施例6
[0863]
化合物ab24863的制备
[0864]
步骤1):
[0865][0866]
将化合物1(3.86g,30mmol)溶解在n,n-二甲基乙酰胺(250ml)中,再加入化合物2(12.1g,90mmol),然后加入三乙烯二胺(10.1g,90mmol),再加入四氟硼酸三叔丁基膦(870mg,3mmol),最后加入双(二亚芐基丙酮)钯(1.37g,1.5mmol),然后氮气置换三次,升温至120℃搅拌2小时过夜。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.0g)。收率:32%。
[0867]
步骤2):
[0868]
[0869]
将化合物3(100mg,0.5mmol)溶解在乙腈(10ml)中,再加入化合物4(244mg,1mmol),然后氮气置换三次,升温至80℃搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=10:1)得到化合物ab24863(140mg)。收率:59.8%。
[0870]
化合物ab24863:
[0871]1h nmr(400mhz,dmso-d6)δ13.01(s,1h),9.16(s,1h),8.46(d,j=7.9hz,2h),8.26(dd,j=16.4,8.2hz,4h),8.14(d,j=6.9hz,1h),7.31(dd,j=20.1,7.4hz,4h),7.20(d,j=7.3hz,1h),6.43(s,2h),4.20(s,2h).
[0872]
ms-esi:理论值[m-br]
+
388.40,实测值388.25。
[0873]
实施例7
[0874]
化合物ab24878的制备
[0875]
步骤1):
[0876][0877]
将化合物1(2.7g,23mmol)和2(2.5g,19mmol)溶解在n,n-二甲基乙酰胺(30ml)中,在加入三乙烯二胺(6.5g,58mmol)、双(二亚芐基丙酮)钯(890mg,0.97mmol)、四氟硼酸三叔丁基膦(561mg,1.94mmol),在封管下120℃搅拌16小时。点板检测产生新点,用水和乙酸乙酯(60ml)萃取,有机相减压浓缩得到残余物,残余物经柱层析(甲醇:二氯甲烷=5%)纯化得到化合物3(800mg)。收率:17.9%。
[0878]
步骤2):
[0879][0880]
将化合物3(92mg,0.5mmol)和4(244g,1mmol)溶解在乙腈(10ml)中。在室温下搅拌16小时。点板检测产生新点,将反应液直接过滤并用乙腈洗涤滤饼得到化合物ab24878(116.2mg)。收率:53.02%。
[0881]
化合物ab24878:
[0882]1h nmr(400mhz,dmso-d6)δ9.28(s,1h),8.77(d,j=11.6hz,2h),8.59(d,j=8.2hz,1h),8.48(s,2h),8.37(d,j=6.3hz,1h),7.96(t,j=7.8hz,1h),7.80(d,j=7.2hz,2h),7.52(t,j=7.2hz,2h),7.38(d,j=7.1hz,1h),6.53(s,2h).
[0883]
ms-esi:理论值[m-br]
+
358.37,实测值358.30。
[0884]
实施例8
[0885]
化合物ab24872的制备
[0886]
步骤1):
[0887][0888]
将化合物1(500mg,3.6mmol)溶解在二氯甲烷(20ml)中,冰浴下加入戴斯马丁氧化剂(2.02g,4.7mmol),在室温下搅拌2小时。点板检测产生新点。滤液减压浓缩减压除去有机溶剂通过柱层析(乙酸乙酯:石油醚=0-10%)得到化合物2(340mg)。收率:69.1%。
[0889]
步骤2):
[0890][0891]
将化合物2(340mg,2.67mmol),3(286mg,2.22mmol),双(二亚芐基丙酮)钯(102mg,0.11mmol),四氟硼酸三叔丁基膦(64mg,0.22mmol)和三乙烯二胺(750mg,6.68mmol)溶解在n,n-二甲基乙酰胺(50ml)中。然后氮气置换三次,120℃搅拌16小时后,点板检测反应产生新点,然后冷却到室温,加入水和乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=66.6%)得到化合物4(200mg)。收率:37.9%。
[0892]
步骤3):
[0893][0894]
将化合物4(200mg,0.96mmol)和化合物5(245mg,1.15mmol)溶解在乙腈(10ml)中。氮气置换三次,在室温下搅拌5小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24872(92.6mg)。收率:28.3%。
[0895]
化合物ab24872:
[0896]1h nmr(400mhz,cd3od)δ10.11(s,1h),9.54(s,1h),9.20(dd,j=39.1,6.4hz,2h),8.78(d,j=7.5hz,2h),8.46
–
8.36(m,2h),8.22(dd,j=29.1,7.7hz,3h),7.98(d,j=6.7hz,1h),7.24(s,2h),3.22(d,j=11.7hz,6h).
[0897]
ms-esi:理论值[m-br]
+
341.43,实测值341.25。
[0898]
实施例9
[0899]
化合物ab24854的制备
[0900]
步骤1):
[0901][0902]
将化合物1(8g,47.1mmol)溶解在四氢呋喃(80ml)中,冰浴下滴加2.5n的氢化铝锂的四氢呋喃溶液(56ml,141.2mmol),室温搅拌30分钟,然后升温75℃回流过夜。点板检测产生新点。然后冷却到室温,冰水浴下滴加水(56ml),再滴加15%氢氧化钠水溶液(56ml),再加入水(158ml),垫硅藻土过滤掉铝盐,加入乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂得到化合物2(5.6g)。收率:75.76%。
[0903]
步骤2):
[0904][0905]
将化合物2(3g,17.64mmol)溶解在二氯甲烷(50ml)中,冰浴下加入戴斯马丁氧化剂(8.97g,21.18mmol),室温搅拌1小时,点板检测产生新点。然后加入二氯甲烷(50ml),垫硅藻土过滤,滤液减压浓缩减压除去有机溶剂通过柱层析(乙酸乙酯:石油醚=0-10%)得到化合物3(2.4g)。收率:80.9%。
[0906]
步骤3):
[0907][0908]
将化合物3-1(1.67g,12.99mmol)和3(2.4g,14.29mmol)溶解在n,n-二甲基乙酰胺(30ml)中,在加入三乙烯二胺(4.37g,38.97mmol)、双(二亚芐基丙酮)钯(595mg,0.65mmol)、四氟硼酸三叔丁基膦(377mg,1.31mmol),在120℃下搅拌16小时。点板检测产生新点,用水和乙酸乙酯(10ml)萃取,有机相减压浓缩得到残余物,残余物经柱层析(甲醇:二氯甲烷=10%)纯化得到化合物4(1.2g)(50%粗品)。
[0909]
步骤4):
[0910][0911]
将化合物4(500mg,2.06mmol)溶解在乙腈(5ml)中,然后加入化合物5(660mg,3.09mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,粗品送制备得到化合物ab24854(20mg)。收率:2.59%。
[0912]
化合物ab24854:
[0913]1h nmr(400mhz,cd3od)δ9.02(s,1h),8.09(s,2h),7.97(dd,j=13.7,7.1hz,3h),7.42(d,j=8.0hz,2h),7.32
–
7.19(m,4h),6.27(s,2h),4.25(s,2h),2.45(s,3h).
[0914]
ms-esi:理论值[m-cf3coo]
+
375.12,实测值375.20。
[0915]
实施例10
[0916]
化合物ab24945的制备
[0917]
步骤1):
[0918][0919]
将化合物1(200mg,1.69mmol)溶解在n’n-二甲基甲酰胺(20ml)中,冰浴下加入氢化钠(203mg,5.07mmol),冰浴下搅拌30分钟,再加入化合物2(289mg,1.86mmol),室温下搅拌3小时。点板监测反应有新点,加入水(10ml)和乙酸乙酯(10ml)萃取,乙酸乙酯萃取三次,合并有机相。有机相用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,通过柱层析纯化(乙酸乙酯:石油醚=0-10%)得到化合物3(260mg)。收率:73.8%。
[0920]
步骤2):
[0921][0922]
将化合物3(130mg,0.625mmol)溶解在乙腈(10ml)中,再加入4(200mg,0.94mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤得到化合物ab24945(70mg)。收率:32.8%。
[0923]
化合物ab24945:
[0924]1h nmr(400mhz,cdcl3)δ10.96(s,1h),8.05(d,j=7.4hz,2h),7.87(s,2h),7.78
(s,1h),7.42(s,2h),7.36
–
7.28(m,5h),6.81(d,j=11.9hz,3h),5.70(s,2h),2.41(s,3h).
[0925]
ms-esi:理论值[m-br]
+
341.43,实测值341.10。
[0926]
实施例11
[0927]
化合物ab24837的制备
[0928]
步骤1):
[0929][0930]
将化合物1(440mg,2mmol)溶解在干燥的nn-二甲基甲酰胺(20ml)中,再加入2(428.4mg,4.2mmol),双三苯基膦二氯化钯(42mg,0.06mmol),n,n-二异丙基乙胺(825mg,6.4mmol)和碘化亚铜(19mg,0.1mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物3(130mg)。收率:33%。
[0931]
步骤2):
[0932][0933]
将化合物3(130mg,0.47mmol)溶解在二氧六环(6ml)中,再加入叔丁醇钾(336.6mg,3mmol),然后氮气置换三次,温度升至110℃搅拌16小时。点板检测新点出现,用水(20ml)稀释,然后加入乙酸乙酯(10ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(50mg)。收率:50%。
[0934]
步骤3):
[0935][0936]
将化合物4(340mg,1.75mmol)溶解在醋酸(5ml)中,再加入钯碳(100mg,3mmol),然后氢气置换三次,温度为室温搅拌12小时。点板检测新点出现,过滤旋干,送制备得到化合物5(50mg)。收率:50%
[0937]
步骤4):
[0938][0939]
将化合物6(50mg,0.26mmol)溶解在乙腈(10ml)中,再加入化合物7(182mg,0.78mmol),然后氮气置换三次,升温至80℃搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30mlx3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过制备纯化得到化合物ab24837(30mg)。收率:33.71%。
[0940]
化合物ab24837:
[0941]1h nmr(400mhz,dmso-d6)δ9.40(s,1h),8.05(d,j=6.6hz,1h),8.00(d,j=8.0hz,2h),7.93(s,1h),7.69(d,j=7.9hz,2h),7.38(d,j=6.5hz,2h),7.32(d,j=6.5hz,3h),6.82(d,j=6.5hz,1h),5.87(s,2h),5.36(d,j=8.9hz,1h),3.74
–
3.65(m,1h),2.99(s,1h).
[0942]
ms-esi:理论值[m-cf3coo]
+
349.84,实测值349.00。
[0943]
实施例12
[0944]
化合物ab24827a的制备
[0945]
步骤1):
[0946][0947]
将化合物1(440mg,2mmol)溶解在n,n-二甲基甲酰胺(20ml)中,再加入化合物2(486mg,4.2mmol),再加入碘化亚铜(19mg,0.1mmol),再加入n,n-二异丙基乙胺(824mg,6.4mmol),最后加入双三苯基膦二氯化钯(42mg,0.06mmol),然后氮气置换三次,常温搅拌16小时。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(50mlx3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通薄层层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(332mg)。收率:79.8%。
[0948]
步骤2):
[0949][0950]
将化合物3(332mg,1.6mmol)溶解在1,4-二氧六环(10ml)中,再加入叔丁醇钾(538mg,4.8mmol),然后氮气置换三次,升温至100℃搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通薄层层析纯化(甲醇:二氯甲烷=10:1)得到化合物4(189mg)。
收率:56.7%。
[0951]
步骤三)
[0952][0953]
将化合物4(189mg,0.9mmol)溶解在乙腈(10ml)中,加入化合物5(233mg,1.1mmol)然后氮气置换三次,升温至80℃搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通薄层层析纯化(甲醇:二氯甲烷=10:1)得到化合物ab24827a。收率9.3%。
[0954]
化合物ab24827a:
[0955]1h nmr(400mhz,dmso-d6)δ13.00(s,1h),9.08(s,1h),8.33(d,j=6.5hz,1h),8.05(d,j=8.5hz,2h),7.93(d,j=6.8hz,1h),7.72(d,j=8.3hz,2h),7.28(d,j=28.2hz,5h),6.80(s,1h),6.32(s,2h),4.23(s,2h).
[0956]
ms-esi:理论值[m-cf3coo]
+
361.84,实测值361.25。
[0957]
实施例13
[0958]
化合物ab24887的制备
[0959]
步骤1):
[0960][0961]
将化合物1(200mg,1.69mmol)溶解在n,n-二甲基甲酰胺(20ml)中,冰浴下加入nah(203mg,5.07mmol),在0℃下搅拌30分钟。再缓慢加入化合物2(318mg,1.86mmol)在室温下搅拌3小时,点板检测产生新点,加入水(30ml)和乙酸乙酯(30mlx3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物3(280mg)。收率:79.5%。
[0962]
步骤2):
[0963]
[0964]
将化合物3(280m g,1.3mmol)溶解在乙腈(5ml)中,然后加入化合物4(430mg,2.0mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物ab24887(220mg)。收率:47.9%。
[0965]
化合物ab24887:
[0966]1h nmr(400mhz,dmso,d6)δ9.28(s,1h),8.47(s,1h),8.32(s,1h),8.15(s,1h),7.95(d,j=7.6hz,2h),7.44(d,j=7.7hz,2h),7.34(s,5h),7.17(s,1h),6.37(s,2h),5.66(s,2h),2.41(s,3h).
[0967]
ms-esi:理论值[m-br]
+
341.43,实测值341.25。
[0968]
实施例14
[0969]
化合物ab24888的制备
[0970]
步骤1):
[0971][0972]
将化合物1(200mg,1.69mmol)溶解在n,n-二甲基甲酰胺(20ml)中,冰浴下加入nah(203mg,5.07mmol),在0℃下搅拌30分钟。再缓慢加入化合物2(318mg,1.86mmol)在室温下搅拌3小时,点板检测产生新点,加入水(30ml)和乙酸乙酯(30ml x3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物3(280mg)。收率:79.5%
[0973]
步骤2):
[0974][0975]
将化合物3(250m g,1.2mmol)溶解在乙腈(5ml)中,然后加入化合物4(440mg,1.8mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤,滤饼用乙腈(3ml)洗涤三次,旋干得到化合物ab24888(300mg)。收率:67.1%。
[0976]
化合物ab24888:
[0977]1h nmr(400mhz,dmso,d6)δ9.26(s,1h),8.73(s,1h),8.58(d,j=8.1hz,1h),8.46(t,j=7.4hz,2h),8.35(d,j=6.8hz,1h),8.16(s,1h),7.94(t,j=7.9hz,1h),7.33(s,5h),7.19(s,1h),6.47(s,2h),5.66(s,2h).
[0978]
ms-esi:理论值[m-br]
+
372.40,实测值372.25。
[0979]
实施例15
[0980]
化合物ab24895的制备
[0981]
步骤1):
[0982][0983]
将化合物1(500mg,4.23mmol),碘苯(963mg,4.23mmol),碘化亚铜(16.2mg,0.085mmol),磷酸钾(1.79g,8.46mmol)和环己二胺(99mg,0.87mmol)溶解在n,n-二甲基乙酰胺(20ml)中。氮气置换三次,升温至110℃搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物3(580mg)。
[0984]
步骤2):
[0985][0986]
将化合物3(290mg,1.49mmol)和化合物4(477mg,2.24mmol)溶解在乙腈(10ml)中。氮气置换三次,在室温下搅拌3小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24895(377mg)。收率:77.3%。
[0987]
化合物ab24895:
[0988]1h nmr(400mhz,dmso-d6)δ9.45(s,1h),8.56(d,j=5.9hz,1h),8.31(s,1h),8.14(d,j=6.5hz,1h),7.96(d,j=7.3hz,2h),7.70(dd,j=22.8,7.0hz,4h),7.57(d,j=6.7hz,1h),7.43(d,j=7.3hz,2h),7.36(s,1h),6.50(s,2h),2.40(s,3h).
[0989]
ms-esi:理论值[m-br]
+
327.41,实测值327.20。
[0990]
实施例16
[0991]
化合物ab24833a的制备
[0992]
步骤1):
[0993][0994]
将化合物1(2.0g,15.5mmol),2(5.6g,46.6mmol),双(二亚芐基丙酮)钯(771.0mg,0.5mmol),四氟硼酸三叔丁基膦(451.0mg,1mmol)和三乙烯二胺(5.24g,30mmol)溶解在n,n-二甲基乙酰胺(50ml)中。然后氮气置换三次,120℃搅拌16小时后,点板检测反应产生新点,然后冷却到室温,加入水和乙酸乙酯(100ml x3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:
石油醚=66.6%)得到化合物3(70mg)。收率:2.16%。
[0995]
步骤2):
[0996][0997]
将化合物3(70mg,0.336mmol)和4(157mg,0.673mmol)溶解在乙腈(10ml)中。在80℃下搅拌3小时。点板检测产生新点,然后冷却到室温,将反应液直接过滤并用乙酸乙酯洗涤滤饼得到化合物ab24833a(40mg)。收率:32.8%。
[0998]
化合物ab24833a:
[0999]1h nmr(399mhz,dmso-d6)δ12.76(s,1h),9.26(s,1h),8.36(d,j=7.0hz,1h),8.06(s,2h),8.02(d,j=7.2hz,1h),7.82(s,1h),7.75(s,2h),7.29(d,j=7.8hz,4h),7.18(s,1h),6.33(s,2h),4.14(s,2h).
[1000]
ms-esi:理论值[m-cf3coo]
+
361.85,实测值361.25。
[1001]
实施例17
[1002]
化合物ab24916的制备
[1003]
步骤1):
[1004][1005]
将化合物1(480mg,3.0mmol)溶解在醋酸(7ml)中,混合液中加入液溴(480mg,3.0mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30mlx3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物2(400mg)。收率:55.8%。
[1006]
步骤2):
[1007][1008]
将化合物2(150mg,0.63mmol)溶解在乙腈(10ml)中,再加入3(150mg,0.82mmol),
然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤,滤饼用乙腈(2ml)洗涤三次,旋干得到化合物ab24916(50mg)。收率:23.1%。
[1009]
化合物ab24916:
[1010]1h nmr(400mhz,dmso-d6)δ9.55(s,1h),8.26(d,j=7.0hz,1h),8.15(d,j=7.1hz,1h),7.69(s,1h),7.47(d,j=7.6hz,1h),7.35(dd,j=20.0,5.6hz,6h),7.07(d,j=7.0hz,1h),6.98(d,j=6.7hz,1h),5.69(d,j=10.6hz,1h),4.57(d,j=5.5hz,2h),3.21(d,j=12.6hz,1h),3.11(d,j=16.3hz,1h),2.75(d,j=10.4hz,1h),2.46
–
2.41(m,1h),2.32(s,3h).
[1011]
ms-esi:理论值[m-br]
+
343.44,实测值343.10。
[1012]
实施例18
[1013]
化合物ab24913的制备
[1014]
步骤1):
[1015][1016]
将化合物1(500mg,2.77mmol)溶解在醋酸(7ml)中,混合液中加入液溴(443mg,2.77mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30mlx3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物2(200mg)。收率:27.8%。
[1017]
步骤2):
[1018][1019]
将化合物3(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物4(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物5(2.6g)。收率:26.8%。
[1020]
步骤3):
[1021][1022]
将化合物2(200mg,0.77mmol)溶解在乙腈(10ml)中,再加入5(212mg,1.12mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤,滤饼用乙腈(2ml)洗涤三次,旋干得到化合物ab24913(50mg)。收率:17.5%。
[1023]
化合物ab24913:
[1024]1h nmr(400mhz,dmso,d6)δ9.34(s,1h),8.22(s,1h),8.12(d,j=6.5hz,1h),7.82(s,1h),7.72(d,j=8.0hz,1h),7.50(d,j=7.9hz,1h),7.34(d,j=25.3hz,5h),7.01(d,j=6.4hz,2h),5.68(d,j=14.0hz,1h),4.57(d,j=5.3hz,2h),3.19(t,j=17.3hz,3h),2.77(d,j=9.0hz,1h)。
[1025]
ms-esi:理论值[m-br-]
+
363.86,实测值363.30。
[1026]
实施例19
[1027]
化合物ab24841a的制备
[1028]
步骤1):
[1029][1030]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1031]
步骤2):
[1032][1033]
将化合物4(500mg,2.7mmol)溶解在醋酸(50ml)中,混合液中加入液溴(442mg,2.7mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物5(700mg)。收率:97.3%。
[1034]
步骤3):
[1035][1036]
将化合物5(400mg,1.5mmol)和化合物3(200mg,1.1mmol)溶解在乙腈(10ml)中。氮气置换三次,在室温下搅拌5小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24841a(37mg)。收率:9.3%。
[1037]
化合物ab24841a:
[1038]1h nmr(400mhz,cdcl3)δ9.96(s,1h),7.90
–
7.52(m,3h),7.25(s,8h),6.50(s,1h),5.50(s,1h),4.43(s,2h),3.34(s,1h),3.05(s,1h),2.50(d,j=38.1hz,2h).
[1039]
ms-esi:理论值[m-cf3coo]
+
363.86,实测值363.25。
[1040]
实施例20
[1041]
化合物ab24920的制备
[1042]
步骤1):
[1043][1044]
将化合物1(500mg,2.6mmol)溶解在四氢呋喃(10ml)中。0℃下加入液溴(418mg,2.6mmol),在0℃条件下搅拌2小时。点板检测产生新点,用2m碳酸氢钠水溶液(40ml)和乙酸乙酯(40ml)稀释,有机相旋干得到化合物2(400mg,crude)。
[1045]
步骤2):
[1046][1047]
将化合物2(200mg,0.70mmol),化合物3(130mg,0.70mmol)溶解在乙腈(10ml)中。在室温下搅拌4小时。点板检测产生新点,反应液旋干经层析柱(dcm:meoh=10:1)得到化合物ab24920(41mg)。收率:14.8%。
[1048]
化合物ab24920:
[1049]1h nmr(400mhz,dmso,d6)δ=9.44(s,1h),8.54(s,1h),8.46(d,j=8.1,1h),8.26(d,j=6.5,1h),8.14(d,j=6.0,1h),7.76(d,j=8.3,1h),7.37(s,4h),7.31(s,1h),7.04(s,2h),5.79(d,j=12.9,1h),5.73(s,1h),4.58(d,j=4.9,2h),2.83(s,1h),2.51(s,1h).
[1050]
ms-esi:理论值[m-br]
+
374.41,实测值374.30。
[1051]
实施例21
[1052]
化合物ab24923的制备
[1053]
步骤1):
[1054][1055]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1056]
步骤2):
[1057][1058]
将化合物4(300mg,2.03mmol)溶解在醋酸(10ml)中,混合液中加入液溴(326mg,2.03mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物5(400mg)。收率:86.7%。
[1059]
步骤3):
[1060][1061]
将化合物5(200mg,0.88mmol)溶解在乙腈(10ml)中,再加入3(109mg,0.59mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,旋干制备得到化合物ab24923(25mg)。收率:8.6%。
[1062]
化合物ab24923:
[1063]1h nmr(400mhz,cd3od)δ8.68(s,1h),8.14(d,j=6.6hz,1h),8.06(t,j=6.7hz,3h),7.71(s,1h),7.37(s,7h),7.31(d,j=3.5hz,1h),6.97(dd,j=26.9,6.0hz,3h),4.93
–
4.91(m,2h),4.60(s,2h),3.44(d,j=13.3hz,1h),2.85(t,j=9.2hz,1h),2.64(d,j=10.5hz,1h).
[1064]
ms-esi:理论值[m-cf3coo-]
+
330.40,实测值330.30。
[1065]
实施例22
[1066]
化合物ab24840a的制备
[1067]
步骤1):
[1068][1069]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1070]
步骤2):
[1071][1072]
将化合物4(500mg,3.0mmol)溶解在醋酸(50ml)中,混合液中加入液溴(480mg,3.0mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂得到化合物5(600mg)。收率:38.46%。
[1073]
步骤3):
[1074][1075]
将化合物5(300mg,1.2mmol)和化合物3(200mg,1.1mmol)溶解在乙腈(10ml)中。氮
气置换三次,在室温下搅拌5小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24840a(27.6mg)。收率:7.2%。
[1076]
化合物ab24840a:
[1077]1h nmr(400mhz,dmso,d6)δ9.38(s,1h),8.31(d,j=7.1hz,1h),8.16(d,j=7.0hz,1h),7.84
–
7.75(m,2h),7.60(d,j=8.1hz,1h),7.34(dd,j=23.4,6.5hz,5h),6.99(d,j=6.6hz,2h),5.62(t,j=6.7hz,1h),4.58(d,j=5.4hz,2h),3.85(dd,j=17.3,8.2hz,1h),3.45(s,1h).
[1078]
ms-esi:理论值[m-cf3coo]
+
349.84,实测值349.20。
[1079]
实施例23
[1080]
化合物ab24904的制备
[1081]
步骤1):
[1082][1083]
将化合物1(146mg,1.0mmol)溶解在醋酸(5ml)中,混合液中加入液溴(160mg,1.0mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30mlx3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物2(180mg)。收率:97.3%。
[1084]
步骤2):
[1085][1086]
将化合物2(180mg,0.79mmol)溶解在乙腈(10ml)中,再加入3(161mg,0.87mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤,滤饼用乙腈(2ml)洗涤三次,旋干得到化合物ab24904(40mg)。收率:15.4%。
[1087]
化合物ab24904:
[1088]1h nmr(400mhz,dmso-d6)δ9.76(s,1h),8.34(d,j=6.1hz,1h),8.20(d,j=6.0hz,1h),7.64(d,j=6.7hz,1h),7.45(d,j=6.7hz,1h),7.37(s,4h),7.30(d,j=5.3hz,2h),7.11(s,1h),6.97(s,1h),5.67(s,1h),4.57(s,2h),3.77(dd,j=16.2,8.1hz,1h),2.53(s,3h),2.48(s,1h).
[1089]
ms-esi:理论值[m-br]
+
329.42,实测值329.50。
[1090]
实施例24
[1091]
化合物ab24905的制备
[1092]
步骤1):
[1093][1094]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1095]
步骤2):
[1096][1097]
将化合物4(300mg,2.05mmol)溶解在醋酸(10ml)中,混合液中加入液溴(328mg,2.05mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-20%)得到化合物5(300mg)。收率:65%。
[1098]
步骤3):
[1099][1100]
将化合物5(200mg,0.89mmol)溶解在乙腈(10ml)中,再加入3(110mg,0.60mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24905(110mg)。收率:56%。
[1101]
化合物ab24905:
[1102]1h nmr(400mhz,dmso-d6)δ9.43(s,1h),8.30(d,j=6.9hz,1h),8.15(d,j=6.8hz,1h),7.63(d,j=7.6hz,1h),7.55(d,j=8.9hz,2h),7.36(s,4h),7.30(d,j=5.6hz,
1h),6.99(t,j=8.0hz,2h),5.62(s,1h),4.57(d,j=5.5hz,2h),3.78(dd,j=16.7,8.4hz,1h),3.37(s,1h),2.38(s,3h).
[1103]
ms-esi:理论值[m-br]
+
329.41,实测值329.25。
[1104]
实施例25
[1105]
化合物ab24883的制备
[1106]
步骤1):
[1107][1108]
将化合物1(1.06g,10mmol)溶解在乙醇(50ml)中,再加入化合物2(1.37g,10mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(1.13g,30mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(20ml)稀释,然后加入乙酸乙酯(20ml x 3)萃取,有机相合并后,饱和食盐水(20ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(600mg)。收率:26.4%。
[1109]
步骤2):
[1110][1111]
将化合物3(50mg,0.22mmol)溶解在n’n-二甲基甲酰胺(5ml)中,再加入2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(125.55mg,0.33mmol)、n’n-二异丙基乙胺(85.2mg,0.66mmol)和化合物4(25.9mg,0.24mmol),然后氮气置换三次,室温搅拌过夜。点板监测产生新点,用水(10ml)和乙酸乙酯(10ml)萃取,乙酸乙酯萃取三次,合并有机相,有机相用饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24883(27.9mg)。收率:36.7%。
[1112]
化合物ab24883
[1113]1h nmr(400mhz,dmso,d6)δ8.79(s,1h),8.70(d,j=8.2hz,1h),7.94(d,j=8.4hz,2h),7.77(s,1h),7.62(s,1h),7.36(s,4h),7.26(s,1h),6.78(d,j=8.1hz,2h),4.43(d,j=5.0hz,2h).
[1114]
ms-esi:理论值[m+1]
+
348.30,实测值348.20。
[1115]
实施例26
[1116]
化合物ab24851的制备
[1117]
步骤1):
[1118][1119]
将化合物1(3.0g,18.3mmol)溶解在甲苯(50ml)中,再加入化合物2(5.8g,54.8mmol),碳酸铯(12.0g,36.5mmol),三-(二亚苯-base丙酮)二钯(334mg,0.36mmol),2-二环己基磷-2,4,6-三异丙基联苯(262mg,0.54mmol),然后氮气置换三次,升温至110℃搅拌16小时。点板检测新点出现,将反应温度降至室温,用水(50ml)稀释,然后加入乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(150mg)。收率:4.4%。
[1120]
步骤2):
[1121][1122]
将化合物3(150m g,0.78mmol)溶解在乙腈(5ml)中,然后加入化合物4(151m g,0.71mmol),然后氮气置换三次,加热80℃搅拌过夜。点板检测新点出现,然后冷却到室温,将反应液旋干送制备得到化合物ab24851(10mg)。收率:3.9%。
[1123]
化合物ab24851:
[1124]1h nmr(400mhz,cd3od)δ7.93(d,j=7.8hz,2h),7.34(dd,j=47.3,19.8hz,9h),4.58(s,2h),4.37(s,2h),2.45(s,3h).
[1125]
ms-esi:理论值[m-cf3coo]
+
323.43,实测值323.20。
[1126]
实施例27
[1127]
化合物ab24850的制备
[1128]
步骤1):
[1129][1130]
将化合物1(2g,5.91mmol),2(2.51g,7.09mmol)和甲醇钠(958mg,17.73mmol)溶解
在无水乙醇(30ml)中,室温下搅拌16小时。点板检测产生新点,然后冷却到室温,加入水(50ml)和乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析(乙酸乙酯:石油醚=0-30%)得到化合物3(2.1g),收率:86.24%。。
[1131]
步骤2):
[1132][1133]
将化合物3(1.2g,2.91mmol),溶解在四氢呋喃(6ml)和水(6ml)中,再加入浓盐酸(3ml),在100℃下搅拌3小时。点板检测产生新点,然后冷却到室温,加入饱和碳酸氢钠水溶液调碱,用乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物4(500mg),收率:83.21%。
[1134]
步骤3):
[1135][1136]
将化合物4(200m g,1.17mmol)和化合物5(249mg,1.17mmol),溶解在乙腈(10ml),再加入三乙胺(356mg,3.51mmol)),在80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,将反应液旋干送制备得到ab24850(40mg)。收率:11.32%。
[1137]
化合物ab24850:
[1138]1h nmr(400mhz,cd3od)δ8.83(s,0h),7.93(d,j=7.4hz,1h),7.43
–
7.27(m,2h),7.22(s,0h),6.99(s,0h),6.48(s,0h),5.84(s,1h),2.44(s,3h).
[1139]
ms-esi:理论值[m+1]
+
303.14,实测值:303.00。
[1140]
实施例28
[1141]
化合物ab24885的制备
[1142]
步骤1):
[1143][1144]
将化合物1(519mg,3mmol)溶解在四氢呋喃(30ml)中,再加入化合物2(481mg,4.5mmol),再加入甲烷磺酸(2-二环己基膦)-3,6-二甲氧基-2',4',6'-三异丙基-1,1'-联苯)(2'-氨基-1,1'-联苯-2-基)钯(ii)(163mg,0.18mmol),降温至0℃,然后注射双三甲基硅基胺基锂(7.5ml),然后氮气置换三次,升温至40搅拌16小时。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(80mg)。收率:13%。
[1145]
步骤2):
[1146][1147]
将化合物3(160mg,0.8mmol)溶解在正叔丁醇(10ml)中,再加入原甲酸三乙酯(296mg,2mmol),再加入甲酸(37mg,0.8mmol),然后氮气置换三次,升温至110℃搅拌18小时。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通过薄层层析得到化合物4(100mg)。收率:63.8%。
[1148]
步骤3):
[1149][1150]
将化合物4(100mg,0.5mmol)溶解在乙腈(10ml)中,再加入化合物5(127mg,0.6mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通过薄层层析得到化合物ab24885(20mg)。收率:9.4%。
[1151]
化合物ab24885:
[1152]1h nmr(400mhz,dmso-d6)δ9.39(s,1h),8.92(s,1h),8.54(d,j=6.4hz,1h),8.17(d,j=6.9hz,1h),7.99(d,j=7.7hz,2h),7.42(d,j=10.2hz,7h),5.72(s,2h),4.85
–
4.84(m,2h),2.46(s,3h).
[1153]
ms-esi:理论值[m-br]
+
342.41,实测值342.30。
[1154]
实施例29
[1155]
化合物ab24898的制备
[1156]
步骤1):
[1157][1158]
将化合物2(53.5ml,150mmol,3n)溶解在四氢呋喃,在0℃下加入化合物1(6.25g,50mmol)。在0℃到室温下搅拌16小时。点板检测产生新点,在0℃下加入饱和氯化铵淬灭,用硅藻土过滤和乙酸乙酯萃取,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯;石油醚=1:2)得到化合物3(4.2g)。收率:41.37%。
[1159]
步骤2):
[1160][1161]
将化合物3(4.06g,20mmol)溶解在四氢呋喃,在0℃下加入戴斯马丁氧化剂(10.17g,24mmol)。在0℃下搅拌2小时。点板检测产生新点,通过柱层析纯化(乙酸乙酯;石油醚=1:3)得到化合物4(4.0g)。收率:99.0%。
[1162]
步骤3):
[1163][1164]
将化合物4(402mg,2mmol)溶解在乙醇中,在加入水合肼(200mg,4mmol)。在90℃条件下搅拌16小时。点板检测产生新点,直接旋干通过柱层析纯化(乙酸乙酯;石油醚=1:1)得到化合物5(60mg)。收率:15.30%。
[1165]
步骤4):
[1166][1167]
化合物5(100mg,0.51mmol)和化合物6(123.93mg,0.51mmol)溶解在乙腈(5ml)中。在室温下搅拌3小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲
醇:二氯甲烷=0-30%)得到化合物ab24898(100mg)。收率:54.61%。
[1168]
化合物ab24898:
[1169]1h nmr(400mhz,dmso-d6)δ9.77(s,1h),8.89(d,j=6.4hz,1h),8.78(s,1h),8.65
–
8.47(m,3h),8.11(d,j=7.4hz,2h),7.97(t,j=7.9hz,1h),7.65
–
7.50(m,3h),6.65(s,2h).
[1170]
ms-esi:理论值[m-br-]
+
359.36,实测值359.25。
[1171]
实施例30
[1172]
化合物ab24839b的制备
[1173]
步骤1):
[1174][1175]
将化合物1(2.1g,20mmol)溶解在氨水和乙醇(40:40ml)中。在-78℃到-10℃下搅拌3小时。然后在加入2(6.72g,40mmol),在室温条件下搅拌过夜。点板检测产生新点,然后加入浓盐酸溶液调节ph值到1,用水和乙酸乙酯(80ml)萃取,水相再用50%氢氧化钠调节ph值到14,再用水和二氯甲烷(2x80ml)萃取,有机相旋干得到化合物3(1.6g)。收率:54.42%。
[1176]
步骤2):
[1177][1178]
将化合物3(5g,28.57mmol),化合物4(21g,142.85mmol)和三乙胺(28.85g,285.7mmol)溶解在乙腈(60ml)中。在80℃搅拌16小时。点板检测产生新点,用水和乙酸乙酯(200mlx2)萃取,有机相旋干经层析柱(pe:ea=5:1)得到化合物5(2.2g)。收率:25.41%。
[1179]
步骤3):
[1180][1181]
将化合物5(2.2g,7.26mmol),化合物6(1.68g,10.89mmol),碳酸钠(2.1g,19.8mmol)和[1,1'-双(二苯基膦基)二茂铁]二氯化钯(495.6mg,0.66mmol)溶解在二氧六环:水(21:7ml)中。在95℃封管条件下搅拌16小时。点板检测产生新点,用水和乙酸乙酯(200mlx2)萃取,有机相旋干经层析柱(pe:ea=3:1)得到化合物7(200mg)。收率:11.02%。
[1182]
步骤4):
[1183][1184]
将化合物7(500mg,2mmol),二甲氨基吡啶(48.8mg,0.4mmol),三乙胺(404mg,4mmol)和物三氟乙酸酐(2.1g,10mmol)溶解在二氯甲烷(10ml)中。在室温条件下搅拌16小时。点板检测产生新点,用水和二氯甲烷(50mlx2)萃取,有机相旋干经层析柱(pe:ea=3:1)得到化合物8(200mg)。收率:28.82%。
[1185]
步骤5):
[1186][1187]
将化合物8(300mg,0.86mmol),grubbs catalyst 2nd(100mg)溶解在二氯甲烷(10ml)中。在40℃条件下搅拌16小时。再加入氢氧化钾水溶液(1n,5ml)搅拌1小时,点板检测产生新点,用水和二氯甲烷(50mlx2)萃取,有机相旋干经层析柱(dcm:meoh=10:1)得到化合物9(120mg)。收率:62.57%。
[1188]
步骤6):
[1189][1190]
将化合物9(60mg,0.25mmol)溶解在乙腈(5ml)中,然后加入化合物10(57mg,0.25mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物ab24839b(6mg)。收率:9.94%。
[1191]
化合物ab24839b:
[1192]1h nmr(400mhz,cd3od)δ8.16(s,1h),8.05(d,j=7.1hz,2h),7.83(s,1h),7.62(d,j=7.3hz,2h),7.37(d,j=13.9hz,6h),7.09(d,j=6.1hz,1h),6.40(d,j=11.0hz,1h),6.20(s,1h),4.80
–
4.74(m,2h),3.62(s,1h),3.03(s,1h),2.81(d,j=10.6hz,1h).
[1193]
ms-esi:理论值[m-br]
+
375.87,实测值375.30。
[1194]
实施例31
[1195]
化合物ab24959的制备
[1196]
步骤1):
[1197][1198]
将化合物1(294mg,2mmol)溶解在二甲亚砜(10ml)中,加入碳酸铯(1.64g,5mmol),碘化亚铜(76.2mg,0.4mmol),n,n-2甲基乙二胺五滴,反应液室温搅拌10分钟。加入化合物2(650mg,3mmol);反应液加热120度搅拌2小时。点板检测产生新点,用水和乙酸乙酯(10ml)萃取,有机相减压浓缩得到残余物,残余物经大板(甲醇:二氯甲烷=10%)纯化得到化合物3(200mg)。收率:47.62%。
[1199]
步骤2):
[1200][1201]
将化合物3(200mg,0.89mmol)溶解在乙腈(10ml)中,然后加入化合物4(189.57mg,0.89mmol),然后氮气置换三次,室温搅拌过夜。点板检测产生新点,有固体析出,过滤,乙腈(5ml)洗涤,得到化合物ab24959(70mg)。收率:22.03%。
[1202]
化合物ab24959:
[1203]1h nmr(400mhz,dmso-d6)δ8.83(d,j=5.4hz,2h),8.27(d,j=5.5hz,2h),8.04(d,j=7.2hz,1h),7.95(d,j=7.2hz,2h),7.63(s,1h),7.45(d,j=5.7hz,4h),6.31(s,2h),4.24(s,2h),3.21(s,2h),2.42(s,3h)。
[1204]
ms-esi:理论值[m-br]
+
357.43,实测值357.10。
[1205]
实施例32
[1206]
化合物ab24938的制备
[1207]
步骤1):
[1208][1209]
将化合物1(2g,23mmol)和化合物2(2.5g,19mmol)溶解在n,n-二甲基乙酰胺(30ml)中,在加入三乙烯二胺(6.5g,58mmol)、双(二亚芐基丙酮)钯(890mg,0.97mmol)、四氟硼酸三叔丁基膦(561mg,1.94mmol),在封管下120℃搅拌16小时。点板检测产生新点,用水和乙酸乙酯(10ml)萃取,有机相减压浓缩得到残余物,残余物经柱层析(甲醇:二氯甲烷=5%)纯化得到化合物3(800mg)。收率:26.1%。
[1210]
步骤2):
[1211][1212]
将化合物3(100mg,0.625mmol)溶解在乙腈(5ml)中,然后加入化合物4(200mg,0.938mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物ab24938(78mg)。收率:39.8%。
[1213]
化合物ab24938:
[1214]1h nmr(400mhz,dmso-d6)δ9.14(s,1h),8.23(d,j=9.1hz,3h),8.08(s,1h),8.00(d,j=7.0hz,1h),7.84(d,j=7.3hz,1h),7.68(t,j=7.1hz,1h),6.39(s,2h),3.14(s,1h),1.33(d,j=5.7hz,6h).
[1215]
ms-esi:理论值[m-br]
+
313.80,实测值313.25。
[1216]
实施例33
[1217]
化合物ab24821的制备
[1218]
步骤1):
[1219][1220]
将化合物1(2.7g,20mmol)溶解在n,n-二甲基甲酰胺(50ml)中,加入化合物1-1(5.3g,40mmol)、2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(11.4g,30mmol)和n,n-二异丙基乙胺(9g,70mmol)。在室温下搅拌1小时。点板检测产生新点,加入水(50ml)和乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物2(3.6g)。收率:91.1%。
[1221]
步骤2):
[1222][1223]
将化合物2(200mg,1mmol)溶解在干燥的四氢呋喃(5ml)中,在0℃下加入1n甲基溴化镁的四氢呋喃溶液(2ml)。在0℃下搅拌3小时。点板检测产生新点,加入饱和碳酸氢钠水溶液(6ml)、水(20ml)和乙酸乙酯(20mlx3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物3(67mg)。收率:37.4%。
[1224]
步骤3):
[1225][1226]
将化合物3(363mg,3mmol)溶解在醋酸(5ml)中,混合液中加入液溴(383mg,3.8mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物4(100mg)。收率:97.3%。
[1227]
步骤4):
[1228][1229]
将化合物5(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物6(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物7(2.6g)。收率:26.8%。
[1230]
步骤5):
[1231][1232]
将化合物4(100mg,0.46mmol)和化合物7(86mg,0.46mmol)溶解在乙腈(10ml)中,在室温下搅拌5小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24821(15mg)。收率:10.1%。
[1233]
化合物ab24821:
[1234]1h nmr(400mhz,dmso-d6)δ9.45(s,1h),9.03(s,1h),8.77(s,1h),8.16(d,j=7.0hz,1h),8.05(d,j=7.1hz,1h),7.36(s,4h),7.30(s,1h),7.05(d,j=8.3hz,1h),7.01(d,j=7.3hz,1h),5.92(s,2h),4.56(d,j=5.4hz,2h),2.63(s,3h)。
[1235]
ms-esi:理论值[m-br]
+
319.38,实测值319.30。
[1236]
实施例34
[1237]
化合物ab24839的制备
[1238]
步骤1):
[1239][1240]
将化合物1(2.1g,20mmol)溶解在氨水和乙醇(40:40ml)中。在-78℃到-10℃下搅拌3小时。然后在加入2(6.72g,40mmol),在室温条件下搅拌过夜。点板检测产生新点,然后加入浓盐酸溶液调节ph值到1,用水和乙酸乙酯(80ml)萃取,水相再用50%氢氧化钠调节ph值到14,再用水和二氯甲烷(2x80ml)萃取,有机相旋干得到化合物3(1.6g)。收率:54.42%。
[1241]
步骤2):
[1242][1243]
将化合物3(5g,28.57mmol),化合物4(21g,142.85mmol)和三乙胺(28.85g,285.7mmol)溶解在乙腈(60ml)中。在80℃搅拌16小时。点板检测产生新点,用水和乙酸乙酯(200mlx2)萃取,有机相旋干经层析柱(pe:ea=5:1)得到化合物5(2.2g)。收率:25.41%。
[1244]
步骤3):
[1245][1246]
将化合物5(2.2g,7.26mmol),化合物6(1.68g,10.89mmol),碳酸钠(2.1g,19.8mmol)和[1,1'-双(二苯基膦基)二茂铁]二氯化钯(495.6mg,0.66mmol)溶解在二氧六环:水(21:7ml)中。在95℃封管条件下搅拌16小时。点板检测产生新点,用水和乙酸乙酯(200mlx2)萃取,有机相旋干经层析柱(pe:ea=3:1)得到化合物7(200mg)。收率:11.02%。
[1247]
步骤4):
[1248][1249]
将化合物7(500mg,2mmol),二甲氨基吡啶(48.8mg,0.4mmol),三乙胺(404mg,4mmol)和物三氟乙酸酐(2.1g,10mmol)溶解在二氯甲烷(10ml)中。在室温条件下搅拌16小
时。点板检测产生新点,用水和二氯甲烷(50mlx2)萃取,有机相旋干经层析柱(pe:ea=3:1)得到化合物8(200mg)。收率:28.82%。
[1250]
步骤5):
[1251][1252]
将化合物8(300mg,0.86mmol),grubbs catalyst 2nd(100mg)溶解在二氯甲烷(10ml)中。在40℃条件下搅拌16小时。再加入氢氧化钾水溶液(1n,5ml)搅拌1小时,点板检测产生新点,用水和二氯甲烷(50mlx2)萃取,有机相旋干经层析柱(dcm:meoh=10:1)得到化合物9(120mg)。收率:62.57%。
[1253]
步骤6):
[1254][1255]
将化合物9(120mg,0.53mmol)溶解在四氢呋喃啊(5ml)中。在加入钯碳(12mg),在氢气条件下搅拌4小时。点板检测产生新点,用硅藻土过滤,滤液旋干得到化合物10(20mg)。收率:16.77%。
[1256]
步骤7):
[1257][1258]
将化合物10(20mg,0.08mmol)溶解在乙腈(5ml)中,然后加入化合物11(20.71mg,0.08mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物ab24839(3.1mg)。收率:9.94%。
[1259]
化合物ab24839:
[1260]1h nmr(400mhz,cd3od)δ8.05(d,j=7.7hz,2h),7.92
–
7.82(m,2h),7.62(d,j=7.7hz,2h),7.40(dd,j=30.0,8.5hz,6h),6.92(d,j=6.7hz,1h),5.80(s,2h),5.21(d,j=10.2hz,1h),2.69
–
2.45(m,2h),2.13(s,2h),1.99(s,2h).
[1261]
ms-esi:理论值[m-br]
+
377.89,实测值377.25。
[1262]
实施例35
[1263]
化合物ab27130的制备
[1264]
步骤1):
[1265][1266]
将化合物1(200mg,1.01mmol),三苯基磷(400mg,3.54mmol)溶解在四氢呋喃(10ml)中,然后氮气置换三次,升温至80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,过滤,用四氢呋喃洗涤三次得到粗品化合物2(350mg)。收率:91.1%。
[1267]
步骤2):
[1268][1269]
将化合物2(200mg,0.52mmol)和化合物3(108mg,0.46mmol)溶解在四氢呋喃(10ml)中,再加入三乙胺(2ml),然后氮气置换三次,升温至70℃下搅拌16小时。点板检测产生新点,然后冷却到室温,减压浓缩,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(150mg)。收率:89%。
[1270]
步骤3):
[1271][1272]
将化合物4(200mg,0.61mmol)溶解在乙酸乙酯盐酸气(5ml)中,在室温下搅拌3小时。点板检测产生新点,减压浓缩得到粗品化合物5(210mg)。
[1273]
步骤4):
[1274][1275]
将化合物5(200mg,0.97mmol)溶解在乙醇(5ml)中,加入钯碳(20mg),置换氢气三
次,在室温下搅拌过夜。点板检测产生新点,过滤,减压浓缩,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物6(60mg)。收率:29.5%。
[1276]
步骤5):
[1277][1278]
将化合物7(200mg,1.11mmol)溶解在二氯甲烷(10ml)中,再加双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(456mg,1.11mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物8(250mg)。收率:87.29%。
[1279]
步骤6):
[1280][1281]
将化合物6(100mg,0.48mmol)和化合物8(148mg,0.57mmol)溶解在乙腈(10ml)中,然后加入碳酸钾(66mg,0.48mmol)。在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27130(55mg)。收率:29.4%。
[1282]
化合物ab27130:
[1283]1h nmr(400mhz,dmso-d6)δ9.37(s,1h),8.18(s,1h),8.09(s,1h),7.79(d,j=45.7hz,2h),7.53(s,1h),7.38(d,j=20.0hz,5h),6.93(s,1h),5.71(d,j=9.8hz,1h),4.77(s,1h),3.22(s,2h),2.79(s,2h),2.52(s,2h),2.10(s,1h),1.89(s,1h).
[1284]
ms-esi:理论值[m-br]
+
389.90,实测值389.10。
[1285]
实施例36
[1286]
化合物ab27141的制备
[1287]
步骤1):
[1288][1289]
将化合物1(240mg,2mmol)溶解在干燥的n-n-二甲基甲酰胺(10ml)中,再加入2
(555mg,1.5mmol),和三乙胺(606.0mg,6.0mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物3(260mg)。收率:58.47%。
[1290]
步骤2):
[1291][1292]
将化合物3(111mg,0.50mmol)溶解在乙腈(10ml)中,再加入化合物4(130mg,0.5mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27141(40mg)。收率:19.95%。
[1293]
化合物ab27141:
[1294]
1h nmr(400mhz,dmso-d6)δ9.67(s,1h),8.75(d,j=6.4hz,1h),8.22(d,j=6.5hz,1h),8.05(s,1h),7.80(s,1h),7.73(d,j=7.8hz,1h),7.57
–
7.50(m,3h),7.40(dd,j=12.0,7.2hz,4h),7.14(s,1h),6.25
–
6.15(m,2h),3.43(d,j=43.7hz,2h),3.20(d,j=16.7hz,1h),2.95(d,j=10.2hz,1h),2.06(d,j=6.2hz,3h).
[1295]
ms-esi:理论值[m-br]
+
401.91,实测值:401.10。
[1296]
实施例37
[1297]
化合物ab24957的制备
[1298]
步骤1):
[1299][1300]
将化合物1(300mg,3.15mmol)溶解在乙腈(10ml)中,再加入2(671mg,2.35mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,点板检测新点出现,将反应液旋干,通过薄层析法,得到化合物3(600mg)。收率:83.54%
[1301]
步骤2):
[1302]
[1303]
将化合物3(200mg,0.87mmol)溶解在三氯氧磷(10ml)中,然后氮气置换三次,90度搅拌2h。点板检测新点出现,点板检测新点出现,将反应液旋干,拉干,得到化合物4(215mg粗品),直接投下一步。
[1304]
步骤3):
[1305][1306]
将化合物4(215mg,0.88mmol)溶解在n,n-二甲基甲酰胺(10ml)中,再加入化合物5(117mg,0.88mmol),再加入三乙胺(267mg,2.64mmol),然后氮气置换三次,80度搅拌过夜。点板检测新点出现,得到化合物ab24957(80mg)。收率:26.50%。
[1307]
化合物ab24957:
[1308]1h nmr(400mhz,dmso,d6)δ8.30(s,2h),7.95(d,j=8.2hz,2h),7.45(d,j=8.1hz,1h),7.38(s,1h),7.32
–
7.27(m,2h),6.00(s,2h),4.85(s,2h),3.86(t,j=6.0hz,2h),3.04(t,j=5.9hz,2h),2.44(s,2h)。
[1309]
ms-esi:理论值[m-br]
+
343.18,实测值343.30。
[1310]
实施例38
[1311]
化合物ab24989的制备
[1312]
步骤1):
[1313][1314]
将化合物1(200mg,1.69mmol)溶解在n’n-二甲基甲酰胺(20ml)中,冰浴下加入氢化钠(203mg,5.07mmol),冰浴下搅拌30分钟,再加入化合物2(289mg,1.86mmol),室温下搅拌3小时。点板监测反应有新点,加入水(10ml)和乙酸乙酯(10ml)萃取,乙酸乙酯萃取三次,合并有机相。有机相用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,通过柱层析纯化(乙酸乙酯:石油醚=0-10%)得到化合物3(260mg)。收率:73.8%。
[1315]
步骤2):
[1316][1317]
将化合物3(300mg,1.44mmol)溶解在乙腈(10ml)中,再加入4(577mg,2.16mmol),
然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤得到化合物ab24989(30mg)。收率:5.3%。
[1318]
化合物ab24989:
[1319]1h nmr(400mhz,dmso,d6)δ9.25(s,1h),8.45(s,1h),8.33(s,3h),8.16(s,2h),7.90(s,1h),7.34(s,5h),7.20(s,1h),6.44(s,2h),5.67(s,2h).
[1320]
ms-esi:理论值[m-br]
+
395.40,实测值395.30。
[1321]
实施例39
[1322]
化合物ab24906的制备
[1323]
步骤1):
[1324][1325]
将化合物1(438mg,3mmol)溶解在乙酸(5ml)中,加入一滴氢溴酸,取液溴(384mg,2.4mmol)加入到乙酸(2ml)中后注射到上述混合物中,然后氮气置换三次,室温搅拌3小时。点板检测新点出现,过滤,减压浓缩减压,通过薄层析得到化合物2(400mg)。收率:59.51%。
[1326]
步骤2):
[1327][1328]
将化合物2(200mg,0.9mmol)溶解在乙腈(10ml)中。加入化合物3(171mg,0.9mmol)。然后氮气置换三次,室温搅拌3小时。点板检测产生新点,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(二氯甲烷:甲醇=10:1)得到化合物ab24906(100mg)。收率:27.23%。
[1329]
化合物ab24906:
[1330]1h nmr(400mhz,dmso-d6)δ9.54(s,1h),8.30(d,j=7.0hz,1h),8.15(d,j=7.0hz,1h),7.66(d,j=7.6hz,1h),7.48(s,1h),7.33(d,j=25.3hz,6h),7.00(dd,j=22.7,6.8hz,2h),5.62(s,1h),4.57(d,j=4.8hz,2h),3.76(d,j=8.3hz,1h),3.39(s,1h),2.44(s,3h).
[1331]
ms-esi:理论值[m-br]
+
329.16,实测值329.16。
[1332]
实施例40
[1333]
化合物ab24949的制备
[1334]
步骤1):
[1335][1336]
将化合物1(200mg,1.22mmol)溶解在乙酸(5ml)中,加入一滴氢溴酸,取液溴(193mg,1.22mmol)加入到乙酸(2ml)中后注射到上述混合物中,然后氮气置换三次,室温搅拌3小时。点板检测新点出现,过滤,减压浓缩减压,通过薄层析得到化合物2(300mg)。收率:101%。
[1337]
步骤2):
[1338][1339]
将化合物3(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物4(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物5(2.6g)。收率:26.8%。
[1340]
步骤3):
[1341][1342]
将化合物6(300mg,1.24mmol)溶解在乙腈(10ml)中。加入化合物5(228mg,1.24mmol)。然后氮气置换三次,室温搅拌3小时。点板检测产生新点,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(二氯甲烷:甲醇=10:1)得到化合物ab24949(35mg)。收率:12.5%。
[1343]
化合物ab24949:
[1344]1h nmr(400mhz,cd3od)δ8.16
–
7.98(m,3h),7.35(d,j=21.1hz,5h),7.16(s,2h),6.95(d,j=12.6hz,2h),4.59(s,2h),3.39(s,1h),3.24
–
3.19(m,1h),2.76(s,1h),2.59(s,1h).
[1345]
ms-esi:理论值[m-br]
+
347.40,实测值:347.10。
[1346]
实施例41
[1347]
化合物ab24954的制备
[1348]
步骤1):
[1349][1350]
将化合物1(176mg,1.0mmol)溶解在醋酸(7ml)中,混合液中加入液溴(160mg,1.0mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物2(200mg)。收率:78.43%。
[1351]
步骤2):
[1352][1353]
将化合物2(200mg,0.78mmol)溶解在乙腈(10ml)中,再加入3(150mg,0.82mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤,滤饼用乙腈(2ml)洗涤三次,旋干得到化合物ab24954(20mg)。收率:7.14%。
[1354]
化合物ab24954:
[1355]1h nmr(400mhz,cd3od)δ8.11(d,j=7.4hz,1h),8.03(d,j=7.3hz,1h),7.58(d,j=8.0hz,1h),7.37(s,5h),7.32(s,1h),7.26(d,j=7.3hz,1h),6.98(d,j=7.2hz,1h),6.92(d,j=7.3hz,1h),4.86
–
4.84(m,1h),4.59(s,2h),3.90(s,3h),3.40(d,j=18.1hz,1h),3.00(t,j=12.3hz,1h),2.69(s,1h),2.60(s,1h).
[1356]
ms-esi:理论值[m-cf3coo]
+
359.45,实测值359.10。
[1357]
实施例42
[1358]
化合物ab24963的制备
[1359]
步骤1):
[1360][1361]
将化合物1(8g,83.33mmol)溶解在三氯氧磷(40ml)中,然后氮气置换三次,加热90℃搅拌过夜。点板检测新点出现,旋干三氯氧磷,冰水浴下加入二氯甲烷(50ml),缓慢滴加冰水(50ml),二氯甲烷(50ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=30-80%)得到
化合物2(5g),收率:52.17%。
[1362]
步骤2):
[1363][1364]
将化合物2(2.5g,21.73mmol)溶解在n,n-二甲基甲酰胺(50ml)中,再加入化合物3(7.43g,65.22mmol)和碳酸钾(9.01g,65.22mmol),然后氮气置换三次,加,80℃搅拌过夜。点板检测新点出现,加入水(50ml)和乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物4(2.1g),收率:52.24%。
[1365]
步骤3):
[1366][1367]
将化合物4(200mg,1.08mmol)溶解在乙腈(10ml)中,再加入化合物5(371mg,1.62mmol),然后氮气置换三次,室温搅拌过夜。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab24963(20mg)。收率:5.54%。
[1368]
化合物ab24963
[1369]1h nmr(400mhz,dmso,d6)δ10.18(s,1h),8.77(s,1h),8.14(s,1h),7.98(d,j=8.2hz,2h),7.33(d,j=22.3hz,5h),7.13(d,j=8.2hz,2h),6.97(s,1h),5.83(s,2h),4.73(s,2h),3.86(s,3h).
[1370]
ms-esi:理论值[m-br]
+
334.16,实测值:334.25。
[1371]
实施例43
[1372]
化合物ab24964的制备
[1373]
步骤1):
[1374][1375]
将化合物1(8g,83.33mmol)溶解在三氯氧磷(40ml)中,然后氮气置换三次,加热90℃搅拌过夜。点板检测新点出现,旋干三氯氧磷,冰水浴下加入二氯甲烷(50ml),缓慢滴加冰水(50ml),二氯甲烷(50ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=30-80%)得到化合物2(5g),收率:52.17%。
[1376]
步骤2):
[1377][1378]
将化合物2(2.5g,21.73mmol)溶解在n,n-二甲基甲酰胺(50ml)中,再加入化合物3(7.43g,65.22mmol)和碳酸钾(9.01g,65.22mmol),然后氮气置换三次,加,80℃搅拌过夜。点板检测新点出现,加入水(50ml)和乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物4(2.1g),收率:52.24%。
[1379]
步骤3):
[1380][1381]
将化合物4(200mg,1.08mmol)溶解在乙腈(10ml)中,再加入5(446mg,1.62mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过柱层析纯化(甲醇:二氯甲烷=10%)得到化合物ab24964(30mg)。收率:7.3%。
[1382]
化合物ab24964:
[1383]1h nmr(400mhz,dmso-d6)δ10.13(s,1h),8.79(s,1h),8.12(d,j=25.9hz,3h),7.94(d,j=6.7hz,2h),7.77(s,2h),7.51(s,1h),7.44(s,1h),7.35(d,j=17.5hz,3h),6.97(s,1h),5.92(s,2h),4.74(s,1h).
[1384]
ms-esi:理论值[m-cf3coo]
+
380.46,实测值:380.30。
[1385]
实施例44
[1386]
化合物ab24967的制备
[1387]
步骤1):
[1388][1389]
将化合物1(8g,83.33mmol)溶解在三氯氧磷(40ml)中,然后氮气置换三次,加热90℃搅拌过夜。点板检测新点出现,旋干三氯氧磷,冰水浴下加入二氯甲烷(50ml),缓慢滴加冰水(50ml),二氯甲烷(50ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=30-80%)得到化合物2(5g),收率:52.17%。
[1390]
步骤2):
[1391][1392]
将化合物2(2.5g,21.73mmol)溶解在n,n-二甲基甲酰胺(50ml)中,再加入化合物3(7.43g,65.22mmol)和碳酸钾(9.01g,65.22mmol),然后氮气置换三次,加,80℃搅拌过夜。点板检测新点出现,加入水(50ml)和乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物4(2.1g),收率:52.24%。
[1393]
步骤3):
[1394][1395]
将化合物4(200mg,1.08mmol)溶解在乙腈(15ml)中,再加入5(367mg,1.29mmol),然后氮气置换三次,室温搅拌过夜。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab24967(30mg)。收率:7.16%。
[1396]
化合物ab24967:
[1397]1h nmr(400mhz,dmso,d6)δ10.29(s,1h),8.75(s,1h),8.14(s,1h),8.05(s,1h),7.92(s,1h),7.78(s,2h),7.33(d,j=23.1hz,6h),6.99(d,j=6.7hz,1h),5.90(s,2h),4.73(s,2h).
[1398]
ms-esi:理论值[m-br]
+
388.13,实测值:388.25。
[1399]
实施例45
[1400]
化合物ab24991的制备
[1401]
步骤1):
[1402][1403]
将化合物1(200mg,1.69mmol)溶解在n,n-二甲基甲酰胺(20ml)中,冰浴下加入nah(203mg,5.07mmol),在0℃下搅拌30分钟。再缓慢加入化合物2(318mg,1.86mmol)在室温下搅拌3小时,点板检测产生新点,加入水(30ml)和乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物3(200mg)。收率:56.9%。
[1404]
步骤2):
[1405][1406]
将化合物3(200mg,0.96mmol)溶解在乙腈(10ml)中,再加入化合物4(337mg,1.44mmol),然后氮气置换三次,室温搅拌过夜。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24991(100mg)。收率:28.86%。
[1407]
化合物ab24991:
[1408]1h nmr(400mhz,dmso,d6)δ9.26(s,1h),8.41(d,j=42.8hz,2h),8.06(dd,j=48.7,20.6hz,3h),7.85(d,j=6.8hz,1h),7.69(d,j=7.0hz,1h),7.27(d,j=60.4hz,6h),6.40(s,2h),5.67(s,2h).
[1409]
ms-esi:理论值[m-br]
+
361.11,实测值:361.05。
[1410]
实施例46
[1411]
化合物ab27106的制备
[1412]
步骤:
[1413][1414]
将化合物1(80mg,0.38mmol)和化合物2(103mg,0.385mmol)溶解在乙腈(5ml)中。在室温下搅拌3小时。点板检测产生新点,减有固体析出,过滤,滤饼用乙腈(2ml)洗涤三次,旋干得到化合物ab27106(57mg)。收率:37.97%。
[1415]
化合物ab27106:
[1416]
1h nmr(400mhz,dmso-d6)δ13.53(s,1h),9.29(s,1h),8.33
–
8.25(m,4h),8.14(d,j=6.7hz,1h),8.05(d,j=8.3hz,2h),7.38
–
7.28(m,4h),7.21(dd,j=7.2,4.0,1.4hz,1h),6.53(s,2h),4.22(s,2h).
[1417]
ms-esi:理论值[m-br]
+
395.40,实测值395.05。
[1418]
实施例47
[1419]
化合物ab27107的制备
[1420]
步骤:
[1421][1422]
将化合物1(100mg,0.50mmol)和化合物2(141mg,0.5mmol)溶解在乙腈(5ml)中。在室温下搅拌3小时。点板检测产生新点,减有固体析出,过滤,滤饼用乙腈(2ml)洗涤三次,旋干得到化合物ab27107(65mg)。收率:31.55%。
[1423]
化合物ab27107:
[1424]1h nmr(400mhz,dmso-d6)δ13.10(s,1h),9.24(s,1h),8.41
–
8.12(m,5h),7.67(d,j=8.3hz,2h),7.40
–
7.27(m,4h),7.21(t,j=7.1hz,1h),6.48(s,2h),4.22(s,2h).
[1425]
ms-esi:理论值[m-br]
+
411.40,实测值411.05。
[1426]
实施例48
[1427]
化合物ab27114的制备
[1428]
步骤1):
[1429][1430]
将化合物1(4.4g,20mmol)溶解在n,n-二甲基甲酰胺(20ml)中,再加入化合物2(4.28g,42mmol),再加入碘化亚铜(0.19g,1mmol),再加入n,n-二异丙基乙胺(8.24g,64mmol),最后加入双三苯基膦二氯化钯(190mg,0.6mmol),然后氮气置换三次,常温搅拌16小时。点板检测新点出现,用水(100ml)稀释,然后加入乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=2:1)得到化合物3(3.5g)。收率:84.13%。
[1431]
步骤2):
[1432][1433]
将化合物3(1.5g,7.2mmol)溶解在1,4-二氧六环(40ml)中,再加入叔丁醇钾(2.4mg,21.6mmol),然后氮气置换三次,升温至100℃搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通薄层层析纯化(甲醇:二氯甲烷=10:1)得到化合物4(1.1g)。收率:73.45%。
[1434]
步骤3)
[1435][1436]
将化合物4(104mg,0.5mmol)溶解在乙腈(10ml)中,加入化合物5(160mg,0.6mmol)然后氮气置换三次,室温搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通薄层层析纯化(二氯甲烷:甲醇=10:1)得到化合物ab27114(141mg)。收率59.49%。
[1437]
化合物ab27114:
[1438]1h nmr(400mhz,dmso-d6)δ13.04(s,1h),9.11(s,1h),8.35(d,j=6.0hz,1h),8.24(d,j=7.2hz,2h),8.03(d,j=7.2hz,2h),7.96(d,j=6.2hz,1h),7.33(s,2h),7.26(s,1h),6.82(s,1h),6.41(s,2h),4.24(s,2h).
[1439]
ms-esi:理论值[m-br]
+
395.14,实测值395.14。
[1440]
实施例49
[1441]
化合物ab27124的制备
[1442]
步骤1):
[1443][1444]
将化合物1(200mg,1.69mmol)溶解在n,n-二甲基甲酰胺(20ml)中,冰浴下加入nah(203mg,5.07mmol),在0℃下搅拌30分钟。再缓慢加入化合物2(318mg,1.86mmol)在室温下搅拌3小时,点板检测产生新点,加入水(30ml)和乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物3(200mg)。收率:56.9%
[1445]
步骤2):
[1446][1447]
将化合物4(200mg,1.11mmol)溶解在二氯甲烷(10ml)中,再加入化合物5(456mg,1.11mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化
合物6(250mg)。收率:87.29%。
[1448]
步骤3):
[1449][1450]
将化合物3(150mg,0.58mmol)溶解在乙腈(10ml)中,再加入6(100mg,0.48mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过薄层析法,得到化合物ab27124(65mg)。收率:34.99%。
[1451]
化合物ab27124:
[1452]1h nmr(400mhz,dmso,d6)δ9.45(s,1h),8.62(s,1h),8.40(d,j=6.8hz,1h),8.21(d,j=2.5hz,1h),7.88(d,j=2.0hz,1h),7.79(dd,j=8.3,2.3hz,1h),7.58(d,j=8.3hz,1h),7.42
–
7.31(m,5h),7.19(d,j=3.3hz,1h),5.71(s,2h),3.30(s,3h),3.04(dd,j=13.2,4.6hz,1h),2.69(d,j=8.9hz,1h).
[1453]
ms-esi:理论值[m-br]
+
387.13,实测值387.20。
[1454]
实施例50
[1455]
化合物ab27127的制备
[1456]
步骤:
[1457][1458]
将化合物1(100mg,0.42mmol)溶解在乙腈(10ml)中,再加入2(77.73mg,0.42mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过薄层析法,得到化合物ab27127(15mg)。收率:9.73%。
[1459]
化合物ab27127:
[1460]1h nmr(400mhz,dmso-d6)δ9.50(s,1h),8.65(s,1h),8.40(d,j=6.5hz,1h),8.20(s,1h),7.72(s,1h),7.49(s,1h),7.41
–
7.26(m,6h),7.14(s,1h),6.36(d,j=11.1hz,1h),5.70(s,2h),3.31(s,1h),3.21
–
3.06(m,1h),2.95(t,j=30.6hz,1h),2.65(s,1h),2.33(s,3h).
[1461]
ms-esi:理论值[m-br]
+
367.47,实测值367.25。
[1462]
实施例51
[1463]
化合物ab24924的制备
[1464]
步骤1):
[1465][1466]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1467]
步骤2):
[1468][1469]
将化合物4(400mg,2.1mmol)溶解在醋酸(10ml)中,混合液中加入液溴(348mg,2.17mmol)、氢溴酸水溶液两滴,然后氮气置换三次,在室温下搅拌3小时。点板检测产生新点,有固体析出,过滤,二氯甲烷(5ml)洗涤,滤饼除去有机溶剂,得到化合物5(400mg)。收率:81.3%。
[1470]
步骤3):
[1471][1472]
将化合物5(300mg,1.16mmol)和化合物3(107mg,0.58mmol)溶解在乙腈(10ml)中。在室温下搅拌3小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10%)得到化合物ab24924(15mg)。收率:3.9%。
[1473]
化合物ab24924:
[1474]1h nmr(400mhz,cd3od)δ8.96(s,1h),8.57(d,j=5.3hz,1h),8.05(dd,j=7.5,1.9hz,1h),7.97(dd,j=7.4,1.9hz,1h),7.41(d,j=5.3hz,1h),7.29(t,j=4.6hz,4h),7.27
–
7.20(m,1h),6.92(dd,j=7.4,2.9hz,1h),6.86(dd,j=7.5,2.9hz,1h),4.52(s,2h),3.35(s,1h),3.24
–
3.21(m,1h),3.20
–
3.17(m,1h),2.72(d,j=4.5hz,1h),2.56
–
2.48(m,
1h).
[1475]
ms-esi:理论值[m-cf3coo]
+
330.41,实测值330.30。
[1476]
实施例52
[1477]
化合物ab24996的制备
[1478]
步骤1):
[1479][1480]
将化合物1(22g,100mmol)溶解在四氢呋喃(200ml)中,加入化合物2(10.5g,150mmol),在零下78度滴加正丁基锂(80ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=50:1)得到化合物3(12g)。收率:55.2%。
[1481]
步骤2):
[1482][1483]
将化合物3(12g,55.6mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入化合物硝酸银(1.89g,11.12mmol)和过硫酸钾(37g,139mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物4(3.1g)。收率:26.05%。
[1484]
步骤3):
[1485][1486]
将化合物4(1.5mg,6.9mmol)溶解在二氯甲烷(20ml)中,再加入c8h
18
n2o2hbr3(2.9g,6.9mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(2.2g)。收率:85.48%。
[1487]
步骤4):
[1488][1489]
将化合物5(150mg,0.5mmol)溶解在乙腈(5ml)中,然后加入化合物6(104mg,
0.5mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab24996(40mg)。收率:16.0%。
[1490]
化合物ab24996:
[1491]1h nmr(400mhz,dmso-d6)δ9.38(s,1h),8.56(d,j=6.7hz,1h),8.36(d,j=6.9hz,1h),8.17(s,1h),8.11(d,j=8.0hz,1h),7.94(s,1h),7.80(d,j=8.1hz,1h),7.35(s,5h),7.17(s,1h),6.20(d,j=9.8hz,1h),5.67(s,2h),3.40(s,3h),3.06(s,1h),2.68(s,1h).
[1492]
ms-esi:理论值[m-br]
+
421.15,实测值:421.15。
[1493]
实施例53
[1494]
化合物ab27111的制备
[1495]
步骤1):
[1496][1497]
将化合物1(36.3g,150mmol)溶解在四氢呋喃(120ml)中,加入化合物2(12.6g,180mmol),在零下78度滴加正丁基锂(120ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物3(6.72g)。收率:18.66%。
[1498]
步骤2):
[1499][1500]
将化合物3(6.72g,28mmol)溶解在二氯甲烷(200ml)和水(200ml)中,加入化合物硝酸银(952mg,5.6mmol)和过硫酸钾(18.9g,70mmol),,在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物4(2.35g)。收率:36.33%。
[1501]
步骤3):
[1502][1503]
将化合物4(2.0g,8.69mmol)溶解在二氯甲烷(50ml)中,再加入化合物双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(3.65g,8.90mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法(石油醚:乙酸乙酯=0-10%),得到化合物5(2.5g)。收率:93.10%。
[1504]
步骤4):
[1505][1506]
将化合物5(240mg,0.78mmol)溶解在乙腈(10ml)中,然后加入化合物6(150mg,0.78mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27111(88mg)。收率:27.31%。。
[1507]
化合物ab27111:
[1508]1h nmr(400mhz,dmso-d6)δ9.72(s,1h),8.27(d,j=6.8hz,1h),8.17(d,j=6.7hz,1h),8.02(d,j=8.5hz,1h),7.48(s,1h),7.40(d,j=11.9hz,5h),7.29(s,1h),7.11(d,j=5.7hz,1h),6.99(d,j=5.6hz,1h),5.81(d,j=10.7hz,1h),4.57(d,j=4.9hz,2h),3.25(s,2h),3.21(s,1h),2.81(d,j=9.3hz,1h).
[1509]
ms-esi:理论值[m-br]
+
413.42,实测值:413.20。
[1510]
实施例54
[1511]
化合物ab27112的制备
[1512]
步骤1):
[1513][1514]
将化合物1(8g,83.33mmol)溶解在三氯氧磷(40ml)中,然后氮气置换三次,加热90℃搅拌过夜。点板检测新点出现,旋干三氯氧磷,冰水浴下加入二氯甲烷(50ml),缓慢滴加冰水(50ml),二氯甲烷(50ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=30-80%)得到化合物2(5g),收率:52.17%。
[1515]
步骤2):
[1516][1517]
将化合物2(2.5g,21.73mmol)溶解在n,n-二甲基甲酰胺(50ml)中,再加入化合物3(7.43g,65.22mmol)和碳酸钾(9.01g,65.22mmol),然后氮气置换三次,80℃搅拌过夜。点板检测新点出现,加入水(50ml)和乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物4(2.1g),收率:52.24%。
[1518]
步骤3):
[1519][1520]
将化合物4(100mg,0.54mmol)溶解在乙腈(10ml)中,加入化合物5(173mg,0.65mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27112(40mg)。收率:19.9%。
[1521]
化合物ab27112:
[1522]1h nmr(400mhz,dmso-d6)δ10.47(s,1h),8.79(s,1h),8.20(s,3h),8.01(d,j=6.7hz,2h),7.37(s,5h),7.06(d,j=6.5hz,1h),5.97(s,2h),4.73(s,2h).
[1523]
ms-esi:理论值[m-br]
+
372.36,实测值:372.10。
[1524]
实施例55
[1525]
化合物ab27125的制备
[1526]
步骤1):
[1527][1528]
将化合物1(22g,100mmol)溶解在四氢呋喃(200ml)中,加入化合物2(10.5g,150mmol),在零下78度滴加正丁基锂(80ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=50:1)得到化合物3(13g)。收率:60.3%。
[1529]
步骤2):
[1530][1531]
将化合物3(6.48g,30mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入化合物硝酸银(1g,6mmol)和过硫酸钾(20g,270mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物4(584mg)。收率:9.0%。
[1532]
步骤3):
[1533][1534]
将化合物4(584mg,1.98mmol)溶解在二氯甲烷(20ml)中,再加入c8h
18
n2o2hbr3(820mg,1.98mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(670mg)。收率:94.7%。
[1535]
步骤4):
[1536][1537]
将化合物5(200mg,0.65mmol)溶解在乙腈(5ml)中,然后加入化合物6(100mg,0.65mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27125(53mg)。收率:16.3%。
[1538]
化合物ab27125:
[1539]1h nmr(400mhz,dmso-d6)δ9.40(s,1h),8.58(d,j=6.0hz,1h),8.37(d,j=6.2hz,1h),8.15(d,j=17.0hz,2h),8.06(d,j=7.5hz,1h),7.76(d,j=7.5hz,1h),7.35(s,5h),7.17(s,1h),6.24(d,j=12.0hz,1h),5.68(s,2h),3.39(s,2h).
[1540]
ms-esi:理论值[m-br]
+
421.15,实测值:421.15。
[1541]
实施例56
[1542]
化合物ab27126的制备
[1543]
步骤1):
[1544][1545]
将化合物1(200mg,1.69mmol)溶解在n,n-二甲基甲酰胺(20ml)中,冰浴下加入nah(203mg,5.07mmol),在0℃下搅拌30分钟。再缓慢加入化合物2(318mg,1.86mmol)在室温下搅拌3小时,点板检测产生新点,加入水(30ml)和乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物3(200mg)。收率:56.9%
[1546]
步骤2):
[1547][1548]
将化合物4(30g,124mmol)溶解在四氢呋喃(200ml)中,加入化合物5(10.46g,149mmol),置换氮气三次,在零下78℃滴加正丁基锂(100ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物6(11.2g)。收率:38.93%。
[1549]
步骤3):
[1550][1551]
将化合物6(11.2g,48mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入硝酸银(1.65g,9.7mmol)和过硫酸钾(32.6g,121mmol),,在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去水和有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物7(930mg)。收率:8.42%。
[1552]
步骤4):
[1553][1554]
将化合物7(930mg,4.04mmol)溶解在二氯甲烷(20ml)中,再加入双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(1.68g,4.04mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物8(800mg)。收率:64.50%。
[1555]
步骤5):
[1556][1557]
将化合物8(200mg,0.65mmol)溶解在乙腈(5ml)中,然后加入化合物3(100mg,0.65mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27126(20mg)。收率:7.04%。
[1558]
化合物ab27126:
[1559]1h nmr(400mhz,dmso-d6)δ9.41(s,1h),8.58(s,1h),8.37(d,j=5.9hz,1h),8.18(s,1h),7.70(dd,j=33.1,12.2hz,3h),7.35(s,5h),7.16(s,1h),6.25(s,1h),5.68(s,2h),3.48(s,2h),3.04(d,j=9.3hz,1h),2.65(s,1h).
[1560]
ms-esi:理论值[m-br]
+
437.15,实测值:437.20。
[1561]
实施例57
[1562]
化合物ab27131的制备
[1563]
步骤1):
[1564][1565]
将化合物1(22g,100mmol)溶解在四氢呋喃(200ml)中,加入化合物2(10.5g,150mmol),在零下78度滴加正丁基锂(80ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=50:1)得到化合物3(13g)。收率:60.1%。
[1566]
步骤2):
[1567][1568]
将化合物3(6.48g,30mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入化合物硝酸银(1g,6mmol)和过硫酸钾(20g,270mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物4(584mg)。收率:9.0%。
[1569]
步骤3):
[1570][1571]
将化合物4(584mg,1.98mmol)溶解在二氯甲烷(20ml)中,再加入c8h
18
n2o2hbr3(820mg,1.98mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(670mg)。收率:94.7%。
[1572]
步骤4):
[1573]
[1574]
将化合物5(150mg,0.5mmol)和化合物6(105mg,0.5mmol)溶解在乙腈(10ml)中。在室温下搅拌3小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过薄层析纯化(甲醇:二氯甲烷=10%)得到化合物ab27131(30mg)。收率:11.9%。
[1575]
化合物ab27131:
[1576]1h nmr(400mhz,dmso-d6)δ9.29(s,1h),8.15(d,j=14.3hz,2h),8.05(dd,j=14.3,7.1hz,2h),7.73(d,j=7.4hz,1h),7.45
–
7.30(m,5h),6.90(d,j=6.3hz,1h),5.70(d,j=12.1hz,1h),4.77(s,1h),2.81(s,2h),2.59(s,4h),2.10(s,1h),1.88(s,1h).
[1577]
ms-esi:理论值[m-br]
+
423.17,实测值:423.17
[1578]
实施例58
[1579]
化合物ab27133的制备
[1580]
步骤1):
[1581][1582]
将化合物1(160g,1mmol)溶解在二氯甲烷(50ml)中,再加入化合物双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(414mg,1mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法(石油醚:乙酸乙酯=0-10%),得到化合物2(240mg)。收率:100%。
[1583]
步骤2):
[1584][1585]
将化合物2(240mg,1.0mmol)溶解在乙腈(10ml)中,然后加入化合物3(210mg,1.0mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化甲醇二氯甲烷=0-30%)得到化合物ab27133(70.0mg)。收率:18.97%。
[1586]
化合物ab27133:
[1587]1h nmr(400mhz,dmso-d6)δ9.47(s,1h),8.20(s,1h),8.12(d,j=6.4hz,1h),7.71(s,1h),7.48(d,j=7.2hz,1h),7.39(d,j=6.3hz,2h),7.34(d,j=6.5hz,4h),6.98(d,j=6.7hz,1h),5.72(d,j=11.3hz,1h),4.77(s,1h),3.33
–
3.27(m,1h),3.23(d,j=12.8hz,1h),3.12(d,j=15.4hz,1h),2.77(d,j=9.3hz,2h),2.57(s,1h),2.33(s,3h),2.08(s,1h),1.88(s,1h).
[1588]
ms-esi:理论值[m-br]
+
369.49,实测值:369.15。
[1589]
实施例59
[1590]
化合物ab27142的制备
[1591]
步骤1):
[1592][1593]
将化合物1(5.0g,22.72mmol)溶解在干燥的n-n-二甲基甲酰胺(100ml)中,再加入2(7.65g,68.16mmol),二甲基二茂铁二氯化钯(1.0g,1.2mmol),氯化锂(0.96mg,22.72mmol)和碳酸钠(4.8g,45.44mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物3(2.65g)。收率:56.89%。
[1594]
步骤2):
[1595][1596]
将化合物3(2.65g,12.99mmol)溶解在乙醇(100ml)中,再加入氢氧化钠(15.59g,389.70mmol),然后氮气置换三次,温度升至90℃搅拌过夜。点板检测新点出现,用水(20ml)稀释,然后加入二氯甲烷(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(1.1g)。收率:63.66%。
[1597]
步骤3):
[1598][1599]
将化合物4(260mg,2mmol)溶解在干燥的n-n-二甲基甲酰胺(10ml)中,再加入化合物5(253mg,1.5mmol),和碳酸钾(830mg,6mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化
(乙酸乙酯:石油醚=0-50%)得到化合物6(100mg)。收率:22.52%。
[1600]
步骤4):
[1601][1602]
将化合物6(100mg,0..45mmol)溶解在乙腈(10ml)中,再加入化合物7(116mg,0.45mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27142(12.1mg)。收率:6.70%。
[1603]
化合物27142:
[1604]1h nmr(400mhz,cd3od-d6)δ9.25(s,1h),8.38(d,j=6.2hz,1h),8.06
–
7.96(m,2h),7.66(d,j=14.5hz,2h),7.48(d,j=7.8hz,1h),7.33(d,j=16.3hz,5h),5.57(s,2h),3.47(t,j=13.4hz,1h),3.33(s,1h),3.04(s,1h),2.75(d,j=10.2hz,1h),2.44(s,4h).
[1605]
ms-esi:理论值[m-br]
+
401.91,实测值:401.10。
[1606]
实施例60
[1607]
化合物ab27144的制备
[1608]
步骤1):
[1609][1610]
将化合物1(22g,100mmol)溶解在四氢呋喃(200ml)中,加入化合物2(10.5g,150mmol),在零下78度滴加正丁基锂(80ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=50:1)得到化合物3(13g)。收率:60.1%。
[1611]
步骤2):
[1612][1613]
将化合物3(6.48g,30mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入化合物硝酸银(1g,6mmol)和过硫酸钾(20g,270mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物4(584mg)。收率:9.0%。
[1614]
步骤3):
[1615][1616]
将化合物4(584mg,1.98mmol)溶解在二氯甲烷(20ml)中,再加入c8h
18
n2o2hbr3(820mg,1.98mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(670mg)。收率:94.7%。
[1617]
步骤4):
[1618][1619]
将化合物5(150mg,0.5mmol)和化合物6(92mg,0.5mmol)溶解在乙腈(10ml)中。在室温下搅拌3小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过薄层析纯化(二氯甲烷:甲醇=10:1)得到化合物ab27144(30mg)。收率:12.6%。
[1620]
化合物ab27144:
[1621]1h nmr(400mhz,dmso-d6)δ9.33(s,1h),8.25(d,j=6.3hz,1h),8.12(d,j=11.7hz,2h),8.03(d,j=7.2hz,1h),7.71(d,j=7.9hz,1h),7.34(d,j=24.9hz,5h),7.02(s,2h),5.72(d,j=10.7hz,1h),4.58(d,j=4.9hz,2h),3.39(s,1h),2.83(s,1h),2.50(s,2h).
[1622]
ms-esi:理论值[m-br]
+
397.15,实测值:397.15。
[1623]
实施例61
[1624]
化合物ab27156的制备
[1625]
步骤1):
[1626][1627]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1628]
步骤2):
[1629][1630]
将化合物4(30g,124mmol)溶解在四氢呋喃(200ml)中,加入化合物5(10.46g,149mmol),置换氮气三次,在零下78℃滴加正丁基锂(100ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物6(11.2g)。收率:38.93%。
[1631]
步骤3):
[1632][1633]
将化合物6(11.2g,48mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入硝酸银(1.65g,9.7mmol)和过硫酸钾(32.6g,121mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去水和有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物7(930mg)。收率:8.42%。
[1634]
步骤4):
[1635][1636]
将化合物7(930mg,4.04mmol)溶解在二氯甲烷(20ml)中,再加入双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(1.68g,4.04mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物8(800mg)。收率:64.50%。
[1637]
步骤5):
[1638][1639]
将化合物8(200mg,0.65mmol)溶解在乙腈(5ml)中,然后加入化合物3(100mg,0.65mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27156(12mg)。收率:4.5%。
[1640]1h nmr(400mhz,dmso-d6)δ9.50(s,1h),8.25(d,j=6.7hz,1h),8.14(d,j=6.6hz,1h),7.76
–
7.66(m,2h),7.61(d,j=8.2hz,1h),7.34(d,j=24.9hz,5h),7.03(dd,j
=16.4,6.5hz,2h),5.75(d,j=10.8hz,1h),4.58(d,j=4.8hz,2h),3.24(s,3h),2.81(d,j=8.6hz,1h).
[1641]
ms-esi:理论值[m-br]
+
413.41,实测值:413.30。
[1642]
实施例62
[1643]
化合物ab27128的制备
[1644]
步骤1):
[1645][1646]
将化合物1(200mg,1.69mmol)溶解在n,n-二甲基甲酰胺(20ml)中,冰浴下加入nah(203mg,5.07mmol),在0℃下搅拌30分钟。再缓慢加入化合物2(318mg,1.86mmol)在室温下搅拌3小时,点板检测产生新点,加入水(30ml)和乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析(甲醇:二氯甲烷=0-10%)得到化合物3(200mg)。收率:56.9%
[1647]
步骤2):
[1648][1649]
将化合物4(200mg,1.05mmol)溶解在二氯甲烷(10ml)中,再加入双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(434mg,1.05mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(260mg)。收率:92.05%。
[1650]
步骤3):
[1651][1652]
将化合物3(125mg,0.65mmol)溶解在乙腈(10ml)中,再加入化合物5(260mg,0.96mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过薄层析法,得到化合物ab27128(20mg)。收率:7.73%
[1653]1h nmr(400mhz,dmso-d6)δ9.45(s,1h),8.61(dd,j=10.6,4.8hz,2h),8.52(dd,j=8.5,2.5hz,1h),8.41(d,j=7.1hz,1h),8.21(d,j=3.3hz,1h),7.83(d,j=8.5hz,1h),7.42
–
7.31(m,5h),7.21(d,j=3.2hz,1h),6.34(d,j=14.0hz,1h),5.71(s,2h),3.47(s,
2h),3.09(dd,j=13.3,5.7hz,1h),2.73(s,1h).
[1654]
ms-esi:理论值[m-br]+398.15,实测值:398.25。
[1655]
实施例63
[1656]
化合物ab27169的制备
[1657]
步骤1):
[1658][1659]
将化合物1(200mg,1.85mmol)溶解在无水乙醇(30ml)中,然后加入化合物2(236mg,236mmol),然后氮气置换三次,90度搅拌过夜。点板检测新点出现,然后加入硼氢化钠(210mg,5.55mmol),室温搅拌3h。点板检测新点出现,用水(20ml)淬灭,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物3(100mg)。收率:27.16%。
[1660]
步骤2):
[1661][1662]
将化合物3(100mg,0.5mmol)溶解在乙腈(10ml)中,然后加入化合物4(160mg,0.75mmol),然后氮气置换三次,80度搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27169(25mg)。收率:15.10%。
[1663]1h nmr(400mhz,dmso-d6)δ8.65(s,1h),8.10(s,2h),7.87(s,2h),7.38(d,j=12.9hz,8h),7.27(s,1h),6.89(s,1h),5.86(s,2h),4.64(s,2h),2.39(s,4h),2.20(s,3h).
[1664]
ms-esi:理论值[m-br]+331.18,实测值:331.30。
[1665]
实施例64
[1666]
化合物ab27166的制备
[1667]
步骤1):
[1668][1669]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1670]
步骤2):
[1671][1672]
将化合物3(184mg,1mmol)溶解在n,n,二甲基己酰胺(5ml)中,然后加入三乙胺(303mg,3mmol),然后氮气置换三次,零度搅拌30分钟,零度下加入化合物4(157mg,2mmol),室温反应,点板检测新点出现,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物5(180mg)。收率:79.2%。
[1673]
步骤3):
[1674][1675]
将化合物5(180mg,0.8mmol)溶解在乙腈(10ml)中,然后加入化合物6(426mg,2mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过制备纯化得到化合物ab27166(40mg)。收率:10.5%。
[1676]1h nmr(400mhz,dmso-d6)δ8.78(d,j=6.3hz,2h),8.16(d,j=6.3hz,2h),7.91(d,j=7.6hz,2h),7.43(d,j=7.6hz,2h),7.35(d,j=7.1hz,1h),7.27(d,j=7.2hz,3h),6.29(s,2h),5.32(s,2h),2.40(s,3h),2.38(s,2h).
[1677]
ms-esi:理论值[m-cf3coo]+359.44,实测值:359.20。
[1678]
实施例65
[1679]
化合物ab27170的制备
[1680]
步骤1):
[1681][1682]
将化合物1(1g,9.26mmol)溶解在乙醇(10ml)中,再加入化合物2(2.9g,27.78mmol),然后氮气置换三次,升温至90℃搅拌过夜小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(422mg,11.11mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(30ml)稀释,然后加入乙酸乙酯(20ml x 3)萃取,有机相合并后,饱和食盐水(20ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(1.5g)。收率:81.4%。
[1683]
步骤2):
[1684][1685]
将化合物3(100mg,0.51mmol)和化合物4(108mg,0.51mmol)溶解在乙腈(10ml)中。在80℃下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27170(75mg)。收率:29.4%。
[1686]1h nmr(400mhz,dmso-d6)δ9.20(d,j=24.3hz,1h),8.07(dd,j=48.5,6.5hz,1h),7.92(d,j=6.8hz,2h),7.40(dd,j=22.1,7.3hz,5h),7.31(s,1h),7.03
–
6.84(m,2h),5.96(s,2h),4.55(s,2h),2.40(s,3h),2.32(d,j=7.7hz,3h).
[1687]
ms-esi:理论值[m-br]+331.43,实测值:331.25。
[1688]
实施例66
[1689]
化合物ab24917的制备
[1690]
步骤1):
[1691][1692]
将化合物1(160mg,1mmol)溶解在醋酸(7ml)中,混合液中加入液溴(160mg,1.0mmol)、氢溴酸水溶液两滴,在室温下搅拌3小时。点板检测产生新点,加入冰水(30ml),加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,得到化合物2(260mg)。收率:90.0%。
[1693]
步骤2):
[1694][1695]
将化合物2(260mg,0.9mmol)溶解在乙腈(10ml)中,再加入3(165mg,0.9mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,有固体析出,过滤,滤饼用乙腈(2ml)洗涤三次,旋干得到化合物ab24917(45mg)。收率:14.57%
[1696]1h nmr(400mhz,dmso-d6)δ9.76(s,1h),8.30(d,j=7.2hz,1h),8.20(d,j=7.0hz,1h),7.82(d,j=7.8hz,1h),7.45
–
7.37(m,4h),7.34
–
7.30(m,1h),7.26(d,j=10.1hz,2h),7.17
–
7.11(m,1h),7.03
–
6.97(m,1h),5.76(dd,j=13.8,4.1hz,1h),4.60(d,j=5.4hz,2h),3.33
–
3.22(m,2h),3.12(d,j=16.4hz,1h),2.83
–
2.72(m,1h),2.46(s,1h),2.38(s,3h).
[1697]
ms-esi:理论值[m-br]+343.45,实测值:343.10。
[1698]
实施例67
[1699]
化合物ab24956的制备
[1700]
步骤1):
[1701][1702]
将化合物1(300mg,3.15mmol)溶解在乙腈(10ml)中,再加入2(671mg,2.35mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,点板检测新点出现,将反应液旋干,通过薄层析法,得到化合物3(600mg)。收率:83.54%
[1703]
步骤2):
[1704]
[1705]
将化合物3(200mg,0.87mmol)溶解在三氯氧磷(10ml)中,然后氮气置换三次,90度搅拌2h。点板检测新点出现,点板检测新点出现,将反应液旋干,拉干,得到化合物4(215mg粗品),直接投下一步。
[1706]
步骤3):
[1707][1708]
将化合物4(215mg,0.88mmol)溶解在n,n-二甲基甲酰胺(10ml)中,再加入化合物5(137mg,0.88mmol),再加入三乙胺(267mg,2.64mmol),然后氮气置换三次,80度搅拌过夜。点板检测新点出现,将反应液旋干,送制备得到化合物ab24956(20mg)。收率:6.91%
[1709]1h nmr(400mhz,dmso-d6)δ8.27(s,2h),7.92(d,j=6.6hz,2h),7.40(d,j=18.2hz,6h),7.08(s,2h),5.96(s,2h),4.95(s,4h),2.41(s,3h).
[1710]
ms-esi:理论值[m-cf3coo]+329.16,实测值:329.25。
[1711]
实施例68
[1712]
化合物ab27176的制备
[1713]
步骤1):
[1714][1715]
将化合物1(100mg,0.76mmol)溶解在干燥的n-n-二甲基甲酰胺(10ml)中,冰浴下加入氢化钠(61mg,1.56mmol),冰浴下搅拌10分钟,再加入2(130mg,0.76mmol),然后氮气置换三次,室温5h。点板检测新点出现,用水(20ml)稀释,然后加入乙酸乙酯(15ml x 3)萃取,有机相合并后,饱和食盐水(20ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物3(90mg)。收率:53.1%。
[1716]
步骤2):
[1717]
[1718]
将化合物3(90mg,0.4mmol)溶解在乙腈(10ml)中,再加入化合物4(116mg,0.48mmol),然后氮气置换三次,70℃搅拌过夜。点板检测新点出现,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27176(40mg)。收率:26.2%。
[1719]1h nmr(400mhz,dmso-d6)δ9.43(s,1h),8.54(s,1h),8.30(s,1h),7.89(s,1h),7.73(s,1h),7.50(s,1h),7.34(s,5h),6.13(d,j=12.3hz,1h),5.59(s,2h),3.21(s,2h),3.03(d,j=11.6hz,1h),2.62(s,1h),2.49(s,1h),2.48(s,3h),2.36(s,1h),2.34(s,3h).
[1720]
ms-esi:理论值[m-br]+381.49,实测值:381.10。
[1721]
实施例69
[1722]
化合物ab27174的制备
[1723]
步骤1):
[1724][1725]
将化合物1(10.0g,25.44mmol)溶解在干燥的n-n-二甲基甲酰胺(100ml)中,再加入2(15.3g,136mmol),二甲基二茂铁二氯化钯(2.0g,2.4mmol),氯化锂(1.82mg,45mmol)和碳酸钠(9.6g,90mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物3(5.3g)。收率:56.89%。
[1726]
步骤2):
[1727][1728]
将化合物3(3.2g,15.6mmol)溶解在乙醇(100ml)中,再加入氢氧化钠(18.7g,468mmol),然后氮气置换三次,温度升至90℃搅拌过夜。点板检测新点出现,用水(20ml)稀释,然后加入二氯甲烷(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(1.9g)。收率:63.66%。
[1729]
步骤3):
[1730][1731]
将化合物4(100mg,0.751mmol)溶解在干燥的n-n-二甲基甲酰胺(10ml)中,再加入5(95mg,0.751mmol),和碳酸钾(311mg,2.25mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(50ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和
食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物6(60mg)。收率:35.8%。
[1732]
步骤4):
[1733][1734]
将化合物6(60mg,0.269mmol)溶解在乙腈(10ml)中,再加入化合物7(78mg,0.269mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27174(20mg)。收率:18.54%。
[1735]1h nmr(400mhz,dmso-d6)δ9.49(s,1h),8.60(d,j=6.5hz,1h),8.34(d,j=6.5hz,1h),8.14(s,1h),8.06(d,j=7.6hz,1h),7.90(s,1h),7.77(d,j=7.7hz,1h),7.35(s,5h),6.37(d,j=11.0hz,1h),5.61(s,2h),3.09(d,j=10.1hz,1h),2.67(d,j=8.6hz,1h),2.35(s,3h).
[1736]
ms-esi:理论值[m-br]+435.41,实测值:435.35。
[1737]
实施例70
[1738]
化合物ab24948的制备
[1739]
步骤1):
[1740][1741]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1742]
步骤2):
[1743][1744]
将化合物4(200mg,1.22mmol)溶解在二氯甲烷(10ml)中,再加入双(n,n-二甲基乙
酰胺)二溴代溴酸氢盐(505mg,1.22mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(270mg)。收率:92.97%。
[1745]
步骤3):
[1746][1747]
将化合物3(140mg,0.74mmol)溶解在乙腈(10ml)中,再加入5(270mg,1.11mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,化合物ab24948(220mg)。收率:75.47%
[1748]1h nmr(400mhz,cd3od)δ10.19(s,1h),9.05(s,1h),8.94(s,1h),8.44
–
8.30(m,3h),8.15(d,j=25.3hz,5h),7.83(s,2h),6.52(s,1h),5.38(s,2h),4.03(d,j=15.5hz,2h),3.95(s,1h),3.60(d,j=8.4hz,1h).
[1749]
ms-esi:理论值[m-br]+347.16,实测值:347.10。
[1750]
实施例71
[1751]
化合物ab27163的制备
[1752]
步骤1):
[1753][1754]
将化合物1(1.19mg,10mmol)溶解在n,n,二甲基己酰胺(50ml)中,然后加入钠氢(480mg,20mmol),然后氮气置换三次,零度搅拌30分钟,零度下加入化合物2(1.85g,10mmol),室温反应,点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物3(1.2g)。收率:53.8%。
[1755]
步骤2):
[1756]
[1757]
将化合物3(100mg,0.45mmol)溶解在乙腈(10ml)中,然后加入化合物4(107.55mg,0.45mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27163(30mg)。收率:17.49%。
[1758]1h nmr(400mhz,dmso-d6)δ9.37(s,1h),8.54(s,1h),8.37
–
8.29(m,2h),7.72(s,1h),7.51(d,j=7.5hz,1h),7.42(d,j=7.0hz,2h),7.37(d,j=8.0hz,3h),7.30(d,j=6.8hz,1h),7.18(s,1h),6.14(dd,j=28.5,8.4hz,2h),3.19(d,j=15.1hz,2h),2.98(d,j=9.9hz,1h),2.64(s,1h),2.34(s,3h),1.97(d,j=6.4hz,3h).
[1759]
ms-esi:理论值[m-br]+381.49,实测值:381.20。
[1760]
实施例72
[1761]
化合物ab27184的制备
[1762]
步骤1):
[1763][1764]
化合物1(360mg,2.25mmol)溶解在二氯甲烷(10ml)中,然后加入化合物c8h18n2o2hbr3(929mg,2.25mmol),再加入一滴甲醇,然后氮气置换三次,室温搅拌1h。点板检测新点出现,减压浓缩减压除去有机溶剂,通过薄层层析(石油醚:乙酸乙酯=5:1)纯化得到化合物2(470mg)。收率:64.48%。
[1765]
步骤2):
[1766][1767]
将化合物2(116mg,0.5mmol)溶解在乙腈(10ml)中,然后加入化合物3(111mg,0.5mmol),然后氮气置换三次,80℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过薄层层析(二氯甲烷:甲醇=10:1)纯化得到化合物ab27184(104mg)。收率:46.73%。
[1768]1h nmr(400mhz,dmso-d6)δ9.37(s,1h),8.54(s,1h),8.33(d,j=11.0hz,2h),7.81(d,j=6.6hz,1h),7.31(dd,j=58.4,33.6hz,9h),6.17(s,1h),6.10(s,1h),3.18(d,j=18.2hz,2h),2.98(s,1h),2.64(s,1h),2.38(s,3h),1.96(s,3h).
[1769]
ms-esi:理论值[m-br]+381.49,实测值:381.30
[1770]
实施例73
[1771]
化合物ab27162的制备
[1772]
步骤1):
[1773][1774]
将化合物1(1.19g,10mmol)溶解在n,n,二甲基己酰胺(50ml)中,然后加入钠氢(480mg,20mmol),然后氮气置换三次,零度搅拌30分钟,零度下加入化合物2(1.85g,10mmol),室温反应,点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物3(1.2g)。收率:53.8%。
[1775]
步骤2):
[1776][1777]
将化合物4(30g,124mmol)溶解在四氢呋喃(200ml)中,加入化合物5(10.46g,149mmol),置换氮气三次,在零下78℃滴加正丁基锂(100ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物6(11.2g)。收率:38.93%。
[1778]
步骤3):
[1779][1780]
将化合物6(11.2g,48mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入硝酸银(1.65g,9.7mmol)和过硫酸钾(32.6g,121mmol),,在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去水和有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物7(930mg)。收率:8.42%。
[1781]
步骤4):
[1782][1783]
将化合物7(930mg,4.04mmol)溶解在二氯甲烷(20ml)中,再加入双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(1.68g,4.04mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物8(800mg)。收率:64.50%。
[1784]
步骤5):
[1785][1786]
将化合物3(100mg,0.45mmol)溶解在乙腈(10ml)中,然后加入化合物8(138mg,0.45mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27162(30.0mg)。收率:14.78%。
[1787]1h nmr(400mhz,dmso-d6)δ9.39(s,1h),8.56(s,1h),8.36(s,2h),7.70(dd,j=33.7,12.2hz,3h),7.46
–
7.26(m,5h),7.20(s,1h),6.19(s,2h),3.34(s,2h),3.02(d,j=10.4hz,1h),2.64(s,1h),1.97(d,j=6.4hz,3h).
[1788]
ms-esi:理论值[m-br]+451.16,实测值:451.35。
[1789]
实施例74
[1790]
化合物ab27145的制备
[1791]
步骤1):
[1792][1793]
将化合物1(236mg,2.0mmol)溶解在的n-n-二甲基甲酰胺(10ml)中,在冰浴条件下加入氢化钠(24mg,1.0mmol),然后氮气置换三次,冰浴下搅拌30分钟,再在冰浴条件下缓慢滴加化合物2(408mg,2.4mmol),室温搅拌90分钟。点板检测新点出现,用冰水(20ml)稀释,然后加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物3(200mg)。收率:62.5%。
[1794]
步骤2):
[1795][1796]
将化合物3(60mg,0.31mmol)溶解在乙腈(10ml)中,然后加入化合物4(100mg,0.31mmol),然后氮气置换三次,60℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机
溶剂,通过薄层层析纯化得到化合物ab27145(30mg)。收率:24.88%。
[1797]1h nmr(400mhz,dmso-d6)δ9.37(s,1h),8.57(d,j=6.7hz,1h),8.34(d,j=6.6hz,1h),8.07(s,1h),7.80
–
7.71(m,2h),7.67(d,j=8.1hz,1h),7.13(s,1h),6.21(d,j=12.0hz,1h),4.37(s,2h),3.33(s,2h),3.06(d,j=10.1hz,1h),2.69(s,1h),1.84(d,j=7.0hz,2h),0.84(t,j=6.8hz,3h).
[1798]
ms-esi:理论值[m-br]+389.39,实测值:389.05。
[1799]
实施例75
[1800]
化合物ab27129的制备
[1801]
步骤1):
[1802][1803]
将化合物1(5.5g,25mmol)溶解在n,n-二甲基甲酰胺(200ml)中,加入化合物2(52.5ml),再加入碘化亚铜(237mg,1.25mmol),再加入n,n-二异丙基乙胺(10.0g,80mmol),再加入双三苯基膦二氯化钯(525.75mg,0.75mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物3(2.25g)。收率:67.67%。
[1804]
步骤2):
[1805][1806]
将化合物3(2.25g,17mmol)溶解在1,4-二氧六环(20ml)中,加入叔丁醇钾(51ml),在110℃下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(1.2g)。收率:54.3%。
[1807]
步骤3):
[1808][1809]
将化合物4(550mg,4.2mmol)溶解在n,n二甲基甲酰胺(10ml)中,冰浴下再加入化合物钠氢(304mg,12.7mmol),在室温下搅拌3小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(294mg)。收率:31.53%。
[1810]
步骤4):
[1811][1812]
将化合物5(100mg,0.5mmol)溶解在乙腈(10ml)中,然后加入化合物6(129mg,0.5mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=10%)得到化合物ab27129(40mg)。收率:16.67%。
[1813]1h nmr(400mhz,dmso-d6)δ9.11(s,1h),8.36(d,j=6.4hz,1h),8.06
–
7.93(m,2h),7.66(d,j=7.5hz,1h),7.48(d,j=7.8hz,1h),7.34(d,j=6.5hz,3h),7.08(d,j=6.2hz,2h),6.93(s,1h),5.67(s,2h),3.44(d,j=12.1hz,1h),3.33(s,1h),3.00(s,1h),2.77(s,1h),2.53(s,3h).
[1814]
ms-esi:理论值[m-br]+401.91,实测值:401.20。
[1815]
实施例76
[1816]
化合物ab27161的制备
[1817]
步骤1):
[1818][1819]
将化合物1(1.19g,10mmol)溶解在n,n,二甲基己酰胺(50ml)中,然后加入钠氢(480mg,20mmol),然后氮气置换三次,零度搅拌30分钟,零度下加入化合物2(1.85g,10mmol),室温反应,点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物3(1.2g)。收率:53.8%。
[1820]
步骤2):
[1821][1822]
将化合物3(111mg,0.5mmol)溶解在乙腈(10ml)中,然后加入化合物4(146mg,0.5mmol),然后氮气置换三次,80℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机
溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27161(90mg)。收率:41.37%。
[1823]1h nmr(400mhz,dmso-d6)δ9.47(s,1h),8.62(d,j=6.1hz,1h),8.38(s,2h),8.21
–
8.01(m,2h),7.76(d,j=7.7hz,1h),7.57
–
7.16(m,6h),6.42(d,j=13.2hz,1h),6.21(d,j=5.8hz,1h),3.44(d,j=13.0hz,2h),3.05(d,j=11.5hz,1h),2.69(s,1h),1.97(d,j=6.2hz,3h).
[1824]
ms-esi:理论值[m]+435.47,实测值:435.25。
[1825]
实施例77
[1826]
化合物ab27165的制备
[1827]
步骤1):
[1828][1829]
将化合物1(100mg,0.5mmol)溶解在乙腈(10ml)中,然后加入化合物2(130.0mg,0.5mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27165(80.0mg)。收率:39.90%。
[1830]1h nmr(400mhz,dmso-d6)δ9.47(s,1h),8.61(d,j=5.8hz,1h),8.45
–
8.30(m,2h),7.83(s,1h),7.75(d,j=7.7hz,1h),7.54(d,j=7.7hz,1h),7.44(d,j=6.1hz,2h),7.32(dd,j=22.8,3.1hz,3h),7.19(s,1h),6.38(d,j=12.2hz,1h),6.21(d,j=5.5hz,1h),3.33
–
3.11(m,2h),3.02(d,j=11.2hz,1h),2.65(s,1h),1.96(d,j=5.5hz,3h).
[1831]
ms-esi:理论值[m-br]+401.91,实测值401.10。
[1832]
实施例78
[1833]
化合物ab24961的制备
[1834]
步骤1):
[1835][1836]
将化合物1(202mg,1.09mmol)溶解在乙腈(10ml)中,再加入化合物2(250mg,1.09mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过薄层析法,得到化合物ab24961(40mg)。收率:10.65%
[1837]1h nmr(400mhz,dmso-d6)δ10.47(s,1h),8.88(s,1h),8.27(d,j=6.7hz,1h),
7.81(d,j=7.5hz,1h),7.37(d,j=3.3hz,3h),7.25(d,j=7.9hz,2h),7.03(d,j=7.2hz,1h),5.70(d,j=9.9hz,1h),4.73(d,j=5.0hz,2h),2.74(d,j=9.9hz,1h),2.37(s,4h),2.06(s,3h).
[1838]
ms-esi:理论值[m-br]+344.44,实测值344.10。
[1839]
实施例79
[1840]
化合物ab27158的制备
[1841]
步骤1):
[1842][1843]
化合物1(700mg,6mmol)溶解在二氯甲烷(80ml)中,然后加入化合物环丙基硼酸(1.5g,18mmol),三乙胺(1.2g,12mmol),醋酸铜(1.2g,6mmol)然后氧气置换三次,室温搅拌过夜。点板检测新点出现,用水(20ml)稀释,然后加入二氯甲烷(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物2(170mg)。收率:15.58%。
[1844]
步骤2):
[1845][1846]
将化合物2(85mg,0.5mmol)溶解在乙腈(10ml)中,然后加入化合物3(150mg,0.5mmol),然后氮气置换三次,80℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过制备纯化得到化合物ab27158(40mg)。收率:15.99%。
[1847]1h nmr(400mhz,dmso-d6)δ9.35(s,1h),8.58(d,j=6.3hz,1h),8.25(d,j=6.3hz,1h),8.00(s,1h),7.71(dd,j=35.0,14.5hz,3h),7.07(s,1h),6.18(d,j=12.2hz,1h),3.76(s,1h),3.05(s,1h),2.65(s,1h),2.49(s,2h),1.14(d,j=22.5hz,4h).
[1848]
ms-esi:理论值[m-cf3coo]+387.37,实测值:387.10
[1849]
实施例80
[1850]
化合物ab27155的制备
[1851]
步骤1):
[1852][1853]
将化合物1(236mg,2.0mmol)溶解在的n-n-二甲基甲酰胺(10ml)中,在冰浴条件下加入氢化钠(24mg,1mmol),然后氮气置换三次,冰浴下搅拌30分钟,再在冰浴条件下缓慢注射碘乙烷(374mg,2.4mmol),室温搅拌90分钟。点板检测新点出现,用水(20ml)稀释,减压浓缩减压除去有机溶剂,得到粗品用甲醇过滤,滤液减压浓缩减压除去有机溶剂,通过薄层层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物2(185mg)。收率:62.9%。
[1854]
步骤2):
[1855][1856]
将化合物4(30g,124mmol)溶解在四氢呋喃(200ml)中,加入化合物5(10.46g,149mmol),置换氮气三次,在-78℃滴加正丁基锂(100ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物6(11.2g)。收率:38.93%。
[1857]
步骤3):
[1858][1859]
将化合物6(11.2g,48mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入硝酸银(1.65g,9.7mmol)和过硫酸钾(32.6g,121mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去水和有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物7(930mg)。收率:8.42%。
[1860]
步骤4):
[1861][1862]
将化合物7(930mg,4.04mmol)溶解在二氯甲烷(20ml)中,再加入双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(1.68g,4.04mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物8(800mg)。收率:64.50%。
[1863]
步骤5):
[1864][1865]
将化合物2(90mg,0.61mmol)溶解在乙腈(10ml)中,然后加入化合物8(472mg,1.53mmol),然后氮气置换三次,80℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27155(20mg)。收率:8.7%。
[1866]1h nmr(400mhz,dmso-d6)δ9.37(s,1h),8.58(d,j=6.4hz,1h),8.32(d,j=6.6hz,1h),8.10(s,1h),7.71(dd,j=34.7,14.4hz,3h),7.13(s,1h),6.23(d,j=9.9hz,1h),4.44(d,j=6.7hz,2h),3.33(s,2h),3.06(d,j=12.7hz,1h),2.67(s,1h),1.42(dd,j=6.5hz,3h).
[1867]
ms-esi:理论值[m-br]+375.36,实测值:375.20。
[1868]
实施例81
[1869]
化合物ab27104的制备
[1870]
步骤1):
[1871][1872]
将化合物1(22g,100mmol)溶解在四氢呋喃(200ml)中,加入化合物2(10.5g,150mmol),在零下78度滴加正丁基锂(80ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=50:1)得到化合物3(12g)。收率:55.30%。
[1873]
步骤2):
[1874][1875]
将化合物3(12g,55.6mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入化合物硝酸银(1.89g,11.12mmol)和过硫酸钾(37g,139mmol),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=10:1)得到化合物4(3.1g)。收率:25.93%。
[1876]
步骤3):
[1877][1878]
将化合物4(1.5g,6.9mmol)溶解在二氯甲烷(20ml)中,再加c8h18n2o2hbr3(2.9g,6.9mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析法,得到化合物5(2.2g)。收率:854.48%。
[1879]
步骤4):
[1880][1881]
将化合物5(150mg,0.5mmol)溶解在乙腈(5ml)中,然后加入化合物6(105mg,0.5mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab27104(20mg)。收率:7.96%。
[1882]1h nmr(400mhz,dmso-d6)δ9.29(s,1h),8.17(s,1h),8.09(s,2h),7.91(s,1h),7.78(d,j=7.8hz,1h),7.38(d,j=21.0hz,6h),6.90(d,j=6.8hz,1h),5.70(d,j=13.2hz,1h),4.77(s,1h),3.32(s,2h),2.81(s,2h),2.62(s,1h),2.10(s,1h),1.88(s,1h).
[1883]
ms-esi:理论值[m-br]+423.45,实测值:423.25。
[1884]
实施例82
[1885]
化合物ab27154的制备
[1886]
步骤1):
[1887][1888]
将化合物1(500mg,4.23mmol)溶解在的n-n-二甲基甲酰胺(10ml)中,在冰浴条件下加入氢化钠(304.56mg,12.7mmol),然后氮气置换三次,冰浴下搅拌30分钟,再在冰浴条件下缓慢注射碘甲烷(723.89mg,5.1mmol),室温搅拌90分钟。点板检测新点出现,用水(20ml)稀释,减压浓缩减压除去有机溶剂,得到粗品用甲醇过滤,滤液减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=10%)得到化合物2(479mg)。收率:85.78%。
[1889]
步骤2):
[1890][1891]
将化合物2(100mg,0.76mmol)加入乙腈(10ml)中,再加入化合物3(233mg,0.76mmol),80℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,滤液减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=10%)得到化合物ab27154(40mg)。收率:11.10%。
[1892]1h nmr(400mhz,dmso-d6)δ9.35(s,1h),8.56(d,j=6.8hz,1h),8.24(d,j=6.8hz,1h),7.99(s,1h),7.81
–
7.70(m,2h),7.67(d,j=8.2hz,1h),7.11(s,1h),6.16(d,j=11.0hz,1h),4.01(s,3h),3.33(s,2h),3.06(d,j=8.6hz,1h),2.67(d,j=11.1hz,1h).
[1893]
ms-esi:理论值[m-cf3coo]+361.34,实测值:361.05
[1894]
实施例83
[1895]
化合物ab24999的制备
[1896]
步骤1):
[1897][1898]
将化合物1(4.4g,20mmol)溶解在干燥的n,n-二甲基甲酰胺(150ml)中,再加入化合物2(4.28g,42mmol),双三苯基膦二氯化钯(421mg,0.6mol),n,n-二异丙基乙胺(8.25g,64mmol)和碘化亚铜(190mg,1mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,用水(250ml)稀释,然后加入乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-50%)得到化合物3(3.5g)。收率:89.74%。
[1899]
步骤2):
[1900][1901]
将化合物3(3.5g,17.9mmol)溶解在二氧六环(100ml)中,再加入1摩尔的叔丁醇钾的四氢呋喃溶液(53.8ml),然后氮气置换三次,温度升至110℃搅拌16小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(100ml x 3)萃取,有机相合并后,饱和食盐水(300ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(2.2g)。收率:62.8%
[1902]
步骤3):
[1903][1904]
将化合物4(800mg,4.12mmol)溶解在冰醋酸(50ml)中。在加入钯碳(100mg),在氢气条件下80℃搅拌16小时。点板检测产生新点,用硅藻土过滤,滤液旋干通过制备纯化得到化合物5(100mg)。收率:12.3%。
[1905]
步骤4):
[1906][1907]
将化合物5(70mg,0.35mmol)溶解在丙酮(10ml)中,再加入6(286mg,0.76mmol)和乙酸钠(143mg,1.75mmol),然后氮气置换三次,80℃搅拌2小时。点板检测新点出现,点板检测新点出现,减压浓缩减压除去有机溶剂,通过薄层层析纯化得到化合物ab24999(21.8mg)。收率:15.5%
[1908]1h nmr(400mhz,dmso-d6)δ9.48(s,1h),8.14(d,j=7.5hz,2h),8.08(d,j=7.1hz,1h),7.95(s,1h),7.62(d,j=8.0hz,2h),7.40(d,j=6.7hz,2h),7.35(s,3h),6.85(d,j=6.8hz,1h),5.93(s,2h),5.39(s,1h),3.76
–
3.66(m,1h),2.99(d,j=18.1hz,1h).
[1909]
ms-esi:理论值[m-br]+399.39,实测值:399.10。
[1910]
实施例84
[1911]
化合物ab24988的制备
[1912]
步骤1):
[1913][1914]
将化合物1(100mg,0.85mmol)溶解在干燥的n-n-二甲基甲酰胺(10ml)中,冰浴下加入氢化钠(68mg,1.69mmol),冰浴下搅拌10分钟,再加入2(145mg,0.85mmol),然后氮气置换三次,室温5h。点板检测新点出现,用水(20ml)稀释,然后加入乙酸乙酯(15ml x 3)萃取,有机相合并后,饱和食盐水(20ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物3(90mg)。收率:50.90%。
[1915]
步骤2):
[1916][1917]
将化合物3(100mg,0.48mmol)溶解在乙腈(10ml)中,再加入4(136mg,0.48mmol),然后氮气置换三次,室温搅拌过夜。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24988(50mg)。收率:25.34%。
[1918]1h nmr(400mhz,dmso-d6)δ9.26(s,1h),8.46(s,1h),8.35(s,1h),8.18(d,j=8.9hz,3h),7.64(d,j=7.0hz,2h),7.34(s,5h),7.19(s,1h),6.39(s,2h),5.67(s,2h).
[1919]
ms-esi:理论值[m-br]+411.40,实测值:411.30。
[1920]
实施例85
[1921]
化合物ab27149的制备
[1922]
步骤1):
[1923][1924]
将化合物1(22g,100mmol)溶解在四氢呋喃(200ml)中,加入化合物2(10.5g,150mmol),在零下78度滴加正丁基锂(80ml,2.5mol/l),在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=50:1)得到化合物3(13g)。收率:60.3%。
[1925]
步骤2):
[1926][1927]
将化合物3(6.48g,30mmol)溶解在二氯甲烷(100ml)和水(100ml)中,加入化合物硝酸银(1g,6mmol)和过硫酸钾(20g,270mmol),,在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(石油醚:乙酸乙酯=0-10%)得到化合物4(584mg)。收率:9.0%。
[1928]
步骤3):
[1929][1930]
将化合物4(584mg,1.98mmol)溶解在二氯甲烷(20ml)中,再加入c8h
18
n2o2hbr3(820mg,1.98mmol),在室温下搅拌1小时。点板检测产生新点,将反应液旋干,通过薄层析
法,得到化合物5(670mg)。收率:94.7%。
[1931]
步骤4):
[1932][1933]
将化合物6(236mg,2.0mmol)溶解在的n-n-二甲基甲酰胺(10ml)中,在冰浴条件下加入氢化钠(24mg,1mmol),然后氮气置换三次,冰浴下搅拌30分钟,再在冰浴条件下缓慢注射碘乙烷(374mg,2.4mmol),室温搅拌90分钟。点板检测新点出现,用水(20ml)稀释,减压浓缩减压除去有机溶剂,得到粗品用甲醇过滤,滤液减压浓缩减压除去有机溶剂,通过薄层层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物7(185mg)。收率:62.9%。
[1934]
步骤5):
[1935][1936]
将化合物7(50mg,0.34mmol)加入乙腈(10ml)中,再加入化合物5(100mg,0.34mmol),80℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,滤液减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=10%)得到化合物ab27149(13.1mg)。收率:10.7%。
[1937]1h nmr(400mhz,cd3od-d4)δ9.23(s,1h),8.44(d,j=6.6hz,1h),8.28(s,1h),8.14(d,j=6.6hz,1h),7.94(s,2h),7.70(d,j=7.7hz,1h),7.10(s,1h),6.05(d,j=13.8hz,1h),4.48(d,j=7.0hz,2h),3.55(d,j=13.6hz,1h),3.43(d,j=16.8hz,1h),3.07(d,j=10.6hz,1h),2.81(d,j=10.1hz,1h),1.54(dd,j=6.9hz,3h).
[1938]
ms-esi:理论值[m-br]+359.36,实测值:359.25。
[1939]
实施例86
[1940]
化合物ab27118的制备
[1941]
步骤1):
[1942][1943]
将化合物1(300mg,4.05mmol)溶解在n,n-二甲基乙酰胺(20ml)中,在加入化合物2(259mg,2.02mmol)、三乙烯二胺(585.8.mg,2.02mmol)、双(二亚芐基丙酮)钯(92.4mg,0.1mmol)、四氟硼酸三叔丁基膦(678mg,6.06mmol),在110℃下搅拌16小时。点板检测产生
新点,用水和乙酸乙酯(10ml)萃取,有机相减压浓缩得到残余物,残余物经柱层析(甲醇:二氯甲烷=10%)纯化得到化合物3(100mg)。收率:34.8%
[1944]
步骤2):
[1945][1946]
将化合物3(50mg,0.225mmol)溶解在乙腈(10ml)中,再加入化合物4(160mg,0.56mmol),然后氮气置换三次,温度升至110℃搅拌2小时。点板检测新点出现,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab27118(22.9mg)。收率:24.8%。
[1947]1hnmr(400mhz,dmso-d6)δ9.14(s,1h),8.24(s,3h),8.18(s,1h),8.04(s,3h),7.19(s,2h),7.09(s,2h),6.41(s,2h),4.13(s,2h),2.23(s,3h).
[1948]
ms-esi:理论值[m-br]+409.42,实测值:409.20。
[1949]
实施例87
[1950]
化合物ab24987的制备
[1951]
步骤1):
[1952][1953]
将化合物1(100mg,0.85mmol)溶解在干燥的n-n-二甲基甲酰胺(10ml)中,冰浴下加入氢化钠(68mg,1.69mmol),冰浴下搅拌10分钟,再加入2(145mg,0.85mmol),然后氮气置换三次,室温5h。点板检测新点出现,用水(20ml)稀释,然后加入乙酸乙酯(15ml x 3)萃取,有机相合并后,饱和食盐水(20ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物3(90mg)。收率:50.90%。
[1954]
步骤2):
[1955][1956]
将化合物3(100mg,0.48mmol)溶解在乙腈(10ml)中,再加入4(136mg,0.48mmol),然后氮气置换三次,室温搅拌过夜。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24987(50mg)。收率:26.37%。
[1957]1h nmr(400mhz,dmso-d6)δ9.29(s,1h),8.48(s,1h),8.36(d,j=5.3hz,1h),8.24(s,2h),8.18(s,1h),8.04(d,j=5.9hz,2h),7.35(s,5h),7.21(s,1h),6.44(s,2h),5.68(s,2h).
[1958]
ms-esi:理论值[m-br]
+
395.40,实测值:395.25。
[1959]
实施例88
[1960]
化合物ab27148的制备
[1961]
步骤1):
[1962][1963]
将化合物1(500mg,4.23mmol)溶解在的n-n-二甲基甲酰胺(10ml)中,在冰浴条件下加入氢化钠(304.56mg,12.7mmol),然后氮气置换三次,冰浴下搅拌30分钟,再在冰浴条件下缓慢注射碘甲烷(723.89mg,5.1mmol),室温搅拌90分钟。点板检测新点出现,用水(20ml)稀释,减压浓缩减压除去有机溶剂,得到粗品用甲醇过滤,滤液减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=10%)得到化合物2(479mg)。收率:85.78%。
[1964]
步骤2):
[1965][1966]
将化合物2(100mg,0.76mmol)加入乙腈(10ml)中,再加入化合物3(200mg,0.76mmol),80℃搅拌过夜。点板检测新点出现,减压浓缩减压除去有机溶剂,滤液减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=10%)得到化合物ab27148(40mg)。收率:18.81%。
[1967]1h nmr(400mhz,dmso-d6)δ9.36(s,1h),8.57(d,j=6.7hz,1h),8.25(d,j=6.5hz,1h),8.14(s,1h),8.07(d,j=7.7hz,1h),8.00(s,1h),7.77(d,j=7.9hz,1h),7.11(s,1h),6.22(d,j=10.6hz,1h),4.01(s,3h),3.40(s,2h),3.08(s,1h),2.70(s,1h).
[1968]
ms-esi:理论值[m-br]
+
345.34,实测值:345.05
[1969]
实施例89
[1970]
化合物ab24852的制备
[1971]
步骤1):
[1972][1973]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,
53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1974]
步骤2):
[1975][1976]
将化合物3(368mg,2mmol)和4(1.2g,6mmol)溶解在乙腈(10ml)中。在80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,点板检测新点出现,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24852(107.3mg)。收率:12.5%。
[1977]
化合物ab24852:
[1978]1h nmr(400mhz,dmso-d6)δ9.61(s,1h),8.69(s,1h),8.56(d,j=8.2hz,1h),8.42(d,j=7.5hz,1h),8.19(d,j=6.7hz,1h),8.09(d,j=6.8hz,1h),7.93(t,j=7.8hz,1h),7.39(s,4h),7.31(s,1h),7.11(d,j=6.8hz,1h),7.04(d,j=6.6hz,1h),6.06(s,2h),4.58(d,j=4.6hz,2h).
[1979]
ms-esi:理论值[m-br]
+
348.37,实测值:348.30。
[1980]
实施例90
[1981]
化合物ab24807a的制备
[1982]
步骤1):
[1983][1984]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1985]
步骤2):
[1986][1987]
将化合物3(368mg,2mmol)和4(1.2g,6mmol)溶解在乙腈(10ml)中。在80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,将反应液旋干送制备得到化合物ab24807a(22.9mg)。收率:3.7%。
[1988]
化合物ab24807a:
[1989]
1h nmr(400mhz,dmso-d6)δ9.41(s,1h),8.15(d,j=7.2hz,1h),8.04(d,j=7.4hz,1h),7.97(d,j=7.7hz,2h),7.70(d,j=6.7hz,1h),7.58(t,j=7.5hz,2h),7.35(d,j=4.1hz,4h),7.28(d,j=3.7hz,1h),7.01(dd,j=16.5,7.3hz,2h),5.92(s,2h),4.54(d,j=5.5hz,2h).
[1990]
ms-esi:理论值[m-br]
+
303.30,实测值:303.25。
[1991]
实施例91
[1992]
化合物ab24803a的制备
[1993]
步骤1):
[1994][1995]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200mlx3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[1996]
步骤2):
[1997][1998]
将化合物3(500mg,2.72mmol)和化合物4(1.23g,5.42mmol)溶解在乙腈(10ml)中。
在80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,将反应液旋干送制备得到化合物ab24803a(100mg)。收率:11.08%。
[1999]
化合物ab24803a:
[2000]1h nmr(400mhz,dmso,d6)δ9.19(s,0h),8.13(s,0h),8.03(s,0h),7.96(d,j=8.1hz,1h),7.36(s,2h),7.11(d,j=8.2hz,1h),6.99(s,1h),5.84(s,1h),4.56(s,1h),3.85(s,3h).
[2001]
ms-esi:理论值[m-cf3coo]
+
333.16,实测值:333.30。
[2002]
实施例92
[2003]
化合物ab24810a的制备
[2004]
步骤1):
[2005][2006]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2007]
步骤2):
[2008][2009]
将化合物3(500mg,2.72mmol)和化合物4(1.5g,5.43mmol)溶解在乙腈(10ml)中。氮气置换三次,开启搅拌,将反应升温至80℃,搅拌反应16小时。减压蒸馏除去乙腈,通过制备纯化得到化合物ab24810a(120mg)。收率:26.8%。
[2010]
化合物ab24810a:
[2011]1h nmr(399mhz,dmso-d6)δ9.25(s,1h),8.15(d,j=6.3hz,1h),8.04(d,j=6.8hz,1h),7.96(d,j=7.4hz,1h),7.63(s,2h),7.55(s,1h),7.37(d,j=6.3hz,4h),7.30(s,1h),7.01(s,2h),5.80(s,2h),4.56(d,j=5.8hz,2h).
[2012]
ms-esi:理论值[m-cf3coo]
+
387.38,实测值:387.30。
[2013]
实施例93
[2014]
化合物ab24805a的制备
[2015]
步骤1):
[2016][2017]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2018]
步骤2):
[2019][2020]
将化合物3(552mg,3mmol)溶解在乙腈(20ml)中,再加入化合物4(2.1g,9mmol),然后氮气置换三次,升温至80℃搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通过制备纯化得到化合物ab24805a(24.4mg)。收率:2.4%。
[2021]
化合物ab24805a:
[2022]
1h nmr(400mhz,dmso-d6)δ9.24(s,1h),8.13(d,j=7.0hz,1h),8.01(s,2h),7.93(d,j=7.6hz,1h),7.80(s,1h),7.64(s,1h),7.37(d,j=6.6hz,4h),7.30(s,1h),7.01(s,2h),5.89(s,2h),4.56(d,j=5.9hz,2h).
[2023]
ms-esi:理论值[m-cf3coo]
+
337.82,实测值:337.30。
[2024]
实施例94
[2025]
化合物ab24808a的制备
[2026]
步骤1):
[2027][2028]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检
测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2029]
步骤2):
[2030][2031]
将化合物3(500mg,2.72mmol)和4(1.5g,5.43mmol)溶解在乙腈(10ml)中。在80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,将反应液旋干送制备得到化合物ab24808a(120mg)。收率:11.6%。
[2032]
化合物ab24808a:
[2033]1h nmr(400mhz,dmso-d6)δ9.24(s,1h),8.13(d,j=6.8hz,1h),8.01(d,j=7.7hz,1h),7.91(d,j=8.4hz,2h),7.83(d,j=6.9hz,2h),7.33(d,j=23.6hz,5h),7.00(s,2h),5.87(s,2h),4.56(d,j=5.7hz,2h).
[2034]
ms-esi:理论值[m-cf3coo]
+
382.27,实测值:382.95。
[2035]
实施例95
[2036]
化合物ab24845a的制备
[2037]
步骤1):
[2038][2039]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2040]
步骤2):
[2041][2042]
将化合物3(184mg,1mmol)溶解在乙腈(10ml)中,再加入4(426mg,2mmol),然后氮气置换三次,升温至80℃搅拌过夜。点板检测新点出现,直接减压浓缩减压除去有机溶剂,通过制备纯化得到化合物ab24845a(23.2mg)。收率:5.3%.
[2043]
化合物ab24845a:
[2044]1h nmr(400mhz,dmso-d6)δ9.24(s,1h),8.16(d,j=6.8hz,1h),8.05(d,j=6.7hz,1h),7.90(d,j=8.0hz,2h),7.42(d,j=7.6hz,2h),7.38(s,4h),7.32(s,1h),7.01(s,2h),5.89(s,2h),4.57(d,j=5.6hz,2h),2.41(s,3h).
[2045]
ms-esi:理论值[m-cf3coo]+317.40,实测值:317.35。
[2046]
实施例96
[2047]
化合物ab24955的制备
[2048]
步骤1):
[2049][2050]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2051]
步骤2):
[2052][2053]
将化合物3(368mg,2mmol)溶解在n,n-二甲基甲酰胺(8ml)中,在冰浴下加入氢化钠(120mg,5mmol)在0℃下搅拌1小时。然后缓慢加入碘甲烷(284mg,2mmol),恢复到室温搅拌过夜。点板检测产生新点,用水和乙酸乙酯(10ml)萃取,有机相减压浓缩得到残余物,残
余物经柱层析(甲醇:二氯甲烷=10%)纯化得到化合物4(100mg)。
[2054]
收率:25.25%
[2055]
步骤3):
[2056][2057]
将化合物4(100m g,1.07mmol)溶解在乙腈(5ml)中,然后加入化合物5(80m g,0.40mmol),然后氮气置换三次,室温搅拌过夜。点板检测新点出现,将反应液旋干,通过制备纯化得到化合物ab24955(24.8mg)。收率:5.2%。
[2058]
化合物ab24955:
[2059]1h nmr(400mhz,dmso-d6)δ8.23(s,1h),8.13(s,1h),7.90(d,j=7.3hz,2h),7.41(d,j=7.7hz,2h),7.36(d,j=6.8hz,2h),7.31(d,j=6.6hz,1h),7.24(d,j=6.7hz,2h),7.18(d,j=6.2hz,2h),5.91(s,2h),4.89(s,2h),3.28(s,3h),2.40(s,3h).
[2060]
ms-esi:理论值[m-cf3coo]
+
331.43,实测值:331.30。
[2061]
实施例97
[2062]
化合物ab24809a的制备
[2063]
步骤:
[2064][2065]
将化合物1(500mg,2.72mmol)和2(1.5g,5.43mmol)溶解在乙腈(10ml)中。在80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,将反应液旋干送制备得到化合物ab24809a(120mg)。收率:11.89%。
[2066]
化合物ab24809a:
[2067]1h nmr(400mhz,dmso-d6)δ9.25(s,1h),8.17(d,j=7.4hz,3h),7.99(d,j=7.9hz,3h),7.36(s,5h),7.01(s,2h),5.94(s,2h),4.56(s,2h).
[2068]
ms-esi:理论值[m-cf3coo]
+
371.38,实测值:371.30。
[2069]
实施例98
[2070]
化合物ab24983的制备
[2071]
步骤1):
[2072][2073]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2074]
步骤2):
[2075][2076]
将化合物3(368mg,2mmol)和4(1.2g,6mmol)溶解在乙腈(10ml)中。在80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,点板检测新点出现,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(甲醇:二氯甲烷=0-10%)得到化合物5(107.3mg)。收率:12.5%。
[2077]
步骤3):
[2078][2079]
将化合物5(347mg,1mmol)溶解在无水乙醇(4ml)和水(1ml)中,混合液中加入还原铁粉(560mg,10mmol)、氯化铵(324mg,6mmol),在80℃下搅拌3小时。点板检测产生新点,过滤,滤液加入乙酸乙酯(30ml x 3)萃取,有机相合并后,饱和食盐水(30ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-30%)得到化合物ab24983(10.6mg)。收率:2.6%。
[2080]
化合物ab24983:
[2081]1h nmr(400mhz,dmso-d6)δ9.43(s,1h),8.15(d,j=6.8hz,1h),8.04(d,j=6.4hz,1h),7.37(s,4h),7.30(s,1h),7.21(d,j=7.3hz,1h),7.12(s,2h),7.04(d,j=
6.1hz,1h),6.99(d,j=6.9hz,1h),6.87(d,j=7.2hz,1h),5.83(s,2h),5.49(s,2h),4.55(s,2h)。
[2082]
ms-esi:理论值[m-br]
+
318.39,实测值:318.30。
[2083]
实施例99
[2084]
化合物ab24813的制备
[2085]
步骤1):
[2086][2087]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2088]
步骤2):
[2089][2090]
将化合物4(1.0g,8.88mmol)溶解在二氯甲烷(30ml)中,冰浴下加入三氯化铝(2.3g,17.76mmol)、化合物5(2.8g,13.3mmol),反应液冰浴条件下搅拌1小时,tlc检测新点出现,用冰水(50ml)稀释,然后加入二氯甲烷(30ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,得到化合物6(300mg)。收率:12.94%。
[2091]
步骤3):
[2092][2093]
将化合物6(400mg,1.53mmol)和化合物3(300mg,1.64mmol)溶解在乙腈(10ml)中。氮气置换三次,在室温下搅拌5小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24813(24mg)。收率:3.1%。
[2094]
化合物ab24813:
[2095]1h nmr(400mhz,cdcl3)δ11.09(s,1h),8.17(s,1h),7.90(s,1h),7.66(s,1h),7.46(s,2h),7.36
–
7.24(m,8h),6.50(s,1h),4.54(s,2h),1.92(s,6h).
[2096]
ms-esi:理论值[m-cf3coo]
+
365.88,实测值:365.25。
[2097]
实施例100
[2098]
化合物ab24814的制备
[2099]
步骤:
[2100][2101]
将化合物1(100mg,0.403mmol)溶解在三氯氧磷(10ml)中,拌3小时,在110℃,lcms检测,降温,浓缩,在冰浴下加入2(96mg,0.806mmol),甲醇(20ml),室温反应,浓缩,送制备得到化合物ab24814(41.2mg)。收率:28.1%。
[2102]
化合物ab24814:
[2103]1h nmr(400mhz,dmso-d6)δ9.25(d,j=6.9hz,1h),8.05(d,j=7.4hz,1h),8.03
–
7.94(m,3h),7.67(d,j=7.8hz,2h),7.36(d,j=7.6hz,4h),7.26(s,1h),7.01(s,1h),6.79(s,1h),5.85(s,2h),4.89(s,1h),1.51(d,j=6.3hz,3h).
[2104]
ms-esi:理论值[m-cf3coo]
+
351.85,实测值:351.00。
[2105]
实施例101
[2106]
化合物ab24817的制备
[2107]
步骤1):
[2108][2109]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2110]
步骤2):
[2111][2112]
将化合物4(500mg,3.21mmol)和双(n,n-二甲基乙酰胺)二溴代溴酸氢盐(1.3g,3.21mmol)溶解在甲醇(20ml)中。氮气置换三次,在室温下搅拌16小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-5%)得到化合物5(510mg)。收率:67.8%。
[2113]
步骤3):
[2114][2115]
将化合物5(350mg,1.5mmol)和化合物3(184mg,1.0mmol)溶解在乙腈(10ml)中。氮气置换三次,在室温下搅拌5小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24817(47mg)。收率:14%。
[2116]
化合物ab24817:
[2117]1h nmr(400mhz,dmso-d6)δ9.27(s,1h),9.00(s,1h),8.35(d,j=8.2hz,1h),8.11(d,j=6.7hz,1h),8.00(d,j=6.9hz,1h),7.78(d,j=8.2hz,1h),7.36(s,4h),7.29(s,1h),7.01(s,2h),5.88(s,2h),4.55(d,j=5.3hz,2h).
[2118]
ms-esi:理论值[m-cf3coo]
+
338.81,实测值:338.20。
[2119]
实施例102
[2120]
化合物ab24880的制备
[2121]
步骤1):
[2122][2123]
将化合物1(5.6g,53.13mmol)溶解在乙醇(10ml)中,再加入化合物2(5g,53.13mmol),然后氮气置换三次,升温至90℃搅拌2小时。点板检测新点出现,将反应温度降至0摄氏度,硼氢化钠(4.01g,106.2mmol)缓慢加入,体系自然升至室温搅拌1小时。点板检测新点出现,用水(200ml)稀释,然后加入乙酸乙酯(200ml x 3)萃取,有机相合并后,饱和食盐水(200ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=10:1)得到化合物3(2.6g)。收率:26.8%。
[2124]
步骤2):
[2125][2126]
将化合物3(300mg,1.63mmol)溶解在乙腈(10ml)中,再加入4(1.38g,4.89mmol),乙酸钠(669mg,8.15mmol)然后氮气置换三次,室温搅拌16小时。液质检测新点出现,然后冷却到室温,将反应液旋干,通过薄层层析纯化得到化合物ab24880(300mg)。收率:60.74%。
[2127]
化合物ab24880:
[2128]1h nmr(400mhz,dmso,d6)δ9.46(s,1h),8.78(s,1h),8.17(d,j=6.7hz,1h),8.06(t,j=7.0hz,2h),7.99(d,j=7.5hz,1h),7.75(s,1h),7.32(d,j=26.4hz,5h),7.09
–
6.95(m,2h),5.96(s,2h),4.54(d,j=5.0hz,2h).
[2129]
ms-esi:理论值[m-br]
+
304.14,实测值:304.05。
[2130]
实施例103
[2131]
化合物ab24822的制备
[2132]
步骤1):
[2133]
将化合物1(247mg,1mmol)溶解在三氯氧磷(10ml)中,然后氮气置换三次,升温至110℃搅拌3小时。点板检测新点出现,过滤,减压浓缩减压,得到化合物2(200mg)。收率:75.18%。
[2134]
步骤2):
[2135][2136]
将化合物2(200mg,0.8mmol)溶解在无水甲醇(10ml)中。在0℃下加入化合物3
(162.2mg,1.5mmol)和三乙胺(5ml)搅拌16小时。点板检测产生新点,过滤,减压浓缩减压除去有机溶剂,通过薄层层析纯化(二氯甲烷:甲醇=8:1)得到化合物ab24822(42.8mg)。收率:11.8%。
[2137]
化合物ab24822:
[2138]1h nmr(400mhz,dmso-d6)δ9.31(s,1h),8.56(s,1h),8.13(s,1h),7.99(d,j=8.5hz,3h),7.82(s,1h),7.69(d,j=7.3hz,2h),7.41(s,1h),7.33(s,1h),7.03(s,2h),5.89(s,2h),4.67(s,2h)。
[2139]
ms-esi:理论值[m-cf3coo]
+
338.81,实测值:338.15。
[2140]
实施例104
[2141]
化合物ab24846的制备
[2142]
步骤1):
[2143][2144]
将化合物1(8g,83.33mmol)溶解在三氯氧磷(40ml)中,然后氮气置换三次,加热90℃搅拌过夜。点板检测新点出现,旋干三氯氧磷,冰水浴下加入二氯甲烷(50ml),缓慢滴加冰水(50ml),二氯甲烷(50ml x 3)萃取,有机相合并后,饱和食盐水(100ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=30-80%)得到化合物2(5g),收率:52.17%。
[2145]
步骤2):
[2146][2147]
将化合物2(2.5g,21.73mmol)溶解在n,n-二甲基甲酰胺(50ml)中,再加入化合物3(7.43g,65.22mmol)和碳酸钾(9.01g,65.22mmol),然后氮气置换三次,加,80℃搅拌过夜。点板检测新点出现,加入水(50ml)和乙酸乙酯(50ml x 3)萃取,有机相合并后,饱和食盐水(50ml)洗涤,无水硫酸钠干燥,减压浓缩减压除去有机溶剂,通过柱层析纯化(乙酸乙酯:石油醚=0-30%)得到化合物4(2.1g),收率:52.24%。
[2148]
步骤3):
[2149][2150]
将化合物4(200m g,1.08mmol)溶解在乙腈(15ml)中,然后加入化合物5(345m g,
1.62mmol),然后氮气置换三次,加热80℃搅拌过夜。点板检测新点出现,然后冷却到室温,将反应液旋干送制备得到ab24846(30mg)。收率:8.72%。
[2151]
化合物ab24846:
[2152]1h nmr(400mhz,dmso,d6)δ8.77(s,1h),8.14(s,1h),7.89(s,2h),7.42(s,8h),7.35(s,3h),7.10
–
6.90(m,1h),5.86(s,2h),4.71(s,2h),2.39(s,4h).
[2153]
ms-esi:理论值[m-cf3coo]
+
318.16,实测值:318.10。
[2154]
实施例105
[2155]
化合物ab24838的制备
[2156]
步骤1):
[2157][2158]
将化合物1(200mg,1.01mmol),三苯基磷(400mg,3.54mmol)溶解在四氢呋喃(10ml)中,然后氮气置换三次,升温至80℃下搅拌16小时。点板检测产生新点,然后冷却到室温,过滤,用四氢呋喃洗涤三次得到粗品化合物2(350mg)。收率:91.1%。
[2159]
步骤2):
[2160][2161]
将化合物2(200mg,0.52mmol)和化合物3(108mg,0.46mmol)溶解在四氢呋喃(10ml)中,再加入三乙胺(2ml),然后氮气置换三次,升温至70℃下搅拌16小时。点板检测产生新点,然后冷却到室温,减压浓缩,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物4(150mg)。收率:89%。
[2162]
步骤3):
[2163][2164]
将化合物4(200mg,0.61mmol)溶解在乙酸乙酯盐酸气(5ml)中,在室温下搅拌3小时。点板检测产生新点,减压浓缩得到粗品化合物5(210mg)。
[2165]
步骤4):
[2166][2167]
将化合物5(200mg,0.97mmol)溶解在乙醇(5ml)中,加入钯碳(20mg),置换氢气三次,在室温下搅拌过夜。点板检测产生新点,过滤,减压浓缩,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物6(60mg)。收率:29.5%。
[2168]
步骤5):
[2169][2170]
将化合物6(110mg,0.52mmol)和化合物7(184mg,0.79mmol)溶解在乙腈(10ml)中,然后加入碳酸钾(72mg,0.52mmol)。在70℃下搅拌5小时。点板检测产生新点,减压浓缩减压除去有机溶剂,通过柱层析纯化(甲醇:二氯甲烷=0-10%)得到化合物ab24838(61mg)。收率:32.3%。
[2171]
化合物ab24838:
[2172]1h nmr(399mhz,dmso-d6)δ9.30(s,1h),8.01(dd,j=17.6,9.1hz,2h),7.70(d,j=7.8hz,1h),7.39(d,j=6.8hz,1h),7.33(d,j=6.2hz,2h),6.92(d,j=7.0hz,1h),5.90(s,2h),4.76(s,1h),2.77(d,j=10.0hz,1h),2.57(d,j=16.7hz,1h),2.09(s,1h),1.87(d,j=8.4hz,1h).
[2173]
ms-esi:理论值[m-br]
+
363.86,实测值:363.15。
[2174]
实施例106考察各实施例制备的不同化合物对nci-h82细胞的抑制作用
[2175]
实验方法
[2176]
细胞活力检测采用promega celltiter-glo试剂盒,该试剂盒通过直接检测细胞内atp含量反应细胞活力。将小细胞肺癌细胞nci-h82(atcc,编号htb-175)培养于含10%胎牛血清的rpmi1640培养基并添加p/s,采用promega celltiter-glo试剂盒测定不同化合物对nci-h82的半抑制剂量ic50,实验结果表1所示:
[2177]
表1不同化合物对nci-h82细胞的抑制作用
[2178]
[2179]
[2180][2181]
从表1中可以看出,本发明的化合物对nci-h82细胞具有优异的抑制效果。
[2182]
实施例107
[2183]
考察实施例89制备的化合物ab24852对多种不同肿瘤细胞系的抑制效果
[2184]
细胞活力检测采用promega celltiter-glo试剂盒,该试剂盒通过直接检测细胞内atp含量反应细胞活力。将不同的癌细胞培养在培养基中,采用promega celltiter-glo试剂盒测定ab24852化合物的半抑制剂量ic50。其中,各肿瘤细胞系名称、来源及培养条件如下:
[2185]
细胞系a-375(atcc,编号crl-1619)培养于含10%胎牛血清的dmem培养基+p/s;
[2186]
细胞系snu-398(atcc,编号crl-2233)培养于含10%胎牛血清的rpmi1640培养基+p/s;
[2187]
细胞系nci-h1048(atcc,编号crl-5853)培养于含5%胎牛血清的hites培养基+p/s;
[2188]
细胞系mia paca-2(atcc,编号crl-1420)培养于含10%胎牛血清的dmem培养基+p/s;
[2189]
细胞系22rv1(atcc,编号crl-2505)培养于含10%胎牛血清的rpmi1640培养基+p/s;
[2190]
细胞系g-401(atcc,编号crl-1441)培养于含10%胎牛血清的mccoy’s 5a培养基+
p/s;
[2191]
细胞系mda-mb-453(atcc,编号htb-131)培养于含10%胎牛血清的leibovitz's l-15培养基+p/s;
[2192]
细胞系su-dhl-2(atcc,编号crl-2956)培养于含10%胎牛血清的rpmi1640培养基+p/s;
[2193]
细胞系oci-aml-4(dsmz,编号acc-729)培养于alpha-mem培养基(含20%胎牛血清及20%体积分数的经5637细胞系调整的培养基)+p/s;
[2194]
细胞系sw48(atcc,编号ccl-231)培养于含10%胎牛血清的leibovitz's l-15培养基+p/s;
[2195]
化合物ab24852对多种肿瘤细胞抑制效果如表2所示。
[2196]
表2化合物ab24852对多种肿瘤细胞抑制效果
[2197] 细胞系所属癌种ic50(μm)1a-375黑色素癌1.32snu-398肝癌1.73nci-h1048肺癌1.14mia paca-2胰腺癌0.7522rv1前列腺癌2.36g-401肾癌1.07mda-mb-453乳腺癌0.28su-dhl-2淋巴癌0.39oci-aml-4白血病0.810sw48肠癌0.7
[2198]
备注:a-375为黑色素癌、snu-398为间变性低分化肝细胞癌,nci-h1048为小细胞肺癌,mda-mb-453为三阴乳腺癌,su-dhl-2为b细胞淋巴癌,oci-aml-4为m4型急性髓细胞性白血病,sw48为dukes'type c,grade iv结直肠腺癌。
[2199]
从表2中可以看出,化合物ab24852对多种肿瘤细胞具有优异的抑制效果。
[2200]
实施例108
[2201]
考察线粒体膜通透性转换孔在daoy细胞和nci-h82细胞中活性
[2202]
1.1实验背景:线粒体膜通透性转换孔(mptp)是在线粒体内膜上的一个非特异通道,能让分子量小于1.5kd的小分子自由通过,其活性受线粒体内过氧化物(如h2o2)、ph以及钙离子的影响。有的细胞线粒体膜通透性转换孔活跃,如正常体细胞等,有的细胞线粒体膜通透性转换孔不活跃,如一些肿瘤细胞等。对于线粒体膜通透性转换孔活跃的细胞而言,加入过氧化物(如h2o2)其线粒体膜通透性转换孔活性会增加,导致线粒体膜电势降低;而对于线粒体膜通透性转换孔不活跃甚至关闭的细胞而言,加入过氧化物(如h2o2)对线粒体膜通透性转换孔活性无明显影响,线粒体膜电势无明显变化。基于这个原理,我们可以通过测量线粒体膜在过氧化物刺激下,电势差的变化来确定mptp在特定细胞中是否活跃。
[2203]
1.2实验方法和结果:
[2204]
daoy细胞为人髓母细胞瘤细胞(atcc,编号htb-186)培养于含10%胎牛血清的dmem培养基并添加p/s,nci-h82细胞为小细胞肺癌细胞(atcc,编号htb-175)培养于含10%
胎牛血清的rpmi1640培养基并添加p/s,向培养基中添加1.5μm cyclosporin a(csa,csa可有效抑制mptp线粒体膜通透性转换孔活性),同时选择未添加cyclosporin a(csa)培养的细胞作为空白对照。通过tetramethylrhodamine(tmrm)检测线粒体膜电势差的高低,tmrm荧光强度高,膜电势差高,结果如表3所示:
[2205]
表3不同处理组中的相对tmrm信号强度(%)
[2206][2207]
备注:“+”表示存在,
“‑”
表示无。
[2208]
从表3中可以看出,daoy细胞在h2o2作用下膜电势下调,而这种下调可被线粒体膜通透性转换孔抑制剂csa逆转,表明daoy细胞中线粒体膜通透性转换孔是活跃的。nci-h82细胞膜电势不受h2o2和csa影响,表明nci-h82细胞中mptp线粒体膜通透性转换孔是不活跃的。因此,从表3中可以看出,daoy细胞中线粒体膜通透性转换孔是活跃的,而nci-h82细胞中线粒体膜通透性转换孔是不活跃的。
[2209]
实施例109
[2210]
考察实施例制备的相关化合物抑制癌细胞生长的活性与mptp活跃程度有关
[2211]
3.1实验背景:细胞活力检测采用promega celltiter-glo试剂盒,该试剂盒通过直接检测细胞内atp含量反应细胞活力。本实验采用线粒体膜通透性转换孔活跃的daoy细胞和线粒体膜通透性转换孔不活跃的nci-h82细胞,检测实施例制备的相关化合物对daoy细胞、daoy细胞加mptp抑制剂(cyclosporin a,csa,1.5μm,sigma),以及对nci-h82细胞活力抑制的ic50值。
[2212]
3.2实验方法和结果:daoy细胞培养于含10%胎牛血清的dmem培养基并添加p/s,nci-h82细胞培养于含10%胎牛血清的rpmi1640培养基并添加p/s,在两种细胞(daoy细胞和nci-h82细胞)及三种条件下(daoy细胞无csa、daoy细胞有csa和nci-h82细胞无csa)测定相关化合物的半抑制剂量ic50,实验结果表4所示:
[2213]
表4实施例制备的相关化合物对daoy细胞无csa、daoy细胞有csa和nci-h82细胞无csa的抑制作用
[2214][2215][2216]
从表4可以看出,实施例制备的相关化合物对daoy细胞和nci-h82细胞均具有抑制作用,尤其是对mptp不活跃的nci-h82细胞抑制效果更好。此外,当通过添加mptp抑制剂csa从而降低daoy细胞mptp活性时,能够显著提高相关化合物对daoy细胞的抑制效果,从而表明降低细胞的mptp活性能够显著增强相关化合物的抗肿瘤活性,相关化合物对mptp不活跃细胞的抑制效果更显著。
[2217]
实施例110考察实施例制备的不同化合物对不同肿瘤细胞株的敏感性测试
[2218]
使用细胞活性检测试剂检测实施例制备的不同化合物对不同肿瘤细胞系的抑制效果。
[2219]
实验背景:细胞活力检测采用promega celltiter-glo试剂盒,该试剂盒通过直接检测细胞内atp含量反应细胞活力。本实验检测不同化合物对不同肿瘤细胞系细胞活力抑制的ic50值,以此分析对不同化合物敏感或不敏感的细胞系。
[2220]
实验方法和结果:各肿瘤细胞均培养于含有10%fbs的培养基中(加p/s),细胞传代3小时或隔天后,加入梯度稀释的不同相关小分子,培养3天后测定相关半抑制剂量ic50。
[2221]
各肿瘤细胞系名称、来源及培养条件如下:
[2222]
细胞系nci-h82(atcc,编号htb-175)培养于含10%胎牛血清的rpmi1640培养基+p/s;
[2223]
细胞系g-401(atcc,编号crl-1441)培养于含10%胎牛血清的mccoy’s 5a培养基+p/s;
[2224]
细胞系mda-mb-453(atcc,编号htb-131)培养于含10%胎牛血清的leibovitz's l-15培养基+p/s;
[2225]
细胞系sw48(atcc,编号ccl-231)培养于含10%胎牛血清的leibovitz's l-15培养基+p/s;
[2226]
细胞系cfpac-1(atcc,编号crl-1918)培养于含10%胎牛血清的imdm培养基+p/s;
[2227]
细胞系786-o(atcc,编号crl-1932)培养于含10%胎牛血清的rpmi1640培养基+p/s;
[2228]
细胞系gb-1(jcrb,编号ifo50489)培养于含10%胎牛血清的dmem培养基+p/s;
[2229]
实验结果如表5所示:
[2230]
表5实施例制备的化合物对不同细胞株的抑制作用(ic50,μm)
[2231][2232][2233]
备注:ic50为半抑制浓度(50%inhibiting concentration),即达到50%抑制效果时所需的抑制剂浓度。
[2234]
由表5可知,基于不同肿瘤细胞对不同化合物的敏感性检测发现nci-h82(人小细胞肺癌细胞)、g-401(肾癌)、mda-mb-453(三阴乳腺癌细胞)、sw48(dukes'type c,grade iv结直肠腺癌)对化合物是敏感的(ic50值相对较低)。而786-o(肾透明细胞腺癌细胞系)、cfpac-1(人胰腺癌细胞)、gb-1(人脑胶质母细胞瘤细胞)和sf-126(人脑瘤细胞)对相关化合物是不敏感的(ic50值相对较高)。
[2235]
实施例111
[2236]
对相关化合物敏感的4例肿瘤细胞系和不敏感的4例肿瘤细胞系使用rt-qpcr基因表达分析试验检测其nnmt基因的mrna转录水平,分别测定这些肿瘤细胞系nnmt基因表达情况,结果如图1所示。
[2237]
由图1可知,用rt-qpcr基因表达分析实验对化合物敏感的4株细胞(nci-h82、g-401、mda-mb-453和sw48)和不敏感的4株细胞(786-o、cfpac-1、gb-1和sf126)进行nnmt基因的mrna转录水平检测发现:nnmt基因在敏感株细胞(nci-h82、g-401、mda-mb-453和sw48)中低表达而在不敏感株细胞(786-o、cfpac-1、gb-1和sf126)中高表达。
[2238]
因此,从图1中可以得出,与nnmt基因高表达的肿瘤细胞株相比,化合物对nnmt基因低表达的肿瘤细胞株的抑制作用显著增强,即肿瘤细胞中nnmt基因表达与其对相关化合物的敏感性呈负相关。
[2239]
实施例112
[2240]
对相关化合物敏感的4例肿瘤细胞系和不敏感的4例肿瘤细胞系nnmt基因启动子区、nnmt基因转录起始位点前1050bp到转录起始位点后500bp之间区域以及nnmt基因转录起始位点前1050bp到转录起始位点前193bp之间区域进行重亚硫酸盐测序以检测相关区域内dna cpg位点甲基化水平,首先利用重烟硫酸盐对基因组dna进行处理,将未发生甲基化的胞嘧啶脱氨基变成尿嘧啶,而发生了甲基化的胞嘧啶未发生脱氨基,因而可以基于此将
经重亚硫酸盐处理的和未处理的测序样本进行比较来发现甲基化的位点,结果如图2、图3和图4所示。
[2241]
如图2(启动子区,转录起始位点前2000bp到转录起始位点后500bp之间区域)、图3(转录起始位点前1050bp到转录起始位点后500bp之间区域)及图4(转录起始位点前1050bp到转录起始位点前193bp之间区域)所示,相关化合物对nnmt基因启动子区或nnmt基因相关区域内dna cpg位点甲基化水平高的肿瘤细胞株的抑制作用显著较强,对nnmt基因启动子区或nnmt基因相关区域内dna cpg位点甲基化水平低的肿瘤细胞株的抑制作用显著较弱,表明肿瘤细胞nnmt基因启动子区或nnmt基因相关区域内dna cpg位点甲基化水平高与其对相关化合物的敏感性呈正相关。
[2242]
实施例113考察本实施例制备的相关化合物在肝微粒体中的稳定性
[2243]
试验使用corning的人肝微粒体,试验步骤如下:
[2244]
1)配制缓冲液c:
[2245]
缓冲液a:1.0l的0.1m磷酸二氢钾缓冲液(含1.0mm edta);
[2246]
缓冲液b:1.0l的0.1m磷酸氢二钾缓冲液(含1.0mm edta);
[2247]
缓冲液c:将缓冲液a加入到700ml缓冲液b中,当ph达到7.4时停止。
[2248]
2)配制10mm储备液:
[2249]
将测试的化合物溶于dmso,配成10mm储备液。
[2250]
3)给药溶液的配制:
[2251]
500μm溶液:将10μl的10mm储备液加入到190μl acn中;
[2252]
1.5μm给药溶液(溶解于肝微粒体溶液中):
[2253]
将18.75μl的20mg/ml肝微粒体加入到479.75μl缓冲液c中,然后再加入1.5μl的500μm溶液,轻微振荡混匀。
[2254]
4)6mm nadph溶液的配制:
[2255]
称取nadph,然后加入适量缓冲液c,配制成6mm的nadph溶液。
[2256]
5)将30μl的1.5μm给药溶液分别加入到96孔板上设置为不同时间点(0分钟、5分钟、15分钟、30分钟、45分钟)的孔中,复样数为2。
[2257]
6)制备0分钟样品:先将135μl acn(含内标)加入到0分钟的孔中,再加入15μl的6mm nadph溶液。
[2258]
7)将含有1.5μm给药溶液的96孔板和nadph溶液在37℃水浴预热5分钟。
[2259]
8)将预热15μl的6mm nadph溶液加入到设置为5分钟、15分钟、30分钟、45分钟点的孔中,启动反应并开始计时。
[2260]
9)在计时器显示5分钟、15分钟、30分钟和45分钟时,加入135μl acn(含内标)终止反应。涡旋振荡10分钟,在离心机(thermo multifuge
×
3r)上采用5594
×
g将样品离心15分钟。
[2261]
10)从离心后的样品中取出50μl上清液,转移至已加入50μl水的96孔样品板中,混合,最后将样品送至lc-ms/ms分析。
[2262]
实验结果如表6所示:
[2263]
表6本实施例制备的化合物在人肝微粒体稳定性
[2264][2265][2266]
备注:t
1/2
是指半衰期。
[2267]
从表6中可以看出,本实施例制备的化合物在肝微粒体具有优异的半衰期t
1/2
,从而表明本实施例制备的化合物在肝脏中具有优异的稳定性。
[2268]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1