一种负载锂的三维微孔磺化聚醚醚酮、制备方法及其应用
1.本发明属于医用生物材料应用技术领域,具体涉及一种负载锂的三维(3d)微孔磺化聚醚醚酮(speek
‑
li)、制备方法及其应,通过表面化学修饰负载锂的三维微孔磺化聚醚醚酮以促进植入物
‑
界面骨整合。
背景技术:
2.作为一种半结晶、高性能、不可吸收的热塑性材料,聚醚醚酮(peek)已被用作替代金属植入物的材料,用于创伤、矫形和脊柱外科手术。与金属植入物相比,peek具有以下优点:
①
耐环境性,这有助于提高耐腐蚀性在人体内;
①
低弹性模量(3
‑
4gpa),与人类皮质骨(18gpa)的弹性模量非常接近,这可以降低应力屏蔽的程度;
③
透光性有利于术后随访期间评估peek植入物周围的新骨形成;
④
碳纤维可以增强peek的抗疲劳性能。然而,由于其生物惰性,使得peek植入物与宿主骨组织之间骨整合能力较差,容易发生种植体位移、笼陷或假性关节的并发症,从而限制了其作为骨修复材料的应用。既往对peek材料表面改性的研究主要包括:“羟基石灰石(ha)
‑
peek复合材料”、“纳米氟磷石灰
‑
peek”、“纳米二氧化钛
‑
peek复合结构”等。但是这些生物复合结构无法与聚醚醚酮基体形成稳定持久的结合、对提高peek的生物相容性效果一般以及制作成本较高等缺点。
3.锂盐是一类经典的精神疾病治疗用药,近年来其在骨科领域的应用效果及机制受到越来越多的关注。目前有关研究发现,锂离子可促进促血管生成活性因子的分泌,进而促进骨血管新生和骨再生;也有研究将锂离子运用于骨关节炎、骨质疏松症以及骨科材料的修饰改进等方面,这为骨科疾病的治疗途径开拓了新的渠道。
技术实现要素:
4.本发明的目的在于研究通过表面化学修饰的方法制备负载锂的三维(3d)微孔磺化聚醚醚酮(speek
‑
li)以促进植入物
‑
骨组织界面的骨整合,进而满足临床对peek的生物相容性及骨整合的需求。本发明是通过表面化学改性技术将可刺激促血管生成因子分泌、增强骨再生、软骨生成和保护的锂离子负载到磺化处理的三维微孔磺化聚醚醚酮,以增强其生物相容性和骨整合能力。经过磺化、锂化处理后的peek表面形成了多重微孔网格的三维立体结构,显著增加材料与骨组织的接触面积,促进骨髓间充质干细胞(bmscs)的粘附及成骨分化能力。为了实现上述目的,本发明提供以下技术方案:
5.一种负载锂的三维微孔磺化聚醚醚酮的制备方法,包括以下步骤:
6.a、将聚醚醚酮基体经清洗烘干后备用;
7.b、将步骤a处理后的聚醚醚酮基体浸入浓硫酸中进行磺化处理,处理结束后去除多余的浓硫酸残基,得到磺化聚醚醚酮;
8.c、将步骤b处理后的磺化聚醚醚酮基体浸入氢氧化锂溶液中进行锂化处理,结束后去离子水清洗表面,得到表面负载锂的磺化聚醚醚酮,并烘干备用。
9.进一步的,所述步骤a的具体清洗步骤为:将聚醚醚酮基体依次经过丙酮、无水乙
醇、去离子水摇床上清洗,每次15min,共3次循环;清洗后的聚醚醚酮基体,放入37℃的烘箱里干燥备用。
10.进一步的,所述步骤b的磺化处理使用的浓硫酸的浓度是98%,处理时间为3min,处理结束后置于去离子水中中止反应;置于100℃的水浴锅中加热4h,去除多余的浓硫酸残基,得到的磺化聚醚醚酮放入37℃的烘箱里干燥备用。
11.进一步的,所述步骤c的锂化处理使用的氢氧化锂溶液的浓度是1mol/l,处理温度是120℃,处理时间是6h;清洗后的表面负载锂的磺化聚醚醚酮放入37℃的烘箱里干燥备用。
12.本发明所述的制备方法制得的负载锂的三维微孔磺化聚醚醚酮。
13.本发明所述的负载锂的三维微孔磺化聚醚醚酮在制备促进植入物
‑
界面骨整合的药物的应用。有益效果:本发明提供了一种负载锂的三维微孔磺化聚醚醚酮、制备方法及其应用,对制备的speek
‑
li进行表面特征分析提示制备成功;体外细胞实验证明speek
‑
li具有促进bmscs粘附、增值、向成骨分化;体内实验利用大鼠股骨远端植入棒模型证明speek
‑
li促进植入物
‑
骨界面整合。
14.与现有技术相比,本发明具有以下优点:
15.(1)本发明采用表面化学修饰改性技术进行材料的制备,其操作简单、反应条件温和,室温下,peek即可与浓硫酸发生磺化反应,引入基团
‑
so3h;lioh电离产生的oh
‑
与
‑
so3h电离产生h
+
,在热反应的条件下,发生中和反应,从而得到speek
‑
li;
16.(2)peek基体经过改性后,对材料本身性质没有很大改变,也没有引入对人体有害的元素,使得peek优良的机械性能得以保留;
17.(3)本发明所述制备方法比较简便,制作成本较低,制备的speek
‑
li性能优异,生物相容性及促骨长入能力显著提高,在临床上有较好的应用前景。
附图说明
18.下面结合附图及实施例对本发明作进一步描述。
19.图1为电镜下三种材料的表征图;
20.图2为xps分析结果图;
21.图3为afm分析结果图;
22.图4为三种材料的水接触角图;
23.图5为cck
‑
8结果图;
24.图6为电镜下bmsc细胞铺展图;
25.图7为细胞荧光骨架结果图;
26.图8为成骨相关基因表达情况图;
27.图9为alp、ars染色结果图;
28.图10为alp试剂盒检测、细胞外基质矿化定量结果图;
29.图11为大鼠股骨三维重建结果图;
30.图12为ct定量分析图;
31.图13为股骨he染色结果图;
32.图14为免疫荧光结果图。
具体实施方式
33.下面结合具体实施例来进一步描述本发明,但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
34.一、材料与方法
35.1、材料
36.1.1试剂及实验设备
37.1.1.1主要药品及试剂
38.peek片购自苏州爱得科技发展股份有限公司,中国;lioh购自sigma,美国;浓硫酸,苏州享尚益电子材料有限公司,中国;多聚甲醛、pbs、dab显色剂、苏木素、伊红、无水乙醇、蒸馏水。col
‑
1、ocn抗体购自cell signaling technology公司,美国;alp试剂盒购自碧云天生物科技公司,中国;ars染液购自sigma,美国。
39.1.1.2主要仪器
40.micro
‑
ct(skyscan 1176,比利时)、扫描电子显微(carl zeiss,德国)、x射线光电子能谱xps(escalabxi,thermo scientific,美国)、pcr仪器、石蜡切片机(leica 2135,德国)、烤片机(leica 1120,德国)、石蜡包埋机(leica 1150,德国)、共聚焦显微镜(leica,tcs sp8,德国)、axiovert 40c光学显微镜(zeiss,德国)、接触角测定仪(digidrop,zeiss,德国)、酶标仪(supermax 3000al,中国)手术器械一套等。
41.1.2实验动物
42.健康sd鼠60只,雄性,体重190~220g,由苏州大学动物实验中心提供。喂养条件如下:五只一笼,室温18~20℃,湿度50~60%,通风良好,自由摄食进水。
43.2、实验方法
44.2.1.peek的处理
45.peek的处理过程如以下反应式所示,首先依次经过丙酮,乙醇和去离子水中清洗,每一步置于摇床上清洗15min,一共三次循环以去除peek表面的杂质。然后用烘干机37℃过夜干燥。之后,在室温下在磁力搅拌机中用浓度98%浓硫酸处理样品3min。随后的去离子水充分清洗样品,标记为speek,水热100℃反应4h,去除多余的硫酸,最后放入浓度1mol/l的lioh溶液在120℃条件下反应6h,去离子水清洗表面后,恒温干燥箱中于37℃干燥24h,即得到speek
‑
li样本。
[0046][0047]
2.2样品表征检测
[0048]
使用扫描电子显微镜对表面进行观察。样本制备完成后,首先经过临界点干燥,然后离子溅射仪对样品进行喷金处理,然后用扫描电镜观察并采集图像,xps对样品表面进行元素分析。通过接触角测定仪测试样品表面亲水性,测量温度为室温,平行测量3次。afm对材料表面立体结构进行分析。
[0049]
2.3细胞实验
[0050]
大鼠原代bmscs的提取:
[0051]
(1)麻醉过量处死大鼠,75%酒精泡5min;
[0052]
(2)先初步分离小鼠的股骨和胫骨,去除多余的组织;
[0053]
(3)依次在75%酒精、无菌pbs、75%酒精、无菌pbs的培养皿涮洗,每次3min;
[0054]
(4)剪去股骨和胫骨的两端,用1ml注射器吸取培养基吹出细胞,直到髓腔泛白;
[0055]
(5)收集细胞悬液,离心机1200转,3min,弃上清;
[0056]
(6)向沉淀中加入2ml红细胞裂解液,3min,再次离心机1200转,3min;
[0057]
(7)弃上清,种于培养皿,于5%co2、37℃培养箱进行培养;48h后首次半换液,72h全换液。细胞长至80%融合后以0.25%胰酶消化传代。
[0058]
2.4采用cck
‑
8法检测bmscs增殖
[0059]
紫外线灭菌消毒试样后,将三组样品置于细胞培养板中(24孔)。细胞计数板用于细胞计数,调整细胞密度约为2
×
104/孔,每孔设计7组重复。培养的时间点为第1天、第3天和第5天,在此时间点终止培养。计数细胞和检测细胞活力采用cck
‑
8法,具体方法如下:
[0060]
(1)细胞培养液被吸管吸除后,pbs溶液冲洗3遍,以弃用;
[0061]
(2)50μl cck
‑
8反应液和500μl pbs溶液加入每孔中,避光,37℃孵育2h;
[0062]
(3)孵育结束后,每孔分别取100μl加入96孔板;
[0063]
(4)采用酶标仪测量,舍弃最大值及最小值,记录450nm波长处的od值。
[0064]
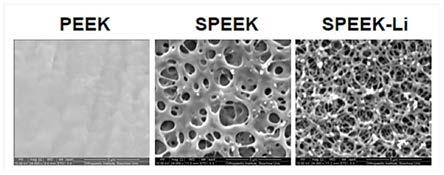
2.5扫描电镜检测bmscs粘附
[0065]
bmscs的培养按上述方法,3组样品表面的接种密度4
×
104/孔,培养时间点为24h,方法如下:
[0066]
(1)吸弃培养液,pbs清洗3次,每次3min;
[0067]
(2)4%多聚甲醛固定2h;
[0068]
(3)吸弃固定液,pbs溶液清洗3次,每次3min;
[0069]
(4)再者行不同的乙醇梯度进行脱水(10%、30%、50%、70%、70%、85%、85%90%、100%、100%),每次15min,临界点干燥仪,最后采用离子溅射仪表面镀金;
[0070]
(5)进行扫描电镜的观察。
[0071]
2.6鬼笔环肽检测bmscs骨架
[0072]
bmscs的培养按上述方法,3组样品的接种密度为2
×
104/孔,培养24h后染色,具体方法如下:
[0073]
(1)细胞采用pbs清洗2次,每次5min;
[0074]
(2)4%多聚甲醛为pbs溶液所配制,固定时间为15min;
[0075]
(3)室温下鬼笔环肽(1:500)室温染色1h;
[0076]
(4)染细胞核5min(加dapi),再行pbs清洗2次;
[0077]
(5)共聚焦荧光显微镜进行观察。
[0078]
2.7碱性磷酸酶(alp)活性检测
[0079]
bmscs的培养按上述方法,接种密度为2
×
104/孔,培养时间为3天,具体方法如下:
[0080]
(1)取数量为10μl对硝基苯酚溶液(10mm),用检测缓冲液稀释至0.2ml,最终浓度为0.5mm;
[0081]
(2)收集的样品各20μl于96孔微孔板中,并设置了空白孔和标准孔,标准液20μl加入标准孔,双蒸水20μl加入空白孔;
[0082]
(3)再分别添加底物缓冲液120μl于待测孔、标准孔和空白孔中;
[0083]
(4)充分振荡2min、10min孵育37℃、100μl反应终止液加入每孔、再次震荡1min;
[0084]
(5)测量其od值(利用450nm波长酶标仪)。alp活性u/(gprot)=(测定孔
‑
空白孔)吸光度/(标准孔
‑
空白孔)吸光度
×
酚标准品浓度(0.003mg/ml)
÷
待测样本蛋白浓度(gprot/ml);
[0085]
(6)得到各组单位蛋白的alp活性,进行统计分析。
[0086]
2.8rt
‑
pcr相关检测成骨相关基因
[0087]
bmscs的培养按上述方法,接种密度为4
×
104/孔,将细胞接种于含有peek、speek、speek
‑
li的24孔板,设置3个复孔,培养时间为3天。
[0088]
(1)trizol溶液中加入样本并溶解,氯仿加入后盖紧离心管盖,在冰上放置10min(剧烈震荡后),在温度为4℃时以12000rpm速率进行离心15min;
[0089]
(2)eppendorf管(1.5ml)置入上清液,200μl氯仿加入后,震荡后,静置冰上15min,4℃温度下以12000rpm的速率进行离心5min;
[0090]
(3)取500μl上清液于新eppendorf管,而等体积的异丙醇被加入每管中,震荡后,静置15min于冰上,后4℃温度下以12000rpm速率离心10min;
[0091]
(4)弃去上清液,进行预沉淀及再次沉淀(75%的乙醇溶液被加入后),振荡离心管需温和,目的使沉淀悬浮;在温度为4℃时以12000rpm速率离心5min;后在常温下晾干约1h;
[0092]
(5)depc水中溶解rna,rna稀释后的浓度为0.5μg/μl,采用紫外分光光度计测量rna的od260/od280值,其值约为1.8
‑
2.0,对rna的含量进行计算;
[0093]
(6)逆转录试剂盒逆转录为cdna;
[0094]
(7)并使用real
‑
time pcr mix(takara)在光循环仪(roche,basel,switzerland)上进行pcr,gaphd作为管家基因,下表中包含以下引物:
[0095][0096]
gapdh:glyceraldehyde 3
‑
phosphate dehydrogenase;alp:alkaline phosphatase;bmp
‑
2:bone morphogentic protein 2;ocn:osteocalcin;runx2:runt
‑
related transcription factor 2.结果采用以目的基因c(t)值减去内参基因c(t)值进行分析:目的基因相对表达量=2
‑△
c(t)(以2为底数,差值为指数计算所得值表示目的基因相对表达量)。
△
c(t)=目的基因c(t)
‑
内参基因c(t)。
[0097]
2.9bmscs矿化检测
[0098]
茜素红染色:茜素红具有羟基蒽醌结构与钙盐中的钙离子结合后形成配合物显示为红色。茜素红染色后直接观察细胞基质中钙盐沉积的情况,作定性分析,判断细胞成骨的程度。样品表面的接种密度2
×
104/孔,待细胞贴壁后,加入成骨分化诱导培养基,诱导时间为14天,具体方法如下:
[0099]
(1)吸弃培养液,pbs清洗3次,每次3min;
[0100]
(2)4%的多聚甲醛固定细胞10min,蒸馏水冲洗3次;
[0101]
(3)加入0.1%的茜素红tris
‑
hcl(ph值8.3),37℃染色30min,蒸馏水冲洗,干燥处理。
[0102]
3.0碱性磷酸酶(alp)染色
[0103]
样品表面的接种密度2
×
104/孔,待细胞贴壁后,加入成骨分化诱导培养基,诱导时间为7天,具体方法如下:
[0104]
(1)吸弃培养液,pbs清洗3次,每次3min;
[0105]
(2)4%的多聚甲醛固定细胞10min,蒸馏水冲洗3次;
[0106]
(3)预混孵育液a液与b液(4:1)为孵育工作液,37℃孵育45min,pbs洗2次,中止反应。
[0107]
3.1动物实验
[0108]
各组动物均在全麻下进行常规手术操作,由股骨远端髁间窝处向平行股骨干方向。手术前常规予禁食6h,禁饮2h。麻醉药物为戊巴比妥,麻醉方式均为腹腔注射。常规剃毛、备皮后,安尔碘消毒、铺巾,手术采用膝关节正中入路,依次暴露皮肤、皮下组织,沿髌骨骨内侧打开膝关节腔,充分暴露股骨髁,然后用克氏针从股骨髁间窝钻至股骨髓腔内,术后逐层缝合,并肌注青霉素80万单位预防感染。
[0109]
3.2动物实验分组
[0110][0111]
3.3标本采集
[0112]
各组动物均于术后8周,行安乐死。取下所有的股骨置于4%多聚甲醛固定24h后,每组取30只大鼠先行micro
‑
ct检测,另外30只大鼠再以10%edta脱钙4周,石蜡包埋,行组织学检测。
[0113]
3.4micro
‑
ct检测扫描参数:分辨率18μm,电压80kv;电流100μa;每次曝光时间为100ms;0.9
°
/8images。采用wedemeyer c方法(wedemeyer c,et al.particle
‑
induced osteolysis in three
‑
dimensional micro
‑
computed tomography.calciftissue int.2007;81(5):394
‑
402),选定一圆柱形感兴趣区域(roi),应用micro
‑
ct图像分析软件对图像进行3d分析,记录roi股骨的骨密度(bmd,mg/mm2),骨表面积骨体积比值(bs/bv),骨体积与组织体积比值(bv/tv)和骨小梁厚度(tb.th,mm)。
[0114]
3.5组织学染色
[0115]
股骨经10%edta脱钙4周后,取出股骨内的材料,将完全软化的股骨标本修剪整齐,尽量去除多余组织,冲洗干净后置于包埋盒中进行乙醇梯度脱水。具体如下:入60%、70%、80%、90%、溶液2h、95%乙醇各1h,最后将包埋盒置于正丁醇溶液中8h。将装有标本的包埋盒从正丁醇中取出,置于包埋机融蜡盒中4h,然后将包埋盒置于另一侧相对清洁融蜡盒中4h。将包埋模具里装满纯蜡,将包埋盒中的股骨标本置于模具纯蜡中,将模具注满纯蜡后盖上包埋盒,置于
‑
20℃冷却台上固定约1h后取下蜡块,常温保存。
[0116]
3.5.1苏木素
‑
伊红染色(h&e染色)
[0117]
(1)石蜡切片经二甲苯(10min
×
3次)脱蜡后,依次经过100%、100%、95%、90%,85%的乙醇至水,每道5min;
[0118]
(2)蒸馏水冲洗3min,苏木素溶液染色1min,自来水浸洗10min;
[0119]
(3)2%乙酸1min,自来水浸洗5min;
[0120]
(4)氨水1min(提拉10次),自来水浸洗5min;
[0121]
(5)95%乙醇5s;
[0122]
(6)伊红染色5min;
[0123]
(7)梯度酒精脱水:95%乙醇2min
×
2次;
[0124]
(8)常规脱水、透明、封片,光镜下观察股骨的形态学变化。
[0125]
3.5.2免疫荧光检测
[0126]
脱蜡前,将切片在室温中放置60℃恒温箱中烘烤30min。
[0127]
1、复水
[0128]
(1)切片置于二甲苯中浸泡15min,更换二甲苯后再浸泡15min;
[0129]
(2)无水乙醇中浸泡5min;
[0130]
(3)95%乙醇中浸泡5min;
[0131]
(4)70%乙醇中浸泡5min。
[0132]
2、抗原修复
[0133]
酶消化方法:常用0.1%胰蛋白酶,胰蛋白酶使用前预热至37℃,切片也预热至37℃,每张切片滴加0.2ml消化液覆盖完全组织,于37℃温箱内消化约30min,避光。
[0134]
3、免疫荧光染色
[0135]
(1)pbs洗3次各5min;
[0136]
(2)滴加正常山羊血清封闭液,室温20min,甩去多余液体;
[0137]
(3)滴加ⅰ抗100μl,室温静置1h;
[0138]
(4)4℃过夜后需在37℃复温45min;
[0139]
(5)pbs洗3次各5min;
[0140]
(6)滴加ⅱ抗40~50μl,37℃1h;
[0141]
(7)pbs洗3次各5min;
[0142]
(8)dapi显色10min;
[0143]
(9)pbs洗10min。
[0144]
4、统计学分析
[0145]
结果数据采用spss11.0统计软件分析,数据用均数
±
标准差(x
±
s)表示,多组比较选用单因素方差分析(one
‑
way anova检验),两两比较在总体方差齐的条件下,选用lsd及dunnett
‑
t法进行分析。p<0.05为差异有统计学意义。
[0146]
二、结果
[0147]
1、表征检测
[0148]
扫描电镜表征观察,可以看到未经表面处理的纯peek表面不规则,而经硫酸磺化处理的speek表面呈密集的三维多孔结构,孔径大小不一,有2
‑
3层,仅位于较薄的表层,在此基础上经lioh处理的材料,表面呈现出三维多孔结构,孔径大小均匀,很多小的颗粒均匀分布在表面(图1)。应用xps检测并分析样品表面的化学成分,speek样品的xps光谱中,c和o是主导元素,经lioh处理后,引入了li元素,表明li元素已成功加载到样品的表面,(图2)。
[0149]
afm结果显示:peek表面相对平整,speek表面形成较大的凹陷,而经过锂化后,speek表面表面变得十分致密,呈现出均匀的起伏,这使得材料的粗燥度大大增加,从而提高材料与细胞的接触面积,提供了一个较好的粘附条件(图3)。
[0150]
水接触角结果显示:与peek相比较(72.23
±
2.32
°
);经过磺化修饰后引入基团
‑
so3h,由于表面形成多孔的表面,speek亲水性降低(96.06
±
1.56
°
),而经lioh处理的speek
‑
li材料,亲水性得到一定的提升(76.23
±
2.31
°
)(图4)。
[0151]
2、体外结果:
[0152]
cck
‑
8结果表明:与peek组相比,speek组和speek
‑
li组的细胞增值没有表现出负性作用,且更加促进细胞增值(图5)。bmscs接种于材料表面,扫描电镜显示,speek
‑
li材料上的bmscs铺展明显高于speek组和peek组,伸出了较多伪足,且伪足之间相互融合,细胞铺展更充分。而peek组和speek组的细胞有明显的皱缩,说明负载锂的多孔结构有利于bmscs粘附在材料表面(图6)。通过细胞骨架染色可见,speek
‑
li组的细胞骨架更明显,细胞铺展面积更大,细胞核表现出融合(图7)。与纯peek相比,speek和speek
‑
li均促进成骨相关基因alp、bmp
‑
2、ocn及runx2的表达,尤其是锂化后上调水平更高(图8)。为了进一步分析成骨分
化,在成骨培养基中第7天和第14天后分别行alp染色和茜素红(ars)染色评估成骨活力及矿化的程度,可以观察到,alp染色颜色最深的为speek
‑
li组,最高的矿化度是speek
‑
li组(图9和图10)。
[0153]
3、体内结果
[0154]
实验动物一般情况良好,各组动物均在术后1h内苏醒,可在笼内自由活动,正常进食,精神状态无明显变化。无切口无红肿、渗液等炎性反应,均一期愈合。实验过程中无动物死亡。micro
‑
ct分析结果显示:与peek组比较,speek组和speek
‑
li组的材料界面骨量增加。speek
‑
li组周边骨密度(bmd)明显升高(***p<0.005)。骨表面积与骨体积比值(bs/bv)speek
‑
li组<speek组<peek组(***p<0.005):骨体及分数(bv/tv)相比较与peek组,speek
‑
li组骨体积增多(***p<0.005)。骨小梁厚度(tb.th):speek与peek组比较差异有统计学意义(**p<0.01),在speek
‑
li组作用更明显(***p<0.005)。见图11
‑
12。he染色结果:peek组周围骨小梁减少,骨组织内细胞数量少,且多为炎性细胞,而speek组和speek
‑
li组骨小梁排列紧凑,数量及面积增多,其中以speek
‑
li组最为明显。见图13。
[0155]
免疫荧光检测:
[0156]
在荧光显微镜下观察col
‑
1及ocn的表达量:与peek组比较,speek组表达量明显增加,差异有统计学意义(*p<0.05)。见图14。
[0157]
总结:结果表明通过表面化学修饰获得负载锂的三维(3d)微孔磺化聚醚醚酮(speek
‑
li)促进假体与骨界面的骨整合,体外细胞实验结果表明,speek
‑
li材料通过促进了bmscs细胞粘附及增值,上调了bmscs的成骨相关基因并提高了矿化能力;体内动物模型结果明显,speek
‑
li周边的骨量明显增加,col 1及ocn等成骨标志性蛋白表达增加。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1