控制植物开花的制作方法
控制植物开花
1.相关申请数据
2.本技术要求2019年6月28日提交的澳大利亚临时申请2019902304号和2019年7月12日提交的澳大利亚临时申请2019902483号的优先权,其各自全部内容通过引用整体并入本文。
技术领域
3.本发明涉及具有改变的花性别(fsl)多肽活性水平的植物和植物部分,以及基于改变的fsl多肽活性和/或fsl基因座基因型控制植物花性别表型的方法。还提供了产生种子败育型和/或单性结实的无核果实的新植物及其生产方法。
背景技术:
4.花性别
5.野生葡萄藤植物,有时称为酿酒葡萄(vitis sylvestris),是雌雄异体的,意味着该植物具有雄性花或雌性花。野生植物花一旦到达冠层顶部并暴露于强光,产生大量小簇花(carmona等人,2008)。由野生葡萄藤雌性植物产生的浆果小且为小簇。由葡萄属物种产生的单性花仍然具有相反性别的萎缩器管。栽培葡萄藤植物是雌雄同体。商业葡萄园具有带雌雄同体花的植物,其中自花受精(自花授粉)被认为是授粉的主要途径。
6.通过观察需要开花的成熟植物和甚至随后的成熟花的物理特征来鉴定花的性别。雄性花具有直立雄蕊、有活力的花粉和发育不全的小的无功能的心皮。雌雄同体花具有直立雄蕊、有活力的花粉和功能性心皮。雌性花的特征在于功能性心皮和反折的雄蕊以及不发芽的不育花粉(carmona等人2008)。仅有雌性花的雌雄异体植物通常具有较低的用于果实生产的商业价值,因为它们需要附近的雄性或雌雄同体植物提供花粉以结实果实(battilana等人,2013)。花型在花发育的早期阶段遵循双性发育模式,在晚期阶段通过器官败育产生单性,当所有花器官的成熟发生时(pannell,2017),这似乎适用于开花植物,并且假定已经随着花的起源而进化(chanderbali等人,2010)。
7.花的性别仍然是商业上感兴趣的,因为它可能是育种以及生产和作物产量(例如种子收集或果实大小、每株植物的果实产量)的问题。在一些物种中,雌性花与雄性花的比例是低产的原因(mao等人2017-在vernicia fordii(油桐)中)。玉米(zea mays)、黄瓜(cucumis sativus)和甜瓜(cucumis melo)是雌雄同株的植物,其已经经历了重要的研究和开发(tanurdzic和banks 2004)以成为用于食物和饲料的重要作物。在不同植物上具有雄性和雌性花的雌雄异体植物包括白花蝇子草(silene latifolia)、番木瓜(carica papaya)、大麻(cannabis sativa)和山木兰(mercurialis annua)(mao等人,2017)。
8.植物花的性别可受环境条件、遗传突变或激素应用的影响或控制,因此认为植物的性身份是定量的(pannell 2017)。在葫芦科家族中,性别表达受遗传、激素和环境因素的网络控制。黄瓜(cucumis sativus)是一种被培育成全雌系以通过仅产生雌性花来提高产量的作物。性表达被认为是由f基因座和m基因座控制的,f基因座调节雌性花的表达,m基因
座被认为调节两性花的表达(yamasaki等人,2001)。性表达能够受植物激素如乙烯和环境刺激调节。在西瓜中,全雌系(gy)、雄性花两性花同株(a)和三性花同株(tm)基因座控制性形式的遗传(ji等人,2015)。在遗传水平上,通过三对基因的组合来控制黄瓜、甜瓜和西瓜的性别决定。雌雄同株的黄瓜由1-氨基环丙烷-1-羧酸合酶(acs)基因控制,该基因在鲤鱼中特异性表达并参与雌性花中雄蕊发育的停滞(manzano等人,2011)。该基因及其家族成员类似地控制具有在乙烯生物合成中的限速酶的西瓜中的花性别,(ji等人,2016),导致两性花(csacs11/csacs2)的功能丧失或促进雌性花(csacs1g)以及与转录因子(cmwip1)相互作用以影响植物表达全雌系或雌雄同体花(ji等人,2017)中起作用。
9.乙烯生物合成酶1-氨基环丙烷-1-羧酸合酶(acs)在影响雌性花在雌雄同株的、雄性花两性花同株的和全雌系同体黄瓜植物中的表达中具有关键作用(yamasaki等人2000;yamasaki等人2001)。发现cs-acs2仅在全雌系黄瓜植物中表达,并且负责引起更高水平的乙烯产生并由f基因座调节(yamasaki等人2001)。乙烯是促进甜瓜和黄瓜雌性花发育的主要激素,而赤霉素在这些植物中具有相反的作用(yamasaki等人2005)。与对葫芦物种(黄瓜、甜瓜和南瓜)的雌性化效应相反,乙烯在西瓜中具有雄性化效应(manzano等人,2011)。jie等人(2017)进一步证明了乙烯和乙烯竞争剂,赤霉素和硝酸银与在黄瓜中公开的反应相比在西瓜的不同遗传背景中的作用。这些结果表明激素产生和应答具有显著的相互作用和对植物遗传学的依赖,但这仍有待完全阐明(jie等人2017)。
10.控制或改变花的性别在育种和开发杂种或种群中具有实际应用。自从peterson和anhder(1960)报道了赤霉素在黄瓜中的雄性化作用,它已被广泛用于在所有雌性黄瓜栽培品种中保持全雌系的育种品系和产生种子。这种全雌系自交品系降低了育种和开发成本,可以维持或提供产量提高和种子质量。
11.虽然有性表型的决定因素是多样的,但是仍然不清楚这些基因的表达变化是否是器官性别决定的原因或结果。因此有需要显示雌性发育的特定雄性是否是主性控制基因的下游调控基因。在葡萄属中,激素可以改变花的性发育,并且细胞分裂素已经显示在该过程中起主要作用(negi和olmo,1966,1971;zhang等人,2013)。
12.在葡萄属物种的葡萄藤中,花性别基因座与连锁群2(lg2)的位置先前由dalbo等人(2000)和riaz等人(2006)提出位于染色体2上接近遗传标记vvis3。chaib等人(2010)在微葡萄藤和微小葡萄藤群体中进行了证实。fetcher等人,(2012)鉴定了编码腺嘌呤磷酸核糖基转移酶的vviaprt,其作为区分雌性和雄性/雌雄同体植物的标志物。fetcher等人,(2012)预测了11个基因,并且报道了腺嘌呤磷酸核糖基转移酶(aprt,现在称为aprt3)在确定葡萄藤花的性别中具有关键作用,并且其表达与雌性花一致。然而,coito等人(2017)发现aprt3区分了雄性和雌性以及雌雄同体植物,提出了包括第三个未知基因的模型。赤霉素(ga)被认为是促进黄瓜雄性花产生和抑制雌性花发育的乙烯竞争剂(friedlander等人,1977)。
13.尽管已经提出许多候选基因作为葡萄藤中花性别的遗传控制剂,但是控制花性别的基因仍然是未知的。
14.无核葡萄
[0015]“无核”鲜食葡萄品种由于花受精和种子开始发育,但在早期(即败育)停止发育,只在果实中留下种子的痕迹,从而产生无籽果实。葡萄mads-box蛋白5(vvmads5,又称
vviagl11)基因的突变基因座(无论是杂合状态还是纯合状态)与葡萄藤的无籽果实(sdl1)密切相关。该突变在编码序列的590bp处有一个g到t的替换,导致arg-197leu的替换,最近被假设为与种子败育型无核的表型有关(royo等人,2018)。
[0016]
尽管在授粉后产生种子痕迹的种子败育型无核葡萄的遗传控制被认为是由于mads5基因中的突变(sdl1)造成的,但是对葡萄藤中单性结实的无核浆果发育的遗传控制是未知的或未理解的。
[0017]
微葡萄藤
[0018]
本发明人(boss和thomas,nature,2002)描述了具有快速开花表型的矮小葡萄植物(称为微葡萄藤)的发育,并且在葡萄藤ga不敏感基因(vvgai1)中具有snp。vvgai1和vvgai1之间从t到a、的单个核苷酸差异在翻译区的位置231。vvgai1等位基因中存在的点突变将保守della结构域的亮氨酸残基转化为组氨酸。突变基因赤霉酸不敏感基因是显性的(在杂合(gai1/gai1)或纯合状态(gai1/gai1)中),导致矮态型和快速开花表型。
[0019]
葡萄藤育种与改良
[0020]
对于葡萄藤改良,需要修饰并能够控制用于育种目的的花的性别以组合或维持有利的表型性状。对于鲜食葡萄育种和生产,希望生产不产生种子痕迹的真单性结实的无核果实。对于城市/室内耕作和覆盖耕作,希望具有可以高密度生长并产生无核的新鲜果实的矮小鲜食葡萄选择。
技术实现要素:
[0021]
本发明至少部分基于发明人的惊人发现,即被称为花性别(fsl)基因座的基因座负责被子植物如葡萄藤中的花性别,并且不同的fsl基因座基因型和由其表达的多肽可用于确定、控制和/或选择花性别表型,即分别为雌性、雄性或雌雄同体花表型。本发明人已经表征了fsl基因座负责雄性器官发育,表现类似于sp在oberles 1938年的花性别确定模型,即在葡萄属物种中。它在雄性和雌雄同体中占优势。在雌性中,基因座是隐性和无功能性的。本发明人还证实了雌性(fsl/fsl)和雌雄同体(fsl/fsl或fsl/fsl)基因型之间在fsl基因座的植物富含at序列和锌结合(platz)结构域内的单核苷酸多态性(snp)和各自的花性别表型之间100%的一致性。酿酒用葡萄
[0022]
因此,在第一方面,本发明提供了与具有赋予雄性或雌雄同体花表型的fsl基因座基因型的相应植物或其部分相比具有改变的花性别(fsl)多肽活性水平的植物或其部分。
[0023]
在一个实例中,与具有赋予雌雄同体花表型的fsl基因座基因型的相应植物或其部分相比,植物或其部分具有改变水平的fsl多肽活性。在一个实例中,赋予雌雄同体花表型的fsl基因座基因型包括fsl基因座的雌雄同体等位基因。在一个实例中,由fsl基因座的雌雄同体等位基因编码的fsl多肽包括seq id no:1所示氨基酸序列,其生物活性片段或与seq id no:1所示序列具有至少40%同一性的氨基酸序列。例如,由fsl基因座的雌雄同体等位基因编码的fsl多肽可包括与seq id no:1所示序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或至少96%同一性的氨基酸序列。例如,fsl多肽可包括与seq id no:1所示序列具有至少97%、至少98%或至少99%同一性的氨基酸序列。在描述包括与seq id no:1所示序列具有同一性水平的氨基酸序列的示例性fsl多肽的每个前述实例中,fsl多肽可以是seq id no:1所示fsl多肽的直系同源物。在一个具体实
例中,fsl多肽包括seq id no:1所示的氨基酸序列。
[0024]
在一个实例中,与具有赋予雄性花表型的fsl基因座基因型的相应植物或其部分相比,植物或其部分具有改变水平的fsl多肽活性。在一个实例中,赋予雄性花表型的fsl基因座基因型包括fsl基因座的雄性等位基因。在一个实例中,由fsl基因座的雌雄同体等位基因编码的fsl多肽包括seq id no:3所示氨基酸序列,其生物活性片段或与seq id no:3所示序列具有至少40%同一性的氨基酸序列。例如,由fsl基因座的雄性等位基因的fsl多肽可包括与seq id no:3所示序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%或至少96%同一性的氨基酸序列。例如,fsl多肽可包括与seq id no:3所示序列具有至少97%、至少98%或至少99%同一性的氨基酸序列。在描述包括与seq id no:3所示序列具有同一性水平的氨基酸序列的示例性fsl多肽的每个前述实例中,fsl多肽可以是seq id no:3所示fsl多肽的直系同源物。在一个具体实例中,fsl多肽包括seq id no:3所示的氨基酸序列。
[0025]
在一个实例中,植物或其部分包括含有编码fsl多肽的多核苷酸序列的fsl基因座,其中多核苷酸序列相对于野生型fsl基因座等位基因的相应多核苷酸序列被修饰,该野生型fsl基因座等位基因在表达时赋予雄性花或雌雄同体花表型。例如,编码fsl多肽的多核苷酸序列可以相对于fsl基因座的野生型雌雄同体等位基因的相应多核苷酸序列被修饰。例如,编码fsl多肽的多核苷酸序列可以相对于fsl基因座的野生型雄性等位基因的相应多核苷酸序列被修饰。在一些实例中,编码fsl基因座的植物富含at序列和锌结合(platz)结构域的多核苷酸序列的区域可以例如相对于编码相应野生型platz结构域的多核苷酸序列被修饰。在一个实例中,编码野生型platz结构域的多核苷酸序列编码seq id no:1所示序列的残基26至残基75所示的氨基酸序列。在一个实例中,编码fsl多肽的多核苷酸序列包括相对于野生型fsl基因座等位基因的相应多核苷酸序列的一个或多个核苷酸添加、缺失或替换,其当表达时赋予雄性或雌雄同体花表型,例如在编码platz结构域的序列中的一个或多个核苷酸添加、缺失或替换。例如,编码fsl多肽的多核苷酸序列可以在相对于seq id no:6或7中所示orf序列的位置153和189之间,例如位置155和159之间(或在相应基因组序列的一个或多个相应核苷酸位置)包括一个或多个(例如1、2、3、4、5、6、7、8、9、10或更多个)核苷酸添加、缺失或替换。例如,编码fsl多肽的多核苷酸序列可具有相对于seq id no:6或7中所示orf序列在位置153和189之间(或在相应基因组序列的一个或多个相应核苷酸位置)缺失的一个或多个(例如1、2、3、4、5、6、7、8、9、10或更多个)核苷酸。例如,编码fsl多肽的多核苷酸序列可在相对于seq id no:6或7所示orf序列的155和159位之间缺失一个或多个t(例如t、tt或ttt)(或在相应基因组序列的一个或多个相应核苷酸位置缺失一个或多个t)。例如,编码fsl多肽的多核苷酸序列可具有相对于seq id no:6或7所示orf序列在155和159位之间添加的一个或多个t(例如t、tt或ttt)(或在相应基因组序列的一个或多个相应核苷酸位置添加的一个或多个t)。在一些实例中,编码fsl多肽的多核苷酸序列已被基因编辑。
[0026]
在一些实例中,相对于由相应的野生型fsl基因座等位基因编码的fsl多肽,由经修饰的多核苷酸序列编码的fsl多肽包括一个或多个氨基酸添加、缺失或替换(例如,编码多核苷酸序列的一个或多个核苷酸添加、缺失或替换的结果)。例如,植物或其部分可包括fsl多肽,该fsl多肽相对于由相应野生型fsl基因座等位基因编码的相应氨基酸序列在
platz结构域中包括一个或多个氨基酸添加、缺失或替换。在一个实例中,由相应的野生型fsl基因座等位基因编码的platz结构域包括seq id no:1中所示序列的残基26至残基75的氨基酸序列。在一些实例中,fsl多肽是截短的。在一些实例中,植物或其部分不存在fsl多肽或其结构域,例如platz结构域。
[0027]
在一些实例中,植物或其部分包括靶向fsl基因座的信使rna(mrna)的rna干扰(rnai)剂,由此与不包括rnai剂的相应植物或其部分相比降低植物或其部分中的fsl多肽活性。根据其中该植物或植物部分包括rnai剂的实例,该植物或其部分可以用用于表达该rnai剂的构建体(例如,表达该rnai剂的表达载体)转染和/或已经整合到其基因组中。rnai剂可以是本领域已知的或本文描述的任何rnai剂。
[0028]
在一个实例中,相应的野生型fsl基因座等位基因是fsl基因座的雌雄同体等位基因。根据该实例,相应野生型fsl基因座等位基因的orf可以包括seq id no:6所示的多核苷酸序列,与其具有至少60%同一性的序列,或其对应于植物物种的直系同源序列。在一个实例中,相应野生型fsl基因座等位基因的orf包括与seq id no:6所示序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列。在描述相应野生型fsl基因座等位基因的orf的每个前述实例中,等位基因包括相对于seq id no:6所示序列具有百分比水平同一性的序列,野生型fsl基因座等位基因可以是seq id no:6所示序列的直系同源物。在这点上,seq id no:6中所示的序列代表vitus vinifera的fsl基因座的雌雄同体等位基因的orf。在一个具体实例中,相应野生型fsl基因座等位基因的orf包括seq id no:6所示的序列。
[0029]
在另一个实例中,相应的野生型fsl基因座等位基因是fsl基因座的雄性等位基因。根据该实例,相应野生型fsl基因座等位基因的orf可以包括seq id no:7所示的多核苷酸序列,与其具有至少60%同一性的序列,或其对应于植物物种的直系同源序列。在一个实例中,相应野生型fsl基因座等位基因的orf包括与seq id no:6所示序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列。在描述相应野生型fsl基因座等位基因的orf的每个前述实例中,等位基因包括相对于seq id no:7所示序列具有百分比水平同一性的序列,野生型fsl基因座等位基因可以是seq id no:7所示序列的直系同源物。在这点上,seq id no:7中所示的序列代表vitus vinifera的fsl基因座的雄性等位基因的orf。在一个具体实例中,野生型fsl基因座的orf包括seq id no:7所示的序列。
[0030]
在一个实例中,相应的野生型fsl基因座等位基因包括编码platz结构域的多核苷酸序列,该platz结构域包括seq id no:1所示序列的残基26至残基75的氨基酸序列或与其具有至少70%同一性的氨基酸序列。例如,相应的野生型fsl基因座等位基因可以包括编码platz结构域的序列,platz结构域包括与seq id no:1中所示序列的残基26至残基75所示氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少96%同一性、至少97%同一性、至少98%或至少99%同一性的氨基酸序列。在一个具体实例中,相应的野生型fsl基因座等位基因包括编码platz结构域的序列,platz结构域包括seq id no:1中所示序列的残基26至残基75的氨基酸序列。
[0031]
在一些实例中,相对于相应野生型植物或其部分中fsl多肽活性的水平,植物或植物部分中的fsl多肽活性降低。例如,相对于相应野生型植物或其部分中的fsl多肽活性水
平,植物或植物部分中的fsl多肽活性可降低至少10%。例如,相对于相应野生型植物或其部分中fsl多肽活性的水平,植物或植物部分中的fsl多肽活性可降低至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%。
[0032]
在上述每个实例中,fsl多肽活性可以相对于包括fsl基因座的雄性或雌雄同体等位基因的相应植物或其部分中fsl多肽活性的水平降低。例如,fsl多肽活性可相对于相应雌雄同体野生型植物或其部分中fsl多肽活性的水平,或相对于相应雄性野生型植物或其部分中fsl多肽活性的水平可降低。
[0033]
在描述fsl多肽活性水平降低的植物或植物部分的每个前述实例中,fsl多肽活性降低可以由fsl多肽的表达相对于相应野生型植物或其部分的表达水平的相应降低引起。可替换地或附加地,fsl多肽活性的降低可由fsl基因座mrna的表达相对于相应野生型植物或其部分的表达水平的相应降低引起。
[0034]
在一些实例中,在植物或植物部分中消除fsl多肽活性。例如,fsl多肽表达可被完全抑制或编码fsl多肽的fsl基因座可在植物或其部分中敲除。
[0035]
在一个实例中,植物或其部分中fsl多肽活性的改变导致植物花的雄性生殖部分缺失或无功能。例如,本文所述fsl多肽活性的降低可导致植物花的雄性生殖部分或植物部分缺失或无功能。在一些实例中,由于fsl多肽的活性改变(例如降低),花的雄性生殖部分存在但无功能。花的无功能性雄性生殖部分可能由于fsl多肽活性的改变(例如降低)而发育不足,导致其是无功能性的。
[0036]
在一些实例中,植物产生雄性不育的花。
[0037]
本发明还提供了产生表型雌性花的fsl多肽活性水平降低的植物或其部分,其中与产生包括功能性雄性生殖部分的花的植物或植物部分相比,fsl多肽活性水平降低。在一些实例中,植物或植物部分可以是具有本文所述fsl多肽活性水平改变的植物或植物部分,例如,相对于包括fsl基因座的雄性或雌雄同体等位基因的对应植物或植物部分,fsl多肽活性水平改变。在一些实例中,植物或植物部分可包括对赋予雌性花表型的雌性等位基因(f/f)纯合的fsl基因座。在一些实例中,fsl基因座(f/f)基因型在植物或植物部分中是非天然存在的。
[0038]
本发明还提供了产生无核果实的植物或其部分,该植物包括:
[0039]
(i)赋予植物矮态型的多核苷酸;和
[0040]
(ii)赋予雌性花表型的雌性等位基因(f/f)纯合的花性别(fsl)基因座。
[0041]
在一个实例中,fsl基因座的雌性等位基因的orf包括seq id no:5中所示的序列,或与其具有至少70%同一性的序列,条件是对应于seq id no:5中所示序列的位置621的核苷酸是a。例如,fsl基因座的雌性等位基因的orf可以包括与seq id no:5所示序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列,条件是对应于seq id no:5所示序列的位置621的核苷酸是a。在一些实例中,fsl基因座的雌性等位基因的orf包括seq id no:5中所示的序列。
[0042]
在描述fsl基因座的雌性等位基因的orf的前述实例的每一个中,orf与seq id no:5所示序列具有百分比水平的同一性,fsl基因座的雌性等位基因可以是对应于植物物种的seq id no:5所示序列的直系同源物。
[0043]
本发明还提供了具有如本文所述的改变的fsl多肽活性水平的植物或其部分,其
中植物包括赋予植物矮态型的多核苷酸。根据该实施方案的植物或植物部分产生无核果实。
[0044]
在描述产生无核果实的植物或植物部分的每个前述实例中,赋予矮态型的多核苷酸相对于相应的野生型多核苷酸序列被改变。
[0045]
在一个实例中,赋予矮态型的多核苷酸是赤霉酸不敏感(gai1)基因或其片段的变体。gai1基因的变体编码变体gai1蛋白。在一个实例中,赋予植物矮态型的gai1基因或其片段的变体在编码della结构域的区域中包括一个或多个突变。例如,编码gai1蛋白的della结构域的区域中的一个或多个突变可改变植物或植物部分的赤霉酸(ga)响应特性。一个或多个突变可选自氨基酸替换、缺失或添加。della结构域中的一个或多个突变可以防止植物或植物部分响应ga信号转导。因此,在一些实例中,包括gai1基因或其片段的变体的植物或植物部分对ga信号转导无反应或反应不佳。在一个实例中,变体gai1蛋白包括seq id no:8中所示的在位置38处具有leu至his替换的序列,或具有seq id no:8中所示序列的至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的序列,条件是对应于seq id no:8的位置38的della结构域的leu被更大的碱性残基例如his替换。在优选的实施方案中,变体gai1蛋白包括与seq id no:8所示序列具有至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%或至少99.8%同一性的序列,条件是对应于seq id no:8的位置38的della结构域的leu被更大的碱性残基例如his替换。在描述包括seq id no:8中所示序列具有百分比水平同一性的序列的变体gai1蛋白的每个前述实例中,变体gai1蛋白可以是seq id no:8中所示序列的直系同源物,包括在对应于seq id no:8的残基38的位置处的leu替换,例如用较大的碱性残基如his替换。在一个实例中,变体gai1蛋白序列包括seq id no:9所示的序列。
[0046]
在一个实例中,赋予矮态型的gai1基因或其片段的变体以纯合(gai1/gai1)状态存在。
[0047]
在一个实例中,赋予矮态型的gai1基因或其片段的变体以杂合(gai1/gai1)状态存在。
[0048]
在一个实例中,della结构域例如由于一个或多个突变而从gai1基因或其片段中改变、截短或缺失。
[0049]
在另一个实例中,gai1蛋白或其della结构域被沉默,例如转录后沉默。根据该实例,赋予植物矮态型的多核苷酸可以是靶向gai1蛋白的mrna转录物(例如对应于della结构域)的rnai剂。
[0050]
在上述每个实例中,当花未被授粉时,植物或其部分产生单性结实的无核果实,当花被有活力的花粉授粉时,植物或其部分产生含有种子的果实。
[0051]
在每个前述实例中,植物或其部分进一步包括赋予植物或其部分无籽果实的多核苷酸。
[0052]
在一个实例中,赋予植物或其部分无籽果实的多核苷酸相对于相应的野生型基因或其野生型等位基因被改变。例如,赋予植物或其部分无籽果实的多核苷酸可包括相对于相应野生型基因或其野生型等位基因的一个或多个突变。一个或多个突变可选自氨基酸替换、缺失或添加。
[0053]
在一个实例中,赋予植物或植物部分无籽果实的多核苷酸是葡萄mads盒蛋白5
(vvmads5)基因座的变体。
[0054]
在一个实例中,vvmads5基因座编码包括seq id no:10所示氨基酸序列的vvmads5蛋白,且变体vvmads5蛋白包括用疏水氨基酸例如leu(r197l)替换seq id no:10所示序列的197位arg。在一个实例中,变体vvmads5基因座编码变体vvmads5蛋白,其包括seq id no:11中所示的氨基酸序列,或与seq id no:11中所示的序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的序列,条件是相对于seq id no:11在位置197处的氨基酸是疏水性氨基酸,例如leu。例如,变体vvmads5基因座可以编码包括与seq id no:11中所示序列具有至少99.1%、至少99.2%、至少99.3%、至少99.4%或至少99.5%同一性的氨基酸序列的变体vvmads5蛋白,条件是相对于seq id no:11在197位的氨基酸是疏水性氨基酸,例如leu。在描述编码变体vvmads5蛋白的变体vvmads5基因座的每个前述实例中,变体vvmads5蛋白包括相对于seq id no:11中所示序列具有百分比水平同一性的序列,变体vvmads5蛋白可以是seq id no:11中所示序列的直系同源物,其在位置197处包括相应氨基酸替换。
[0055]
在一个实例中,变体vvmads5基因座编码包括seq id no:11所示氨基酸序列的变体vvmads5蛋白。
[0056]
在一个实例中,赋予无籽果实的变体vvmads5基因座以纯合状态存在。
[0057]
在一个实例中,赋予无籽果实的变体vvmads5基因座以杂合状态存在。
[0058]
在一个实例中,变体vvmads5基因座包括导致vvmads5蛋白缺失或截短的一个或多个突变。
[0059]
在另一个实例中,vvmads5蛋白被沉默,例如转录后沉默。根据这个实例,向植物赋予无籽果实的多核苷酸可以是靶向由vvmads5基因座编码的mrna转录物的rnai剂。
[0060]
本发明还提供了产生无核果实的植物或其部分,该植物包括:
[0061]
(i)花性别(fsl)基因座基因型,其为如本文所述的杂合型(fsl/fsl),或为如本文所述的雌雄同体fsl基因座等位基因(fsl/fsl)的纯合型;
[0062]
(ii)如本文所述的赋予植物矮态型的多核苷酸;和
[0063]
(iii)如本文所述的赋予无籽果实的多核苷酸。
[0064]
在描述进一步包括赋予无籽果实的多核苷酸的植物或植物部分的前述实例的每一个中,当花未被授粉时,植物产生单性结实的无核果实,当花被有活力的花粉授粉时,植物产生种子败育型果实。
[0065]
在一个实例中,如本文所述的植物是雌雄异体植物物种。
[0066]
在另一个实例中,如本文所述的植物是雌雄同体植物物种。
[0067]
在上述每个实施例中,植物优选是产生果实的植物,即被子植物。例如,植物可以是生产浆果的植物、生产柑果的植物、生产核果的植物、生产梨果的植物或生产瓠果的植物。
[0068]
在一个实例中,植物是生产浆果的植物。例如,植物可以是葡萄属种(vitis sp.),即例如,选自以下组成的组的葡萄属物种:欧洲葡萄(vitis vinifera)、vitis lambrusca、圆叶葡萄(vitis rotundifolia)、夏葡萄(vitis aestivalis)及其杂种。在一个实例中,葡萄属物种产生鲜食葡萄。在另一个实例中,葡萄属物种生产酿酒葡萄。
[0069]
在一个实例中,植物部分是细胞、种子、果实、根、植物插条或接穗。
[0070]
本文还提供了控制植物中花性别的方法,该方法包括与具有赋予雄性或雌雄同体花表型的fsl基因座基因型的相应植物或其部分中的fsl多肽活性水平相比,改变植物或其部分中的fsl多肽活性水平。在一个实例中,与表达由fsl基因座的野生型雌雄同体等位基因编码的fsl多肽的相应植物或其部分相比,植物或其部分具有改变水平的fsl多肽活性。在另一个实例中,植物或其部分与表达由fsl基因座的野生型雄性等位基因编码的fsl多肽的相应植物或其部分相比具有改变的fsl多肽活性水平。本文描述了由fsl基因座的野生型雌雄同体和雄性等位基因编码的示例性fsl多肽。
[0071]
在一个实例中,赋予雌雄同体花表型的fsl基因座基因型包括编码fsl多肽的fsl基因座的雌雄同体等位基因,fsl多肽包括seq id no:1所示氨基酸序列,其生物活性片段或与seq id no:1所示序列具有至少40%同一性的氨基酸序列;和
[0072]
赋予雄性花表型的fsl基因座基因型包括编码fsl多肽的fsl基因座的雄性等位基因,fsl多肽包括seq id no:3所示氨基酸序列,其生物活性片段或与seq id no:3所示序列具有至少40%同一性的氨基酸序列。
[0073]
在一些实例中,具有改变的fsl多肽活性水平的植物或植物部分包括fsl多肽,该fsl多肽包括seq id no:2中所示的氨基酸序列,其生物活性片段,或为与seq id no:2所示序列具有至少40%、至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%同一性的氨基酸序列。
[0074]
在一个实施例中,方法包括修饰含有编码fsl多肽或其生物活性片段的多核苷酸序列的fsl基因座。例如,方法可包括例如相对于编码platz结构域的fsl基因座的野生型雌雄同体或雄性等位基因的相应多核苷酸序列,修饰编码植物富含at序列和锌结合(platz)结构域的fsl基因座的区域。修饰fsl基因座的区域可包括相对于表达时赋予雄性或雌雄同体花表型的野生型fsl基因座等位基因的相应多核苷酸序列,向编码fsl多肽的多核苷酸序列引入一个或多个核苷酸添加、缺失或替换。例如,编码fsl多肽的多核苷酸序列可以相对于fsl基因座的野生型雌雄同体等位基因的相应多核苷酸序列被修饰。例如,编码fsl多肽的多核苷酸序列可以相对于fsl基因座的野生型雄性等位基因的相应多核苷酸序列被修饰。在一个实例中,编码fsl多肽的多核苷酸序列可以在相对于seq id no:6或7中所示序列的位置153和189之间,例如位置155和159之间(或在相应基因组序列的一个或多个相应核苷酸位置)包括一个或多个(例如1、2、3、4、5、6、7、8、9、10或更多个)核苷酸添加、缺失或替换的orf。例如,编码fsl多肽的多核苷酸序列可具有相对于seq id no:6或7中所示序列在位置153和189之间(或在相应基因组序列的一个或多个相应核苷酸位置)缺失的一个或多个(例如1、2、3、4、5、6、7、8、9、10或更多个)核苷酸的orf。例如,编码fsl多肽的多核苷酸序列可在相对于seq id no:6或7所示序列的155和159位之间缺失一个或多个t(例如t、tt或ttt)(或在相应基因组序列的一个或多个相应核苷酸位置缺失一个或多个t)的orf。例如,编码fsl多肽的多核苷酸序列可具有相对于seq id no:6或7所示序列在155和159位之间添加的一个或多个t(例如t、tt或ttt)(或在相应基因组序列的一个或多个相应核苷酸位置添加的一个或多个t)的orf。
[0075]
在一个实施例中,使用基因编辑技术实现fsl基因座的修饰。例如,编码fsl多肽的多核苷酸序列可以使用crispr、talon或zfn技术或其组合进行基因编辑。
[0076]
在一个实例中,由经修饰的多核苷酸序列编码的fsl多肽或其生物活性片段相对
于由相应野生型fsl基因座等位基因编码的fsl多肽包括一个或多个氨基酸添加、缺失或替换(例如,由于编码多核苷酸序列的一个或多个核苷酸添加、缺失或替换)。例如,相对于相应的野生型氨基酸序列,修饰fsl基因座处的多核苷酸可导致fsl多肽的platz结构域中的一个或多个氨基酸添加、缺失或替换。在一些实例中,由修饰的多核苷酸序列编码的fsl多肽是截短的。在一些实例中,由修饰的多核苷酸序列编码的fsl多肽或其结构域,例如platz结构域,在植物或其部分中不存在。
[0077]
在其它实例中,通过用靶向fsl基因座信使rna(mrna)的rna干扰(rnai)剂进行转录后沉默来改变植物或其部分中fsl多肽活性的水平。根据该实施例,该方法可以包括向植物或其部分引入靶向fsl基因座或其等位基因的mrna的rnai剂。例如,该植物或其部分可以用用于表达该rnai剂的构建体(例如,表达该rnai剂的表达载体)转染和/或已经整合到其基因组中。rnai剂可以是本领域已知的或本文描述的任何rnai剂。
[0078]
在一些实例中,fsl基因座的多核苷酸序列相对于相应野生型fsl基因座等位基因的多核苷酸序列被修饰。
[0079]
在一个实例中,相应的野生型fsl基因座等位基因可以是fsl基因座的雌雄同体等位基因。根据该实例,相应野生型fsl基因座等位基因的orf可以包括seq id no:6所示的多核苷酸序列,与其具有至少60%同一性的序列,或其对应于植物物种的直系同源序列。在一个实例中,相应野生型fsl基因座等位基因的orf包括与seq id no:6所示序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列。在一个具体实例中,相应野生型fsl基因座等位基因的orf包括seq id no:6所示的序列。
[0080]
在另一个实例中,相应的野生型fsl基因座等位基因可以是fsl基因座的雄性等位基因。根据该实例,相应野生型fsl基因座等位基因的orf可以包括seq id no:7所示的多核苷酸序列,与其具有至少60%同一性的序列,或其对应于植物物种的直系同源序列。在一个实例中,相应野生型fsl基因座等位基因的orf包括与seq id no:7所示序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列。在一个具体实例中,相应野生型fsl基因座等位基因的orf包括seq id no:7所示的序列。
[0081]
根据如本文所述的控制植物中花性别的方法的实例,相对于相应野生型植物或其部分中fsl多肽活性的水平,植物或植物部分中的fsl多肽活性降低。例如,相对于相应野生型植物或其部分中fsl多肽活性的水平,植物或植物部分中的fsl多肽活性可降低至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、或至少95%。
[0082]
在描述在进行该方法后fsl多肽活性水平降低的植物或植物部分的每个前述实例中,fsl多肽活性的降低可由fsl多肽表达的相应降低或fsl多肽活性的降低或编码fsl多肽的多核苷酸活性的降低引起。可替换地或附加地,fsl多肽活性的降低可由fsl基因座mrna的表达相对于相应野生型植物或其部分(例如相应雌雄同体或雄性野生型植物或其部分)中的表达水平的相应降低引起。
[0083]
在一些实例中,在进行该方法后,在植物或植物部分中消除fsl多肽活性。例如,fsl多肽表达可被完全抑制或编码fsl多肽的fsl基因座可在植物或其部分中敲除。
[0084]
在一个实例中,改变植物或其部分中fsl多肽活性导致植物花的雄性生殖部分缺失或无功能。例如,如本文所述降低fsl多肽活性可导致植物花的雄性生殖部分或植物部分缺失或无功能。在一些实例中,如本文所述降低fsl多肽的活性可导致花的雄性生殖部分无功能(即使存在)。花的无功能性雄性生殖部分可能由于fsl多肽活性的改变(例如降低)而发育不足,导致其是无功能性的。因此,改变植物或其部分中fsl多肽的水平可导致产生表型雌性或雄性不育花的植物或植物部分。
[0085]
在一些实例中,其中fsl多肽活性被改变的植物或植物部分包括如本文所述的赋予矮态型的多核苷酸。在一些实例中,其中fsl多肽活性被改变的植物或植物部分已经包括赋予矮态型的多核苷酸。在其它实例中,该方法包括向植物或植物部分引入赋予矮态型的多核苷酸。
[0086]
在一些实例中,其中fsl多肽活性被改变的植物或植物部分包括如本文所述的赋予无籽果实的多核苷酸。在一些实例中,其中fsl多肽活性被改变的植物或植物部分已经包括赋予无籽果实的多核苷酸。在其它实例中,该方法包括向植物或植物部分引入赋予无籽果实的多核苷酸。
[0087]
在一个实例中,其中fsl多肽活性被改变的植物或植物部分是雌雄异体植物物种。
[0088]
在另一个实例中,其中fsl多肽活性被改变的植物或植物部分是雌雄同体植物物种。
[0089]
在上述每个实施例中,其中fsl多肽活性被改变的植物优选是产生果实的植物,即被子植物。例如,植物可以是生产浆果的植物、生产柑果的植物、生产核果的植物、生产梨果的植物或生产瓠果的植物。
[0090]
在一个实例中,其中fsl多肽活性被改变的植物或植物部分产生浆果。例如,植物可以是葡萄属种(vitis sp.),即例如,选自以下组成的组的葡萄属物种:欧洲葡萄(vitis vinifera)、vitis lambrusca、圆叶葡萄(vitis rotundifolia)、夏葡萄(vitis aestivalis)及其杂种。在一个实例中,葡萄属物种产生鲜食葡萄。在另一个实例中,葡萄属物种生产酿酒葡萄。
[0091]
在一个实例中,植物部分是细胞、种子或种子部分、果实、根、植物插条或接穗。
[0092]
本文还涉及控制植物中花性别的方法,包括相对于具有赋予雌性花表型的fsl基因座基因型的相应植物或其部分中相应fsl多肽的活性水平,增加植物或其部分中fsl基因座的雄性或雌雄同体等位基因编码的fsl多肽的活性水平。
[0093]
在一个实例中,由fsl基因座的雌雄同体等位基因编码的fsl多肽包括seq id no:1所示氨基酸序列,其生物活性片段或与seq id no:1所示序列具有至少40%同一性的氨基酸序列。本文描述和考虑了由fsl基因座的雌雄同体等位基因编码的其它示例性fsl多肽。在一个具体实例中,fsl基因座的雌雄同体等位基因编码包括seq id no:1所示氨基酸序列的fsl多肽或其生物活性片段。
[0094]
在一个实例中,由fsl基因座的雄性等位基因编码的fsl多肽包括seq id no:3所示氨基酸序列,其生物活性片段或与seq id no:3所示序列具有至少40%同一性的氨基酸序列。本文描述和考虑了由fsl基因座的雄性等位基因编码的其它示例性fsl多肽。在一个具体实例中,fsl基因座的雄性等位基因编码包括seq id no:3所示氨基酸序列的fsl多肽或其生物活性片段。
[0095]
在一个实例中,提高植物或其部分中由fsl基因座的雄性或雌雄同体等位基因编码的fsl多肽的活性水平赋予其中存在功能性雄性生殖部分的花表型。
[0096]
本发明还提供了产生产生已知性别的花的植物的方法,该方法包括以下步骤:
[0097]
i)杂交两个亲本植物,
[0098]
ii)从杂交中筛选一种或多种子代植物以确定花性别(fsl)基因座处的基因型,和
[0099]
iii)基于fsl基因座基因型选择能够表现出所需花性别表型的子代植物,其中雌性fsl基因座等位基因纯合的fsl基因座基因型(f/f)赋予雌性花表型,雌性fsl基因座等位基因杂合的fsl基因座基因型和雌雄同体fsl基因座等位基因(f/h)赋予雌雄同体花表型,雌雄同体fsl基因座等位基因纯合的fsl基因座基因型(h/h)赋予雌雄同体花表型,并且对于雄性fsl基因座等位基因和雌性fsl基因座等位基因(m/f)或雌雄同体fsl基因座等位基因(m/h)杂合的fsl基因座基因型赋予雄性花表型,并且对于雄性fsl基因座等位基因(m/m)纯合的fsl基因座基因型赋予雄性花表型,
[0100]
由此产生产生已知性别的花的植物。
[0101]
本文描述了fsl基因座序列,包括雄性、雌性和雌雄同体fsl基因座等位基因序列,并且除非另有说明,应加以必要的变通应用于描述产生本文所述的产生已知性别的花的植物的方法的每个实例。
[0102]
在一个实例中,方法包括选择具有雌性fsl基因座等位基因(f/f)纯合的fsl基因座基因型的子代植物,从而产生产生雌性花的植物。
[0103]
在一个实例中,方法包括选择具有fsl基因座基因型的子代植物,该基因型对于雌性fsl基因座等位基因和雌雄同体fsl基因座等位基因(f/h)是杂合的或对于雌雄同体fsl基因座等位基因(h/h)是纯合的,从而产生产生雌雄同体花的植物。
[0104]
在一个实例中,fsl基因座的雌性等位基因具有包括seq id no:5所示序列或与其具有至少70%同一性的序列的orf,条件是对应于seq id no:5所示序列的位置621的核苷酸是a。例如,fsl基因座的雌性等位基因可以包括含有与seq id no:5所示序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列的orf,条件是对应于seq id no:5所示序列的位置621的核苷酸是a。在一些实例中,fsl基因座的雌性等位基因的orf包括seq id no:5中所示的序列。
[0105]
在描述fsl基因座的雌性等位基因的orf的前述实例的每一个中,orf与seq id no:5所示序列具有百分比水平的同一性,fsl基因座的orf可以是对应于植物物种的seq id no:5所示序列的直系同源物。
[0106]
在一个实例中,fsl基因座的雌雄同体等位基因具有orf,其包括seq id no:6所示的序列,或与seq id no:6所示序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%的同一性的序列,条件是对应于seq id no:6所示序列的位置627的核苷酸是c。在一些实例中,fsl基因座的雌雄同体等位基因的orf包括seq id no:6中所示的序列。
[0107]
在描述fsl基因座的雌雄同体等位基因的orf的前述实例的每一个中,orf与seq id no:6所示序列具有百分比水平的同一性,fsl基因座的orf可以是对应于植物物种的seq id no:6所示序列的直系同源物。
[0108]
本发明还提供了生产产生无核果实的植物的方法,该方法包括以下步骤:
[0109]
i)杂交两种亲本植物,其中一种亲本植物包括fsl基因座,该fsl基因座对于赋予雌性花表型的雌性等位基因(f/f)是纯合的,并且另一种亲本植物包括赋予矮态型的多核苷酸,
[0110]
ii)针对雌性等位基因(f/f)纯合的fsl基因座的存在或不存在,以及赋予矮态型的多核苷酸的存在或不存在,从杂交中筛选一种或多种子代植物,以及
[0111]
iii)选择包括fsl基因座的子代植物,该fsl基因座对于雌性等位基因(f/f)是纯合的并且包括赋予矮态型的多核苷酸,
[0112]
由此产生产生无核果实的植物。
[0113]
本发明还提供了生产产生无核果实的植物的方法,该方法包括以下步骤:
[0114]
i)杂交两种亲本植物,其中至少一种亲本植物包括(a)赋予雌性花表型的纯合fsl/fsl,赋予雌雄同体花表型的纯合(fsl/fsl)、或杂合或纯合(fsl/fsl)的花性别(fsl)基因座,(b)至少一种亲本植物包括赋予矮态型的多核苷酸,和(c)至少一种亲本植物包括赋予无籽果实的多核苷酸,
[0115]
ii)根据以下从杂交中筛选一个或多个子代植物,存在或不存在fsl基因座,该fsl基因座对于雌性表型(fsl/fsl)是纯合的,对于雌雄同体表型(fsl/fsl)是纯合的,或对于雌雄同体表型(fsl/fsl)是杂合的,(b)存在或不存在赋予矮态型的多核苷酸,和(c)存在或不存在赋予无籽果实的多核苷酸,和
[0116]
iii)选择子代植物,包括(a)赋予雌性或雌雄同体花表型的fsl基因座基因型,(b)赋予矮态型的多核苷酸,和(c)赋予无籽果实的多核苷酸,
[0117]
由此产生产生无核果实的植物。
[0118]
一种产生种子败育型无核果实的子代植物,其包括(a)赋予雌雄同体花表型的fsl基因座基因型,(b)赋予矮态型的多核苷酸,和(c)赋予无籽果实的多核苷酸。
[0119]
一种产生单性结实的无核果实得子代植物,其包括(a)赋予雌性花表型的fsl基因座基因型,(b)赋予矮态型的多核苷酸,和(c)赋予无籽果实的多核苷酸。
[0120]
本发明还提供了生产产生无核果实的植物的方法,该方法包括以下步骤:
[0121]
i)杂交两种亲本植物,其中至少一种亲本植物包括对赋予雌性花表型的雌性等位基因(f/f)纯合的fsl基因座,至少一种亲本植物包括赋予矮态型的多核苷酸,并且至少一种亲本植物包括赋予无籽果实的多核苷酸,
[0122]
ii)针对雌性等位基因(f/f)纯合的fsl基因座的存在或不存在,以及赋予矮态型的多核苷酸的存在或不存在,以及赋予无籽果实的多核苷酸的存在或不存在,从杂交中筛选一种或多种子代植物,以及
[0123]
iii)选择包括雌性等位基因(f/f)纯合的fsl基因座,赋予矮态型的多核苷酸和赋予无籽果实的多核苷酸的子代植物,
[0124]
由此产生产生单性结实的无核果实的植物。
[0125]
本发明还提供了生产产生无核果实的植物的方法,该方法包括以下步骤:
[0126]
i)杂交两种亲本植物,其中至少一种亲本植物包括赋予矮态型的多核苷酸,并且至少一种亲本植物包括赋予无籽果实的多核苷酸,
[0127]
ii)针对赋予矮态型的多核苷酸的存在或不存在,以及赋予无籽果实的多核苷酸的存在或不存在,从杂交中筛选一种或多种子代植物,以及
[0128]
iii)选择包括赋予矮态型的多核苷酸和赋予无籽果实的多核苷酸的子代植物,
[0129]
由此产生产生单性结实的无核果实的植物。
[0130]
在描述产生无核果实的方法的每个前述实例中,该方法可以进一步包括:
[0131]
iv)使在iii)中选择的子代与具有与一个或亲本植物相同的基因型但缺乏为其选择子代的多核苷酸的植物回交足够的次数,以产生具有亲本的大部分基因型但包括目的多核苷酸的植物,以及
[0132]
iv)选择具有目的多核苷酸的子代植物,优选其中子代包括雌雄同体fsl基因座等位基因或雌性fsl基因座等位基因或二者,更优选其中子代对于雌性fsl基因座等位基因是纯合的。
[0133]
fsl基因座的雌性等位基因先前已在本文中描述,并且应加以必要的变更应用于产生如本文所述的产生无核果实的植物的方法的每个实例,除非另有说明。在一个具体实例中,fsl基因座的雌性等位基因具有包括seq id no:5所示序列的orf。
[0134]
本文描述了分别赋予矮态型和无籽果实的示例性多核苷酸,并且除非另有说明,在作必要的变更后将其应用于产生如本文所述的产生无核果实的植物的方法的每个实例。在一个具体实例中,赋予矮态型的多核苷酸是编码包括seq id no:9所示序列的变体gai1蛋白的gai1基因的变体。在一个具体实例中,赋予无籽果实的多核苷酸是编码包括seq id no:11所示序列的变体vvmads5蛋白的vvmads5基因座的变体。
[0135]
在一个实例中,产生无核果实的植物是雌雄异体植物物种。
[0136]
在一个实例中,产生无核果实的植物是雌雄同体植物物种。
[0137]
在一个实例中,产生无核果实的植物是产生浆果的植物、产生柑果的植物、产生核果的植物、产生梨果的植物或产生瓠果的植物。
[0138]
在一个实例中,植物产生无核浆果。例如,植物可以是葡萄属种(vitis sp.),即例如,选自以下组成的组的葡萄属物种:欧洲葡萄(vitis vinifera)、vitis lambrusca、圆叶葡萄(vitis rotundifolia)、夏葡萄(vitis aestivalis)及其杂种。在一个实例中,葡萄属物种产生鲜食葡萄。在另一个实例中,葡萄属物种生产酿酒葡萄。
[0139]
本发明还提供了通过本文所述的方法产生的植物或其部分。
[0140]
在一个实例中,植物部分是细胞、种子或种子部分、果实、根、植物插条或接穗。
[0141]
本文还提供了由本文所述植物产生的果实。
[0142]
在一个具体实例中,植物是葡萄属物种(vitis sp.),果实为葡萄。
[0143]
在一个实例中,果实是无核的。在一个实例中,果实是种子败育型无核果实。在一个实例中,果实是单性结实的无核的。
[0144]
本发明还提供了产生果实的方法,该方法包括使本文所述的植物生长从而产生果实。
[0145]
在一个实例中,产生果实的方法进一步包括收获从植物产生的果实。
[0146]
在一个实施例中,生产果实的方法进一步包括加工果实。例如,加工果实可以包括包装果实。例如,加工果实可以包括从果实生产一种或多种产品。
[0147]
本发明还提供了由本文所述的植物或其果实产生的产品。
[0148]
在一个实例中,产品是食品、食品成分、饮料产品或饮料成分。食品可以选自例如鲜食葡萄、果酱、橘子酱、果冻、小葡萄干和葡萄干组成的组。食品成分可以是例如熟葡萄
id no:5所示序列的直系同源物。
[0164]
在一个实例中,fsl基因座的雌雄同体等位基因具有包括seq id no:6所示序列或与其具有至少70%同一性的序列的orf,条件是对应于seq id no:6所示序列的位置627的核苷酸是c。本文描述了示例性雌雄同体fsl基因座等位基因序列。
[0165]
在一些实例中,fsl基因座的雌雄同体等位基因具有包括seq id no:6所示序列的orf。
[0166]
在描述具有与seq id no:6所示序列具有百分水平同一性的orf的fsl基因座的雌雄同体等位基因的每个前述实例中,fsl基因座的雌雄同体等位基因可以是对应于植物物种的seq id no:6所示序列的直系同源物。
[0167]
在一个实例中,fsl基因座的雄性等位基因具有包括seq id no:7所示序列或与其具有至少70%同一性的序列的orf,条件是对应于seq id no:7所示序列的位置627的核苷酸是c。本文描述了示例性雄性fsl基因座等位基因序列。在一些实例中,fsl基因座的雄性等位基因具有包括seq id no:7所示序列的orf。
[0168]
在描述具有与seq id no:7所示序列具有百分水平同一性的orf的fsl基因座的雄性等位基因的每个前述实例中,fsl基因座的雄性等位基因可以是对应于植物物种的seq id no:7所示序列的直系同源物。
[0169]
在一个实施例中,通过基于pcr的测定确定植物在fsl基因座的基因型。
[0170]
除非另外具体说明,否则本文中的任何实施方案应被理解为比照任何其他实施方案进行必要的变更。
[0171]
本发明不限于本文描述的特定实施方案的范围,这些实施例仅用于示例性目的。如本文,功能等同的产品、组合物和方法显然在本发明的范围内。
[0172]
在整个说明书中,除非另有特别说明或上下文另有要求,引用单个步骤、物质组成、步骤组或物质组成组应被认为包括一个和多个(即一个或更多个)那些步骤、物质组成、步骤组或物质组成组。
[0173]
以下通过以下非限制性实施例并参考附图描述本发明。
附图说明
[0174]
图1.(a)来自赤霞珠(cabernet sauvignon)的fsl雌雄同体等位基因(h)的dna序列;(b)来自葡萄属物种克隆04c023v0003的fsl雌性等位基因(f)的dna序列;(c)来自葡萄属物种克隆04c023v0006的fsl雌雄同体等位基因(h)的dna序列。(d)来自葡萄属物种克隆04c023v0016的fsl雄性等位基因(m)的dna序列。在(a)-(d)的每一个中,开放阅读框加下划线,编码platz结构域的序列加粗。
[0175]
图2.使用clustal o(1.2.4)进行fsl基因座的雌性等位基因(seq id no:5)、雌雄同体等位基因(seq id no:6)和雄性等位基因(seq id no:7)的开放阅读框(orf)的多重序列比对。
[0176]
图3.(a)来自赤霞珠(cabernet sauvignon)和葡萄属物种克隆04c023v0006的fsl雌雄同体等位基因(h)的蛋白序列;(b)来自葡萄属物种克隆04c023v0003的fsl雌性等位基因(f)的蛋白a序列;(c)来自葡萄属物种克隆04c023v0006的fsl雌雄同体等位基因(h)的蛋白序列。在(a)-(c)的每一个中,编码platz结构域的序列用粗体表示。
[0177]
图4.来自vitus vinifera的雌雄同体蛋白序列的进化树。
[0178]
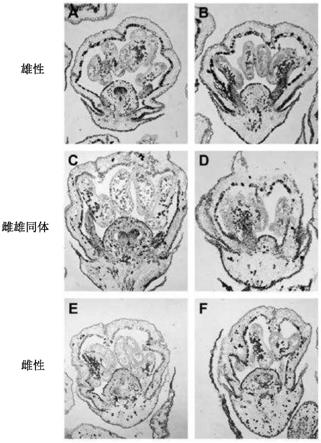
图5.显示fsl在花发育的1-2期的表达,如通过修饰的e-l系统测定的(coombe(1995))。原位杂交用于定位(a和b)雄性花、(c和d)雌雄同体和(e和f)雌性花中的fsl转录物。花被(p)器官包封生殖器官。红色和绿色箭头指向(a)中雄蕊的花药和花丝。胚珠由蓝色箭头标记。
[0179]
图6.通过rt-qpcr测量的叶片和早花中fsl的相对基因表达
[0180]
图7.靶向葡萄中fsl基因座的crispr指导rna的体外筛选。选择命名为sgrnafs1和sgrnafs4的指导rna用于微葡萄藤的crispr编辑。
[0181]
图8.具有靶向fsl的crispr构建体的微葡萄藤的遗传转化。
[0182]
图9.说明雌雄同体和fsl基因编辑的植物之间花表型的差异。雌雄同体花具有直立的雄蕊(a),而fsl基因编辑的植物具有很少形成的具有收缩花丝的雄蕊(b)。如通过花粉管的延伸所看到的,花粉在雌雄同体花中是有活力的(c),而如通过花粉萌发测定所确定的,fsl编辑的基因没有可育的花粉(d)。
[0183]
图10.显示在fsl敲除植物中发现的最高频率突变。前13个突变频率表明大多数突变是指导rna的第16个碱基处的t插入或t凝胶化。注-仅显示了总20bp指导中的17bp。
[0184]
图11.fsl敲除和h等位基因的氨基酸比对。t插入和t缺失都产生无义突变,导致蛋白合成的早期终止。
[0185]
图12.显示来自未授粉(a)和用花粉授粉以产生有活力的褐色种子(b)的雌性微葡萄藤的单性结实的无核果实。
[0186]
图13.显示来自雌性微葡萄藤的单性结实的和种子败育型无核果实(a),并且当用花粉授粉时产生无活力的种子痕迹(b)。
[0187]
图14.显示了来自雌雄同体微葡萄藤(a)的种子败育型无核果实。具有褐色种子的典型雌雄同体微葡萄藤植物(b)。
[0188]
图15.提供了crispr/cas9载体和命名为fs1和fs4的指导rna的克隆位置的示意图。
[0189]
图16.提供了fs1和fs4获得的fsl基因座突变体的dna序列比对,显示以》10%的频率发生的突变的类型和位置。fs1和fs4的突变主要涉及碱基t并发生在pam位点的5'端。
[0190]
图17.在t1代crispr/cas9花性别品系中获得的fsl基因座的纯合突变体的基因组dna序列比对。针对雌雄同体基因座和纯合突变品系进行dna序列翻译和比对。fs4指导突变的4个品系和fs1指导突变的3个品系。fs1指导序列导致在距起始密码子157bp处的t插入或t缺失或双缺失。fs4指导序列导致5bp缺失,从起始密码子起184bp处的t插入和从起始密码子起182bp处的ct缺失和从起始密码子起180bp处的10bp缺失。突变用下划线标出。外显子-内含子边界用箭头表示。
[0191]
图18.针对fs1和fs4指导rna获得的t1代crispr/cas9花性别品系中获得的fsl基因座的纯合突变体的氨基酸序列比对。比对显示突变对蛋白序列的影响。
[0192]
序列表的关键字
[0193]
seq id no:1是对应于来自葡萄的fsl雌雄同体等位基因(h)的氨基酸序列。
[0194]
seq id no:2是对应于来自多种葡萄的fsl雌性等位基因(f)的氨基酸序列。
[0195]
seq id no:3是对应于来自多种葡萄的fsl雄性等位基因(m)的氨基酸序列。
[0196]
seq id no:4是对应于来自赤霞珠的fsl雌雄同体等位基因(h)的开放阅读框(orf)dna序列。
[0197]
seq id no:5是对应于来自多种葡萄的fsl雌性等位基因(f)的开放阅读框(orf)序列。
[0198]
seq id no:6是对应于来自多种葡萄的fsl雌雄同体等位基因(h)的开放阅读框(orf)序列。
[0199]
seq id no:7是对应于来自多种葡萄的fsl雄性等位基因(m)的开放阅读框(orf)序列。
[0200]
seq id no:8是由葡萄中的gai1基因编码的赤霉酸不敏感(gai1)della蛋白的氨基酸序列。
[0201]
seq id no:9是包括leu至his替换的变体gai1蛋白的氨基酸序列,其由葡萄中的变体gai1基因编码。
[0202]
seq id no:10是由葡萄中的vvmads5基因编码的vitus vinifera mads-盒5(vvmads5)蛋白的氨基酸序列。
[0203]
seq id no:11是由葡萄中变体vvmads5基因编码的变体vvmads5蛋白的氨基酸序列。
[0204]
seq id no:12是命名为低聚核苷酸dt b26的引物的dna序列。
[0205]
seq id no:13是命名为csfs1_cds_f1的引物的dna序列。
[0206]
seq id no:14是命名为fsl_rt_f1的引物的dna序列。
[0207]
seq id no:15是命名为fsl_rt_r1的引物的dna序列。
[0208]
seq id no:16是对应于命名为“guide fs1”(反义方向)的单指导rna(sgrna)的dna序列。
[0209]
seq id no:17是对应于命名为“guide fs4”(反义方向)的单指导rna(sgrna)的dna序列。
[0210]
seq id no:18是对应于命名为“guide fs2”(反义方向)的单指导rna(sgrna)的dna序列。
[0211]
seq id no:19是对应于命名为“guide fs3”(有义方向)的单指导rna(sgrna)的dna序列。
[0212]
seq id no:20是命名为vvsdlf1的引物的dna序列。
[0213]
seq id no:21是命名为vvsdlf2的引物的dna序列。
[0214]
seq id no:22是命名为vvsdlrev的引物的dna序列。
具体实施方式
[0215]
一般技术和定义
[0216]
除非另有明确定义,否则本文使用的所有技术和科学术语均应被视为具有与本领域(例如,在植物分子遗传学、植物育种、细胞培养、蛋白化学、葡萄酒生产和生物化学中)普通技术人员通常理解的相同含义。
[0217]
除非另有说明,本发明中使用的重组dna、重组蛋白、细胞培养和免疫学技术是本领域技术人员熟知的标准方法。这些技术在以下来源文献中都有描述和解释,例如,
j.perbal,《分子克隆实用指南》(a practical guide to molecular cloning),john wiley and sons(1984),sambrook等人,《分子克隆:实验室手册》(molecular cloning:a laboratory manual),cold spring harbor laboratory press(1989),t.a.brown(编),《基本分子生物学:一种实用方法》(essential molecular biology:a practical approach),第1卷和第2卷,irl press(1991),d.m.glover和b.d.hames(编),《dna克隆:一种实用方法》(dna cloning:a practical approach),第1-4卷,irl press(1995和1996),以及f.m.ausubel等人,(编),《分子生物学现行实验指南》(current protocols in molecular biology),greene pub.associates and wiley-interscience(1988,包括目前为止的所有更新),ed harlow和david lane(编)《抗体:实验室手册》(antibodies:a laboratory manual),cold spring harbor laboratory,(1988),以及j.e.coligan等人,(编),《免疫学现行实验指南》(current protocols in immunology),john wiley&sons(包括目前为止的所有更新)。
[0218]
在整个说明书中,除非上下文另外要求,否则词语“包括(comprise)”或诸如“包括(comprises)”或“包括(comprising)”的变体应理解为暗示包括所述的步骤或元件或整数,或步骤或元件或整数组,但不排除任何其他步骤或元件或整数或元素或整数组。
[0219]
术语“和/或”,例如“x和/或y”应理解为意指“x和y”或“x或y”,并且应理解为提供对两种含义或任一含义的明确支持。
[0220]
花性别
[0221]
如本文所用,术语“花”是指开花植物(被子植物)的生殖结构。花通常由两部分组成:营养部分,由花瓣和花被中的相关结构组成,以及生殖或有性部分。“花”可以具有雄性和雌性生殖部分(其中花可以是雌雄同体的),或者可以仅具有雄性或雌性生殖部分,在这种情况下,花可以分别是雄性花或雌性花。雄性生殖部分通常称为“雄蕊”,雌性生殖部分称为“雌蕊”。雄蕊有两部分:花药和花丝。花药携带花粉并且通常由称为花丝的线状部分保持。雌蕊有三部分:柱头、花柱和子房。柱头是在雌蕊顶部的粘性结构,其捕获并保持从花药转移的花粉。花柱是管状结构,其保持柱头并向下通向包括胚珠(或卵)的子房。取决于花是雄性花、雌性花还是雌雄同体花,它将仅具有雄性生殖部分、仅具有雌性生殖部分、或分别具有雌性和雄性生殖部分。
[0222]
本领域技术人员应当理解,植物可以是雌雄同株的、雌雄异体的或雌雄同体的。“雌雄同株的植物”应理解为是指在同一植物上具有雄性和雌性生殖系统的植物,即具有一些雌性花和其它雄性花的植物。“雄性花”是在没有发育的雌蕊的情况下发育充满花粉的雄蕊的花,而“雌性花”是在没有发育的雄蕊的情况下发育保持胚珠的雌蕊的花。另一方面,“雌雄异体植物”应理解为是指雄性和雌性生殖系统出现在不同植物上的植物。即,一株植物具有雄性生殖部分(具有充满花粉的雄蕊的花),另一株植物具有雌性部分(具有保持胚珠的雌蕊的花)。雄性或雌性的花(如雌雄异体和雌雄同株植物的情况)有时也称为“不完全花”。“雌雄同体植物”或“雌雄同体”应理解为是指产生含有雄性和雌性生殖部分(即,充满花粉的雄蕊和保持胚珠的雌蕊)的花的植物。雌雄同体植物主要是自花授粉的和真正双性的。来自雌雄同体植物的花有时也称为“完全花”。
[0223]
如本文所用,术语“雌性花表型”、“表型雌性的花”或类似术语应理解为意指仅具有功能性雌性生殖部分并表现出雌性花表型的花。在一些实例中,表现出雌性花表型的花
可以是遗传雌雄同体花,其中雄性生殖部分是无功能的和/或缺失的,即由于植物中fsl多肽活性降低或缺失。根据该实例,植物中fsl多肽活性的降低或缺失阻止或抑制花雄性生殖部分的发育和/或成熟。“遗传雌雄同体花”应理解为是指在fsl基因座具有雌雄同体基因型即hh=雌雄同体或hf=雌雄同体的花。类似地,“雌雄同体花表型”、“雌雄同体的花表型”或类似应理解为具有功能性雄性和雌性生殖部分的花。因此,术语“雄性花表型”是指仅具有功能性雄性生殖部分的花。
[0224]
如本文所用,术语“控制植物中的花性别”或类似术语应理解为意指控制或影响植物是否发育表型为雄性、雌性或雌雄同体的花。即,控制植物是否将发育仅具有雄性生殖部分(充满花粉的雄蕊)、仅具有雌性生殖部分(保持胚珠的雌蕊)或两者的花。
[0225]
如本文所用的术语“花性别(fsl)基因座”或“fsl基因座”或“fsl基因”应理解为是指编码本发明人已显示负责被子植物中的花性别或花性的多肽(本文称为fsl多肽)的基因或基因座。本发明人已经表征了葡萄中fsl基因座的雌性(f)和雌雄同体(h)和雄性(m)等位基因,其开放阅读框(orf)dna序列分别在seq id no:5-7中给出。因此,本文提及的“fsl基因座”意在包括seq id no:5-7中所示的fsl基因座等位基因序列的orf,以及与其具有至少60%同一性的fsl基因座序列(例如,与seq id no:5-7中所示的序列具有至少65%、或至少70%、或至少75%、或至少80%、或至少85%、或至少90%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%的同一性)。还考虑对应于感兴趣的特定植物物种的那些序列的直系同源物。
[0226]
术语“基因座”(多个基因座)应理解为是指染色体上发现基因、多核苷酸或遗传标记的特定位置或地点。
[0227]
如本文所用,术语“等位基因”是指在特定基因座的基因或多核苷酸序列的任何一种或多种替代形式或变体,所有这些都涉及共同的性状或特征。在植物或植物部分的多倍体(例如,二倍体)细胞中,一个等位基因存在于一对同源染色体的每个染色体上的相应位置。在fsl基因座的上下文中,术语“等位基因”在本文中用于定义fsl基因座的替代形式,其是本发明人已经显示与不同的花性别表型相关。例如,本发明人已经表征了葡萄中fsl基因座的雌性(f)和雌雄同体(h)和雄性(m)等位基因,其orf dna序列分别在seq id no:5-7中给出。因此,本文提及的“fsl基因座的雌性等位基因”、“雌性fsl基因座等位基因”或类似物应理解为是指与雌性花表型相关的fsl基因座的变体。类似地,本文提及的“fsl基因座的雌雄同体等位基因”、“fsl基因座的雌雄同体的等位基因”、“雌雄同体fsl基因座等位基因”、“雌雄同体的fsl基因座等位基因”或类似应理解为是指与雌雄同体花表型相关的fsl基因座的变体。本文提及的“fsl基因座的雄性等位基因”、“雄性fsl基因座等位基因”或类似物应理解为是指与雄性花表型相关的fsl基因座的变体。
[0228]
含有转录区的基因的基因组形式或克隆可以被称为“内含子”或“间插区”或“间插序列”的非编码序列打断,其相对于基因的“外显子”可以是同源的或异源的。如本文所用的“内含子”是作为初级rna转录物的一部分转录但不存在于成熟mrna分子中的基因片段。从核或初级转录物中去除或“剪接出”内含子;因此,在信使rna(mrna)中不存在内含子。内含子可以含有调控元件如增强子。如本文所用的“外显子”是指在rna分子未被翻译的情况下,对应于存在于成熟mrna或成熟rna分子中的rna序列的dna区域。mrna在翻译过程中起作用以确定新生多肽中氨基酸的序列或顺序。术语“基因”包括编码本文所述的本发明的全部或
部分蛋白的合成或融合分子和与上述任一种互补的核苷酸序列。可以将基因导入合适的载体中,用于细胞中的染色体外维持,或优选用于整合到宿主基因组中。通过修饰葡萄中的fsl基因座多核苷酸序列并由此改变其中的fsl多肽活性,本发明人发现fsl基因座的表达对于葡萄花中雄性生殖器官发育是必需的。具体地,本发明人已经表明fsl基因座的敲除导致葡萄中花的雄性生殖器官无功能,产生表型雌性花。这支持了这样的结论,即fsl基因座的雄性或雌雄同体等位基因的表达是花中正常雄性生殖器官发育所必需的。在不存在这种表达或不存在适当水平的表达的情况下,雄性生殖器官将是无功能的或不存在,产生表型雌性花。如本文所用,“无功能性雄性生殖器官”或“无功能性雄性生殖部分”或类似术语应理解为意指不能使花的雌性生殖器官(即雌蕊)受精的雄蕊。在一些实例中,雄蕊是无功能的,因为它含有无活力的花粉,即不育花粉,和/或因为它是反折的和发育不全的。然而,其中雄蕊是无功能的其它实施方案也被考虑和包括在本文中。具有无功能雄性生殖部分的花表现出“雄性不育”。
[0229]
基于fsl基因座,特别是fsl基因座的雄性或雌雄同体等位基因的表达是花中功能性雄性生殖器官发育所需的发现,本发明考虑了与包括野生型fsl基因座或其等位基因的相应野生型植物或其部分相比具有改变水平的fsl多肽活性的植物或其部分的生产和用途。这种改变的表达可用于通过改变雄性生殖器官或部分的发育来控制花的性别。
[0230]
本发明人已经表征了由葡萄属物种中fsl基因座的雌雄同体、雌性和雄性等位基因编码的多肽序列,其分别在seq id no:1-3中示出。本文提及的“fsl多肽”意在包括seq id no:1-3中所示的fsl多肽序列,以及与其具有至少40%同一性(例如,与seq id no:1-3中所示的序列具有至少50%,或至少60%,或至少70%,或至少80%,或至少90%,或至少95%,或至少96%,或至少97%,或至少98%或至少99%同一性)的fsl多肽序列。还考虑对应于感兴趣的特定植物物种的那些序列的直系同源物。在具体实例中,由fsl基因座的雄性或雌雄同体等位基因编码的fsl多肽的活性可以改变,因为这些等位基因被认为是发育功能性雄性生殖器官所必需的。
[0231]
术语“改变的fsl多肽活性水平”或类似术语应理解为意指相对于包括赋予雄性或雌雄同体花表型的fsl基因座基因型的相应比较植物或植物部分中的fsl多肽活性水平,改变(例如增加或降低)的fsl多肽活性水平。赋予雌雄同体花表型的fsl基因座基因型可包括fsl基因座的雌雄同体等位基因,例如fsl基因座的野生型雌雄同体等位基因。同样地,赋予雄性花表型的fsl基因座基因型可以包括fsl基因座的雄性等位基因,例如fsl基因座的野生型雄性等位基因。根据上述实例,“改变的fsl多肽活性水平”可以是相对于fsl基因座的雌雄同体或雄性等位基因编码的fsl多肽的活性改变的fsl多肽活性水平。在一个实例中,fsl多肽活性水平的改变是fsl多肽活性相对于相应对比植物或植物部分中fsl多肽活性水平的降低。在另一个实例中,fsl多肽活性水平的改变是在相应的对比植物或植物部分中不存在fsl多肽活性。
[0232]
改变植物或植物部分中fsl多肽活性的水平可以通过相对于fsl基因座的野生型等位基因的相应多核苷酸序列,例如相对于fsl基因座的野生型雄性或雌雄同体等位基因的相应多核苷酸序列修饰fsl基因座内的多核苷酸来实现。在一个实例中,编码fsl多肽的多核苷酸序列可以在相对于seq id no:6或7中所示序列的位置153和189之间,例如位置155和159之间(或在相应基因组序列的一个或多个相应核苷酸位置)包括一个或多个(例如
1、2、3、4、5、6、7、8、9、10或更多个)核苷酸添加、缺失或替换的orf。例如,编码fsl多肽的多核苷酸序列可具有相对于seq id no:6或7中所示序列在位置153和189之间(或在相应基因组序列的一个或多个相应核苷酸位置)缺失的一个或多个(例如1、2、3、4、5、6、7、8、9、10或更多个)核苷酸的orf。例如,编码fsl多肽的多核苷酸序列可在相对于seq id no:6或7所示序列的155和159位之间(或在相应基因组序列的一个或多个相应核苷酸位置处)缺失一个或多个t(例如t、tt或ttt)的orf。例如,编码fsl多肽的多核苷酸序列可具有相对于seq id no:6或7所示序列在155和159位之间(或在相应基因组序列的一个或多个相应核苷酸位置处)添加的一个或多个t(例如t、tt或ttt)的orf。例如,可以修饰编码fsl多肽的多核苷酸,使得开放阅读框由于一个或多个突变(例如,核苷酸替换、缺失或添加)而被终止密码子中断。根据该实例,修饰可产生无功能的fsl多肽。在另一个实例中,可以修饰编码fsl多肽的多核苷酸,使其更类似于fsl基因座的雌性等位基因。在这方面,本发明人已经确定由fsl基因座的雌性等位基因编码并包括seq id no:2所示氨基酸序列的fsl多肽的变体导致雄性功能的丧失,即在来自表达该变体fsl多肽的植物或植物部分的花中没有雄性生殖部分发育。相对于由fsl基因座的相应雌雄同体和雄性等位基因编码的fsl多肽(分别如seq id no:1和3所示),该fsl多肽变体(本文称为雌性fsl多肽)赋予雄性功能的丧失。在某些实施方案中,赋予雄性功能丧失的fsl多肽变体在对应于seq id no:2所示序列第138位氨基酸的位置不包括甲硫氨酸(m)。在其它实施方案中,赋予雄性功能丧失的fsl多肽变体在对应于seq id no:1所示序列的位置79、120、145、166、195、200、226、232的位置包括一个或多个或所有氨基酸。因此,改变植物或植物部分中fsl多肽活性的水平可以通过修饰编码fsl多肽的多核苷酸以实现如本文所述的雄性功能的丧失来实现。修饰多核苷酸序列(例如crispr、talon和zfn)的方法在本领域和本文中描述。
[0233]
在另一个实施方案中,改变植物或植物部分中fsl多肽活性的水平可以通过改变fsl多肽的表达水平(例如增加或降低表达水平)来实现。例如,fsl多肽活性可通过改变植物或植物部分中表达的fsl多肽的丰度而改变。例如,fsl多肽的表达水平可以通过改变编码fsl多肽的fsl基因座或其等位基因的每个细胞的拷贝数来调节。这可以通过引入包括编码序列和与其可操作地连接并在细胞中有功能的转录控制元件的合成基因构建体来实现。可以选择多种转化体并筛选具有有利水平的fsl多肽活性和/或由于合成构建体整合位点附近内源序列的影响而产生的表达特异性的那些转化体。合成构建体表达的有利水平和模式是导致fsl表型或其它表型显著改变的水平和模式。或者,可以从来自育种计划的诱变种子群体或植物群体筛选具有改变的fsl多肽活性或与花性别相关的其它表型的个体品系。
[0234]
在另一个实施方案中,改变植物或植物部分中fsl多肽活性的水平可以通过改变fsl基因座转录产物的水平来实现。例如,rna干扰(rnai)剂可用于靶向fsl基因座的mrna,从而与相应的野生型植物或其部分相比降低植物或其部分中的fsl多肽活性。
[0235]
在另一个实施方案中,改变植物或植物部分中fsl多肽活性的水平可以通过修饰fsl多肽与其一种或多种结合配偶体(例如参与转录过程的dna或蛋白结合配偶体)的相互作用来实现。
[0236]
如本文所述,改变fsl多肽的活性可包括降低活性水平。例如,降低fsl多肽的活性水平可包括降低fsl多肽的表达,包括功能或生物活性fsl多肽的表达水平。例如,相对于包括赋予雄性或雌雄同体花表型的fsl基因座基因型的相应植物或其部分中的fsl多肽活性
水平,植物或植物部分中的fsl多肽活性可降低至少10%。例如,相对于包括赋予雄性或雌雄同体花表型的fsl基因座基因型的相应植物或其部分中的fsl多肽活性水平,植物或植物部分中的fsl多肽活性可降低至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%。在一些实例中,改变fsl多肽的活性可包括通过敲除fsl基因座或其等位基因完全抑制fsl多肽或阻止fsl多肽的表达。
[0237]
发明人已经鉴定fsl基因座编码“植物富含at序列和锌结合”或“platz”结构域。已发现platz转录因子超家族仅存在于植物中,并且可能是转录因子。在本发明之前,platz蛋白尚未被鉴定为参与花性别决定。事实上,对platz蛋白在植物中的精确功能仍然缺乏了解。在葡萄研究中,diaz-riquelman(2014)发现卷须中platz转录因子家族上调,这被认为与卷须发育期间发生的细胞分化有关。本发明人已经鉴定了葡萄fsl多肽中seq id no:1和3所示序列的26至75位和seq id no:2所示序列的24至73位的platz结构域。该结构域在多肽水平(即,100%同一性)vitus vinifera的每个雌性、雌雄同体和雄性等位基因中是保守的。platz结构域似乎是fsl多肽活性及其在雄性生殖器官发育中的作用所必需的。在此基础上,改变植物或植物部分中fsl多肽的活性以控制花的性别可包括修饰编码platz结构域的多核苷酸序列,或使用靶向对应于platz结构域的转录物区域的rnai剂进行fsl mrna转录物的转录后沉默。
[0238]
植物或其部分中fsl多肽活性的改变,例如本文所述fsl多肽活性的降低,可导致植物花的雄性生殖部分缺失或无功能。在一些实例中,由于fsl多肽的活性改变(例如降低),花的雄性生殖部分可能不存在。在一些实例中,由于编码fsl多肽的fsl基因座或其等位基因的多核苷酸序列中的一个或多个突变导致fsl多肽的活性改变(例如降低),花的雄性生殖部分可能不存在。在其他实例中,由于fsl多肽的活性改变(例如降低),花的雄性生殖部分可以存在但无功能。花的无功能性雄性生殖部分可能由于fsl多肽活性的改变(例如降低)而发育不足,导致其是无功能性的。在一些实例中,fsl多肽水平改变(例如降低)的植物或植物部分产生雄性不育的花。
[0239]
本发明人还鉴定了编码platz结构域的fsl基因座的区域中的特异性有义突变snp,其显示在葡萄中基因型即雄性花(fsl/fsl或fsl/fsl)、雌性花(fsl/fsl)或雌雄同体花(fsl/fsl或fsl/fsl)和花性别表型之间100%的一致性。如本文所用,snp可称为“花性别snp”。在fsl基因座的雌性等位基因中,花性别snp位于seq id no:5所示orf序列的621位并包括a。在fsl基因座的雌雄同体等位基因中,snp位于seq id no:6所示orf序列的627位并包括c。本发明人预期使用该花性别snp来确定植物或植物部分的fsl基因座基因型并由此预测其花性别表型,例如甚至在植物或植物部分足够成熟以产生花之前。如本文所述,该snp可形成用于确定植物或植物部分的花性别的诊断方法或测试的一部分。例如,“fsl基因座的雌性等位基因”(或类似术语)可具有包括seq id no:5所示序列或与其具有至少70%同一性的序列(例如,与seq id no:5所示序列具有至少75%、或至少80%、或至少85%、或至少90%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%同一性)的orf,条件是对应于seq id no:5所示orf序列第621位的核苷酸位置是a。例如,“fsl基因座的雌雄同体等位基因”或“fsl基因座的雄性等位基因”(或类似术语)可以具有包括seq id no:6中所示的序列或与其具有至少70%同一性的序列(例如,与seq id no:5中所示序列具有至少75%、或至少80%、或至少85%、或至少90%、或至少95%、或至少96%、或至少97%、或至少
98%或至少99%的同一性),条件是对应于seq id no:6中所示orf序列的位置627的核苷酸位置是c。通过测定植物或植物部分在fsl基因座内的花性别snp处的基因型(使用标准分子技术),可以预测或测定花性别。
[0240]
如本文所述,术语“fsl基因座”、“fsl基因座等位基因”和“fsl多肽”旨在包括例证的葡萄属物种的直系同源fsl基因座序列、直系同源fsl等位基因序列(包括雄性、雌性和雌雄同体fsl等位基因序列)和直系同源fsl多肽序列。直系同源物将优选地对应于所产生的特定植物物种。“直系同源”基因、基因座、等位基因或多肽是在物种形成事件后发生变异的同源物。尽管一旦两个物种发生差异,直系同源基因、基因座、等位基因或多肽之间可能出现序列变异,但直系同源物可维持与其进化的祖先基因、基因座、等位基因或多肽相同或基本上相同的功能。因此,直系同源fsl基因座序列,包括其雄性、雌性和雌雄同体等位基因,将被理解为包括来源于除了葡萄以外的植物物种的fsl基因座序列,该植物物种具有与seq id no:4-7所示序列相同的祖先,并且在各自的植物物种中执行相同或相似的功能。同样,直系同源fsl多肽应理解为包括来源于除葡萄以外的植物物种的fsl多肽序列,其与seq id no:1-3所示序列具有共同的祖先,并且在各自的植物物种中执行相同或相似的功能。
[0241]
术语“野生型”通常理解为是指天然存在于生物体(或给定群体)中的基因、基因座、等位基因、多肽或表型的典型或常见形式。除非另有特别说明,术语“野生型”应理解为具有其常规含义。然而,在fsl基因座的上下文中,术语“野生型”在本文中用于描述fsl基因座等位基因的天然存在的或未修饰的形式和本发明内容的修饰的或改变的对应物。在这方面,本发明人已经表明存在fsl基因座的性别特异性等位基因,即雄性特异性fsl基因座等位基因、雌性特异性fsl基因座等位基因和雌雄同体特异性fsl基因座等位基因。为了描述各自性别特异性fsl基因座等位基因的天然存在或未修饰形式与本发明的修饰或改变的对应物,术语“野生型”也用于表示各自天然存在或未修饰的等位基因形式。因此,本文所用的术语“野生型雄性fsl基因座等位基因”、“fsl基因座的野生型雄性等位基因”或类似术语应理解为指fsl基因座的天然存在或未修饰的雄性等位基因。类似地,本文所用的术语“野生型雌性fsl基因座等位基因”、“fsl基因座的野生型雌性等位基因”或类似术语应理解为指fsl基因座的天然存在或未修饰的雌性等位基因。类似地,本文所用的术语“野生型雌雄同体fsl基因座等位基因”、“fsl基因座的野生型雌雄同体等位基因”或类似术语应理解为是指fsl基因座的天然存在或未修饰的雌雄同体等位基因。根据其中植物物种是葡萄的实例,雌性、雌雄同体和雄性的野生型等位基因可以具有分别包括seq id no:5-7中所示序列的orf。然而,应当理解,fsl基因座的雌性、雌雄同体和雄性等位基因的序列可以在特定物种内变化(例如,在不同群体之间变化),以及在物种之间变化(例如,直系同源物)。因此,应当理解,在fsl基因座的雌性、雌雄同体和雄性等位基因的上下文中提及野生型也可包括分别与seq id no:5-7中所示序列具有至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%同一性的orf序列。
[0242]
本发明人还发现fsl基因座的性别特异性等位基因编码具有不同序列的fsl多肽。因此,本文在fsl多肽的上下文中提及的术语“野生型”是指分别由本文所述的fsl基因座的野生型雌雄同体、雌性和雄性等位基因编码的天然存在的或未修饰的fsl多肽变体。根据其中植物物种是葡萄的实例,由fsl基因座的野生型雌雄同体、雌性和雄性等位基因编码的fsl多肽可以分别包括seq id no:1-3中所示的序列。然而,如同fsl基因座及其性别特异性
等位基因一样,应当理解由fsl基因座的野生型雌雄同体、雌性和雄性等位基因编码的fsl多肽序列可以在特定物种内变化(例如不同群体之间的变化),以及在不同物种之间变化(例如fsl多肽直系同源物)。因此,应当理解,提及由fsl基因座的野生型雌雄同体、雌性和雄性等位基因编码的fsl多肽序列(统称为“野生型fsl多肽”)也可包括分别与seq id no:1-3中所示氨基酸序列具有至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97、至少98%、至少99%同一性的序列。
[0243]
在本发明的植物或其部分的上下文中使用的术语“野生型”应理解为意指其中fsl基因座或fsl多肽未被修饰的植物或植物部分,即包括在该植物物种中天然存在的fsl基因座或其等位基因的植物或植物部分。
[0244]
如本文在修饰fsl基因座或其等位基因的上下文中使用的术语如“修饰(modifying)”、“修饰(modify)”、“修饰(modifies)”或类似术语应理解为是指相对于参考fsl基因座序列,例如fsl基因座的野生型雄性或雌雄同体等位基因的序列,向fsl基因座序列或其等位基因引入一个或多个物理变化,包括核苷酸替换、添加和/或缺失。本文描述了示例性修改。fsl基因座序列的修饰可以使用本领域已知的用于修饰核酸的任何方法实现,包括例如随机和定点诱变、转基因表达、crispr、talon和/或zfn技术,如本领域或本文所述。fsl基因座序列或其等位基因的一个或多个改变优选导致由此编码的fsl多肽的氨基酸序列的一个或多个改变,例如相对于由相应的未修饰的fsl基因座序列或其等位基因编码的fsl多肽序列的一个或多个氨基酸添加、缺失或替换。因此,fsl多肽活性水平的改变可以通过在fsl基因座或其等位基因的序列中引入一个或多个改变来实现。优选通过修饰fsl基因座或其等位基因的序列和由此编码的相应fsl多肽来降低或消除fsl多肽活性。然而,在一些备选的实例中,fsl多肽活性可以通过修饰fsl基因座或其等位基因的序列来增加,例如通过使用重组方法将fsl基因座的雄性等位基因或雌雄同体等位基因的一个或多个拷贝引入植物或植物部分。
[0245]
如本文所用,术语“杂合的”是指在特定基因座存在不同的等位基因(给定基因的形式)。因此,提及“杂合体”是指具有存在于至少一个基因座的不同等位基因(给定基因的形式)的二倍体或多倍体个体植物细胞或植物。
[0246]
如本文所用,术语“纯合的”是指在同源染色体片段中的一个或多个基因座处存在相同的等位基因。因此,本文提及的“纯合体”是指在一个或多个基因座具有相同等位基因的单个植物细胞或植物。
[0247]
如本文所用,术语“能够基于fsl基因座基因型表现出所需花性别表型的子代植物”应理解为是指具有赋予目的花性别表型的fsl基因座基因型的子代。在一些实例中,“能够基于fsl基因座基因型表现出期望的花性别表型的子代植物”实际上表现出目的花性别表型,即子代植物处于花期中或花朵处于发育阶段。在其它实例中,“能够基于fsl基因座基因型表现出所需花性别表型的子代植物”例如在一段步骤时不在花期中。这可能是因为子代植物不成熟并且还不能开花,或者因为环境条件不利于开花。
[0248]
无核
[0249]
如本文所用,术语“果实”应理解为意指从被子植物花的子房发育的种子承载结构,通常在用有活力的花粉受精后。
[0250]
如本文所用,术语“种子”旨在包括“成熟种子”以及“发育中的种子”,其发生在受
精后,种子休眠建立前和收获前。
[0251]
本文在果实的上下文中使用的术语“无核”可指在(成熟)果实中完全不存在硬种子(即由于单性结实而“无核组”)和/或总种子数显著减少(即“减少的种子组”)和/或种子发育在早期阶段停止(例如由于无籽果实),使得完全发育的种子的最终数目显著减少,其中显著降低是指降低至野生型的至少40%,优选降低至野生型的至少50%、60%、70%、80%、90%、95%或98%,最优选降低至100%(即完全无核)。种子败育型无核果实通过生物过程发生,由此花被施肥并且种子开始发育,但是种子的发育在早期阶段中断,在果实中留下“种子痕迹”。因此,如本文所用的术语“无核”包括这样的表型,其中果实含有种子痕迹或一个或多个软种子,它们是异常中断的未发育的种子的残余物。
[0252]
矮态型
[0253]
本发明提供了产生无核果实的新植物或植物部分,其中植物或植物部分具有如本文所述的改变的例如降低的fsl多肽活性,和赋予矮态型的多核苷酸。
[0254]
本发明提供了产生无核果实的新植物或植物部分,其中植物或植物部分包括如本文所述的fsl基因座雌性等位基因(f/f)纯合的fsl基因座,和赋予矮态型的多核苷酸。对于fsl基因座雌性等位基因(f/f)纯合的植物或植物部分可使用如本文所述的花性别snp鉴定。
[0255]
如本文所述,“矮态”植物应理解为意指相对于特定物种的平均(正常)高度在高度上较短的特定物种的单个植物或植物品种。由此,“矮态型”是型态矮小。
[0256]
文献丰富了包括基因和实现矮态型的手段的矮态植物的开发。本文考虑了本领域已知的用于赋予植物矮态型的任何多核苷酸。
[0257]
在一个实例中,赋予植物矮态型的多核苷酸相对于相应的野生型或天然存在的多核苷酸序列被改变。
[0258]
本发明人先前已经描述了具有快速开花表型的矮小葡萄树(称为“微葡萄藤”)的发育(boss和thomas,(2002)《自然》(nature),416(6883):847-850)。先前报道的“微葡萄藤”表型是基于赤霉酸不敏感(vvgai1)基因的变体,其在正常vvgai1基因的231位的翻译区中包括snp(t至a突变)。存在于变体vvgai1基因中的点突变将保守della结构域的亮氨酸残基转化为组氨酸,从而改变植物的赤霉酸(ga)响应特性。当以杂合(gai1/gai1)或纯合(gai1/gai1)状态存在时,变体gai1基因引起矮态型和快速开花表型。因此,在一些实例中,本文提及的“突变的赤霉酸不敏感(gai1)基因”或在植物或其植物子代、繁殖材料或果实的上下文中的类似物应理解为是指如先前在boss和thomas(2002)中描述的赋予矮态型和快速开花表型的突变的gai1基因变体,其全部内容通过引用并入本文,或类似地防止gai1蛋白响应ga信号转导的其他突变的gai1基因变体。
[0259]
在一个实例中,赋予矮态型的多核苷酸是gai1基因或其片段的变体。gai1基因的变体可以编码“变体gai1蛋白”。在一个实例中,gai1基因或其片段的变体在编码della结构域的区域中包括一个或多个突变。例如,编码gai1蛋白的della结构域的区域中的一个或多个突变可改变植物或植物部分的ga响应特性,例如,如在微葡萄藤中。例如,della结构域中的一个或多个突变可以防止植物或植物部分响应ga信号转导。因此,在一些实例中,包括gai1基因或其片段的变体的植物或植物部分对ga信号转导无反应或反应不佳。一个或多个突变可选自氨基酸替换、缺失或添加。在一个实例中,变体gai1蛋白可包括seq id no:8中
所示的在其位置38处具有leu至his替换的序列,或具有与seq id no:8所示序列至少85%同一性、或至少90%同一性、或至少95%同一性、或至少96%同一性、或至少97%同一性、或至少98%同一性、或至少99%的同一性的序列、条件是对应于seq id no:8的位置38的della结构域的leu被更大的碱性残基例如his替换。在一个实例中,变体gai1蛋白包括与seq id no:8所示序列具有至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%或至少99.8%同一性的序列,条件是对应于seq id no:8的位置38的della结构域的leu被更大的碱性残基例如his替换。
[0260]
变体gai1蛋白可包括seq id no:9所示的序列。根据该实例,植物或植物部分可以是如boss和thomas,(2002)《自然》(nature),416(6883):847-850中所述的“微葡萄藤”,其具有如本文所述的改变水平的fsl多肽活性。在其它实例中,della结构域可以从gai1基因或其片段改变截短或完全缺失,例如作为一个或多个突变的结果。一个或多个突变优选导致无功能的gai1基因。
[0261]
赋予矮态型的多核苷酸,例如gai1基因或其片段的变体,可以以纯合(gai1/gai1)状态或杂合(gai1/gai1)状态存在。
[0262]
还考虑了其中gai1蛋白或其della结构域被沉默(例如使用rnai剂转录后沉默)的植物或植物部分。根据该实例,赋予植物矮态型的多核苷酸可以是靶向gai1蛋白的mrna转录物(例如对应于della结构域)的rnai剂。本文描述了rnai剂。
[0263]
在描述具有改变水平的fsl多肽活性和赋予矮态型的多核苷酸的植物或植物部分的每个前述实施例中,当花未被授粉时,植物或其部分可产生单性结实的无核果实,而当花被有活力的花粉授粉时,植物或其部分可产生含种子的果实。
[0264]
无籽果实
[0265]
本发明还考虑了产生无核果实的新植物和植物部分,其中植物或植物部分包括:如本文所述的改变的例如降低的fsl多肽活性水平;赋予如本文所述的矮态型的多核苷酸;和赋予无籽果实的多核苷酸。
[0266]
本发明还考虑了产生无核果实的新植物和植物部分,其中植物或植物部分包括如本文所述的fsl基因座雌性等位基因(f/f)纯合的fsl基因座;赋予如本文所述的矮态型的多核苷酸;和赋予无籽果实的多核苷酸。
[0267]“无籽果实”是在一些果实,特别是许多鲜食葡萄中产生无核的生物机制。在“种子败育型”无核果实中,仍需要正常的授粉和受精以确保果实“结实”,即在植物上继续发育;然而,受精后开始生长的胚胎随后的流产导致接近无核的状态。未发育的种子的剩余部分在果实中可见。“无核”鲜食葡萄品种由于花受精和种子开始发育,但在早期停止发育,在果实中留下种子的痕迹,从而产生无籽果实。在一些实例中,从本发明的植物或植物部分产生的果实是“无核的”,其具有与从种子败育型植物的受精的雌性胚珠产生的果实表现出的一致的无核性表型。通常,种子败育型果实可含有一种或多种“软种子”,其为停滞的受精种子的残余物。
[0268]
从无籽果实中鉴别为单性结实。“单性结实”在本领域中通常被理解,并且也结合本发明被理解为描述果实的发育而不使雌性胚珠受精。“单性结实”字面上是指“原始状态的果实”。由于生产果实不需要授粉过程,因此种子从未发育。在这个意义上,“单性结实的”果实表现出真正的无核性。
[0269]
本文考虑了本领域已知的用于赋予植物无籽果实的任何多核苷酸。在一些实例中,赋予植物或其部分无籽果实的多核苷酸可以相对于相应的野生型或天然存在的基因而改变。在一个具体实例中,赋予植物或植物部分无籽果实的多核苷酸是葡萄mads盒蛋白5(vvmads5)基因座的变体。当以杂合或纯合状态存在时,已知变体或突变的vvmads5基因座(也称为vviagl11)与vitus属中的无籽果实(sdl1)无核性表型相关。vvmads5变体中的突变导致编码序列590bp处的g至t替换,导致arg197leu替换(royo等人,2018)。因此,本文提及的“与无籽果实相关的突变的vvmads5基因”、“变体vvmads5基因座”或类似物应理解为包括royo等人(2018)中描述的突变体vvmads5基因,其全部内容通过引用并入本文。
[0270]
在一个实例中,赋予无籽果实的多核苷酸是vvmads5基因座的变体。编码vvmads5蛋白(即内源或非变体蛋白)的vvmads5基因座可以包括seq id no:10中所示的氨基酸序列,并且变体vvmads5蛋白可以包括用疏水氨基酸例如leu(r197l)替换seq id no:10中所示序列的197位arg。在一个实例中,变体vvmads5基因座编码变体vvmads5蛋白,变体vvmads5蛋白包括seq id no:11中所示的氨基酸序列或与其具有至少80%同一性的序列(例如,与seq id no:11所示序列具有至少85%同一性、或至少90%同一性、或至少95%同一性、或至少96%同一性、或至少97%同一性、或至少98%同一性、或至少99%的同一性),条件是相对于seq id no:11在197位的氨基酸是疏水性氨基酸,例如leu。例如,变体vvmads5基因座可以编码包括与seq id no:11中所示序列具有至少99.1%、至少99.2%、至少99.3%、至少99.4%或至少99.5%同一性的氨基酸序列的变体vvmads5蛋白,条件是相对于seq id no:11在197位的氨基酸是疏水性氨基酸,例如leu。在一个具体实例中,变体vvmads5基因座编码包括seq id no:11所示氨基酸序列的变体vvmads5蛋白,如royo等人,2018中所述。在其它实例中,vvmads5蛋白从植物或植物部分被截短或完全缺失,例如作为vvmads5基因座的一个或多个突变的结果。一个或多个突变优选导致无功能的vvmads5蛋白。
[0271]
赋予无籽果实例如编码本文所述变体vvmads5蛋白的变体vvmads5基因座的多核苷酸可以以纯合或杂合状态存在。
[0272]
在另一个实例中,vvmads5蛋白被沉默,例如转录后沉默。根据这个实例,向植物赋予无籽果实的多核苷酸可以是靶向由vvmads5基因座编码的mrna转录物的rnai剂。
[0273]
在描述进一步包括赋予无籽果实的多核苷酸的植物或植物部分的前述实例的每一个中,当花未被授粉时,植物产生单性结实的无核果实,当花被有活力的花粉授粉时,植物产生种子败育型果实。
[0274]
多肽类
[0275]
本文所用的术语“fsl多肽”应理解为是指由本文所述的fsl基因座或其等位基因编码的多肽,其活性已由本发明人显示为负责花的性别。特别地,本发明人已经表明由fsl基因座的雄性和雌雄同体等位基因编码的fsl多肽负责花的雄性生殖器官的发育。本文所用的术语“fsl多肽”总体涉及与seq id no:1-3所示多肽序列具有高水平基本序列同一性的蛋白家族,例如与seq id no:1-3所示序列具有至少40%同一性的fsl多肽序列(例如,与seq id no:1-3中所示的序列具有至少50%、或至少60%、优选至少70%、或至少80%、或至少90%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%的同一性)。还考虑对应于感兴趣的特定植物物种的那些序列的直系同源物。本发明人已经确定,当在植物中
表达时,fsl多肽家族的某些变体的改变的活性水平引起改变的花性别表型。变体的实例包括seq id no:2提供的氨基酸序列,由fsl基因座的雌性等位基因编码。相对于由fsl基因座的相应雌雄同体和雄性等位基因编码的fsl多肽(分别如seq id no:1和3所示),该fsl多肽变体(本文称为雌性fsl多肽)赋予雄性功能的丧失,即功能性雄性生殖部分不在花中发育。在某些实施方案中,赋予雄性功能丧失的fsl多肽变体在对应于seq id no:2所示序列第138位氨基酸的位置不包括甲硫氨酸(m)。在其它实施方案中,赋予雄性功能丧失的fsl多肽变体在对应于seq id no:1所示序列的位置79、120、145、166、195、200、226、232的位置包括一个或多个或所有氨基酸。在具体实例中,由fsl基因座的雄性或雌雄同体等位基因编码的fsl多肽的活性可以改变,以通过修饰本文所述的一个或多个氨基酸赋予雄性功能的丧失,因为这些等位基因被认为是发育功能性雄性生殖器官所必需的。
[0276]
本发明人已经鉴定fsl多肽包括“植物富含at序列和锌结合”或“platz”结构域。已发现platz转录因子超家族仅存在于植物中,并且可能是转录因子。在本发明之前,platz蛋白尚未被鉴定为参与花性别决定。本发明人已经鉴定了葡萄fsl多肽中seq id no:1和3所示序列的26至75位和seq id no:2所示序列的24至73位的platz结构域。因此,本文提及的“platz结构域”意在包括seq id no:1和3中所示序列的第26至75位和seq id no:2中所示序列的第24至73位的氨基酸序列,以及与那些序列具有至少40%同一性(例如与seq id no:1-3所示序列内的platz结构域具有至少80%、或至少90%、或至少95%、或至少96%、或至少97%、或至少98%或至少99%的同一性)的fsl多肽的platz结构域。还考虑对应于感兴趣的特定植物物种的那些序列的直系同源物。在一些实例中,可将一个或多个突变引入fsl多肽的platz结构域以改变fsl多肽活性,例如赋予雄性功能的丧失。
[0277]
本文提及的“变体gai1蛋白”应理解为意指由gai1基因或其片段的变体编码的蛋白或多肽,其包括一个或多个突变,例如在编码della结构域的区域中,如本文所述。编码gai1蛋白的della结构域的区域中的一个或多个突变优选改变表达变体gai1蛋白的植物或植物部分的ga响应特性。一个或多个突变可选自氨基酸替换、缺失或添加。示例性的“变体gai1蛋白”包括但不限于包括seq id no:8中所示的在其位置38处具有leu至his替换的序列,或与其具有至少80%同一性(例如,具有与seq id no:8所示序列至少85%同一性、或至少90%同一性、或至少95%同一性、或至少96%同一性、或至少97%同一性、或至少98%同一性、或至少99%同一性)的序列的那些多肽,条件是对应于seq id no:8的位置38的della结构域的leu被更大的碱性残基例如his替换。在优选的实例中,变体gai1蛋白包括与seq id no:8所示序列具有至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%或至少99.8%同一性的序列,条件是对应于seq id no:8的位置38的della结构域的leu被更大的碱性残基例如his替换。一个优选的变体gai1蛋白可包括seq id no:9所示的序列。
[0278]
本文提及的“变体vvmads5蛋白”应理解为意指由变体vvmads5基因座或其片段编码的任何蛋白或多肽,条件是该多肽在序列上不同于野生型或天然存在的vvmads5蛋白。示例性“变体vvmads5蛋白”包括但不限于包括seq id no:11中所示的氨基酸序列或与其具有至少80%同一性的序列(例如,与seq id no:11中所示序列具有至少85%同一性,或至少90%同一性、或至少95%同一性、或至少96%同一性、或至少97%同一性、或至少98%同一性、或至少99%的同一性)的那些多肽,条件是相对于seq id no:11在197位的氨基酸是疏
水性氨基酸,例如leu。例如,变体vvmads5基因座可以编码包括与seq id no:11中所示序列具有至少99.1%、至少99.2%、至少99.3%、至少99.4%或至少99.5%同一性的氨基酸序列的变体vvmads5蛋白,条件是相对于seq id no:11在197位的氨基酸是疏水性氨基酸,例如leu。一种优选的变体vvmads5蛋白包括seq id no:11所示的氨基酸序列,如royo等人,2018所述。
[0279]
本文所用的fsl多肽的“生物活性片段”是保持全长fsl多肽活性的本发明的fsl多肽的一部分。本文所用的生物活性片段不包括全长多肽。生物活性片段可以是任何大小的部分,只要它们保持确定的活性。在一个实例中,fsl多肽的生物活性片段是platz结构域。优选地,生物活性片段保持全长多肽活性的至少10%。
[0280]
术语“多肽”和“蛋白”在本文中通常可互换使用。
[0281]
多肽或多肽类可以通过其氨基酸序列与参考氨基酸序列的同一性程度(%同一性),或通过与一个参考氨基酸序列比与另一个参考氨基酸序列具有更大的%同一性来定义。多肽与参考氨基酸序列的%同一性通常通过gap分析测定(needleman和wunsch,1970;gcg程序),参数为空位产生罚分=5,和空位延伸罚分=0.3。查询序列长度为至少100个氨基酸,gap分析在至少100个氨基酸的区域上比对两个序列。甚至更优选地,查询序列长度为至少250个氨基酸,gap分析在至少250个氨基酸的区域上比对两个序列。甚至更优选地,gap分析在其全长上比对两个序列,并且在参考序列的全长上确定同一性的程度。多肽或多肽类可以具有与参考多肽相同的酶活性,或与参考多肽不同的活性,或缺乏参考多肽的活性。优选地,其活性根据本发明而改变的fsl多肽的活性比参考fsl多肽(例如,由本文所述的fsl基因座的野生型等位基因编码的fsl多肽)的活性至少低10%(例如,至少低20%、或至少低30%、或至少低40%、或至少低50%、或至少低60%、或至少低70%、或至少低80%、或至少低90%)。在一些实例中,fsl多肽活性水平的改变意味着不存在fsl活性。
[0282]
如本文所用,“生物活性片段”是保持全长参考多肽的限定活性的本发明的多肽的一部分。本文所用的生物活性片段不包括全长多肽。生物活性片段可以是任何大小的部分,只要它们保持确定的活性。
[0283]
关于确定的多肽或酶,应当理解高于本文提供的%同一性数字将包括优选的实施方案。因此,在适用时,根据最小%同一性数字,优选多肽/酶包括至少60%,更优选至少65%,更优选至少70%,更优选至少75%,更优选至少80%,更优选至少85%,更优选至少90%,更优选至少91%,更优选至少92%,更优选至少93%,更优选至少94%,更优选至少95%,更优选至少96%,更优选至少97%,更优选至少98%,更优选至少99%,更优选至少99.1%,更优选至少99.2%,更优选至少99.3%,更优选至少99.4%,更优选至少99.5%,更优选至少99.6%,更优选至少99.7%,更优选至少99.8%,甚至更优选至少99.9%与相关命名的seq id no相同的氨基酸序列。
[0284]
本文定义的多肽的氨基酸序列突变体可以通过向本文定义的核酸中引入适当的核苷酸变化,或通过所需多肽的体外合成来制备。这样的突变体包括例如氨基酸序列中残基的缺失、插入或替换。可以进行缺失、插入和替换的组合以得到最终的构建体,条件是最终的多肽产物具有所需的特征。
[0285]
可以使用本领域已知的任何技术制备突变体(改变的或变体)多肽,例如,使用定向进化或合理的设计策略(参见下文)。使用本领域和本文描述的技术可以容易地筛选衍生
自突变/改变的dna的产物,以确定它们是否具有fsl多肽活性并影响雄性生殖部分花的发育。
[0286]
在设计氨基酸序列突变体时,突变位点的位置和突变的性质将取决于待修饰的特征。突变位点可以单独或串联修饰,例如,通过(1)首先用保守的氨基酸选择替换,然后根据获得的结果用更多的自由基选择替换,(2)缺失目标残基或(3)插入邻近定位位点的其他残基。
[0287]
氨基酸序列缺失一般为约1至15个残基,更优选约1至10个残基,通常约1至5个连续残基。
[0288]
替换突变体在多肽中除去了至少一个氨基酸残基并在其位置插入了不同的残基。替换诱变使酶失活的最佳目的位点包括鉴定为活性位点的位点。其它目的位点是其中从各种菌株或物种获得的特定残基相同的位点。这些位置对于生物活性可能是重要的。这些位点,尤其是属于至少三个其它相同保守位点的序列的那些位点,优选以相对保守的方式被替换。这样的保守替换显示在表1中“示例性替换”的标题下。
[0289]
表1.示例性替换。
[0290][0291]
在一个优选的实施方案中,当与天然存在的多肽相比时,突变体/变体多肽仅具有或不超过一个或两个或三个或四个氨基酸改变。具有所需活性的突变体可以使用本领域的标准方法进行工程化,例如通过对已知目的基因进行随机诱变、靶向诱变或饱和诱变,或通过对不同基因进行dna改组。
[0292]
还考虑了例如具有改变的fsl活性的本发明的fsl多肽,其在合成期间或合成之后例如通过生物素化、苄基化、糖基化、乙酰化、磷酸化、酰胺化,通过已知的保护/阻断基团的衍生化,蛋白水解裂解,与抗体分子或其它细胞配体的连接等进行差异修饰。此类多肽可以在细胞中例如通过磷酸化进行翻译后修饰,其可以调节它们的活性。这些修饰可用于增加本发明的fsl多肽的稳定性和/或生物活性。
[0293]
多核苷酸
[0294]
术语“多核苷酸”和“核酸”可互换使用。它们是指任何长度的核苷酸的聚合形式,脱氧核糖核苷酸或核糖核苷酸或其类似物。本发明的多核苷酸可以是基因组、cdna、半合成或合成来源的、双链或单链的,并且凭借其来源或操作:(1)与天然与其相连的多核苷酸的
全部或部分不缔合,(2)与天然与其相连的多核苷酸以外的多核苷酸连接,或(3)天然不存在。以下是多核苷酸的非限制性实例:基因或基因片段的编码或非编码区、外显子、内含子、信使rna(mrna)、转移rna(trna)、核糖体rna(rrna)、核酶、cdna、重组多核苷酸、质粒、载体、任何序列的分离dna、任何序列的分离rna、任何序列的嵌合dna、核酸探针和引物。对于体外应用,多核苷酸可以包括修饰的核苷酸,例如通过与标记组分缀合。
[0295]
如本文所用,“分离的多核苷酸”是指已经从与其以其天然状态缔合或连接的多核苷酸序列分离的多核苷酸,或非天然存在的多核苷酸。
[0296]
如本文所用,术语“基因”在其最广泛的上下文中考虑,并且包括脱氧核糖核苷酸序列,该脱氧核糖核苷酸序列包括结构基因的转录区(如果翻译的话)和蛋白编码区,并且包括在5'和3'端上与编码区相邻的序列,在任一端上的距离为至少约2kb,并且其参与基因的表达。在这点上,基因包括控制信号,例如与给定基因天然相关的启动子、增强子、终止和/或聚腺苷酸化信号、或异源控制信号,在这种情况下,基因被称为“嵌合基因”。位于蛋白编码区5'并存在于mrna上的序列称为5'非翻译序列。位于蛋白编码区3'或下游并存在于mrna上的序列称为3'非翻译序列。术语“基因”包括基因的cdna和基因组形式。基因的基因组形式或克隆含有可被称为“内含子”、“间隔区”或“间隔序列”的非编码序列中断的编码区。内含子是转录成核rna(nrna)的基因片段。内含子可以含有调控元件如增强子。从核或初级转录物中去除或“剪接出”内含子;因此,mrna转录物中不存在内含子。含有至少一个内含子的基因可以进行可变剪接,从单个转录的基因产生可选择的mrna,因此产生多肽变体。天然状态的基因或嵌合基因可以缺少内含子。mrna在翻译过程中起作用以确定新生多肽中氨基酸的序列或顺序。术语“基因”包括编码本文所述的本发明的全部或部分蛋白的合成或融合分子和与上述任一种互补的核苷酸序列。
[0297]
如本文所用,“嵌合dna”是指在自然界中不天然发现的任何dna分子;本文也称为“dna构建体”或“基因构建体”。典型地,嵌合dna包括在自然界中不一起天然发现的调控和转录或蛋白编码序列。因此,嵌合dna可包括来源于不同来源的调控序列和编码序列,或来源于相同来源但以不同于天然存在的方式排列的调控序列和编码序列。开放阅读框可以或可以不与其天然的上游和下游调控元件连接。开放阅读框可以掺入到,例如,植物基因组中、非天然位置、或不天然发现的复制子或载体中,如细菌质粒或病毒载体。术语“嵌合dna”不限于可在宿主中复制的dna分子,而是包括能够通过例如特异性接合体序列连接到复制子中的dna。
[0298]
术语“基因修饰的”、“基因修饰”、“修饰的”(在核酸序列的上下文中)及其变异是更广泛的术语,包括通过转化或转导将基因导入细胞,突变细胞中的基因并遗传改变或调节细胞或如上所述修饰的任何细胞的子代中基因的调节。
[0299]
本发明的“重组多核苷酸”是指通过人工重组方法构建或修饰的核酸分子。重组多核苷酸可以以与其天然状态相比改变的量存在于植物得细胞或其部分中或以改变的速率表达(例如,在mrna的情况下)。在一个实施方案中,多核苷酸对于植物或其部分是内源的,并且其表达通过重组手段改变,例如,将外源控制序列引入内源目的基因的上游,以使转化的植物或其部分能够表达由该基因编码的多肽,或通过zfn、talen或crispr方法在目的基因中产生缺失。
[0300]
本发明的“重组多核苷酸”包括尚未从其存在于其中的基于细胞的或无细胞的表
或类似术语应理解为意指任何核苷酸序列,其当相对于可表达遗传序列适当定位和连接时,能够至少部分调节遗传序列的表达。本领域技术人员将意识到,顺式调控区能够在转录或转录后水平上激活、沉默、增强、抑制或改变基因序列的表达水平和/或细胞类型特异性和/或发育特异性。在优选的实施方案中,顺式作用序列是增强或刺激可表达遗传序列表达的激活物序列。
[0308]
将启动子或增强子元件“可操作地连接”至可转录的多核苷酸是指将可转录的多核苷酸(例如,编码蛋白的多核苷酸或其他转录物)置于启动子的调控下,然后该启动子控制多核苷酸的转录。在异源启动子/结构基因组合的构建中,通常优选将启动子或其变体定位在距可转录多核苷酸的转录起始位点的一定距离处,该距离与该启动子与其在其天然环境中控制的蛋白编码区之间的距离大致相同;即,启动子来源的基因。如现有技术中已知的,该距离中的一些变化可以被调节而不损失功能。类似地,调控序列元件(例如,操纵子、增强子等)相对于待置于其控制下的可转录多核苷酸的优选定位由元件在其天然环境中的定位限定;即,其来源的基因。
[0309]
本文所用的“启动子”或“启动子序列”是指基因的区,通常在rna编码区的上游(5'),其控制目的细胞中转录的起始和水平。“启动子”包括经典基因组基因的转录调控序列,如tata盒和ccaat盒序列,以及响应发育和/或环境刺激或以组织特异性或细胞类型特异性方式改变基因表达的额外调节元件(即上游活化序列、增强子和沉默子)。启动子通常但不一定(例如,一些pol iii启动子)位于结构基因的上游,其调节结构基因的表达。此外,包括启动子的调控元件通常位于基因转录起始位点的2kb内。启动子可含有位于起始位点更远的其它特异性调控元件,以进一步增强细胞中的表达,和/或改变与其可操作连接的结构基因的表达的时间或可诱导性。
[0310]“组成型启动子”是指指导可操作地连接的转录序列在生物体如植物的许多或所有组织中表达的启动子。如本文所用的术语组成型不一定表示基因在所有细胞类型中以相同水平表达,但该基因在广泛的细胞类型中表达,尽管水平的一些变化通常是可检测的。
[0311]
在一个优选的实施方案中,如果使用组成型启动子,其导致从外源多核苷酸转录的mrna的高水平,使得与缺乏外源多核苷酸的同基因小麦植物相比,在植物的至少一部分中产生的特异性nac转录因子的水平高至少约5倍或10倍或15倍或20倍。medberry等人(1992,1993)、sambrook等人(1989,上文)和us 5,164,316公开了评估启动子活性的非限制性方法。可导致这些mrna产生水平的组成型启动子的实例包括但不限于rsyn7启动子的核心启动子和wo99/43838和us 6,072,050中公开的其它组成型启动子;核心camv 35s启动子(odell等人,1985)或其增强形式;水稻肌动蛋白(mcelroy等人,1990);泛素(christensen等人,1989和1992);pemu(last等人,1991);mas(velten等人,1984);als启动子(us 5,659,026)等。其他组成型启动子包括,例如,在us 5,608,149中讨论的那些;5,608,144;5,604,121;5,569,597;5,466,785;5,399,680;5,268,463;5,608,142;以及6,177,611。
[0312]
如本文所用的“选择性表达”是指几乎仅在例如植物的特定器官中表达,例如卵细胞、精细胞、胚珠、花粉、雄蕊、花药、胚乳、胚、叶或根。在优选的实施方案中,启动子选择性地或优先地在葡萄藤植物的花或花部分中表达。因此,选择性表达可以与组成型表达形成对比,是指在植物经历的大部分或全部条件下在植物的许多或全部组织中的表达。
[0313]
选择性表达还可以导致基因表达产物在特定植物组织、器官或发育阶段的区室
化。在特定亚细胞位置如质体、细胞溶质、液泡或非原质体的空间中的区室化可以通过在基因产物的结构中包括适当的信号来实现,例如信号肽,用于转运至所需细胞区室,或在半自主细胞器(质体和线粒体)的情况下,通过将具有适当调控序列的转基因直接整合到细胞器基因组中。
[0314]“组织特异性启动子”或“器官特异性启动子”是相对于许多其它组织或器官优选在一种组织或器官中表达的启动子,优选在例如植物中大部分(如果不是全部)其它组织或器官中表达的启动子。通常,启动子在特定组织或器官中的表达水平比在其它组织或器官中高10倍。
[0315]“可诱导启动子”响应于内源性或外源性刺激(例如通过化学化合物(化学诱导物))的存在或响应于环境、激素、化学和/或发育信号而选择性地表达可操作地连接的dna序列。可诱导的或调节的启动子包括,例如,由光、热、应激、感染或干旱、植物激素、创伤或化学品如乙醇、茉莉酮酸酯、水杨酸或安全剂调节的启动子。如本文所用,“植物胁迫诱导型启动子”是在小麦植物中有功能的任何诱导型启动子,因此该术语不限于源自植物的启动子。
[0316]
用于在植物中表达上述核酸的合适的诱导型启动子包括由触发开花或与开花相关的生理或环境条件诱导的启动子。合适的诱导型启动子是本领域已知的并在本文中考虑。
[0317]
可以使用的其它顺式作用序列包括转录和/或翻译增强子。增强子区域是本领域技术人员熟知的,并且可以包括atg翻译起始密码子和相邻序列。当包括起始密码子时,起始密码子应与编码序列阅读框同相,其涉及外来或外源多核苷酸,以确保整个序列的翻译,如果要翻译的话。翻译起始区可由转录起始区的来源提供,或由外源或外源多核苷酸提供。该序列还可以来源于选择用于驱动转录的启动子的来源,并且可以被特异性修饰以增加mrna的翻译。
[0318]
本发明的核酸构建体可包括约50至1,000个核苷酸碱基对的3'非翻译序列,其可包括转录终止序列。3'非翻译序列可以含有转录终止信号,其可以包括或不包括聚腺苷酸化信号和能够影响mrna加工的任何其它调控信号。聚腺苷酸化信号用于向mrna前体的3'端添加聚腺苷酸片段。聚腺苷酸化信号通常通过存在与标准型5'aataaa-3’的同源性而被识别,尽管变异并不少见。不包括聚腺苷酸化信号的转录终止序列包括poli或poliii rna聚合酶的终止子,其包括4个或更多个胸苷。合适的3'非翻译序列的实例是含有来自根癌土壤杆菌的章鱼碱合酶(ocs)基因或胭脂碱合酶(nos)基因的聚腺苷酸化信号的3'转录非翻译区(bevan等人,1983)。合适的3'非翻译序列也可以衍生自植物基因,例如核酮糖-1,5-二磷酸羧化酶(ssrubisco)基因,尽管也可以使用本领域技术人员已知的其它3'元件。
[0319]
由于插入在转录起始位点和编码序列起点之间的dna序列,即未翻译的5'前导序列(5'utr),如果它被翻译和转录,可以影响基因表达,人们也可以使用特定的前导序列。合适的前导序列包括包括被选择以指导外源或内源dna序列的最佳表达的序列的那些。例如,这样的前导序列包括优选的序列,其可以增加或维持mrna稳定性并防止不适当的翻译起始,如joshi(1987)所述。
[0320]
用于降低基因表达的多核苷酸
[0321]
根据本发明的fsl多肽活性水平的改变也可以通过使用rna干扰(rnai)转录自fsl
基因座的信使rna(mrna)的转录后沉默来实现。术语“rna干扰”或“rnai”通常是指由细胞的细胞质中的双链rna(dsrna)分子引发的基因表达的rna依赖性沉默。dsrna分子减少或抑制靶核酸序列的转录产物,从而使基因沉默或减少该基因的表达。“双链rna”或“dsrna”是指具有双链结构并包括彼此长度相似的“反义序列”或“引导链”和“有义序列”或“随从链”的rna分子。同源反义和有义序列可以在单个rna链中或在分开的rna链中。反义序列基本上与靶序列互补,在本发明的情况下,靶序列是fsl多肽转录物的区域。本领域已知的一系列不同rnai技术可用于改变fsl多肽的活性。改变的fsl多肽活性可以相对于fsl多肽在相应的野生型植物或其部分中的活性水平来确定,在该野生型植物或其部分中没有对fsl基因座序列或表达产物进行修饰。
[0322]
rna干扰
[0323]
rna干扰(rnai)特别可用于特异性降低基因的表达,如果基因编码蛋白,这导致特定蛋白的产量降低。尽管不希望受理论的限制,但是waterhouse等人(1998)已经提供了dsrna(双链rna)可用于减少蛋白产生的机制的模型。该技术依赖于含有与目的基因或其部分的mrna基本相同的序列的dsrna分子的存在。方便地,dsrna可由重组载体或宿主细胞中的单个启动子产生,其中有义和反义序列侧接无关序列,其使得有义和反义序列杂交形成dsrna分子,无关序列形成环结构。合适的dsrna分子的设计和生产完全在本领域技术人员的能力范围内,特别是考虑到waterhouse等人(1998)、smith等人(2000)、wo 99/32619、wo 99/53050、wo 99/49029和wo 01/34815。
[0324]
在一个实例中,引入指导至少部分双链rna产物合成的dna,该双链rna产物与待失活的靶基因(例如fsl基因座)具有同源性。因此,dna包括有义和反义序列,当转录为rna时,可杂交形成双链rna区。在本发明的一个实施方案中,有义和反义序列被包括内含子的间隔区分隔,内含子在转录成rna时被剪接掉。已经显示这种排列导致更高效率的基因沉默(smith等人,2000)。双链区可以包括一个或两个从一个dna区或两个dna区转录的rna分子。双链分子的存在被认为来自内源系统的应答,该应答破坏双链rna以及来自靶基因的同源rna转录物,有效地降低或消除靶基因的活性。
[0325]
杂交的有义和反义序列的长度应各为至少19个连续核苷酸,优选至少50个连续核苷酸,更优选至少100或至少200个连续核苷酸。通常,使用对应于靶基因mrna区域的100-1000个核苷酸的序列。可以使用对应于整个基因转录物的全长序列。有义序列与靶转录物的同一性程度(因此也是反义序列与靶转录物的互补序列的同一性)应为至少85%、至少90%或95-100%。rna分子当然可以包括不相关的序列,其可以起稳定分子的作用。rna分子可以在rna聚合酶ii或rna聚合酶iii启动子的控制下表达。后者的实例包括trna或snrna启动子。
[0326]
优选的小干扰rna(“sirna”)分子包括与靶mrna的约19-25个连续核苷酸相同的核苷酸序列。优选地,sirna序列以二核苷酸aa开始,包括约30-70%(优选30-60%、更优选40-60%、更优选约45%-55%)的gc含量,并且与待导入的生物体基因组中除靶标以外的任何核苷酸序列不具有高百分比同一性,例如,如通过标准blast搜索确定的。
[0327]
微小rna
[0328]
微小rna(缩写为mirna)通常是19-25个核苷酸(在植物中通常约20-24个核苷酸)的非编码rna分子,其衍生自形成不完整茎环结构的较大前体。mirna与靶信使rna转录物
(mrna)上的互补序列结合,通常导致翻译抑制或靶降解和基因沉默。可以基于天然mirna来设计人工mirna(amirna)用于降低任何目的基因的表达,如本领域所熟知的。
[0329]
在植物细胞中,认为mirna前体分子在细胞核中被大量加工。pre-mirna(含有一个或多个局部双链或“发夹”区以及mrna的通常的5'“帽”和聚腺苷酸化尾)被加工成较短的mirna前体分子,其也包括茎-环或折回结构并被称为“pre-mirna”。在植物中,pre-mirna被不同的dicer样(dcl)酶切割,产生mirna:mirna*双链体。在转运出细胞核之前,这些双链体被甲基化。
[0330]
在细胞质中,来自mirna:mirna双链体的mirna单链选择性地并入活性rna诱导的沉默复合物(risc)中用于靶识别。risc-复合物含有特定亚组的argonaute蛋白,其发挥序列特异性基因抑制(参见例如millar和waterhouse,2005;pasquinelli等人,2005;almeida和allshire,2005)。
[0331]
共抑制
[0332]
基因可抑制已存在于基因组中的相关内源基因和/或转基因的表达,该现象称为同源性依赖性基因沉默。同源性依赖性基因沉默的大多数情况分成两类-在转基因的转录水平起作用的那些和转录后操作的那些。
[0333]
转录后同源性依赖性基因沉默(即共抑制)描述转基因植物中转基因和相关内源或病毒基因表达的丧失。共抑制通常但不总是在转基因转录物丰富时发生,并且通常认为其在mrna加工、定位和/或降解的水平上被触发。存在几种模型来解释共抑制如何起作用(参见taylor,1997)。
[0334]
共抑制涉及将基因或其片段的额外拷贝以相对于其表达的启动子的有义方向引入植物中。有义片段的大小,其与靶基因区的对应性及其与靶基因的序列同一性程度可由本领域技术人员确定。在一些情况下,基因序列的额外拷贝干扰靶植物基因的表达。关于实现共抑制方法的方法,参考wo 97/20936和ep 0465572。
[0335]
反义多核苷酸
[0336]
术语“反义多核苷酸”是指与编码内源多肽的特定mrna分子的至少一部分互补并且能够干扰转录后事件如mrna翻译的dna或rna分子。反义方法的使用是本领域熟知的(参见例如g.hartmann和s.endres,《反义方法论手册》(manual of antisense methodology),kluwer(1999))。bourque(1995)和senior(1998)综述了反义技术在植物中的应用。bourque(1995)列出了反义序列如何在植物系统中用作基因失活方法的大量实例。bourque还指出获得任何酶活力的100%抑制可能不是必需的,因为部分抑制将更可能导致系统中的可测量变化。senior(1998)指出反义方法现在是非常成熟的操纵基因表达的技术。
[0337]
在一个实施方案中,反义多核苷酸在生理条件下杂交,即,反义多核苷酸(其是完全或部分单链的)至少能够与编码内源多肽的mrna形成双链多核苷酸,例如:在细胞内的正常条件下,fsl多肽mrna(例如,对应于seq id no:5-7中所示的orf序列或如本文所述的与其具有百分比水平同一性的序列)、gai1蛋白mrna(对应于seq id no:8或9中所示的序列或如本文所述与其具有百分比水平同一性的序列)和/或vvmads5蛋白mrna(例如,对应于seq id no:10或11中所示的序列或如本文所述与其具有百分比水平同一性的序列)。
[0338]
反义分子可包括对应于结构基因的序列或影响对基因表达或剪接事件的控制的序列。例如,反义序列可以对应于内源基因的靶向编码区,或5'-非翻译区(utr)或3'-utr或
这些的组合。它可以与内含子序列部分互补,该内含子序列可以在转录期间或之后被剪接掉,优选仅与靶基因的外显子序列互补。考虑到utr的通常更大的差异,靶向这些区域提供了更高的基因抑制特异性。
[0339]
反义序列的长度应为至少19个连续核苷酸,优选至少50个核苷酸,更优选至少100、200、500或750个核苷酸。可以使用与整个基因转录物互补的全长序列。长度最优选为100-750个核苷酸。反义序列与靶转录物的同一性程度应为至少90%,更优选95-100%。反义rna分子当然可以包括不相关的序列,其可以起稳定分子的作用。
[0340]
重组载体
[0341]
本发明的一个实施方案包括重组载体,其包括至少一种本文定义的多核苷酸,并且能够将多核苷酸递送到宿主细胞中。重组载体包括表达载体。重组载体含有异源多核苷酸序列,即,与本文定义的多核苷酸不天然相邻的多核苷酸序列,优选来自不同物种。载体可以是rna或dna,通常是病毒载体,来源于病毒或质粒。质粒载体典型地包括提供原核细胞中表达盒的容易选择、扩增和转化的额外核酸序列,例如puc来源的载体、pgem来源的载体、psp来源的载体或含有一个或多个t-dna区的二元载体。额外核酸序列包括复制起源,以提供载体的自主复制;可选择的标记基因,优选编码抗生素或抗除草剂性;独特的多个克隆位点,提供多个位点以插入核酸序列或核酸构建体中编码的基因;以及增强原核细胞和真核细胞(特别是植物细胞)转化的序列。
[0342]
本文所用的“表达载体”是能够转化宿主细胞并影响一种或多种特定多核苷酸表达的dna载体。本发明的表达载体含有调控序列,例如转录控制序列、翻译控制序列、复制起点和与宿主细胞相容并控制本发明的多核苷酸表达的其它调控序列。特别地,本发明的表达载体包括转录控制序列。转录控制序列是控制转录起始、延伸和终止的序列。特别重要的转录控制序列是控制转录起始的序列,例如启动子、增强子、操纵子和阻遏物序列。所使用的调控序列的选择取决于目标生物体例如植物和/或靶器官或组织。这种调控序列可以从任何真核生物如植物或植物病毒获得,或者可以化学合成。适用于稳定转染植物细胞或建立转基因植物的许多载体已描述于例如以下文献中,pouwels等人《克隆载体:实验室手册》(cloning vectors:a laboratory manual),1985,增刊,1987,weissbach和weissbach,《植物分子生物学方法》(methods for plant molecular biology),academic press,1989,以及gelvin等人《植物分子生物学手册》(plant molecular biology manual),kluwer academic publishers,1990。通常,植物表达载体包括例如在5'和3'调控序列和显性选择标记的转录控制下的一个或多个克隆的植物基因。此类植物表达载体还可含有启动子调控区(例如,控制诱导型或组成型、环境或发育调节型、或细胞或组织特异性表达的调控区)、转录起始位点、核糖体结合位点、转录终止位点和/或聚腺苷酸化信号。
[0343]
已经描述了许多在植物细胞中有活性的组成型启动子。用于在植物中组成型表达的合适启动子是本领域已知的并且在本文前面有描述。
[0344]
为了在植物的源组织中表达,例如在花及其繁殖部分、芽、果实,根或茎中表达,可优选本发明中使用的启动子在这些特定组织中具有相对高的表达。为此目的,可以从许多启动子中选择具有组织或细胞特异性或增强表达的基因。这种启动子的实例在文献中报道,并且是本领域技术人员已知的。
[0345]
如本文所用,“可操作地连接”是指两个或更多个核酸(例如,dna)片段之间的功能
关系。通常,它是指转录调控元件(启动子)与转录序列的功能关系。例如,如果启动子在合适的细胞中刺激或调节编码序列的转录,则其与本文定义的多核苷酸的编码序列可操作地连接。通常,与转录序列可操作连接的启动子转录调控元件与转录序列物理上相邻,即它们是顺式作用的。然而,一些转录调控元件如增强子不需要在物理上与它们增强转录的编码序列相邻或非常接近。
[0346]
当存在多个启动子时,每个启动子可以独立地相同或不同。
[0347]
重组载体还可以含有一个或多个信号肽序列,以使表达的本文定义的多肽保留在细胞的内质网(er)中,或转移到质体中,和/或含有导致核酸分子作为融合蛋白表达的融合序列。合适的信号片段的实例包括能够指导本文定义的多肽的分泌或定位的任何信号片段。
[0348]
为了便于鉴定转化体,重组载体理想地包括可选择的或可筛选的标记基因。“标记基因”是指赋予表达该标记基因的细胞独特表型的基因,因此允许这种转化的细胞与不具有该标记的细胞区别开来。可选择的标记基因促进了可以基于对选择剂(例如除草剂、抗生素)的抗性来“选择”的性状。可筛选的标记基因(或报告基因)赋予可通过观察或测试即通过“筛选”来鉴定的性状(例如,未转化细胞中不存在的β-葡糖醛酸糖苷酶、荧光素酶、gfp或其他酶活力)。用于选择植物转化体的示例性可选择的标记包括但不限于编码潮霉素b抗性的hyg基因;新霉素磷酸转移酶(nptii)基因,其赋予对卡那霉素、巴龙霉素的抗性;来自大鼠肝脏的谷胱甘肽-s-转移酶基因,其赋予对谷胱甘肽衍生的除草剂的抗性,如例如ep 256223中所述;谷氨酰胺合成酶基因,其在过表达时赋予对谷氨酰胺合成酶抑制剂如草丁膦的抗性,如例如wo 87/05327中所述;来自绿产色链霉菌(streptomyces viridochromogenes)的乙酰基转移酶基因,其赋予对选择剂草丁膦的抗性,如例如ep 275957中所述;编码5-烯醇莽草酸酯-3-磷酸合酶(epsps)的基因,其促进对n-膦酰基甲基甘氨酸的抗性,如hinchee等人(1988)描述;赋予针对双丙氨膦的抗性的bar基因,如例如wo 91/02071中所述;腈水解酶基因,例如来自臭鼻克雷伯菌(klebsiella ozaenae)的bxn,其赋予对溴苯腈的抗性(stalker等人,1988);促进甲氨蝶呤抗性的二氢叶片酸还原酶(dhfr)基因(thillet等人,1988);突变的乙酰乳酸合酶基因(als),其赋予对咪唑啉酮、磺酰脲或其它als抑制性化学品的抗性(ep 154,204);突变的邻氨基苯甲酸酯合酶基因,其赋予对5-甲基色氨酸的抗性;或赋予除草剂抗性的茅草枯脱卤素酶基因。
[0349]
5'非翻译前导序列可衍生自被选择用于表达本发明的多核苷酸的启动子,或可相对于待产生的酶的编码区是异源的,并且如果需要可被特异性修饰以增加mrna的翻译。关于优化转基因表达的综述,参见koziel等人(1996)。5'非翻译区还可以从来自合适的真核生物基因、植物基因(小麦和玉米叶绿素a/b结合蛋白基因前导序列)或合成基因序列的植物病毒rna(烟草花叶病毒、烟草蚀纹病毒、玉米矮花叶病毒、苜蓿花叶病毒等)获得。本发明不限于其中非翻译区衍生自伴随启动子序列的5'非翻译序列的构建体。前导序列也可以来自不相关的启动子或编码序列。可用于本发明上下文的前导序列包括玉米hsp70前导序列(us 5,362,865和us 5,859,347)和tmvω元件。
[0350]
转录的终止通过在表达载体中可操作地连接到目的多核苷酸的3'非翻译dna序列实现。重组dna分子的3'非翻译区含有聚腺苷酸化信号,该聚腺苷酸化信号在植物中起作用以引起将腺苷酸核苷酸添加到rna的3'端。3'非翻译区可从植物细胞中表达的各种基因获
得。胭脂碱合酶3'非翻译区、来自豌豆小亚基rubisco因的3'非翻译区、来自大豆7s种子贮藏蛋白基因的3'非翻译区通常用于这一功能。含有农杆菌肿瘤诱导(ti)质粒基因的多聚腺苷酸信号的3'转录、非翻译区也是合适的。
[0351]
重组dna技术可用于改善转化多核苷酸的表达,例如通过根据宿主细胞种类进行密码子优化或缺失使转录物不稳定的序列来操纵得到的转录物的翻译效率,以及翻译后修饰的效率。
[0352]
优选地,将重组载体稳定地掺入细胞如植物细胞的基因组中。因此,重组载体可包括允许载体整合到基因组或细胞染色体中的适当元件。
[0353]
农杆菌介导的转移是用于将基因导入植物细胞的广泛适用的系统,因为dna可以导入整个植物组织,从而绕过了从原生质体再生完整植物的需要。使用农杆菌介导的植物整合载体将dna导入植物细胞是本领域熟知的(参见例如us 5,177,010、us 5,104,310、us 5,004,863、us 5,159,135)。此外,t-dna的整合是相对精确的过程,导致很少的重排。待转移的dna区由边界序列限定,插入dna通常插入植物基因组。
[0354]
农杆菌转化载体能够在大肠杆菌和农杆菌中复制,以便于如(klee等人,plant dna infectious agents(植物dna传染性病原体),hohn和schell,(编辑),springer-verlag(施普林格出版公司),new york(纽约),(1985):179-203)描述的进行操作。使用农杆菌转化方法形成的基因修饰植物通常在一个染色体上含有单个遗传基因座。这样的基因修饰的植物可以被称为对于添加的基因或基因变体是半合子的。更优选的是对于添加的基因或基因变体纯合的基因修饰的植物;即一种基因修饰的植物,其含有两个添加的基因,一个基因位于染色体对的每个染色体上的相同基因座。纯合的基因修饰植物可通过如下获得:将含有单个添加的基因或基因变体的独立分离体遗传修饰植物进行有性交配(自交),使所产生的种子中的一些发芽并分析所得植物的目的基因。
[0355]
还应理解,也可以将两种不同的基因修饰植物交配/杂交以产生含有两种独立分离的导入基因或基因变体的子代。合适的子代的自交可以产生对于引入的基因或基因变体都是纯合的植物。还包括与亲本植物回交和与另一植物异交,如无性繁殖。关于其他常用于不同性状和作物的育种方法的描述可以在fehr,breeding methods for cultivar development(栽培品种发展的育种方法),j.wilcox(编辑),american society of agronomy(美国农学会),madison wis.(1987)中找到。
[0356]
利用磷酸钙沉淀法、聚乙二醇处理法、电穿孔法以及这些处理的组合,可以实现植物原生质体的转化。这些系统在不同植物菌株中的应用取决于从原生质体再生该特定植物株的能力。描述了从原生质体再生谷物的说明性方法(fujimura等人,1985;toriyama等人,1986;abdullah等人,1986)。
[0357]
也可以使用细胞转化的其它方法,包括但不限于通过将多核苷酸如dna直接转移到花粉中,通过将多核苷酸如dna直接注射到植物的生殖器官中,或通过将多核苷酸如dna直接注入未成熟胚的细胞中,然后再水化干燥的胚而将dna导入植物中。
[0358]
从单株原生质体转化体或从各种转化的外植体再生、发育和培养植物是本领域熟知的(weissbach等人,methods for plant molecular biology(植物分子生物学方法),academic press(学术出版社),san diego,(1988))。这种再生和生长过程通常包括选择转化细胞、在胚胎发育的通常阶段到生根的小植株阶段培养那些个体化细胞的步骤。类似地
再生转基因胚胎和种子。然后将所得转基因生根枝条种植在合适的植物生长培养基如土壤中。
[0359]
为了证实引入的遗传物质在细胞和植物中的存在,可以使用本领域技术人员已知的方法进行聚合酶链反应(pcr)扩增或southern印迹分析。引入的基因或基因变体的表达产物可以以多种方式中的任一种检测,这取决于产物的性质,并且包括western blot和酶测定。定量蛋白表达和检测不同植物组织中复制的一种特别有用的方法是使用报告基因,如gus。一旦获得转基因植物,它们可以生长以产生具有所需表型的植物组织或部分。可以收获植物组织或植物部分,和/或收集种子。种子可用作生长具有所需特征的组织或部分的其它植物的来源。
[0360]
细胞
[0361]
本发明还提供了包括用本文定义的一种或多种重组分子转化的宿主细胞或其子代细胞的重组细胞。核酸分子向细胞中的转化可通过可将核酸分子插入细胞中的任何方法实现。转化技术包括但不限于转染、电穿孔、显微注射、脂质转染、吸附和原生质体融合。重组细胞可以保持单细胞或可以生长到组织、器官或多细胞生物体中。转化的核酸分子可以保持在染色体外或可以以保持其表达能力的方式整合到转化(即重组)细胞的染色体内的一个或多个位点中。优选的宿主细胞是植物细胞,更优选是葡萄藤细胞。
[0362]
本发明还提供了分离自本发明的植物或植物部分的植物细胞。例如,分离自本文所述fsl多肽活性水平改变的植物或植物部分的细胞。例如,分离自产生本文所述无核果实的植物或植物部分的细胞。在一些实例中,培养细胞。
[0363]
植物和植物部分
[0364]
术语“植物”当用作名词时是指整个植物,而术语“植物部分”或“其部分”(在植物的上下文中)是指植物细胞及其子代、多个植物细胞、存在于植物发育的任何阶段的结构、或植物组织。这样的结构包括但不限于叶、茎、插条和接穗、花、果实、坚果、根、种子、种皮、胚。术语“植物组织”包括植物的分化和未分化的组织,包括存在于叶、茎、花、果实、坚果、根、种子中的那些,例如胚胎组织、胚乳、真皮组织(例如表皮、周皮)、维管组织(例如木质部、韧皮部)或基本组织(包括薄壁组织、厚角组织和/或厚壁组织细胞)、以及培养中的细胞(例如、单细胞、原生质体、愈伤组织、胚胎等)。植物组织可以是植物、器官培养物、组织培养物或细胞培养物。
[0365]
如本文所用,“子代”是指从亲本产生的子代的直接和所有后续世代,例如第二、第三或后一代后代。
[0366]
如本文所用,术语“植物”包括开花植物的所有物种,即被子植物。在一个实例中,如本文所述的植物是雌雄异体植物。在另一个实例中,如本文所述的植物是雌雄同体植物。植物优选是产生果实的植物。例如,植物可以是生产浆果的植物、生产柑果的植物、生产核果的植物、生产梨果的植物或生产瓠果的植物。在这些广泛的果实种类的每一种中的示例性果实生产植物是本领域已知的并且在本文中考虑。
[0367]
预期用于实施本发明的植物包括单子叶片植物和双子叶片植物。目标植物包括但不限于以下:谷物(例如,小麦、大麦、黑麦、燕麦、水稻、玉米、高粱和相关作物);葡萄;甜菜(糖用甜菜和饲用甜菜);梨果,核果和无核小水果(苹果、梨、李子、桃、杏仁、樱桃、草莓、树莓和黑莓);豆科植物(豆类、小扁豆、豌豆、大豆);含油植物(油菜或其它芸苔属、芥菜、罂
粟、橄榄、向日葵、红花、亚麻、椰子、蓖麻油植物、可可豆、花生);黄瓜植物(西葫芦、黄瓜、甜瓜);纤维植物(棉花、亚麻、大麻、黄麻);柑橘类果实(橙子、柠檬、葡萄柚、柑桔);蔬菜(菠菜、生菜、芦笋、卷心菜、胡萝卜、洋葱、番茄、马铃薯、红辣椒);樟科(鳄梨、肉桂、樟脑);或植物,例如玉米、烟草、坚果、咖啡、甘蔗、茶、葡萄藤、啤酒花、草皮、香蕉和天然橡胶植物、以及观赏植物(花、灌木、阔叶树和常绿植物,例如针叶树)。
[0368]
在一个具体实例中,植物是生产浆果的植物。例如,植物可以是葡萄属种(vitis sp.),即例如,选自以下组成的组的葡萄属物种:欧洲葡萄(vitis vinifera)、vitis lambrusca、圆叶葡萄(vitis rotundifolia)、夏葡萄(vitis aestivalis)、vitus riperia及其杂种。在一个实例中,葡萄属物种产生鲜食葡萄。在另一个实例中,葡萄属物种生产酿酒葡萄。圆叶葡萄(vitis rotundifolia)也称为muscadinia rotundifolia并且包括其它圆叶葡萄亚属物种。
[0369]
产生植物和植物部分的方法
[0370]
本领域已知有许多技术可用于产生如本文所述的fsl多肽活性水平改变的植物,包括产生如本文所述的无核果实的植物和植物部分,包括但不限于tilling、锌指核酸酶(zfn)、tal效应物核酸酶(talen)和成簇的规律间隔的短回文重复序列(crispr)。
[0371]
tilling
[0372]
本发明的植物可使用称为tilling(在基因组中靶向诱导的局部损害)的方法产生。在第一步中,通过用化学诱变剂处理种子(或花粉),在植物群体中诱导引入的突变如新的单碱基对改变,然后将植物推进到突变将稳定遗传的世代。提取dna,并从群体的所有成员中存储种子以创建可随时间反复访问的资源。
[0373]
对于tilling测定,设计pcr引物以特异性扩增目的单个基因靶标。如果靶标是基因家族的成员或多倍体基因组的一部分,特异性尤其重要。接着,染料标记的引物可用于从多个个体的合并dna扩增pcr产物。将这些pcr产物变性并再退火以形成错配碱基对。错配或异源双链代表天然存在的单核苷酸多态性(snp)(即,群体中的几种植物可能携带相同的多态性)和诱导的snp(即,仅罕见的单个植物可能显示突变)。异源双链体形成后,使用识别和切割错配dna的核酸内切酶如cel i是在tilling群体中发现新snp的关键。
[0374]
使用这种方法,可以筛选数以千计的植物以鉴定在基因组的任何基因或特定区中具有单碱基改变以及小插入或缺失(1-30bp)的任何个体。被分析的基因组片段的大小范围可以是0.3至1.6kb。在8倍合并和每个测定96个泳道时,这种组合允许每个单一测定筛选多达百万碱基对的基因组dna,使得tilling是高通量技术。
[0375]
tilling进一步描述于slade和knauf(2005)和henikoff等人,(2004)中。
[0376]
除了允许突变的有效检测之外,高通量tilling技术对于天然多态性的检测是理想的。因此,通过与已知序列异源双链化来查询未知同源dna揭示了多态性位点的数目和位置。鉴定了核苷酸变化和小的插入和缺失,包括至少一些重复数多态性。这被称为ecotilling(comai等人,2004)。
[0377]
每个snp通过其在几个核苷酸内的近似位置来记录。因此,每个单倍型都可以根据其迁移率进行归档。可以使用用于错配切割测定的相同扩增dna的等分试样以相对小的增量努力获得序列数据。单反应的左或右测序引物通过其与多态性的接近度来选择。sequencher软件进行多重比对并发现碱基变化,在每种情况下确认凝胶条带。
[0378]
在含有排列的生态型dna的ecotilling板中,可以筛选生态型dna而不是来自诱变植物的dna库。因为检测是在具有接近碱基对分辨率的凝胶上进行的,并且背景模式在不同的泳道上是一致的,所以可以匹配大小相同的条带,从而在单个步骤中发现snp并对其进行基因分型。用于筛选的pcr产物可以进行dna测序。
[0379]
使用位点特异性核酸酶的基因组编辑
[0380]
基因组编辑使用由与非特异性dna切割模块融合的序列特异性dna结合结构域组成的工程化核酸酶。这些嵌合核酸酶通过诱导靶dna双链断裂而实现有效和精确的遗传修饰,dna双链断裂刺激细胞的内源性细胞dna修复机制以修复诱导的断裂。这些机制包括例如易错非同源末端连接(nhej)和同源定向修复(hdr)。
[0381]
在具有延伸的同源臂的供体质粒存在下,hdr可导致引入单个或多个转基因以校正或替代现有基因。在缺乏供体质粒的情况下,nhej介导的修复产生引起基因破坏的靶标的小插入或缺失突变。
[0382]
可用于本发明方法的工程化核酸酶包括锌指核酸酶(zfn)和转录激活物样(tal)效应物核酸酶(talen)。
[0383]
通常,核酸酶编码基因通过质粒dna、病毒载体或体外转录的mrna递送到细胞中。荧光替代报告载体的使用也允许富集zfn-和talen-修饰的细胞。作为zfn基因递送系统的替代,细胞可以与能够穿过细胞膜并诱导内源基因破坏的纯化的zfn蛋白接触。
[0384]
复杂的基因组通常包括与预定dna靶标相同或高度同源的序列的多个拷贝,这可能导致靶外活性和细胞毒性。为了解决这一问题,可以使用结构(miller等人,2007;szczepek等人,2007)和基于选择的方法(doyon等人,2011;guo等人,2010)来产生具有优化的切割特异性和降低毒性的改进的zfn和talen异二聚体。
[0385]
锌指核酸酶(zfn),其包括dna结合结构域和dna切割结构域,其中dna结合结构域由至少一个锌指组成并且与dna切割结构域可操作地连接。锌指dna结合结构域位于蛋白的n端,dna切割结构域位于蛋白的c端。
[0386]
zfn必须具有至少一个锌指。在一个优选的实施方案中,zfn具有至少三个锌指,以便具有足够的特异性,用于宿主细胞或生物体中的定向基因重组。通常,具有多于三个锌指的zfn将对每个另外的锌指具有逐渐更大的特异性。
[0387]
锌指结构域可以衍生自任何种类或类型的锌指。在一个具体的实施方案中,锌指结构域包括cis2his2型锌指,其通常由例如锌指转录因子tfiiia或sp1代表。在优选的实施方案中,锌指结构域包括三个cis2his2型锌指。可以改变zfn的dna识别和/或结合特异性,以便在细胞dna中的任何选定位点实现靶向基因重组。这种修饰可以使用已知的分子生物学和/或化学合成技术来完成。(参见例如bibikova等人,2002)。
[0388]
zfn dna切割结构域衍生自一类非特异性dna切割结构域,例如ii型限制性酶如foki的dna裂解结构域(kim等人,1996)。其它有用的核酸内切酶可包括例如hhai、hindiii、nod、bbvci、ecori、bgli和alwi。
[0389]
如果存在,zfn的切割和识别结构域之间的接头包括选择的氨基酸残基序列,使得所得接头是柔性的。或者,为了最大的靶位点特异性,制备无接头构建体。无接头构建体强烈偏好与相隔6bp的识别位点结合,然后在识别位点之间切割。然而,对于长度在0和18个氨基酸之间的接头长度,zfn介导的切割发生在间隔5和35bp之间的识别位点之间。对于给定
的接头长度,将存在与结合和二聚化一致的识别位点之间距离的限制。(bibikova等人,2001)。在一个优选的实施方案中,在切割和识别结构域之间没有接头,并且靶基因座包括两个相对于彼此反向的9个核苷酸的识别位点,由6个核苷酸的间隔区隔开。
[0390]
为了根据本发明的优选实施方案靶向基因重组或突变,必须在宿主dna中鉴定两个9bp锌指dna识别序列。这些识别位点将处于彼此相反的方向并被约6bp的dna分开。然后通过设计和产生锌指组合产生zfn,锌指组合在靶基因座特异性结合dna,然后将锌指连接到dna切割结构域。
[0391]
zfn活性可通过使用瞬时低温培养条件来提高核酸酶表达水平(doyon等人,2010)和位点特异性核酸酶与dna末端加工酶的共递送(certo等人,2012)来提高。zfn介导的基因组编辑的特异性可以通过使用锌指切口酶(zfnickases)来改善,锌指切口酶刺激hdr而不激活易错nhe-j修复途径(kim等人,2012;wang等人,2012;ramirez等人,2012;mcconnell smith等人,2009)。
[0392]
转录激活物样(tal)效应物核酸酶(talen)包括tal效应物dna结合结构域和核酸内切酶结构域。
[0393]
tal效应子是植物病原性细菌的蛋白,其被病原体注射到植物细胞中,在那里它们行进到细胞核并起转录因子的作用以开启特定的植物基因。tal效应子的一级氨基酸序列决定其结合的核苷酸序列。因此,可以预测tal效应子的靶位点,并且为了与特定核苷酸序列结合的目的,可以工程化并产生tal效应子。
[0394]
与编码tal效应子的核酸序列融合的是编码核酸酶或核酸酶的一部分的序列,通常是来自ii型限制性核酸内切酶如foki的非特异性切割结构域(kim等人,1996)。其它有用的核酸内切酶可包括例如hhai、hindiii、nod、bbvci、ecori、bgli和alwi。一些核酸内切酶(例如foki)仅作为二聚体起作用的事实可以被利用来增强tal效应子的靶特异性。例如,在一些情况下,每个foki单体可以与识别不同dna靶序列的tal效应子序列融合,并且只有当两个识别位点紧密接近时,失活单体才会聚在一起产生功能酶。通过需要dna结合来激活核酸酶,可以产生高度位点特异性的限制性酶。
[0395]
序列特异性talen可识别细胞中存在的预选靶核苷酸序列内的特定序列。因此,在一些实施方案中,可以扫描靶核苷酸序列的核酸酶识别位点,并且可以基于靶序列选择特定的核酸酶。在其它情况下,talen可以被工程化以靶向特定的细胞序列。
[0396]
使用可编程rna引导的dna核酸内切酶的基因组编辑
[0397]
与上述位点特异性核酸酶不同,成簇的规律间隔的短回文重复序列(crispr)/cas系统提供了zfn和talen的替代方案用于诱导靶向遗传改变。crispr系统依赖于crispr rna(crrna)和反式激活嵌合rna(tracrrna)用于侵入的外源dna的序列特异性沉默。存在三种类型的crispr/cas系统:在ii型系统中,cas9用作rna引导的dna核酸内切酶,其在crrna-tracrrna靶标识别时切割dna。crispr rna碱基对与tracrrna形成将cas9核酸内切酶引导至互补dna位点用于切割的双rna结构。
[0398]
crispr系统可以通过共递送表达cas核酸内切酶的质粒和必要的crrna组分而携带至植物细胞,如本领域和本文所述。可以将cas核酸内切酶转化为切口酶以提供对dna修复机制的额外控制(cong等人,2013)。
[0399]
crispr基因座是一类独特的散布的短序列重复序列(ssr),其首先在大肠杆菌中
被识别(ishino等人,1987;nakata等人,1989)。类似的散布的ssr已在嗜盐菌(haloferax mediterranei)、酿脓链球菌(streptococcus pyogenes),鱼腥藻(anabaena)和结核分枝杆菌(mycobacterium tuberculosis)中鉴定(groenen等人,1993;hoe等人,1999;matepohl等人,1996;mojica等人,1995)。
[0400]
crispr基因座的共同结构特征在jansen等人,(2002)中描述为(i)存在多个短直接重复序列,其在给定基因座内显示没有或非常小的序列变化;(ii)在相似大小的重复序列之间存在非重复间隔区序列;(iii)在携带多个crispr基因座的大多数物种中存在几百个碱基对的共同前导序列;(iv)基因座内不存在长开放阅读框;以及(v)存在一种或多种cas基因。
[0401]
crispr通常是24-40bp的短的部分回文序列,含有多达11bp的内部和末端反向重复序列。尽管已检测到分离的元件,但它们通常以由独特的插入20-58bp序列间隔的重复单位的簇(每个基因组最多约20或更多)排列。crispr在给定基因组内通常是同质的,其中大部分是相同的。然而,在例如古菌中存在异质性的实例(mojica等人,2000)。
[0402]
如本文所用,术语“cas基因”是指通常与侧翼crispr基因座相关或接近侧翼crispr基因座或在侧翼crispr基因座附近偶联的一个或多个cas基因。haft等人(2005)对cas蛋白家族进行了全面综述。真核生物工作中最经常采用的crispr-cas系统使用cas9效应蛋白,典型地使用rna引导的酿脓链球菌cas9或多种植物物种中的优化序列变体(luo等人,2016)。本文所用的cas包括cas9、cas12酶(例如cas12a、cas12b、cas12f、cpf1、c2c1、c2c3)和其它crispr-cas系统如rna引导的cas13 rna酶。
[0403]
切口酶
[0404]
crispr-cas ii系统使用具有两个酶切割结构域ruvc和hnh结构域的cas9核酸酶。已显示突变将双链切割改变为单链切割并产生称为切口酶或核酸酶失活的cas9的技术变体。ruvc亚结构域切割非互补dna链,hnh亚结构域切割与grna互补的dna链。切口酶或核酸酶失活的cas9保留由grna指导的dna结合能力。亚结构域中的突变是本领域已知的,例如具有d10a突变或h840a突变的酿脓链球菌cas9核酸酶。
[0405]
基因组碱基编辑或修饰
[0406]
碱基编辑是通过将脱氨酶与cas9结构域融合而产生的(wo 2018/086623)。通过融合,脱氨酶可以利用由grna引导的序列靶向,通过dna中的胞苷的脱氨基作用使靶向的胞苷(c)转化为尿嘧啶(u)。然后,细胞的错配修复机制用t代替u。合适的胞苷脱氨酶可以包括apobec1脱氨酶、活化诱导的胞苷脱氨酶(aid)、apobec3g和cda1。此外,cas9-脱氨酶融合体可以是具有切口酶活性以产生单链断裂的突变cas9。已表明切口酶蛋白在促进同源定向修复中可能更有效(luo等人,2016)。
[0407]
常规植物育种方法
[0408]
除了上述方法之外,本发明的植物还可以使用本领域已知的常规植物育种技术产生。这样的方法通常包括杂交具有已知多核苷酸或基因(包括其特定变体)的亲本系,其赋予特定性状,并筛选杂交产生的子代以鉴定具有目的多核苷酸或基因的特定组合和/或显示目的特定表型的子代。子代的筛选可以基于表型和/或基于使用本领域已知的分子技术的分子表征。在一些实例中,常规育种方法涉及随后与亲本系回交以在一个或多个多核苷酸或基因处实现特定基因型状态。常规的植物育种技术是本领域熟知的,并且本文预期产
生产生已知性别的花的植物和/或产生产生无核果实的植物,如本文所述。
[0409]
果实及其产品
[0410]
本文还提供了由本文所述植物产生的果实。果实可以是无核的。优选地,果实是种子败育型无核果实。更优选地,果实是单性结实的无核的。根据其中生长果实的植物是葡萄属物种的实例,果实将是葡萄,例如无核葡萄。在一个实例中,葡萄是无核鲜食葡萄。
[0411]
本发明的果实可通过使如本文所述的植物在足以使植物开花并产生果实的条件和时间段下生长来产生。在一些实例中,果实可以从植物收获。然而,在其他实例中,可能希望将果实留在植物上(例如,用于苗圃销售)。在一些实例中,该方法进一步包括加工果实。例如,加工果实可以包括包装果实和/或由果实生产一种或多种产品(例如,一种或多种食品或饮料产品或成分)。
[0412]
本发明还提供了由本文所述的植物或其果实产生的产品。在一个实例中,产品是食品、食品成分、饮料产品或饮料成分。食品可以选自例如鲜食葡萄、果酱、橘子酱、果冻、小葡萄干和葡萄干组成的组。食品成分可以是例如熟葡萄酒、酸果汁、醋或葡萄糖浆(mosto cotto)。饮料产品可以是例如葡萄酒、格拉巴酒、白兰地或葡萄汁。饮料成分可以是例如酿酒葡萄、鲜食葡萄或其果汁。
[0413]
实施例
[0414]
实施例1:材料和方法
[0415]
微葡萄藤植物品系
[0416]
在澳大利亚阿德莱德的csiro urrbrae基地,微葡萄藤植物在温室或生长室中在25-30℃的白天以及20-25℃的夜间生长16小时。将植物保持在盆中,每天浇水并以规则的间隔给予缓释肥料。所研究的微葡萄藤基因型具有雄性花(fsl/fsl)、雌性花(fsl/fsl)或雌雄同体花(fsl/fsl或fsl/fsl)。研究了许多具有不同花型的微葡萄藤品系,实例包括03c003v0060(l1莫尼耶比诺(pinot meunier)子代
×
richter 110)(雄性花,m/f)、04c023v0003(雌性花,f/f)、04c023v0006(雌雄同体花,h/h)。通过将葡萄藤根茎richter 110(m/f)与雌性微葡萄藤系00c001v0008(f/f)杂交获得具有雄性花的微葡萄藤品系。
[0417]
使用oiv描述符no 151通过形态学评分进行花性别的表型分型(http://www.oiv.int/)。
[0418]
使用植物基因组dna小提试剂盒(dnaeasy plant mini kit)(qiagen 69106)从微葡萄藤叶中提取基因组dna。
[0419]
雄性、雌雄同体和雌性等位基因的克隆
[0420]
为了获得编码dna序列和翻译的蛋白序列,使用植光谱植物总rna试剂盒(spectrum plant total rna kit)货号#strn250(sigma)按照制造商的说明从修饰的e-l系统的花期1-2提取总rna。修饰的e-l系统的描述可以在coombe采用一套确定葡萄藤生长阶段的系统('adoption of a system for identifying grapevine growth stages’)(1995)《澳大利亚葡萄和葡萄酒研究杂志》(aust.j.grape and wine res.)1:104-110的论文中找到。从fsl基因编辑的植物(fsl敲除)、雄性植物03c003v0016(来自l1莫尼耶比诺(pinot meunier)子代
×
richter 110的子代),雌性植物04c023v0003(来自grenache
×
l1莫尼耶比诺的子代)和纯合雌雄同体04c023v0006(来自grenache
×
l1针叶树的子代)提取总rna。使用superscript iv第一链合成系统,货号#18091050(invitrogen),按照制造商的
说明,使用寡dt b26 5
’‑
gactcgagtcgacatcgattttttttttttttttt-3’(seq id no:12)产生第一链cdna。使用来自bioline货号#bio-25047的mytaq
tm hs red mix,按照制造商对20μl反应体积和2μl模板的说明,使用标准pcr技术从cdna扩增编码序列。pcr反应条件为95℃下3分钟用于初始变性,然后95℃下30秒、58℃下30秒、72℃下1分钟和40秒的35个循环。在72℃下进行最终延伸孵育10分钟。用于扩增的引物是b26和csfs1_cds_f1 5
’‑
cag tgc cag ttt tgc agg c-3’(seq id no:13),引物从实施例2中的赤霞珠cdna h序列设计。根据制造商的说明书,使用qiagen pcr克隆试剂盒,货号#231124克隆pcr产物用于测序。
[0421]
雌雄同体和雌性品系中花阶段1-2中的fsl表达
[0422]
使用rt-qpcr从第一链cdna测量fsl的基因表达。将第一链cdna和基因特异性引物设计为每个等位基因的3个主要区域。所用引物为:
[0423]
fsl_rt_f1 5
’‑
acgccggtggaataaacagg-3’(seq id no:14);和
[0424]
fsl_rt_r1 5
’‑
tct cct ttc tcc atc cct aat tga-3’(seq id no:15)。
[0425]
在rt-qpcr测定中以1x浓度使用lightcycler 480sybr green 1master 2x浓度货号#04 887 352 001(roche),以及在15μl反应体积中的基因特异性引物10pmol/反应(1μl的10μm储备液)和3μl第一链cdna。在转子基因rg-3000(corbett research)中进行pcr扩增,95℃下10分钟,然后95℃下20秒,58℃下20秒,72℃下20秒的50个循环,然后进行最72℃下5分钟的终步骤。使用rotor-gene 3000软件(corbett research)对每个基因和每个cdna样品生成标准曲线、熔解曲线和ct值。使用参考基因泛素对ct值进行归一化,以确定每个样本中的相对基因表达水平,方法是使用qiagen讲义中描述的相对定量比较方法“成功实时pcr的关键因素(critical faces for success real-time pcr)”(https://www.gene-quantification.de/qiagen-qpcr-sample-assay-tech-guide-2010.pdf)。
[0426]
花粉萌发试验
[0427]
将来自花的花药收集在单腔载玻片上并使其干燥5分钟以释放花粉。将花粉收集在萌发溶液(0.5m蔗糖,硼酸100mg/ml和硝酸钙300mg/l,ph5.4)中,并且在28摄氏度下在黑暗中在加湿容器中的倒置载玻片上孵育过夜。通过差示干涉对比(dic)明视野显微镜在20x放大倍数下评价花粉萌发。
[0428]
fsl基因编辑载体对纯合子雌雄同体(h/h)04c023v0006的遗传转化
[0429]
通过农杆菌介导的转化将含有基因编辑盒cas9-sgrna盒的二元载体pclb1301nh插入纯合雌雄同体04c023v0006中。完整方法描述于iocco等人,(2001)中,并且使用chaib,j等人,(2010)植物杂志,62(6):1083-1092中描述的方法再生转基因植物。基因编辑载体设计在实施例6中有更详细的描述。
[0430]
葡萄藤自交系发育育种
[0431]
产生在身材和花性别上都不同的纯合品系是希望的,以提高将来的微葡萄藤和正常身材的葡萄的育种效率。鉴定fsl基因和用于选择的序列将允许育种者在苗期筛选出雌性植物。为了通过自花授粉(自交)实现这种连续的近交,进行自交,同时在两个位点保持杂合状态(vvgai1/vvgai1)和花性别(fsl/fsl)。将原始的l1莫尼耶比诺突变体微葡萄藤用作雌性亲本,并将花去雄以接受来自赤霞珠(cabernet sauvignon)或雷司令(riesling)的花粉作为雄性亲本。在新鲜的0.5m h2o2中浸泡12小时后,从收集的种子萌发子代群体,在无菌水中漂洗并转移到无菌的2.6mm ga(赤霉酸)中孵育过夜,然后再次在无菌水中清洗并密封
湿气。将种子在4℃下储存约3周,将种子切碎,再次在ga中孵育18h并转移到衬有无菌滤纸的皮氏培养皿(petri dish)中。将种子在光照下保持在25℃,发芽后转移到盆中并在25-30℃的白天和20-25℃夜间保持在生长室或温室中16h。身材等位基因的分离产生50%具有矮态型的子代。fsl基因座遵循fsl/fsl
×
fsl/fsl杂交的1:1的预期分离比。为每个群体分离微葡萄藤个体并在温室中生长。葡萄藤可以高密度生长,每m2生长34个微葡萄藤。
[0432]
实施例2:通过基因作图克隆雌雄同体性基因座并克隆和测序雄性、雌性和雌雄同体等位基因
[0433]
通过基因作图,本发明人已经鉴定了被认为负责葡萄藤中花性别的基因。本发明人其命名为花性别(fsl)基因。该基因座的测序鉴定了fsl的雄性(m)、雌性(f)和雌雄同体(h)等位基因之间的单核苷酸多态性(snp)。来自该基因的snp标记已用于植物h和f等位基因的基因分型,基因型和表型之间100%匹配。使用标准分子方法,从在csiro产生的花cdna文库中测序来自赤霞珠(cabernet sauvignon)的全长h cdna。在修饰的e-l系统的阶段12从未成熟的花序制备cdna文库。从田间生长的植物收集组织。修改的e-l系统的描述可以在b.g.coombe(1995)《澳大利亚葡萄和葡萄酒研究杂志》(aust.j.grape and wine res.),1:104-110的论文中找到。图1a和seq id no:1列出了来自赤霞珠的fsl的cdna。
[0434]
使用实施例1中描述的克隆方法,从基因型03c003v0016和04c023v003的雄性、雌性和雌雄同体分离fsl,并分离04c023v0006。这些分别示于图1b-d中,并分别示于seq id no:2-4中。fsl基因座的雌性、雌雄同体和雄性等位基因的开放阅读框(orf)的比对(分别为seq id no:5-7)提供于图2中。
[0435]
实施例3:蛋白序列和blast分析
[0436]
从cdna序列获得蛋白序列,并对蛋白和cdna序列进行blast分析。蛋白序列示于图3a-c和seq id no:5-7中。这些比对预测platz(植物富含at序列和锌结合)结构域的存在(nagano等人,(2001)核酸研究29(20):4097-4105)。
[0437]
对于cdna序列(图1a-d)和氨基酸序列(图3a-c),platz结构域(锌指盒)的预测区域以黄色突出显示。使用在线工具prosite(sigrist,c.j.a.,(2009)《核酸研究》(nucleic acids research),38:161-166.)鉴定每种情况下的区域。从序列中可以明显看出,在不同等位基因之间的氨基酸序列中没有差异,然而在雌性等位基因(粗体)的cdna序列中存在c到t的替换,这产生了均编码天冬氨酸的有义突变gac
→
gat(参见图1b-d)。
[0438]
也为雌雄同体蛋白序列建立了进化树(图3)。大多数命中是未表征的没有已知功能的序列。获得的用于进化树的蛋白序列比对和命中支持fsl基因含有platz结构域和它可能是转录因子的结论。platz超家族转录因子已被发现只存在于植物中,到目前为止还没有被鉴定参与花的性别决定。事实上,platz蛋白在植物中的精确功能仍然缺乏了解,并且有迹象表明它们可以响应于胁迫而发挥功能(so等人,(2015)poj,8(6):479-484)。
[0439]
蛋白的氨基酸序列与从高等植物的基因组序列预测的其它未表征的蛋白的氨基酸序列相似。然而,在植物界之外没有发现直系同源序列。这些直系同源蛋白中的多重比对显示几个半胱氨酸和组氨酸残基是不变的,表明这些蛋白是一类新的锌依赖性dna结合蛋白(nagano等人2001)。
[0440]
实施例4:葡萄藤花中花性别(fsl)基因的表达
[0441]
为了更好地理解fsl在指定花性别中的功能,进行mrna原位杂交以鉴定该基因被
转录的花器官和组织。从fsl基因(seq id no:4所示序列的54-765bp)合成地高辛标记的711bp探针。对711bp探针的blast分析表明该探针特异于与fsl转录物的杂交。使用幼小未成熟阶段的花(未彼此分离的花)确定fsl的表达模式。根据jackson,d.p.(1992)在植物中的原位杂交(in-situ hybridisation in plants)中描述的方法进行原位杂交。收录于:《分子植物病理学:实用方法。实用方法系列》(molecular plant pathology:a practical approach.practical approach series),1(85)。oxford university press以及https://www.its.caltech.edu/~plantlab/protocols/insitu.pdf。
[0442]
来自mrna原位杂交的结果显示fsl在雄蕊的花丝和花药以及雄性花的胚珠中表达(图5a和b)。在雌雄同体花中,在雄蕊的花丝和胚珠中检测到表达(图5c和d)。与雄性花相比,雌雄同体花的花药中fsl表达降低。在雄性花和雌雄同体花中,在花被器官中未检测到fsl表达(图5a-d)。由于预期雌性花显示无功能的fsl表型,在雄蕊花药和花丝中观察到很少或没有表达(图5e-f)。有趣的是,fsl似乎在胚珠中表达(图5e)。总之,这些结果表明fsl主要在雄性和雌雄同体花的雄蕊中表达,而该基因的表达在雄性生殖器官无功能的雌性花中不存在。
[0443]
当花仍然紧凑和紧密闭合时,还对从叶和早期发育的花阶段1-2获得的cdna进行实时pcr分析,以使用实施例1中描述的方法测定fsl的表达模式。如图6所示,fsl的表达在v6纯合雌雄同体(h/h)中最高,在v3雌性(f/f)中非常低,这支持了fsl参与通过正常雄蕊发育的花性别决定的发现。该实验的结果表明f等位基因在花中的表达比h等位基因低27倍。该数据表明fsl被下调以产生雌性花表型。
[0444]
实施例5:将葡萄藤花从雌雄同体转化为雌性的基因编辑
[0445]
方法和结果
[0446]
将crispr/cas9介导的突变引入fsl基因的推定的platz结构域内,目的是产生fsl敲除的微葡萄藤植物,以确定开花中的基因功能。crispr/cas9载体具有spcas9,接着是单个crrna:tracrna sgrna(jinek等人(2012)《科学》(science)337(6096):816-821)。spcas9被密码子优化用于葡萄以优化翻译效率。
[0447]
使用在线工具benchling(https://benchling.com)确定了fsl所有可能的20bp指导rna。选择位于推定的platz结构域内的指导rna,然后使用指导-it sgrna体外转录和筛选系统,货号#632639(takara bio usa,inc)用cas9和dna模板筛选体外切割。选择两种指导rna,命名为sgrnafs1和sgrnafs4(图7)。
[0448]
crispr/cas9-sgrna盒由genscript合成(https://www.genscript.com/)并克隆到二元载体pclb1301nh中用于使用实施例1中描述的一般方法转化。使用的sgrna序列如下:
[0449]
·
指导fs1(在反义方向):ggcggtgagggagcaaacag(seq id no:16)
[0450]
·
指导fs4(在反义方向):aggggtgcacctgtagaagg(seq id no:17)
[0451]
·
指导fs2(在反义方向):gtcttgcaagcttcgttcgc(seq id no:18)
[0452]
·
指导fs3(在有义方向):gcagcagcgtctctgtacct(seq id no:19)
[0453]
图8说明了微葡萄藤的遗传转化。
[0454]
通过扩增子sanger测序检查所得转基因t0代小植株的基因编辑,超过62%的植株在fsl的预测区域具有编辑。用next gen基因测序进一步分析一些植物以确定突变类型、位
置和频率。选择在预测位置周围具有高突变频率的t0植物进行t1代杂交。
[0455]
还使用实施例1中描述的方法对t0代的花性别进行表型分析。sgrnafs1编辑的两株植物发育雌性花,雄蕊反折,花粉不育,如实施例1所述的花粉萌发试验所确定的那样。图9显示了原始雌雄同体植物和fsl敲除植物的花表型。
[0456]
通过amplicon nextgen测序确定fsl敲除植物中突变的突变类型位置和频率。对于叶和花基因组dna样本,指导序列周围的突变频率均为98%,这意味着两个等位基因都已经通过基因编辑而突变,并且该突变可以传递到t1代。图10显示最常见的突变类型和位置是指导序列第16个碱基的t插入或t缺失。产生的t插入或t缺失的编辑对应于相对于seq id no:6或7所示序列的位置155和159。
[0457]
fsl敲除和h等位基因的预测氨基酸序列的比对显示敲除产生无义突变,其中蛋白合成由于终止密码子而过早中断(图11)。
[0458]
讨论
[0459]
通过基因编辑微葡萄藤内的fsl将雌雄同体转化为雌性花有力地支持了fsl参与雄性器官发育的结论,证实了实施例4中的发现。通过基因编辑引入的突变导致截短的无功能蛋白,从而阻止雄性生殖器官发育并产生雌性花表型。因此,本发明提供了用于将雌雄同体开花植物转化为雌性开花植物的新方法和总体通用方法。这些方法和办法可用于雄性不育选择育种策略。
[0460]
实施例6:单性结实的无核果实矮小雌性葡萄藤
[0461]
基于fsl基因负责葡萄藤中的花性别的发现,本发明人随后开发了快速开花并产生无核果实的矮化植物及其生产方法。chaib等人,2010中描述了用于繁殖和种子萌发的微葡萄藤的生长条件和方案。植物在南澳大利亚waite的温室中生长。这是通过在单株植物中组合两个基因实现的:1)杂合(gai1/gai1)或纯合状态(gai1/gai1)的突变基因赤霉酸不敏感基因,其导致矮态型和快速开花表型;和2)雌性fsl基因座(纯合状态的f/f)。对种群进行植物身材和浆果颜色的视觉表型分析。
[0462]
然后通过用来自基因型如雷司令(riesling)的有活力的花粉人工授粉开花时雌性微葡萄藤的一些花序,并使其它花序不受授粉来测试具有上述遗传特性的植物。用显示花粉供体名称和授粉日期的纸标签标记花序。使授粉的花序生长成簇,收获果实并切片以观察授粉后约3个月的种子发育(如果有的话)。在由雌性微葡萄藤上的授粉花发育的浆果切片中发现硬种子,但在由非授粉花发育的浆果中没有发现种子(图12a和b)。
[0463]
正常的雌性葡萄藤产生在未授粉时不发育果实的花,但当这些花与来自雄性或雌雄同体植物的花粉交叉授粉时产生果实。相反,本文所开发的雌性微葡萄藤被证明产生通常无核的浆果,除非被交叉授粉。因此,与fsl f/f基因型组合的矮化基因在没有授粉的情况下产生无核果实,但当花用有活力的花粉授粉时产生坚硬的有活力的种子。
[0464]
实施例7:有单性结实的和种子败育型无核果实的矮小雌性葡萄藤
[0465]
根据实施例6的发现,本发明人开发了即使在用有活力的花粉授粉后也能迅速开花并产生无核果实的矮化植物及其生产方法。这是通过在单株植物中组合三个基因实现的:1)杂合(gai1/gai1)或纯合状态(gai1/gai1)的突变基因赤霉酸不敏感基因,其导致矮态型和快速开花表型;2)雌性fsl基因座(纯合状态的f/f);以及3)葡萄mads-box蛋白5(vvmads5)基因的突变基因座(无论是杂合状态还是纯合状态)与葡萄藤的无籽果实(sdl1)
密切相关。vvmads5已被分离,序列已保存在genbank数据库中(genbank:af373604.1;boss等人,(2002)《植物科学杂志》(j.plant sci.),162(6):887-895)。该基因在以后的几篇文献中被鉴定为与无核性相关的关键基因,也被称为vviagl11。
[0466]
简言之,在开花期间将花粉从无核葡萄品种收集在小瓶中,在42℃的烘箱中干燥过夜并在-80℃的冷冻器中储存直至使用。最初选择的无核品种为克瑞森无核(crimson seedless)、红宝石无核(ruby seedless)、黑宝石无籽葡萄干(black gem currant)和ms-03-48-44。后来,来自品种如黑美人(fantasy seedless)(fresno b 36-27
×
fresno c 78-68)和夏皇家无核(summer royal)(fresno a 69-190
×
fresno c 20-149)的花粉也已用于生产具有单性结实的和种子败育型的矮小雌性葡萄藤。当雌性微葡萄藤植物的花序开始落帽时,轻轻地除去所有的帽,并将所选择的无核品种的花粉涂刷到实施例6中发育的矮小雌性微葡萄藤花的柱头上。用显示花粉供体名称和授粉日期的纸标签标记花序。接下来的一天或两天重复授粉以覆盖所有发育后期的花。
[0467]
收获果实并在授粉后约3个月提取种子。使种子发芽并使分离的子代在温室中的盆中生长。当花序在该分离的子代中发育时,将植物与来自测试品种如雷司令(riesling)的有活力的花粉杂交以证实子代的无核表型并鉴定和选择真正无核的植物。
[0468]
还开发了无核标记测试以证实表现出真正无核表型的那些植物具有vvmads5基因型。简言之,开发引物以通过pcr从无核品种如克瑞森无核(crimson seedless)、红宝石无核(ruby seedless)和接种的苏丹娜(sultana)单球菌中用snps分离vvmads5的基因组区域。然后设计引物,按照lgc biosearch technologies的“在罗氏lc480系列仪器上运行kasptm基因分型反应指南(guide to running kasp
tm genotyping reactions on the roche lc480-series instruments)”,使用kasptm方法对无核品种进行基因分型。一组引物(下文)成功地鉴定了无核snp并将其与表型匹配。该标记命名为sdl1。
[0469]
所用引物:
[0470]
vvsdlf1:gaaggtgaccaagttcatgctatccaggcattagtttctcg(seq id no:20)
[0471]
vvsdlf2:gaaggtcggagtcaacggattatccaggcattagtttctct(seq id no:21)
[0472]
vvsdlrev:aagtgggtagcctgtggat(seq id no:22)
[0473]
存在这样的情况,其中雌性微葡萄藤的花序可能被来自其它葡萄藤的空气中的花粉授粉,在这种情况下浆果可能发育硬种子。因此,重要的是开发在授粉后不形成硬种子的真正无核的微葡萄藤,以解决花被风吹花粉无意授粉的情况。本发明人已经通过将突变的vvmads5无籽果实基因座导入包括与fsl雌性(f/f)基因座组合的突变的gai1矮化基因的雌性微葡萄藤中实现了这一点。这种植物即使在授粉后也产生无核果实。当所有三种基因组合时,产生具有不育花粉的矮化葡萄藤,并产生具有或不具有受精的无核果实。用无核标记的基因分型证实了vvmads5基因的突变基因座。通过在开花时人工授粉几个雌性微葡萄藤的一些花序,用来自基因型如雷司令(riesling)的有活力的花粉进一步测试表型。用花粉供体名称和授粉日期的纸标签标记花序。使授粉的花序生长成簇,收获果实并切片以观察授粉后约3个月的种子发育(如果有的话)。在从未受精的花发育的浆果中,单性结实的无核是明显的(图13a)。在由授粉的花发育的浆果中,种子败育型无核是明显的,即仅观察到通常不发芽的软种子痕迹(图13b)。
[0474]
实施例8:有种子败育型无核果实的矮小雌雄同体葡萄藤
[0475]
本发明人还开发了即使在用有活力的花粉授粉后也能快速开花并产生无核果实的新的矮化雌雄同体植物及其生产方法。植物和方法组合了两种基因:1)杂合(gai1/gai1)或纯合状态(gai1/gai1)的突变基因赤霉酸不敏感基因,其导致矮态型和快速开花表型;以及2)vvmads5基因的突变基因座(无论是杂合状态还是纯合状态)与葡萄藤的无籽果实(sdl1)密切相关。
[0476]
当在雌性微葡萄藤植物的花序中开始落帽时,轻轻地除去所有的帽,并将来自选择的无核品种的花粉(如实施例7)刷到花的柱头上。用显示花粉供体名称和授粉日期的纸标签标记花序。接下来的一天或两天重复授粉以覆盖所有发育后期的花。
[0477]
收获果实并在授粉后约3个月提取种子。使种子发芽并使分离的子代在温室中的盆中生长。用无核标记物(描述于实施例7)进行基因分型,以证实产生雌雄同体花并发育成无核浆果的植物中vvmads5基因的突变基因座。雌雄同体微葡萄藤的浆果切片证实,使用sdl标记并含有突变的vvmads5基因座的基因分型为种子败育型无核果实的植株是无核的或仅具有软的种子痕迹,而其它雌雄同体植株具有硬的褐色种子(图14a和b)。
[0478]
雌雄同体微葡萄藤表现出典型的花的雌雄同体表型并在浆果中发育硬种子。通过将突变的vvmads5基因座导入雌雄同体背景(通过常规植物育种或重组dna技术),产生了具有无核浆果的雌雄同体微葡萄藤植物。无核雌雄同体对于鲜食葡萄市场以及将无核引入其它葡萄基因型的进一步育种工作是重要的。
[0479]
实施例9:其他新组合
[0480]
雌性和雌雄同体微葡萄藤是用浆果果肉颜色(来自葡萄品种dunkelfelder的红色果肉性状)和浆果风味(来自麝香葡萄和芳蒂娜(frontignac white)葡萄品种的麝香香味;muscadinia-ms27-31杂交种的棉花糖风味)的新组合培育而成。因此,已经开发了能够提供全年果实生产以适合不同口味和味道的精选的微葡萄藤。
[0481]
实施例10:葡萄浆果果汁生产和分析
[0482]
使用f/f黑浆果无核微葡萄藤(15c018v0005),无核白浆果雌雄同体品系(15c018v0058)和接种的muscat调味的雌雄同体(17c001v0006)分析来自本文示例的各种微葡萄藤品系的浆果果汁。使用oenofoss
tm
白利糖度分析仪(tss)按照制造商的说明进行分析。将浆果在无菌塑料袋中压碎并将2ml浆果转移到2ml微量离心管(eppendorf tube)中并以13000rpm离心1分钟。使用oenofoss
tm
白利糖度分析仪(tss)分析约0.6ml上清液以测试样品ph、总酸度、挥发性酸度、α氨基氮、氨、酒石酸、苹果酸和密度。结果示于表2中。
[0483]
实施例11:用微葡萄藤浆果生产葡萄酒
[0484]
从由无核雌雄同体(15c018v0058)和有种子的雌雄同体(17c001v0006)微葡萄藤产生的果实小规模地制备葡萄酒。将2kg葡萄串转移到具有一汤匙干冰和1.2ml pms 100mg/ml溶液(基于50ppm,60%汁回收)的压封袋(305mm
×
405mm 50um)中。压榨浆果,直到所有浆果被破坏,并且可以看到自由流动的汁液。通过厨房筛过滤汁液并在1489rcf下离心2分钟以除去固体。从离心瓶中取出500ml汁液并转移到具有气锁和硅取样隔膜的500ml的schott瓶中。在加入酵母,dap和pvpp之前,将汁液温度调节1-2小时。用10ml过夜酵母培养物(maurivin pdm酵母),1ml的476mg/ml dap原液(200ppm yan-酵母可同化氮)和1ml的pvpp 130mg/ml(260ppm pvpp)接种汁液。汁液在18℃发酵,每两小时以100rpm振荡2分钟。每24小时测量总糖。当糖分达到2.5g/l时,用虹吸装置在氩气压力下用500μl硫酸铜1mg/ml
和500μl pms(100mg/ml)将葡萄酒放入清澈的酒瓶中装满,并在4℃下静置7天。通过向顶部填充弹丸使顶部空间最小化。冷沉降后,通过使用氩气将葡萄酒推入200ml、100ml和50ml琥珀色瓶(cospak)的组合中,使其通过0.45μm高压灭菌的地下水过滤器(air-met fth-45)过滤。用tampertell盖细胞棉盖(cospak)密封瓶子,然后用蜡密封。根据制造商的说明书,使用来自foss的oenofoss
tm
分析仪对每种葡萄品种葡萄酒样品进行成品葡萄酒分析。
[0485]
葡萄酒的oenofoss测量
[0486]
简言之,在葡萄酒制造过程中收集约1ml葡萄酒并转移到2ml eppendorf管中并以13000rpm离心1分钟。使用oenofoss
tm
分析仪分析约0.6ml上清液的乙醇、ph、总酸度、挥发性酸度、苹果酸、葡萄酒密度和葡萄糖/果糖。
[0487]
通过oenofoss
tm
进行的葡萄酒分析的结果示于表3中。
[0488]
讨论:
[0489]
浆果在完全成熟前被采摘,因此糖水平对于酒精发育是次优的。所得葡萄酒的酒精含量低于由oenfoss测定的8%的可检测水平。然而,该实验成功地表明,浓郁的麝香风味存在于由麝香风味的微葡萄藤系17c001v0006制备的葡萄酒中。无核浆果可能可用于白葡萄酒生产,由于种子天然的非常高的酚含量引起的风味问题,目前需要除去种子。高酚类物质可以在发酵过程中被提取到葡萄酒中,因此不存在种子可以改善葡萄酒的质量。表皮接触的白葡萄酒,表皮发酵的白葡萄酒加工允许葡萄酒在表皮仍然存在的同时发展,这与常规白葡萄酒生产不同,常规白葡萄酒生产将回收榨汁的葡萄压碎到发酵容器中,导致有色色素、酚和单宁的损失。红葡萄酒需要表皮接触和浸渍以产生颜色、香味和质地。
[0490]
表2:来自微葡萄藤葡萄的样品的鲜食葡萄汁(must)的不同特征的oenofoss值。数值来自使用袋式折射计测量的在约17-18brix收获的每条线的随机选择的浆果样品。
[0491][0492]
表3:精选微葡萄藤葡萄制备小规模葡萄酒样品的oenofoss分析
[0493]
[0494]
实施例12:通过基因编辑产生的vvifsl的纯合t1突变体的基因型和表型评价
[0495]
vvifsl中的指导序列的位置
[0496]
设计了位于vvifsl第二外显子的两个指导rna序列fs1和fs4。根据pam序列的存在、它们在靶上和靶外的benchling评分以及在体外形成crispr/cas9复合物和切割模板dna的能力来选择这些化合物(数据未示出)。图15显示crispr/cas9载体和指导rna的克隆位置。
[0497]
t1植物的产生和基因分型
[0498]
选择fs1和fs4指导的几种t0基因编辑植物进行自交以获得t1子代,确定突变的遗传模式并获得t1纯合突变体。基于突变频率选择t0品系用于t1子代产生。如chaib等人,2010中所述进行自交并使种子发芽。使用扩增子sanger测序(按照实施例5)对来自发芽胚胎的根进行基因分型。对胚胎突变纯合子、杂合子和非突变纯合子进行评分,转移到sm培养基中培养2周形成植株,然后盆栽到土壤中(从南澳大利亚州甘比尔山van schaiks购买的biogro土壤混合物),转移到温室或生长室中发育花朵4个月。白天将温室温度设定为25℃,夜晚设定为20℃,每天浇水两次,持续5分钟。生长室温度设定为25℃,湿度85℃,16小时日照/8小时夜晚循环灯泡400w(420kwh/1000h)白光。每天给植物浇水一次,持续5分钟。
[0499]
第一代t0转基因植物基因编辑分析
[0500]
用于分析crispr/cas9基因编辑的fs1和fs4的15个gfp阳性植物显示在引导序列周围的扩增子sanger序列破坏。这些扩增子的nextgen测序分析显示fs1的基因编辑频率为91.8%至35.9%,fs4的基因编辑频率为58.6%至17.3%。鉴定了在任何一种植物中以》10%的频率发生的突变类型和位置。图16显示了这些突变。fs1和fs4的突变主要涉及碱基t并发生在pam位点的5'端。
[0501]
t1代突变的遗传模式
[0502]
当t0亲本中的突变频率接近100%时,如在杂交a和e中,很可能两个等位基因都已经被基因编辑,即双等位基因突变解释了为什么在t1代中没有野生型子代分离,并且在每个等位基因上携带不同突变的纯合突变体和杂合子存在1:1分离。当突变频率为约50%时,就杂交c、d q、f&v而言,等位基因之一可能已被基因编辑,而另一个则不被编辑,即,单等位基因突变。这产生50%是杂合的和25%是纯合的突变体或25%是野生型的子代。对于杂交c、q f和v的情况,观察到的基因型的卡方检验p值不显著。然而,杂交d显示出与预期基因型频率的显著偏差,这表明40%的nextgen突变频率不是由于单等位基因突变,而是由于在t0植物中以嵌合状态存在的突变,其中一些片段被突变而其它片段不被突变。仍然获得t1纯合突变体。尽管没有获得杂交a的野生型子代,但它可能是低嵌合体,因为t0亲本中的花保持雌雄同体,不同于杂交e,其中t0植物表现出雌性花,表明两个fsl基因都已被完全敲除。
[0503]
从t0自身杂交获得的t1纯合突变体列于表4中。一些突变对于不同的杂交是相同的,它们已经在图17中进行了比对。
[0504]
获得fs1和fs4指导rna的纯合t1突变体。翻译并比对编码序列以确定突变对蛋白序列的影响(图18)。
[0505]
表4:从每个t0杂交获得的突变类型。fs1和fs4指原始指导序列。
[0506]
杂交名称t0植物t0花表型t1中的纯合突变t1植物名称afs1_a1b_01雌雄同体fs1_2t_缺失t1_a_fs1_2tdel
cfs4_m2b_14雌雄同体fs4_ct_缺失t1_c_fs4_ctdelcfs4_m2b_14雌雄同体fs4_10bp缺失t1_c_fs4_10bpdeldfs4_m2b_03雌雄同体fs4_5bp_缺失t1_d_fs4_5bpdeldfs4_m2b_03雌雄同体fs4_t_插入t1_d_fs4_tinsefs1_bia_3雌性fs1_t_插入t1_e_fs1_tinsefs1_bia_3雌性fs1_t_缺失t1_e_fs1_tdel
[0507]
突变引起显著的氨基酸序列变化
[0508]
所有dna碱基缺失和插入都导致移码或无义突变,这可能影响蛋白活性。t1_c_fs4_ctdel、t1-d_fs4、t1_a_fs1_tins和t1_a_fs1_2tdel在platz结构域内产生无义突变。t1_c-fs4_ctdel的出现早于其它突变体。t1_a_fs1_2tdel和t1_afs1_tins在相同位置产生无义突变。
[0509]
t1代中的花表型
[0510]
来自t1代的所有纯合突变体显示从雌雄同体转化为具有收缩雄蕊的雌性花,并且一个突变体没有花粉产生。对来自2至6个单个花序的花进行评分,并对每个突变体的22至54个花进行评分(表5)。使用花粉萌发测定,来自所有突变体的花粉显示出活力。这通过在杂交中使用花粉进一步证实,在杂交中突变被传递。突变体的每花药花粉计数在原始雌雄同体植物和产生花粉的突变体之间没有显著差异。所分析的花药的数目为6-49。至少3个单个纯合突变体被证实具有雌性花,野生型t1子代具有雌雄同体表型,证实突变引起表型改变。
[0511]
表5:t1突变体的基因型和表型总结。
[0512][0513]
讨论
[0514]
本发明人已经使用crispr/cas9技术证明葡萄藤连锁群2内的vvifsl platz转录因子对于花中正常雄性器官发育是必需的。基因的敲除似乎是隐性的,因为只有一个突变等位基因的植物显示雌雄同体表型。
[0515]
在雄性和雌雄同体的vvifsl之间在dna和蛋白水平上没有发现差异,表明其行为类似于sp,雄性器官发育所必需的显性基因,如oberle,1938描述的。然而,在雌性等位基因中,发现氨基酸替换以及起始密码子位置的改变使蛋白无功能并导致雄性器官发育的丧失。
[0516]
雌性基因型(fsl/fsl)中显著较低的表达表明缺乏干扰雄性器官发育的基因表达/蛋白量水平。与雄性或雌雄同体株序列(图2)相比,雌性基因的atg起始位置进一步延长了5’,这可能会改变5’上游序列,影响转录诱导剂的结合。然而,也存在可能影响蛋白活性的氨基酸替换。
[0517]
使用crispr/cas9突变体,发明人通过由于蛋白序列的改变而使vvifsl失活类似地实现了雌性表型。t0的单等位基因突变体保持了原始雌雄同体花表型,表明只有一个功能性fsl基因是雄性器官发育所必需的,使其成为显性性状。
[0518]
根据snp,ncbi loc100247272似乎是引起正常雄性器官发育的显性fsl,而loc100852507似乎是引起异常雄性器官发育的隐性fsl。表明黑皮诺(pinot noir)基因组对于性基因座fsl/fsl是杂合的。
[0519]
不清楚为什么ct突变影响花粉育性,而其它突变产生收缩的雄蕊和有活力的花粉。无义突变在platz结构域内发生得更早,因此可能对其功能有更多的影响。
[0520]
这是第一次描述了platz结构域转录因子在植物花发育中起作用。
[0521]
实施例13:讨论
[0522]
本发明人已经鉴定了被称为花性别(fsl)基因座的基因座负责被子植物如葡萄藤中的花性别,并且不同的fsl基因座基因型和由其表达的多肽可用于确定、控制和/或选择花性别表型,即分别为雌性、雄性或雌雄同体花表型。本发明人已经表征了负责雄性性器官测定的基因座,葡萄属物种中的fsl基因座,并且还证实了雌性fsl/fsl和雌雄同体fsl/fsl或fsl/fsl基因型之间在fsl基因座的植物富含at序列和锌结合(platz)结构域内的单核苷酸多态性(snp)和各自的花性别表型之间100%的一致性。
[0523]
本发明人通过使用crispr在fsl基因座的platz结构域中引入突变而产生了fsl敲除的葡萄植物。本发明人已经证明所得fsl敲除植物不发育功能性雄性生殖器官,支持了fsl基因座的表达对于花中功能性雄性生殖器官的发育是必需的结论。基于这些发现,本发明描述了具有改变的fsl多肽活性的植物和植物部分,以及通过选择特定的fsl基因座基因型或通过修饰fsl基因座产生具有特定花性别表型的植物的方法。
[0524]
本发明还基于发明人的发现,新的单性结实的无核葡萄品种可以通过组合以下各项来生产:(i)fsl基因座,其决定将已被修饰以赋予雌性花表型的雄性花性别,和(ii)赋予矮态型的多核苷酸,如赋予葡萄藤矮态型和快速开花的赤霉酸不敏感(gai1)基因座的变体。本发明人已经表明,具有上述fsl/gai1遗传特性的葡萄藤在花未授粉时产生单性结实的无核果实,而在花用有活力的花粉授粉时产生含有种子的果实。
[0525]
此外,本发明基于发明人的令人惊讶的发现,新的种子败育型/单性结实的无核葡萄品种可以通过组合以下各项来生产:(i)fsl基因座,其在雌性中是纯合的或已经被修饰
以赋予雌性花表型,(ii)赋予矮态型的多核苷酸,如赋予葡萄藤矮态型和快速开花的gai1基因座的变体;(iii)赋予无籽果实的多核苷酸,例如葡萄mads盒蛋白5(vvmads5)基因座的变体。本发明人已经表明,具有上述fsl/gai1/vvmads5遗传特性的葡萄藤在花未授粉时产生单性结实的无核果实,而在花用有活力的花粉授粉时产生种子败育型果实。在这方面,本发明提供了新的“无核”基因型,其能够在葡萄中产生无核果实,包括甚至在授粉后的“真无核”果实。
[0526]
本领域技术人员将理解,在不脱离如广泛描述的本发明的精神或范围的情况下,可以对如具体实施例中所示的本发明做出许多变化和/或修改。因此,本实施方案在所有方面都被认为是说明性的而非限制性的。
[0527]
本文讨论和/或引用的所有出版物均全文引入本文。
[0528]
包括在本说明书中的文件、动作、材料、装置、物品等的任何讨论仅仅是为了提供本发明的上下文。不应视为承认这些内容中的任何或全部形成现有技术基础的一部分或者是与本发明相关的领域中的公知常识,因为其存在于本技术的每个权利要求的优先权日之前。
[0529]
参考文献
[0530]
almeida和allshire(2005)《细胞生物学现观》(trends cell biology)15:251-258.
[0531]
antcliff(1980)《植物改良年鉴》(annales de l’amelioration des plantes)39:113-122.
[0532]
ausubel等人,(编),《分子生物学现行实验指南》(current protocols in molecular biology),greene pub.(1988,包括目前为止的所有更新),associates and wiley-interscience.
[0533]
battilana等人(2013)《分子生物技术》(molecular biotechnology)54(3):1031-1037.
[0534]
bevan等人(1983)《核酸研究》(nucleic acid ressearch),11:369-385.
[0535]
bibikova等人(2001)《分子与细胞生物学》(molecular and cellular biology),21:289-287.
[0536]
bibikova等人(2002)《遗传学》(genetics)161:1169-1175.
[0537]
boss和thomas,(2002)《自然》(nature),416(6883):847-850
[0538]
bourque(1995)《植物学》(plant science),105:125-149.
[0539]
brown t.a.(编),《基本分子生物学:一种实用方法》(essential molecular biology:a practical approach),(1991).第1卷和第2卷,irl press,
[0540]
carmona等人(2008)《实验植物学学报》(journal of experimental botany),59(10):2579-2596.
[0541]
certo等人(2012)《自然方法》(nature methods)8:941-943.
[0542]
chaib等人(2010)《植物杂志》(the plant journal),62(6):1083-1092.
[0543]
chanderbali等人(2010)《美国科学院院报》(pnas usa),107:22570
–
22575.
[0544]
christensen&quail(1989)《植物分子生物学》(plant molecular biology).12:619-632.
[0545]
christensen等人(1992)《植物分子生物学》(plant molecular biology).18:675-689.
[0546]
coito等人(2017)《植物科学前沿》(frontiers in plant science),8:98.
[0547]
coito等人,(2019)《同行界》(peerj),doi 10.7717/peerj.7879.
[0548]
coligan等人(编)《当前免疫学实验指南》(current protocols in immunology),john wiley&sons.
[0549]
comai等人(2004)《植物杂志》(plant journal),37:778-786.
[0550]
coombe采用一套确定葡萄藤生长阶段的系统('adoption of a system for identifying grapevine growth stages’)(1995)《澳大利亚葡萄和葡萄酒研究杂志》(aust.j.grape and wine res.)1:104-110dalbo,等人(2000).
[0551]
doyon等人(2010)《自然方法》(nature methods)7:459-460.
[0552]
doyon等人(2011)《自然方法》(nature methods)8:74-79.
[0553]
fechter等人(2012)《分子遗传学与基因组学》(molecular genetics and genomics),287 247
–
259.
[0554]
friedlander等人(1977)《植物和细胞生理学》(plant and cell physiology),18(1):261-269.
[0555]
gelvin等人《植物分子生物学手册》(plant molecular biology manual),kluwer academic publishers,1990
[0556]
glover和hames(编),《dna克隆:实用方法》(dna cloning:a practical approach),(1995 and 1996)(1-4卷),irl press.
[0557]
groenen等人(1993)《分子微生物学》(molecular microbiology),10:1057-1065.
[0558]
guo等人(2010)《分子生物学杂志》(journal of molecular biology),400:96-107.
[0559]
haft等人(2005)《计算生物学》(computational biology),1(6):e60
[0560]
harlow和lane(编)《抗体:实验室手册》(antibodies:a laboratory manual),(1988),cold spring harbor laboratory,
[0561]
hartmann和endres,《反义方法论手册》(manual of antisense methodology),kluwer(1999).
[0562]
henikoff等人(2004)《反义方法论手册》(plant physiology),135:630-636.
[0563]
hinchee等人(1988)《生物技术》(biotechnology),6:915.
[0564]
hoe等人(1999)《新发传染病》(emerging infectious diseases),5:254-263.
[0565]
iocco等人(2001)《转基因研究》(transgenic research)10:105
–
112.
[0566]
ishino等人(1987)《细菌学杂志》(journal of bacteriology),169:5429-5433.
[0567]
jackson(1992)植物的原位杂交(in-situ hybridisation in plants).见:《分子植物病理学:实用方法。实用方法系列》(molecular plant pathology:a practical approach.practical approach series),1(85).oxford university press.
[0568]
janssen等人(2002)《omics综合生物学杂志》(omics journal of integrated biology),6:23-33.
[0569]
ji等人,(2015)《园艺科学》(scientia horticulturae),193:367-373.
[0570]
ji等人(2016)《综合生物学杂志》(journal of integrated plant biology),58:762-765.
[0571]
jie等人(2017)《园艺植物杂志》(horticultural plant journal),3(3):91-100.
[0572]
jinek等人(2012)《科学》(science)337(6069):816-821.
[0573]
joshi(1987)《核酸研究》(nucleic acid research),15:6643-6653.
[0574]
kim等人(1996)《美国科学院院报》,93:1156-1160.
[0575]
kim等人(2012)《基因组研究》(genome research),22:1327-1333.
[0576]
koziel等人(1996)《植物分子生物学》(plant molecular biology),32:393-405.
[0577]
last等人(1991)《理论与应用遗传学》(theoretical and applied genetics),81(5):581-588.
[0578]
medberry等人(1992)《植物细胞》(plant cell),4:185-192.
[0579]
medberry等人(1993)《植物杂志》(plant journal),3:619-626.
[0580]
manzano等人(2011)《植物生长调节》(plant growth regulation),65:213
–
221.
[0581]
mao等人(2017)《植物科学前沿》(frontiers in plant science),8:1291.
[0582]
mcelroy等人(1990)《植物细胞》(plant cell),2:163-171.
[0583]
mcconnell smith等人(2009)《美国科学院院报》(pnas usa),106:5099-5104.
[0584]
millar和waterhouse(2005)《功能和整合基因组学》(functional and integrative genomics),5:129-135.
[0585]
miller等人(2007)《自然生物技术》(nature biotechnology)25:778-785.
[0586]
mojica等人(1995)《分子微生物学》(molecular microbiology),17:85-93.
[0587]
mojica等人(2000)《分子微生物学》(molecular microbiology),36:244-246.
[0588]
nakata等人(1989)《细菌学杂志》(journal of bacteriology),171:3553-3556.
[0589]
nagano等人(2001)《核酸研究》(nucleic acids research),29(20):4097-4105.
[0590]
negi和olmo(1966)《科学》(science),152:1624
–
1625.
[0591]
negi和olmo(1971)《葡萄属》(vitis),9:265-279.
[0592]
odell等人(1985)《自然》(nature)313:810-812.
[0593]
oberle(1938)《纽约州农业实验站公报》(new york state agricultural experiment station bulletin)250:3-32.
[0594]
pannell(2017)《现代生物学》(current biology),27(5):r191-r197.
[0595]
perbal(1984),《分子克隆实用指南》(a practical guide to molecular cloning),john wiley and sons(1987增补).
[0596]
pasquinelli等人(2005)《遗传学与发展的最新观点》(current opinions in genetics and development),15:200-205.
[0597]
peterson和anhder,(1960)《科学》(science),131:1673
–
1674.
[0598]
pouwels等人《克隆载体:实验室手册》(cloning vectors:a laboratory manual),1985.
[0599]
ramirez等人(2012)《核酸研究》(nucleic acids research),40:5560-5568.
[0600]
riaz等人(2006)《理论与应用遗传学》(theoretical and applied genetics),113:1317-1329.
[0601]
royo等人(2018)《植物生理学》(plant physiology),177:1234-1253.
[0602]
sambrook等人,(1989),《分子克隆:实验室手册》(molecular cloning:a laboratory manual),cold spring harbor laboratory press.
[0603]
senior(1998)《生物技术和基因工程评论》(biotechology and genetic.engineering reviews),15:79-119.
[0604]
sigrist,c.j.a.,(2009)《核酸研究》(nucleic acids research),38:161-166.
[0605]
slade和knauf(2005)《转基因研究》(transgenic research),14:109-115.
[0606]
smith等人(2000)《自然》(nature)407:319-320.
[0607]
so等人,(2015)poj,8(6):479-484.
[0608]
stalker等人(1988)《科学》(science)242:419-423.
[0609]
szczepek等人(2007)《自然生物技术》(nature biotechnology)25:786-793.
[0610]
taylor(1997)《植物细胞》(the plant cell)9:1245-1249.
[0611]
tanurdzic和banks(2004)《植物细胞》(plant cell),16(增刊1):s61
–
s71.
[0612]
thillet等人(1988)《生物化学杂志》(the journal of biological chemistry),263:12500.
[0613]
van embden等人(2000)《细菌学杂志》(journal of bacteriology),182:2393-2401.
[0614]
valleau(1916)《美国博物学家》(the american naturalist)50(597):554-564.
[0615]
velten等人(1984)《epbo杂志》(epbo journal),3:2733-2730.
[0616]
waterhouse等人(1998)《美国科学院院报》(pnas usa),95:13959-13964.
[0617]
wang等人(2012)《基因组研究》(genome research),22:1316-1326.
[0618]
weissbach和weissbach,《植物分子生物学方法》(methods for plant molecular biology),academic press,1989.
[0619]
yamasaki等人(2000)《植物和细胞生理学》(plant and cell physiology),41:608
–
616.
[0620]
yamasaki等人(2001)《植物和细胞生理学》(plant and cell physiology),42:608
–
619.
[0621]
yamasaki,等人(2005)《维生素和激素》(vitamins and hormones),72:79-110.
[0622]
zhang等人(2013)《现代生物学》(current biology),23(20):1979-1989.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1