富集囊泡RNA的方法与流程
富集囊泡rna的方法
技术领域
1.本发明涉及用于从包含细胞外囊泡的样品富集细胞外rna的方法和试剂盒。具体来说,公开了用于从包含细胞外囊泡的样品直接富集细胞外核酸例如细胞外rna的方法。
背景技术:
2.来自于细胞外囊泡(ev)的分析物,特别是细胞外rna(在本文中也被称为“无细胞”或“cfrna”)与诊断和研究目的相关。阴离子交换基质例如膜可用于从生物样品、特别是无细胞生物流体例如血浆、血清或尿液捕获ev(参见ep 2 941 629b1和wo 2017/197399以及来自于qiagen的exorneasy试剂盒)。这些结合基质的缺点在于洗脱通常使用高盐浓度进行,这使得在不进行进一步的耗时且复杂的净化工作流程的情况下,洗脱液与大多数下游应用不相容。或者,带有伯氨、仲氨和/或叔氨基作为功能组成部分的阴离子交换基质也可以在高ph下,通常在高于10的ph值下洗脱,但这对rna完整性有害。因此,现有产品如exorneasy使用合并的裂解和洗脱步骤,其使用含有高盐浓度例如硫氰酸胍或硫氰酸钠和苯酚的qiazol。在用qiazol洗脱后进行特别是使用氯仿的有机萃取,并在硅胶基质(例如rneasy柱或mas g珠子)上进行rna净化。
3.对用于从包含细胞外囊泡的样品富集并因此分离细胞外rna的其他方法,存在着不断增长的兴趣和需求。具体来说,对用于分离包含囊泡rna的细胞外rna的改进的方法,存在着需求。
4.本公开的一个目的是提供一种避免现有技术的缺点的方法。具体来说,一个目的是提供比现有技术工作流程耗时更少的从细胞外囊泡分离rna的方法。另一个目的是提供一种在分离细胞外rna例如囊泡rna后避免繁琐和复杂的净化流程的方法。
技术实现要素:
5.本公开是基于下述发现,即细胞外囊泡可以被结合到阴离子交换粒子,并随后在促进从所述细胞外囊泡释放出的细胞外rna的即时再结合的条件下高效裂解。结果,所述细胞外囊泡不需使用高盐和/或基于苯酚的洗脱溶液洗脱并提取,然后进行rna富集流程。所释放的囊泡rna可以通过结合到最初用于结合所述细胞外囊泡的阴离子交换粒子直接富集。由此提供了一种用于将细胞外囊泡(ev)结合到阴离子交换粒子的简化的工作流程,然后对结合的ev进行非离液裂解。释放的核酸与用于结合和富集ev的同一种阴离子交换基质的立即再结合节省了工作步骤和材料。此外,可以避免离液盐的使用。取决于所使用的阴离子交换粒子,然后可以使用低盐、中等ph的洗脱缓冲液洗脱结合的细胞外rna。这种洗脱缓冲液与许多核心下游应用相容,并且不需进一步净化。这同样节省了处理步骤和资源。
6.根据本公开,将结合的细胞外囊泡在至少一种去污剂存在下裂解,所述去污剂裂解ev并在酸性裂解条件下允许释放的rna直接结合到所述阴离子交换粒子。非常有利的是,所使用的去污剂不实质性抑制释放的囊泡rna与所述阴离子交换粒子的结合。所使用的去污剂可以是非离子或阴离子去污剂。
7.为了进一步改进裂解步骤并除去污染蛋白质,在所述裂解步骤中可以包括蛋白水解酶处理,并且可以进行额外的清洗步骤以消除ev组分例如脂质、膜蛋白等。结果,可以消化所有种类的蛋白质,包括可能凭借其净负电荷或通过与存在的其他带负电荷生物分子的相互作用而结合到阴离子交换粒子的蛋白质。
8.此外,根据本公开的方法允许使用磁性阴离子交换粒子作为阴离子交换粒子。这避免了使用常用于富集ev的昂贵的现有技术的阴离子交换膜。此外,磁性阴离子交换粒子的使用使得根据本公开的方法可以自动化。因此,根据一个有利实施方式,结合步骤(aa)中的固相由粒子例如磁性粒子提供。这允许以自动或半自动方式执行本发明的方法。
9.所使用的阴离子交换粒子优选地包含阴离子交换基团,其允许释放的囊泡rna的高效结合,并在同时允许使用中等的ph高效洗脱结合的rna。结合的细胞外rna可以使用高盐,或者优选地使用具有中等ph例如7-9、例如8至9或8.5至9的低盐缓冲液来洗脱。在此类情况下,富集的细胞外rna可以直接用于下游应用。
10.根据第一方面,提供了一种用于从包含细胞外囊泡的样品富集细胞外核酸例如优选为细胞外rna的方法,所述方法包括下述步骤:
11.(aa)制备酸性结合混合物,其包含所述样品和阴离子交换固相,并将细胞外囊泡结合到所述阴离子交换固相;
12.(bb)从所述结合混合物分离出包含结合的细胞外囊泡的阴离子交换固相;
13.(cc)在至少一种去污剂存在下裂解所述结合的细胞外囊泡,并将释放的囊泡核酸例如优选为rna结合到所述阴离子交换固相;
14.(dd)从裂解物分离带有结合的核酸的阴离子交换固相。
15.正如在本文中公开的,所述细胞外核酸优选为细胞外rna,其是ev中的主要核酸。此外,尽管可以使用不同形式的固相(包括过滤器和膜),但在本方法中优选地使用阴离子交换粒子。这是优选的,因为阴离子交换粒子例如磁性粒子易于处理并更好地适合于自动化。因此,本文呈现的公开的焦点在于阴离子交换粒子。尽管专业技术人员将会认识到,本公开也适用于更广泛的情形和其他固相类型的使用。
16.根据所述第一方面的方法的一个子方面,提供了一种用于从包含细胞外囊泡的样品富集细胞外rna的方法,所述方法包括下述步骤:
17.(aa)制备酸性结合混合物,其包含所述样品和阴离子交换粒子,并将细胞外囊泡结合到所述阴离子交换粒子;
18.(bb)从所述结合混合物分离出包含结合的细胞外囊泡的阴离子交换粒子;
19.(cc)在至少一种去污剂存在下裂解所述结合的细胞外囊泡,并将释放的rna结合到所述阴离子交换粒子;
20.(dd)从裂解物分离带有结合的rna的阴离子交换粒子。
21.根据第二方面,提供了一种用于执行根据所述第一方面的方法的试剂盒,其包含:
22.(a)阴离子交换粒子,
23.(b)酸性试剂,优选为缓冲液;
24.(c)酸性裂解试剂,优选为不同于酸性试剂(b)并包含去污剂的缓冲液;
25.(d)任选的一种或多种清洗溶液;和
26.(e)任选的一种或多种洗脱溶液。
27.术语“试剂”在本文中以广义使用,并且涵盖溶液以及缓冲液的使用。对于本领域技术人员而言,本技术的其他目的、特征、优点和方面将从下文的描述和权利要求书变得显而易见。然而应当理解,下文的描述、权利要求书和具体实例尽管指示了本技术的优选实施方式,但仅以说明的方式给出。
附图说明
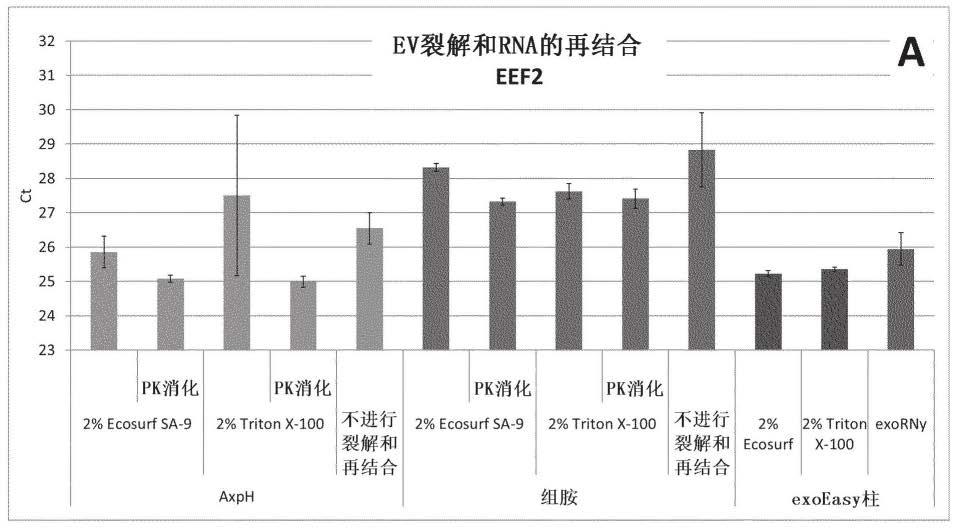
28.图1a:示出了实施例2的结果,在这里是囊泡mrna(eef2)的回收。示出了ct值,其中更低的ct值指示更好的回收。
29.图1b:示出了实施例2的结果,在这里是囊泡mirna(let-7a)的回收。
30.图1c:示出了实施例2的结果,在这里是可能与囊泡rna共分离的非囊泡mirna(mir-122)的回收。
31.图2:示出了实施例3的结果,在这里是使用四种不同阴离子交换粒子类型(如图中所指示的带有pei(axph)、聚组氨酸(p-his)、寡聚组氨酸(10-his)或组胺),在不同条件下的rna净化和洗脱。
具体实施方式
32.正如由实施例证实的,可以从包含细胞外囊泡的样品富集并因此分离细胞外rna。术语富集以广义使用,并且尤其涵盖了靶分析物、在这里是包含囊泡rna的细胞外rna的分离和纯化。本文描述的工作流程能够高度简化地富集和分析尤其是包含在细胞外囊泡中的细胞外rna。
33.当在本文中使用时,“细胞外dna”和“细胞外rna”具体来说分别是指不包含在细胞中,而是包含在生物样品例如(含细胞)体液样品的细胞外级分中的dna和rna。一般来说,细胞外核酸通常也被称为无细胞核酸,例如无细胞dna(“cfdna”)和无细胞rna(“cfrna”)。这些术语在本文中作为同义词使用。从循环体液(例如血液)获得的无细胞核酸也被称为循环无细胞核酸,例如ccfdna或ccfrna。细胞外核酸可以从除细胞或无细胞级分富集,所述级分可以从含细胞体液(例如血液、血浆或血清,优选为血浆)获得。细胞外rna可以从已在先前的步骤中除去非囊泡细胞外dna的样品富集,因此所述样品包含比以前更少的非囊泡细胞外dna。具体来说,包含细胞外囊泡的除细胞或无细胞生物样品可以经历去除dna步骤,特别是通过将dna例如细胞外dna结合到包含阴离子交换基团的粒子,并从结合混合物中分离出结合的dna,由此提供包含细胞外囊泡的去除dna的样品,使其经历根据本公开的方法的步骤(aa),用于将细胞外囊泡结合到阴离子交换粒子。这种包含细胞外囊泡的去除细胞外dna的样品,可用作本公开的方法的样品。
34.根据特别优选实施方式,细胞外rna使用根据本公开的第一和第二方面的方法和试剂盒来富集。然而,所述方法和试剂盒可能不限于细胞外rna的富集。它可能也适合于分离包含在细胞外囊泡中的细胞外dna。囊泡dna可能仅存在于癌症患者(或者可能也包括其他疾病)的血浆中,并且因此可以代表可使用根据本公开的方法和试剂盒富集的有利的靶。具体来说,也已显示细胞外囊泡含有来自于它们的起源细胞的基因组dna片段。本公开中描述的方法和试剂盒也可用于分离此类囊泡dna(也与本文所公开的非囊泡无细胞dna分离开)。因此,本发明的方法和试剂盒也可供用于从包含细胞外囊泡的样品富集细胞外核酸,
特别是富集包含在细胞外囊泡中的细胞外rna和/或dna。
35.存在于体液的无细胞级分中的典型细胞外核酸的实例包括但不限于哺乳动物细胞外核酸例如细胞外肿瘤相关或肿瘤衍生dna和/或rna、其他细胞外疾病相关dna和/或rna、表观遗传修饰的dna、胎儿dna和/或rna、小干扰rna例如mirna和sirna,以及非哺乳动物细胞外核酸例如病毒核酸、从例如原核生物(例如细菌)、病毒、真核寄生虫或真菌释放到细胞外核酸群体中的病原体核酸。所述细胞外核酸群体通常包含一定量的从受损或垂死细胞释放的细胞内核酸。
36.当在本文中使用时,术语“细胞外囊泡”(ev)具体来说是指细胞起源的任何类型的分泌囊泡。ev可大致分为外泌体、微囊泡(mv)和凋亡小体。ev例如外泌体和微囊泡是由细胞分泌的小囊泡。已发现ev通过包括血液和尿液在内的许多不同的体液循环,这使得它们容易获得。由于ev的组成与亲代细胞类似,因此循环ev是生物标志物的有价值的来源。循环ev可能由外泌体和mv的混合物组成。它们含有受到脂质双层保护以免于降解的核酸,特别是mrna、mirna、其他小rna。因此,所述内含物被专门包装,并代表了局部和远程细胞通讯的机制。它们可以在细胞之间运输rna。ev例如外泌体是循环生物标志物的丰富多样的来源。所述起源细胞可以是健康细胞或癌细胞。所述起源细胞也可以是其他受疾病影响或受影响的细胞,包括受胁迫影响的细胞。例如,所述细胞可能受到神经变性疾病影响。另一个实例是应激细胞,例如经历衰老的细胞。应激细胞可能释放更多ev(以及此外细胞外dna)。ev例如外泌体通常被癌细胞、特别是分裂的癌细胞主动分泌。作为肿瘤微环境的一部分,ev例如外泌体似乎在成纤维细胞生长、促结缔组织增生反应、上皮-间质转化(emt)和sc的启动以及治疗抗性建立和肿瘤转移和治疗抗性的启动中发挥重要作用。因此,对分析ev和相应的ev内含物例如囊泡rna存在着很大兴趣。
37.正如本文中公开的,根据本公开的第一和第二方面的方法和试剂盒分别是基于相同的核心原理,用于将ev结合到阴离子交换粒子、特别是磁性阴离子交换粒子,并在至少一种去污剂存在下裂解所述ev,使得释放的rna被结合到所述阴离子交换粒子。
38.根据第一方面的方法
39.根据所述第一方面的方法已在上面的发明内容中概述。
40.根据优选实施方式,在步骤(aa)中,所述细胞外囊泡被结合到阴离子交换粒子,并且在步骤(cc)中,释放的rna被结合到阴离子交换粒子。尽管阴离子交换粒子、特别是磁性阴离子交换粒子是优选的,但本公开的方法和试剂盒不限于阴离子交换粒子。本发明的核心原理也可以有利地使用,以便通过制备包含样品和阴离子交换固相的酸性结合混合物并将细胞外囊泡结合到所述阴离子交换固相,从所述包含细胞外囊泡的样品富集细胞外rna。阴离子交换固相可以选自本领域中已知的用于富集分析物的任何固相。具体来说,固相可以选自多孔固相,例如膜或柱。所述固相优选地包含这里提到的本公开中所定义的阴离子交换基团。所述释放的囊泡核酸与阴离子交换膜或过滤器的再结合,可以通过重新施用所述裂解物来实现。
41.根据所述第一方面的方法的优选实施方式,提供了一种用于从包含细胞外囊泡的样品富集细胞外rna的方法,所述方法包括下述步骤:
42.(aa)制备酸性结合混合物,其包含所述样品和阴离子交换粒子,并将细胞外囊泡结合到所述阴离子交换粒子;
43.(bb)从所述结合混合物分离出包含结合的细胞外囊泡的阴离子交换粒子;
44.(cc)在至少一种去污剂存在下裂解所述结合的细胞外囊泡,并将释放的rna结合到所述阴离子交换粒子;
45.(dd)从裂解物分离带有结合的rna的阴离子交换粒子。
46.正如通过实施例演示的,根据所述第一方面的方法允许通过下述方式从包含细胞外囊泡的样品富集细胞外rna:将细胞外囊泡结合到所述阴离子交换粒子,然后分离所述粒子,并在至少一种去污剂存在下裂解结合的细胞外囊泡,同时允许释放的rna结合到所述阴离子交换粒子。根据所述第一方面的方法有利地允许分离具体来说包含在细胞外囊泡中的细胞外rna,而不需复杂且耗时的净化。通过裂解所述结合到阴离子交换粒子的细胞外囊泡并结合所述释放的rna,可以直接富集囊泡rna。此外,通过选择所述阴离子交换粒子、特别是阴离子交换基团的类型,可以将所述细胞外rna结合到所述阴离子交换粒子,使得它们可以通过包含高盐浓度或优选低盐浓度的洗脱缓冲液容易地从所述粒子上洗脱。因此,可以得到富集的rna,其可以直接用于分析,而不需用于从例如qiazol除去洗脱缓冲液化合物例如苯酚的后续分离净化程序。
47.根据优选实施方式,所述方法还包括其他步骤:
48.(ee)任选地清洗结合的rna;和
49.(ff)从所述阴离子交换粒子洗脱所述结合的rna。
50.任选的步骤(ee)和步骤(ff)的其他优选实施方式在下文进一步公开。
51.步骤(aa)
52.步骤(aa)包括制备包含样品(包含细胞外囊泡)和阴离子交换粒子的酸性结合混合物,并将细胞外囊泡结合到所述阴离子交换粒子。
53.根据步骤(aa),制备包含所述样品和阴离子交换粒子的酸性结合混合物,并将所述细胞外囊泡结合到所述阴离子交换粒子。因此,所述酸性结合混合物有利地提供了用于将所述细胞外囊泡结合到阴离子交换粒子的结合条件。此外,除了细胞外囊泡之外,包含在所述样品中的其他细胞外rna也可能结合到所述阴离子交换粒子。例如,非囊泡无细胞rna(cfrna)或循环无细胞rna(ccfrna)可能包含在所述样品中,它们也可以与细胞外囊泡一起结合到所述阴离子交换粒子。根据一个实施方式,细胞外dna主要不在步骤(aa)中结合到所述固相。具体来说,这可以通过提供已去除细胞外dna的包含细胞外囊泡的样品来实现。例如,可以提供其中在步骤(aa)之前通过例如将细胞外dna结合到包含阴离子交换粒子的固相而除去了所述细胞外dna的样品。
54.根据优选实施方式,所述阴离子交换粒子是磁性阴离子交换粒子。使用磁性阴离子交换粒子具有下述优点,即通过提供例如磁铁形式的磁场,可以容易地从所述剩余混合物分离出所述粒子。由于磁场的提供可以通过自动化平台容易地实现,因此使用磁性阴离子交换粒子具有所述方法可以完全或部分以自动化方式执行的优点。
55.步骤(aa)的其他优选实施方式在下文中进一步公开。
56.步骤(bb)
57.步骤(bb)包括从所述结合混合物分离出包含结合的细胞外囊泡的阴离子交换粒子(或其他固相)。
58.根据优选实施方式,步骤(bb)包括清洗分离的带有结合的细胞外囊泡的阴离子交
换粒子。优选地,当在步骤(bb)中进行清洗时,所述细胞外囊泡结合到所述阴离子交换粒子。清洗可以使用本领域中应用的任何适合的清洗溶液来进行。根据一个实施方式,为了清洗,所述酸性试剂的组分以步骤(aa)的酸性结合混合物中提供的浓度使用。与所述酸性试剂和酸性结合混合物相关的公开内容可以在下文找到并在此引用。清洗所述分离的带有结合的细胞外囊泡的阴离子交换粒子可以进一步减少污染物例如样品中包含的蛋白质的量。
59.在分离步骤(bb)(以及同样地分离步骤(dd))中,所述阴离子交换粒子可以通过离心、沉降或磁性分离进行分离。优选地,使用可以通过磁场的帮助分离的磁性阴离子交换粒子。磁性阴离子交换粒子是特别优选的,因为它们可以通过磁场容易地从剩余溶液中分离,允许将样品转移到现有自动化平台,用于以自动化方式执行分离步骤(bb)和/或(dd)。分离阴离子交换粒子的其他方式可以在本领域中容易地发现,并且也可应用于根据本公开的步骤(bb)和/或步骤(dd)的范围。
60.如果使用不同类型的固相,可以应用不同的分离原理,例如离心、施加真空等。
61.步骤(cc)
62.步骤(cc)包括在至少一种去污剂存在下裂解结合的细胞外囊泡并将释放的rna结合到所述阴离子交换粒子。
63.本公开的步骤(cc)有利地允许裂解结合的细胞外囊泡以释放出所包含的rna。然后将释放的rna直接结合到所述阴离子交换粒子。因此,不需提供不同的结合固相,而是将裂解混合物中存在的在步骤(aa)中用于结合ev的阴离子交换粒子直接用于结合所述释放的rna。因此,步骤(cc)是使细胞外囊泡中包含的细胞外rna成为允许通过与存在的阴离子交换粒子结合而直接分离的形式的一种简单快速的方式。有利的是,在步骤(cc)中使用的所述去污剂不实质性抑制释放的囊泡rna与阴离子交换粒子的结合。因此,不必为了使释放的rna结合到阴离子交换粒子而除去所述去污剂。在步骤(cc)中,提供了允许所述释放的rna与阴离子交换粒子直接结合的裂解条件。
64.此外,通过裂解所述细胞外囊泡并将释放的rna结合到所述阴离子交换粒子,结合产物可以例如直接用于下游应用,例如分析。根据一个实施方式,所述细胞外rna被结合到阴离子交换粒子,其中所述阴离子交换粒子被配置成使得可以使用温和的低盐浓度洗脱缓冲液进行洗脱。
65.根据优选实施方式,步骤(cc)包括通过将分离的包含结合的细胞外囊泡的阴离子交换粒子与酸性裂解试剂进行接触,以制备裂解混合物,所述酸性裂解试剂包含适合于裂解细胞外囊泡以将囊泡rna释放到裂解物中的至少一种去污剂。
66.根据优选实施方式,所述去污剂以所述结合的细胞外囊泡的裂解和囊泡rna的释放得以实现的浓度使用。有利情况下,所述去污剂对所述释放的rna与阴离子交换粒子的结合没有或基本上没有负面干扰。因此,所述去污剂以足以用于裂解和rna的释放但允许释放的rna与阴离子交换粒子结合的浓度提供。细胞外囊泡的基于去污剂的裂解在本领域中也被公开(参见例如osteikoetxea等,org biomol chem 2015oct 14;13(38):9775)。在裂解和再结合步骤中去污剂的浓度可以根据所述去污剂的选择来选择,以实现细胞外囊泡的高效裂解和再结合。
67.本文中使用的以百分率值指示的浓度或浓度范围,具体对于液体组合物中的固体化合物、固体物质或固体组合物来说作为重量体积百分比(w/v)给出,并且对于液体组合物
中的液体化合物、液体物质或液体组合物来说作为体积百分比(v/v)给出。例如,sds可以以w/v百分比添加,并且triton x-100或tween 20按照v/v百分比添加。在其他实施方式中,对于所有实施方式即液体和固体化合物来说,所指示的浓度旨在指w/v。
68.根据一个实施方式,在步骤(cc)中,包含阴离子交换粒子的所述裂解混合物包含浓度为至少0.1%,例如至少0.2%,例如至少0.3%,例如至少0.4%、至少0.5%、至少0.75%或至少1%的所述去污剂。
69.根据优选实施方式,在步骤(cc)中,包含阴离子交换粒子的所述裂解混合物包含浓度为至少1.25%,例如至少1.5%、至少1.75%或至少2%的所述去污剂。
70.根据一个实施方式,在步骤(cc)中,包含阴离子交换粒子的所述裂解混合物包含浓度为15%或更低、10%或更低、7%或更低或5%或更低的所述去污剂。
71.根据优选实施方式,步骤(cc)包括通过将分离的包含结合的细胞外囊泡的阴离子交换粒子与包含去污剂的裂解试剂进行接触来制备裂解混合物,其中所述去污剂以0.1至15%例如0.5至10%、0.75%至7%或1%至5%范围内的浓度包含在所述裂解混合物中。
72.根据优选实施方式,在步骤(cc)中用于裂解细胞外囊泡的所述去污剂不是阳离子去污剂。不受理论限制,据信阳离子去污剂可以干扰所述细胞外囊泡与阴离子交换粒子的结合。
73.根据优选实施方式,在步骤(cc)中用于裂解细胞外囊泡的所述至少一种去污剂选自非离子表面活性剂和阴离子去污剂。不受理论限制,据信非离子表面活性剂和阴离子型表面活性剂当提供在所述裂解混合物中时不干扰或不显著干扰所述释放的rna与阴离子交换粒子的结合。因此,根据本发明的去污剂有利地允许所述释放的rna与阴离子交换粒子在所述裂解混合物中的结合。适合的实施方式被公开在本文和工作例中。
74.根据一个实施方式,在步骤(cc)中用于裂解细胞外囊泡的所述去污剂是非离子去污剂,优选为基于聚氧乙烯的非离子去污剂。此类非离子去污剂可以选自(i)聚氧乙烯脂肪醇醚,(ii)聚氧乙烯烷基苯基醚,(iii)聚氧乙烯-聚氧丙烯嵌段共聚物,(iv)聚氧乙烯脂肪酸酯,(v)乙氧基化丙氧基化醇,(vi)基于甾体糖苷的非离子去污剂,和(vii)失水山梨醇脂肪酸酯。任选地,所述非离子去污剂具有至少一个下述特征:
75.(i)它是聚氧乙烯脂肪醇醚,任选地包含具有4至28个碳原子的脂肪醇组分和具有2至150个(ch2ch2o)单元的聚氧乙烯组分,任选地选自聚氧乙烯月桂基醚例如聚氧乙烯(4)月桂基醚(例如30)或聚氧乙烯(23)月桂基醚(例如35)、聚氧乙烯鲸蜡基醚例如聚氧乙烯(10)鲸蜡基醚(例如56)或聚氧乙烯(20)鲸蜡基醚(例如58)、聚氧乙烯硬脂基醚例如聚氧乙烯(2)硬脂基醚(例如72)或聚氧乙烯(20)硬脂基醚(例如78)和聚氧乙烯油基醚例如聚氧乙烯(20)油基醚(例如98);
76.(ii)它是聚氧乙烯烷基苯基醚,任选为聚氧乙烯辛基苯基醚或聚氧乙烯壬基苯基醚,任选为支链的,任选地选自聚氧乙烯对异辛基苯基醚(例如triton
tm x-100)、聚氧乙烯叔辛基苯基醚(例如triton
tm x-114)、聚氧乙烯(40)异辛基苯基醚(例如triton
tm x-450)、辛基苯氧基聚(氧化乙烯)乙醇(例如ca-630)或4-壬基苯基-聚乙二醇;
77.(iii)它是聚氧乙烯-聚氧丙烯嵌段共聚物,例如泊洛沙姆;
78.(iv)它是聚氧乙烯脂肪酸酯,例如聚氧乙烯失水山梨醇单月桂酸酯(
20)、聚氧乙烯失水山梨醇单油酸酯(80);
79.(v)它是乙氧基化丙氧基化醇,例如种子油醇乙氧基化物,特别是种子油醇乙氧基化物4eo(ecosurf
tm sa-4)、种子油醇乙氧基化物7eo(ecosurf
tm sa-7)或种子油醇乙氧基化物9eo(ecosurf
tm sa-9);
80.(vi)它是基于甾体糖苷的非离子去污剂,例如洋地黄皂苷;和/或
81.(vii)它是失水山梨醇脂肪酸酯,例如失水山梨醇单月桂酸酯(例如20)、失水山梨醇单硬脂酸酯(例如60)或失水山梨醇单油酸酯(例如80)。
82.非离子去污剂优选地包括聚氧乙烯去污剂,特别是聚氧乙烯烷基醚(其中烷基组成部分优选为4至28、优选地8至24、更优选地12至20个碳原子的直链或支链烷基,并且聚氧乙烯组成部分具有至少2、优选地至少4、更优选地6至24个乙烯单元)、聚氧乙烯烷基芳基醚(其中优选地被烷基对位取代的苯基被偶联到聚氧乙烯基团)和triton x系列的去污剂。
83.根据一个实施方式,在步骤(cc)中用于裂解细胞外囊泡的所述去污剂是阴离子去污剂,任选为脂肪醇的硫酸盐或磺酸盐。适合的阴离子去污剂可以选自:
84.(i)脂肪醇的硫酸盐或磺酸盐,例如十二烷基硫酸钠、十二烷基磺酸钠或十二烷基苯磺酸;
85.(ii)基于胆汁酸的去污剂,例如脱氧胆酸盐,特别是脱氧胆酸钠或胆酸钠,和
86.(iii)基于肌氨酸的去污剂,例如十二烷酰基肌氨酸或n-月桂酰基肌氨酸。
87.任选地,所述阴离子去污剂选自十二烷基硫酸钠、十二烷基磺酸钠、十二烷基苯磺酸、n-月桂酰基肌氨酸和胆酸钠,并且其中所述阴离子去污剂任选为十二烷基硫酸钠。
88.优选的阴离子去污剂是硫酸(盐)、磺酸(盐)、磷酸(盐)和羧酸,优选地作为盐例如碱金属盐或碱土金属盐如钠盐、锂盐或钾盐,或作为游离酸。具体来说,阴离子去污剂可以是脂肪醇的硫酸盐,特别是具有4至28个碳原子、优选地8至18个碳原子的非支链或支链烷基链的脂肪醇的硫酸盐,或烷基芳基磺酸盐,特别是直链烷基苯磺酸盐。阴离子去污剂的具体实例是十二烷基硫酸钠(sds)、十二烷基硫酸锂、辛基硫酸钠、十二烷基磺酸钠、癸基磺酸钠、辛基磺酸钠、十二烷基苯磺酸(ddbsa)、n-月桂酰基肌氨酸、胆酸钠和脱氧胆酸钠。
89.根据特定实施方式,在步骤(cc)中用于细胞外囊泡裂解的所述去污剂选自triton x-100、十二烷基硫酸钠、脱氧胆酸盐、十二烷酰基肌氨酸和/或ecosurf sa-9。
90.根据优选实施方式,步骤(cc)的酸性裂解试剂包含:
91.(i)所述至少一种去污剂,任选地以上文为裂解混合物所定义的浓度;和
92.(ii)缓冲剂。
93.具体来说,在步骤(cc)的裂解试剂中所述至少一种去污剂的浓度可以选自0.1至15%的范围,例如0.5至10%、0.75%至7%或1%至5%。
94.根据一个实施方式,所述酸性裂解试剂具有促进所述释放的囊泡rna与磁性粒子的阴离子交换基团的结合的酸性ph。通过提供适合于步骤(cc)中释放的rna的结合的ph,不需添加其他组分即可将所述释放的rna结合到阴离子交换粒子。然而,如果需要,可以向步骤(cc)的裂解混合物添加其他组分,以增强所述释放的rna与阴离子交换基团的结合。
95.根据优选实施方式,所述酸性裂解试剂具有2.5至5.5,例如2.7至5.3、3至5或3至4.7范围内的ph。所述酸性裂解试剂的具体ph值可以在本发明的实施例中找到。根据一个实施方式,提供了3.5至4.5范围内的ph,例如4。
96.根据一个实施方式,所述酸性裂解试剂的ph≤5,任选地≤4.7、≤4.5或≤4.3。
97.根据优选实施方式,在步骤(cc)中使用的所述酸性裂解试剂包含基于羧酸的缓冲剂,任选为乙酸盐。其他缓冲剂也可用于步骤(cc)中的酸性裂解试剂,特别是本领域中已知的酸性缓冲剂。所述缓冲剂可以以≤500mm,例如≤450mm、≤400mm、≤350mm、优选地≤300mm或≤250mm的浓度存在于步骤(cc)中的酸性裂解试剂中。
98.根据优选实施方式,所述酸性裂解试剂建立了允许所述释放的囊泡rna与阴离子交换粒子直接结合的条件。
99.根据一个实施方式,所述酸性裂解试剂中的总盐浓度是1m或更低,优选为0.75m或更低、0.5m或更低或370mm或更低。可以发现其他适合的盐浓度,只要所述细胞外rna、特别是释放的囊泡rna结合到阴离子交换粒子即可。
100.根据一个实施方式,所述酸性裂解试剂中的总盐浓度是350mm或更低,例如325mm或更低、300mm或更低或275mm或更低。在所述酸性裂解试剂中提供不干扰而是偏好性地增强所述释放的rna与阴离子交换粒子的结合的总盐浓度,可能是特别适合的。
101.根据一个实施方式,在步骤(cc)中使用的所述酸性裂解试剂不包含离液盐和/或有机溶剂。步骤(cc)中的酸性裂解试剂不包含离液盐和/或有机溶剂可以被理解为所述酸性裂解试剂完全不包含或以非有效量包含此类化合物。因此,有利情况下,这些化合物不干扰所述释放的囊泡rna与阴离子交换粒子的结合。
102.蛋白水解酶
103.根据优选实施方式,步骤(cc)包括添加蛋白水解酶。所述蛋白水解酶可以有利地帮助裂解并因此提高囊泡rna的得率。不受理论限制,据信蛋白水解酶例如蛋白酶k使可能存在于步骤(cc)的裂解混合物中的降解酶失活。此外,可以除去污染物,例如在步骤(aa)中结合到所述阴离子交换基团或固相的蛋白质。因此,所述裂解混合物中存在的细胞外rna的降解被减少。
104.根据优选实施方式,所述蛋白水解酶是蛋白酶,优选为蛋白酶k。
105.根据一个实施方式,在由步骤(cc)中的酸性裂解试剂建立的条件下,从裂解的细胞外囊泡释放的囊泡rna与所述裂解混合物中存在阴离子交换粒子的结合。有利的是,这种结合不受所述酸性裂解试剂的化合物的负面影响,而是优选地通过提供适合的ph和缓冲剂而被增强。
106.根据一个实施方式,步骤(cc)包括将分离的包含结合的细胞外囊泡的阴离子交换粒子与所述酸性裂解试剂进行接触,并且其中不需添加其他试剂即可在步骤(cc)中建立ev裂解和囊泡rna结合的条件。此类实施方式是有利的,因为避免了进一步的处理步骤,例如不需添加其他阴离子交换粒子或其他缓冲或酸性试剂。
107.根据一个实施方式,步骤(cc)包括将所述裂解混合物温育,以允许细胞外囊泡的裂解和所述释放的囊泡rna与阴离子交换粒子的直接结合。根据特定实施方式,温育在室温或更高温度下进行。例如,可以发现,将温度提高以使添加的蛋白水解酶更有活性将是适合的,例如通过加热至30℃或更高、35℃或更高、40℃或更高或45℃或更高的温度。专业技术人员可以在本领域中容易地发现适合的温度。
108.步骤(dd)
109.步骤(dd)包括从裂解物分离带有结合的rna的阴离子交换粒子。
110.根据优选实施方式,在步骤(dd)中从裂解物分离的阴离子交换粒子包含与其结合的细胞外rna,其包含囊泡rna和任选的非囊泡rna。非囊泡rna的结合可能在步骤(aa)的结合混合物中,通过细胞外非囊泡rna与样品中存在的阴离子交换粒子的结合得以实现。
111.根据特定实施方式,所述结合的rna包含在步骤(aa)中与细胞外囊泡一起结合到阴离子交换粒子的非囊泡rna。
112.用于分离阴离子交换粒子的方式和技术已在上文中结合步骤(bb)进行描述并在此引用。根据特定实施方式,使用磁性阴离子交换粒子,便于通过磁力例如磁铁进行分离。
113.步骤(ee)
114.根据优选实施方式,所述方法还包括任选的步骤(ee),其包括清洗所述结合的rna。
115.根据一个实施方式,包括清洗所述结合的rna的步骤(ee)是强制性的。根据一个实施方式,根据所述第一方面的方法包括进行一个或多个清洗步骤(ee)。在清洗步骤结束时,将所述阴离子交换粒子与清洗溶液分开以除去所述清洗溶液可能是优选的。在清洗步骤进行多次的情况下,在每个清洗步骤后分离所述阴离子交换粒子可能是优选的。
116.适合的清洗溶液可以在本领域中发现并被专业技术人员所知。根据特定实施方式,所述清洗溶液可以对应于如上所定义的酸性裂解试剂。任选地,所述清洗溶液对应于包含去污剂的如上所定义的酸性裂解试剂。
117.步骤(ff)
118.根据优选实施方式,所述方法还包括步骤(ff),其包括从所述阴离子交换粒子洗脱所述结合的rna。
119.根据所述第一方面的方法在优选实施方式中允许洗脱所述细胞外rna,使得所述细胞外rna不需在复杂且耗时的后续分离净化中进行纯化。有利的是,可以通过提供允许对细胞外rna进行直接分析的洗脱缓冲液,将所述结合的细胞外rna从所述阴离子交换粒子例如磁性阴离子交换粒子洗脱。
120.根据优选实施方式,洗脱步骤(ff)使用一种或多种洗脱溶液来进行。根据优选实施方式,所述洗脱溶液具有优选为至少8.0、至少8.3或至少8.5的碱性ph,并且其中优选地所述洗脱溶液的ph≤9或《9。根据一个实施方式,所述洗脱溶液包含缓冲剂,其任选地选自tris、hepes、hpps或氨缓冲剂,优选为tris。
121.根据一个实施方式,洗脱包括加热步骤。所述加热步骤可以改进洗脱和/或允许使用包含更少盐的洗脱溶液,这可以有利地允许获得可直接用于分析的富集的细胞外rna,避免了后续的净化,例如盐的去除。
122.根据一个实施方式,如上所述的洗脱溶液与包含在由所述洗脱溶液提供的洗脱条件下释放出结合的rna的阴离子交换基团的阴离子交换粒子相组合使用。这是特别有利的,因为避免了需要后续净化例如除去盐或有机化合物的严苛洗脱条件。因此,所述阴离子交换基团可以包含每个阴离子交换基团至少一个氨基,任选地1至20或1至15个氨基。优选地,所述氨基是咪唑环的一部分。根据特定实施方式,所述阴离子交换基团包含组氨酸或组胺。根据优选实施方式,所述粒子的阴离子交换基团选自:(i)寡聚组氨酸,其中组氨酸单体的数目在4至18的范围内,例如5至16、6至14、7至13或优选地8至12,和(ii)组胺基团,任选地其中所述阴离子交换基团包含每个阴离子交换基团1个组胺基团。
123.根据一个实施方式,所述洗脱溶液中的总盐浓度为500mm或更低,例如250mm或更低、200mm或更低、150mm或更低或100mm或更低,任选为50mm或更低。根据特定实施方式,所述洗脱溶液包含选自5至250mm的盐浓度。例如,所述洗脱溶液可以包含200mm或10mm盐,特别是200mm或10mm tris。
124.根据一个实施方式,所述洗脱溶液中的总盐浓度为至少500mm,例如至少750mm、至少1m或至少1.2m。当提供更强地结合细胞外rna的阴离子交换粒子时,这种盐浓度可能是有利的。例如,强烈结合细胞外rna的基于聚乙烯亚胺或基于聚组氨酸的阴离子交换粒子,可能需要包含所述盐浓度的洗脱溶液。
125.根据一个实施方式,所述洗脱溶液是提取试剂,任选地其中所述洗脱溶液包含苯酚和/或包含离液盐,其任选地选自胍盐、硫氰酸盐、碘化物盐、高氯酸盐、三氯乙酸盐和三氟乙酸盐。任选地,此类洗脱溶液具有至少7.5或至少8的ph。
126.根据第二方面的试剂盒
127.根据第二方面,提供了一种用于执行根据所述第一方面的方法的试剂盒,其包含:
128.(a)阴离子交换粒子;
129.(b)酸性试剂;
130.(c)不同于酸性试剂(b)并包含去污剂的酸性裂解试剂;
131.(d)任选的一种或多种清洗溶液;和
132.(e)任选的一种或多种洗脱溶液。
133.所述试剂盒可用于执行根据所述第一方面的方法。优点如上所述,包括所使用的试剂和固相。包括酸性裂解试剂(c),其允许裂解结合到所述阴离子交换粒子的细胞外囊泡并将释放的rna结合到所述阴离子交换粒子。因此,不但建立了裂解条件,而且同时还建立了结合条件。所述富集的rna具有高质量和纯度。因此,所述试剂盒和相应的方法变得容易使用,并且可以避免后续的复杂且耗时的净化工作流程,因为在步骤(aa)中使用由试剂盒组分(a)提供的阴离子交换粒子可以直接富集细胞外rna。
134.可以在根据本公开的试剂盒中优选地使用的阴离子交换粒子在整个本公开中描述并在此引用。根据优选实施方式,所述阴离子交换粒子是磁性阴离子交换粒子。具体的阴离子交换基团在下文描述。根据一个实施方式,所述阴离子交换基团包含至少一个氨基。根据特定实施方式,所述粒子的阴离子交换基团选自:(i)聚乙烯亚胺;(ii)聚组氨酸,其中组氨酸单体的数目为至少30;(iii)寡聚组氨酸,其中组氨酸单体的数目在4至18的范围内,例如5至16、6至14、7至13或优选地8至12,和(iv)组胺。
135.根据优选实施方式,所述试剂盒的酸性试剂是如下所述并在此引用的酸性试剂。根据一个实施方式,所述酸性试剂包含缓冲剂,并提供允许所述细胞外囊泡与阴离子交换粒子结合的ph。根据一个实施方式,所述酸性试剂的ph在2至5的范围内,例如2.5至5,优选地3至5,更优选地3至4.5。此外,所述酸性试剂可以包含基于羧酸的缓冲剂,例如乙酸盐缓冲剂,任选地由乙酸钠/乙酸缓冲剂提供。
136.所述包含去污剂的酸性裂解试剂已在上文描述并在此引用。根据特定实施方式,所述去污剂不是阳离子去污剂。因此,优选的去污剂选自非离子表面活性剂和阴离子去污剂。有利情况下,所述去污剂以足以裂解所述裂解混合物中的细胞外囊泡的浓度提供。具体来说,在所述酸性裂解试剂中,所述去污剂可能具有至少0.1%,例如至少0.2%,例如至少
0.3%,例如至少0.4%、至少0.5%、至少0.75%,或至少1%,或至少1.25%,例如至少1.5%、至少1.75%或至少2%的浓度。在步骤(cc)的裂解试剂中,所述去污剂的浓度可以选自0.1至15%的范围,例如0.5至10%、0.75%至7%或1%至5%。
137.所述酸性裂解试剂可以选自在整个本公开中描述的酸性裂解试剂。酸性裂解试剂优选地可以包含如上所定义的缓冲剂,并在所述裂解混合物中提供允许释放的rna与阴离子交换粒子结合的ph。因此,所述酸性裂解试剂建立了允许所述释放的囊泡rna与阴离子交换粒子直接结合的条件。
138.根据一个实施方式,所述试剂盒包含洗脱溶液。适合的洗脱溶液已在上文描述并在此引用。提供包含低盐浓度的洗脱溶液可能是特别适合的,例如所述洗脱溶液中的总盐浓度为500mm或更低,例如250mm或更低、200mm或更低、150mm或更低或100mm或更低,任选为50mm或更低。
139.所述试剂盒可以包含其他组分,例如一种或多种清洗溶液和/或蛋白水解酶例如蛋白酶k,它们在本公开中已被描述,并且也适用于此处。可以与根据所述第一方面的方法相结合使用的其他特点,也可以整合到根据所述第二方面的试剂盒中。
140.具体的实施方式
141.下面描述本发明的其他实施方式。
142.样品
143.根据一个实施方式,所述包含细胞外囊泡的样品是体液或源自于体液。所述样品优选为通过除去细胞从体液获得的样品。所述样品可以是无细胞或除细胞体液样品。根据一个实施方式,所述无细胞或除细胞体液样品是或源自于除去细胞的下述样品:全血,血浆,血清,淋巴液,尿液,清液(liquor),脑脊液,滑液,组织间隙液,腹水,乳汁,支气管灌洗液,唾液,羊水,精液,身体分泌物,鼻腔分泌物,阴道分泌物,伤口分泌物和排泄物。根据特定实施方式,所述样品选自血浆、血清和尿液,其中尿液优选为除细胞或无细胞尿液。
144.根据特定实施方式,所述方法包括从体液样品除去细胞,由此提供除细胞体液样品作为包含细胞外囊泡的样品,其中将所述样品在步骤(aa)中与阴离子交换粒子并优选地与酸性试剂进行接触,以制备所述酸性结合混合物。
145.根据一个实施方式,所述样品是包含细胞外囊泡的细胞培养上清液。根据一个实施方式,所述包含细胞外囊泡的样品是植物提取物例如水果提取物。
146.去除dna步骤
147.根据一个实施方式,在步骤(aa)之前,对包含细胞外囊泡的除细胞或无细胞生物样品进行去除dna步骤,特别是通过将dna例如细胞外dna结合到包含阴离子交换基团的粒子,并从所述结合混合物分离结合的dna,由此提供包含细胞外囊泡的去除dna的样品,使其经历根据前述权利要求中的任一项所述的方法的步骤(aa),用于将细胞外囊泡结合到所述阴离子交换粒子。
148.根据特定实施方式,所述方法包括:
149.(a)制备结合混合物,其包含:
[0150]-包含细胞外囊泡的生物样品,其中优选地所述生物样品是除细胞或无细胞体液样品,
[0151]-阴离子交换粒子,
[0152]-包含缓冲剂的酸性结合缓冲液,
[0153]
并将细胞外dna结合到所述粒子;
[0154]
(b)从结合混合物中分离出带有结合的细胞外dna的粒子,其中剩余的结合混合物提供包含细胞外囊泡的样品;并且
[0155]
(c)使用包括根据下文进一步详细描述的条目1至76并且如结合根据所述第一方面的方法所描述的步骤(aa)至(dd)的方法,从提供包含细胞外囊泡的样品的所述剩余的结合混合物富集细胞外囊泡。
[0156]
此类方法公开在由本技术人今天提交的pct申请pct/ep2020/086576和相应的优先权申请ep19216746.8中,两者均通过参考并入本文。正如公开的,这个实施方式可用于在ev结合步骤之前从生物样品去除非囊泡dna,例如由细胞死亡释放的dna。这种非囊泡dna的释放可以在例如样品采集或细胞培养期间发生。通过选择结合条件和固相的阴离子交换基团,特别是通过调节使用的结合缓冲液的酸性ph,可以在细胞外dna结合步骤(a)中减少或甚至消除细胞外囊泡和其他细胞外rna与所述包含阴离子交换基团的固相的结合。与cfdna的结合相比,ev与固相的阴离子交换基团的结合对ph变化更加敏感。因此,尽管cfdna在更广的酸性ph范围内显示出相近的结合效率,但ev在较高ph下结合效率较低。正如在ep19216746.8和pct/ep2020/086576中公开的,这可用于在步骤(a)中建立所述结合混合物中的酸性结合条件,在此条件下细胞外dna仍然以高产率结合到固相的阴离子交换基团,而ev与用于cfdna结合的固相的阴离子交换基团的结合已被显著减弱。根据ep19216746.8和pct/ep2020/086576中公开的一个实施方式,在细胞外dna结合步骤(a)中,所述结合混合物的ph在3.5至6、3.7至5.5或4至5.2的范围内,任选地其中所述结合混合物的ph≥4、≥4.2或≥4.5。可以在步骤(a)中用于在结合混合物中建立用于细胞外dna与阴离子交换粒子结合的条件的酸性结合缓冲液,可以包含基于羧酸的缓冲剂。所述缓冲剂可以包含选自柠檬酸盐、草酸盐、甲酸盐、乙酸盐、丙酸盐、乳酸盐和酒石酸盐,特别是选自柠檬酸盐或草酸盐,更优选为柠檬酸盐的缓冲剂组分。正如在ep19216746.8和pct/ep2020/086576中公开的,可以使用这些酸性结合条件将细胞外dna结合到例如阴离子交换粒子、特别是磁性阴离子交换粒子,所述粒子包含含有三烷基胺基或二烷基氨基烷基的阴离子交换基团。然而,在步骤(a)中使用的此类结合条件下,细胞外囊泡与所述阴离子交换粒子的结合减弱。在步骤(b)中,将带有结合的细胞外dna的粒子与包含未结合的细胞外囊泡的剩余结合混合物分离开。因此,细胞外囊泡和任选的其他细胞外rna主要包含在步骤(b)中提供的剩余结合混合物中。这种已除去所述带有结合的细胞外dna的阴离子交换粒子的剩余的结合混合物提供了包含细胞外囊泡的样品。然后可以在步骤(c)中使用根据本文公开的第一方面的方法的步骤(aa)至(dd),从所述剩余的结合混合物富集细胞外囊泡。正如本文公开的,执行步骤(aa)至(dd)提供了从所述结合到阴离子交换固相的富集的细胞外囊泡释放的核酸。然后可以在本文所公开的步骤(ee)和(ff)中将所述结合的核酸任选地清洗和洗脱。这提供了纯化形式的囊泡核酸例如囊泡rna。
[0157]
这个实施方式也允许以纯化形式分离无细胞dna,例如通过任选地清洗在步骤(b)中分离的所述阴离子交换粒子并从其洗脱结合的细胞外dna。此类在根据本发明的第一方面的方法的步骤(aa)之前进行的处理,也可用于在富集ev之前去除其他不想要的组分,例如非囊泡的带负电荷的蛋白质。
[0158]
步骤(aa)
[0159]
根据所述第一方面的方法的步骤(aa)在上文中公开。在下面的公开内容中描述了步骤(aa)的其他实施方式,其可以被有利地用于建立将细胞外囊泡和任选的其他细胞外(非囊泡)rna结合到阴离子交换粒子的条件。
[0160]
结合混合物和酸性试剂的ph
[0161]
根据优选实施方式,在步骤(aa)中制备的所述酸性结合混合物具有2至6范围内的ph,例如2.5至5.5,优选地3至5,更优选地3至4.5。提供的ph有利地允许所述细胞外囊泡结合到阴离子交换粒子,特别是磁性阴离子交换粒子。
[0162]
根据一个实施方式,在步骤(aa)中准备所述ev结合条件包括添加酸性试剂,任选地其中所述酸性试剂的ph在2至5的范围内,例如2.5至5,优选地3至5,更优选地3至4.5。
[0163]
根据优选实施方式,所述酸性试剂包含缓冲剂,优选为基于羧酸的缓冲剂。因此,所述基于羧酸的缓冲剂包含羧酸和所述羧酸的盐,其中优选地所述羧酸(i)包含1至3个羧酸基团,(ii)是脂族的,和/或(iii)是饱和的。所述基于羧酸的缓冲剂可以包含1至3个羧基,优选地1个羧基。根据特定实施方式,所述基于羧酸的缓冲剂是乙酸盐缓冲剂,任选地由乙酸钠/乙酸缓冲剂提供。
[0164]
根据优选实施方式,所述步骤(aa)中的ev结合混合物包含来自于所述酸性试剂的缓冲剂,其浓度为100mm至1m,优选地《1m,例如200mm至700mm、300mm至600mm或350mm至550mm,任选地其中所述缓冲剂是乙酸盐。因此,所述缓冲剂可以由乙酸钠/乙酸缓冲剂提供。
[0165]
根据优选实施方式,在步骤(aa)中,所述用于将细胞外囊泡结合到阴离子交换粒子的结合混合物的ph低于所述粒子的阴离子交换基团的离子化形式的pka,任选地其中所述ph比所述pka低至少1、至少1.5、至少2或至少2.5个单位。适合的pka值在下文描述。
[0166]
根据一个实施方式,在步骤(aa)中,所述结合混合物的ph对应于被添加以调节结合条件的酸性试剂的ph,或与其偏离≤1、≤0.75或优选地≤0.5个ph单位。所述偏离可以取决于由所述酸性试剂提供的缓冲剂的缓冲强度和/或浓度。
[0167]
根据特别优选实施方式,在步骤(aa)中使用磁性阴离子交换粒子。磁性阴离子交换粒子允许以自动或半自动方式执行根据本公开的方法。
[0168]
根据一个实施方式,所述阴离子交换粒子在粒子表面处包含阴离子交换基团。所述阴离子交换粒子的阴离子交换基团可以包含相同或不同类型的阴离子交换基团。根据一个实施方式,所述阴离子交换基团具有相同类型。根据一个实施方式,通过共价附连将所述阴离子交换基团附连到所述粒子的表面,任选地使用基于碳二亚胺的反应,特别是通过将所述粒子的羧基与所述阴离子交换基团中包含的氨基进行反应。将阴离子交换基团附连到粒子、特别是二氧化硅粒子例如磁性二氧化硅粒子的适合的方式在本领域中是公知的。此外,适合的方式可以在本公开的实施例部分中找到。
[0169]
根据优选实施方式,所述阴离子交换基团包含至少一个可离子化基团作为官能团,其中优选地所述可离子化基团可以通过质子化作用离子化。离子化以及优选地质子化作用可以例如通过在所述结合混合物中提供适合的ph,以使所述可离子化基团处于带电荷例如带正电荷形式来实现。
[0170]
根据一个实施方式,所述阴离子交换基团的可离子化基团作为单体、寡聚体或聚
合物提供在所述粒子的表面上。提供单体和寡聚体可能是有利的,以便允许在步骤(ff)中使用低盐浓度洗脱溶液例如包含低于500mm、例如低于250mm、例如200mm或10mm的总盐浓度的洗脱溶液来洗脱结合的细胞外rna。
[0171]
根据一个实施方式,所述粒子包含每个阴离子交换基团含有至少一个可离子化基团的阴离子交换基团和连接物或间隔物组成部分。例如,所述阴离子交换基团可以被共价附连到所述粒子例如磁性粒子。然后,在所述阴离子交换基团上,所述间隔物可以被包含所述共价附连与可离子化基团之间。
[0172]
根据优选实施方式,所述粒子包含含有至少一个氨基作为可离子化基团的阴离子交换基团。可以被离子化、特别是通过质子化作用离子化的适合的氨基在下文中公开,并且在本领域中是已知的。在特定实施方式中,所述阴离子交换基团包含每个阴离子交换基团一个氨基作为可离子化基团。或者,在一个阴离子交换基团中包含多个氨基作为可离子化基团。
[0173]
根据优选实施方式,所述粒子包含含有至少一个伯氨、仲氨或叔氨基的阴离子交换基团。具体来说,所述阴离子交换基团可以包含仲氨基。
[0174]
根据一个实施方式,所述粒子的阴离子交换基团包含选自下述结构式的伯胺、仲胺和叔胺的基团
[0175]
(r)3n、(r)2nh、rnh2和/或x-(ch2)
n-y
[0176]
其中
[0177]
x是(r)2n、rnh或nh2,
[0178]
y是(r)2n、rnh或nh2,
[0179]
r各自独立地是任选取代的直链、支链或环状烷基、烯基、炔基或芳基取代基,其可以包含一个或多个优选地选自o、n、s和p的杂原子,并且
[0180]
n是0至20、优选地0至18范围内的整数。
[0181]
根据一个实施方式,所述阴离子交换基团包含至少一个氨基,其中所述氨基是杂环或杂芳环的一部分。在特定实施方式中,所述氨基是咪唑环的一部分。优选地,所述阴离子交换基团包含组氨酸或组胺或其衍生物。
[0182]
根据一个实施方式,所述阴离子交换基团包含可离子化基团,其离子化形式、优选为质子化形式具有≤8.0或≤7.5的pka值。
[0183]
根据优选实施方式,所述阴离子交换基团包含可离子化基团,其离子化形式、优选为质子化形式具有选自4.0至8.0或4.5至7.5、优选地5.0至7.5例如5.5至7.5或5.5至7.0的范围的pka值。因此,所述阴离子交换基团在具有例如3至5的ph的结合混合物中优选地带正电荷。此外,所述阴离子交换基团的相对低的pka值有利地允许使用高盐或优选地在中等ph例如7至9下使用低盐洗脱溶液洗脱所述结合的细胞外rna。
[0184]
根据优选实施方式,所述阴离子交换基团包含至少一个可离子化基团,其中所述基团可以通过质子化作用离子化,其中所述可离子化基团在步骤(aa)的结合混合物的酸性ph下被质子化,并且在碱性ph例如至少8或至少8.5的碱性ph下为中性或不带电荷。
[0185]
根据优选实施方式,所述粒子包含阴离子交换基团,其在步骤(aa)的结合混合物的ph下,任选地在≥3至≤6或≥3.5至≤5.5范围内的ph下具有每个阴离子交换基团单个正电荷。
[0186]
根据一个实施方式,所述阴离子交换基团包含每个阴离子交换基团数目为n的可离子化基团,其中数目n选自1至300、1至250或1至200的范围,任选地其中所述阴离子交换基团选自下述阴离子交换基团:
[0187]
(i)所述阴离子交换基团包含每个阴离子交换基团30至300或50至250个可离子化基团,任选地其中这些阴离子交换基团由聚组氨酸提供;
[0188]
(ii)所述阴离子交换基团包含每个阴离子交换基团2至《30个可离子化基团,例如每个阴离子交换基团3至25、4至20、5至18、6至15或8至12个可离子化基团,任选地其中这些阴离子交换基团由寡聚组氨酸基团提供;或
[0189]
(iii)所述阴离子交换基团包含每个阴离子交换基团1至5个可离子化基团,例如每个阴离子交换基团1至4或1至3个可离子化基团,特别是每个阴离子交换基团1、2或3个可离子化基团。
[0190]
根据一个实施方式,所述可离子化基团由氨基提供。因此,所述可离子化氨基可以被包含在聚合物中,任选地其中所述聚合物是(i)聚烷基亚胺,其任选地选自聚乙烯亚胺、聚丙烯亚胺或聚丁烯亚胺,优选为聚乙烯亚胺,或者(ii)是包含咪唑基团的聚合物,例如聚组氨酸。此类聚合物可以有利地允许所述细胞外rna以高效率结合。
[0191]
根据特定实施方式,在步骤(aa)中使用的所述粒子的阴离子交换基团选自:(i)聚乙烯亚胺;(ii)聚组氨酸,其中组氨酸单体的数目为至少30;(iii)寡聚组氨酸,其中组氨酸单体的数目在4至18的范围内,例如5至16、6至14、7至13或优选地8至12,和(iv)组胺。
[0192]
正如本文公开的,所述阴离子交换基团可以包含至少一个作为杂环或杂芳环的一部分的氨基。所述氨基可以是咪唑环的一部分。所述阴离子交换基团可以包含例如组氨酸和/或组胺。根据一个实施方式,所述固相包含偶联到羧基修饰的表面的组胺。或者,可以将咪唑羧酸例如4-咪唑乙酸偶联到表面例如氨基修饰的表面。
[0193]
根据特定实施方式,所述阴离子交换基团包含组氨酸或组胺。组氨酸基团的数目优选为至少3或至少4。根据一个实施方式,所述阴离子交换基团选自:(i)寡聚组氨酸,其中组氨酸单体的数目在4至18的范围内,例如5至16、6至14、7至13或优选地8至12,和(ii)组胺基团,任选地其中所述阴离子交换基团包含每个阴离子交换基团1个组胺基团。
[0194]
根据特定实施方式,所述阴离子交换基团选自(i)聚组氨酸和(ii)包含bis-tris基团的阴离子交换基团。根据一个实施方式,所述聚组氨酸中组氨酸单体的数目为至少30。
[0195]
根据一个实施方式,所述可离子化氨基被包含在聚烷基亚胺聚合物中,所述聚烷基亚胺聚合物任选地选自聚乙烯亚胺、聚丙烯亚胺或聚丁烯亚胺,优选为聚乙烯亚胺。
[0196]
根据一个实施方式,所述阴离子交换基团的每个阴离子交换基团的分子量为1500da或更低、1000da或更低、500da或更低或300da或更低。根据另一个实施方式,所述阴离子交换基团的每个阴离子交换基团的分子量低于35000da或低于30000da。可以使用本领域中已知的阴离子交换基团的其他分子量。
[0197]
步骤(gg)
[0198]
根据一个实施方式,所述方法还包括分析洗脱的rna分子的步骤(gg)。
[0199]
富集的细胞外rna可以使用适合的测定法和/或分析方法来分析和/或进一步处理。因此,根据一个实施方式,对所述分离的细胞外核酸进行分析。所述分析可用于鉴定、检测、筛选、监测或排除疾病、感染和/或至少一个胎儿特征。可以对所述包含或怀疑包含在富
集的分离物中的富集的细胞外(总)rna和/或特定的靶细胞外rna进行鉴定、定量、修饰、与至少一种酶接触、扩增、反转录、克隆、测序、与探针接触和/或检测。相应的方法在现有技术中是公知的,并在医学、诊断和/或预后领域中常用。
[0200]
其他步骤
[0201]
正如也在本文中公开的,所述方法还可以包括一个或多个中间清洗步骤。
[0202]
自动化
[0203]
根据优选实施方式,在步骤(aa)中将磁性阴离子交换粒子用于结合细胞外囊泡,并且其中所述方法的一个或多个步骤使用在磁场帮助下移动磁性粒子的自动化系统来进行,任选地其中步骤(aa)至(dd)以自动化方式进行。也可以将根据所述第一方面的方法的特定步骤自动化,并手动进行其他步骤。例如,任选地,步骤(aa)可以手动进行,并且步骤(bb)至(dd)或甚至步骤(ee)和(ff)可以以自动化方式进行。
[0204]
其他实施方式
[0205]
在下文中再次并更详细地描述本发明的实施方式。具体来说,本发明公开并提供了下述条目:
[0206]
1.一种用于从包含细胞外囊泡的样品富集细胞外核酸例如优选为细胞外rna的方法,所述方法包括下述步骤:
[0207]
(aa)制备酸性结合混合物,其包含所述样品和优选地由阴离子交换粒子提供的阴离子交换固相,并将细胞外囊泡结合到所述阴离子交换固相;
[0208]
(bb)从所述结合混合物分离出包含结合的细胞外囊泡的阴离子交换固相;
[0209]
(cc)在至少一种去污剂存在下裂解所述结合的细胞外囊泡,并将释放的核酸例如优选为rna结合到所述阴离子交换固相;
[0210]
(dd)从裂解物分离带有结合的核酸的阴离子交换固相。
[0211]
2.根据条目1所述的方法,其中所述方法包括:
[0212]
(ee)任选地清洗结合的rna;和
[0213]
(ff)从所述阴离子交换粒子洗脱所述结合的rna。
[0214]
3.根据条目1所述的方法,其中步骤(cc)包括通过将分离的包含结合的细胞外囊泡的阴离子交换粒子与包含至少一种去污剂的酸性裂解试剂进行接触来制备裂解混合物
[0215]
4.根据条目3所述的方法,其中所述去污剂适合于裂解细胞外囊泡,并且其中所述去污剂以使所述结合的细胞外囊泡发生裂解并释放囊泡rna的浓度用于(cc)的裂解混合物中。
[0216]
5.根据条目1至4中的任一项所述的方法,其中在步骤(cc)中,包含阴离子交换粒子的所述裂解混合物包含浓度为至少0.1%,例如至少0.2%、至少0.5%、至少0.75%或至少1%的去污剂。
[0217]
6.根据条目1至4中的任一项所述的方法,其中在步骤(cc)中,包含阴离子交换粒子的所述裂解混合物包含浓度为至少1.25%,例如至少1.5%、至少1.75%或至少2%的去污剂。
[0218]
7.根据条目1至6中的任一项所述的方法,其中在步骤(cc)中,包含阴离子交换粒子的所述裂解混合物包含浓度为15%或更低、10%或更低、7%或更低或5%或更低的去污剂。
[0219]
8.根据条目1至7中的任一项所述的方法,其中步骤(cc)包括通过将分离的包含结合的细胞外囊泡的阴离子交换粒子与包含所述去污剂的酸性裂解试剂进行接触来制备裂解混合物,其中所述去污剂以0.1至15%例如0.5至10%、0.75%至7%或1%至5%范围内的浓度包含在所述裂解混合物中。
[0220]
9.根据条目1至8中的一项或多项所述的方法,其中在步骤(cc)中用于裂解细胞外囊泡的所述去污剂不是阳离子去污剂。
[0221]
10.根据条目1至9中的一项或多项所述的方法,其中在步骤(cc)中用于裂解细胞外囊泡的所述至少一种去污剂选自非离子表面活性剂和阴离子去污剂。
[0222]
11.根据条目10所述的方法,其中在步骤(cc)中用于裂解细胞外囊泡的所述去污剂是非离子去污剂,优选为基于聚氧乙烯的非离子去污剂。
[0223]
12.根据条目11所述的方法,其中所述非离子去污剂选自:(i)聚氧乙烯脂肪醇醚,(ii)聚氧乙烯烷基苯基醚,(iii)聚氧乙烯-聚氧丙烯嵌段共聚物,(iv)聚氧乙烯脂肪酸酯,(v)乙氧基化丙氧基化醇,(vi)基于甾体糖苷的非离子去污剂,和(vii)失水山梨醇脂肪酸酯,
[0224]
任选地其中所述非离子去污剂具有至少一个下述特征:
[0225]
(i)它是聚氧乙烯脂肪醇醚,任选地包含具有4至28个碳原子的脂肪醇组分和具有2至150个(ch2ch2o)单元的聚氧乙烯组分,任选地选自聚氧乙烯月桂基醚例如聚氧乙烯(4)月桂基醚(例如30)或聚氧乙烯(23)月桂基醚(例如35)、聚氧乙烯鲸蜡基醚例如聚氧乙烯(10)鲸蜡基醚(例如56)或聚氧乙烯(20)鲸蜡基醚(例如58)、聚氧乙烯硬脂基醚例如聚氧乙烯(2)硬脂基醚(例如72)或聚氧乙烯(20)硬脂基醚(例如78)和聚氧乙烯油基醚例如聚氧乙烯(20)油基醚(例如98);
[0226]
(ii)它是聚氧乙烯烷基苯基醚,任选为聚氧乙烯辛基苯基醚或聚氧乙烯壬基苯基醚,任选为支链的,任选地选自聚氧乙烯对异辛基苯基醚(例如triton
tm x-100)、聚氧乙烯叔辛基苯基醚(例如triton
tm x-114)、聚氧乙烯(40)异辛基苯基醚(例如triton
tm x-450)、辛基苯氧基聚(氧化乙烯)乙醇(例如ca-630)或4-壬基苯基-聚乙二醇;
[0227]
(iii)它是聚氧乙烯-聚氧丙烯嵌段共聚物,例如泊洛沙姆;
[0228]
(iv)它是聚氧乙烯脂肪酸酯,例如聚氧乙烯失水山梨醇单月桂酸酯(20)、聚氧乙烯失水山梨醇单油酸酯(80);
[0229]
(v)它是乙氧基化丙氧基化醇,例如种子油醇乙氧基化物,特别是种子油醇乙氧基化物4eo(ecosurf
tm sa-4)、种子油醇乙氧基化物7eo(ecosurf
tm sa-7)或种子油醇乙氧基化物9eo(ecosurf
tm sa-9);
[0230]
(vi)它是基于甾体糖苷的非离子去污剂,例如洋地黄皂苷;
[0231]
(vii)它是失水山梨醇脂肪酸酯,例如失水山梨醇单月桂酸酯(例如20)、失水山梨醇单硬脂酸酯(例如60)或失水山梨醇单油酸酯(例如80)。
[0232]
13.根据条目10所述的方法,其中在步骤(cc)中用于裂解细胞外囊泡的所述去污剂是阴离子去污剂,任选为脂肪醇的硫酸盐或磺酸盐。
[0233]
14.根据条目13所述的方法,其中所述阴离子去污剂选自:
[0234]
(i)脂肪醇的硫酸盐或磺酸盐,例如十二烷基硫酸钠、十二烷基磺酸钠或十二烷基苯磺酸;
[0235]
(ii)基于胆汁酸的去污剂,例如脱氧胆酸盐,特别是脱氧胆酸钠或胆酸钠,和
[0236]
(iii)基于肌氨酸的去污剂,例如十二烷酰基肌氨酸或n-月桂酰基肌氨酸;
[0237]
任选地其中所述阴离子去污剂选自十二烷基硫酸钠、十二烷基磺酸钠、十二烷基苯磺酸、n-月桂酰基肌氨酸和胆酸钠,并且其中所述阴离子去污剂任选为十二烷基硫酸钠。
[0238]
15.根据条目1至14中的任一项所述的方法,其中在步骤(cc)中用于细胞外囊泡裂解的所述去污剂选自triton x-100、十二烷基硫酸钠、脱氧胆酸盐、十二烷酰基肌氨酸和/或ecosurf sa-9。
[0239]
16.根据条目3至15中的任一项所述的方法,其中步骤(cc)的酸性裂解试剂包含:
[0240]
(i)所述至少一种去污剂,其浓度任选地如条目5-8中的任一项中为所述裂解混合物所定义;和
[0241]
(ii)缓冲剂。
[0242]
17.根据条目16所述的方法,其中所述酸性裂解试剂具有促进释放的囊泡rna与所述粒子的阴离子交换基团结合的酸性ph。
[0243]
18.根据条目13至17中的任一项所述的方法,其中所述酸性裂解试剂具有2.5至5.5例如2.7至5.3、3至5或3至4.7范围内的ph,任选地其中所述ph在3至4.5或3至4.3的范围内。
[0244]
19.根据条目18所述的方法,其中所述酸性裂解试剂的ph≤5,优选地≤4.7、≤4.5或≤4.3。
[0245]
20.根据条目16至19中的任一项所述的方法,其中在步骤(cc)中使用的所述酸性裂解试剂具有一个或多个下述特征:
[0246]-它包含基于羧酸的缓冲剂,任选为乙酸盐;
[0247]-它包含浓度≤500mm,例如≤450mm、≤400mm、≤350mm,优选地≤300mm或≤250mm的缓冲剂。
[0248]
21.根据条目3至20中的任一项所述的方法,其中所述酸性裂解试剂建立允许释放的囊泡rna与所述阴离子交换粒子直接结合的条件。
[0249]
22.根据条目16至21中的任一项所述的方法,其中所述酸性裂解试剂中的总盐浓度为1m或更低,优选为0.75m或更低、0.5m或更低或370mm或更低。
[0250]
23.根据条目22所述的方法,其中所述酸性裂解试剂中的总盐浓度为350mm或更低,例如325mm或更低、300mm或更低或275mm或更低。
[0251]
24.根据条目16至23中的任一项所述的方法,其中在步骤(cc)中使用的所述酸性裂解试剂具有一个或多个下述特征:
[0252]-它不包含离液盐;和/或
[0253]-它不包含有机溶剂。
[0254]
25.根据条目1至24中的任一项所述的方法,其中步骤(cc)包括添加蛋白水解酶。
[0255]
26.根据条目1至25中的任一项所述的方法,其中所述蛋白水解酶是蛋白酶,优选为蛋白酶k。
[0256]
27.根据条目3至26中的一项或多项所述的方法,其中在由步骤(cc)中的酸性裂解
试剂建立的条件下,从裂解的细胞外囊泡释放的囊泡rna与所述裂解混合物中存在的阴离子交换粒子结合。
[0257]
28.根据条目3至27中的任一项所述的方法,其中步骤(cc)包括将分离的包含结合的细胞外囊泡的阴离子交换粒子与所述酸性裂解试剂进行接触,并且其中没有为了在步骤(cc)中建立ev裂解和囊泡rna结合的条件而添加其他试剂。
[0258]
29.根据条目1至28中的任一项所述的方法,其中步骤(cc)包括将所述裂解混合物温育,以允许细胞外囊泡裂解并且释放的囊泡rna直接结合到阴离子交换粒子。
[0259]
30.根据条目29所述的方法,其中温育在室温或更高温度下进行。
[0260]
31.根据条目1至30中的任一项所述的方法,其中在步骤(dd)中从裂解物分离的所述阴离子交换粒子包含与其结合的细胞外rna,所述细胞外rna包括囊泡rna和任选的非囊泡rna。
[0261]
32.根据条目31所述的方法,其中结合的rna包含在步骤(aa)中与所述细胞外囊泡一起结合到所述阴离子交换粒子的非囊泡rna。
[0262]
33.根据条目1至32中的任一项所述的方法,其中在步骤(aa)中制备的所述酸性结合混合物具有2至6、例如2.5至5.5、优选地3至5、更优选地3至4.5范围内的ph。
[0263]
34.根据条目1至33中的任一项所述的方法,其中准备步骤(aa)中的ev结合条件包括添加酸性试剂,任选地其中所述酸性试剂的ph在2至5、例如2.5至5、优选地3至5、更优选地3至4.5的范围内。
[0264]
35.根据条目34所述的方法,其中所述酸性试剂包含缓冲剂,优选为基于羧酸的缓冲剂,任选地其中所述基于羧酸的缓冲剂具有一个或多个下述特征:
[0265]-所述基于羧酸的缓冲剂包含羧酸和所述羧酸的盐,其中优选地所述羧酸(i)包含1至3个羧酸基团,(ii)是脂族的,和/或(iii)是饱和的;
[0266]-所述基于羧酸的缓冲剂包含1个羧基;和/或
[0267]-所述基于羧酸的缓冲剂是乙酸盐缓冲剂,任选地由乙酸钠/乙酸缓冲剂提供。
[0268]
36.根据条目34或35所述的方法,其中所述步骤(aa)中的ev结合混合物包含来自于所述酸性试剂的缓冲剂,其浓度为100mm至1m,优选地<1m,例如200mm至700mm、300mm至600mm或350mm至550mm,任选地其中所述缓冲剂是乙酸盐。
[0269]
37.根据条目1至36中的一项或多项所述的方法,其中在步骤(aa)中,用于将细胞外囊泡与阴离子交换粒子结合的所述结合混合物的ph低于所述粒子的阴离子交换基团的离子化形式的pka,任选地其中所述ph比所述pka低至少1、至少1.5、至少2或至少2.5个单位。
[0270]
38.根据条目1至37中的一项或多项所述的方法,其中在步骤(aa)中,所述结合混合物的ph对应于为调节结合条件而添加的酸性试剂的ph,或与其偏离≤1、≤0.75或优选地≤0.5个ph单位。
[0271]
39.根据条目1至38中的一项或多项所述的方法,其中在步骤(aa)中使用磁性阴离子交换粒子。
[0272]
40.根据条目1至39中的一项或多项所述的方法,其中所述阴离子交换粒子具有一个或多个下述特征:
[0273]
(i)它们在粒子表面处包含阴离子交换基团;
[0274]
(ii)它们包含相同或不同类型的阴离子交换基团;
[0275]
(iii)所述阴离子交换基团通过共价附连,任选地使用基于碳二亚胺的反应,特别是通过所述粒子的羧基与所述阴离子交换基团中包含的氨基的反应,附连到所述粒子的表面。
[0276]
41.根据条目1至40中的一项或多项所述的方法,其中所述阴离子交换基团包含至少一个可离子化基团作为官能团,其中优选地所述可离子化基团可以通过质子化作用离子化。
[0277]
42.根据条目1至41中的一项或多项所述的方法,其中所述阴离子交换基团的可离子化基团作为单体、寡聚物或聚合物提供在所述粒子的表面上。
[0278]
43.根据条目1至42中的一项或多项所述的方法,其中所述粒子包含每个阴离子交换基团含有至少一个可离子化基团的阴离子交换基团和连接物或间隔物组成部分。
[0279]
44.根据条目1至43中的一项或多项所述的方法,其中所述粒子包含含有至少一个氨基作为可离子化基团的阴离子交换基团。
[0280]
45.根据条目1至44中的一项或多项所述的方法,其中所述粒子包含含有至少一个伯氨、仲氨或叔氨基的阴离子交换基团。
[0281]
46.根据条目1至45中的一项或多项所述的方法,其中所述粒子的阴离子交换基团包含选自下述结构式的伯胺、仲胺和叔胺的基团
[0282]
(r)3n、(r)2nh、rnh2和/或x-(ch2)
n-y
[0283]
其中
[0284]
x是(r)2n、rnh或nh2,
[0285]
y是(r)2n、rnh或nh2,
[0286]
r各自独立地是任选取代的直链、支链或环状烷基、烯基、炔基或芳基取代基,其可以包含一个或多个优选地选自o、n、s和p的杂原子,并且
[0287]
n是0至20、优选地0至18范围内的整数。
[0288]
47.根据条目1至46中的一项或多项所述的方法,其中所述阴离子交换基团包含至少一个氨基,其中所述氨基是杂环或杂芳环的一部分。
[0289]
48.根据条目47所述的方法,其中所述氨基是咪唑环的一部分。
[0290]
49.根据条目48所述的方法,其中所述阴离子交换基团包含组氨酸或组胺或它们的能够结合细胞外核酸和ev的衍生物。
[0291]
50.根据条目1至49中的任一项所述的方法,其中所述阴离子交换基团包含离子化形式、优选为质子化形式的pka值≤8.0或≤7.5的可离子化基团。
[0292]
51.根据条目1所述的方法,其中所述阴离子交换基团包含离子化形式、优选为质子化形式的pka值在选自4.0至8.0或4.5至7.5、优选地5.0至7.5例如5.5至7.5或5.5至7.0的范围内的可离子化基团。
[0293]
52.根据条目1至51中的一项或多项所述的方法,其中所述阴离子交换基团包含至少一个可离子化基团,其中所述基团可以通过质子化作用离子化,其中所述可离子化基团在步骤(aa)的结合混合物的酸性ph下质子化,而在碱性ph下,例如在至少8或至少8.5的碱性ph下是中性或不带电荷的。
[0294]
53.根据条目1至52中的一项或多项所述的方法,其中所述粒子包含在步骤(aa)
和/或步骤(cc)的结合混合物的ph下,任选地在≥3至≤6或≥3.5至≤5.5的范围内的ph下,每个阴离子交换基团具有单个正电荷的阴离子交换基团。
[0295]
54.根据条目1至53中的任一项所述的方法,其中所述阴离子交换基团包含每个阴离子交换基团数目为n的可离子化基团,其中数目n选自1至300、1至250或1至200的范围,任选地其中所述阴离子交换基团选自下述阴离子交换基团:
[0296]
(i)所述阴离子交换基团包含每个阴离子交换基团30至300或50至250个可离子化基团,任选地其中这些阴离子交换基团由聚组氨酸提供;
[0297]
(ii)所述阴离子交换基团包含每个阴离子交换基团2至《30个可离子化基团,例如每个阴离子交换基团3至25、4至20、5至18、6至15或8至12个可离子化基团,任选地其中这些阴离子交换基团由寡聚组氨酸基团提供;或
[0298]
(iii)所述阴离子交换基团包含每个阴离子交换基团1至5个可离子化基团,例如每个阴离子交换基团1至4或1至3个可离子化基团,特别是每个阴离子交换基团1、2或3个可离子化基团。
[0299]
55.根据条目54所述的方法,其中所述可离子化基团由氨基提供。
[0300]
56.根据条目55所述的方法,其中所述可离子化氨基被包含在聚合物中,任选地其中所述聚合物是:
[0301]
(i)聚烷基亚胺,任选地选自聚乙烯亚胺、聚丙烯亚胺或聚丁烯亚胺,优选为聚乙烯亚胺,或
[0302]
(ii)是包含咪唑基团的聚合物,例如聚组氨酸。
[0303]
57.根据条目1至56中的任一项所述的方法,其中在步骤(aa)中使用的所述粒子的阴离子交换基团选自(i)聚乙烯亚胺;(ii)聚组氨酸,其中组氨酸单体的数目为至少30;(iii)寡聚组氨酸,其中组氨酸单体的数目在4至18,例如5至16、6至14、7至13或优选地8至12的范围内;和(iv)组胺。
[0304]
58.根据条目1至57中的任一项所述的方法,其中所述阴离子交换基团具有每个阴离子交换基团1500da或更低、1000da或更低、500da或更低或300da或更低的分子量。
[0305]
59.根据条目1至57中的任一项所述的方法,其中所述阴离子交换基团具有每个阴离子交换基团低于35000da或低于30000da的分子量。
[0306]
60.根据条目2至59中的任一项所述的方法,其中洗脱步骤(ff)使用一种或多种洗脱溶液来进行。
[0307]
61.根据条目60所述的方法,其中所述洗脱溶液具有优选为至少8.0、至少8.3或至少8.5的碱性ph,并且其中优选地所述洗脱溶液的ph≤9或<9。
[0308]
62.根据条目60或61所述的方法,其中所述洗脱溶液包含任选地选自tris、hepes、hpps或氨缓冲剂的缓冲剂,优选为tris。
[0309]
63.根据条目60至62中的任一项所述的方法,其中洗脱包括加热步骤。
[0310]
64.根据条目60至63中的任一项所述的方法,其中所述具有根据条目61至63中的任一项所述的特征的洗脱溶液,与包含在由所述洗脱溶液提供的洗脱条件下释放出结合的rna的阴离子交换基团的阴离子交换粒子相组合使用。
[0311]
65.根据条目64所述的方法,其中所述阴离子交换基团包含每个阴离子交换基团至少一个氨基,任选地1至20或1至15个氨基。
[0312]
66.根据条目65所述的方法,其中所述氨基是咪唑环的一部分。
[0313]
67.根据条目66所述的方法,其中所述阴离子交换基团包含组氨酸或组胺。
[0314]
68.根据条目64至67中的任一项所述的方法,其中所述粒子的阴离子交换基团选自(i)寡聚组氨酸,其中组氨酸单体的数目在4至18,例如5至16、6至14、7至13或优选地8至12的范围内,和(ii)组胺基团,任选地其中所述阴离子交换基团包含每个阴离子交换基团1个组胺基团。
[0315]
69.根据条目60至68中的任一项所述的方法,其中所述洗脱溶液中的总盐浓度为500mm或更低,例如250mm或更低、200mm或更低、150mm或更低或100mm或更低,任选为50mm或更低。
[0316]
70.根据条目60至68中的任一项所述的方法,其中所述洗脱溶液中的总盐浓度为至少500mm,例如至少750mm、至少1m或至少1.2m。
[0317]
71.根据条目60至68中的任一项所述的方法,其中所述洗脱溶液是提取缓冲液,任选地其中所述洗脱溶液具有至少一个下述特征:
[0318]
(i)它包含苯酚
[0319]
(ii)它包含离液盐,任选地选自胍盐、硫氰酸盐、碘化物盐、高氯酸盐、三氯乙酸盐和三氟乙酸盐
[0320]
任选地,其中所述洗脱溶液具有至少7.5或至少8的ph。
[0321]
72.根据条目1至71中的任一项所述的方法,其中步骤(bb)还包括清洗分离的阴离子交换粒子。
[0322]
73.根据条目1至72中的任一项所述的方法,其中在步骤(bb)和(dd)中,所述阴离子交换粒子通过离心、沉降或磁性分离来分离,其中优选地使用在磁场帮助下分离的磁性阴离子交换粒子。
[0323]
74.根据条目1至73中的任一项所述的方法,其包括执行一个或多个清洗步骤(ee)。
[0324]
75.根据条目1至74中的任一项所述的方法,其中所述方法包括(gg)分析洗脱的rna分子。
[0325]
76.根据条目1至75中的任一项所述的方法,其中磁性阴离子交换粒子被用于在步骤(aa)中结合所述细胞外囊泡,并且其中所述方法的一个或多个步骤使用在磁场帮助下移动磁性粒子的自动化系统来进行,任选地其中步骤(aa)至(dd)以自动化方式进行。
[0326]
77.根据条目1至76中的任一项所述的方法,其中所述包含细胞外囊泡的样品是体液或源自于体液。
[0327]
78.根据条目77所述的方法,其中所述样品是通过除去细胞从体液获得的样品。
[0328]
79.根据条目77或78所述的方法,其中所述样品是无细胞或除细胞体液样品。
[0329]
80.根据条目77至79中的任一项所述的方法,其中所述无细胞或除细胞体液样品是下述样品或通过除去细胞从下述样品衍生:全血,血浆,血清,淋巴液,尿液,清液,脑脊液,腹水,乳汁,支气管灌洗液,唾液,羊水,精液,身体分泌物,鼻腔分泌物,阴道分泌物,伤口分泌物和排泄物。
[0330]
81.根据条目77至80中的任一项所述的方法,其中所述样品选自血浆、血清和尿液,其中尿液优选为除细胞或无细胞尿液。
[0331]
82.根据条目1至81中的任一项所述的方法,其中在步骤(a)之前,所述方法包括从体液样品除去细胞,从而提供除细胞体液样品作为包含细胞外囊泡的样品,其中在步骤(aa)中将所述样品与所述阴离子交换粒子并优选地与酸性试剂例如结合缓冲液接触,以制备所述酸性结合混合物。
[0332]
83.根据条目1至76中的任一项所述的方法,其中所述样品是包含细胞外囊泡的细胞培养上清液。
[0333]
84.根据条目1至83中的任一项所述的方法,其中在步骤(aa)之前,对包含细胞外囊泡的除细胞或无细胞生物样品进行去除dna步骤,特别是通过将dna例如细胞外dna结合到包含阴离子交换基团的粒子并从结合混合物分离出结合的dna,从而提供包含细胞外囊泡的去除dna的样品,使其经历根据前述条目中的任一项所述的方法的步骤(aa),用于将细胞外囊泡结合到所述阴离子交换粒子。
[0334]
85.根据条目1至84中的任一项所述的方法,其中所述方法包括:
[0335]
(a)制备结合混合物,其包含
[0336]-包含细胞外囊泡的生物样品,其中优选地所述生物样品是除细胞或无细胞体液样品,
[0337]-阴离子交换粒子,
[0338]-包含缓冲剂的酸性结合缓冲液,
[0339]
并将细胞外dna结合到所述粒子;
[0340]
(b)从结合混合物中分离出带有结合的细胞外dna的粒子,其中剩余的结合混合物提供包含细胞外囊泡的样品;并且
[0341]
(c)使用包括根据前述条目、特别是条目1至76中的任一项所述的步骤(aa)至(dd)的方法,从提供包含细胞外囊泡的样品的所述剩余的结合混合物富集细胞外囊泡。
[0342]
86.一种用于执行根据条目1至85中的任一项所述的方法的试剂盒,其包含:
[0343]
(a)阴离子交换粒子,
[0344]
(b)酸性试剂,优选为酸性缓冲液;
[0345]
(c)酸性裂解试剂,优选为不同于酸性试剂(b)并包含去污剂的缓冲液;
[0346]
(d)任选的一种或多种清洗溶液;和
[0347]
(e)任选的一种或多种洗脱溶液。
[0348]
87.根据条目86所述的试剂盒,其中所述阴离子交换粒子如条目39至59中的任一项中所定义。
[0349]
88.根据条目86或87所述的试剂盒,其中优选为缓冲液的所述酸性试剂如条目34至38中的任一项中所定义。
[0350]
89.根据条目86至88中的任一项所述的试剂盒,其中优选为缓冲液的所述酸性裂解试剂包含如条目3至15中的任一项中所定义的去污剂。
[0351]
90.根据条目86至89中的任一项所述的试剂盒,其中优选为缓冲液的所述酸性裂解试剂如条目2或16至24中的任一项中所定义。
[0352]
91.根据条目86至90中的任一项所述的试剂盒,其中所述试剂盒包含洗脱溶液,其中所述洗脱溶液如条目61至71中的任一项中所定义,和/或蛋白水解酶。
[0353]
本发明不受本文公开的示例性方法和材料的限制,并且与本文描述的方法和材料
相似或等效的任何方法和材料都可以用于本发明实施方式的实践或测试。数字范围包括定义范围的数字。本文提供的标题不是对本发明的各个不同方面或实施方式的限制,其可以通过参考整个本说明书来阅读。
[0354]
当在主题说明书、条目和权利要求书中使用时,没有具体数目的指称包括复数的情况,除非上下文另有明确规定。术语“包括”、“具有”、“包含”和它们的变体被同义地使用,并且应被解释为是非限制性的。可能存在其他组分和步骤。在整个本说明书中,在组合物被描述为包含组分或材料的情况下,另外设想了所述组合物可以在也基本上由所列举的组分或材料的任何组合构成或由所述组合构成的实施方式中,除非另有描述。对“本公开”和“本发明”等的指称包括本文中教导的单个或多个方面;以此类推。本文中教导的方面被术语“发明”涵盖。
[0355]
优选地选择和组合本文中描述的优选实施方式,并且由优选实施方式的相应组合产生的特定主题内容也属于本公开。
[0356]
实施例
[0357]
应当理解,下述实施例仅用于说明目的,而不应被解释为以任何方式限制本发明。下述实施例证实了根据本公开的方法允许从包含细胞外囊泡(ev)的生物样品有效地富集cfrna。ev被结合到包含阴离子交换基团的固体粒子。在结合并优选地清洗结合的ev后,通过执行基于去污剂的裂解步骤释放出包括囊泡rna在内的ev内含物。有利的是,所使用的裂解条件允许释放的cfrna直接结合到用于捕获ev的阴离子交换粒子。然后可以清洗结合的cfrna并将其从阴离子交换粒子上洗脱。这个工作流程非常有利,因为它只需几个步骤,并且通过使用磁性阴离子交换粒子而适合于自动化。
[0358]
1.实施例1:磁性阴离子交换粒子
[0359]
在实施例中使用的磁性阴离子交换粒子(也被称为“磁珠”)如下所述来制备。使用基于碳二亚胺的偶联将带有羧基表面基团的磁珠偶联到不同的阴离子交换基团。作为配体,偶联了下述阴离子交换基团:
[0360]-聚乙烯亚胺(pei
–“
axph”珠),
[0361]-聚组氨酸(5,000-25,000g/mol,n=32-160),
[0362]-his-10(寡聚组氨酸,n=10),和
[0363]-组胺。
[0364]
其他阴离子交换基团也可用于根据本公开的方法中。具体来说,可以有利地使用包含其中质子化形式具有5.5至9、例如6至8左右的pka值的官能团的阴离子交换基团,以便于结合的rna的后续洗脱。可以使用与上述相同的偶联化学或不同的偶联化学,将所述阴离子交换基团作为配体偶联到磁珠。适合的偶联策略在本领域中是公知的。
[0365]
2.实施例2:ev的结合、裂解和rna的再结合
[0366]
实施例2演示了使用结合到阴离子交换粒子的ev的基于去污剂的裂解和释放的囊泡rna的即时再结合的工作流程。
[0367]
ev结合
[0368]
使用人类血浆(合并物)作为包含ev的生物样品的核心实例。将1ml人类血浆与1ml酸性ev结合缓冲液进行接触。在实施例2中使用的所述ev结合缓冲液包含乙酸盐缓冲剂(在这里是465mm)并具有低于5的ph(在这里是ph 4),并颠倒5次。然后将2ml所述混合物添加到
axph或组胺珠(参见实施例1)以便制备结合混合物,然后对所述结合混合物进行10min上下颠倒温育。将带有结合的ev的磁性阴离子交换粒子磁性分离2min并除去上清液。将分离的粒子用1ml清洗缓冲液(例如乙酸盐,ph 5,235mm盐)清洗以除去样品残留物,并分离2min。除去清洗缓冲液。
[0369]
ev裂解和释放的囊泡rna的结合
[0370]
通过添加400μl包含去污剂和缓冲剂的酸性裂解试剂(在这里是235mm乙酸盐缓冲液、2%triton x-100或2%ecosurf sa-9,ph 4),将结合到阴离子交换珠的ev裂解,以便释放出囊泡rna。为了消化可能污染的蛋白质,向某些样品添加蛋白水解酶(在这里是蛋白酶k)以支持裂解。将所述样品上下颠倒温育10min。正如本文公开的,这些ev裂解条件有效地裂解ev,从而释放出囊泡rna。此外,所述ev裂解条件促进所述释放的囊泡rna与所述粒子的阴离子交换基团的结合,因为所述ev裂解条件提供了适合的rna结合条件。因此,在ev裂解和释放的囊泡rna的即时再结合后,获得带有结合的cfrna的阴离子交换粒子。然后将磁性粒子分离3min。
[0371]
为了比较,对于某些样品可以省略所述基于去污剂的裂解步骤,并通过添加qiazol(参见下文)直接处理带有结合的ev的阴离子交换粒子。它的目的是显示ev结合到所述阴离子交换粒子。此外它允许确定在基于去污剂的ev裂解和cfrna结合步骤期间囊泡rna是否被有效释放并重新结合到阴离子交换珠。
[0372]
基于qiazol的洗脱
[0373]
然后,将所述阴离子交换珠分离,在qiazol中洗脱,并根据mirneasy方案进行rna分离:
[0374]
将700μl qiazol(qiagen)这种基于苯酚/胍的裂解试剂(调整到ph 8)添加到所述阴离子交换粒子,用于结合的分析物的洗脱/裂解。cfrna在这些条件下从所述珠子释放。此外,ev在这些条件下裂解,从而释放出囊泡rna(参见其中省略了基于去污剂的裂解步骤并将所述带有结合的ev的珠子直接处理的对照)。将所述样品简短地涡旋振荡,然后进行3min上下颠倒的温育。将所述阴离子交换粒子分离2min,并将包含cfrna的qiazol洗脱液/上清液转移到2ml反应管中。添加90μl氯仿,涡旋振荡(20sec),并在室温温育2-3min。为了分离包含回收的cfrna的水性相,在4℃下以12000g进行15min离心。然后使用mirneasy micro方案(qiagen)从洗脱液纯化cfrna。因此,将所述水性相转移到新的2ml反应管中,然后添加2x体积的etoh(100%)并混合。将结合混合物施加到rneasy minelute离心柱(8000xg离心15sec,载样两次),然后清洗并洗脱结合的cfrna。
[0375]
参比
[0376]
作为参比,将1ml相同血浆的等分试样按照exorneasy工作流程(qiagen),使用exoeasy柱进行处理,使用或不使用含有2%triton或ecosurf的额外清洗步骤。
[0377]
分析
[0378]
使用qpcr测定法,对分离的mrna和mirna进行eef2(mrna,quantitect测定法)、let-7a和mir-122(两者均使用mircury lna测定法)的定量。
[0379]
囊泡rna:mrna eef2,mirna let-7a;和
[0380]
非囊泡rna:mir-122。
[0381]
结果
[0382]
结果示出在图1a-c中。
[0383]
结果显示,在根据本公开的方法中使用的基于去污剂的裂解步骤允许高效裂解ev,并将释放的囊泡rna结合到与用于ev结合相同的阴离子交换珠。mrna回收率高。
[0384]
所述结果表明,在使用axph珠而不进行根据本发明的额外的去污剂裂解和再结合步骤时,以与exorneasy相近的效率回收到mrna。在所使用的条件下,ev与组胺珠的结合效率较低。令人吃惊的是,当在工作流程中包含基于去污剂的裂解和rna结合步骤时,对于测试的所有三种结合基质来说,mrna回收率不是仅仅与参比exorneasy相当,而是事实上提高,特别是在也包含使用蛋白酶k的蛋白水解酶消化步骤时。因此,当包含基于去污剂的ev裂解和rna结合步骤时,囊泡mrna(eef2,参见图1a)以提高的效率被回收。这是一个重要的改进,因为囊泡mrna是一种重要的靶分析物。
[0385]
对于主要出现在来自于健康供体的血浆中的ev内的let-7amirna来说(图1b),在不使用基于去污剂的裂解的情况下,在axph与组胺珠之间回收率相当,并接近于exorneasy。当包含基于去污剂的裂解时,回收率实际略微下降,表明用于短mirna与阴离子交换珠的结合条件需要进一步改进。这可以通过改变所使用的ev裂解缓冲液,以在裂解期间建立也允许短mirna的高效结合的条件来实现。或者,可以在ev裂解后添加结合试剂以改进结合条件,从而促进释放的mirna的结合。
[0386]
对于主要出现在ev外部并因此在使用exorneasy时不被高效回收的mir-122来说(图1c),使用组胺珠的回收率与exorneasy相当,并在包含去污剂裂解时略微下降。当使用axph珠时回收率高得多,表明在ev结合步骤期间不仅ev被捕获,而且此外存在于血浆样品中的游离ago2-mirna复合体也被捕获。因此,除了囊泡rna之外,根据本公开的方法也允许回收非囊泡rna。因此,也可以有利地分离总cfrna。
[0387]
总而言之,所述基于去污剂的裂解步骤允许高效裂解结合到阴离子交换粒子的ev,并在同时能够将释放的囊泡rna直接结合到与用于结合所述ev相同的阴离子交换粒子。对于测试的所有三种结合基质来说,使用基于去污剂的裂解步骤时囊泡mrna eef2的得率提高。通过用蛋白水解酶消化步骤(例如使用蛋白酶k)支持裂解,可以改进ev的裂解和rna的回收,正如通过甚至更高的得率所证实的。
[0388]
3.实施例3:将不同洗脱溶液用于不同阴离子交换珠
[0389]
实施例2显示,根据本公开的方法提供了一种用于富集囊泡rna(和任选的非囊泡rna)的高效工作流程,其只需几个步骤即可实现囊泡rna/cfrna与阴离子交换相的结合。这一点和使用磁性阴离子交换粒子的可能性,使得根据本发明的方法特别适合于自动化。然后对提供的带有结合的cfrna的阴离子交换粒子进行清洗以除去样品残留物,然后可以将所述cfrna洗脱。为了减少实际操作时间并提供适合于自动化的包括最终洗脱步骤的方法,与实施例2的基于qiazol的工作流程相比需要更少步骤并且更加简单的洗脱步骤是合乎需要的。这可以通过进行其中将所述带有结合的rna的阴离子交换粒子与洗脱溶液在碱性ph下进行接触的洗脱步骤来实现。
[0390]
实施例3验证了所述结合到阴离子交换珠的rna可以在中等ph下洗脱。为了分析不同的洗脱条件,将以前分离的rna用作试验样品。将20或400ng来自于大鼠肝脏的rna在ph 4的233mm乙酸盐缓冲液中与225μg具有pei、聚组氨酸(p-his)、寡聚组氨酸(10-his)或组胺官能团的磁珠温育,用于将所述rna结合到所述阴离子交换粒子。然后使用相同的乙酸盐缓
冲液清洗所述粒子,并用下述溶液顺序洗脱:
[0391]
(1)100μl 200mm tris,ph 8.5,
[0392]
(2)100μl 200mm tris,1m nh4cl ph 8.5,和
[0393]
(3)500μl调节到ph 8的qiazol(ph 8的qiazol通过向700μlqiazol添加150μl 2m tris碱、2m硫氰酸胍来制备),
[0394]
以确定在每种条件(从最温和到最严苛条件,即从(1)至(3))下,有多少rna在结合到阴离子交换粒子后可以从其洗脱。
[0395]
向洗脱液(1)和(2)添加500μl qiazol,并遵照标准的mirneasy micro方案从所有3种原始洗脱液重新分离rna。为了参比,将20和400ng rna直接添加到qiazol,并遵照相同的工作流程进行分离。
[0396]
使用qpcr测定法对所述分离的rna的β-肌动蛋白(mrna,quantitect测定法)和mir-16(mircury lna测定法)进行定量。
[0397]
结果
[0398]
结果示出在图2中。实施例3显示,通过添加不同的洗脱溶液,可以从阴离子交换粒子成功地洗脱结合的rna。总而言之,不同阴离子交换粒子和洗脱条件可以有利地用于根据本公开的提取rna的方法。所述结果表明,使用温和或中等的洗脱条件,可以从所述测试的阴离子交换粒子洗脱rna。
[0399]
β-肌动蛋白和mir-16的qpcr测定的结果示出在图2的上图中。在ph 8.5下,使用低盐缓冲液,rna从pei包被的珠子的洗脱不太有效。然而,在1m氯化铵存在下rna被高效洗脱(一些剩余的rna只被qiazol洗脱)。因此,使用ph 8.5的含有1m氯化铵的tris的洗脱,提供了适合的温和洗脱条件。
[0400]
令人吃惊的是,使用p-his珠时,使用ph 8.5的tris在低盐缓冲液中进行的rna洗脱在低rna输入量下是无效的。使用ph 8.5的含有1m氯化铵的tris缓冲液进行的洗脱的效率约为60-80%。因此,在这里更严苛的洗脱条件是优选的。
[0401]
使用ph 8.5的tris,rna从10-his和组胺珠高效洗脱。用更严苛的洗脱缓冲液洗脱的剩余rna的浓度降低超过10倍(由在晚3个pcr循环后检测到所指示),证实了rna已被ph 8.5的tris高效洗脱。
[0402]
在其他实验中,证实了使用10mm tris也可实现rna的洗脱。因此,在适合于自动化的示例性工作流程中,将包含ev的生物样品(例如血浆)与酸性结合缓冲液和用于结合ev的包含组胺基团的磁性阴离子交换粒子进行接触。在清洗后,优选地在蛋白酶k存在下(参见实施例2)进行基于去污剂的ev裂解和rna结合步骤。在分离并清洗带有结合的cfrna的组胺珠后,使用ph 8.5的10mm tris将结合的rna洗脱。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1