一种花椒内生放线菌HJG-5及其应用
一种花椒内生放线菌hjg
‑
5及其应用
技术领域
1.本发明属于微生物发酵及应用技术领域,具体涉及一种花椒内生放线菌hjg
‑
5及其应用。
背景技术:
2.植物病害是威胁农业生产的主要因素之一,而目前在我国的农业生产中,化学合成农药由于抗菌谱广、防效高、见效快的特点,在病害防治上一直占据主要地位,但随着其长期超用、滥用、误用造成的3r问题也越来越严重。随着可持续发展观念的深入人心以及人们对食品安全的关注,寻求安全、高效、符合可持续发展理念的新的防治途径,成为了植物病害防治亟待解决的课题。利用微生物或其代谢产物防治病害,因其高效低毒、选择性强,对生态环境影响小且兼具增产增收等特点,成为当前的研究热点。植物内生放线菌与其寄主在共生过程中,形成了和谐的关系,其寄主广泛、种类复杂多样,产生的抑菌活性物质种类繁多,具有广阔的应用前景。verma等从azadirachta indicaa.juss的根部组织中分离得到三株内生链霉菌,发现其悬浮液处理种子后,可显著促进植株的生长,并可抑制链格孢病原菌的生长繁殖。misk等人从澳大利亚的多种植物中分离得到11株内生放线菌,发现其均可抑制疫霉根腐病菌的生长,且菌株wra1可显著促进植株生长。王真真等从水稻植株中分理筛选出一株可显著抑制稻瘟病菌生长的内生放线菌
‑
米修链霉菌osirt
‑
1,大田条件下对水稻苗瘟、穗瘟的防效分别为7.76%、25.65%。因此,筛选植物内生拮抗放线菌,研究其生防作用与生防机制,对微生物农药的实际生产应用具有重要的现实意义。
3.花椒既可作香料的原料又可入药。其药用价值在《神农本草经》和《本草纲目》中均有记载,可散寒除湿,温中止痛。韩胜男发现花椒挥发油对hela、a549、k562有较强的抑制作用。ge,paul等从花椒中提取的化合物中的一种主要成分可抑制麦蛾产卵,且对其幼虫有较强的拒食作用。singh等研究发现花椒精油不能控制米象的繁殖但是可保护小麦免受损害。navarrete等发现花椒茎皮煎煮后可减少羊体内肠线虫的数量,其氯仿提取物α
‑
山椒素对蛔虫有剧烈毒性。paik等发现花椒果皮挥发性物质可抑制hepg2肝癌细胞。但是目前对花椒内生放线菌的研究还未见相关报道。
4.近年来,化学农药的大量使用导致农产品出口受限,抗药性,环境污染等问题的产生,急需要开发新型高效、广谱、低毒、环保的生物抑菌剂。
技术实现要素:
5.本发明提供一种花椒内生放线菌hjg
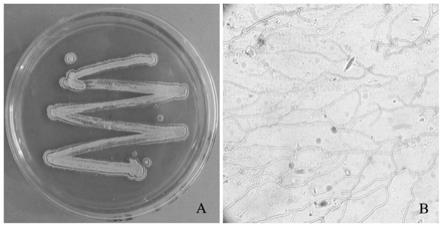
‑
5,菌株hjg
‑
5的发酵液中含有促生长活性物质能够促进植物生长,而且含有高效、广谱、低毒、环保的抑菌活性物质能够起到很好的抑菌作用。
6.一种花椒内生放线菌hjg
‑
5,名称为:hjg
‑
5,分类名称为:肉桂粟色链霉菌streptomycescinnamocastaneus,保藏编号为:cgmcc no.14969,保藏日期:2017年11月30日,保藏单位为:中国微生物菌种保藏管理委员会普通微生物中心,北京市朝阳区北辰西路
1号院3号中国科学院生物研究所。
7.进一步地,通过分子生物学研究确定,hjg
‑
5菌株可以归为肉桂粟色链霉菌。
8.更进一步地,花椒内生放线菌hjg
‑
5菌株在燕麦粉琼脂培养基上培养2
‑
3d,菌落表面光滑呈白色,培养至第6d后开始有白色的气生菌丝从菌落边缘长出,8d后开始逐渐变为浅灰色;培养过程中菌落形态为圆锥形隆起,菌落边缘有4
‑
6圈的同心轮纹,外围有晕状壤边;通过显微观察,气生菌丝发达、分支较多,基内菌丝无横隔、不断裂。
9.更进一步地,花椒内生放线菌hjg
‑
5菌株的培养特征为,在isp2、pda和营养琼脂上菌落表面隆起呈致密的绒粉状,气生菌丝发达,为白色或灰白色,基内菌丝棕黄色或黄褐色;在isp5上气生菌丝为浅灰色,基内菌丝为淡鹅黄色;在isp4、察氏和高氏一号培养基上生菌丝稀薄,多呈很淡的白灰色,无基内菌丝;在isp3上几乎不生长。
10.更进一步地,花椒内生放线菌hjg
‑
5菌株可产黑色素,可使部分明胶液化,硝酸盐还原为阳性,淀粉水解,牛奶凝固并胨化,不产生h2s,纤维素上不生长;不能利用淀粉、木糖、阿拉伯糖和果糖,能利用葡萄糖、麦芽糖、蔗糖、乳糖、甘露醇和甘油。
11.一种花椒内生放线菌hjg
‑
5在生产促生长活性物质、广谱抑菌活性物质方面的用途。
12.进一步地,所述促生长活性物质、广谱抑菌活性物质来源于前述hjg
‑
5菌株发酵培养后的发酵液。
13.更进一步地,前述hjg
‑
5菌株发酵培养的发酵培养基中碳源为麦芽糖,氮源为胰蛋白胨;且麦芽糖:胰蛋白胨的配比为2:1。
14.更进一步地,前述hjg
‑
5菌株发酵培养的培养条件为转速180r
·
min
‑
1,ph=8,装液量125ml/250ml,接种量8%,培养温度为28℃,培养时间为9d。
15.更进一步地,前述发酵液具有较好的热稳定性,80℃以下抑菌率维持在80%左右,在中性和弱碱性环境下非常稳定;经紫外照射不改变抑菌活性;4℃条件下,贮存稳定性良好,放置90d后,对a.solani的抑制率能达到原始发酵液抑菌活性的85.15%。
16.更进一步地,前述发酵液稀释20倍时,促生长作用和抑菌作用最优;20倍稀释的发酵液处理番茄种子后发芽指数相对于ck提高了16.75%;番茄幼苗株高,根长,鲜重、干重也较ck组分别提高了29.0%、 20.4%、24.9%、35.9%,均有显著增长。
17.本发明的有益之处在于:本发明中的一种花椒内生放线菌hjg
‑
5是从花椒的各组织中分离纯化筛选到的抑菌谱广、抑菌效果显著的菌株;菌株hjg
‑
5的发酵液中含有促生长活性物质和广谱抑菌活性物质,为丰富生物农药天然资源和微生物农药的开发研究奠定了基础。
附图说明
18.图1是本发明的一种花椒内生放线菌hjg
‑
5对12种病原菌的抑制作用图;
19.图2是本发明的一种花椒内生放线菌hjg
‑
5发酵滤液对12种病原菌的抑制作用图;
20.图3是本发明的一种花椒内生放线菌hjg
‑
5菌落和气生菌丝形态特征图;
21.图4是本发明的一种花椒内生放线菌hjg
‑
5的16srdna扩增产物电泳结果图;
22.图5是本发明的一种花椒内生放线菌hjg
‑
5系统发育树;
23.图6发明的一种花椒内生放线菌hjg
‑
5生长及抑菌活性物质的产量图;
libanotis),核桃腐烂病菌(monilinia laxa),桃褐腐病菌(moniliniafructicola),均由山西农业大学农药学实验室保存。
52.1.4供试化学试剂
53.ch4o、c6h
14
、c4h8o2、chcl3、ch2cl2、ch3(ch2)3oh、hcl、naoh。
54.1.5供试仪器
55.hzq
‑
qx全温震荡培养箱,uv
‑
754紫外可见分光光度计,hd
‑
920超净工作台,st16r冷冻离心机, alpcl
‑
32l高温灭菌锅,旋转蒸发仪,s
‑
234分析天平,电热恒温培养箱,dds
‑
11a电导仪。
56.2.实验方法
57.2.1花椒内生拮抗放线菌的分离筛选
58.2.1.1植物样品的采集
59.选择长势良好,健康的花椒植株的根茎叶果实进行采集,保鲜袋内4℃冰箱保存并用标签纸标记,于一周内尽快处理。
60.2.1.2内生放线菌的分离纯化
61.植物样品的预处理:将采集回的样品在水流下冲洗干净后,用超声清洗仪彻底清洗干净样品表面残存的杂质。将样品用无菌刀切割成2cm小段后,75%的酒精中浸泡3min、无菌水冲洗2次,3%的naclo中浸泡3min,无菌水冲洗3次,再至75%酒精浸泡1min后,无菌水冲洗3次后于灭菌的干燥滤纸片上晾干。
62.组织匀浆法分离菌株:将消毒后的材料于研钵中加入10ml无菌水研磨,静止15min,取上清液80μl 涂布于含k2cr2o7750μg/ml高氏1号平板,28℃培养2
‑
3周,每天观察记录菌落情况,一经发现有菌落长出,立即挑取,根据菌落表观特征,大小,可溶性色素有无等在高氏培养基上划线培养,多次纯化后编号并斜面保藏。
63.表面消毒结果检验:取最后一次冲洗水80μl涂布于高氏一号平板上,同等条件培养,作为对照用于检验表面消毒是否彻底。
64.2.1.3内生拮抗放线菌的筛选
65.(1)初筛
66.采用四点平板对峙法,取培养6
‑
7天的b.cinerea和a.solani,用打孔器制作ф5mm的菌饼,接于pda 平板中央,在距其2cm处十字接种供试的放线菌,28℃培养,7天后测量病原菌直径,计算抑菌率,以只接种病原菌为ck,每处理实验3次重复。
[0067][0068]
(2)复筛
[0069]
将待测放线菌接种于pda培养基上,28℃,培养7d后,打取2个ф为5mm的菌饼,接入种子培养液 (100ml/250ml)中,28℃、160r
·
min
‑1摇瓶培养48h,得到种子液,将其按10%(v/v)的接种量接入 200ml/500ml发酵培养基中,28℃,160r
·
min
‑1,摇瓶培养7d后,得到菌株的发酵液。发酵液经12000r
·
min
‑1离心,0.22μm微孔滤膜过滤得到发酵滤液。
[0070]
采用生长速率法,将发酵滤液与pda培养基按1:9混匀制备平板。待平板凝固后,将ф5mm的a.solani 菌块接入中央,28℃下培养6
‑
7d后,十字交叉法测定病菌直径,计算抑菌率。3次重复,以空白pd培养液为ck。
[0071]
2.2内生放线菌hjg
‑
5的分类鉴定
[0072]
2.2.1形态特征观测
[0073]
采用插片法将hjg
‑
5菌株接种在pda培养基上,28℃下培养7d
‑
21d,期间每隔5d取埋片于光学显微镜下观察,根据《链霉菌鉴定手册》和《放线菌的分类和鉴定》进行初步鉴定,主要观察菌落形态,基内菌丝、气生菌丝生长形态;基内菌丝有无横隔、断裂等特征。
[0074]
2.2.2培养特征观察
[0075]
选用高氏1号、isp 2、isp3、isp 4、isp 5、马铃薯琼脂、营养琼脂、察氏琼脂8种培养基,制备平板,接种hjg
‑
5菌株后,28℃培养,分别在第5d、7d、10d、15d、21d后观察记录菌丝颜色和生长情况,是否产生可溶性色素以及产生的颜色。
[0076]
2.2.3生理生化鉴定
[0077]
参照《链霉菌鉴定手册》和《放线菌快速鉴定与系统分类》的方法,对菌株hjg
‑
5进行生理生化鉴定。
[0078]
2.2.4碳源利用
[0079]
以普戈二氏固体培养基为基础,碳源种类有葡萄糖、庶糖、乳糖、麦芽糖、木糖、阿拉伯糖、果糖、甘露醇、甘油及淀粉,制备平板后,划线接种hjg
‑
5菌株,28℃恒温培养7d后,观察菌株生长情况。
[0080]
2.2.5黑色素产生
[0081]
将hjg
‑
5菌株接种于酪氨酸培养基中,28℃恒温培养,分别在接种后的第7d和14d,观察有无黑色素产生。
[0082]
2.2.6硫化氢产生
[0083]
将hjg
‑
5菌株接入柴斯纳培养基中,28℃培养7天后,观察是否有黑色或褐色出现。
[0084]
2.2.7硝酸盐还原试验
[0085]
将hjg
‑
5菌株接种在硝酸盐液体培养基中,28℃、培养7d
‑
10d后,取一份培养液加格里斯试剂和苯胺试剂后变红色或粉色的为阳性,再取份培养液,加入苯胺试剂后若为蓝色则为阴性,若不变色则为阳性。
[0086]
2.2.8明胶液化
[0087]
将hjg
‑
5菌株接入明胶培养基,28℃、培养7d
‑
14d,观察前4℃冰箱中冷却30min,如菌落周围明胶可流动,则为阳性,否则为阴性。
[0088]
2.2.9牛奶凝固或胨化
[0089]
将hjg
‑
5菌株接入牛奶液体培养基中,28℃培养,第5d、10d、15d观察,如出现凝块后又变为液体,则为阳性。
[0090]
2.2.10淀粉水解
[0091]
将hjg
‑
5菌株划线接种于淀粉琼脂培养基平板上,7d后在菌落周围滴加碘液,观察透明圈出现情况,有则为阳性。
[0092]
2.2.11纤维素利用
[0093]
将hjg
‑
5菌株接种于浸入培养基的滤纸条上,28℃培养7d,若菌株在滤纸条上可生长,且将滤纸分解变薄为纤维状,为阳性。
[0094]
2.2.12分子生物学鉴定
[0095]
采用ctab法提取hjg
‑
5菌株的dna,扩增16s rdna基因。引物为27f:5
′‑
agagtttgatcctggctcag
‑3′
,1492r:5
′‑
tacggytaccttgttacgactt
‑3′
。扩增体系和程序参考coombs的方法,扩增产物送至金唯智生物科技有限公司测序。将获得的16srdna序列在ncbi上blast后,与genbank中的序列经行比对,选取与其同源性较高的菌株基因序列,利用mega5.1软件进行分析,并采用neighbor
‑
j oining法构建hjg
‑
5菌株系统发育树。
[0096]
2.3内生放线菌hjg
‑
5发酵培养
[0097]
2.3.1种子液的制备
[0098]
将保存的hjg
‑
5菌株在pda平板上活化,打取两个ф5mm菌饼,接种至100ml/250ml pd培养基的三角瓶中,28℃,160r
·
min
‑1,摇瓶培养48h后得到种子培养液。
[0099]
2.3.2发酵液的制备
[0100]
将hjg
‑
5菌株的种子液按10%(v/v)的量接入pd发酵培养基,28℃,160r
·
min
‑1,摇瓶培养7d后,得到菌株的发酵液,12000r
·
min
‑1离心、0.22μm微孔滤膜过滤,即得hjg
‑
5的发酵滤液,4℃保存备用。 2.3.3发酵液抑菌活性检测
[0101]
采用前述生长速率法,以a.solani为指示菌,以空白pd培养液为ck。
[0102]
2.3.4菌体生长及抑菌活性物质的积累
[0103]
将种子培养液以10%(v/v)接入pd发酵培养基(250ml/500ml),28℃,160r
·
min
‑1,培养不同时间 (1d、2d、3d、4d、5d、6d、7d、8d、9d),每天取发酵液100ml,12000r
·
min
‑1离心,上清液经0.22μm微孔滤膜过滤后,用生长速率法,测其对a.solani的抑菌活性,沉淀菌体烘干称重。
[0104]
2.3.5培养基及培养条件筛选
[0105]
将hjg
‑
5菌株的种子发酵液按10%(v/v)的接种量接种于各灭菌的基础培养液(a:高氏1号液体培养基、b:小米液体培养基、c:黄豆粉液体培养基、d:黄豆玉米粉液体培养基、e:pd培养基)中,28℃, 160r
·
min
‑1,7d后,测定不同发酵基础培养基条件下hjg
‑
5菌株发酵滤液对a.solani的抑菌率,确定最佳发酵基础培养基。
[0106]
以等量(20g/l)的可溶性淀粉、麦芽糖、蔗糖、乳糖、甘露醇、玉米粉分别代替基础培养基中的葡萄糖,其他成分不变,以发酵基础培养基为ck,测定不同c源时,hjg
‑
5菌株发酵滤液对a.solani的抑菌活性,确定最佳碳源。
[0107]
以上述筛选出的最佳c源作为c源,分别添加等量(10g/l)黄豆粉、蛋白胨、胰蛋白胨、酵母粉、牛肉浸膏、尿素、(nh4)2so4、kno3,测定不同n源条件下,hjg
‑
5菌株发酵滤液对a.solani的抑菌活性,确定最佳氮源,以原始pd培养基作ck。
[0108]
为进一步研究发酵条件对hjg
‑
5菌株抑菌活性物质产量的影响,采用正交试验l16(45),参见表1,对转速、ph、装液量、接种量、发酵时间进行优化,从而筛选出菌株hjg
‑
5最佳发酵条件。
[0109]
表1发酵条件正交试验设计
[0110][0111]
2.4hjg
‑
5菌株发酵液稳定性测定
[0112]
2.4.1热稳定性测定
[0113]
取六支无菌试管,每支装发酵滤液10ml,分别于40℃、60℃、80℃、100℃、121℃温度条件下处理30min,冷却至室温后测定其抑菌活性,以未处理的发酵滤液为ck。
[0114]
2.4.2紫外辐射稳定性测定
[0115]
分别取10ml发酵滤液于灭菌培养皿中,在紫外灯(15cm)下分别照射2h、4h、6h、8h、10h、12 h、24h后,测其抑菌活性,以未经紫外照射的发酵滤液为ck。
[0116]
2.4.3酸碱稳定性测定
[0117]
分别取10ml发酵滤液于灭菌试管中,用1mol/lhcl和1mol/lnaoh溶液将其ph分别调节至: 2.0、3.0、4.0、5.0、7.0、8.0、9.0、10、11.0、12.0,室温下放置2h后调回原始ph 6.0,测定其抑菌活性,以未经酸碱处理的发酵滤液(ph6.0)为对照。
[0118]
2.4.4贮存稳定性测定
[0119]
取发酵滤液,存于无菌试管中,4℃冰箱黑暗保存,分别于0d、15d、30d、45d、60d、75d、90d、105d、 120d取样检测其抑菌活性。
[0120]
以上抑菌活性的检测均采用生长速率法,以a.solani为靶标菌。
[0121]
2.5hjg
‑
5菌株发酵滤液抑菌作用的初步研究
[0122]
2.5.1对病菌菌丝生长及形态的影响
[0123]
挑取抑菌活性测定中被抑制的a.solani菌丝于载玻片上,显微观察菌丝形态,以正常生长的a.solani 菌丝为ck,记录并显微照相。
[0124]
2.5.2对病菌细胞膜透性的影响
[0125]
将培养后大量产孢的a.solani接于pd培养液中,28℃,160r
·
min
‑1,5
‑
6d后,7500r
·
min
‑1离心收集菌丝体,无菌水清洗3次后,称取5份,每份5g置于100ml三角瓶中,加入50ml无菌水,再分别加入发酵滤液,使终浓度分别为5%,10%,13%,20%,ck加等体积的pd培养液,28℃、160r
·
min
‑1,分别在0、0.5h、1h、1.5h、2h、4h、6h、20h、24h,取5ml离心后,测定上清液电导率值。以电导率值变化表示抑菌活性物质对a.solani细胞膜透性的影响。
[0126]
2.6hjg
‑
5菌株发酵液促生与生防作用测定
[0127]
2.6.1对番茄种子萌发的影响
[0128]
选取大小均匀饱满的番茄种子,表面消毒后,分别在发酵液原液、5x、10x、20x、50x、80x、100x 稀释液中浸种24h,以空白发酵液处理作为ck,每皿30粒摆放于铺有两层灭菌滤纸的培养皿中,27℃黑暗培养,定时统一加无菌水保持湿润,每处理3次重复,试验重复2次,每天观察并测定7日内各处理的发芽指数。
[0129]
发芽指数(gi)=∑gt/dt
[0130]
式中:gt:在t日内的发芽数;dt:发芽日数。
[0131]
2.6.2对番茄苗生长的影响
[0132]
以上述方法选取番茄种子,表面消毒后播种,待幼苗长出第四片真叶时,选取长势大小一致的幼苗留苗,并分别用发酵液原液、5x、10x、20x、50x、80x及100x稀释的发酵液进行灌根,每株20ml,五天后再次灌根,以pd培养液为ck,室温培养,适时适量浇水,播种70d后测量株高、鲜重、干重及根长。
[0133]
2.6.3离体叶片防效测定
[0134]
选取番茄植株上相近叶位、生长一致的健康叶片,表面处理消毒后,采用针刺接种
法,在叶片上分别喷施发酵液原液和5x、10x、20x稀释液,以喷空白pd培养液为ck,24h后接种番茄早疫病菌菌饼,将处理后的叶片置于底部铺有无菌湿滤纸的培养皿中,每处理六个叶片,试验重复三次,27℃保湿黑暗交替培养,4d后观察叶片发病情况,计算抑菌率。
[0135]
抑制率/%=(对照病斑面积
‑
处理病斑面积)*100/对照病斑面积
[0136]
2.6.4离体果实防效测定
[0137]
选取健康番茄果实,75%酒精消毒,无菌水冲洗干净后备用,采用针刺接种法,在果实中部用无菌针划φ为5mm的伤口,分别喷施发酵液原液,5x、10x、20x稀释液,以喷空白pd为ck,24h后接种 a.solani菌饼,置于底部铺有湿润滤纸的无菌托盘内,保鲜膜包裹密封。每处理5个果实,试验重复3次, 27℃培养,4d后观测果实发病情况。
[0138]
2.7抑菌活性物质的初步分离及生物活性测定
[0139]
2.7.1最佳萃取溶剂的筛选
[0140]
将菌株hjg
‑
5发酵滤液装于五个三角瓶中(200ml/500ml),分别加入等体积的石油醚、乙酸乙酯、氯仿、二氯甲烷、正丁醇,28℃,160r
·
min
‑1,4h后于分液漏斗中,静置4
‑
6h,分别收集有机相和水相,多次萃取合并organic phase后,在适宜温度条件下旋蒸至干,用甲醇溶解并定容至10ml,用生长速率法测其对a.solani的抑菌活性,以确定最佳的有机萃取溶剂。
[0141]
2.7.2硅胶柱层析
[0142]
2.7.2.1抑菌活性物质粗提物的制备
[0143]
制备hjg
‑
5菌株发酵液3l,经12000r
·
min
‑1离心、0.22μm微孔滤膜过滤后,得发酵滤液,用正丁醇等体积萃取三次后,合并有机相,55℃下旋蒸,用5ml甲醇溶解粗提物,0.45μm有机微孔滤膜过滤后, 4℃冰箱储存。
[0144]
2.7.2.2硅胶柱层析
[0145]
装柱:将硅胶(200
‑
300目)用石油醚调至糊状,倾入层析柱中(30
×
450mm),边加边搅拌,用橡胶锤轻轻敲击柱体,以排出柱中气泡,轻拧旋塞,使硅胶缓慢沉降,装至离管口5
‑
7cm即可,用适量石油醚淋柱,柱面停止下降为止,同时在柱床表面均匀覆盖一层石英砂,以保护柱床表面的平整。
[0146]
加样:待柱内液体表面距硅胶表面1cm左右时,用吸管将制备的粗提物(2ml)沿柱内壁缓慢、均匀地加入,当样品移动到硅胶表面以下时,依次用极性由小到大的试剂进行梯度洗脱。
[0147]
洗脱与样品收集:洗脱液依次为石油醚:氯仿(1:1)、氯仿:甲醇(2:1)、氯仿:甲醇(1:1)、氯仿:甲醇(1:2)、甲醇,每个梯度洗脱液200ml。控制流速为3~4滴/s,每管20ml。
[0148]
2.7.2.3硅胶薄层层析检测
[0149]
试管中所收集的流分经tlc检测(展开剂为氯仿:甲醇4:1,碘升华作为显色剂),根据rf值合并相同的流分。
[0150]
2.7.2.4各组分生物活性测定
[0151]
合并后的组分经减压浓缩后,用抑菌圈法测定各组分所分离物质对a.solani的抑菌率。
[0152]
3.结果与分析
[0153]
3.1花椒内生拮抗放线菌的分离筛选及抑菌活性测定
[0154]
3.1.1花椒内生放线菌的分离纯化
[0155]
根据菌落表观特征,大小,可溶性色素有无等对分离培养基上长出的放线菌进行分类纯化,共得到11 株内生放线菌,其中8株来自于根部,3株来自茎部。ck培养基上未见菌落,证明表面消毒彻底,所得菌株均为花椒内生菌。
[0156]
3.1.2花椒内生拮抗放线菌的筛选
[0157]
以b.cinerea和a.solani为指示菌,采用四点平板对峙法对分离得到的11株内生放线菌进行初筛,其中6株可观察到抑菌作用(表2),对a.solani的抑菌率在44.4%~73.59%之间,对b.cinerea的抑制率在 29.25%~60.10%之间,其中hjg
‑
5菌株对两种病菌的抑菌率均为最佳。
[0158]
用生长速率法对6株拮抗菌复筛,由表2可得,六株菌代谢产物对a.solani的抑制率为47.18%~81.92%之间,其中hjg
‑
5菌株发酵滤液的抑菌率为最高的81.92%。在此实验基础上,选择最优菌株hjg
‑
5进行后续的研究。
[0159]
表2花椒内生拮抗放线菌的筛选
[0160][0161]
注:表中英文小写字母表示新复极差检验在p<0.05水平上的差异显著性。
[0162]
3.1.3hjg
‑
5菌株抑菌谱测定
[0163]
3.1.3.1hjg
‑
5菌株抑菌活性测定
[0164]
以12种病原菌为指示菌测定hjg
‑
5菌株的抑菌谱,表3可知,hjg
‑
5菌株对供试病原菌均有抑制作用,抑制率为42.87%
‑
76.55%;对m.laxa和a.solani的抑制率最好,分别是77.42%、76.55%;对于v.mali、 s.sclerotiorum(lib.)de bary和c.lindemuthianum的抑菌效果较差,分别为45.98%、49.84%和42.87%;对于其他病原菌的抑菌率在51.91%
‑
70.54%之间,效果见图1。
[0165]
表3 hjg
‑
5菌株对12种病原菌的抑制作用
[0166]
[0167][0168]
3.1.3.2hjg
‑
5菌株发酵滤液抑菌谱测定
[0169]
对hjg
‑
5菌株的发酵滤液进行抑菌谱的测定,以确保其研究开发价值。由表4可知,菌株发酵滤液对供试的12种病菌的抑制作用存在显著差异,对m.laxa和a.solani的抑制率最佳,分别为80.47%、82.39%,对f.graminearum、l.libanotis、m.fructicola的抑制率也较好,分别为73.88%、75.26%、70.32%。而对r.solani,v.mali、s.sclerotiorum(lib.)debary的抑制率较差,低于40%,效果见图2。
[0170]
表4 hjg
‑
5菌株发酵滤液对12种病原菌的抑制作用
[0171][0172]
3.2hjg
‑
5菌株分类地位
[0173]
3.2.1形态特征
[0174]
hjg
‑
5菌株在燕麦粉琼脂培养基上培养2
‑
3d,菌落表面光滑呈白色,培养至第6d后开始有白色的气生菌丝从菌落边缘长出,8d后开始逐渐变为浅灰色。培养过程中菌落形态为圆锥形隆起,菌落边缘有4
‑
6 圈的同心轮纹,外围有晕状壤边。通过显微观察,气生菌丝发达、分支较多,基内菌丝无横隔、不断裂,效果见图3。
[0175]
3.2.2培养特征
[0176]
参见表5,hjg
‑
5菌株在isp2、pda和营养琼脂上生长较优,菌落表面隆起呈致密的绒粉状,气生菌丝发达,为白色或灰白色,基内菌丝棕黄色或黄褐色。在isp5上生长中等,气
生菌丝为浅灰色,基内菌丝为淡鹅黄色。在isp4,察氏和高氏一号培养基上生长较差,气生菌丝稀薄,多呈很淡的白灰色,无基内菌丝,在isp3上几乎不生长。在供试的8种培养基上均不产生可溶性色素。
[0177]
表5内生放线菌hjg
‑
5在不同培养基上的培养特征
[0178][0179]
注:
“‑”
:不生长;“+”:生长;“++”:生长良好;“+++”:生长旺盛
[0180]
3.2.3生理生化测定
[0181]
参见表6,生理生化检测结果表明,内生拮抗放线菌hjg
‑
5可产黑色素,可使部分明胶液化,硝酸盐还原为阳性,淀粉水解,牛奶凝固并胨化,不产生h2s,纤维素上不生长。菌株不能利用淀粉、木糖、阿拉伯糖和果糖,对葡萄糖、麦芽糖、蔗糖、乳糖、甘露醇和甘油这几种碳源都有比较好的利用程度。
[0182]
表6 hjg
‑
5菌株生理生化特征及碳源利用
[0183][0184]
注:
“‑”
:阴性;“+”:阳性
[0185]
3.2.4分子生物学
[0186]
利用引物27f/1492r,以hjg
‑
5菌株dna为模板,进行pcr扩增,琼脂糖凝胶电泳检测pcr产物如图4所示,条带清晰、单一。测序后,序列长度为1361bp。将16srdna序列与genbank中已登录的近似种16srdna序列进行比对,选取与其同源性较高的菌株的基因序列,利用
mega5.1软件进行分析,并采用neighbor
‑
joining法构建hjg
‑
5菌株系统发育树,最终hjg
‑
5菌株与streptomyces cinnamocastaneus, ab184588聚于同一分支,参见图5,同源性达99%,亲缘关系最近,因此,将菌株hjg
‑
5归为肉桂粟色链霉菌streptomyces cinnamocastaneus。
[0187]
3.3发酵条件优化
[0188]
3.3.1菌体生长曲线
[0189]
hjg
‑
5菌株的生长曲线及抑菌活性物质的产量变化如图6所示,菌株在0
‑
7d内快速生长,随发酵时间的延长,菌丝干重增加,在第7d时达到顶峰,8
‑
9d为稳定期,发酵第10d开始出现衰退趋势。
[0190]
由hjg
‑
5菌株的抑菌率曲线可知,抑菌活性物质的产量随发酵时间的延长逐渐增加,发酵1d后即开始出现抑菌效果,在第7d时达到最大值,为85.89%,第8
‑
9d时,抑菌率较稳定,与最高值无显著差异,第10d开始出现下降趋势,结合菌丝干重曲线可知菌株自身生长与抑菌活性物质的产量是基本保持一致的。 3.3.2培养基及培养条件筛选
[0191]
3.3.1基础培养基筛选
[0192]
采用a~e五种基础培养基,a:高氏一号液体培养基、b:小米液体培养基、c:黄豆粉液体培养基、d: 黄豆玉米粉液体培养基、e:pd培养基,进行发酵培养,7d后采用生长速率法测其发酵滤液对a.solani 的抑菌率。由图7可知,各发酵培养基中菌株的抑菌活性有显著差异,其中,e培养基的发酵滤液的抑菌效果最好,为84.63%,其次为d培养基的76.27%,a培养基的抑菌效果最差,仅为4.52%,因此,选择 e培养基即pd为基础培养基进行下一步的优化试验。
[0193]
3.3.2碳源筛选
[0194]
以pd为基础培养基,添加不同c源条件下,hjg
‑
5菌株的发酵滤液对a.solani抑菌活性存在显著差异,如图8,ck为pd,以麦芽糖为c源时,抑菌活性最佳,为86.29%,其次葡萄糖ck为84.28%,甘露醇、淀粉、乳糖和玉米粉次之,以蔗糖为碳源时,抑菌效果最差,为31.28%。因此以麦芽糖为最佳c 源。
[0195]
3.3.3氮源筛选
[0196]
不同n源对hjg
‑
5菌株抑菌活性的差异如图9,供试的8种n源中,胰蛋白胨营养条件下菌株的抑菌活性最好,为87.60%,与抑菌率为84.32%的未加氮源的ck相比,差异显著,其次为酵母粉和(nh4)2so4,分别为83.64%、83.52%,牛肉膏、蛋白胨、kno3和黄豆粉次之,且抑菌活性均小于ck,加入尿素为氮源时,抑菌效果最差为19.32%,因此后期试验选择胰蛋白胨作为n源。
[0197]
3.3.4发酵条件正交优化
[0198]
在上述筛选出的最佳培养基成分基础上,选择转速、ph、装液量、接种量、发酵时间五个因素对发酵条件进行进一步的优化,结果如表7,其中第5组的抑菌效果最好,为91.30%,相应的水平组合为 a2b1c2d3e4,从图10的走势进行直观分析,可知最佳的水平组合为a4b3c4d3e4,这组试验并没有被包含在正交设计试验表中,因此追加一次该水平下的试验,以增加试验结果的准确性,追加试验的抑菌率为91.78%,高于第5组的抑菌效果。从极差分析可知,五个因素对hjg
‑
5菌株发酵滤液对a.solani的抑菌活性影响程度大小依次为转速>装液量>发酵时间>ph>接种量,因此,通过正交试验优化后hjg
‑
5菌株发酵条件为转
速180r
·
min
‑1,ph为8,装液量125ml/250ml,接种量8%,发酵时间9d。
[0199]
表7 hjg
‑
5菌株发酵条件正交试验分析表
[0200][0201][0202]
3.3.5优化后的生物活性检测
[0203]
按照优化后的培养基配方及培养条件进行hjg
‑
5菌株的发酵,生长速率法测定发酵滤液对a.solani的抑菌活性,实验结果表明,优化后的发酵滤液抑菌活性得到显著提高,由优化前的83.70%提高到91.78%,参见图11。
[0204]
3.4hjg
‑
5菌株发酵滤液稳定性测定
[0205]
3.4.1热稳定性
[0206]
hjg
‑
5菌株发酵液经不同温度处理30min后抑菌活性如图12,随着温度的升高,抑菌活性渐有降低,但除121℃处理后抑菌活性降至22.54%外,80℃以内抑菌活性物质较稳定,抑菌率维持在80%左右,100℃处理后的发酵液对a.solani有63.63%的抑菌率,即仍有较强的抑菌活性,该试验结果表明hjg
‑
5菌株代谢产物热稳定性较好。
[0207]
3.4.2酸碱稳定性
[0208]
发酵液经酸碱处理后的抑菌率变化如图13。在ph7
‑
ph9环境下抑菌活性最好,与未经处理组ck相比抑菌活性无显著差异,随着酸碱性的增加,抑菌率渐有降低但也维持在80%左右。综上可得,该菌株抑菌活性物质有较强的ph稳定性。
[0209]
3.4.3紫外辐射稳定性
[0210]
发酵滤液经不同时间紫外光照射后得到的抑菌活性如图14所示,随着照射时间的累加,发酵液对 a.solani的抑制率稍有降低,但抑菌率总体在80%左右,在照射24小时后的抑菌率为79.51%,相比于未紫外处理的ck组抑菌率仅下降了6.5%,由此可得出紫外照射下,抑菌活性物质较稳定,不会发生降解与改变。
[0211]
3.4.4贮存稳定性
[0212]
在4℃下,发酵滤液有较好的贮存稳定性如图15所示,30天内,抑菌活性在80%以上,40d
‑
80d时,抑菌率无显著性差异,均在77%左右,储存90d时,对a.solani的抑制率仍有74.03%,为原始发酵液抑菌活性的85.15%。
[0213]
3.5hjg
‑
5菌株发酵滤液抑菌作用
[0214]
3.5.1对a.solani菌丝形态的影响
[0215]
菌株发酵滤液对a.solani菌丝形态的影响如图16,a为正常菌丝;b、c为菌株hjg
‑
5处理的菌丝;对照a.solani菌丝生长发育正常,菌丝光滑且粗细均匀,间隔清晰,菌丝体细胞内溶物均匀分散,结构完整。hjg
‑
5发酵液处理后,菌丝生长异常,畸形肿胀,粗细不均,出现细胞质聚集,外渗等现象。
[0216]
3.5.2对a.solani细胞膜透性的影响
[0217]
当菌丝体细胞膜透性改变,胞内物质外渗时,会造成电导率值的变化。因此常通过测定电导率值,来反映抑菌物质对菌体膜透性的影响。参见图17,随着时间的延长,各处理的电导率值均出现增高的趋势,且上升幅度与加入发酵滤液的量呈正比,而ck的电导率上升幅度很小,曲线平缓。同一时间内,电导率值与发酵滤液添加量呈正相关。因此,可以得知,菌株代谢产物对番茄早疫病菌细胞膜透性影响较大,随着发酵滤液浓度的增加和时间的延长,这种破坏程度加剧。
[0218]
3.6hjg
‑
5菌株发酵滤液促生与生防作用测定
[0219]
3.6.1对番茄种子萌发的影响
[0220]
番茄种子的gi随发酵滤液浓度的增加呈先升后降的态势,参见图18,其中,20x、50x和80x稀释的发酵液对种子萌发有显著促进作用,20x稀释的发酵液处理番茄种子后发芽指数为49.07,相比于对照的42.03,提高了16.75%,当稀释倍数逐渐增大时,促进作用减弱,发酵液100倍稀释处理后的gi与ck 无显著差异,而高浓度的发酵液浸种后对种子的萌发呈现抑制趋势。
[0221]
3.6.2对番茄幼苗生长的影响
[0222]
参见图19,经不同浓度发酵液灌根处理后,番茄幼苗的生长情况,当发酵液浓度在100x
‑
20x稀释时,番茄幼苗株高,根长,鲜重、干重均随发酵液浓度的增加而增加,尤以20x稀释液的效果最好,较ck组分别提高了29.0%、20.4%、24.9%、35.9%,而随着发酵液浓度的增大,促生作用减弱,抑制作用渐有增强,发酵原液相对于ck,对植株的各项指标均有显著地抑制作用,由此可知,菌株发酵液在低浓度时对植株发育有一定的促进作用,而在高浓
度时,则制约植株的发育,参见图20。
[0223]
3.6.3离体防效
[0224]
3.6.3.1hjg
‑
5菌株发酵滤液对离体叶片a.solani的防效
[0225]
hjg
‑
5菌株发酵液在离体叶片上对a.solani的防效,参见表8,不同浓度的发酵液在离体叶片上对 a.solani有不同程度的防效,ck的番茄叶片接种病原菌1天后开始发病,4d后病斑面积逐渐扩大至 485.10mm3,喷施发酵液原液的叶片防治效果最好,病斑面积仅为122.33mm3,抑制率为80.60%,当增加发酵液稀释倍数时,防效逐渐降低,与发酵原液的防效差异显著,参见图21。
[0226]
表8 hjg
‑
5菌株发酵滤液对离体叶片a.solani的防治效果
[0227][0228]
3.6.3.2hjg
‑
5菌株发酵滤液对离体果实a.solani的防效
[0229]
不同浓度发酵滤液在离体果实上对a.solani的抑制效果差异显著,参见表9,防治效果最低的为20x 稀释的发酵液,对a.solani的抑菌率为44.34%,而高浓度的发酵液,在离体番茄果上对a.solani有明显的防效,防治效果最佳的发酵液原液,抑菌率达到82.96%。
[0230]
表9 hjg
‑
5菌株发酵滤液对离体果实a.solani的防治效果
[0231][0232][0233]
3.7抑菌活性物质的初步分离及生物活性测定
[0234]
3.7.1最佳萃取溶剂的筛选
[0235]
使用5种不同极性的有机溶剂对hjg
‑
5菌株发酵滤液中抑菌活性物质进行粗提,旋蒸浓缩后测定各有机相及水相对a.solani的抑菌活性,参见表10,五个处理的有机相和水相均有不同程度的抑菌作用,其中以正丁醇为萃取剂时,有机相与水相的抑菌效果差别最大,有机相抑菌率为93.12%,水相为43.39%。随着有机溶剂极性的减弱,各萃取剂有机相的抑菌活性逐渐降低,石油醚萃取液的抑菌活性仅为30.03%,表明该活性物质为极性较大的脂溶性物质,因此,选择正丁醇为最佳的萃取剂。
[0236]
表10菌株hjg
‑
5不同有机溶剂萃取物的抑菌活性
[0237][0238]
3.7.2硅胶柱层析分离抑菌活性物质
[0239]
发酵液经正丁醇萃取后,得到活性物质粗提物,湿法上样后经石油醚、氯仿、甲醇不同配比的梯度洗脱后,每管20ml,共收集到60管,经tlc检测后,合并rf(比移值)相同的流分后共得10个组分,将各组分减压浓缩后,采用抑菌圈法测定其对a.solani的抑菌活性,参见图22。组分8的抑菌效果最佳,抑菌圈直径为18.63mm,而组分4、5及10对a.solani几乎无抑菌活性。
[0240]
4结论
[0241]
4.1花椒内生拮抗放线菌的分离筛选及鉴定
[0242]
本发明采用组织匀浆法从花椒植株的各组织部位共分离得到11株内生放线菌,通过平板对峙法及发酵液生长速率法筛选得出1株具有很好抑菌活性的hjg
‑
5菌株,通过测定其抑菌谱可知,该菌株抑菌谱较广,特别是能很好的抑制m.laxa和a.solani的生长,活菌对其抑制率在70%以上,发酵液对其则有80%以上的抑菌率,总体上代谢产物的抑菌活性要高于活菌菌体,因此也可以推断,hjg
‑
5菌株通过代谢产生抑菌活性物质来抑制病原菌的生长,且为具有很好的生防潜力的菌株。
[0243]
通过菌株形态特征,培养特征,生理生化鉴定以及菌株16srdna测序分析,将菌株hjg
‑
5鉴定为肉桂粟色链霉菌,但该菌株可以利用乳糖、甘露醇、甘油,在高氏合成1号和查氏上生长极弱,而在pda 上则能很好的生长,且在所用8种培养特征观察培养基上均观察不到可溶性色素,这与沈梅生发表的肉桂粟色链霉菌streptomyces cinnamocastaneus的描述不同,另一方面,hjg
‑
5菌株分离自花椒植株的根部,而沈梅生的streptomyces cinnamocastaneus菌株则分离于土壤,因此推测内生放线菌株hjg
‑
5最初是土壤放线菌的一部分,后经长期进化,进入植株的根部,因生存环境的改变,自身理化性质发生改变。
[0244]
4.2hjg
‑
5菌株发酵条件的研究
[0245]
本发明从供试5种培养基中筛选出最佳的基础培养基pd,又以单因素法筛选出最佳的c源麦芽糖和最佳n源胰蛋白胨;采用正交优化法筛选出最适宜菌株的培养条件为:转速180r
·
min
‑1,ph8,装液量 125ml/250ml,接种量8%,发酵时间为9d。对优化后的培养基配方及发酵条件进行生物活性测定,发现其对a.solani的抑菌活性显著提高。
[0246]
4.3hjg
‑
5菌株代谢产物理化特性及抑菌机制
[0247]
为探索抑菌活性物质的理化性质,对菌株发酵液进行各种稳定性试验,结果表明,hjg
‑
5菌株代谢产物有较好的热稳定性,80℃以下抑菌率维持在80%左右,在中性和弱碱性环境下非常稳定;抑菌物质经紫外照射不改变抑菌活性;4℃条件下,贮存稳定性良好,90d时,对a.solani的抑制率能达到原始发酵液抑菌活性的85.15%。可知该菌株产生的抑菌活性物质理化性质稳定。
[0248]
本发明利用光学显微镜观测了hjg
‑
5菌株抑菌活性物质对a.solani菌丝生长的影
响,同时测定了其对菌丝细胞膜透性的影响。结果表明,hjg
‑
5菌株发酵液处理后,a.solani菌丝与正常发育的菌丝相比,出现弯曲折叠,畸形肿胀,细胞质聚集,外渗等现象。通过测定病原菌菌丝培养液的电导率值可知,发酵液的加入使电导率值增大,其与发酵液浓度和处理时间呈正相关,即菌丝细胞膜被破坏,胞内物质外渗,这也与菌丝显微观察到的结果相吻合。
[0249]
4.4hjg
‑
5菌株发酵液促生与生防作用
[0250]
本发明通过对不同浓度hjg
‑
5菌株发酵液对番茄种子萌发,幼苗生长影响的测定可知,发酵液在一定浓度时可以促进种子萌发和植株生长,以20x稀释时效果最佳,其处理后种子gi相对于ck提高了16.75%,番茄幼苗株高,根长,鲜重、干重也较ck组有显著增长。
[0251]
本发明采用刺伤接种法测定hjg
‑
5菌株发酵液的离体防效,发现其发酵滤液在番茄离体叶片和果实上对a.solani的抑菌效果很好,发酵原液可以达到80%以上的抑菌率。由hjg
‑
5菌株的促生能力及生防能力,可知其有很好的生防潜力,在植物病害防治中有很好的应用前景。
[0252]
4.5hjg
‑
5菌株抑菌活性物质的初步分离及生物活性测定
[0253]
本发明使用5种不同极性的有机溶剂对hjg
‑
5菌株发酵滤液中抑菌活性物质进行粗提,结果表明,正丁醇可最大限度的提取抑菌活性物质,即该活性物质为极性较大的脂溶性物质。萃取得到的活性物质粗提物,经硅胶柱梯度洗脱分离、tlc检测后,共得到10个组分,采用抑菌圈法测定其对a.solani的抑菌活性,其中,组分8的抑菌活性最好,抑菌圈直径为18.63mm。花椒内生放线菌hjg
‑
5显示的高效广谱的抑菌活性表明其具有较强的生防潜力。
[0254]
应当理解,以上所描述的具体实施例仅用于解释发明,并不用于限定本发明。由发明的精神所引伸出的显而易见的变化或变动仍处于本发明的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1