一种烯基硼酸酯的合成方法
1.本发明涉及有机合成领域,更具体的说是涉及一种烯基硼酸酯的合成方法。
背景技术:
2.有机硼化学从无到有发展至今,一直都是化学领域中极为重要的一个部分。铃木偶联反应(suzuki coupling reaction)的发现使得有机硼酸酯类化合物可以有效地应用于碳碳键的构建,不仅在有机合成领域能够广受追捧,在材料化学和药物化学领域也有着广泛地应用。因此,高效便捷地合成有机硼酸酯原料便显得格外重要。
3.近年来由于碳硼键容易转化成各种碳碳和碳异原子键,有机碳化合物的合成是一项重要任务;特别是,过渡金属催化已经成为炔烃氢硼基化合成烯基硼酸酯的重要合成策略。现有制备烯基硼酸酯的技术中,一直依赖于rh、ru、ir、fe等过渡金属,而廉价易得的碱金属催化多取代炔烃硼氢化的报道为数不多。文献(org.chem.front.,2019,6,2949
–
2953)报道一种正丁基锂促进了氢硼化,但反应条件苛刻,官能团忍耐性差。文献(angew.chem.int.ed.2016,55,15356
–
15359)报道了用铝催化炔烃的氢硼化反应,但产率普遍较低,且催化剂制取繁琐,具有一定局限性,从而也限制了烯基硼酸酯
技术实现要素:
4.针对现有技术存在的不足,本发明的目的在于提供一种烯基硼酸酯的合成方法,该合成方法以氨基锂作为催化剂,催化剂制取容易,且反应物原料易得,反应过程简单,安全,高收率。
5.为实现上述目的,本发明提供了如下技术方案:一种烯基硼酸酯的合成方法,在氮气氛围下,将炔烃类物质、频哪醇硼烷(hbpin)和氨基锂催化剂加入装有有机溶剂的反应容器中搅拌混合,混合均匀后在温度为70
‑
110℃的条件下进行反应,反应时间为18
‑
28h,反应结束后过滤提纯,制得烯基硼酸酯。
6.作为本发明的进一步改进,所述氨基锂催化剂为二(三甲基硅基)氨基锂(lin(tms)2),简称lhmds。
7.作为本发明的进一步改进,所述炔烃类物质为苯乙炔、4
‑
甲基苯乙炔、4
‑
乙基苯乙炔、4
‑
叔丁基苯乙炔、4
‑
苯基苯乙炔、4
‑
氟苯乙炔、1,4
‑
苯乙炔、4
‑
甲氧基苯乙炔、叔丁基乙炔和环己烯基乙炔中的任意一种。
8.作为本发明的进一步改进,所述炔烃类物质与所述频哪醇硼烷两者之间添加的摩尔份之比为1:1.1
‑
1.5。
9.作为本发明的进一步改进,所述炔烃类物质与所述氨基锂催化剂两者之间添加的摩尔份之比为1:0.04
‑
0.10。
10.作为本发明的进一步改进,所述有机溶剂为甲苯。
11.本发明的反应式为:
[0012][0013]
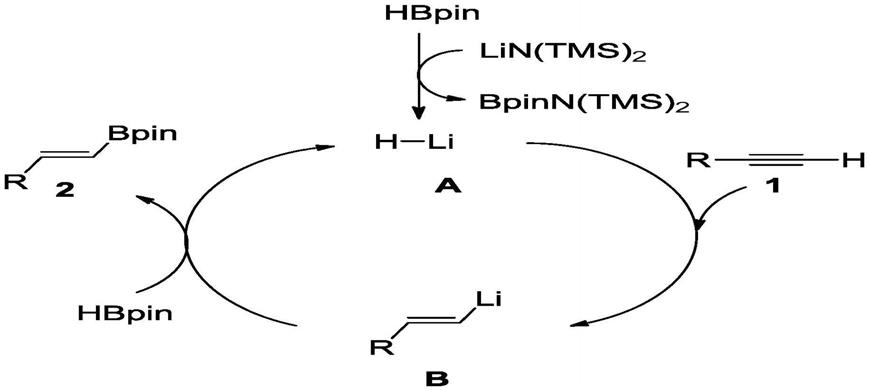
本发明的反应机理
[0014][0015]
首先频哪醇硼烷和硅胺基锂反应,得到氢化锂中间体,氢化锂中间体a插入碳碳三键,得到烯基锂中间体b,b与频哪醇硼烷反应得到产物烯基硼和氢化锂中间体完成催化循环。
[0016]
本发明人通过深入细致研究,发现一种在硅胺基锂催化体系下,催化炔烃硼氢化反应从而实现结构多样化的烯基硼酸酯的合成,该方法原子经济性高,成键效率高,反应条件温和。相较于以往方法,反应条件和底物普适性有明显改善,这是其它方法难以实现的。采用本发明方法制备得到的有机硼试剂,品质高,收率高,反应普适性好,反应原子经济性高,后处理方便;实现了碱催化炔烃硼氢化构建有机硼化合物,为构建有机硼试剂提供了重要借鉴。
[0017]
本发明的有益效果:
[0018]
(1)反应普适性好,产率高,大部分反应产率在90%以上,原子经济性高;
[0019]
(2)这是对炔烃硼氢化的重要补充,为构建含有机硼化合物提供了重要思路;
[0020]
(3)反应条件较为温和且不需要大量/繁琐的添加剂;
[0021]
(4)硅胺基锂催化剂结构简单、价格便宜、可商业购买,且反应不用金属催化剂。
具体实施方式
[0022]
下面通过实施例对本发明作进一步说明,但实施例并不限制本发明的保护范围。
[0023]
实施例1
[0024]
(e)
‑
4,4,5,5
‑
四甲基
‑2‑
苯乙烯基
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0025][0026]
制备方法:氮气保护下,向反应容器中加入原料苯乙炔(0.5mmol)、频哪醇硼烷
(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在80℃下反应24h,过滤提纯,制得产物;产物分离收率98%。
[0027]1h nmr(500mhz,cdcl3):δ7.50
–
7.48(m,2h),7.40(d,j=18.5hz,1h),7.35
–
7.26(m,3h),6.17(d,j=18.5hz,1h),1.31(s,12h).
13
c nmr(125mhz,cdcl3):δ149.7,137.6,129.0,128.7,127.2,83.5,24.9.
[0028]
实施例2
[0029]
(e)
‑
4,4,5,5
‑
四甲基
‑2‑
(4
‑
甲基苯乙烯基)
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0030][0031]
制备方法:氮气保护下,向反应容器中加入原料4
‑
甲基苯乙炔(0.5mmol)、频哪醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在80℃反应24h,过滤提纯,制得产物;产物分离收率89%。
[0032]1h nmr(500mhz,cdcl3)δ7.40
‑
7.36(m,3h),7.12
‑
7.10(m,2h),6.11(d,j=18.5hz,1h),2.31(s,3h),1.29(s,12h).
13
c nmr(125mhz,cdcl3)δ149.5,138.9,134.8,129.3,127.0,83.2,24.8,21.3.
[0033]
实施例3
[0034]
(e)
‑2‑
(4
‑
乙基苯乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0035][0036]
制备方法:氮气保护下,向反应容器中加入原料4
‑
乙基苯乙炔(0.5mmol)、频哪醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在80℃反应24h,过滤提纯,制得产物;产物分离收率89%。
[0037]1h nmr(500mhz,cdcl3)δ7.41
‑
7.37(m,3h),7.15(d,j=8.0hz,2h),6.12(d,j=18.5hz,1h)2.62(q,j=8.0hz,2h),1.32(s,12h),1.21(t,j=8.0hz,3h).
13
c nmr(125mhz,cdcl3)δ149.6,145.3,135.1,128.1,127.2,115.4(br,c
‑
b),83.3,28.8,24.9,15.5.
[0038]
实施例4
[0039]
(e)
‑2‑
(4
‑
(叔丁基)苯乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0040][0041]
制备方法:氮气保护下,向反应容器中加入原料4
‑
叔丁基苯乙炔(0.5mmol)、频哪
醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在80℃反应24h,过滤提纯,制得产物;产物分离收率88%。
[0042]1h nmr(500mhz,cdcl3)δ7.45
‑
7.35(m,5h),6.12(d,j=18.5hz,1h),1.31(s,21h).
13
c nmr(125mhz,cdcl3)δ152.2,149.5,134.9,126.9,125.6,83.4,34.8,31.4,24.9.
[0043]
实施例5
[0044]
(e)
‑2‑
(2
‑
([1,1'
‑
联苯基]
‑4‑
基)乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0045][0046]
制备方法:氮气保护下,向反应容器中加入原料4
‑
苯基苯乙炔(0.5mmol)、频哪醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在80℃反应24h,过滤提纯,制得产物;产物分离收率90%。
[0047]1h nmr(500mhz,cdcl3)δ7.60
‑
7.55(m,6h),7.46
‑
7.41(m,3h),7.35
‑
7.32(m,1h),6.21(d,j=18.5,1h),1.32(s,12h).
13
c nmr(125mhz,cdcl3)δ149.1,141.7,140.6,136.6,128.9,127.6,127.5,127.3,127.0,83.4,24.9.
[0048]
实施例6
[0049]
(e)
‑2‑
(4
‑
氟苯乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0050][0051]
制备方法:氮气保护下,向反应容器中加入原料4
‑
氟苯乙炔(0.5mmol)、频哪醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在80℃反应24h,过滤提纯,制得产物;产物分离收率97%。
[0052]1h nmr(500mhz,cdcl3):δ7.47
–
7.44(m,2h),7.35(d,j=18.5hz,1h),7.02(t,j=8.0hz,2h),6.07(d,j=18.5hz,1h),1.31(s,12h).
13
c nmr(125mhz,cdcl3):δ163.3(d,j=248.3hz),148.3,133.9,128.8(d,j=8.3hz),115.7(d,j=21.6hz),83.5,24.9.
[0053]
实施例7
[0054]
1,4
‑
双((e)
‑2‑
(4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷
‑2‑
基)乙烯基)苯的制备,结构式如下:
[0055][0056]
制备方法:氮气保护下,向反应容器中加入原料1,4
‑
苯乙炔(0.5mmol)、频哪醇硼烷(1.2mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在100℃反应24h,过滤提纯,制得产物;产物分离收率78%。
[0057]1h nmr(500mhz,cdcl3)δ7.45(s,4h),7.36(d,j=18.5hz,2h),6.16(d,j=18.5hz,2h),1.31(s,24h);
13
c nmr(125mhz,cdcl3)δ148.7,137.8,127.2,119.6(br,c
‑
b),83.8,24.8.
[0058]
实施例8
[0059]
(e)
‑2‑
(4
‑
甲氧基苯乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0060][0061]
制备方法:氮气保护下,向反应容器中加入原料4
‑
甲氧基苯乙炔(0.5mmol),频哪醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在100℃反应24h,过滤提纯,制得产物;产物分离收率98%。
[0062]1h nmr(500mhz,cdcl3)δ7.49
–
7.39(m,2h),7.35(d,j=18.5hz,1h),6.92
–
6.80(m,2h),6.01(d,j=18.5hz,1h),3.81(s,3h),1.31(s,12h).
13
cnmr(125mhz,cdcl3)δ160.3,149.0,130.4,128.4,113.9,83.2,55.3,24.8.
[0063]
实施例9
[0064]
(e)
‑2‑
(3,3
‑
二甲基丁
‑1‑
烯
‑1‑
基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2二氧硼烷的制备,结构式如下:
[0065][0066]
制备方法:氮气保护下,向反应容器中加入原料叔丁基乙炔(0.5mmol),频哪醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在100℃反应24h,过滤提纯,制得产物,产物分离收率80%。
[0067]1h nmr(500mhz,cdcl3)δ6.64(d,j=18.5hz,1h),5.35(d,j=18.5hz,1h),1.28(s,12h),1.02(s,9h).
13
c nmr(125mz,cdcl3)δ164.5,112.6(c
‑
b),83.1,35.1,28.9,24.9.
[0068]
实施例10
[0069]
(e)
‑2‑
(2
‑
(环己
‑1‑
烯
‑1‑
基)乙烯基)
‑
4,4,5,5
‑
四甲基
‑
1,3,2
‑
二氧杂硼烷的制备,结构式如下:
[0070][0071]
制备方法:在氮气保护下,向反应容器中加入原料环己烯基乙炔(0.5mmol),频哪醇硼烷(0.6mmol)、催化剂lhmds(7mol%)和有机溶剂甲苯(0.5ml)搅拌混合,混合均匀后在100℃反应24h,过滤提纯,制得产物;产物分离收率80%。
[0072]1h nmr(500mhz,cdcl3)δ7.02(d,j=18.5hz,1h),5.96(t,j=3.9hz,1h),5.42(d,j=18.5hz,1h),2.22
–
2.07(m,4h),1.76
–
1.47(m,4h),1.27(s,12h).
13
c nmr(125mhz,cdcl3)δ153.2,137.1,134.3,83.0,26.2,24.8,23.7,22.4,22.3.
[0073]
本发明方法可以直接合成目标产物,无需分离中间产物,只需在常压下搅拌反应既可获得目标物,产率最高可达到98%,大大简化了工艺工程,降低了能量消耗,具有高产率的优点;且反应过程中废弃溶液较少,也未排放出其它污染气体和液体,因此本发明减少了废弃溶液的排放,具有保护环境和保障操作人员健康的优点;在本发明中所使用的的物质毒性较低,保证了操作人员的健康;此外,可以制备一系列的烯基硼酸酯物质,该方法具有较强的底物普适性,为开发烯基硼酸酯类物质提供了较好的保证。
[0074]
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1